王艳霞1,2,3, 解志红1,3

 , 张蕾1,3, 常大勇4
, 张蕾1,3, 常大勇4 1. 中国科学院烟台海岸带研究所, 山东 烟台 264003;
2. 中国科学院大学, 北京 100049;
3. 中国科学院海洋大科学研究中心, 山东 青岛 266071;
4. 烟台固特丽生物科技股份有限公司, 山东 烟台 264003
收稿日期:2019-10-08;修回日期:2019-11-21;网络出版日期:2019-12-27
基金项目:NSFC-山东省联合基金重点项目(U1806206);山东省重点研发计划(2017GSF17129);边际土地产能效益扩增机理与藏粮于地技术模式(KFZD-SW-112)
*通信作者:解志红, Tel:+86-535-2109183;E-mail:zhxie@yic.ac.cn.
摘要:[目的] 为探究盐生植物田菁及其根际功能微生物改良盐碱地的效果,本研究从黄河三角洲盐碱区田菁根际土壤中分离促生菌,并明确其耐盐促生效果。[方法] 采用选择培养方法从田菁根际土壤中分离固氮菌、解磷菌以及解钾菌,并进行16S rRNA分子生物学鉴定。之后对菌株的耐盐及促生特性进行测定,筛选性状优良菌株进行玉米促生作用研究。[结果] 共分离得到105株根际促生菌,其中N102兼具多种促生特性且耐盐性达15%。田菁种子发芽试验表明,N102可显著提高田菁发芽率(47%,P < 0.05)、芽长(48.5%,P < 0.05)和根长(60%,P < 0.05);玉米盆栽试验结果表明,N102对盐胁迫下玉米的株高、根长、叶绿素含量、地上部干重以及根干重具有显著的促进作用。经系统发育分析,N102与Enterobacter soli ATCC BAA-2102(NR117547)序列相似度为99.30%,鉴定属于Enterobacter属。[结论] 菌株N102具有多种植物促生耐盐特性,具有开发成有效促进盐碱地作物生长的微生物肥的良好前景。
关键词:植物根际促生菌田菁耐盐
Screening of plant growth promoting and salt tolerant rhizobacteria in Sesbania cannabina
Yanxia Wang1,2,3, Zhihong Xie1,3

 , Lei Zhang1,3, Dayong Chang4
, Lei Zhang1,3, Dayong Chang4 1. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, Shandong Province, China;
2. Chinese Academy of Sciences University, Beijing 100049, China;
3. Marine Science Research Center of Chinese Academy of Sciences, Qingdao 266071, Shandong Province, China;
4. Yantai Guteli Biotechnology Co., Ltd., Yantai 264003, Shandong Province, China
Received: 8 October 2019; Revised: 21 November 2019; Published online: 27 December 2019
*Corresponding author: Zhihong Xie, Tel: +86-535-2109183; E-mail: zhxie@yic.ac.cn.
Foundation item: Supported by the NSFC-Shandong Joint Fund Key Project (U1806206), by the Shandong Key Research and Development Program (2017GSF17129) and by the Marginal Land Productivity Benefits Amplification Mechanism and Storing Food in Land Technology Model (KFZD-SW-112)
Abstract: [Objective] To explore the effects of halophyte Sesbania cannabina and its rhizosphere functional microorganisms on ameliorating saline alkali soil, we isolated and identified the plant growth promoting rhizobacteria (PGPR) of S. cannabina grew in saline-alkali soil of Yellow River Delta, and further studied the growth-promoting and salt-tolerant characteristics of PGPRs. [Methods] Nitrogen-fixing, phosphorus-dissolving and potassium-dissolving bacteria were isolated from rhizosphere soil of S. cannabina by selective culture and identified by 16S rRNA molecular biology. Traits of plant growth-promoting and salt tolerance of the strains were determined and analyzed, and strains with excellent traits were selected to further study their growth promotion effect on corn. [Results] We totally obtained 105 rhizosphere isolates, of which N102 had growth-promoting and salt tolerance activities. As shown by seed germination test, N102 could significantly increase the germination rate (47%, P < 0.05), bud length (48.5%, P < 0.05), root length (60%, P < 0.05) of S. cannabina. The pot experiment also shows that N102 could significantly improve plant height, root length, shoot dry weight, root dry weight and chlorophyll content of corn under salt stress. According to phylogenetic analysis, the similarity between N102 and Enterobacter soli ATCC BAA-2102 (NR117547) sequence was 99.30%, this it was identified as Enterobacter genus. [Conclusion] Strain N102 has high salt-tolerant and plant growth-promoting characteristics, promising to develop as microbial inoculants or microbial fertilizers that can effectively promote the growth of crops in saline-alkali soils.
Keywords: plant growth promoting rhizobacteriaSesbania cannabinasalt tolerance
黄河三角洲位于我国山东省黄河入海口,近百年来滩涂面积和滨海盐土不断增加[1]。滨海盐碱土逐渐由非盐碱土变为弱盐碱土、中盐碱土和强盐碱土,含盐量和盐碱化程度越来越高,盐碱荒地广泛分布[2]。盐碱化改变了土壤生物特性及理化性质,影响作物幼苗根系形态的建成,进而不利于植物生长,已成为制约黄河三角洲农业可持续发展的重要因素。
近年来科研工作者对黄河三角洲地区盐碱地改良进行了大规模的研究和治理工作。在早期主要有水利工程措施、农业技术措施、物理化学改良措施等,这些措施在不同时期特定条件下可以取得一定的盐碱土改良结果,但均有其局限性,或费用高或工作量大而未被广泛应用[3-4]。现今利用生物方法来改良黄河三角洲盐碱地已逐渐被试验应用,包括从国内外广泛引种耐盐碱植物,如罗布麻、田菁和枸杞等。其中普通田菁(Sesbania cannabina)为豆科田菁属一年生草本盐生植物,相比其他盐生植物,其抗旱、抗病虫能力较强,并具有强的耐盐(0.6%–1.0%)、耐涝、耐瘠能力[5];其根系发达,根瘤多而大,固氮能力强,鲜草养分含量丰富。这些特点使得田菁成为一种优良的夏季绿肥并可作为滩涂盐碱地土壤修复和改造的先锋植物。此外,我国黄河三角洲已有多年种植田菁的历史,可能潜藏着独特的田菁微生物种群结构。因此,具有耐盐性的田菁根际促生菌的分离筛选是一项对微生物资源开发以及环境治理都具有重要意义的工作。
植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)是存在于植物根际的一类能够促进和保护植物生长发育的有益菌,可以促使植物适应其所在的不同生态环境,并具有应用于改良盐碱土的潜力[6]。这些微生物一般具有固氮、解磷、解钾能力,有时还能分泌植物激素、维生素以及抗生素等,相关研究也多集中在某些农作物的PGPR的促生或生防功能上,而有关盐碱植物根际土中的PGPR研宄还较少[7]。目前有****发现将PGPR接种于作物的种子或幼苗后,可有效缓解盐胁迫对作物造成的伤害[8-10]。比如,Hamaoui等研究发现将固氮螺菌接种到鹰嘴豆和蚕豆上,可以显著降低盐水浇灌对植物生长的负面影响,并且促进作物结瘤、改善根和芽的发育[11]。Woitke等研究发现在盐胁迫下枯草芽孢杆菌显著改善了番茄的生长情况和对营养物质吸收[12]。
本研究通过从黄河三角洲盐碱地田菁的根际土壤中分离筛选固氮、解磷、解钾菌,然后对其进行分类鉴定以及促生特性的分析,以期筛选具有固氮、解磷、解钾、产IAA、产铁载体、产ACC脱氨酶以及耐盐等多种功能的PGPR;并将各菌株分别扩大培养制成菌剂,采用盆栽试验的研究方法,探究盐胁迫条件下PGPR对玉米的促生效果。研究结果不仅将进一步深入和拓展盐碱植物根际功能微生物研究内容,也将为日益严重的盐渍化地区提供一种环境友好、经济有效的利用模式,具有深远的生态效益、经济效益乃至社会效益。
1 材料和方法 1.1 材料
1.1.1 样品:: 2018年9月采集黄河三角洲东营市盐碱地田菁根际土壤。采集时先去除落叶层,然后用铁锹挖去上层覆土,沿着植物根部的生长方向将植物根部取出,抖落植物根部大块土壤,再用无菌刷将附着在根系表面的土壤轻轻刷下,得到的根际土存于无菌聚乙烯塑料袋中,运回实验室进行微生物的分离和筛选。田菁种子为鲁菁1号,山东省农科院惠赠。玉米种子为郑单958。
1.1.2 主要培养基:: LB培养基;Ashby无氮培养基[13];无机磷(PKO)培养基[14];有机磷卵黄培养基[14];硅酸盐培养基、缺钾液体培养基[15];CAS培养基[16];DF固体培养基、ADF固体培养基[17]。
1.1.3 主要试剂和仪器:: 常规化学试剂均为分析纯,购自国药集团化学试剂有限公司;Salkowski比色液[18];Hoagland营养液[19];PCR所用PCR Mix酶,购自天根公司;超微量分光光度计Nanodrop 2000c,购自Thermo公司;火焰原子吸收分光光度计TAS 990 (北京普析通用);PCR仪,6325ZR011715,购自Eppendorf公司。
1.2 PGPR的筛选 将采集的植物根际土样混合均匀,在装有90 mL无菌水的三角瓶中加入10 g混合土样,摇床振荡30 min后放置15 min;然后吸取1 mL上清液,进行梯度稀释,吸取稀释液100 μL分别涂布于固体无氮Ashby培养基、无机磷培养基/有机磷培养基和硅酸盐培养基中,放在30 ℃培养箱中培养,4 d后挑取形状形态各异的单菌落划线纯化至无杂菌长出。挑取已纯化好的单菌落接种到LB液体培养基中,于30 ℃、180 r/min的条件下培养,待菌株处于对数生长期时,吸取适量的菌液于甘油管中,于–80 ℃下冻存。
1.3 菌株固氮能力检测 将筛选到的解磷菌株(包括解无机磷、有机磷)和解钾菌株接种在固体无氮Ashby培养基上,连续观察7 d,记录菌株的长势。
1.4 菌株解磷能力测定 接种菌株于LB液体培养基中,于30 ℃、180 r/min振荡培养过夜,制成种子液,按3%的接种量分别接种至含Ca3(PO4)2、卵磷脂的液体培养基中,于30 ℃、180 r/min振荡培养7 d。培养结束后将发酵液转移于温度4 ℃、转速8000 r/min条件下离心10 min,离心后上收集上清液,用钼蓝比色法测定上清液中有效磷的含量[20]。
1.5 菌株解钾能力测定 接种菌株于LB液体培养基中,于30 ℃、180 r/min振荡培养过夜,制成种子液,按3%的接种量,接种于50 mL缺钾液体培养基中,180 r/min、30 ℃摇床培养7 d。以不加菌作为对照处理,每个处理3个重复。结束后取培养7 d后的发酵液20 mL,加4 mL 6% H2O2,高温消化处理20 min,8000 r/min离心10 min,取上清液用火焰原子分光光度计测定上清液中K+的含量[21]。
1.6 菌株产IAA能力测定 选用经典的Salkowski法。向含有L-色氨酸(200 mg/L)的LB液体培养基中接菌,30 ℃、180 r/min,摇床培养4 d。取50 μL菌悬液滴于白色陶瓷板上,再加50 μL Salkowski比色液。同时用50 mg/L IAA加入比色液作为阳性对照,将白色陶瓷板暗光保存30 min,如果颜色变红,表明细菌有产IAA的能力。
接种可以产IAA的菌株于含有L-色氨酸(200 mg/L)的LB液体培养基中,于30 ℃、180 r/min振荡培养4 d。结束后取菌悬液2 mL,8000 r/min离心10 min,取上清液于试管中,加入等体积的Salkowski比色液,避光静置30 min使其显色,于530 nm下测定吸光度[18]。
1.7 菌株ACC脱氨酶活性检测 将菌株活化后,转接到LB固体培养基上,于30 ℃培养24 h。挑取LB平板上的菌株转接到DF固体培养基上再培养24 h,接着挑取DF平板上的菌株转接至ADF固体培养基上,设置3个重复,于30 ℃培养48–72 h后,能够以ACC为唯一氮源生长的菌株视为阳性菌株[22]。
1.8 菌株产铁载体能力检测 采用点接种法,用无菌枪头挑取适量的菌体点接在CAS平板上,一个平板3个点,每种菌设3个重复,在30 ℃下培养48 h,在CAS检测平板上,分泌铁载体的细菌菌落周围会出现明显的橙色铁载体晕圈。记录平板上橙色晕圈的有无,并测定单菌落橙色铁载体晕圈直径和菌落直径的比值[16]。
1.9 菌株耐盐能力的测定 接种菌株于LB液体培养基中,于30 ℃、180 r/min振荡培养过夜,吸取菌液点接于含NaCl浓度分别为1%、2.5%、5%、10%、12.5%、15%的固体LB培养基上,每个处理3个重复,于30 ℃下培养,5 d时间为限,定期观察并记录生长情况。
选择促生特性良好且具有耐盐特性的菌株接种于含0、5%、10% NaCl的LB液体培养基中,30 ℃、180 r/min培养,定时测定其OD600值,并绘制生长曲线。
1.10 菌株促生耐盐效果验证 种子消毒:选择颗粒饱满、种皮完整的田菁或玉米种子,先用95%的乙醇浸泡30 s以消除表面张力,倒去乙醇,再用2% NaClO浸泡5 min进行表面消毒,最后用无菌水冲洗5–6次。
菌悬液配制:将供试菌株活化后,接种到装有100 mL LB液体培养基的250 mL三角瓶中,于30 ℃、180 r/min振荡培养24 h;之后8000 r/min的条件下离心10 min,弃掉上清液,收集菌体,用无菌水8000 r/min,离心5 min、洗涤2次,再重悬于无菌水中,调整各菌悬液的OD600值为1.0,备用。
田菁种子发芽试验:配制水-琼脂培养基(琼脂含量为7 g/L),按100 mL/瓶分装于350 mL带透气盖的组培瓶中,进行高压灭菌备用;将用菌悬液浸泡12 h的种子胚芽向上,垂直方向插入水-琼脂培养基中,每个组培瓶中放置10粒种子,使其均匀分布。每个处理3个重复[23]。将其置于光照培养箱里培养(温度30 ℃,光暗周期为14 h/10 h),每天观察田菁长势,记录发芽情况,10 d后测量田菁的株高、根长和鲜重。
玉米盆栽试验:采用双因素完全随机区组设计,因素一为PGPR菌剂,无菌水为对照(CK)。因素二为盐分(NaCl)程度,结合前人对田菁植株盐分耐受性研究[5],共设3个处理,即S0 (无盐胁迫:不加NaCl)、S1 (中盐胁迫:根系喷施5% NaCl溶液1 mL)、S2 (重盐胁迫:根系喷施10% NaCl溶液1 mL)。每个处理重复3次。种子消毒处理后,置于恒温箱内避光30 ℃催芽培养48 h,挑选露白种子播种于装有灭菌的拌有Hoagland营养液的蛭石盆栽中,播种深度2 cm。将其置于25 ℃、光暗周期为14 h/10 h的温室培养;待玉米出苗以后,取菌悬液1 mL均匀浇灌至玉米根系周围,CK加等量水;1 d后取盐溶液(0% NaCl、5% NaCl、10% NaCl) 1 mL喷在玉米根系周围,继续培养10 d后收获,测定植株株高、根长、地上部干重、地下部干重以及叶绿素SPAD值。
1.11 菌株分子鉴定 选择具有较好促生耐盐效果的菌株,用移液枪枪头刮取培养皿上的菌落放入1.5 mL的离心管中,加入500 μL灭菌水,盖上盖子插入泡沫水漂,放入沸水中煮15 min,得到菌株的DNA提取物。选择细菌通用引物27F (5′-AGAGTTTGATCCTGG CTCAG-3′)和1492R (5′-GGTTACCTTGTTACGA CTT-3′)对菌株16S rRNA基因进行PCR扩增[24],体系为:DNA模板1 μL,PCR Mix 10 μL,5 μmol/L引物27F 1 μL,5 μmol/L引物1492R 1 μL,ddH2O 7 μL。PCR反应条件为:95 ℃ 5 min;94 ℃ 30 s,56 ℃ 45 s,72 ℃ 1 min,34个循环;72 ℃ 5 min,12 ℃保持。
将扩增产物用1.0%的琼脂糖凝胶电泳检测后送至青岛睿博生物有限公司测序。将获得的序列上传至GenBank数据库,将选取的代表菌株序列在NCBI进行BLASTn程序在线比对,从GenBank中下载与所测序列相近种属的模式菌株的相应基因序列,用MEGA 6.0软件中的Clustal W功能将序列比对后,用邻接法(NJ)构建进化树,进行系统发育分析。
1.12 数据处理及分析 试验数据采用Microsoft Excel 2010处理,显著性分析采用GraphPad Prism7软件进行(P < 0.05)。
2 结果和分析 2.1 菌株促生特性分析 从田菁根际共筛到105株促生菌,其中具有固氮能力的有70株,解难溶性无机磷的有53株,解难溶性有机磷的有22株,解钾的有63株,产IAA的有105株,产ACC脱氨酶的有44株,产铁载体的有24株。此外有4株菌兼具固氮、解无机磷、解有机磷、产IAA、产铁载体和产ACC脱氨酶能力,分别为N102、YP48、K64、K72。其中N102具有较强固氮能力和产ACC脱氨酶能力,此外,其解Ca3(PO4)2能力为36.29±0.14 mg/L,解卵磷脂能力为1.23±0.00 mg/L,解钾能力为48.07±4.63 mg/L,产IAA能力为59.57±0.16 mg/L,产铁载体能力表征为D/d值2.09±0.13。
2.2 菌株耐盐能力分析 根据105株PGPR菌株盐胁迫耐受性平板检测的结果,100%、97.2%、90.5%、51.5%、24.9%和4.9%的菌株能够在1.0%、2.5%、5.0%、10.0%、12.5%和15% NaCl浓度下生长。能够在15% NaCl浓度下生长的菌株为N102、P50、P199、YP101、K64,其中N102生长速度较快。考虑到N102促生特性良好且能够适应高盐环境,故测定其在含0%、5%、10% NaCl的LB液体培养基中的生长情况,以了解不同盐浓度对N102生长的影响。如图 1所示,在0% NaCl浓度下,菌株N102生长曲线基本呈现S型,生长迅速,在9 h左右进入对数生长期,30 h左右进入稳定期;在5% NaCl浓度下,菌株长势略弱于前者;而在10% NaCl浓度下,菌株生长曲线明显变缓,在24 h左右进入对数生长期。这表明随着盐浓度增加,菌株的生长速率变慢,尤其在高盐浓度下,明显抑制了菌株N102的生长。
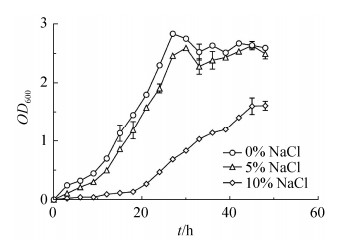 |
| 图 1 N102在不同NaCl浓度LB培养基中的生长曲线 Figure 1 Growth curve of N102 in LB mediums with different concentrations of NaCl. Bars represented standard errors of the means |
| 图选项 |
2.3 菌株对田菁发芽效果分析 综合菌株促生能力的测定结果,对具有优良促生能力的菌株进行试验,观察菌株对田菁生长的影响,结果发现菌株N102对田菁的生长具有较好的促生效果(图 2),表现为在接种N102处理下,田菁的发芽率、根长和鲜重显著高于CK处理(P < 0.05),分别高出47%、48.5%和60% (表 1)。
 |
| 图 2 N102对田菁种子的发芽效果 Figure 2 Effect of N102 on the germination of S. cannabina. A: the control group; B: the treatment group |
| 图选项 |
表 1. PGPR对田菁的发芽效果 Table 1. Effect of PGPR on S. cannabina germination
| Treatment | Germination rate/% | Shoot length | Root length | Fresh weight |
| CK | 56.67±0.06 a | 9.34±0.19 a | 2.64±0.17 a | 0.60±0.04 a |
| N102 | 83.33±0.12 b | 9.79±0.80 a | 3.92±0.08 b | 0.96±0.21 b |
| Values are means (n=3)±standard error. Different lowercase letters indicate that the same index is significantly different (P < 0.05). | ||||
表选项
2.4 菌株对盆栽玉米生长的影响 在不同NaCl浓度的盐胁迫下,菌株N102对玉米的株高、根长、茎秆干重和根干重产生不同程度的促进作用(图 3、图 4)。
 |
| 图 3 在不同盐胁迫下接种N102时玉米的生长情况 Figure 3 Shoot (A, B, C) and root (D, E, F) growth of corn without inoculation (CK) and inoculated with N102 (N102) at different salt stress (S0, S1, S2). S0, S1 and S2 represent salt free, medium salt stress and heavy salt stress, respectively (Same below). Each treatment are three replicates |
| 图选项 |
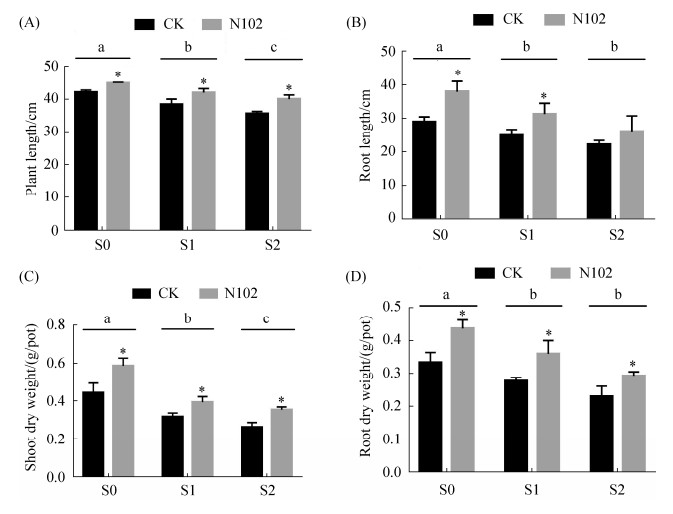 |
| 图 4 在不同盐胁迫下接种N102对玉米形态参数的影响 Figure 4 Effect of N102 inoculation on corn morphological parameters under different salt stress. A: Plant height; B: Root length; C: Shoot dry weight; D: Root dry weight. The error bars represent the standard errors (SE). "*" indicates that the difference between the control and N102 treatment at the same salt concentration was significant (P < 0.05). Different lowercase letters indicate significant differences among the control treatment of the different salt concentration at the P=0.05 level |
| 图选项 |
不接菌条件下,随着NaCl浓度的增加,植株高度、根长、茎秆干重以及根干重均降低,在重盐胁迫下达到最低值(相对于无盐胁迫下,分别降低18.1%、30.9%、67.4%、44.6%)(图 4),不加盐处理的植物的生物量显著高于盐胁迫处理(P < 0.05),并且植物株高和茎秆干重的两个盐胁迫处理间差异显著(P < 0.05)(图 4-A、C)。
接种细菌N102增加了所有盐度水平下的植株高度、根长、茎秆干重以及根干重。接种N102时,不加盐处理的植物的生物量显著高于盐胁迫处理,但两个盐胁迫处理间的生物量均无显著差异(P > 0.05)。与未接菌植株相比,在无盐害条件下,接种N102的植株的株高、根长、茎秆干重及根干重分别显著增加6.8%、30.9%、32%和30.6% (P < 0.05)(图 4);在中盐胁迫下,接种N102的植株的生物量株高、根长、茎秆干重及根干重分别显著增加9.4%、25.7%、24%和29.6% (P < 0.05)(图 4);在重盐胁迫下,接种N102的植株的株高、茎秆干重以及根干重分别增加12.4%、33.7%和27.5%,均达到显著差异(P < 0.05)(图 4-A、C、D),而接种N102植株的根长和未接菌植株的差异不显著(P > 0.05)(图 4-B)。外源添加根际促生菌N102不仅能促进植物的生长,同时在高盐胁迫下还能降低其对植物的伤害。
2.5 菌株对盆栽玉米的叶绿素含量的影响 如图 5所示,随着NaCl浓度增加,植物叶绿素含量逐渐下降。然而,接种细菌N102的植物的叶绿素含量高于未接种细菌的植物(CK),并在所有盐浓度下达到显著差异(P < 0.05),分别比对照增加6.7%、4.5%和7.1%。在不接菌情况下,不加盐处理的植物的叶绿素含量显著高于盐胁迫处理,两个盐浓度间也显著差异(P > 0.05);在接种N102处理下,不加盐处理的植物的叶绿素含量也显著高于盐胁迫处理(P < 0.05),但两个盐胁迫处理间差异不显著(P > 0.05),说明在高盐胁迫时接种N102缓解了盐胁迫对植物叶绿素含量的影响。
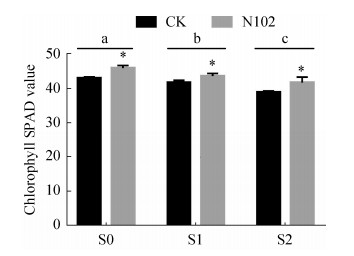 |
| 图 5 在不同盐胁迫下接种N102对玉米叶绿素含量的影响 Figure 5 Effect of N102 inoculation on corn chlorophyll content under different salt stress. The values in the graph are means (n=3 per treatment); the error bars represent the standard errors (SE). "*" indicates that the difference between the control and N102 treatment at the same salt concentration was significant (P < 0.05). Different lowercase letters indicate significant differences in the among the control treatment of the different salt concentration treatments at the P=0.05 level |
| 图选项 |
2.6 菌株的系统发育学分析 通过邻接法(NJ)对菌株N102的16S rRNA基因序列进行系统发育分析,构建进化树如图 6,分析结果表明,N102与标准菌株Enterobacter soli ATCC BAA-2102T亲缘关系最近,两者序列相似度达99.30%,并且N102在进化树上处于Enterobacter属模式种进化支之间,表明该菌株属于Enterobacter属。最后将N102的16S rRNA基因序列上传至NCBI数据库中,获得登录号为MN420987。
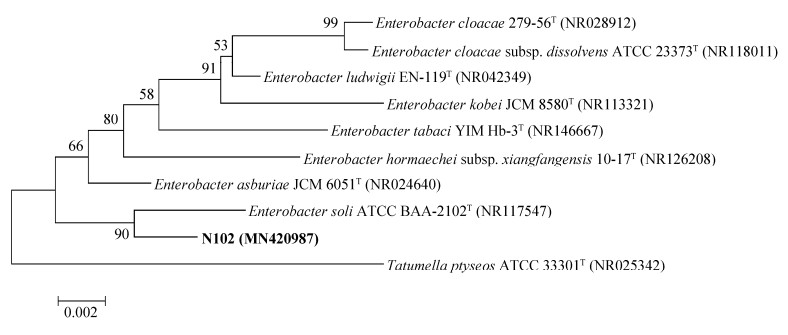 |
| 图 6 N102基于16S rRNA基因序列的系统发育进化树 Figure 6 Phylogenetic tree based on 16S rRNA gene of N102. Numbers in parentheses represent the sequences' accession number in GenBank. Bar 0.002 represents sequence divergence |
| 图选项 |
3 讨论 盐胁迫对植物的生长和发育具有严重危害,因此对一个国家的农业和经济发展产生了巨大的影响[25-26]。植物根际促生细菌(PGPR)在促进重要农作物生长以及应对环境胁迫方面具有重要积极意义[27]。耐盐植物田菁可以很好地适应中国山东省黄河三角洲海滨盐碱区的盐碱环境,并可能进化出了不同耐盐策略。这种植物在盐碱地适应性成功的一部分原因,可能至少取决于它们能够与具有环境适应性的根际微生物建立并且保持有效联系[28]。
本文以黄河三角洲盐碱地田菁根际土壤为研究对象,首先按菌株是否能够在固氮、解磷、解钾培养基生长的筛选策略从土壤中分离了105株根际促生菌,并检测了这些菌株的促生能力,例如固氮、解磷、解钾、产1AA、产ACC脱氨酶以及产铁载体能力,并根据耐盐性进行表征,这些细菌具有高度耐盐性。盐生植物田菁的根际促生菌均具有较高的耐盐性,可能是由于盐生植物根际的离子强度较高,吸水率较高,根际促生菌也更适应高盐度[29]。例如,Qin等[30]检测了从滨海盐生植物补血草根际土壤中分离的8株根际促生菌的NaCl耐受性,他们的结果表明,所有菌株都能够耐受1700 mmol/L NaCl。目前还没有从盐生植物田菁根际土壤分离促生菌的研究。
本研究中选择的根际促生菌具有固氮、解磷、解钾能力,可以增强土壤中营养物质的释放,因此这些被认为是根际促生菌促进植物生长的可能机制[31-33]。所有的根际促生菌都能够产生IAA,这种激素可以刺激种子萌发、根毛形成并增加根和芽发育速率[34-36]。部分根际促生菌具有产生ACC-脱氨酶的能力,其阻遏合成乙烯的前体ACC,这种酶可以通过降低乙烯水平来帮助宿主植物抵抗外界胁迫(生物和非生物)[37]。与其他促生性状相比,较少的根际促生菌具有产生铁载体的能力,铁载体的合成与分泌可以溶解和隔离铁来增加土壤中铁的有效性,改善植物对铁的吸收,从而促进其宿主植物的生长[38-39]。已经在从许多盐生植物根际土壤中分离的细菌中报道了具有固氮、解磷、解钾和(或)产生IAA、ACC脱氨酶、铁载体的能力[40-41]。王琦琦等[41]从盐生植物木碱蓬根际土壤中分离的耐盐根际细菌还具有固氮、解磷、解钾和产生IAA的能力。Qin等[30]从盐生植物补血草根际土壤中分离的根际促生菌具有固氮、解磷、产生IAA和ACC脱氨酶的能力。
在本研究中,一株高效的根际促生菌N102,被鉴定为肠杆菌属(Enterobacter sp.),在生理学上表现出优良的固氮、解磷、产IAA、产ACC脱氨酶和产铁载体等植物促生特性以及较高的耐盐性(0–15%),并且通过改善植物的形态参数和生理参数来促进玉米的生长。近几年,肠杆菌属的一些菌种逐渐被发现具有促进植物生长的作用[42-43]。虽然肠杆菌属的细菌大多被发现于农作物与经济作物根际,但这些肠杆菌属的细菌也可以耐受不同盐浓度[44-45]。Bhise等[44]报道了在阴沟肠杆菌(Enterobacter cloacae) KBPD在盐胁迫条件下具有减轻盐胁迫和促进豇豆生长的潜力。
已经证明,在盐胁迫土壤中接种耐盐性有益细菌可以增加植物生物量,同时减轻盐胁迫对植物的有害影响[46-48]。本研究的结果表明,接种肠杆菌N102显著改善了玉米在盐胁迫下的生长。这种生长促进作用(即株高,根长,茎秆干重和根干重的增加)可能是由于营养物质运输,IAA、ACC脱氨酶和铁载体合成能力。随着盐浓度的增加,玉米的株高、根长、茎秆干重以及根干重都降低,可能归因于盐胁迫下根系Na+、Cl–的过度吸收以及水分、养分吸收和许多其他代谢功能受到干扰[49-50]。在本研究中,重盐胁迫下,接种N102的根长没有显著差异。可能的原因是高盐胁迫下的根际促生菌失去了一些促生特性,促生能力减弱[51]。
植物盐胁迫耐受性的指标之一是叶绿素含量的变化。在本研究中,与对照相比,接种N102的植物叶绿素含量显著增加。Singh等[52]也报道了随着NaCl浓度的增加,植物叶绿素含量下降,而接种促生菌后增加了其研究中的植物叶绿素含量,这与本研究结果类似。
总之,本研究的结果与之前的研究结果一致,即盐生植物是具有促生潜力的耐盐性细菌的有用来源。值得注意的是,从田菁根际土壤分离到的肠杆菌(Enterobacter sp.) N102表现出多种优良性状,因此可以改善盐胁迫下玉米的生长。这也验证了PGPR对植物的促生耐盐效果,为盐碱地微生物菌肥的制备提供了一定的理论依据。然而,考虑到未来的应用性,接种实验必须扩展到大规模的田间试验,以实现此菌株促进植物生长的全部潜力。同时在田间等自然条件下使用时,单一的PGPR通常发挥有益效果的能力有限,因此在未来可尝试共同接种具有多种促生特性的PGPRs菌株来克服这一不足。此外,在本研究中,这一菌株验证了盐胁迫下在田菁及玉米上的促生效果,但也可能具有保护其他重要植物免受盐胁迫的潜力,这需要进一步研究。
References
| [1] | Dong HY, Zhu ZL, Li XH, Yang LP, Zhang Z. Analysis on distribution, utilization status and governance effect of saline-alkali soil in Shandong province. Shandong Agricultural Sciences, 2017, 49(5): 134-139. (in Chinese) 董红云, 朱振林, 李新华, 杨丽萍, 张正. 山东省盐碱地分布、改良利用现状与治理成效潜力分析. 山东农业科学, 2017, 49(5): 134-139. |
| [2] | Li Y, Tao J, Chao JL, Zhang H, Gu W. Research progress of improving measures of "raised field-shallow pool" for coastal saline-alkaline land. Agricultural Research in the Arid Areas, 2014, 32(5): 154-160, 167. (in Chinese) 李颖, 陶军, 钞锦龙, 张化, 顾卫. 滨海盐碱地"台田-浅池"改良措施的研究进展. 干旱地区农业研究, 2014, 32(5): 154-160, 167. |
| [3] | 侯贺贺.黄河三角洲盐碱地生物措施改良效果研究.山东农业大学硕士学位论文, 2014. |
| [4] | Song JR, Yang J, Wang YM, Song CJ. Exploration of the reason and improvement measures of saline-alkali soil in the Yellow River delta. Journal of Anhui Agricultural Sciences, 2017, 45(27): 95-97, 234. (in Chinese) 宋静茹, 杨江, 王艳明, 宋常吉. 黄河三角洲盐碱地形成的原因及改良措施探讨. 安徽农业科学, 2017, 45(27): 95-97, 234. DOI:10.3969/j.issn.0517-6611.2017.27.030 |
| [5] | Zhang LB, Guo XX, Chang SL. The salt tolerance of Tianjing and its improvement effect on coastal saline soil. Jiangsu Agricultural Sciences, 2012, 40(2): 310-312. (in Chinese) 张立宾, 郭新霞, 常尚连. 田菁的耐盐能力及其对滨海盐渍土的改良效果. 江苏农业科学, 2012, 40(2): 310-312. DOI:10.3969/j.issn.1002-1302.2012.02.123 |
| [6] | Kloepper JW, Schroth MN. Relationship of in vitro antibiosis of plant growth-promoting rhizobacteria to plant growth and the displacement of root microflora. Phytopathology, 1981, 71(10): 1020-1024. DOI:10.1094/Phyto-71-1020 |
| [7] | Kumar P, Dubey RC, Maheshwari DK. Bacillus strains isolated from rhizosphere showed plant growth promoting and antagonistic activity against phytopathogens. Microbiological Research, 2012, 167(8): 493-499. DOI:10.1016/j.micres.2012.05.002 |
| [8] | Yasin NA, Akram W, Khan WU, Ahmad SR, Ahmad A, Ali A. Halotolerant plant-growth promoting rhizobacteria modulate gene expression and osmolyte production to improve salinity tolerance and growth in Capsicum annum L. Environmental Science and Pollution Research, 2018, 25(23): 23236-23250. DOI:10.1007/s11356-018-2381-8 |
| [9] | Bano A, Fatima M. Salt tolerance in Zea mays (L). following inoculation with Rhizobium and Pseudomonas. Biology and Fertility of Soils, 2009, 45(4): 405-413. |
| [10] | Chang P, Gerhardt KE, Huang XD, Yu XM, Glick BR, Gerwing PD, Greenberg BM. Plant growth-promoting bacteria facilitate the growth of barley and oats in salt-impacted soil:implications for phytoremediation of saline soils. International Journal of Phytoremediation, 2014, 16(11): 1133-1147. DOI:10.1080/15226514.2013.821447 |
| [11] | Hamaoui B, Abbadi JM, Burdman S, Rashid A, Sarig S, Okon Y. Effects of inoculation with Azospirillum brasilense on chickpeas (Cicer arietinum) and faba beans (Vicia faba) under different growth conditions. Agronomie, 2001, 21(6/7): 553-560. |
| [12] | Woitke M, Junge H, Schnitzler WH. Bacillus subtilis as growth promotor in hydroponically grown tomatoes under saline conditions//Cantliffe DJ, Stoffella PJ, Shaw NL. VII International Symposium on Protected Cultivation in Mild Winter Climates: Production, Pest Management and Global Competition. Kissimmee, Florida, USA: ISHS, 2004: 363-369. |
| [13] | 张晶晶.新疆核桃根际促生菌的筛选及鉴定.新疆农业大学硕士学位论文, 2015. |
| [14] | Guo Y, Yang P, Zhang DY, Liu YY, Ma LJ, Bu N. Screening, identification and growth-promoting effect of multi-function rhizosphere growth-promoting strain of wild soybean. Biotechnology Bulletin, 2018, 34(10): 108-115. (in Chinese) 郭英, 杨萍, 张丹雨, 刘莹莹, 马莲菊, 卜宁. 野大豆多功能根际促生菌的筛选鉴定和促生效果研究. 生物技术通报, 2018, 34(10): 108-115. |
| [15] | Tan K, Wu ZY, Gu YL, Zhou J, Yang YL, Wu HF. Screening of a high potassium-releasing microbial strain. Journal of Liupanshui Normal University, 2018, 30(3): 52-55. (in Chinese) 谭康, 吴泽英, 顾永丽, 周娟, 杨友联, 吴汉福. 一株高效解钾菌的筛选. 六盘水师范学院学报, 2018, 30(3): 52-55. |
| [16] | Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores. Analytical Biochemistry, 1987, 160(1): 47-56. |
| [17] | Dworkin M, Foster JW. Experiments with some microorganisms which utilize ethane and hydrogen. Journal of Bacteriology, 1958, 75(5): 592-603. DOI:10.1128/JB.75.5.592-603.1958 |
| [18] | Shokri D, Emtiazi G. Indole-3-Acetic Acid (IAA) production in symbiotic and non-symbiotic nitrogen-fixing bacteria and its optimization by Taguchi design. Current Microbiology, 2010, 61(3): 217-225. DOI:10.1007/s00284-010-9600-y |
| [19] | Hoagland DR, Arnon DI. The water-culture method for growing plants without soil. California Agricultural Experiment Station Circular, 1950, 347: 1-32. |
| [20] | Rodr??guez H, Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion. Biotechnology Advances, 1999, 17(4/5): 319-339. |
| [21] | 陈华癸.微生物学实验.北京: 农业出版社, 1962. |
| [22] | Singh RP, Jha PN. The multifarious PGPR Serratia marcescens CDP-13 augments induced systemic resistance and enhanced salinity tolerance of Wheat (Triticum aestivum L.). PLoS One, 2016, 11(6): e0155026. DOI:10.1371/journal.pone.0155026 |
| [23] | 杨杉杉.耐盐植物根际促生细菌筛选及其对盐胁迫小麦幼苗的促生效应研究.内蒙古农业大学硕士学位论文, 2018. |
| [24] | Kim K, Jang YJ, Lee SM, Oh BT, Chae JC, Lee KJ. Alleviation of salt stress by Enterobacter sp. EJ01 in tomato and Arabidopsis is accompanied by up-regulation of conserved salinity responsive factors in plants. Molecules and Cells, 2014, 37(2): 109-117. DOI:10.14348/molcells.2014.2239 |
| [25] | Numan M, Bashir S, Khan Y, Mumtaz R, Shinwari ZK, Khan AL, Khan A, AL-Harrasi A. Plant growth promoting bacteria as an alternative strategy for salt tolerance in plants:a review. Microbiological Research, 2018, 209: 21-32. DOI:10.1016/j.micres.2018.02.003 |
| [26] | Kumar A, Verma JP. Does plant-Microbe interaction confer stress tolerance in plants:a review?. Microbiological Research, 2018, 207: 41-52. DOI:10.1016/j.micres.2017.11.004 |
| [27] | Sen S, Ghosh D, Mohapatra S. Modulation of polyamine biosynthesis in Arabidopsis thaliana by a drought mitigating Pseudomonas putida strain. Plant Physiology and Biochemistry, 2018, 129: 180-188. DOI:10.1016/j.plaphy.2018.05.034 |
| [28] | Etesami H, Beattie GA. Mining halophytes for plant growth-promoting halotolerant bacteria to enhance the salinity tolerance of non-halophytic crops. Frontiers in Microbiology, 2018, 9: 148. DOI:10.3389/fmicb.2018.00148 |
| [29] | Komaresofla BR, Alikhani HA, Etesami H, Khoshkholgh-Sima NA. Improved growth and salinity tolerance of the halophyte Salicornia sp. by co-inoculation with endophytic and rhizosphere bacteria. Applied Soil Ecology, 2019, 138: 160-170. DOI:10.1016/j.apsoil.2019.02.022 |
| [30] | Qin S, Feng WW, Zhang YJ, Wang TT, Xiong YW, Xing K. Diversity of bacterial microbiota of coastal halophyte Limonium sinense and amelioration of salinity stress damage by symbiotic plant growth-promoting actinobacterium Glutamicibacter halophytocola KLBMP 5180. Applied and Environmental Microbiology, 2018, 84(19): e01533-18. |
| [31] | Gouda S, Kerry RG, Das G, Paramithiotis S, Shin HS, Patra JK. Revitalization of plant growth promoting rhizobacteria for sustainable development in agriculture. Microbiological Research, 2018, 206: 131-140. DOI:10.1016/j.micres.2017.08.016 |
| [32] | Etesami H, Maheshwari DK. Use of plant growth promoting rhizobacteria (PGPRs) with multiple plant growth promoting traits in stress agriculture:action mechanisms and future prospects. Ecotoxicology and Environmental Safety, 2018, 156: 225-246. DOI:10.1016/j.ecoenv.2018.03.013 |
| [33] | Meena VS, Maurya BR, Verma JP. Does a rhizospheric microorganism enhance K+ availability in agricultural soils?. Microbiological Research, 2014, 169(5/6): 337-347. |
| [34] | Etesami H, Alikhani HA, Hosseini HM. Indole-3-acetic acid (IAA) production trait, a useful screening to select endophytic and rhizosphere competent bacteria for rice growth promoting agents. MethodsX, 2015, 2: 72-78. DOI:10.1016/j.mex.2015.02.008 |
| [35] | Etesami H, Alikhani HA. Co-inoculation with endophytic and rhizosphere bacteria allows reduced application rates of N-fertilizer for rice plant. Rhizosphere, 2016, 2: 5-12. DOI:10.1016/j.rhisph.2016.09.003 |
| [36] | Glick BR. Plant growth-promoting bacteria:mechanisms and applications. Scientifica, 2012, 2012: 963401. |
| [37] | Glick BR. Bacteria with ACC deaminase can promote plant growth and help to feed the world. Microbiological Research, 2014, 169(1): 30-39. DOI:10.1016/j.micres.2013.09.009 |
| [38] | Rajkumar M, Ae N, Prasad MNV, Freitas H. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction. Trends in Biotechnology, 2010, 28(3): 142-149. DOI:10.1016/j.tibtech.2009.12.002 |
| [39] | Nadeem SM, Ahmad M, Zahir ZA, Javaid A, Ashraf M. The role of mycorrhizae and plant growth promoting rhizobacteria (PGPR) in improving crop productivity under stressful environments. Biotechnology Advances, 2014, 32(2): 429-448. |
| [40] | Sarkar A, Ghosh PK, Pramanik K, Mitra S, Soren T, Pandey S, Mondal MH, Maiti TK. A halotolerant Enterobacter sp. displaying ACC deaminase activity promotes rice seedling growth under salt stress. Research in Microbiology, 2018, 169(1): 20-32. DOI:10.1016/j.resmic.2017.08.005 |
| [41] | Wang QQ, Feng L, Li Y, Chu GX, Sun YF. Screening and identification of salt-tolerant promoting bacteria of the rhizosphere of Suaeda dendroides in Xinjiang. Microbiology China, 2019, 46(10): 2569-2578. (in Chinese) 王琦琦, 冯丽, 李杨, 褚贵新, 孙燕飞. 新疆木碱蓬(Suaeda dendroides)根际耐盐促生细菌的筛选及鉴定. 微生物学通报, 2019, 46(10): 2569-2578. |
| [42] | Gupta P, Kumar V, Usmani Z, Rani R, Chandra A, Gupta VK. A comparative evaluation towards the potential of Klebsiella sp. and Enterobacter sp. in plant growth promotion, oxidative stress tolerance and chromium uptake in Helianthus annuus (L.). Journal of Hazardous Materials, 2019, 377: 391-398. DOI:10.1016/j.jhazmat.2019.05.054 |
| [43] | Ji WX, Leng X, Jin ZX, Li HL. Plant growth promoting bacteria increases biomass, effective constituent, and modifies rhizosphere bacterial communities of Panax ginseng. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2019, 69(2): 135-146. |
| [44] | Bhise KK, Bhagwat PK, Dandge PB. Plant growth-promoting characteristics of salt tolerant Enterobacter cloacae Strain KBPD and its efficacy in amelioration of salt stress in Vigna radiata L. Journal of Plant Growth Regulation, 2017, 36(1): 215-226. DOI:10.1007/s00344-016-9631-0 |
| [45] | Habib SH, Kausar H, Saud HM. Plant growth-promoting rhizobacteria enhance salinity stress tolerance in Okra through ROS-scavenging enzymes. BioMed Research International, 2016, 2016: 6284547. |
| [46] | Akram MS, Shahid M, Tariq M, Azeem M, Javed MT, Saleem S, Riaz S. Deciphering Staphylococcus sciuri SAT-17 mediated anti-oxidative defense mechanisms and growth modulations in salt stressed maize (Zea mays L.). Frontiers in Microbiology, 2016, 7: 867. |
| [47] | Islam F, Yasmeen T, Arif MS, Ali S, Ali B, Hameed S, Zhou W. Plant growth promoting bacteria confer salt tolerance in Vigna radiate by up-regulating antioxidant defense and biological soil fertility. Plant Growth Regulation, 2016, 80(1): 23-36. DOI:10.1007/s10725-015-0142-y |
| [48] | Hmaeid N, Wali M, Metoui-Ben Mahmoud O, Pueyo JJ, Ghnaya T, Abdelly C. Efficient rhizobacteria promote growth and alleviate NaCl-induced stress in the plant species Sulla carnosa. Applied Soil Ecology, 2019, 133: 104-113. DOI:10.1016/j.apsoil.2018.09.011 |
| [49] | Hasanuzzaman M, Nahar K, Fujita M. Plant response to salt stress and role of exogenous protectants to mitigate salt-induced damages//Ahmad P, Azooz MM, Prasad MNV. Ecophysiology and Responses of Plants Under Salt Stress. New York: Springer, 2013: 25-87. |
| [50] | Shrivastava P, Kumar R. Soil salinity:a serious environmental issue and plant growth promoting bacteria as one of the tools for its alleviation. Saudi Journal of Biological Sciences, 2015, 22(2): 123-131. DOI:10.1016/j.sjbs.2014.12.001 |
| [51] | Szymańska S, Borruso L, Lorenzo B, Brusetti L, Hulisz P, Furtado B, Hrynkiewicz K. Bacterial microbiome of root-associated endophytes of Salicornia europaea in correspondence to different levels of salinity. Environmental Science and Pollution Research, 2018, 25(25): 25420-25431. DOI:10.1007/s11356-018-2530-0 |
| [52] | Singh RP, Jha PN. The PGPR Stenotrophomonas maltophilia SBP-9 augments Resistance against biotic and abiotic stress in wheat plants. Frontiers in Microbiology, 2017, 8: 1945. DOI:10.3389/fmicb.2017.01945 |
