谢林艳1, 狄义宁1, 何丽莲1,2, 刘鲁峰1, 沈先岳1, 李富生1,2


1. 云南农业大学农学与生物技术学院, 云南 昆明 650201;
2. 云南农业大学甘蔗研究所, 云南 昆明 650201
收稿日期:2019-06-30;修回日期:2019-10-03;网络出版日期:2019-10-24
基金项目:福建农林大学国家甘蔗工程技术研究中心开放课题(NERO2018.6.1);云南省教育厅科学研究基金项目(2019J0143);云南省现代农业甘蔗产业技术体系建设专项(2018-2019)
*通信作者:李富生, E-mail:lfs810@sina.com.
摘要:[目的] 筛选防治甘蔗赤腐病(sugarcane red rot)的生防菌株。[方法] 实验以前期分离获得的甘蔗内生细菌为目标菌,以甘蔗赤腐病的病原真菌镰孢炭疽菌(Colletotrichum falcatum Went.)为指示菌,采用平板对峙法筛选对该病菌有较强抑制作用的菌株,然后通过琼脂扩散法测定菌株代谢产物对抑菌活性的影响,并对具有较好拮抗效果的高效菌株进行抑菌广谱性分析并对其进行鉴定。最后通过形态学、生理生化特征以及16S rDNA和gyrA序列分析对高效菌株YC89进行鉴定。[结果] 经初筛筛选到抑菌带均大于1.60 cm的5株拮抗细菌,其中X22、W2、YC89抑菌带均高达1.87 cm。对初筛得到的5株内生菌进行复筛,结果所示菌株YC89、H1、X22、W2、YT93对镰孢炭疽菌的抑菌率都在75%以上,其中菌株YC89对该病菌的抑菌效果最好,其抑菌率为78%。菌株YC89的发酵液、上清液、过滤液及粗蛋白提取液对镰孢炭疽菌的生长有较强的抑制作用,且菌株YC89对玉米大斑病、甘蔗梢腐病、草莓灰霉病等7种病原菌也有较好的抑制效果。通过菌株鉴定结果,初步将YC89菌株鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。[结论] 菌株YC89对镰孢炭疽菌具有较好的抑制效果,表明其对甘蔗赤腐病的生物防治具有较大的应用潜力。
关键词:甘蔗赤腐病镰孢炭疽菌生防细菌筛选
Screening and identification of endophytic antagonistic Bacteria YC89 in sugarcane red rot
Linyan Xie1, Yining Di1, Lilian He1,2, Lufeng Liu1, Xianyue Shen1, Fusheng Li1,2


1. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, Yunnan Province, China;
2. Sugarcane Research Institute of Yunnan Agricultural University, Kunming 650201, Yunnan Province, China
Received: 30 June 2019; Revised: 3 October 2019; Published online: 24 October 2019
*Corresponding author: Li Fusheng, E-mail:lfs810@sina.com.
Foundation item: Supported by the Open Topic of National Sugarcane Engineering Technology Research Center of Fujian Agriculture and Forestry University(NERO2018.6.1), by the Yunnan Provincial Department of Education Science Research Fund Project (2019J0143) and by the Special Project for the Construction of Modern Agricultural Sugarcane Industry Technology System in Yunnan Province (2018-2019)
Abstract: [Objective] Screening biocontrol strains for controlling sugarcane red rot caused by Colletotrichum falcatum Went. [Methods] The endophytic bacteria isolated from sugarcane were used as target bacteria. The sugarcane red rot pathogenic fungus Colletotrichum falcatum Went. was used as an indicator. Strains with strong inhibitory effect on the pathogen were screened by confrontation culture. Antibacterial activity of the metabolites was determined by agar diffusion method. Then, the broad-spectrum analysis of the antimicrobial activity of highly effective strains with good antagonistic effect was carried out and identified. Finally, the high-efficiency strain YC89 was identified through morphological, physiological and biochemical characteristics in combination with 16S rDNA and gyrA sequence analysis. [Results] Five strains of antagonistic bacteria with bacteriostatic bands greater than 1.60 cm were screened by initial screening, among which X22, W2 and YC89 were up to 1.87 cm. The five endophytic bacteria obtained from the initial screening were rescreened. Strains YC89, H1, X22, W2 and YT93 had a inhibition rate above 75% against sugarcane red rot, among which YC89 had the best inhibition rate of 78%. The culture solution, supernatant, filtrate and crude protein extract of strain YC89 showed strong antagonistic activities to the hyphal growth of Colletotrichum falcatum Went. In addition, strain YC89 also had good activity against 7 plant pathogenic fungi. Strain YC89 was identified as Bacillus velezensis. [Conclusion] Strain YC89 has good biocontrol effect on sugarcane red rot pathogen, and has great application potential in the biological control of sugarcane red rot.
Keywords: sugarcane red rotColletotrichum falcatum Wentbiocontrol bacteriascreening
甘蔗赤腐是由半知菌亚门炭疽菌属镰孢炭疽菌(Colletotrichum falcatum Went.)引起的真菌性病害,其有性阶段为子囊菌门囊孢壳属塔地囊孢壳菌[Physalospora tucumanensis Speg.(=Glomerella tucumanensis)][1]。赤腐病最早于1893年在印度尼西亚爪哇发生并被人们所报道,是人们最早知道的甘蔗病害之一,紧接着在多个甘蔗种植生产国迅速相继暴发[2]。报道指出赤腐病是印度、巴基斯坦、美国和孟加拉等多个甘蔗种植国最为严重的甘蔗病害之一,对甘蔗造成的产量损失可达25%–50%,该病也已成为中国各甘蔗种植生产区最严重的甘蔗病害之一[3]。由于赤腐病病原菌易发生变异,已出现6个以上的变种,一个抗病品种种植4–5年就失效,因此赤腐病被称为甘蔗的癌症[4]。此病害不仅导致甘蔗产量降低,其病原菌还可促使蔗糖转化,降低蔗汁纯度、减少蔗糖糖分[5]。防治甘蔗赤腐病采用化学杀菌剂被认为是目前最有效防治方法,但长期依赖使用化学杀菌剂容易使病原菌产生抗性而导致防治效果降低,连带产生农药残留,危害生态环境,威胁人类的健康[6]。目前甘蔗赤腐病的防治方法主要有抗病育种、化学防治、加强田间管理和生物防治等[7]。利用有益微生物来防治甘蔗赤腐病已成为一种有效且绿色环保的病害防治途径。国内外关于利用有益微生物防控甘蔗赤腐病菌的研究已有很多报道,筛选出了包括假单胞菌(Pseudomonas spp.)[8]、木霉(Trichoderma spp.)[9]和芽孢杆菌(Bacillus spp.)[10]等多种对甘蔗赤腐病具有良好抑菌效果的有益微生物。
植物内生菌(endophyte)是指其生活史中某一定阶段或全部阶段,生活在健康植物各种组织和器官内部的真菌、细菌和放线菌[11]。植物内生菌在植物体内具有稳定的生存空间,不易受外界环境条件的影响,在生物防治中是一种较有潜力的生物菌剂。植物内生菌在生物防治中存在多种生防机制,不同内生菌存在不同的生防机制。生防菌在防治植物病害时能通过分泌抗菌物质、与病原物竞争营养物质和生态位、促进植物生长和诱导植物产生抗性系统等来抑制病原菌的生长[12]。生物防治已被人们广泛关注和研究,并从植物内部和根际土壤中分离筛选到大量的生防菌,目前已有不少生防菌被开发运用于市场。植物内生细菌由于其独特的生态位,可能对植物土传病害和维管束病害等化学防治较为困难的植物病害具有独特的防治作用,现已被认为是生物防治的天然资源,植物内生菌广泛存在于水稻、玉米、马铃薯等多种作物中[13]。
甘蔗赤腐病是由镰孢炭疽菌引起的世界性土传病害,是我国甘蔗种植地区最普遍发生的病害,严重影响着我国甘蔗产业的发展。目前国内尚没有针对赤腐病的高抗病性甘蔗品种,甘蔗病害防控仍以化学防控为主,由此带来的农药残留和环境污染问题已经受到广泛关注。本研究通过平板对峙法从已经分离的甘蔗内生细菌中筛选出对甘蔗赤腐有生防效果的菌株,并对其进行鉴定,以为甘蔗赤腐的微生物防治提供依据。
1 材料和方法 1.1 试验材料
1.1.1 甘蔗内生菌菌株: 甘蔗内生菌株从云南农业大学甘蔗研究所的甘蔗中分离所得。
1.1.2 供试内生菌菌株: 供试内生菌菌株由前人分离自云南农业大学甘蔗所12个栽培种5个野生种的根、茎、叶[14]。
1.1.3 供试病原菌: 玉米大斑病原真菌大斑凸脐蠕孢菌(Exserohilum turcicum)、玉米小斑病原真菌玉蜀黍离蠕孢(Bipolaris maydis)、禾谷茎腐病原真菌禾谷镰孢(Fusarium graminearum)、烟草炭疽病原真菌胶孢炭疽菌(Colletotrichum gloeosporioides)、玉米纹枯病原真菌立枯丝核菌(Rhizoctonia solani)、草莓灰霉病原真菌灰葡萄孢菌(Botrytis cirerea)由云南农业大学植物保护学院生物防治实验室提供,甘蔗赤腐病原真菌镰孢炭疽菌(Colletotrichum falcatum)和甘蔗梢腐病原真菌串珠镰刀菌(Fusarium moniliforme)由云南农业大学甘蔗研究所分离所得。
1.1.4 马铃薯葡萄糖琼脂培养基(PDA): 200 g/L去皮马铃薯,20 g/L葡萄糖,15 g/L琼脂,pH自然。
1.1.5 LB液体培养基: 10 g/L蛋白胨,5 g/L酵母粉,10 g/L NaCl,pH值7.0。
1.1.6 LB固体培养基: 10 g/L蛋白胨,5 g/L酵母粉,10 g/L NaCl,15 g/L琼脂固化而成。
1.2 甘蔗内生生防细菌的筛选
1.2.1 内生生防菌的初筛: 采用平板对峙法[15]对供试内生菌株进行筛选,将经活化后的甘蔗病病原菌菌落经过打孔器处理成直径为5 mm菌饼,将其接种在直径为9 cm的PDA平板中心,然后在距中心30 mm处4个方向接种不同内生细菌。每个平板接4株不同菌株,以不接种内生菌的平板为对照,每个处理3次重复。在28℃下培养,3 d后观察抑菌效果,计算其抑菌带大小。
1.2.2 生防菌的复筛: 选取抑菌圈宽度大于16 mm的内生菌,利用平板对峙培养方法对其进行复筛[16]。在PDA培养基平板的中心接入一块直径为5 mm的甘蔗赤腐病病原菌,在距离中心30 mm处接种初筛获得有抑制作用的内生菌,处理重复3次,以接无菌水为对照。28 ℃条件下培养3 d,待菌丝长出,采用十字交叉法测量对照组直径和处理组直径,并根据公式(1)计算其抑菌率。
 | 公式(1) |
采用琼脂扩散平板法[18],取直径5 mm的病原菌菌饼接种于PDA培养基平板中央。用5mm打孔器在PDA平板上等距离打3个孔,用移液枪分别加入100 μL上清液、过滤液、蛋白粗提液、冷冻上清液及冷冻过滤液,28 ℃培养3 d,在对照病原菌落长满平板时,采用十字交叉法测量各处理组病原菌直径,并根据公式(1)计算其抑菌率。每个处理重复3次,方法同1.2.2。
1.4 YC89菌株抑菌谱测定 采用平板对峙法,以玉米大斑病菌、烟草炭疽病菌、草莓灰霉病菌等7株病原菌为指示菌,测定YC89菌株的抑菌活性及广谱性。用打孔器取直径5 mm活化好的供试病原菌菌块置于PDA平板中央,四周接种YC89菌株,以不接种YC89菌株为对照,每处理重复3次,计算病菌抑制率,方法同1.2.2。
1.5 YC89菌株的鉴定
1.5.1 形态特征和生理生化特征鉴定: 参照《常见细菌系统鉴定手册》对上述分离筛选的高效生防菌株YC89形态特征鉴定。参照文献的方法观察淀粉水解、硝酸还原酶活性、明胶液化、甲基红显色和V-P显色情况等[19]。依据革兰氏染色试剂盒(索莱宝)步骤对菌株进行革兰氏染色,阳性呈紫色,阴性呈红色。
1.5.2 分子生物学鉴定: 依据细菌DNA提取试剂盒(OMEGA)步骤提取YC89菌株的DNA,采用细菌16S rDNA基因的通用引物27F:5′-AGA GTTTGATCCTGGCTCAG-3′,1492R:5′-TACGG CTACCTTGTTACGACTT-3′以及持家基因gyrA的引物GyrA-F:(5′-CAGTCAGGAAATGCGTACG TCCTT-3′),GyrA-R:(5′-CAAGGTAATGCTCCAG GCATTGCT-3′)进行PCR扩增[20]。PCR反应体系为20 μL,包括DNA模板2 μL,引物(F/R)各1 μL,mix 10 μL,ddH2O 6 μL。PCR扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸30 s,共30个循环;最后72 ℃延伸10 min。PCR产物进行1%琼脂糖凝胶电泳并回收目的片段,目的片段送至生工生物工程(上海)股份有限公司进行测序,测序结果用BLAST软件在在GenBank基因库中进行同源性比对,并用MEGA7.0软件构建系统发育树。
2 结果和分析 2.1 内生生防菌的初筛结果 将甘蔗内生菌通过平板对峙法进行初筛,得到22株对甘蔗赤腐病抑菌带 > 1 cm的内生菌。菌株X22,W2,YT93,H1和YC89对赤腐病原菌的抑菌效果最好,它们的抑菌带都达到了1.6 cm,其中表现最好的菌株是X22,W2和YC89,抑菌带均达到了1.87 cm,H1和YT93次之,其抑菌带为1.70 cm (表 1)。
表 1. 内生菌株对甘蔗赤腐病原菌对峙培养的抑菌带分析 Table 1. Analysis of bacteriostatic zones of endophytic strains against sugarcane red rot pathogen in stand-off culture
| Strains | Bacteriostatic zones/cm |
| X22 | 1.87±0.55d |
| X22-g-11 | 1.63±0.40cd |
| X22-g-8 | 1.27±0.21bc |
| gsm-y-6 | 1.57±0.06cd |
| X22-g-6 | 1.57±0.06cd |
| wjm-g-4 | 1.53±0.15cd |
| W2 | 1.87±0.32d |
| H1 | 1.70±0.10cd |
| bm-y-3 | 1.67±0.29cd |
| wjm-g-1 | 1.27±0.12bc |
| MT-g-9 | 1.4±0.26bcd |
| MT-g-7 | 1.63±0.25cd |
| X10-g-6 | 1.27±0.12bc |
| MT-g-13 | 1.60±0.10cd |
| YZ-g-11 | 1.43±0.29cd |
| GT-g-3 | 1.37±0.1bc |
| wjm-g-2 | 1.60±0.10cd |
| YC89 | 1.87±0.15d |
| wjm-g-4 | 1.53±0.15cd |
| YC89-g-19 | 1.27±0.06b |
| YT93 | 1.70±0.44cd |
| YT93-j-3 | 1.43±0.21cd |
| The data are “x±s”. Different uppercase letters in the same column show significant difference at 5% level by Duncan smultiple range test. | |
表选项
2.2 复筛 对初筛得到的抑菌带大于1.6cm的5株内生菌进行复筛,如表 2所示,菌株YC89、H1、X22、W2、YT93对甘蔗赤腐病的抑菌率都在75%以上,其中菌株YC89对甘蔗赤腐病的抑菌效果最好(图 1),其抑菌率为78%,菌株YT93最弱,其抑菌率为76%。
表 2. 对甘蔗赤腐病原菌抑菌效果较好的5株内生菌株 Table 2. Five endophytic strains with good bacteriostatic effect on sugarcane red rot pathogen
| Strains | Origin | Diameter of pathogen/cm | Inhibitionv rate/% |
| YC89 | Leaf of YaCheng89 | 1.98±0.18a | 78 |
| H1 | Root of Narenga porphyrocoma (hance) Bor | 2.10±0.26a | 77 |
| X22 | Root of ROC22 | 2.05±0.40a | 77 |
| W2 | Leaf of Miscanthus floridulus | 2.13±0.32a | 76 |
| YT93 | Leaf of YueTang93-359 | 2.17±0.25a | 76 |
表选项
 |
| 图 1 YC89菌株对镰孢炭疽菌的抑菌作用 Figure 1 Antibacterial effect of YC89 strain on Colletotrichum falcatum. ?A: Control (Colletotrichum falcatum); ?B: Antibacterial effect of YC89 strain on Colletotrichum falcatum. |
| 图选项 |
2.3 生防菌株代谢产物对赤腐病病原菌菌丝生长的影响 如表 3所示生防菌培养液对赤腐病病原菌菌丝生长有较强的抑制作用,其中菌株YC89对赤腐病病原菌抑制率最强高达为100%;生防菌的上清液和冻上清抑菌率均在70%以上,其中W2抑菌率最强,分别达到87%和86%,其次是X22达到84%和81%;生防菌过滤液和冻过滤抑菌率均在60%以上,其中YC89冻过滤液最强为74%,H1过滤液最强为78%,得出上清液和过滤液比冻上清和冻过滤的效果要强;生防菌蛋白粗提液对赤腐病病原菌菌丝生长也有较强抑制作用,其中H1抑菌率最强,达到84%,其次为菌株YC89和W2,抑菌率达到83%和82%。
表 3. 生防菌代谢产物对镰孢炭疽菌菌丝生长的抑制作用 Table 3. Inhibition of mycobacterial metabolites on mycelial growth of Colletotrichum falcatum
| Strains | Inhibition rate/% | |||||
| Culture medium | Crude protein | Supernatant | Frozen supernatant | Filtrate | Frozen filtrate | |
| W2 | 89 | 82 | 88 | 86 | 68 | 66 |
| H1 | 81 | 84 | 85 | 73 | 78 | 69 |
| X22 | 85 | 79 | 84 | 86 | 72 | 71 |
| YC89 | 100 | 83 | 81 | 81 | 77 | 74 |
| YT93 | 79 | 77 | 73 | 72 | 69 | 64 |
表选项
2.4 YC89抑菌活性及广谱性分析 为研究菌株YC89的广谱性,采用平板对峙法对其进行抑菌谱测定。菌株YC89对7株供试病原真菌抑菌效果如图 2所示,YC89对供试病原菌都有较好的抑菌效果,对所测病原菌抑菌率在65%–80%,其中对玉米大斑病、甘蔗梢腐病、草莓灰霉病抑菌效果最好,其抑菌率均达到75%以上(表 4)。
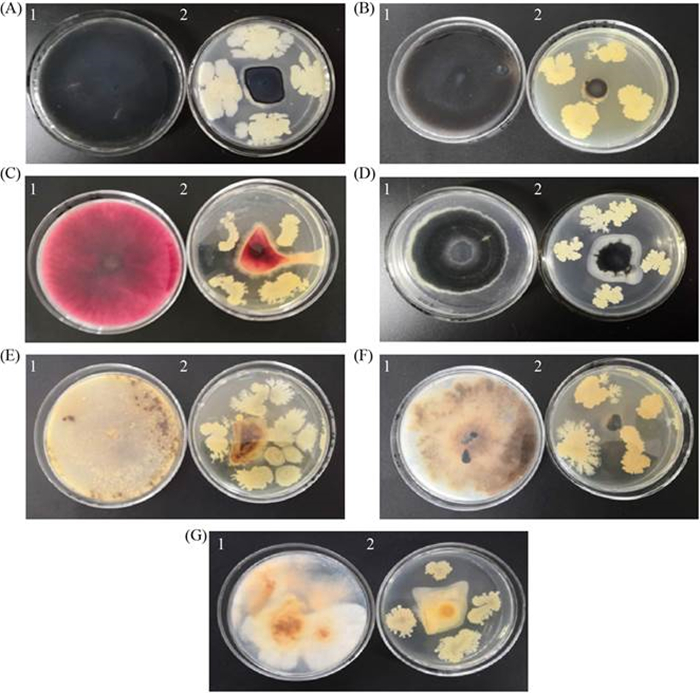 |
| 图 2 YC89菌株对病原真菌的抑制作用 Figure 2 Inhibition of pathogenic fungi by YC89 strain. ?A: Exserohilum turcicum; ?B: Bipolaris maydis; ?C: Fusarium graminearum; ?D: Colletotrichum destructivum; ?E: Rhizoctonia solani; ?F: Botrytis cirerea; ?G: Fusarium moniliforme. 1: Control; 2: Treat. |
| 图选项 |
表 4. YC89对供试病原菌抑菌活性分析 Table 4. Analysis of antibacterial activity of YC89 on the tested
| Pathogen | Diameter of pathogen/cm | Inhibition rate/% |
| Exserohilum turcicum | 1.83±0.29a | 80 |
| Bipolaris maydis | 2.28±0.28ab | 75 |
| Fusarium graminearum | 3.12±0.24c | 65 |
| Colletotrichum gloeosporioides | 2.30±0.17ab | 74 |
| Fusarium moniliforme | 3.15±0.25c | 65 |
| Botrytis cirerea | 2.25±0.85ab | 75 |
| Rhizoctonia solani | 2.87±0.35bc | 68 |
表选项
2.5 YC89菌株的鉴定
2.5.1 YC89形态学和生理生化鉴定: 菌株YC89在LB培养基上菌落形状为椭圆形或圆形,呈白色,菌落边缘皱褶,中间凸起,经革兰氏染色后呈阳性。菌株YC89的生理生化测定结果见表 5,菌株YC89对精氨酸双水解酶、硝酸盐还原、明胶、靛基质、接触酶、淀粉水解、VP等试验均为阳性,对氧化酶、甲基红、乙酰胺酶等试验均为阴性。通过形态学和生理生化鉴定将该菌初步鉴定为芽孢杆菌(Bacillus)。
表 5. 菌株YC89生理生化特征 Table 5. Physiological and biochemical characteristics of strain YC89
| Physiological and biochemical indexes | Results |
| Oxidase | – |
| Arginine double hydrolase | + |
| Indole | + |
| Methyl test | – |
| Catalase | + |
| V.P. test | + |
| Gelatin liquefaction | + |
| Mannose | + |
| Acetylamine | – |
| Starch hydrolysis | + |
| “+”: Positive reaction; “–”: Negative reaction. | |
表选项
2.5.2 分子生物学鉴定结果: 以菌株YC89的DNA为模板扩增16S rDNA基因片段,通过BLAST软件进行同源性比对,并用MEGA7.0软件构建系统发育树。结果显示用细菌通用引物27F/1492R对菌株YC89进行PCR扩增,扩增产物经测序,其目的片段大小为719 bp。将测序结果在NCBI上用BLAST软件进行同源性比对,菌株YC89与贝莱斯芽孢杆菌(Bacillus velezensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)以及西姆芽孢杆菌(Bacillus siamensis)的同源性达99%。利用MEGA7.0软件构建系统发育树(图 3-A)YC89与贝莱斯芽孢杆菌(Bacillus velezensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)以及西姆芽孢杆菌(Bacillus siamensis)同属一分支,其中与Bacillus velezensis strain PG-2-MS (MH838019.1)距离最近。将gyrA基因序列的测序结果在NCBI中进行BLAST比对,结果显示菌株YC89与Bacillus velezensis的gyrA基因序列最为相似,同源性达100%。构建系统发育树(图 3-B)菌株YC89与Bacillus velezensis处于同一个分支,其中与Bacillus velezensis strain M75 (CP016395.1)距离最近。综合上述结果最终将菌株YC89确定为贝莱斯芽孢杆菌(Bacillus velezensis)。
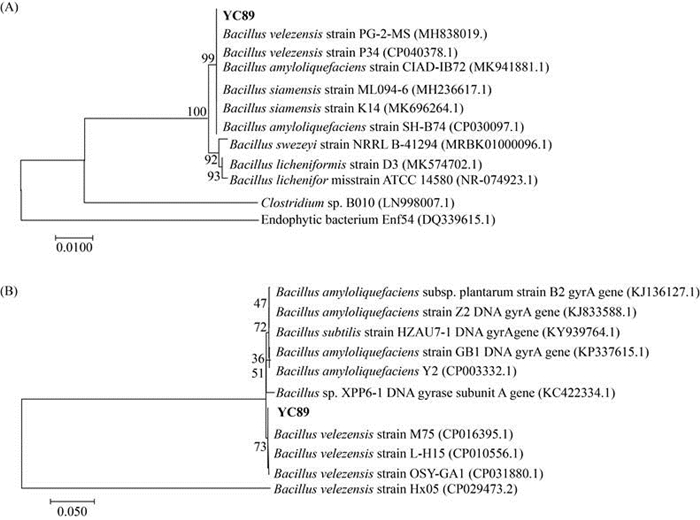 |
| 图 3 菌株YC89的系统发育树 Figure 3 Neighbour-joining phylogenetic trees based on 16S rRNA (A) and gyrA (B) gene sequences of strains 504. Numbers in parentheses represent the sequences accession number in GenBank. Numbers at the nodes represent the bootstrap values based on neighbor-joining analyses of 1000 resampled datasets. Bar 0.5% sequence divergence. Target strain was labeled in bold. |
| 图选项 |
3 讨论 本研究从已经分离的甘蔗内生细菌中,筛选到一株贝莱斯芽孢杆菌YC89,该菌株不仅对甘蔗赤腐病菌具有较好的生防效果,对其他一些植物病原菌也具有较好的抑制效果,为甘蔗赤腐病的生物防治提供了新的微生物资源。
贝莱斯芽孢杆菌是一种新型生防细菌,由西班牙****Ruiz-García等[21]2005年在西班牙南部马赫拉加发现并将其命名为芽孢杆菌种,Wang等[22]2008年将其确定为解淀粉芽孢杆菌的后期异型体。本研究通过形态特征和生理生化特征鉴定将菌株YC89的分类地位初步鉴定为芽孢杆菌属。利用16S rDNA序列进行测序分析,发现菌株YC89与西姆芽孢杆菌(Bacillus siamensis)、贝莱斯芽孢杆菌(Bacillus velezensis)以及解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的同源性均达到99%,对菌株YC89无法作出正确的分类。芽孢杆菌属是一个非常庞大的属,从目前的分类上来说,很多不同的芽孢杆菌间都存在着极高的相似性,传统的分类方法很难有效地确定菌株的分类地位。因此对菌株的鉴定除了采用传统的鉴定方法,还应采用多种分子鉴定方法进行综合分析。本研究除了采用16S rDNA序列对菌株进行鉴定,还进一步采用gyrA序列对菌株进行测序分析,最终发现菌株YC89与Bacillus velezensis的相似性为100%。
植物内生菌因其具有生防活性受到研究人员的广泛关注。内生菌对植物病害防治已成为内生菌研究的巨大潜力,目前对生防菌的研究主要还是集中在实验室,但是从实验室走向大田的过程是比较复杂的,不同的菌株对土壤环境存在着不同的适应力,实验室具有明显拮抗作用的菌株,在大田上的生防效果不一定很好,相反由于菌株对培养基的选择差异性,有些菌株在平板上不具有明显拮抗作用,但在田间却能有较好的生防效果,所以实验室内抑菌圈的大小并不能代表田间的防治效果,要想达到较好的田间防治效果,还需室内筛选与温室防效测定相结合[23]。因此,关于菌株YC89的抑菌机理和田间防治效果,尚有待进一步研究。
References
| [1] | Nithya K, Bukhari KAIM, Valluvaparidasan V, Paranidharan V, Velazhahan, R. Molecular detection of Colletotrichum falcatum causing red rot disease of sugarcane (Saccharum officinarum) using a SCAR marker. Annals of Applied Biology, 2012, 160(2): 168-173. DOI:10.1111/j.1744-7348.2011.00529.x |
| [2] | Viswanathan R, Sundar AR, Malathi P, Rahul PR, Kumar VG, Banumathy R, Prathima PT, Raveendran M, Kumar KK, Balasubramanian P. Interaction between sugarcane and Colletotrichum falcatum causing red rot:understanding disease resistance at transcription level. Sugar Tech, 2009, 11(1): 44-50. DOI:10.1007/s12355-009-0008-6 |
| [3] | Xu HL, Lin MJ, Guan CX, Li JH, An YY, Gong HL, Zheng XW, He S. Effect of red rot disease on sugarcane quality chalracters. Sugarcane and Canesugar, 2012, 2012(3): 23-28. (in Chinese) 许汉亮, 林明江, 管楚雄, 李继虎, 安玉兴, 龚恒亮, 郑学文, 贺帅. 甘蔗赤腐病对甘蔗品质指标的影响. 甘蔗糖业, 2012, 2012(3): 23-28. DOI:10.3969/j.issn.1005-9695.2012.03.006 |
| [4] | Wang BH. The occurrence status and the research progress of sugarcane disease in China. Sugar Crops of China, 2007, 3: 48-51. (in Chinese) 王伯辉. 我国甘蔗病害的发生现状与研究进展. 中国糖料, 2007, 3: 48-51. DOI:10.3969/j.issn.1007-2624.2007.03.017 |
| [5] | Bukhari KAIM, Nithya K, Valluvaparidasan V, Paranidharan V, Velazhahan R. Detection of Colletotrichum falcatum causing red rot of sugarcane by enzyme-linked immunosorbent assay. Archives of Phytopathology and Plant Protection, 2012, 45(7): 823-830. DOI:10.1080/03235408.2011.597959 |
| [6] | Ma C, Zhu HL, Huang TW, Zhang BJ. Screening and identification of endophytic antagonistic bacteria to Botrytis cinerea in tomato. Journal of Shanxi Agricultural Sciences, 2018, 46(3): 437-440, 452. (in Chinese) 马超, 朱洪磊, 黄太伟, 张宝俊. 番茄灰霉病菌内生拮抗细菌的筛选及鉴定. 山西农业科学, 2018, 46(3): 437-440, 452. DOI:10.3969/j.issn.1002-2481.2018.03.30 |
| [7] | Lin SH, Huang CH, Wang BH. Research progress on controlling on red rot disease of sugarcane. Sugar Crops of China, 2011, 4: 69-73. (in Chinese) 林善海, 黄诚华, 王伯辉. 甘蔗赤腐病防治技术研究进展. 中国糖料, 2011, 4: 69-73. DOI:10.3969/j.issn.1007-2624.2011.04.025 |
| [8] | Viswanathan R, Samiyappan R. Pseudomonas spp. colonization in sugarcane rhizosphere reduces titre of Colletotrichum falcatum Went-causing red rot disease of sugarcane. Archives of Phytopathology and Plant Protection, 2006, 39(1): 39-44. DOI:10.1080/03235400500180883 |
| [9] | Singh P, Tripathi N, Joshi D, Pathak AD, Sethi A. Trichoderma elicitors create a potential chemical barrier through induced systemic resistance against Colletotrichum falcatum and minimise sucrose losses in sugarcane. Journal of Plant Pathology, 2018, 100(2): 151-162. DOI:10.1007/s42161-018-0034-x |
| [10] | Liang YQ, Tang W, Wu WH, Li L, Xi JG, Zheng XL, Li R, Zheng JL, Huang X, He CP, Yi KX. Isolation and identification of antagonistic bacteria TWC2 and its control effect against sugarcane red rot. Chinese Journal of Tropical Agriculture, 2018, 38(2): 61-68. (in Chinese) 梁艳琼, 唐文, 吴伟怀, 李乐, 习金根, 郑肖兰, 李锐, 郑金龙, 黄兴, 贺春萍, 易克贤. 甘蔗赤腐病菌拮抗细菌TWC2的分离鉴定及其防效研究. 热带农业科学, 2018, 38(2): 61-68. |
| [11] | Ryan RP, Germaine K, Franks A, Ryan DJ, Dowling DN. Bacterial endophytes:recent developments and applications. FEMS Microbiology Letters, 2008, 278(1): 1-9. DOI:10.1111/j.1574-6968.2007.00918.x |
| [12] | Song WW, Zhu H, Yu FY, Niu XQ, Tang QH, Qin WQ. Plant endophytes and their control effects on plant diseases:a review. Jiangsu Agricultural Sciences, 2018, 46(6): 12-16. (in Chinese) 宋薇薇, 朱辉, 余凤玉, 牛晓庆, 唐庆华, 覃伟权. 植物内生菌及其对植物病害的防治作用综述. 江苏农业科学, 2018, 46(6): 12-16. |
| [13] | 陈博.抗FOC4香蕉内生菌的筛选及菌株DB09208的鉴定和防治效果研究.海南大学硕士学位论文, 2010. |
| [14] | Liu LF, Cun HC, He PF, Di YN, Wu YX, He LL, Li FS, He YQ. Isolation, identification and multiple function analyses of sugarcane endophytes. Chinese Journal of Tropical Crops, 2019, 40(6): 1144-1152. (in Chinese) 刘鲁峰, 寸海春, 何鹏飞, 狄义宁, 吴毅歆, 何丽莲, 李富生, 何月秋. 甘蔗内生菌分离鉴定及功能多样性研究. 热带作物学报, 2019, 40(6): 1144-1152. DOI:10.3969/j.issn.1000-2561.2019.06.016 |
| [15] | 陈孝利.苜蓿内生菌的分离及生防菌株的筛选与鉴定.中国农业科学院硕士学位论文, 2017. |
| [16] | Shi HL, Tan J, Ding CF, Zhao XY, Xiang BK, Luo F. Selecting of antagonistic Bacillus against tobacco black shank and detecting of control efficacy. Hubei Agricultural Sciences, 2018, 57(18): 60-65, 68. (in Chinese) 施河丽, 谭军, 丁才夫, 赵秀云, 向必坤, 罗芳. 烟草黑胫病拮抗芽孢杆菌的筛选及生防效果评价. 湖北农业科学, 2018, 57(18): 60-65, 68. |
| [17] | Yao YP, Ding D, Zhang YQ, Chang XJ, Dong LX, Zhang LT, Du RH, Sun CP. Screening of maize endophytic antagonists against Aspergillus flavus and activities research of antagonistic strain B42-3. Journal of the Chinese Cereals and Oils Association, 2018, 33(3): 84-88. (in Chinese) 姚彦坡, 丁丹, 张友青, 常晓娇, 董李学, 张立田, 杜瑞焕, 孙长坡. 玉米黄曲霉毒素污染生防菌筛选及菌株B42-3抗菌活性研究. 中国粮油学报, 2018, 33(3): 84-88. DOI:10.3969/j.issn.1003-0174.2018.03.014 |
| [18] | Tang M, Gong MF, Luo Y, Guan QL. Crude protein extract of endophytic bacteria strain KLXD06 antagonistic against methicillin-resistant Staphylococcus aureus. Jiangsu Agricultural Sciences, 2015, 43(2): 334-335. (in Chinese) 唐梅, 龚明福, 罗燕, 管芩澜. 抗耐甲氧西林金黄色葡萄球菌内生细菌KLXD06粗蛋白的提取. 江苏农业科学, 2015, 43(2): 334-335. |
| [19] | 李晶.黄瓜枯萎病高效拮抗枯草芽孢杆菌的筛选及生防机制研究.哈尔滨工业大学博士学位论文, 2010. |
| [20] | Li SZ, Chen Y, Yang RH, Zhang CP, Liu Z, Li YL, Chen T, Chen GY, Zou LF. Isolation and identification of a Bacillus velezensis strain against plant pathogenic Xanthomonas spp. Acta Microbiologica Sinica, 2019, 59(10): 1969-1983. (in Chinese) 李生樟, 陈颖, 杨瑞环, 张翠萍, 刘昭, 李逸朗, 陈涛, 陈功友, 邹丽芳. 一株拮抗黄单胞菌的贝莱斯芽孢杆菌的分离和鉴定. 微生物学报, 2019, 59(10): 1969-1983. |
| [21] | Ruiz-García C, Béjar V, Martínez-Checa F, Llamas I, Quesada E. Bacillus velezensis sp. nov., a surfactant-producing bacterium isolated from the river Vélez in Málaga, southern Spain. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(1): 191-195. DOI:10.1099/ijs.0.63310-0 |
| [22] | Wang LT, Lee FL, Tai CJ, Kuo HP. Bacillus velezensis is a later heterotypic synonym of Bacillus amyloliquefaciens. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(3): 671-675. DOI:10.1099/ijs.0.65191-0 |
| [23] | Chen ZB, Jin S, Zhang YF, Mo LL, Wang HY, Li JW, Liu YM. Recent advances and issues on the endophytes and the effects on biological control of plant diseases. Journal of Kunming University, 2014, 36(3): 40-42, 47. (in Chinese) 陈泽斌, 靳松, 张永福, 莫丽玲, 王海燕, 李健文, 刘一鸣. 植物内生菌生物防治研究进展及存在的问题. 昆明学院学报, 2014, 36(3): 40-42, 47. |
