林金水1,2

 , 牛艳婷1, 王帅涛1, 王贵锋1, 田野1, 张恒1, 朱旭飞1, 司青坡1, 成娟丽1, 艾亚楠1, 赵文静1, 张向前2
, 牛艳婷1, 王帅涛1, 王贵锋1, 田野1, 张恒1, 朱旭飞1, 司青坡1, 成娟丽1, 艾亚楠1, 赵文静1, 张向前2 1. 延安大学生命科学学院, 陕西 延安 716000;
2. 陕西省红枣重点实验室(延安大学), 陕西 延安 716000
收稿日期:2019-07-20;修回日期:2019-10-29;网络出版日期:2020-03-10
基金项目:国家自然科学基金(31700031,31860012);陕西省自然科学基础研究计划(2018JQ3004);陕西省教育厅重点实验室科研计划(17JS138);陕西省社发一般项目(2018SF-165);陕西省普通高等学校青年杰出人才支持计划;延安大学博士科研启动项目(YDBK2016-01,YDBK2016-11);国家级大学生创新创业训练项目(201813008,201813019);陕西省大学生创新创业训练项目(S201910719043,S201910719081)
*通信作者:林金水, Tel:+86-911-2332030.E-mail:linjinshui@yau.edu.cn.
摘要:[目的] 本研究以铜绿假单胞菌PAO1(Pseudomonas aeruginosa PAO1,菌种编号ATCC15692)为对象,研究cntRLMN在锌离子摄取中的功能。[方法] 在ΔznuBC的基础上,以同源重组的方法构建了cntRLMN的各种突变菌株,通过质粒接合转移的方法构建其互补菌株及lacZ转录融合报告菌株,运用β-半乳糖苷酶酶活检测研究了Zur蛋白对cntRLMN的转录调控,凝胶阻滞实验(EMSA)检验Zur蛋白与cnt启动子及cnt启动子的突变片段的体外结合,并进一步通过生长曲线分析对cntRLMN中cntR、cntL、cntN等基因的锌离子摄取功能进行了分析和鉴定。最终,通过构建大蜡螟幼虫的侵染模型来研究cntRLMN对铜绿假单胞菌毒力发挥的影响。[结果] lacZ转录融合的酶活分析显示cntRLMN受Zur蛋白的负调控,其表达以Zur蛋白依赖的方式受锌离子饥饿的诱导;EMSA实验的结果显示cntRLMN的启动子可以与His-Zur结合形成DNA-蛋白质复合体,结合位点为GCGTTATAGTATATCAT;生长曲线和大蜡螟幼虫侵染实验的分析结果显示ZnuBC和CntRLMN的功能存在互补性,仅znuBC和cntRLMN双缺失突变时菌株在限锌培养条件下的生长和对大蜡螟幼虫的毒性才受到显著抑制,说明CntRLMN代表另一种独立的锌离子摄取系统。[结论] cntRLMN是受Zur直接负调控的另一种独立的铜绿假单胞菌锌离子摄取系统,对铜绿假单胞菌毒力的发挥起重要作用。
关键词:铜绿假单胞菌锌摄取cntRLMN锌离子摄取调控蛋白Zur凝胶阻滞实验
Characterization of zinc ion uptake mediated by cntRLMN operon in Pseudomonas aeruginosa
Jinshui Lin1,2

 , Yanting Niu1, Shuaitao Wang1, Guifeng Wang1, Ye Tian1, Heng Zhang1, Xufei Zhu1, Qingpo Si1, Juanli Cheng1, Yanan Ai1, Wenjing Zhao1, Xiangqian Zhang2
, Yanting Niu1, Shuaitao Wang1, Guifeng Wang1, Ye Tian1, Heng Zhang1, Xufei Zhu1, Qingpo Si1, Juanli Cheng1, Yanan Ai1, Wenjing Zhao1, Xiangqian Zhang2 1. College of Life Sciences, Yan'an University, Yan'an 716000, Shaanxi Province, China;
2. Shaanxi Key Laboratory of Chinese Jujube(Yan'an University), Yan'an 716000, Shaanxi Province, China
Received: 20 July 2019; Revised: 29 October 2019; Published online: 10 March 2020
*Corresponding author: Lin Jinshui, E-mail:linjinshui@yau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31700031, 31860012), by the Natural Science Basic Research Plan in Shaanxi Province of China (2018JQ3004), by the Scientific Research Program Funded by the Shaanxi Provincial Education Department (17JS138), by the General Social Development Project of Shaanxi Province (2018SF-165), by a Grant from the Outstanding Young Talent Support Plan of the Higher Education Institutions of Shaanxi Province, by the Startup Foundation for Doctors of Yan'an University (YDBK2016-01, YDBK2016-11), by the National Innovation and Entrepreneurship Training Program for College Students (201813008, 201813019), and by the Shaanxi University Student Innovation and Entrepreneurship Training Project (S201910719043, S201910719081)
Abstract: [Objective] We characterized the function of cntRLMN in zinc ion uptake of Pseudomonas aeruginosa PAO1 (ATCC15692). [Methods] On the basis of the mutant strain ΔznuBC, we built ΔcntRLMN using homologous recombination. We also constructed its complementary strain and lacZ fusion report strain through plasmid conjugation transfer. Transcriptional regulation of Zur protein on cntRLMN was studied by beta-galactoside enzyme activity assay. In vitro binding of Zur protein to cnt promoter and mutated fragments of cnt promoter was tested using EMSA. The zinc ion uptake function of cntR, cntL, cntN and other genes in the cntRLMN operon was examined through growth curve analysis. Finally, the influence of cntRLMN mutation on the virulence of P. aeruginosa was studied using the infection model of the wax moth larva. [Results] The enzyme activity analysis of lacZ transcription and fusion showed that cntRLMN was negatively regulated by Zur protein, and its expression was induced by zinc ion starvation in a Zur-dependent manner. The EMSA results showed that the promoter of cntRLMN could bind His-Zur to form a DNA-protein complex, where the binding site was GCGTTATAGTATATCAT. The growth curve and the infection experiment of the wax moth larva showed that ZnuBC and CntRLMN were functionally complementary; when grown in Zn-restricted culture, the toxicity of P. aeruginosa to the wax moth larve was significantly inhibited only in the znuBC and cntRLMN double-deleted strain. [Conclusion] The cntRLMN, which plays an important role in toxicity of P. aeruginosa, is likely an alternative zinc ion uptake system directly and negatively regulated by the Zur protein.
Keywords: Pseudomonas aeruginosazinc intakecntRLMNZurEMSA
锌是生物体内含量第二丰富的过渡金属元素。在很多原核生物体内,大约6%的蛋白质可以结合锌离子,锌离子在这些蛋白质的结构和催化功能方面有很重要的作用[1],同时它也在病原细菌的致病和抗生素耐药方面起重要作用[2]。目前新型抗菌药物开发包括干扰或抑制细胞的锌离子摄取[3]。临床上由细菌感染而引起如菌血症、泌尿系统感染、呼吸系统感染、烧伤感染等多种疾病,往往是由铜绿假单胞菌作为主要感染的致病菌株[4-5],同时由于存在严重抗生素耐药性,它在2017年世界卫生组织发布的首份急需新型抗生素的重点病原体清单中位列首位[2]。人体内因为游离的锌被转运或储藏起来,或与钙网蛋白等螯合在一起,成为缺乏锌的环境,这样形成人体先天的免疫防御系统,铜绿假单胞菌等病原微生物必须从人体中获得锌来满足其生长和感染[2, 6-7]。
高亲和力锌离子摄取系统ZnuABC在许多细菌应对锌饥饿中起主要作用[8]。ZnuABC系统在肠道沙门氏菌、鼠伤寒杆菌等细菌中是唯一的锌离子高亲和性的摄取系统,突变ZnuABC系统的基因将使致病菌几乎不能感染任何宿主。与这些细菌一样,铜绿假单胞菌也拥有一个属ATP结合盒(ATP-binding cassette,ABC)蛋白家族的锌离子高亲和性的ZnuABC摄取系统。其中ZnuA是一个周质空间锌结合蛋白,ZnuB是一个内膜透性酶,ZnuC是一个ATP酶。ZnuA负责投递锌离子给内膜上的ZnuBC转运蛋白复合体。在脑膜炎奈瑟氏菌中,ZnuD与ZnuABC偶联,负责胞外锌离子穿过外膜进入到周质空间。铜绿假单胞菌基因组中PA0781蛋白与脑膜炎奈瑟氏菌ZnuD达27%相似性[9]。原核生物的锌摄取受锌离子摄取调控蛋白(Zn2+-uptake regulator,Zur)的负调控,这种负调控依赖于锌离子浓度,铜绿假单胞菌中锌离子摄取也受调控蛋白Zur负调控[10]。在限锌条件下培养单独突变znuA、znuB、znuC或全部突变znuABC基因的菌株仅微弱影响铜绿假单胞菌的生长[9-10]。这表明铜绿假单胞菌中除ZnuABC外还存在其他有效的锌离子摄取系统,它们对ZnuABC锌离子摄取系统的功能缺失有补偿作用。
通过生物信息学分析、基因敲除、遗传互补和表型分析,本研究在铜绿假单胞菌中揭示了一种新的独立的锌离子摄取系统,该系统由PA4834–PA4837操纵子(本研究命名为cntRLMN,PA4834命名为CntN,PA4835命名为CntM,PA4836命名为CntL,PA4837命名为CntR)所编码,其表达响应胞外锌离子的水平并直接受Zur蛋白的负调控,也对铜绿假单胞菌毒力的发挥起重要作用。
1 材料和方法 1.1 材料
1.1.1 菌株、质粒和引物: 见表 1和表 2。
表 1. 菌株和质粒汇总表 Table 1. List of strains and plasmids used in this study
| Strains and plasmids | Relevant characteristics | Source |
| Strains | ||
| Pseudomonas aeruginosa | ||
| PAO1(ATCC15692) | Wild-type | This lab |
| ΔcntL | Mutant of knockout cntL in PAO1 | This study |
| Δzur | Mutant of knockout zur in PAO1 | This study |
| ΔzurΔcntL | Mutant of knockout zur/cntL in PAO1 | This study |
| ΔzurΔcntN | Mutant of knockout zur/cntN in PAO1 | This study |
| ΔBC | Mutant of knockout znuB/znuC in PAO1 | This lab |
| ΔBCL | Mutant of knockout znuB/znuC/cntL in PAO1 | This study |
| PAO1-V | PAO1 containing plasmid pME6032 | This study |
| ΔBC-V | Mutant of knockout znuB/znuC containing plasmid pME6032 | This study |
| ΔBCL-cntL | Mutant of knockout znuB/znuC/cntL containing plasmid pME6032-cntL | This study |
| ΔBCL-znuBC | Mutant of knockout znuB/znuC/cntL containing plasmid pME6032-znuBC | This study |
| ΔBCR-cntR | Mutant of knockout znuB/znuC/cntR containing plasmid pME6032-cntR | This study |
| ΔBCN-cntN | Mutant of knockout znuB/znuC/cntN containing plasmid pME6032-cntN | This study |
| ΔBCRL-cntR | Mutant of knockout znuB/znuC/cntR/cntL containing plasmid pME6032-cntR | This study |
| Escherichia coli | ||
| TG1 | [F′traD36proABlacIqZΔM15]supEthi-1Δ(lac-proAB) Δ(mcrB-hsdSM)5(rK–mK–) | This lab |
| S17-1 | RP4-2(Km::Tn7, Tc::Mu-1), pro-82, LAMpir, recA1, endA1, thiE1, hsdR17, creC510 | This lab |
| Plasmids | ||
| pK18mobSacB | Kmr; sacB-based gene replacement vector | This lab |
| p34s-Gm | Ampr; Gm resistant cassette carrying vector | This lab |
| pME6032 | Shuttle vector between Pseudomonas and E. coli containing lacIq-Ptac fragment for gene expression; source of tetA gene cassette, Tcr | This lab |
| pME6032-cntL | cntL cloned into pME6032 for complementation | This study |
| pME6032-zur | zur cloned into pME6032 for complementation | This study |
| pME6032-znuBC | znuBC cloned into pME6032 for complementation | This study |
| pME6032-cntR | cntR cloned into pME6032 for complementation | This study |
| pME6032-cntN | cntN cloned into pME6032 for complementation | This study |
| pMini-CTX::lacZ | Ω-FRT-attP-MCS, ori, int, oriT, Tcr | This lab |
| pET28a | Expression vector with N-terminal hexahistidine affinity tag, Kmr | This lab |
| pET28a-zur | pET28a derivative for expression of zur | This study |
表选项
表 2. 引物汇总表 Table 2. List of primers used in this study
| Primers | Sequences (5′→3′) | Description |
| cntL F | CTCGGGATCCAACGCCTCGAAATCCTTC | Detection primers of cntL |
| cntL R | GTGTCGTACAGGCGAATCTCGCATTCCAG | |
| cntL U | CGAGATTCGCCTGTACGACACCCTGATCC | |
| cntL L | CTCGAAGCTTCCTGCTCGGAAAGTATCC | |
| cntL BU F | CTCGGAATTCATGCAAGGACGCACACCG | Amplification |
| cntL BU R | CTCGCTCGAGTCATCGACCGGCCTTCTC | primers of cntL |
| cntR F | CTCGGGATCCATGCAGCGGATCGAGCAG | Detection primers of cntR |
| cntR R | GCGACGATCGACACCGAGGACAAGCGAC | |
| cntR U | CCTCGGTGTCGATCGTCGCTACTACGAGC | |
| cntR L | CTCGAAGCTTCACCAGCGAAGCGATCAG | |
| cntN F | CTCGGGATCCTACGTGCACAGTCCGTTC | Detection primers of cntN |
| cntN R | CCAGAACAGCATCACGCTGAAGGTGAAG | |
| cntN U | CAGCGTGATGCTGTTCTGGAGCGAGGTG | |
| cntN L | CTCGAAGCTTAGACTCAATGCCTGGACC | |
| cntN BU F | CTCGGAATTCATGGTGCTCGACCTGCTG | Amplification primers of cntN |
| cntN BU R | CTCGAGATCTCCGGAGGCTCAGCCCTTC | |
| cntR BU F | CTCGGAATTCATGAGAGTCAGTGTGTCG | Amplification primers of cntR |
| cntR BU R | CTCGAGATCTTAGAGGGCTCAGTAGTTC | |
| zur F | CTCGGGATCCAAGCTTGCCCAGGCGTTC | Detection primers of zur |
| zur R | CGACGGTCTGGCTGACGCACTGGCTGTG | |
| zur U | GTGCGTCAGCCAGACCGTCGAGGTGGTC | |
| zur L | CTCGCTGCAGGCGTGGTCGTGATGGTGG | |
| zur BU F | CTCGGAATTCATGTACAAGATTGCGCCCAAG | Amplification primers of zur |
| zur BU R | CTCGCTCGAGCGTTGTCCATCAGGCGTC | |
| znuBC BU F | CTCGGAATTCATGGACAACGCGCTGGTG | Amplification primers of znuBC |
| znuBC BU R | CTCGAGATCTTCGCCAGATTCTACACCG | |
| PcntR* F | CTCGGGTACCCATGCAGCGGATCGAGCAG | |
| PcntR* R | GAAGACTTCCTCGTGGTTGCTACCAGTTCGATTCCGGCCTC | Detection primers of PcntR* |
| PcntR* U | GTAGCAACCACGAGGAAGTCTTCTTTTCTGGTGCGATTTCC | |
| PcntR* L | CTCGCTGCAGCTGGGGCTTCTTGGTCAC | |
| EMSA F | TCGAGCAGCATGAACAGC | For EMSA |
| EMSA R | ACAGTGAGGACCTCCAGC |
表选项
1.1.2 培养条件: 大肠杆菌、铜绿假单胞菌PAO1、本研究中铜绿假单胞菌各菌株均37 ℃下培养,在摇床中振荡培养时,使用的转速为220 r/min,实验中使用的各培养基如下。
LB液体和固体培养基(g/L):NaCl 10,YEAST EXTRACT 5,TRYPTONE 10,在配制的液体培养基中加入1.5%琼脂粉制成固体培养基。
TSB培养基(g/L):在无菌水中溶解0.3% TSB。
M9基础培养基(mL/L):5×M9盐溶液200,1 mol/L MgSO4 2,20%葡萄糖20。
5×M9盐溶液(g/L):Na2HPO4·7H2O 64,KH2PO4 15,NaCl 2.5,NH4Cl 5,溶解于1 L去离子水中,121 ℃灭菌20 min;20%葡萄糖,115 ℃灭菌30 min。
1.1.3 主要试剂: 琼脂糖、TRYPTONE、YEAST EXTRACT、TSB培养基购自OXOID;琼脂粉购自北京索莱宝科技有限公司;DNA纯化回收试剂盒、质粒小提试剂盒购自天根生化科技有限公司;DNA聚合酶购自全式金生物技术有限公司;限制性内切酶购自TaKaRa生物公司;连接酶购自NEB;N, N, N′, N′-4(2-吡啶甲基)乙二胺(TPEN)购自百灵威科技有限公司;O-NITROPHENYL B-D-GALACTOPYRANOSIDE(ONPG)、4-(2-吡啶偶氮)-间苯二酚(PAR)购自Sigma-Aldrich西格玛奥德里奇(上海)贸易有限公司;N-2-羟乙基哌嗪- N′-2-乙磺酸(HEPES)购自上海阿拉丁生化科技股份有限公司;庆大霉素(Gentamicin,Gm)、卡那霉素(Kanamycin,Km)、氯霉素(Chloramphenicol,Cm)、四环素(Tetracyclin,Tc)、氨苄青霉素(Ampcillin,Amp)和异丙基-β-D-硫代半乳糖苷(IPTG)等购自北京索莱宝科技有限公司。其他常规试剂均使用国产分析纯。
1.2 基因敲除及互补 基因敲除和互补菌株的构建按照文献[11]报道的方法执行。(1)基因敲除:本研究用引物分别扩增了该基因的上游和下游DNA片段,通过重叠延伸PCR构建该基因缺失突变的目的片段。将获得的目的基因片段经过双酶切克隆至自杀载体pK18mobSacB,从p34s-Gm上酶切Gm抗性基因,连接到上一步构建的载体上,进一步转化进大肠杆菌S17-1构建重组菌株,并通过结合作用将重组自杀载体导入相应菌株。在双抗平板上获得的单菌落经PCR检验合格后即为一次重组菌体。再经含有相应抗性的12%蔗糖的LB平皿筛选,通过测序检验,若正确则为目的基因缺失突变株。(2)基因互补:将需要基因经PCR扩增后,酶切、连接到融合型载体pME6032上,构建互补载体。经电击转化的方法将互补载体电转入突变菌株中,经抗性筛选获得遗传互补菌株。
1.3 β-半乳糖苷酶活性的检测 实验以ONPG为底物使用米勒的方法测定转录融合报告菌株的β-半乳糖苷酶活[12]。方法如下:在离心管中依次加入Z Buffer 420 μL、待测菌液100 μL、氯仿20 μL、0.1% SDS 10 μL混匀,30 ℃条件下放置至少1 h。开始酶活检测之前30 min,在底物缓冲液中加入0.004 g/mL ONPG,充分溶解,在菌液中加入100 μL,30 ℃下开始酶活检测。反应完成后,加入250 μL的1 mol/L Na2CO3终止反应,并记录反应时间,最后分别检测反应液在420 nm和550 nm处的吸光值,依据公式计算相应转录融合报告菌株的β-半乳糖苷酶活。米勒酶活单位=1000×(OD420–1.75×OD550)/[(菌液OD600)×(体积)×(反应时间)]。
Z Buffer:100 mmol/L Na2HPO4、40 mmol/L NaH2PO4、10 mmol/L KCl、1 mmol/L MgSO4和5.4 μL/mL β-巯基乙醇。
底物缓冲液:60 mmol/L Na2HPO4、40 mmol/L NaH2PO4、2.7 μL/mL β-巯基乙醇和4 mg/mL ONPG。
本研究中所有的数据均为至少3次独立实验的结果。
1.4 蛋白的异源表达及纯化
1.4.1 pET28a-zur载体的构建: 以铜绿假单胞菌PAO1的DNA为模板,扩增zur片段,经酶切与pET28a连接构建pET28a-zur载体。并进一步转化到大肠杆菌Transetta (DE3)菌株中。
1.4.2 蛋白表达与纯化: 将培养过夜的菌株按1%的转接量,转接至新鲜培养基中培养至指数生长期,加入终浓度为1 mmol/L的IPTG,22 ℃诱导表达过夜。离心收集菌体,加入裂解液悬浮并超声波破碎;将破碎液上清过Ni-NTA (Novagen)纯化柱,接着用洗涤缓冲液洗去杂蛋白,最后用洗脱缓冲液洗脱获得纯的目的蛋白。透析后的蛋白浓度用NanoDrop 1000分光光度计(Thermo Scientific)测定,于–80 ℃保存备用。
1.5 凝胶阻滞实验 凝胶阻滞实验(electrophoretic mobility shift assay,EMSA)按照文献[13]报道的方案执行。EMSA的反应终体积为20 μL,其体系为10 mmol/L Tris-HCl (pH 7.5)、40 mmol/L KCl、10 mmol/L MgCl2、1 mmol/L DTT、1 μmol/L ZnSO4、50 μg/mL ploy(dI-dC)、5%甘油、200 ng启动子区DNA、400–500 ng蛋白质。室温下将加好体系的反应液孵育30 min,经6% Native-PAGE电泳,胶体在0.05%的GlodView I型核酸染料中染色30 min。
1.6 锌载体(zincophore)的提取
1.6.1 培养基上清液中zincophore的提取: 将培养过夜的细菌,按1%的转接量转接至TSB培养基中振荡培养至稳定期,取培养液上清,按与上清3:1的比例加入乙酸乙酯,充分混匀,静置分层,取上层有机相浓缩得到溶质,1 mL菌液的提取物使用1 μL DMSO溶解溶质。
1.6.2 胞内zincophore的提取: 将培养过夜的细菌,按1%的转接量转接至TSB培养基中振荡培养至稳定期,离心取细胞沉淀,无菌水悬浮细胞并超声破碎,加入等体积的乙酸乙酯充分混匀,静置分层,取上层有机相浓缩得到溶质,1 mL菌液的提取物使用1 μL DMSO溶解。
1.7 PAR实验 采用金属指示剂染料4-(2-吡啶偶氮)-间苯二酚(PAR)进行Zn2+结合试验[14]。在没有Zn2+的情况下,PAR的反应液颜色为浅黄色,在490–500 nm处的吸光度较低,OD值小;与Zn2+结合后形成的络合物,颜色变橙红色,在该波长下吸光度显著增加,OD值变大。为了测定铜绿假单胞菌培养物无细胞上清液对Zn2+的螯合能力,将相应菌株在加入200 μmol/L TPEN的M9培养基中37 ℃培养至OD600=0.5 (酶标仪检测)后,经0.22 μm滤膜过滤得培养物的无细胞上清液,执行PAR实验(总体积1 mL)。反应体系如下:先将1 mol/L的HEPES-KOH (pH 7.4) 40 μL、10 mmol/L的ZnCl2 10 μL和无细胞上清液940 μL (或5 μL DMSO溶解的培养物无细胞上清提取物和935 μL的M9培养基)混匀,在室温下孵育15 min,然后加入5 mmol/L的PAR乙醇溶液10 μL,再孵育5 min后,用酶标仪测定497 nm处的吸光度。以添加和不添加ZnCl2的M9+200 μmol/L TPEN培养基(或5 μL DMSO溶解的培养基提取物和935 μL的M9培养基)作为对照。OD497的值越小表示无细胞上清液的Zn2+螯合能力越强。该实验至少设3个生物学平行并且独立重复3次。
1.8 大蜡螟(Galleria mellonella)幼虫的致死实验 将培养至OD620为0.8的菌株,离心取细胞沉淀,使用0.85% NaCl洗涤细胞后稀释细胞浓度,在相同状态(5龄第一天)的大蜡螟幼虫的最后左腹足内使用微量进样器将1×105个细胞注射入体内[15],每种菌体每次注射50个大蜡螟幼虫,每隔12 h统计1次死亡率。实验至少设3个生物学平行并独立重复3次。
1.9 统计分析 实验结果以平均值加减标准偏差的形式体现,使用Student’s t-test (双尾不配对)对显著性进行分析。用GraphPad Prism version 5.00软件(GraphPad software Inc.;San Diego,CA,USA)对结果进行统计学分析并作图,P值< 0.05代表显著。*:P < 0.05;**:P < 0.01;***:P < 0.001。所有的实验都至少设3个生物学平行并且独立重复2次。
2 结果和分析 2.1 不同细菌staphylopine生物合成基因簇的比较 生物信息学分析显示铜绿假单胞菌基因组中存在与金黄色葡萄球菌staphylopine生物合成基因簇同源的cntRLMN操纵子(cnt操纵子) (同源比对使用在线软件EMBOSS Stretcher,https://www. ebi.ac.uk/Tools/psa/emboss_stretcher/) (图 1)。铜绿假单胞菌的CntL蛋白与金黄色葡萄球菌的烟草胺合成酶SaCntL (SAV2469)的氨基酸序列的一致性为29.0%,相似性为43.8%,铜绿假单胞菌的CntM蛋白则与金黄色葡萄球菌的staphylopine脱氢酶SaCntM (SAV2468)的氨基酸序列的一致性为32.8%,相似性为50.4%。相比金黄色葡萄球菌的操纵子,铜绿假单胞菌cntRLMN操纵子中多出两个独特的基因cntR和cntN,cntN基因编码一个有284个氨基酸并包含EamA结构域的细胞质膜蛋白,而cntR基因则编码一个有708个氨基酸的假定的铁载体外膜受体蛋白,但是缺少cntK基因和cntABCDEF基因簇。最近,Arnoux团队在金黄色葡萄球菌中鉴定了一种新型的多功能金属载体staphylopine,它是植物产生的金属螯合剂烟草胺的类似物,能够同时结合并介导镍、铁、钴、铜和锌的转运,在金黄色葡萄球菌致病性和适应性方面起重要作用[16]。该金属载体的生物合成和转运由SacntABCDEFKLM操纵子所介导。SacntKLM基因簇编码staphylopine的生物合成途径,SaCntK是组氨酸消旋酶,SaCntL与烟草胺合成酶同源,SaCntM是staphylopine脱氢酶,而编码staphylopine的SacntABCDEF基因簇转运途径中,staphylopine的分泌由SaCntE负责,而螯合了金属的staphylopine向胞内的转运则由SaCntA–F负责[16]。目前还发现金黄色葡萄球菌并不是唯一可以产生staphylopine的细菌,铜绿假单胞菌及其他微生物病原体基因组中也存在staphylopine生物合成的同源基因[16]。本研究中的生物信息学分析结果显示铜绿假单胞菌中的cntRLMN与金黄色葡萄球菌控制合成staphylopine介导锌离子摄取的cntKLM操纵子同源,这与文献[16]报道的结果相一致。这暗示铜绿假单胞菌中的cnt操纵子可能与金黄色葡萄球菌cntKLM操纵子的功能类似,参与铜绿假单胞菌锌离子的摄取。
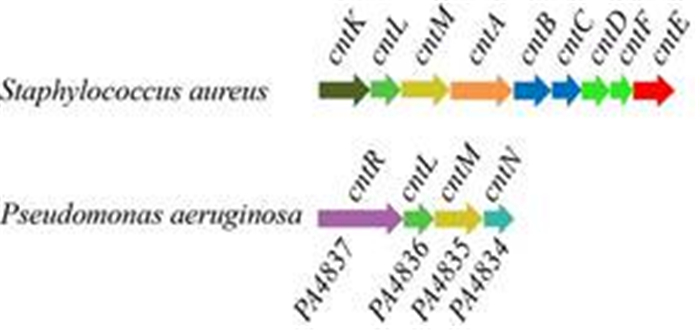 |
| 图 1 铜绿假单胞菌和金黄色葡萄球菌staphylopine生物合成基因簇的比较 Figure 1 The comparison of staphylopine biosynthetic gene clusters between Pseudomonas aeruginosa and Staphylococcus aureus. |
| 图选项 |
2.2 cnt操纵子参与铜绿假单胞菌锌离子的摄取 为了验证铜绿假单胞菌中的cnt操纵子参与锌离子的摄取这一假设,本研究在不同Zn2+浓度下比较了野生型PAO1菌株、cnt操纵子中的各个基因单独突变菌株之间的生长情况。结果相比野生型PAO1菌株,在各种不同Zn2+浓度下各菌株生长均没有显著差异。这可能是由于铜绿假单胞菌中本身其他锌离子摄取系统(如ZnuABC)的功能缺失有补偿作用而掩盖了cnt突变株在限锌培养条件下的生长缺陷表型。为了排除ZnuABC锌离子摄取系统的干扰,本研究以znuBC突变株(ΔBC)作为出发菌株构建了ΔBCL、ΔBCR、ΔBCN及其遗传互补菌株ΔBCL-cntL、ΔBCR-cntR、ΔBCN-cntN。各菌株的生长情况结果如图 2所示。
 |
| 图 2 cnt操纵子参与铜绿假单胞菌锌离子的摄取 Figure 2 The cnt operon participates in the uptake of zinc ions in Pseudomonas aeruginosa. All data are representative of at least three independent. *: P < 0.05; **: P < 0.01;***: P < 0.001. |
| 图选项 |
图 2-A和图 2-B中分别为PAO1、ΔBC、ΔBCL、ΔcntL四种菌株在Zn2+充足的培养基(M9+ 10 μmol/L ZnSO4)和Zn2+缺乏的培养基(M9+ 200 μmol/L TPEN)中的生长曲线。可以看到在锌离子充足的环境下,尽管ΔBC、ΔBCL菌株显示出微弱的生长滞后现象,但是各突变株与野生铜绿假单胞菌PAO1之间没有明显生长差异,然而在限锌环境中ΔBCL菌株的生长比其他菌株却明显减慢,说明只有znuBC和cntL同时缺失才会显著影响在限锌的环境中细菌对锌离子的摄取。由于CntL与金黄色葡萄球菌的烟草胺合成酶SaCntL同源,本研究推测CntL也通过控制合成staphylopine类似物而参与锌离子的摄取。为了验证这一推测,本研究通过PAR实验检测细菌培养物无细胞上清液的锌离子螯合能力,结果如图 2-C所示。
图 2-C中TPEN浓度为200 μmol/L,Zn2+浓度为100 μmol/L。限锌培养条件下,相比PAO1和ΔBC菌株,cntL突变株培养物无细胞上清液的锌离子螯合能力显著降低,这印证了CntL控制合成staphylopine类似物zincophore的推测。说明CntL通过介导staphylopine的类似物zincophore的合成而参与细胞对胞外锌离子的摄取,从而在功能上与ZnuBC形成互补。
图 2-D和图 2-E为各菌株在富锌和限锌的培养基中的生长曲线。可以看到在锌离子充足的环境中,培养的各菌株之间没有明显的生长差异,而在锌离子缺乏的环境中ΔBCL-V、ΔBCR-V、ΔBCN-V的生长状况明显低于PAO1-V和ΔBC-V菌株,并且各遗传互补菌株恢复到野生菌株的生长表型。
2.3 Zur蛋白负调控cnt操纵子的表达 原核生物的锌摄取受锌离子摄取调控蛋白Zur的负调控,为了研究cnt操纵子是否也受锌离子调控蛋白Zur调控,本研究构建了含有cnt操纵子的启动子PcntR′的lacZ转录融合报告菌株,通过检测β-半乳糖苷酶在不同Zn2+浓度下的活性,来反映Zur调控cnt操纵子的情况,结果如图 3所示。
 |
| 图 3 cnt操纵子启动子PcntR′的β-半乳糖苷酶活性检测 Figure 3 The Beta galactosidase activity assay of the cnt operon promoter PcntR′. All data are representative of at least three independent. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
图 3中的黑色柱体为PAO1-V、Δzur-V、Δzur-zur菌株在M9+10 μmol/L ZnSO4中培养测得β-半乳糖苷酶活性,图 3中的灰色柱体为各菌株在M9+200 μmol/L TPEN [N, N, N′, N′-4 (2-吡啶甲基)乙二胺是一种锌离子螯合剂]中培养测得的β-半乳糖苷酶活性。
PAO1-V在富锌的环境中培养时与在限锌的环境中相比β-半乳糖苷酶的酶活显著下降,说明在富锌的环境中cntR基因的表达受到抑制,在限锌的环境中cntR基因的表达受到激活,即环境中锌离子浓度的负调控于cnt操纵子的表达;而相比PAO1-V,Δzur-V菌株在富锌和限锌培养条件下的β-半乳糖苷酶酶活没有显著差异,说明Δzur-V菌株中cntR基因的表达不受环境中锌离子浓度的影响,表明PAO1-V菌株中cnt操纵子的表达对锌离子浓度的响应依赖于Zur蛋白。另外,在富锌的环境中Δzur-V与PAO1-V相比β-半乳糖苷酶酶活显著升高,说明在富锌的环境中zur突变显著激活铜绿假单胞菌cntR基因的表达,同时互补zur基因使Δzur菌株中cntR基因的表达水平得到明显回复,说明在富锌的环境中Zur蛋白阻遏cnt操纵子的表达,即Zur蛋白负调控cnt操纵子的表达。综合以上的实验结果说明Zur蛋白的负调控于cnt操纵子且以Zur蛋白依赖的形式受到锌离子的抑制。
2.4 Zur蛋白与cnt启动子的体外结合 本研究通过EMSA实验进一步判断Zur调控蛋白对cnt操纵子的调控是直接还是间接,如图 4所示:通过参考Ellison等[10]预测的PcntR′上假定的Zur蛋白结合位点(GCGTTATAGTATATCAT) (上端黄色区域),红色碱基为PcntR′的–10区。本实验的对照是使用cntR基因内部的任意一段序列替换假定的Zur蛋白结合位点(下端黄色区域),突变的启动子命名为PcntR*;之后将异源表达纯化到的Zur蛋白与cnt操纵子的启动子PcntR′、cnt操纵子的突变启动子PcntR*进行体外结合实验,结果如图 5所示。
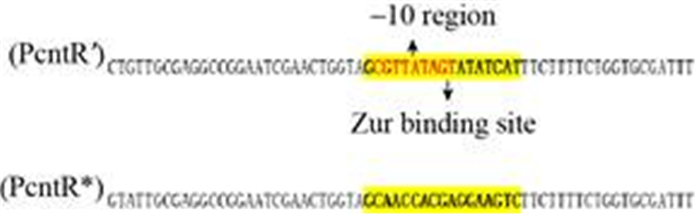 |
| 图 4 野生型和突变型的启动子碱基序列图 Figure 4 The sequence map of wild-type promoter and mutant promoter. |
| 图选项 |
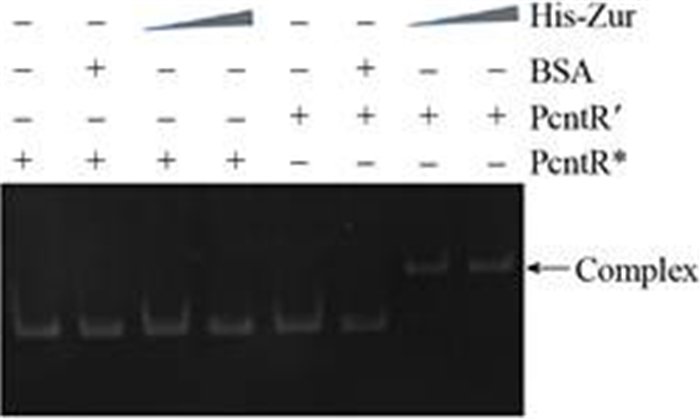 |
| 图 5 Zu和PcntR′启动子的互作 Figure 5 The interaction between Zur and PcntR′ promoter. |
| 图选项 |
图 5中以BSA (500 ng)作为蛋白质的阴性对照,PcntR*作为DNA的阴性对照,His-Zur蛋白用量分别为400 ng和500 ng。可以看到增加His-Zur蛋白量始终可以与PcntR′形成DNA-蛋白质复合体,而无论增加His-Zur蛋白量与否,His-Zur始终不能与PcntR*结合,并且对照蛋白BSA与PcntR′、PcntR*都不进行结合。这些结果说明GCGTTATAGTATATCAT是His-Zur与PcntR′启动子的结合位点,该蛋白能够直接结合PcntR′启动子,这些结果表明Zur调控蛋白对cnt操纵子的调控是直接的。
2.5 CntR是zincophore-Zn2+的外膜受体 通过前面的实验我们已经确定CntL通过介导staphylopine类似物-zincophore的合成而参与铜绿假单胞菌锌离子的摄取,同样cntR基因也参与铜绿假单胞菌中锌离子的摄取,但是我们并不清楚cntR基因参与锌离子摄取的具体功能。生物信息分析显示铜绿假单胞菌中CntR是依赖TonB的外膜受体,所以本研究假设CntR是摄取zincophore-Zn2+的外膜受体。因此,本研究构建了Δzur、ΔzurΔcntL两种突变菌株(由于突变zur基因可显著诱导cnt操纵子的表达而促进zincophore的合成,为了确保从培养物中提取获得zincophore,所以本研究以Δzur作为发酵提取zincophore的出发菌株),ΔBCRL-V、ΔBCRL-cntR两种遗传互补菌株。分别提取Δzur、ΔzurΔcntL上清物中的活性物质(staphylopine类似物- zincophore),并对上清中活性物质的锌离子螯合能力进行检测,将获得的上清提取物分别加到ΔBCRL-V、ΔBCRL-cntR遗传互补菌株中,其生长结果如图 6所示。
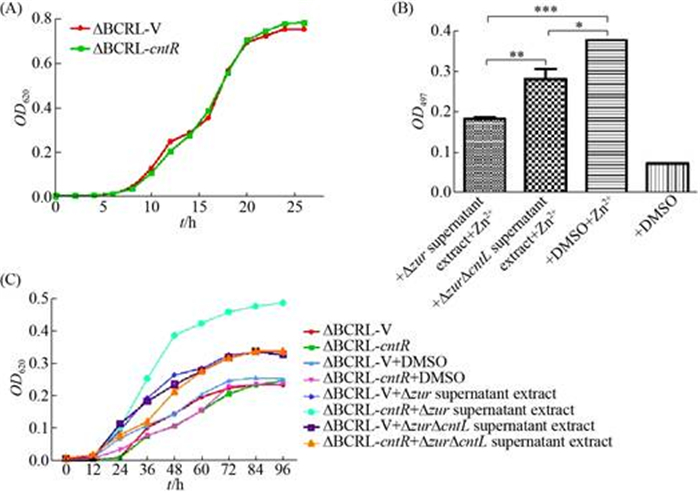 |
| 图 6 CntR是zincophore-Zn2+的外膜受体 Figure 6 CntR is the outer membrane receptor for zincophore-Zn2+. All data are representative of at least three independent. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
| 图选项 |
图 6-A为菌株在富锌条件下的生长曲线,实验结果显示在富锌环境中ΔBCRL-cntR、ΔBCRL-V菌株的生长无显著差异。
图 6-B通过PAR实验检测细菌培养物无细胞上清液提取物的锌离子螯合能力,Zn2+浓度为100 μmol/L,实验结果显示Δzur培养物无细胞上清提取物的OD497明显小于ΔzurΔcntL培养物无细胞上清提取物的OD497,说明Δzur培养物无细胞上清提取物的锌离子螯合能力显著高于ΔzurΔcntL培养物无细胞上清提取物的锌离子螯合能力,暗示Δzur培养物无细胞上清提取物中存在CntL介导合成的zincophore。
图 6-C为菌株限锌条件下的生长曲线,可以看到Δzur的上清提取物可以显著恢复ΔBCRL-cntR遗传互补菌株的生长,但是ΔBCRL-V菌株的生长并没有恢复,表明这种生长促进作用依赖于CntR;ΔzurΔcntL的上清提取物可以部分恢复ΔBCRL-cntR、ΔBCRL-V菌株的生长,但是它们之间的生长无显著差异且这种生长促进作用明显低于Δzur上清提取物对ΔBCRL-cntR菌株的生长促进作用,表明这种生长促进作用也依赖于CntL介导合成的zincophore。
综合上述结果表明CntR作为铜绿假单胞菌摄取zincophore-Zn2+的外膜受体,在限锌的环境中介导胞外zincophore-Zn2+向胞内转运。
2.6 CntN是zincophore的转运蛋白 与cntL类似,本研究也发现cntN参与铜绿假单胞菌中的锌离子摄取,但并不清楚cntN基因在该过程中的具体功能。相比金黄色葡萄球菌的cnt操纵子,铜绿假单胞菌的cnt操纵子中缺少cntABCDEF基因簇,而多出2个独特的基因cntR和cntN,本研究已确定CntR作为铜绿假单胞菌zincophore-Zn2+摄取的外膜受体,其功能与金黄色葡萄球菌SaCntA-F介导螯合了金属的staphylopine向胞内转运的功能类似,这暗示作为细胞质膜蛋白的CntN可能与SaCntE相似,都参与zincophore的分泌。为了验证这一假设,本研究分别提取了Δzur、ΔzurΔcntN培养液上清中的zincophore以及Δzur、ΔzurΔcntN胞内的zincophore,对各种提取物中zincophore的含量进行分析,并检测各种提取物对ΔBCL菌株生长的影响,如图 7所示。
 |
| 图 7 CntN是zincophore的转运蛋白 Figure 7 CntN is a transporter of zincophore. All data are representative of at least three independent. *: P < 0.05;**: P < 0.01; ***: P < 0.001. |
| 图选项 |
图 7-A通过PAR实验检测细菌培养物无细胞上清提取物的锌离子螯合能力,Zn2+浓度为100 μmol/L,DMSO作为提取物的溶剂,提取物的加入量为5 μL/mL。Δzur培养物无细胞上清提取物的OD497明显小于ΔzurΔcntN培养物无细胞上清提取物的OD497,说明Δzur培养物无细胞上清提取物的锌离子螯合能力显著高于ΔzurΔcntN培养物无细胞上清提取物的锌离子螯合能力,说明cntN的缺失导致胞外的zincophore显著减少;而ΔzurΔcntN胞内提取物的OD497明显小于Δzur胞内提取物的OD497,表明ΔzurΔcntN胞内提取物的锌离子螯合能力显著高于Δzur胞内提取物的锌离子螯合能力,说明cntN的缺失导致大量的zincophore在胞内积累。
图 7-B为菌株在M9+200 μmol/L TPEN条件下的生长曲线。用5 mL的培养基对菌体进行培养分别加入DMSO(培养基提取物)、Δzur上清提取物、ΔzurΔcntN上清提取物、Δzur胞内提取物、ΔzurΔcntN胞内提取物。在限锌的培养环境培养ΔBCL时,加入ΔzurΔcntN胞内提取物时菌株生长显著优于加入Δzur胞内提取物,但加入ΔzurΔcntN上清提取物时菌株的生长明显弱于加入Δzur上清提取物。这些结果与提取物中zincophore含量分析的结果相一致,均暗示CntN蛋白介导zincophore的分泌。
综上所述,在胞内合成的zincophore可通过细胞质膜蛋白CntN被转运分泌到胞外参与锌离子摄取。
2.7 cnt操纵子在铜绿假单胞菌毒力发挥中的作用 由于cnt操纵子与铜绿假单胞菌锌离子的摄取有关,因此我们很容易想到突变cnt操纵子可能对铜绿假单胞菌的毒力产生影响。为了验证这一想法,本研究仍以铜绿假单胞菌中负责zincophore合成的cntL基因的突变株为代表,利用大蜡螟幼虫作为模型,用培养的PAO1-V、ΔcntL-V、ΔBC-V、ΔBCL-V、ΔBCL-cntL注射到大蜡螟幼虫体内,12 h统计一次死亡率,结果如图 8所示。
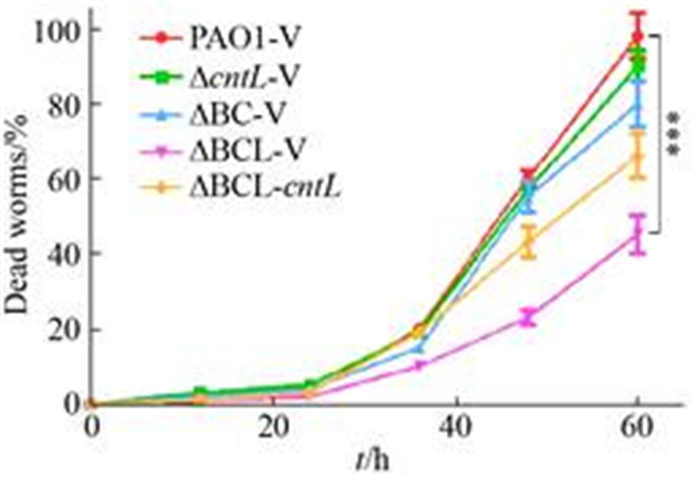 |
| 图 8 铜绿假单胞菌对大蜡螟幼虫的毒力作用 Figure 8 The virulence of Pseudomonas aeruginosa to the larva of wax moth. All data are representative of at least three independent, *: P < 0.05; **: P < 0.01;***: P < 0.001. |
| 图选项 |
注射ΔcntL-V、ΔBC-V后大蜡螟幼虫的死亡率相较于对照菌株PAO1-V并没有显著差异,说明cntL和znuBC单独突变对铜绿假单胞菌的毒力影响不显著,而注射ΔBCL-V菌株大蜡螟幼虫死亡率明显降低。同时,实验还发现注射了各突变菌株的大蜡螟幼虫的平均死亡时间与野生菌相比缓慢了12 h左右。但是遗传互补菌株ΔBCL-cntL并没有完全恢复突变株对大蜡螟幼虫的毒力,这种原因可能是由于本研究使用的是携带cntL基因的质粒在表达互补时造成的不同基因剂量导致的。这些结果表明铜绿假单胞菌在毒力发挥时cnt操纵子也起到重要作用。
3 结论和讨论 本研究通过β-半乳糖苷酶活性的测定和EMSA实验表明Zur蛋白能够直接结合PcntR′启动子,结合位点为GCGTTATAGTATATCAT。而且Zur蛋白负调控cnt操纵子的表达并以Zur蛋白依赖的形式受到锌离子的抑制。分别在富锌和限锌环境下的生长曲线分析表明,ZnuBC和CntL、CntR、CntN都对铜绿假单胞菌摄取锌离子起重要作用,由于ZnuBC是已报道的锌离子摄取系统,因此CntRLMN是一种在功能上与ZnuBC互补的新的锌离子摄取系统。通过对外源添加细胞提取物的生长曲线分析以及PAR实验表明在cnt操纵子中CntL通过控制合成zincophore参与锌离子的摄取;CntN作为细胞质膜转运蛋白,介导zincophore的分泌。CntR是外膜受体,介导胞外zincophore-Zn2+的摄取。另外通过将cnt操纵子的突变菌株和互补菌株对大蜡螟幼虫侵染后的存活率统计表明cnt操纵子突变抑制了铜绿假单胞菌的毒力。
结合Lhospice等[17]和Mastropasqua等[18]对铜绿假单胞菌cnt操纵子各基因功能的报道,本研究提出了铜绿假单胞菌cnt操纵子的功能模型图(图 9):锌离子匮乏环境中,Zur蛋白调控CntL合成zincophore,转运蛋白CntN将zincophore释放到胞质空间,再经细胞外膜某一未知通道分泌到胞外,在胞外环境中螯合游离锌离子形成zincophore-Zn2+复合物,此时zincophore-Zn2+进一步通过外膜受体CntR和一个未知的内膜转运蛋白进入细胞,完成锌离子的转运。当锌离子在胞内大量积累时,锌离子会与Zur蛋白结合从而抑制cnt操纵子的表达。
 |
| 图 9 铜绿假单胞菌cntRLMN操纵子的功能模型 Figure 9 The functional model diagram of cntRLMN operon of Pseudomonas aeruginosa. |
| 图选项 |
本研究中只有在znuBC缺失的基础上突变cntL基因,在限锌环境下才显示出明显参与锌离子的摄取作用,但是ΔBCL突变菌株在限锌环境下仍然不能完全抑制生长,这些都说明了还有其他的锌离子摄取系统在铜绿假单胞菌中有待进一步发现。最近对PAO1进行的转录组分析发现的额外假定金属转运系统也有助于细菌体内锌的平衡[9],以及Lewinson等发现的P型泵(HmtA),可以调节铜和锌的摄取[19],都证明了以上所提的设想。此外本研究提出的模型中缺乏的负责转运锌载体的外膜输出蛋白和内膜输入蛋白,这些蛋白可能由基因组其他部位基因负责编码,这些基因也有待于进一步的研究发现。
Pederick等[9]在限锌培养条件下对铜绿假单胞菌znuA突变株进行转录组分析,结果显示除znuABC和hmtA等两套已知的锌离子摄取系统的表达显著上调外,还有多个未知功能操纵子的表达也明显上调,其中包括cnt操纵子。Hermansen等[20]分离了已经在丹麦许多囊性纤维化患者身上传播了40多年的铜绿假单胞菌DK2,并对其cnt操纵子的启动子进行了详细的研究。结果表明在临床分离的DK2野生株及其大部分突变株的cnt操纵子的启动子均表现出在限锌条件下表达活性升高,而在富锌培养基或者外源补加锌离子后表达活性降低的现象。本文研究的PAO1菌种中cnt操纵子的启动子也出现相同的表达模式。
已有研究显示,铜绿假单胞菌的cnt操纵子在一些临床表型如囊性纤维化症病人痰液[21]、外伤病人伤口[22]及导管插入病人的导管表面的黏液[23]中也出现了显著的表达,这进一步支持了本研究的毒力实验结果。另外,当铜绿假单胞菌感染囊性纤维化患者肺部时,会在气管粘液中分泌一种未知的铁载体,该铁载体由cntRLMN操纵子介导合成[23],暗示这种铁载体可能就是CntRLMN所介导合成的zincophore,显示CntRLMN可能同时具有介导铁离子摄取的功能。
References
| [1] | Capdevila DA, Wang JF, Giedroc DP. Bacterial strategies to maintain Zinc metallostasis at the host-pathogen interface. Journal of Biological Chemistry, 2016, 291(40): 20858-20868. DOI:10.1074/jbc.R116.742023 |
| [2] | Gonzalez MR, Ducret V, Leoni S, Perron K. Pseudomonas aeruginosa zinc homeostasis:key issues for an opportunistic pathogen. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 2019, 1862(7): 722-733. DOI:10.1016/j.bbagrm.2018.01.018 |
| [3] | Battistoni A, Ammendola S, Chiancone E, Ilari A. A novel antimicrobial approach based on the inhibition of zinc uptake in Salmonella enterica. Future Medicinal Chemistry, 2017, 9(9): 899-910. DOI:10.4155/fmc-2017-0042 |
| [4] | Streeter K, Katouli M. Pseudomonas aeruginosa:a review of their pathogenesis and prevalence in clinical settings and the environment. Infection, Epidemiology and Medicine, 2016, 2(1): 25-32. |
| [5] | Ding CY, Yang ZR, Wang J, Liu XR, Cao Y, Pan YT, Han LZ, Zhan SY. Prevalence of Pseudomonas aeruginosa and antimicrobial-resistant Pseudomonas aeruginosa in patients with pneumonia in mainland China:a systematic review and meta-analysis. International Journal of Infectious Diseases, 2016, 49: 119-128. DOI:10.1016/j.ijid.2016.06.014 |
| [6] | Palmer LD, Skaar EP. Transition metals and virulence in bacteria. Annual Review of Genetics, 2016, 50: 67-91. DOI:10.1146/annurev-genet-120215-035146 |
| [7] | Schalk IJ, Cunrath O. An overview of the biological metal uptake pathways in Pseudomonas aeruginosa. Environmental Microbiology, 2016, 18(10): 3227-3246. DOI:10.1111/1462-2920.13525 |
| [8] | Cerasi M, Ammendola S, Battistoni A. Competition for zinc binding in the host-pathogen interaction. Frontiers in Cellular and Infection Microbiology, 2013, 3: 108. |
| [9] | Pederick VG, Eijkelkamp BA, Begg SL, Ween MP, McAllister LJ, Paton JC, McDevitt CA. ZnuA and zinc homeostasis in Pseudomonas aeruginosa. Scientific Reports, 2015, 5: 13139. DOI:10.1038/srep13139 |
| [10] | Ellison ML, Matthew Farrow Ⅲ J, Parrish W, Danell AS, Pesci EC. The transcriptional regulator Np20 is the Zinc uptake regulator in Pseudomonas aeruginosa. PLoS One, 2013, 8(9): e75389. DOI:10.1371/journal.pone.0075389 |
| [11] | Lin JS, Cheng JL, Chen KQ, Guo CH, Zhang WP, Yang X, Ding W, Ma L, Wang Y, Shen XH. The icmF3 locus is involved in multiple adaptation- and virulence-related characteristics in Pseudomonas aeruginosa PAO1. Frontiers in Cellular and Infection Microbiology, 2015, 5: 70. |
| [12] | Miller JH. A short course in bacterial genetics:a laboratory manual and handbook for Escherichia coli and related bacteria. Cold Spring Harbor, NY, USA:Laboratory Press, 1992. |
| [13] | Wilderman PJ, Sowa NA, Fitzgerald DJ, Fitzgerald PC, Gottesman S, Ochsner UA, Vasil ML. Identification of tandem duplicate regulatory small RNAs in Pseudomonas aeruginosa involved in iron homeostasis. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(26): 9792-9797. DOI:10.1073/pnas.0403423101 |
| [14] | Hunt JB, Neece SH, Ginsburg A. The use of 4-(2-pyridylazo)resorcinol in studies of zinc release from Escherichia coli aspartate transcarbamoylase. Analytical Biochemistry, 1985, 146(1): 150-157. DOI:10.1016/0003-2697(85)90409-9 |
| [15] | Jander G, Rahme LG, Ausubel FM. Positive correlation between virulence of Pseudomonas aeruginosa mutants in mice and insects. Journal of Bacteriology, 2000, 182(13): 3843-3845. DOI:10.1128/JB.182.13.3843-3845.2000 |
| [16] | Ghssein G, Brutesco C, Ouerdane L, Fojcik C, Izaute A, Wang SL, Hajjar C, Lobinski R, Lemaire D, Richaud P, Voulhoux R, Espaillat A, Cava F, Pignol D, Borezée-Durant E, Arnoux P. Biosynthesis of a broad-spectrum nicotianamine-like metallophore in Staphylococcus aureus. Science, 2016, 352(6289): 1105-1109. DOI:10.1126/science.aaf1018 |
| [17] | Lhospice S, Gomez NO, Ouerdane L, Brutesco C, Ghssein G, Hajjar C, Liratni A, Wang SL, Richaud P, Bleves S, Ball G, Borezée-Durant E, Lobinski R, Pignol D, Arnoux P, Voulhoux R. Pseudomonas aeruginosa zinc uptake in chelating environment is primarily mediated by the metallophore pseudopaline. Scientific Reports, 2017, 7: 17132. DOI:10.1038/s41598-017-16765-9 |
| [18] | Mastropasqua MC, D'Orazio M, Cerasi M, Pacello F, Gismondi A, Canini A, Canuti L, Consalvo A, Ciavardelli D, Chirullo B, Pasquali P, Battistoni A. Growth of Pseudomonas aeruginosa in zinc poor environments is promoted by a nicotianamine-related metallophore. Molecular Microbiology, 2017, 106(4): 543-561. DOI:10.1111/mmi.13834 |
| [19] | Lewinson O, Lee AT, Rees DC. A P-type ATPase importer that discriminates between essential and toxic transition metals. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(12): 4677-4682. DOI:10.1073/pnas.0900666106 |
| [20] | Hermansen GMM, Hansen ML, Khademi SMH, Jelsbak L. Intergenic evolution during host adaptation increases expression of the metallophore pseudopaline in Pseudomonas aeruginosa. Microbiology, 2018, 164(8): 1038-1047. DOI:10.1099/mic.0.000687 |
| [21] | Son MS, Matthews Jr WJ, Kang Y, Nguyen DT, Hoang TT. In vivo evidence of Pseudomonas aeruginosa nutrient acquisition and pathogenesis in the lungs of cystic fibrosis patients. Infection and Immunity, 2007, 75(11): 5313-5324. DOI:10.1128/IAI.01807-06 |
| [22] | Bielecki P, Komor U, Bielecka A, Müsken M, Puchalka J, Pletz MW, Ballmann M, Martins dos Santos VAP, Weiss S, H ussler S. Ex vivo transcriptional profiling reveals a common set of genes important for the adaptation of Pseudomonas aeruginosa to chronically infected host sites. Environmental Microbiology, 2013, 15(2): 570-587. DOI:10.1111/1462-2920.12024 |
| [23] | Gi M, Lee KM, Kim SC, Yoon JH, Yoon SS, Choi JY. A novel siderophore system is essential for the growth of Pseudomonas aeruginosa in airway mucus. Scientific Reports, 2015, 5: 14644. DOI:10.1038/srep14644 |
