徐荆1, 刘自勇2, 朱海峰3, 高亮亮2, 张培玉1

 , 李福利2
, 李福利2

1. 青岛大学环境科学与工程学院, 山东 青岛 266071;
2. 中国科学院青岛生物能源与过程研究所, 中国科学院生物燃料重点实验室, 山东 青岛 266101;
3. 大连工业大学生物工程学院, 辽宁 大连 116034
收稿日期:2019-06-06;修回日期:2019-07-18;网络出版日期:2019-07-24
基金项目:国家自然科学基金(31800026);中国科学院生物燃料重点实验室项目(CASKLB201804)
*通信作者:张培玉, Tel/Fax:+86-532-83780155, E-mail:envbio@163.com;
李福利, Tel/Fax:+86-532-80662655, E-mail:lifl@qibebt.ac.cn.
摘要:[目的] 探究丙酮丁醇梭菌半胱氨酸合成代谢途径上铁氧还蛋白和胱硫醚-γ-裂解酶基因的功能。[方法] 使用ClosTron系统对半胱氨酸合成途径上的铁氧还蛋白基因(fer)和胱硫醚-γ-裂解酶基因(mccB)进行失活,得到突变株;在不同硫源的培养基中进行分批发酵,分析突变株的生长特点;通过pH控制,使用限磷的连续发酵方法将丙酮丁醇梭菌维持在产酸期和产溶剂期,分析野生型菌株和突变株在连续发酵中的生长情况。[结果] 成功构建Δfer和ΔmccB突变株。在分批发酵中,敲除fer基因的突变株无法利用硫酸盐作为硫源,但添加亚硫酸盐或半胱氨酸可以使其恢复生长;在以半胱氨酸为唯一硫源进行分批发酵时,其终浓度1 mmol/L时不会影响野生型与Δfer突变株的生长,但高于1 mmol/L时生长均会受到抑制。在连续发酵中,Δfer突变株不能在产溶剂阶段生长,添加过量的半胱氨酸也不能恢复生长;敲除mccB基因的突变株仍能在添加甲硫氨酸的培养基中生长,但最大OD仅为野生型的57%;相较于野生型,ΔmccB突变株在产酸期和产溶剂期的生长均受到抑制。[结论] fer基因为半胱氨酸合成途径中硫酸盐还原为亚硫酸盐的关键基因,其控制合成的半胱氨酸不能完全由外源的半胱氨酸替代,敲除后对生长的抑制主要表现在连续发酵中的产溶剂阶段。mccB基因参与调控甲硫氨酸转化为半胱氨酸的过程,其敲除会影响甲硫氨酸到半胱氨酸的转化,但不会阻断该生物反应过程。
关键词:硫元素代谢丙酮丁醇梭菌磷酸限制连续发酵ClosTron系统
Role of ferredoxin and cystathionine γ-lyase in cysteine biosynthesis of Clostridium acetobutylicum
Jing Xu1, Ziyong Liu2, Haifeng Zhu3, Liangliang Gao2, Peiyu Zhang1

 , Fuli Li2
, Fuli Li2

1. College of Environmental Science and Engineering, Qingdao University, Qingdao 266071, Shandong Province, China;
2. Key Laboratory of Biofuels, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong Province, China;
3. College of Biotechnology, Dalian Polytechnic University, Dalian 116034, Liaoning Province, China
Received: 6 June 2019; Revised: 18 July 2019; Published online: 24 July 2019
*Corresponding author: Peiyu Zhang, Tel/Fax: +86-532-83780155, E-mail:envbio@163.com;
Fuli Li, Tel/Fax: +86-532-80662655, E-mail:lifl@qibebt.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31800026) and by the Project of Key Laboratory of Biofuel, Chinese Academy of Sciences (CASKLB201804)
Abstract: [Objective] This study aims to investigate the roles of ferredoxin and cystathionine γ-lyase genes located in cysteine metabolic pathway of Clostridium acetobutylicum. [Methods] ClosTron technology is used to inactivate target genes to obtain mutants. The mutants, cultured in the phosphate-limited medium, are maintained at acidogenesis and solventogenesis phase at controlled pH under continuous fermentation condition. The OD and glucose uptake of wild type and mutants are determined. [Results] The Δfer and ΔmccB mutants are obtained by using ClosTron system. The Δfer mutant cannot use sulfate as the sole sulfur source, but it will recover growth by adding sulfite or cysteine in batch fermentation. Moreover, cysteine is harmful to the growth of C. acetobutylicum and the Δfer mutant as the sole sulfur source, and it mainly influences the growth in solventogenic phase. The ΔmccB mutant also grows poorly during acidogenic and solventogenic phases with methionine or cysteine as the sole sulfur source. [Conclusion] Cysteine is a key sulfur-containing compound in the metabolic pathway of C. acetobutylicum and its metabolism is tightly controlled. Ferredoxin participates in its biosynthesis through reduction reactions of sulfate to sulfite; while the cystathionine γ-lyase participates in another cysteine biosynthesis pathway from methionine to cysteine, which is not essential.
Keywords: sulfur metabolismClostridium acetobutylicumphosphate-limited continuous fermentationClosTron system
硫元素是自然界中一种重要的化学元素,也是所有生命体新陈代谢所必需的化学元素,作为一种结构组分,在生物合成蛋白质及辅酶因子等特定生命活动中起着关键作用[1-3]。在微生物的代谢过程中,硫元素可以从无机源,如硫酸盐和硫代硫酸盐中获取;也可以从有机源,如硫酸酯、氨基磺酸盐中获取。外源的硫一般首先转化为半胱氨酸,随后,细胞代谢所需含硫化合物主要以半胱氨酸代谢的方式合成并参与细胞内重要代谢过程。在微生物模式菌株枯草芽孢杆菌和大肠杆菌中,合成半胱氨酸主要有两个途径:第一个是由外源的硫酸盐还原为亚硫酸盐,最终合成半胱氨酸;第二个是逆硫化通路,在硫缺乏时,甲硫氨酸可以转化为半胱氨酸;另外,外源的半胱氨酸也可以直接作为硫元素被利用[4-5]。
丙酮丁醇梭菌(Clostridium acetobutylicum)是革兰氏阳性厌氧菌。作为产丁醇模式微生物,其发酵过程可分两个阶段——产酸期和产溶剂期[6-9]。通过功能基因组分析,在丙酮丁醇梭菌中也存在前面所述的半胱氨酸合成途径(图 1)[10],但硫元素代谢对产酸期和产溶剂期的影响尚不清楚。通过产酸期和产溶剂期的产物分析和能量代谢化学计算得知,产酸期和产溶剂期的碳源平衡和能量代谢平衡完全不同,而含硫化合物在革兰氏阳性细菌的能量代谢中发挥重要作用[2, 5, 11-12]。探究硫元素代谢相关基因对了解丙酮丁醇梭菌硫代谢机制有十分重要的作用。
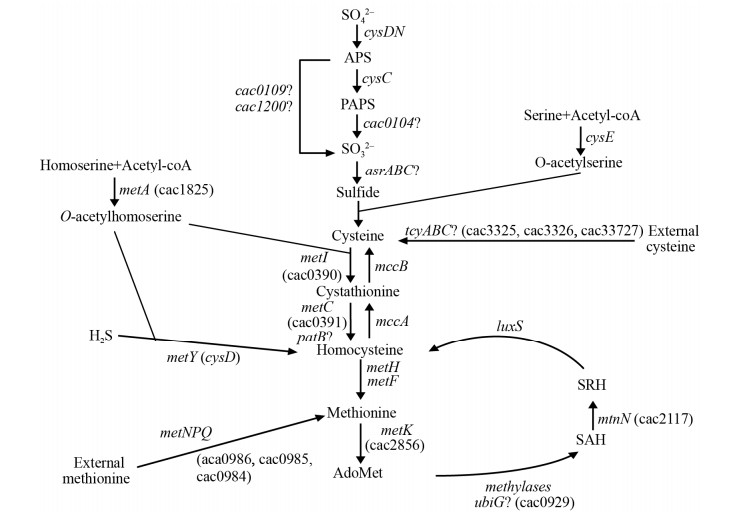 |
| 图 1 丙酮丁醇梭菌中的硫代谢[10] Figure 1 Sulfur metabolism in C. acetobutylicum[10]. A question mark indicates the genes probably involved in this pathway. AdoMet: S-adenosyl-methionine; cysE: Serine O-acetyltransferase; cysK: OAS-thiol-lyase; metK: methionine adenosyltransferase; mtnN: adenosylhomocysteine nucleosidase; luxS: S-ribosylhomocysteine lyase; mccA: cystathionine b-synthase; mccB: cystathionine g-lyase; metA: homoserine acetyl-transferase; metI: cystathionine g-synthase; metC and patB: cystathionine b-lyase; meth: methionine synthase; cysDN: ATP sulfurylase; cysC: APS kinase; asrABC: anaerobic sulfite reductase. The cac numbers for C. acetobutylicum genes correspond to those of AcetoList (http://bioinfo.hku.hk/GenoList/index.pl?database=acetolist). |
| 图选项 |
本研究从硫代谢的重要中间体半胱氨酸的合成途径出发,通过对合成途径上相关基因的敲除解析了硫元素进入丙酮丁醇梭菌代谢途径的路径;通过连续发酵的方法,研究了野生型与突变株在产酸期和产溶剂期的生长状况,揭示了铁氧还蛋白基因(fer)和胱硫醚-γ-裂解酶基因(mccB)在丙酮丁醇梭菌产溶剂发酵过程中起到重要作用,为丙酮丁醇梭菌的硫代谢研究提供了实验基础。
1 材料和方法 1.1 主要菌株、质粒 主要菌株和质粒见表 1。
表 1. 菌株与质粒 Table 1. Strains and plasmids
| Strains/plasmids | Relevant characteristics | Source |
| Clostridium acetobutylicum ATCC 824 | Wild type strain | ATCC |
| Escherichia coli TOP10 | F-, mcrA, Δ(mrr-hsdRMS-mcrBC), φ80lacZΔM15, ΔlacX74, recA1, araD139, Δ(ara-leu)7697, galU, galK, rpsL, (Str R), endA1, nupG | Transgen GmbH, Beijing |
| C. acetobutylicum fer::int (276) | Group Ⅱ intron inserted at 276./277. bp of fer (CAC0105), ErmR | This study |
| C. acetobutylicum mccB::int (414) | Group Ⅱ intron inserted at 414./415. bp of mccB (CAC0930), ErmR | This study |
| pMTL007 | Clostridial expression vector for expression of ClosTron containing Erm RAM, CmR, IPTG-inducible fac promoter | [8, 13-14] |
| pMTL007C-E2 | Clostridial expression vector for expression of ClosTron containing Erm RAM, CmR | [8, 13-14] |
| pAN2 | Plasmid harboring φ3T I methyltransferase gene of B. subtilis phage φ3tI to methylate shuttle plasmids before their introduction into C. acetobutylicum, TetR | [8, 13-14] |
| pMTL007C-E2-fer | ClosTron plasmid retargeted to C. acetobutylicum fer (CAC0105) gene, CmR | This study |
| pMTL007C-E2-mccB | ClosTron plasmid retargeted to C. acetobutylicum mccB (CAC0930) gene, CmR | This study |
表选项
1.2 主要试剂 Taq DNA聚合酶、Pfu DNA聚合酶、Kapa DNA聚合酶、T4连接酶、DNA分子量标准、质粒提取试剂盒、细菌基因组DNA提取试剂盒和琼脂糖凝胶回收试剂盒均购于北京全式金生物技术有限公司。抗生素、培养基相关等化学试剂均为国产或进口分析纯。
1.3 培养基 LB培养基(g/L):酵母提取物5.0,胰蛋白胨10.0,NaCl 10.0。固体培养基额外加琼脂糖15.0 g/L。
梭菌生长培养基Clostridial Growth Medium (CGM)[15](g/L):葡萄糖50.0,K2HPO4 0.75,KH2PO4 0.75,(NH4)2SO4 2.0,MgSO4·7H2O 0.71,MnSO4·H2O 0.01,FeSO4·7H2O 0.01,NaCl 1.0,天冬酰胺2.0,酵母提取物5.0,固体培养基额外加琼脂15.0 g/L。葡萄糖、FeSO4·7H2O和天冬酰胺单独溶解并且使用0.45 μm的滤器过滤灭菌到灭菌后培养基中,同时通氮气保证厌氧环境。
基本培养基Minimal Medium (MM)(g/L)[16]:葡萄糖50.0,CaCO3 1.0,K2HPO4·3H2O 1.0,KH2PO4 1.0,(NH4)2SO4 2.0,MgSO4·7H2O 0.1,MnSO4·H2O 0.015,FeSO4·7H2O 0.015,NaCl 0.01,Na2MoO4·2H2O 0.01,CaCl2·2H2O 0.01,生物素0.1 mg/L,Thiamin- HCl 2 mg/L,ρ-氨基苯甲酸2 mg/L。葡萄糖、FeSO4·7H2O和3种维生素单独溶解并且使用0.45 μm的滤器过滤灭菌到灭菌后的培养基中,同时通氮气保证厌氧环境。
氯元素基本培养基Chloride Minimal Medium (cMM)(g/L):葡萄糖50.0,CaCO3 1.0,K2HPO4·3H2O 1.0,KH2PO4 1.0,NH4Cl 0.8,MgCl2·6H2O 0.1,MnCl2·H2O 0.015,FeCl2·4H2O 0.015,NaCl 0.01,Na2MoO4·2H2O 0.01,CaCl2·2H2O 0.01,生物素0.1 mg/L,Thiamin-HCl 2 mg/L,ρ-氨基苯甲酸2 mg/L。葡萄糖、FeCl2·4H2O和3种维生素单独溶解并且使用0.45 μm的滤器过滤灭菌到灭菌后的培养基中,同时通氮气保证厌氧环境。
磷元素限制培养基Phosphate-limited Medium (PLMM,磷酸盐浓度为0.5 mmol/L)(g/L)[16-17]:葡萄糖40.0,(NH4)2SO4 2.0,KH2PO4 0.07,MgSO4·7H2O 0.1,NaCl 0.01,Na2MoO4·2H2O 0.01,CaCl2·2H2O 0.01,MnSO4·H2O 0.015,FeSO4·7H2O 0.015,生物素0.1 mg/L,Thiamin-HCl 2 mg/L,ρ-氨基苯甲酸2 mg/L。葡萄糖、FeSO4·7H2O和3种维生素单独溶解在去离子水中并且使用稀硫酸调节pH为2.0,之后使用真空抽滤装置过滤除菌后加入到灭菌后的盐溶液中,同时通氮气保证厌氧环境。
1.4 菌株的构建 丙酮丁醇梭菌相关功能基因的DNA序列从NCBI查找获得。选定铁氧还蛋白基因(ferredoxin, fer, gene No. CAC0105)和胱硫醚-γ-裂解酶(cystathionine γ-lyase, mccB, gene No. CAC0930)作为敲除的目的基因。前者位于基因组的一个大的操纵子(CAC0102-0110)中,根据基因功能预测该操纵子作用于无机硫元素合成半胱氨酸的代谢途径上;后者位于基因组的另一个操纵子(CAC0929-0931)中,根据基因功能预测该操纵子作用于甲硫氨酸合成半胱氨酸的合成途径上[10]。突变株所涉及引物按照网站(www.clostron.com)的指引设计,由青岛擎科梓熙生物技术有限公司合成,引物详情见表 2。
表 2. 本研究使用的引物 Table 2. Primers used in this study
| Primer | Sequence (5′→3′) | Source |
| EBS universal | CGAAATTAGAAACTTGCGTTCAGTAAAC | [14] |
| fer ClosTron mutant primers | fer-IBS: AAAAAAGCTTATAATTATCCTTAGGCAACGAAAAGGTGCGCCCAGATAGGGTG fer-EBS1d: CAGATTGTACAAATGTGGTGATAACAGATAAGTCGAAAAGATTAACTTACCTTTCTTTGT fer-EBS2: TGAACGCAAGTTTCTAATTTCGATTTTGCCTCGATAGAGGAAAGTGTC | This study |
| mccB ClosTron mutant primers | mccB-IBS: AAAAAAGCTTATAATTATCCTTAGTAAACGCTATAGTGCGCCCAGATAGGGTG mccB-EBS1d: CAGATTGTACAAATGTGGTGATAACAGATAAGTCGCTATATATAACTTACCTTTCTTTGT mccB-EBS2: TGAACGCAAGTTTCTAATTTCGATTTTTACTCGATAGAGGAAAGTGTCT | This study |
| spofdx-seq-F | GATGTAGATAGGATAATAGAATCCATAGAAAATATAGG | This study |
| fer gene check primers | CAC0105F: ATGGGTGTTGCAACTATGGTAAC CAC0105R: GGGGATCTTGAAACATAGAGCAC | This study |
| mccB gene check primers | CAC0930F: ACGTGATATAAGAATCAAACTTCC CAC0930R: CTTGGAACTGCTGACATACTATG | This study |
| Intron Ⅱ probe primers | Intron Ⅱ-F: CGCGACTCATAGAATTATTTCC Intron Ⅱ-R: ATACTCAGGCCTCAATTAACC | This study |
表选项
利用ClosTron系统对目标基因进行失活,首先构建穿梭重组质粒pMTL007C-E2-fer、pMTL007C-E2-mccB,构建好的重组质粒分别与pAN2一起转化进入E. coli TOP10感受态细胞进行甲基化。甲基化的质粒通过电转进入C. acetobutylicum感受态细胞,并且在含有15 μg/mL甲砜霉素的CGM平板上进行筛选,之后转接到含有5 μg/mL红霉素的CGM平板中进行筛选,得到的转化子转接到液体培养基中过夜培养,随后提取基因组DNA。利用筛选引物,以基因组DNA为模板,进行PCR筛选。阳性克隆重新在不含抗生素的CGM琼脂平板上涂布,对得到的单克隆再进行验证,突变株保存在-80 ℃冰箱。为验证内含子在插入到目的基因中的过程中是否“脱靶”,利用Southern blotting的方法对突变株基因组进行分析,方法参照文献[18]进行。
1.5 丙酮丁醇梭菌发酵
1.5.1 丙酮丁醇梭菌分批发酵: C. acetobutylicum及其突变株的分批发酵在250 mL的厌氧瓶中进行,温度为37 ℃,接种量为10%。基本培养基(MM)中组成成分清晰,可以用来检测野生型和突变株在相同培养条件下的生长差异。在以甲硫氨酸为硫元素的分批发酵实验中,将基本培养基中的硫酸盐用氯化盐代替。发酵开始后,每隔12 h取样,离心去上清,保存在-20 ℃冰箱中,同时测定该时间点的细胞在600 nm的吸光度。分批发酵过程中,每组实验条件包含3个生物学重复,吸光度取3个数值的平均值作图。
1.5.2 丙酮丁醇梭菌连续发酵: 连续发酵在3 L的NewBrunswick发酵罐中进行[9],工作体积为1.5 L。首先在MM培养基中进行种子培养,随后以10%的接种量转入发酵罐中,发酵条件为37℃和150 r/min,使用2 mol/L的KOH将pH控制在5.7进行产酸期发酵。接种后12-16 h,开始连续发酵,稀释速度为0.075 h-1,相当于培养基在13.3 h内重置了一遍。连续发酵4 d后,发酵罐内细胞生长速率趋于稳定,细胞浓度和产物浓度保持稳定,此时的产物主要是乙酸和丁酸,发酵进入稳定的产酸期。而后将pH设置为4.5,pH由于产酸而降低,大约24 h内,pH可以由5.7降低到4.5,通过3-4 d的连续发酵,细胞浓度和产物浓度趋于稳定,产物主要是丙酮和丁醇,丙酮丁醇梭菌进入稳定的产溶剂期生长阶段,连续发酵结束。
1.6 分析方法 细胞吸光度(opticaldensity, OD)由紫外分光光度计Ultrospec2100 Pro (美国GE公司)测定;葡萄糖、乙酸、丁酸和乳酸用高效液相色谱系统Agilent1260 (美国安捷伦公司)测定,色谱柱是安捷伦Hi-PlexH糖醇柱,工作条件是55℃柱温,流动相为5 mmol/L的硫酸,流速为0.7 mL/min,通过示差折光检测器检测目标产物。丙酮和丁醇使用安捷伦公司的气相色谱(Agilent7890B)测定,色谱柱是HP-INNOWAX,高纯氮气作为载气。样品通过乙酸乙酯萃取,异丁醇作为内标。
硫酸根离子在强酸性媒介中,会形成硫酸钡沉淀,生成物的浊度可以通过在420 nm的吸光度来定量,以此测定培养基中硫酸根的量[19]。使用的沉淀液成分为(g/L):BaCl210.0,NaCl10.0,明胶0.25,HCl(37%) 5 mL/L。标准液为10 mmol/L的无水硫酸钠,检测时分别稀释为0、2、4、6、8、10 mmol/L。150 μL各浓度标准液与750 μL去离子水充分混匀后在420 nm波长下检测吸光度作为空白值,之后加入240 μL沉淀液,5 min后重新测定吸光度,绘制标准曲线。样品使用相同的方法与稀释后的标准液同时测定吸光度,并根据标准曲线计算浓度。
2 结果和分析 2.1 Δfer和ΔmccB突变株的构建 构建出正确的重组质粒pMTL007C-E2-fer和pMTL007C-E2-mccB,并成功转化进入丙酮丁醇梭菌中。CGM平板中筛选出可能的突变株,通过PCR的方法进行鉴定。使用相同的PCR引物,以Δfer突变株基因组为模板的PCR产物,由于外源内含子的插入使其长度比野生型的长约1.8 kb (图 2-A);以ΔmccB突变株基因组为模板的PCR产物也比野生型菌株长1.8 kb (图 2-A)。结果初步显示fer基因和mccB基因由于外源基因的插入而失活。
 |
| 图 2 Δfer和ΔmccB突变株的验证 Figure 2 Verification of Δfer and ΔmccB mutants. A: PCR verification of Δfer and ΔmccB mutants. M: marker; lane 1: CAC0105F and CAC0105R primers, Δfer mutant genome DNA; lane 2: CAC0105F and CAC0105R primers, wild type genome DNA; lane 3: CAC0930F and CAC0930R primers, ΔmccB mutant genome DNA; lane 4: CAC0930F and CAC0930R primers, wild type genome DNA; B: southern hybridization analysis of the Δfer and ΔmccB mutants using a specific intron probe. lane 1: marker; lane 2: genomic DNA of wild type (negative control); lane 3: genomic DNA of the Δfer mutant; lane 4: genomic DNA of the ΔmccB mutant. |
| 图选项 |
为进一步验证内含子已经插入到目的基因,对两个以fer和mccB突变株基因组为模板的2.1 kb PCR产物进行测序。分析序列确定了内含子分别在276/277 bp处插入了fer基因,414/415 bp处插入了mccB基因。为了验证内含子只在目的基因实现了插入,而没有“脱靶”,Southern杂交用来检测内含子在突变株中的插入拷贝数。结果如图 2-B所示,说明在Δfer突变株和ΔmccB突变株中的外源内含子序列都是单拷贝。
2.2 突变株和野生型菌株的分批发酵
2.2.1 Δfer突变株和ΔmccB突变株在基本培养基中的分批发酵: fer基因与另外8个功能基因位于一个由8863 bp (CAC0102-0110)组成的操纵子中。通过对基因功能的分析,我们预测该操纵子的功能是还原硫酸根生成亚硫酸根。为验证这一假设,将Δfer突变株和野生型在硫酸根为唯一硫源的MM培养基中培养。结果如图 3-A所示,野生型正常生长,Δfer突变株不能生长,说明fer基因的失活使突变株失去利用硫酸根的能力,导致突变株不能在MM培养基中生长。当亚硫酸钠以1 mmol/L的终浓度加入到基本培养基中,Δfer突变株恢复生长(图 3-A),结果说明在丙酮丁醇梭菌的代谢中,长度为8863 bp的操纵子的功能是还原硫酸根生成亚硫酸根。在硫酸根的代谢中,首先合成半胱氨酸(图 1),因此半胱氨酸以1 mmol/L的浓度添加到基础培养基中,也可以恢复Δfer突变株的生长,但最高OD只能达到3.17±0.07,相同条件下野生株的最高OD可以达到6.79±0.39,说明外源半胱氨酸不能完全代替丙酮丁醇发酵过程中的内源半胱氨酸。
 |
| 图 3 野生型、Δfer突变株和ΔmccB突变株在含有不同硫源的培养基中的分批发酵 Figure 3 Batch fermentation of wild-type, Δfer mutant and ΔmccB mutant in media containing different sulfur source. A: wild type and the Δfer mutant cultured in minimal medium. ▼: wild type; ●: the Δfer mutant; ■: Δfer mutant cultured in the presence of 1 mmol/L sodium sulfite; ▲: Δfer mutant cultured in the presence of 1 mmol/L cysteine. B: wild type and the ΔmccB mutant cultured in chloride minimal medium in the presence of 1 mmol/L methionine as sole sulfur source. □: wild type; ○: the ΔmccB mutant. The experiment was repeated three times. |
| 图选项 |
在丙酮丁醇梭菌硫元素代谢的过程中,甲硫氨酸也可以合成半胱氨酸(图 1),从而为整个代谢提供硫元素,mccB基因功能是催化甲硫氨酸到半胱氨酸的最后一步反应,野生型菌株和ΔmccB突变株在以甲硫氨酸为唯一硫元素的氯元素基本培养基(cMM)中培养(图 3-B),结果显示,mccB基因的失活并不会使突变株在基本培养基中致死,但相较于野生型菌株,突变株的生长受到很大抑制,说明mccB的敲除会影响利用甲硫氨酸合成半胱氨酸,但仍有其他替代基因也可起到相同作用。
2.2.2 半胱氨酸的添加对Δfer突变株和野生型菌株的分批发酵影响: 丙酮丁醇梭菌在基本培养基中生长状况良好,硫酸根通过一系列的还原反应首先合成半胱氨酸,进而硫元素进入下游代谢途径,但结果显示半胱氨酸直接作为硫元素会影响丙酮丁醇梭菌的生长(图 3-A),通过在基础培养基中添加不同浓度的半胱氨酸,检测半胱氨酸对野生型菌株和Δfer突变株生长的影响。结果显示,添加终浓度1 mmol/L或低于1 mmol/L的半胱氨酸不会影响野生型菌株的生长(图 4),添加终浓度2 mmol/L或高于2 mmol/L的半胱氨酸会极大影响野生型菌株的生长。相同的发酵状况也发生在Δfer突变株的分批发酵中(图 5),添加终浓度1 mmol/L或低于1 mmol/L的半胱氨酸会恢复Δfer突变株在基本培养基中的生长,但添加浓度高于1 mmol/L会影响Δfer突变株的生长。
 |
| 图 4 野生型在不同浓度的半胱氨酸作为唯一硫源时的分批发酵生长曲线 Figure 4 Growth curve of wild type in batch fermentation at different concentrations of cysteine as the sole sulfur source. The experiment was repeated three times. |
| 图选项 |
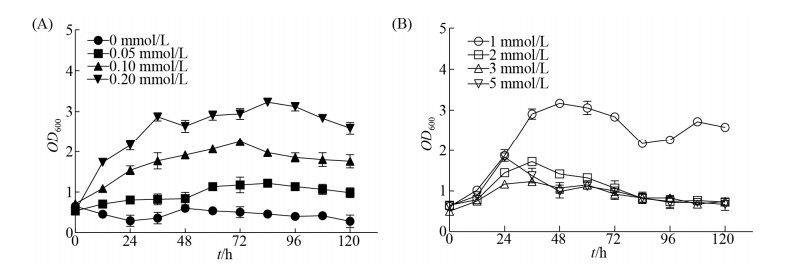 |
| 图 5 Δfer突变株在不同浓度半胱氨酸作为唯一硫源时的分批发酵生长曲线 Figure 5 Growth curve of Δfer mutant in batch fermentation at different concentrations of cysteine as the sole source of sulfur. The experiment was repeated three times. |
| 图选项 |
2.3 fer、mccB基因对丙酮丁醇梭菌产酸期和产溶剂期的影响
2.3.1 野生型的双期连续发酵: 丙酮丁醇梭菌可以通过连续发酵的方法使细胞在产酸期和产溶剂期稳定生长,这为分别研究基因敲除对产酸期和产溶剂期的影响提供了条件。野生型菌株在磷酸限制的连续发酵培养中,通过pH控制,可以稳定地在产酸期和产溶剂期恒定生长(图 6),产物浓度如表 3所示。由于硫酸盐是连续培养基中的唯一硫元素,通过测定产酸期(120 h)和产溶剂期(216 h)发酵罐中硫酸根的剩余量,来比较产酸期和产溶剂期的稳定生长对硫元素的利用情况。结果显示硫酸根浓度在120 h是(17.85±0.14) mmol/L并且在216 h是(18.38±0.09) mmol/L。这个结果显示与产酸期相比,产溶剂期需要更少的硫酸盐来维持稳定生长。
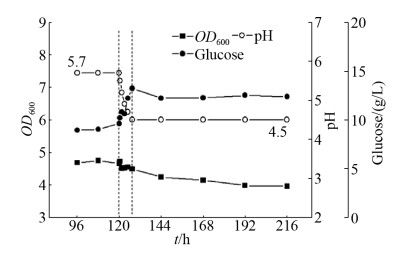 |
| 图 6 丙酮丁醇梭菌在磷限制连续培养中的发酵数据 Figure 6 The fermentation profile of a phosphate- limited continuous culture of C. acetobutylicum. Dashed line indicated the dynamic pH shift from 5.7 to 4.5. |
| 图选项 |
表 3. 磷限制连续发酵中野生型和ΔmccB突变株在产酸阶段和产溶剂阶段的稳定态时的产物浓度 Table 3. Product concentrations in phosphate-limited continuous cultures of the wild type and the ΔmccB mutant during steady-state acidogenic and solventogenic growth
| Product | Continuous of the wild type/(mmol/L) | Continuous of ΔmccB mutant/(mmol/L) | |||
| 120 h | 216 h | 120 h | 216 h | ||
| Residual glucose | 48.0 | 69.0 | 66.0 | 95.0 | |
| Acetate | 23.0 | 23.0 | 12.0 | 2.4 | |
| Butyrate | 73.0 | 21.0 | 52.0 | 17.0 | |
| Acetone | 0.2 | 20.0 | 0.4 | 13.0 | |
| Ethanol | 5.3 | 7.3 | 1.7 | 2.1 | |
| Butanol | 6.0 | 45.0 | 1.0 | 21.0 | |
表选项
2.3.2 Δfer突变株的双期连续发酵: 由于fer基因的失活,Δfer突变株不能还原硫酸根,致使不能在基本培养基中生长,添加半胱氨酸时可以恢复生长,但高浓度半胱氨酸的添加也影响了丙酮丁醇梭菌的生长(图 5)。为了进一步研究fer基因对硫代谢的影响,Δfer突变株在磷限制培养基中进行连续发酵,终浓度1 mmol/L的半胱氨酸作为唯一硫元素。结果显示Δfer突变株能在产酸阶段生长(图 7),在72 h生长达到达稳定状态,通过pH控制进入产溶剂期时,Δfer突变株不能生长,在0.075 h-1的稀释率的连续发酵条件下,OD缓慢降低。为了消除产溶剂期半胱氨酸不足的影响,在120 h关闭pH控制使其开始下降时,额外添加半胱氨酸到PLMM中,在另外3次实验中使其终浓度分别达到2、3或5 mmol/L。结果显示,尽管在PLMM中有足够的硫源并且产溶剂阶段需要更少的硫源,Δfer突变仍然不能在连续发酵的产溶剂期生长,说明外源的半胱氨酸不能在产溶剂期替代内源的半胱氨酸合成。
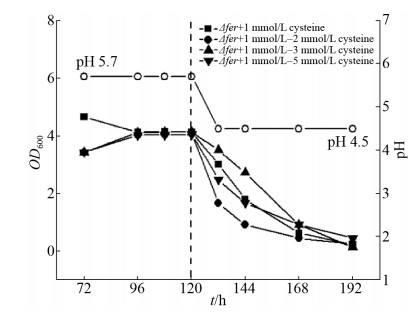 |
| 图 7 以半胱氨酸为唯一硫源时,Δfer突变株在磷限制连续培养中的发酵数据 Figure 7 The fermentation profile of the Δfer mutant in phosphate-limited continuous culture with cysteine as sulfur source. In four replicates, 0, 1, 2, 4 mmol/L cysteine was added respectively to the medium containing 1 mmol/L cysteine after 120 h, to result in a final cysteine concentration of 1, 2, 3, 5 mmol/L. Dashed line indicated the dynamic pH shift from 5.7 to 4.5. |
| 图选项 |
2.3.3 ΔmccB突变株的双期连续发酵: 在有限磷酸盐连续培养条件下,ubiGmccBA操纵子(CAC0929-CAC0930)的表达在产溶剂生长过程中被强烈诱导。此发现说明这个能将甲硫氨酸转化为半胱氨酸的操纵子可能在产溶剂阶段起作用。将ΔmccB突变株在磷缺乏连续培养基中培养(图 8),结果显示该基因的失活对产酸期和产溶剂期的生长都有影响,相对于相同条件下的野生型菌株,ΔmccB突变株产物(表 3)和OD都变小。结果说明mccB基因失活虽不致死,但甲硫氨酸到半胱氨酸的转化途径既影响丙酮丁醇梭菌的产酸期的代谢过程,也影响着产溶剂期的代谢过程。
 |
| 图 8 ΔmccB突变株在磷缺乏连续培养中的发酵数据 Figure 8 The fermentation profile of a phosphate- limited continuous culture of the ΔmccB mutant. Dashed line indicated the dynamic pH shift from 5.7 to 4.5. |
| 图选项 |
3 讨论 枯草芽孢杆菌和大肠杆菌分别是微生物革兰氏阳性和阴性菌的模式生物,研究表明这两种模式生物都具有3种获得半胱氨酸的代谢途径,即通过硫酸根还原途径获得半胱氨酸、通过代谢途径转化甲硫氨酸得到半胱氨酸和直接利用外源半胱氨酸作为硫元素来源[2, 20-22]。丙酮丁醇梭菌是厌氧产孢子革兰氏阳性菌的模式菌株,基于同源比对和丙酮丁醇梭菌的基因功能分析,本研究以丙酮丁醇梭菌半胱氨酸合成代谢途径中铁氧还蛋白(fer)、胱硫醚-γ-裂解酶(mccB)基因为研究对象,使用ClosTron系统设计并构建了Δfer与ΔmccB突变株,在不同硫源的培养基中分批发酵监测突变株和野生型的生长状况,并通过连续发酵的方式探究了目的基因对产酸期和产溶剂期的影响。结果显示,fer基因及其所在的操纵子主要参与半胱氨酸合成途径中硫酸根还原为亚硫酸根的代谢过程,敲除后不能将硫酸根还原为亚硫酸根。另外在产酸、产溶剂双期连续发酵中,fer基因的敲除影响的主要是产溶剂阶段,并且其调控合成的半胱氨酸不能由外源添加的方式来替代。mccB主要调控甲硫氨酸合成半胱氨酸途径,敲除后使丙酮丁醇梭菌的生长和产物合成均受到抑制,但并不致死,说明除了mccB基因外,在丙酮丁醇梭菌中存在其他代替胱硫醚-γ-裂解酶(cystathionine γ-lyase, mccB)的功能酶[21],控制合成的相关基因仍需进一步研究。
另外在半胱氨酸为唯一硫源的分批发酵中,高浓度半胱氨酸严重影响丙酮丁醇梭菌的生长和代谢,这种现象之前并没有报道。丙酮丁醇梭菌是典型的酸醇双期发酵菌,根据产物的生成可以推断产酸期和产溶剂期的能量代谢平衡机制不同,在产酸期主要产物是乙酸和丁酸,生成过程中有ATP产生,糖酵解释放的还原型铁硫氧还蛋白(Fdred)通过氢气产生实现重新氧化,进而实现能量代谢平衡[7, 23-26];产溶剂期的主要产物是丙酮和丁醇,丁醇合成过程中没有ATP产生,但需要NADH作为辅因子,相对于产酸期,额外的NADH来源目前并不清楚。另一方面,由于氢化酶在低pH值条件下,酶活大大降低,糖酵解释放出的还原型铁硫氧还蛋白是通过什么代谢机制进行重新氧化,进而实现产溶剂期代谢过程中的能量代谢平衡机制现在还不清楚。丙酮丁醇梭菌以硫酸根为硫元素进行代谢时,从硫酸根到半胱氨酸的合成过程中,需要NADH和Fdred参与,在这种情况下如果直接用半胱氨酸直接作为硫元素,会破坏产溶剂期的氧化还原平衡,我们猜测这是高浓度半胱氨酸影响丙酮丁醇梭菌产溶剂期代谢的原因。
本研究通过构建突变株以及对突变株进行发酵的方式研究了半胱氨酸合成代谢途径上fer与mccB基因的功能,发现这2个基因均对半胱氨酸的合成具有影响并最终影响丙酮丁醇梭菌的生长代谢,为丙酮丁醇梭菌的硫代谢研究提供了实验基础。
References
| [1] | Albanesi D, Mansilla MC, Schujman GE, de Mendoza D. Bacillus subtilis cysteine synthetase is a global regulator of the expression of genes involved in sulfur assimilation. Journal of Bacteriology, 2005, 187(22): 7631-7638. DOI:10.1128/JB.187.22.7631-7638.2005 |
| [2] | Kredich NM. Biosynthesis of cysteine//Neidhardt FC. Escherichia coli and Salmonella: Cellular and Molecular Biology. 2nd ed. Washington DC: American Society for Microbiology, 1996: 514-527. |
| [3] | Sekowska A, Kung HF, Danchin A. Sulfur metabolism in Escherichia coli and related bacteria: facts and fiction. Journal of Molecular Microbiology and Biotechnology, 2000, 2(2): 145-177. |
| [4] | Zeller T, Klug G. Thioredoxins in bacteria: functions in oxidative stress response and regulation of thioredoxin genes. Naturwissenschaften, 2006, 93(6): 259-266. DOI:10.1007/s00114-006-0106-1 |
| [5] | Ayala-Castro C, Saini A, Outten FW. Fe-S cluster assembly pathways in bacteria. Microbiology and Molecular Biology Reviews, 2008, 72(1): 110-125. DOI:10.1128/MMBR.00034-07 |
| [6] | Jones DT, Woods DR. Acetone-butanol fermentation revisited. Microbiology Reviews, 1986, 50(4): 484-524. |
| [7] | Lütke-Eversloh T, Bahl H. Metabolic engineering of Clostridium acetobutylicum: recent advances to improve butanol production. Current Opinion in Biotechnology, 2011, 22(5): 634-647. DOI:10.1016/j.copbio.2011.01.011 |
| [8] | Amador-Noguez D, Feng XJ, Fan J, Roquet N, Rabitz H, Rabinowitz JD. Systems-level metabolic flux profiling elucidates a complete, bifurcated tricarboxylic acid cycle in Clostridium acetobutylicum. Journal of Bacteriology, 2010, 192(17): 4452-4461. DOI:10.1128/JB.00490-10 |
| [9] | Grimmler C, Janssen H, Krauβe D, Fischer RJ, Bahl H, Dürre P, Liebl W, Ehrenreich A. Genome-wide gene expression analysis of the switch between acidogenesis and solventogenesis in continuous cultures of Clostridium acetobutylicum. Journal of Molecular Microbiology and Biotechnology, 2011, 20(1): 1-15. DOI:10.1159/000320973 |
| [10] | André G, Even S, Putzer H, Burguière P, Croux C, Danchin A, Martin-Verstraete I, Soutourina O. S-box and T-box riboswitches and antisense RNA control a sulfur metabolic operon of Clostridium acetobutylicum. Nucleic Acids Research, 2008, 36(18): 5955-5969. DOI:10.1093/nar/gkn601 |
| [11] | Carmel-Harel O, Storz G. Roles of the glutathione- and thioredoxin-dependent reduction systems in the Escherichia coli and Saccharomyces cerevisiae responses to oxidative stress. Annual Review of Microbiology, 2000, 54(1): 439-461. DOI:10.1146/annurev.micro.54.1.439 |
| [12] | Coppée JY, Auger S, Turlin E, Sekowska A, Le Caer JP, Labas V, Vagner V, Danchin A, Martin-Verstraete I. Sulfur-limitation-regulated proteins in Bacillus subtilis: a two-dimensional gel electrophoresis study. Microbiology, 2001, 147(6): 1631-1640. DOI:10.1099/00221287-147-6-1631 |
| [13] | Heap JT, Pennington OJ, Cartman ST, Carter GP, Minton NP. The ClosTron: a universal gene knock-out system for the genus Clostridium. Journel of Microbiological Methods, 2007, 70(3): 452-464. DOI:10.1016/j.mimet.2007.05.021 |
| [14] | Heap JT, Kuehne SA, Ehsaan M, Cartman ST, Cooksley CM, Scott JC, Minton NP. The ClosTron: Mutagenesis in Clostridium refined and streamlined. Journal of Microbiological Methods, 2010, 80(1): 49-55. DOI:10.1016/j.mimet.2009.10.018 |
| [15] | Wiesenborn DP, Rudolph FB, Papoutsakis ET. Thiolase from Clostridium acetobutylicum Atcc-824 and its role in the synthesis of acids and solvents. Applied and Environmental Microbiology, 1988, 54(11): 2717-2722. DOI:10.1128/AEM.54.11.2717-2722.1988 |
| [16] | Bahl H, Andersch W, Gottschalk G. Continuous production of acetone and butanol by Clostridium acetobutylicum in a two-stage phosphate limited chemostat. European Journal of Applied Microbiology and Biotechnology, 1982, 15(4): 201-205. DOI:10.1007/BF00499955 |
| [17] | Monot F, Martin JR, Petitdemange H, Gay R. Acetone and butanol production by Clostridium acetobutylicum in a synthetic medium. Applied and Environmental Microbiology, 1982, 44(6): 1318-1324. DOI:10.1128/AEM.44.6.1318-1324.1982 |
| [18] | Sambrook J, Russel DW. Molecular cloning: a laboratory manual 3rd ed. Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 2001. |
| [19] | Tabatabai MA. A rapid method for determination of sulfate in water samples. Environmental Letters, 1974, 7(3): 237-243. |
| [20] | Thomas D, Surdin-Kerjan Y. Metabolism of sulfur amino acids in Saccharomyces cerevisiae. Microbiology and Molecular Biology Reviews, 1997, 61(4): 503-532. DOI:10.1128/.61.4.503-532.1997 |
| [21] | Hullo MF, Auger S, Soutourina O, Barzu O, Yvon M, Danchin A, Martin-Verstraete I. Conversion of methionine to cysteine in Bacillus subtilis and its regulation. Journal of Bacteriology, 2007, 189(1): 187-197. DOI:10.1128/JB.01273-06 |
| [22] | Mansilla MC, Albanesi D, de Mendoza D. Transcriptional control of the sulfur-regulated cysH operon, containing genes involved in L-cysteine biosynthesis in Bacillus subtilis. Journal of Bacteriology, 2000, 182(20): 5885-5892. DOI:10.1128/JB.182.20.5885-5892.2000 |
| [23] | Janssen H, Grimmler C, Ehrenreich A, Bahl H, Fischer RJ. A transcriptional study of acidogenic chemostat cells of Clostridium acetobutylicum-solvent stress caused by a transient n-butanol pulse. Journal of Biotechnology, 2012, 161(3): 354-365. DOI:10.1016/j.jbiotec.2012.03.027 |
| [24] | Lehmann D, H?nicke D, Ehrenreich A, Schmidt M, Weuster-Botz D, Bahl H, Lütke-Eversloh T. Modifying the product pattern of Clostridium acetobutylicum. Applied Microbiology and Biotechnology, 2012, 94(3): 743-754. DOI:10.1007/s00253-011-3852-8 |
| [25] | Schwarz KM, Kuit W, Grimmler C, Ehrenreich A, Kengen SWM. A transcriptional study of acidogenic chemostat cells of Clostridium acetobutylicum-cellular behavior in adaptation to n-butanol. Journal of Biotechnology, 2012, 161(3): 366-377. DOI:10.1016/j.jbiotec.2012.03.018 |
| [26] | Cooksley CM, Zhang Y, Wang HZ, Redl S, Winzer K, Minton NP. Targeted mutagenesis of the Clostridium acetobutylicum acetone-butanol-ethanol fermentation pathway. Metabolic Engineering, 2012, 14(6): 630-641. DOI:10.1016/j.ymben.2012.09.001 |
