冯伦元1, 何腊平1,2

 , 李翠芹3, 张宏文1, 邢书奇1, 陈翠翠1
, 李翠芹3, 张宏文1, 邢书奇1, 陈翠翠1 1. 贵州大学酿酒与食品工程学院, 贵州 贵阳 550025;
2. 贵州大学贵州省农畜产品贮藏与加工重点实验室, 贵州 贵阳 550025;
3. 贵州大学化学与化工学院, 贵州贵阳 550025
收稿日期:2019-04-04;修回日期:2019-07-04;网络出版日期:2019-11-19
基金项目:国家自然科学基金(31870002,31660010);贵州省科技支撑([2019]2382号,[2016]2580号);黔科合平台人才项目([2017]5788-11)
*通信作者:何腊平, E-mail:helaping@163.com.
摘要:[目的] 微生物β-葡萄糖苷酶法水解银杏黄酮苷具有重要意义,不过目前这方面的研究极少。因此,本文目的是筛选到水解银杏黄酮苷的酶活高的微生物β-葡萄糖苷酶,并分析其底物选择性机制。[方法] 以银杏叶提取物作为唯一碳源富集培养,从贵州传统发酵豆豉中筛选产对银杏黄酮苷水解酶活高的β-葡萄糖苷酶的菌株,并对该菌株进行鉴定。然后比较此β-葡萄糖苷酶对不同底物的选择性,同时测定此酶水解银杏黄酮苷反应的米氏常数Km及最大反应速率Vmax。最后,对不同的底物进行分子对接,分析其底物特异性机制。[结果] 结果表明,筛选到的菌株GUXN01所产β-葡萄糖苷酶水解银杏黄酮苷的酶活最高,被鉴定为枯草芽孢杆菌。此β-葡糖糖苷酶对β构型的糖类以及苷类等具有广泛的底物特异性和不同的选择性,尤其对银杏黄酮苷具有很好的亲和性。分子对接研究表明枯草芽孢杆菌β-葡萄糖苷酶对银杏黄酮苷和其他糖苷类具有不同亲和性和选择性的原因主要是酶结构和底物分子结构的相互作用力的差异导致的。[结论] 这些发现为GUXN01所产的β-葡萄糖苷酶应用于水解银杏黄酮苷类生产相应苷元奠定了良好的基础。
关键词:贵州传统发酵豆制品枯草芽孢杆菌β-葡萄糖苷酶水解转化银杏黄酮底物选择性
Screening of ginkgo-flavonoids-hydrolyzing microbial β-glucosidase from traditional fermented soybean in Guizhou
Lunyuan Feng1, Laping He1,2

 , Cuiqin Li3, Hongwen Zhang1, Shuqi Xing1, Cuicui Chen1
, Cuiqin Li3, Hongwen Zhang1, Shuqi Xing1, Cuicui Chen1 1. School of Liquor and Food Engineering, Guizhou University, Guiyang 550025, Guizhou Province, China;
2. Key Laboratory of Agricultural and Animal Products Store & Processing of Guizhou Province, Guizhou University, Guiyang 550025, Guizhou Province, China;
3. School of Chemistry and Chemical Engineering, Guizhou University, Guiyang 550025, Guizhou Province, China
Received: 4 April 2019; Revised: 4 July 2019; Published online: 19 November 2019
*Corresponding author: He Laping, E-mail:helaping@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31870002, 31660010), by the Guizhou Science and Technology Support ([2019]2382, [2016]2580) and by the Guizhou Science and Technology Platform Talent Project ([2017]5788-11)
Abstract: [Objective] Hydrolysis of ginkgo flavonoid glycosides by microbial β-glucosidase is less known. Therefore, we screened a microbial β-glucosidase with high enzymatic activity to hydrolyze ginkgo flavonoids and analyze its substrate-specificity. [Methods] β-Glucosidases with high enzymatic activity for the hydrolysis of ginkgo flavone glycoside were screened from traditional fermented soybean meal in Guizhou using Ginkgo biloba extract as the sole carbon source. The strain producing glucosidase was then identified, and the selectivity of the enzyme to different substrates was compared. The Michaelis constant Km and maximum velocity Vmax of the enzymatic reaction to hydrolyze ginkgo flavonoids were determined. Finally, the substrate-specific mechanism of the enzyme was analyzed via molecular docking studies. [Results] Among the strains observed, strain GUXN01 showed the highest β-glucosidase activity and was subsequently identified as Bacillus subtilis. β-glucosidase produced by GUXN01 had broad substrate specificity to sugars and glycosides with the β configuration. The glucosidase showed especially good affinity to ginkgo flavonoid glycosides. Molecular docking studies indicated that B. subtilis β-glucosidase had different affinities and selectivities toward ginkgo flavonoid glycosides and other glycosides due to differences in the interactions between the enzyme and substrate structures. [Conclusion] These findings may serve as a good foundation for the production of the corresponding aglycones via the hydrolysis of ginkgo flavonoid glycosides through the β-glucosidase produced by GUXN01.
Keywords: Guizhou traditional fermented soy productsBacillus subtilisβ-glucosidasehydrolysis transformationginkgo flavonoidssubstrate selectivity
β-葡萄糖苷酶(β-glucosidase,EC·3·2·1·21)是来源广泛的一大类纤维素酶类的一种,它可催化β-D葡萄糖苷键[1],在人类、动植物、微生物的糖代谢以及维持机体正常的生理功能等方面都起着重要的作用[2]。在工业生产中,β-葡萄糖苷酶对纤维素的水解也起着不可替代的重要作用[3]。此外,β-葡萄糖苷酶还广泛用于食品的增香[4]、水解白黎芦醇苷[5]及烷基糖苷[6]的合成等。
目前获得β-葡萄糖苷酶的方法主要有两种:(1)从植物中提取;(2)微生物液体发酵。但来源于植物的β-葡萄糖苷酶的活性通常比微生物来源的活性低[7]。许多国内外****研究了直接利用商业β-葡萄糖苷酶进行生物转化。但是,商业β-葡萄糖苷酶存在价格昂贵、回收困难等诸多弊端,不利于产业化[8]。研究发现,黄豆自身含有β-葡萄糖苷酶,如Hsieh[9]和Suzuki[10]等分别从黄豆及黄豆芽中提取纯化了β-葡萄糖苷酶,用于共轭型异黄酮结合物的水解。但黄豆中内源性β-葡萄糖苷酶水解活性不高,水解效率只有22%–29%。风味豆豉是我国特产,也是贵州特色食品。有研究发现,发酵大豆制品中的大豆异黄酮比未发酵大豆制品具有更高活性[11],据此可推断,传统发酵大豆食品中存在可将大豆异黄酮苷有效转化为苷元的产β-葡萄糖苷酶微生物。因此可从豆豉中筛选产β-葡萄糖苷酶的功能微生物。银杏黄酮是天然的最有效的防治心脑血管疾病的药物,目前其主要来自于银杏叶。不过银杏叶提取物中的银杏黄酮主要以银杏黄酮苷的形式存在,而银杏黄酮苷比相应的银杏黄酮苷元活性低得多,因此将银杏黄酮苷转化为苷元具有现实意义,而β-葡萄糖苷酶酶法转化无疑是理想选择。我们希望利用微生物代谢过程中所产生的酶类,高酶活水解银杏黄酮苷,得到高活性的银杏黄酮苷元。相较于传统的化学转化法来说,酶法转化银杏叶提取物具有反应条件温和、特异性强、反应效率高等优点,而且不破坏银杏叶提取物的其他活性成分。
由于β-葡萄糖苷酶法转化银杏叶提取物中的银杏黄酮苷的优异性,本研究以银杏叶提取物为唯一碳源(辅以无机氮源和无机盐)进行富集培养后,筛选获得水解银杏黄酮苷最高酶活的菌株,同时考察其底物选择性,希望进一步拓宽该β-葡萄糖苷酶的应用范围,并利用分子对接分析此类微生物β-葡萄糖苷酶对不同底物催化的选择性机制,以便于为后续的进一步改造和产业化应用奠定基础。
1 材料和方法 1.1 材料
1.1.1 实验材料与菌种: 豆豉样品来自贵州大方、水城、贵阳、遵义等地传统发酵豆制品,富含丰富微生物。市售大豆购买于贵阳市花溪区星力超市(原产地:黑龙江黑河,非转基因)。
1.1.2 试剂: 3, 5-二硝基水杨酸(AR),上海国药;水杨苷,西安欣禄生物科技有限公司;栀子苷,西安嘉天生物科技有限公司;芦丁、苦杏仁苷、龙胆二糖、CMC-Na、麦芽三糖、芦丁、海藻糖、熊果苷均为生物试剂BR,购自上海源叶生物有限公司;银杏黄酮样品获赠于贵州省生化工程中心;其他试剂均为国产分析纯。
1.1.3 培养基: (1) 富集培养基(g/L):银杏叶提取物5.0,硫酸镁0.5,磷酸二氢钾10.0,硫酸铵2.0;(2)筛选培养基(g/L):银杏叶提取物5.0、硫酸镁0.5、磷酸二氢钾10.0、栀子苷0.1、谷氨酸钠10.0、硫酸铵2.0、琼脂20.0;(3)液体种子培养基(g/L):硫酸铵2.0、硫酸镁0.5、氯化钠2.0、碳酸钙2.0、磷酸二氢钾0.5、银杏叶提取物5.0;(4)固态发酵培养基:黄豆清洗干净,沥水后加入4倍体积溶解了1%的食盐和1%葡萄糖的去离子水完全浸没,常温浸泡18–24 h,沥干水分后121 ℃灭菌20 min;(5) LB斜面培养基(g/L):胰蛋白胨10、酵母提取物5、氯化钠10、琼脂粉20。
1.1.4 仪器与设备: UV2000紫外可见光分光光度计,尤尼柯(上海)仪器有限公司;SHHW2数显恒温水浴锅,上海东星建材试验设备有限公司;CX21SF1奥林巴斯生物显微镜,奥林巴斯中国有限公司;S1000TM PCR仪,德国Thermal Cycler公司;高速冷冻离心机,上海安亭科学仪器厂。
1.2 产β-葡萄糖苷酶菌株的初筛 5 g豆豉样品,加入45 mL灭菌备用的富集培养基中,30 ℃、180 r/min振荡培养24 h。取上清液用生理盐水(0.85%)稀释,分别取10–3、10–4、10–5、10–6、10–7、10–8梯度稀释的菌悬液200 μL涂布于筛选培养基上,分别于28 ℃和37 ℃下培养48 h后,挑选蓝色菌圈大且颜色深的单菌落进行纯化培养。经革兰氏染色镜检为单一菌种后,斜面保藏和甘油保藏备用。挑选若干株菌落形态不同且蓝色菌圈大的进行后续试验:用接种环挑取斜面上的菌苔2–3环接种到种子培养基中,于37 ℃、180 r/min的条件下培养18 h。培养完成后于4 ℃、8000×g离心10 min,即得粗酶液。用直径为2 mm的无菌打孔器在培养基上均匀打孔,每平板均匀打2孔,取20 μL离心后粗酶液注入平板孔(2孔为一组平行),放于37 ℃恒温培养18 h,培养结束后测量平板孔蓝色菌圈直径(mm)。
1.3 高产β-葡萄糖苷酶菌株的复筛
1.3.1 黄豆预处理及固态发酵粗酶液的制备: 剔除霉、蛀、畸的黄豆,除杂后用去离子水冲洗干净,然后准确称量,用4倍体积混合液(含1% NaCl,1%葡萄糖)常温浸泡18–24 h。沥水后,按照每瓶50 g的量分装三角瓶,置于高压蒸汽灭菌锅湿热灭菌20 min后,放入无菌操作台内进行冷却。用接种环挑选2–3环斜面培养基上的菌苔接种到液体种子培养基培养18 h,然后按4%的接种量接种到灭菌的固态发酵培养基上,37 ℃条件下培养72 h,每12 h摇晃1次。称取10 g发酵完成的纳豆溶于40 mL无菌生理盐水中,4 ℃条件下浸提24 h,后用打浆机捣碎经12000×g离心10 min,上清液即为固态发酵粗酶液,用于后续β-葡萄糖苷酶酶活测定。
1.3.2 β-葡萄糖苷酶酶活的测定: 采用3, 5-二硝基水杨酸法[12] (3, 5-dinitrosalicylic acid,DNS法)测定β-葡萄糖苷酶酶活。酶活力单位定义:在测定条件下,每分钟水解银杏黄酮苷产生1 μmol还原糖(以葡萄糖计)所需酶量定义为一个酶活力单位。
1.4 高产水解银杏黄酮苷的β-葡萄糖苷酶的菌株鉴定
1.4.1 菌种形态鉴定: 将复筛得到的水解银杏黄酮苷酶活最高的一株菌GUXN01,在栀子苷-谷氨酸钠显色平板上划线,37 ℃培养24 h,观察单菌落形态,对该菌株进行革兰氏染色,观察菌体形态。
1.4.2 生理生化鉴定: 将纯化好的菌株送中国典型培养物保藏中心(China Center for Type Culture Collection,简称CCTCC)进行生理生化特性鉴定。考察对吲哚、葡萄糖酸盐、水解明胶(蛋白酶)、葡萄糖、甘露醇、N-乙酰-葡萄糖胺、麦芽糖、癸酸、已二酸的利用情况。
1.5 16S rDNA序列鉴定 将复筛得到的水解银杏黄酮苷酶活最高的菌株GUXN01接种于液体种子培养基,37 ℃、180 r/min的条件下培养18 h。将培养液置于2 mL离心管,10000×g离心10 min,收集沉淀。取上述沉淀加入300 μL溶菌酶(浓度50 mg/mL),于37 ℃水浴0.5 h,后使用细菌基因组DNA提取试剂盒进行提取。扩增上游引物为27F (AGAGTTTGATC CTGGTCAGAACGAACGCT),下游引物为1492R (TACGGCTACCTTGTTACGACTTCACCCC)。25 μL聚合酶链反应体系如下:双蒸水5.5 μL;Go Taq Green Master Mix(2×) 12.5 μL;1492R 2.5 μL;27F 2.5 μL;模板DNA 2.0 μL。
反应条件为:94 ℃预变性5 min,94 ℃变性1 min,退火温度从65 ℃降至55 ℃,每个循环降低0.5 ℃,退火时间为3 s,72 ℃延伸1 min,35个循环;恒定退火温度下进行94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min。扩增产物送上海生工公司测序,将得到的序列提交NCBI进行BLAST比对,采用MEGA5.0软件构建系统发育树。
1.6 底物选择性分析 分别以苦杏仁苷、栀子苷、水杨苷、芦丁、银杏黄酮等苷类以及龙胆二糖、麦芽三糖、熊果苷、芦丁、海藻糖等几种分别为α、β构型糖苷键糖类为底物检测β-葡萄糖苷酶的底物选择性[13]。用pH 4.8、0.05 mol/L的醋酸-醋酸钠溶液分别配制1% (W/V)浓度的上述苦杏仁苷、栀子苷等11种样品溶液。分别取上述苦杏仁苷、栀子苷等11种样品溶液1.8 mL于具塞试管中,再加入0.2 mL酶溶液,于50 ℃下水解反应30 min后,各加入3 mL DNS试剂,沸水浴10 min,冷却至室温后加水至15 mL,540 nm处测定吸光值。通过DNS法检测不同底物条件下β-葡萄糖苷酶水解底物释放的葡萄糖的量,来计算β-葡萄糖苷酶对底物的选择性。
1.7 酶促反应初速度和Km及Vmax的测定 参照Allison等的方法[14]。根据所测的反应初速度确定的反应时间,用不同浓度(0.2–1.2 mmol/L)的银杏黄酮为底物,在pH 7.0、0.1 mol/L的Tris-HCl缓冲体系中,50 ℃下测定粗酶的活性,计算相应的反应速度,利用米氏方程双倒数法确定Km及Vmax。
1.8 β-葡萄糖苷酶的底物专一性研究及分子对接(docking)[15-16] 以枯草芽孢杆菌产β-葡萄糖苷酶酶序列为探针,用BLAST程序在蛋白质结构数据库(brookhaven protein data bank,PDB)中搜索同源蛋白,使用联配方法找到同源性最高为45%的产β-葡萄糖苷酶模板(PDB code 3zyz.pdb)。
采用Binding site模块和CASTp程序来分析活性口袋的大小。采用Autodock4.0软件,将底物和辅酶因子对接到β-葡萄糖苷酶的活性部位。Autodock是根据遗传算法,基于半经验自由能打分函数[17-18],可以提供处理各种小分子、大分子(包括蛋白质、核酸和糖)的分子间相互作用分析。
2 结果和讨论 2.1 产β-葡萄糖苷酶菌株的筛选 通过富集培养和初筛平板显色,挑选蓝色菌圈相对较大颜色较深的菌落进行进一步纯化和经革兰氏染色镜检为单一菌种后,筛选获得175株微生物。挑选19株形态不同且蓝色菌圈大的进行打孔试验,测量蓝色菌圈的直径,计算水解蓝色菌圈的面积。19株菌水解栀子苷形成蓝色菌圈排名前三的菌株分别为GUXN01、HP60、JP02,蓝色菌圈面积分别为188.0±12.8、173.0±9.3、164.0±15.0 mm2。
2.2 产β-葡萄糖苷酶活力结果 以葡萄糖量为横坐标,吸光度为纵坐标作葡萄糖浓度标准曲线,线性回归方程为y=0.4657x–0.038,相关系数为R2=0.992。结果表明二者线性关系良好。由图 1可知,以黄豆固态发酵产酶,得到水解银杏黄酮苷酶活力较高的芽孢杆菌产β-葡萄糖苷酶活力分别为GUXN01 4.022、HP60 3.332、GUHP86 2.881 U/g。与2.1中打孔试验结果排名有细微的偏差,但是绝大部分都能很好对应,这可能是试验误差所致。
 |
| 图 1 复筛菌株产水解银杏黄酮苷的β-葡萄糖苷酶活力 Figure 1 Activity of beta-glucosidase producing hydrolyzed ginkgo flavonoid glycosides by double screening strain. |
| 图选项 |
2.3 高产水解银杏黄酮苷的β-葡萄糖苷酶菌株GUXN01的鉴定
2.3.1 形态鉴定: 菌株GUXN01在栀子苷-谷氨酸钠显色平板上的单菌落形态和革兰氏染色菌体形态见图 2。由图 2-A可知,菌株GUXN01菌落在栀子苷-谷氨酸钠显色平板上形成圆形、扁平、有黏性的小菌落,其颜色为淡蓝色偏褐色,边缘规则,较湿润,稍隆起,不透明。由图 2-B可知,革兰氏染色菌体呈紫色,为革兰氏阳性菌,杆状。
 |
| 图 2 菌株GUXN01的菌落形态(A)及细胞形态(B) Figure 2 Colony morphology (A) and cell morphology (B) of strain GUXN01. |
| 图选项 |
2.3.2 生理生化鉴定: 对筛选出菌株GUXN01进行生理生化特征试验,结果见表 1。
表 1. 菌株GUXN01生理生化特性 Table 1. Physiological and biochemical characteristics of strain GUXN01
| Biochemical assays | Results |
| Nitrate reduction to nitrite | + |
| Indol | – |
| Acidified glucose | – |
| Arginine di-aqueous enzyme | – |
| Urease | – |
| Hydrolyzed escin (β-glucosidase) | + |
| Hydrolyzed gelatin (protease) | + |
| PNPG β-galactosidase | – |
| Assimilation of glucose | + |
| Assimilated arabinose | + |
| Assimilated mannose | + |
| Assimilation of mannitol | + |
| Assimilation of N-acetyl-glucosamine | + |
| Assimilation of maltose | + |
| Assimilated gluconate | W |
| Assimilated tannic acid | – |
| Assimilation of adipic acid | W |
| Assimilated malic acid | + |
| Assimilation of citric acid | + |
| Assimilation of phenylacetic acid | W |
| +: ositive; -: egative; W: weak. | |
表选项
由表 1可知,菌株GUXN01能发酵葡萄糖酸盐、葡萄糖、甘露糖、阿拉伯糖、甘露醇,不能发酵吲哚、脲酶、β-半乳糖甙酶、癸酸。
2.3.3 16S rDNA序列分析及基因系统发育分析: PCR产物扩增片段送上海生工基因公司双向测序,将双向测序结果通过DNA man软件进行拼接后显示GUXN01菌株16S rDNA全长为1461 bp。BLAST分析结果显示该基因同枯草芽孢杆菌(Bacillus subtilis)的16S rDNA基因相似度达到100%。通过MEGA 5.0软件与同属亲缘关系较近的模式菌株进行同源性分析并构建系统发育树,如图 3所示,系统发育树分析结果表明,菌株GUXN01与枯草芽孢杆菌菌株(Bacillus subtilis strain) (JN862636.1)属于同一个最小分支,结合前面的形态学和生理生化鉴定结果,最后鉴定GUXN01为枯草芽孢杆菌(Bacillus subtilis)。该菌株已保藏至中国典型培养物保藏中心,保藏号为CCTCC M 2018763。
 |
| 图 3 菌株GUXN01的系统发育树 Figure 3 Phylogenetic tree of strain GUXN01. |
| 图选项 |
2.4 底物选择性分析 由图 4可知,菌株GUXN01产的β-葡萄糖苷酶对11种底物有不同的水解能力,对纤维素、海藻糖以及麦芽三糖水解能力相对于银杏黄酮苷、栀子苷的水解能力较弱。虽然菌株所产的β-葡萄糖苷酶对银杏黄酮苷的催化活力稍次于对水杨苷催化活力,这也显示出其对银杏黄酮苷的高催化活力,因为银杏黄酮苷的空间结构比水杨苷复杂得多,与酶的活性位点相接触的空间障碍也大得多,在这种情况下还能表现出高酶活力,显示出此酶对银杏黄酮苷的偏爱性,说明我们前面用银杏叶提取物作为补充的碳源富集培养菌体细胞是成功的,这有利于筛选出对银杏黄酮苷催化活力高的产β-葡萄糖苷酶菌株。检测菌株产酶的底物特异性表明,菌株GUXN01所产的β-葡萄糖苷酶不仅水解海藻糖和麦芽三糖,还水解芦丁和龙胆二糖。水解底物的最终产物都是葡萄糖[19]。枯草芽孢杆菌GUXN01所产的β-葡萄糖苷酶水解栀子苷、芦丁以及银杏黄酮均表现出很高的酶活力,对酶均具有很大的亲和性。以栀子苷,芦丁和龙胆二糖为底物的酶活性分别为2.364、2.613、3.543 U/g。以上均表明菌株GUXN01所产的β-葡萄糖苷酶具有广泛的底物特异性,可水解β构型的的糖苷类以及苷类[20]。还发现所产酶对由α糖苷键连接的D-葡萄糖组成的层状二糖(CMC-Na)有微弱的水解作用,这主要是由于糖苷键构型不合适,β-葡萄糖苷酶应主要是催化β-型糖苷键。但是由β糖苷键连接的D-葡萄糖组成的龙胆二糖、β糖苷键连接的熊果苷水解能力很高,尽管底物链的长度不同,表明菌株GUXN01所产的β-葡萄糖苷酶的底物可以是含有β糖苷键连接的葡萄糖的碳水化合物。
 |
| 图 4 β-葡萄糖苷酶对不同底物的作用能力 Figure 4 The ability of β-glucosidase to act on different substrates. |
| 图选项 |
图 4也表明β-葡萄糖苷酶具有一定的底物选择性,可水解β构型糖苷键物质和苷类,所有结果均表明菌株GUXN01所产的β-葡萄糖苷酶具有广泛的水解活性和相对专一的底物特异性。
2.5 酶促反应初速度和Km及Vmax的测定 由米氏方程推出

2.6 β-葡萄糖苷酶目标蛋白和模板蛋白活性口袋大小的比较 使用Binding site模块和CASTp程序进行搜索,比较目标蛋白和模板蛋白活性口袋的大小。所有程序使用默认参数。结果列于表 2中。
表 2. β-葡萄糖苷酶目标蛋白和模板蛋白活性口袋大小 Table 2. β-Glucosidase target protein and template protein activity pocket size
| Enzyme active pocket | Binding site module | CASTp |
| Template protein | 917 ?3 | 1064 ?3 |
| Target protein | 94 ?3 | 179.2 ?3 |
表选项
从表 2可看出,目标蛋白的活性口袋比参考模板蛋白的小很多,活性口袋变小,底物的专一性就会变强[22]。β-葡萄糖苷酶具有一定的底物选择性,能水解β-糖苷键构型的多羟基物质,这也可能是目标蛋白只催化β构型物质的原因之一。
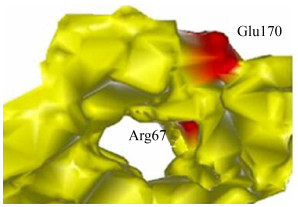
通常研究认为,由于酶的活性位点位于活性中央核心,底物进入活性位点要从通道穿过[23],入口处的氨基酸残基对底物的选择性是尤其重要的,图 5显示β-葡萄糖苷酶与底物结合的入口。从图中看出,Arg67处于入口的底部,与谷氨酸相比,精氨酸作为一种极性氨基酸,其体积相对较小[24],这也有利于像栀子苷、芦丁这样体积较大的底物进入。另外Glu是一种酸性氨基酸,可能会对底物与酶的结合产生一定的阻滞作用[25]。
 |
| 图 5 β-葡萄糖苷酶与底物结合的入口 Figure 5 Entrance of β-glucosidase in combination with substrate. |
| 图选项 |
2.7 β-葡萄糖苷酶和不同配体的相互作用能及打分函数(Kcal/mol) 小分子与生物大分子通过疏水作用力、静电作用力、氢键和范德华作用力相互结合。由于蛋白质结构复杂,对于一个实际体系,小分子配体和蛋白质之间往往同时存在几种作用力。与β-葡萄糖苷酶的相互作用中,氢键数目为正值,Eele为负值说明疏水作用和氢键都存在,同时还存在静电作用。
从表 3可以看出,β-葡萄糖苷酶和水杨苷总的相互作用能为–10.46 Kcal/mol,是较强的非键相互作用,槲皮素-3-O-β-D-葡萄糖苷次之。芦丁是由β-1, 3、β-1, 4葡聚糖组成的复合物,它的相互作用能比麦芽三糖低,这说明芦丁的热力学稳定性要比β-葡萄糖苷酶与麦芽三糖高。打分函数也同样证明了栀子苷和槲皮素-3-O-β-D-葡萄糖苷是β-葡萄糖苷酶的适配体,麦芽三糖却不是。通过分析β-葡萄糖苷酶的底物和辅酶因子的位点,也发现β-葡萄糖苷酶活性口袋极性极强,这有助于水杨苷、栀子苷这样的中性化合物的结合,而不利于像麦芽三糖这样α构型的酸性化合物[26]。
表 3. β-葡萄糖苷酶和不同配体的相互作用能(Kcal/mol)及打分 Table 3. Interaction energy of β-glucosidase and different ligands (Kcal/mol) and scoring
| Ligand | Total interaction energy | Number of hydrogen bonds | Evdw | Eele | Score |
| Salicin | –10.46 | 6 | –51.00 | –0.37 | 7.73 |
| Geniposide | –8.91 | 11 | –10.77 | –1.42 | 10.12 |
| Rutin | –5.41 | 5 | –10.52 | –0.26 | 10.04 |
| Maltotriose | –4.83 | 2 | –8.18 | –1.17 | 6.64 |
| Quercetin-3-O-β-D-glucoside | –8.61 | 4 | –10.81 | –0.35 | 10.38 |
表选项
2.8 β-葡萄糖苷酶与不同底物的分子对接研究 分子对接是一种预测底物进入蛋白质优选方向,了解底物选择性机制的方法。这里我们采用分子对接辅助解释β-葡萄糖苷酶的底物选择性。图 6为β-葡萄糖苷酶与不同底物的分子对接研究结果。
 |
| 图 6 β-葡萄糖苷酶与不同底物的分子对接研究 Figure 6 Molecular docking of β-glucosidase with different substrates. A and B represent the 2D/3D conformation of β-glucosidase and geniposide, respectively; C and D represent β-glucosidase and rutin, respectively docked 2D/3D conformation; E and F represent the 2D/3D conformation of β-glucosidase and quercetin-3-O-β-D-glucoside docking, respectively. |
| 图选项 |
和许多水解酶一样,β-葡萄糖苷酶有底物和辅助因子两个活性位点,目前认为β-葡萄糖苷酶两个催化中心都含有酸性氨基酸[27]Ser和Glu,图 6-A、图 6-B为β-葡萄糖苷酶与栀子苷对接的一个情况,配体分子正好位于受体分子活性位点的位置。底物会接近开放构象下β-葡萄糖苷酶的催化三联体(Ser384-Glu441–Arg169),如图 6-B所示。封闭构象下β-葡萄糖苷酶的盖子结构为一个特殊的loop结构,而大多其他水解酶类的盖子结构为α螺旋结构[28]。这可能也是β-葡萄糖苷酶对栀子苷具有高选择性的原因之一。
为了预测β-葡萄糖苷酶的底物选择性,将反应底物栀子苷和银杏叶提取物的主要成分之一——芦丁,对接至模板的催化口袋中,通过模拟β-葡萄糖苷酶突变体的晶体结构和栀子苷来选择合适的对接位置。栀子苷的对接位置与芦丁对接至β-葡萄糖苷酶晶体结构的位置基本相同,折叠、螺旋、无规则卷曲及活性位点分布大致类似。将其对接复合物用于进一步研究,发现相比于栀子苷,芦丁结合至β-葡萄糖苷酶某些位点的β-折叠和α-螺旋结构相较与栀子苷结合至β-葡萄糖苷酶更短,在图中用蓝色实线标记显示。推测芦丁结合至β-葡萄糖苷酶可能具有更高可能性的呈松散无规则卷曲结构(图 6-B、图 6-D得到了印证),这或许是提高了结构的柔性或可塑性,使底物反应过程中能量消耗更低,分子之间作用力更小,Siddiqui等[29]的研究也印证了这一点,与结构更加紧密的栀子苷相比,β-葡萄糖苷酶与芦丁结合比栀子苷具有更强的催化能力。
对接结果显示,与银杏叶提取物的主要成分芦丁对接过程中,β-葡萄糖苷酶参与相互作用的氨基酸残基有9个(Tyr135、Asn670、Thr668、Gln143、Thr666、Lys656、Trp85、Phe654、Asn88,在图 6-C中用带绿色的标记显示),芦丁被氢键和疏水作用固定在结合口袋中。β-葡萄糖苷酶与栀子苷对接的结果显示,参与相互作用的氨基酸残基仅为5个。表 3结果表明,芦丁的疏水基团主要通过疏水相互作用力及氢键与β-葡萄糖苷酶相互作用,栀子苷和β-葡萄糖苷酶相互作用力则主要为氢键作用。在综合打分中,栀子苷较芦丁分数略高,但是二者酶活力结果显示芦丁对β-葡萄糖苷酶具有更高的亲和力,这可能是酶活测量过程中试验误差所致。
槲皮素-3-O-β-D-葡萄糖苷是银杏黄酮苷的主要成分之一。我们选取β-葡糖苷酶与银杏叶提取物的主要成分槲皮素-3-O-β-D-葡萄糖苷进行对接,以此来探讨β-葡糖苷酶对银杏黄酮具有高底物选择性的原因。
图 6-E、图 6-F显示了受体-配体的相互作用模式,对接结果显示脂肪族氨基酸残基Asn670通过π–π堆积作用而结合于β-葡萄糖苷酶狭长的活性口袋中。槲皮素的2-OH和4-OH上的H原子分别与Asn670上的O原子形成氢键,7-OH上的H原子和O原子分别与Lys656上的O原子和Thr668的H原子形成氢键。在分子对接图中,槲皮素- 3-O-β-D-葡萄糖苷分子高度扭曲,原子间的排列也不规整。此外,配体被Phe669 (疏水)、Ile139 (疏水)、Phe654 (疏水)、Val87 (疏水)、Ala655 (疏水)、Trp85 (疏水)、Gln143 (亲水,极性不带电荷)等疏水作用残基包围,构象稳定。对接研究表明,槲皮素-3-O-β-D-葡萄糖苷的疏水基团主要通过疏水作用力及氢键与β-葡萄糖苷酶相互作用,几种作用力使底物槲皮素-3-O-β-D-葡萄糖苷牢牢锁定在β-葡萄糖苷酶的狭长口袋中。以上结果均显示,β-葡糖苷酶对配体槲皮素-3-O-β-D-葡萄糖苷具有很好的亲和性。
与芦丁的对接结果相比,β-葡萄糖苷酶参与槲皮素-3-O-β-D-葡萄糖苷疏水作用的氨基酸残基为7个(在图 6-E中用红色的带有辐射状短弧线表示),而参与芦丁疏水作用的残基仅为5个。此外,从图 6-C、图 6-E可以看出疏水作用残基在β-葡萄糖苷酶与槲皮素-3-O-β-D-葡萄糖苷对接的四周分布更为均匀,底物被疏水基团紧密包围,而以芦丁为底物的参与疏水作用的残基分布较槲皮素- 3-O-β-D-葡萄糖苷分散,且留下一个较大的缺口,这可能也是β-葡萄糖苷酶对槲皮素-3-O-β-D-葡萄糖苷具有更高选择性的原因之一。综合表 3的β-葡萄糖苷酶和不同配体的相互作用能及打分函数也可以看出,槲皮素-3-O-β-D-葡萄糖苷的相互作用能较芦丁更低,构象更稳定,综合打分也可以看出β-葡萄糖苷酶对槲皮素-3-O-β-D-葡萄糖苷的综合打分较芦丁更高。
打分函数和分子对接从不同角度解释了GUXN01所产β-葡萄糖苷酶为什么对不同底物具有不同的选择性和催化活力。β-葡萄糖苷酶对不同底物的选择性和亲和性主要是由酶分子的结构,特别是其活性中心的结构以及底物分子的结构所决定的[30]。这对于后续如何通过适当改变酶空间结构提高此酶对目标底物的催化活性具有启示意义。
3 结论 以贵州传统发酵豆制品为来源,分离筛选得到对银杏黄酮苷具高水解酶活的产β-葡萄糖苷酶菌株GUXN01。其在37 ℃、pH 7.0培养72 h的固态发酵条件下,所产酶液对银杏黄酮苷具有高水解活性。通过对该菌株的细胞形态、菌落形态、生理生化特征、16S rDNA序列分析以及系统发育分析,鉴定该菌株为枯草芽孢杆菌。分子对接辅助阐释了枯草芽孢杆菌产β-葡萄糖苷酶对银杏黄酮苷和其他糖苷类具有不同亲和性和选择性的原因主要是酶结构和底物分子结构的相互作用力的差异导致的。研究微生物产对银杏黄酮苷具高水解酶活的β-葡萄糖苷酶,可为更好获取和摄入银杏黄酮苷元提供参考。通过探究β-葡萄糖苷酶对不同底物的选择性,对研究生物水解转化将具有指导意义。
References
| [1] | Li XX, Bai YG, Hua C, Ma R, Shi PJ, Luo HY, Yao B. Effect of N-glycosylation on enzymatic properties of β-glucosidase from Talaromyce leycettanus. Acta Microbiologica Sinica, 2019, 59(1): 37-47. (in Chinese) 李新新, 柏映国, 华晨, 马锐, 石鹏君, 罗会颖, 姚斌. 毕赤酵母表达的嗜热蓝状菌β-葡萄糖苷酶N-糖基化修饰的作用与功能. 微生物学报, 2019, 59(1): 37-47. |
| [2] | Nelson CE, Rogowski A, Morland C, Wilhide JA, Gilbert HJ, Gardner JG. Systems analysis in Cellvibrio japonicus resolves predicted redundancy of β-glucosidases and determines essential physiological functions. Molecular Microbiology, 2017, 104(2): 294-305. |
| [3] | Singhania RR, Patel AK, Sukumaran RK, Larroche C, Pandey A. Role and significance of beta-glucosidases in the hydrolysis of cellulose for bioethanol production. Bioresource Technology, 2013, 127: 500-507. |
| [4] | Zhou LH, Li Y. Wine fermentation properties of indigenous saccharomyces cerevisiae KDLYS9-16 with high β-D-glucosidase activity. Food Science, 2017, 38(6): 123-129. (in Chinese) 周立华, 李艳. 自选高产β-D-葡萄糖苷酶酿酒酵母KDLYS9-16的酿酒性能. 食品科学, 2017, 38(6): 123-129. |
| [5] | Feng W, Hu XY, Ma MN, Guo M, Lu FP, Li Y. The screening of β-glycosidase-producing strain and the transforming of resveratrol. Biotechnology Bulletin, 2017, 33(11): 130-135. (in Chinese) 冯薇, 胡小妍, 马明娜, 郭萌, 路福平, 李玉. 产β-葡萄糖苷酶细菌的筛选及转化白藜芦醇的研究. 生物技术通报, 2017, 33(11): 130-135. |
| [6] | 王秀征.固定化β-葡萄糖苷酶及其在烷基糖苷合成中的应用.江南大学硕士学位论文, 2009. http://cdmd.cnki.com.cn/article/cdmd-10295-2009250356.htm |
| [7] | Tanimura K, Takashima S, Matsumoto T, Tanaka T, Kondo A. 2, 3-Butanediol production from cellobiose using exogenous beta-glucosidase-expressing Bacillus subtilis. Applied Microbiology and Biotechnology, 2016, 100(13): 5781-5789. |
| [8] | Hosoda R, Horio Y, Shimoda K, Hamada M, Hamada H, Hamada H. Regioselective hydroxylation and glucosylation of flavanones with cultured plant cells of Eucalyptus perriniana. Natural Product Communications, 2013, 8(7): 905-906. |
| [9] | Hsieh MC, Graham TL. Partial purification and characterization of a soybean β-glucosidase with high specific activity towards isoflavone conjugates. Phytochemistry, 2001, 58(7): 995-1005. |
| [10] | Suzuki H, Takahashi S, Watanabe R, Fukushima Y, Fujita N, Noguchi A, Yokoyama R, Nishitani K, Nishino T, Nakayama T. An isoflavone conjugate-hydrolyzing β-glucosidase from the roots of soybean (Glycine max) seedlings. The Journal of Biological Chemistry, 2006, 281(40): 30251-30259. |
| [11] | Cui ML, Yang HY, He GQ. Apoptosis induction of colorectal cancer cells HTL-9in vitro by the transformed products of soybean isoflavones by Ganoderma lucidum. Journal of Zhejiang University-Science B, 2017, 18(12): 1101-1112. |
| [12] | Stellmach B. Bestimmungsmethoden enzyme. Qian JY, trans. Beijing: China Light Industry Press, 1992: 102-119. (in Chinese) 施特尔马赫.酶的测定方法.钱嘉渊, 译.北京: 中国轻工业出版社, 1992: 102-119. |
| [13] | Shi PJ, Tian J, Yuan TZ, Liu X, Huang HQ, Bai YG, Yang PL, Chen XY, Wu NF, Yao B. Paenibacillus sp. strain E18 bifunctional xylanase-glucanase with a single catalytic domain. Applied and Environmental Microbiology, 2010, 76(11): 3620-3624. |
| [14] | Allison SD, Romero-Olivares AL, Lu Y, Taylor JW, Treseder KK. Temperature sensitivities of extracellular enzyme Vmax and Km across thermal environments. Global Change Biology, 2018, 24(7): 2884-2897. |
| [15] | Ma HY, Ning J, Ge GB, Yang L, Hao DC. Research progress of human cytochrome P4502J2 and its ligands. Acta Pharmaceutica Sinica, 2017, 52(1): 26-33. (in Chinese) 马虹莹, 宁静, 葛广波, 杨凌, 郝大程. 人细胞色素P450酶2J2的功能及其配体研究进展. 药学学报, 2017, 52(1): 26-33. |
| [16] | van der Spoel D, Lindahl E, Hess B, Groenhof G, Mark AE, Berendsen HJC. GROMACS:fast, flexible, and free. Journal of Computational Chemistry, 2005, 26(16): 1701-1718. |
| [17] | 黄艺佳.核酸-配体分子对接方法的研究.华东理工大学硕士学位论文, 2014. |
| [18] | Zhao LQ, Xiao JH, Li S. Molecular docking for in structure-based drug designing. Acta Biophysica Sinica, 2002, 18(3): 263-270. (in Chinese) 赵丽琴, 肖军海, 李松. 分子对接在基于结构药物设计中的应用. 生物物理学报, 2002, 18(3): 263-270. |
| [19] | Zhuang XS, Wang SR, Yuan ZH, Luo ZY, Wu CZ, Cen KF. Analysis of cellulose hydrolysis products in extremely low acids. Transactions of the Chinese Society of Agricultural Engineering, 2007, 23(2): 177-182. (in Chinese) 庄新姝, 王树荣, 袁振宏, 骆仲泱, 吴创之, 岑可法. 纤维素超低酸水解产物的分析. 农业工程学报, 2007, 23(2): 177-182. |
| [20] | He JZ, Shao P, Meng XH, Sun PL. Analysis of structural characteristics of polysaccharide from Ganoderma lucidum. Chinese Journal of Analytical Chemistry, 2010, 38(3): 372-376. (in Chinese) 何晋浙, 邵平, 孟祥河, 孙培龙. 灵芝多糖的结构特征分析. 分析化学, 2010, 38(3): 372-376. |
| [21] | 孙慧慧.定点突变改善海栖热袍菌β-葡萄糖苷酶水解槲皮素糖苷底物专一性的研究.南京师范大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10319-1016066390.htm |
| [22] | 艾义新, 卢俊瑞, 辛春伟, 穆江蓓, 杨旭芸, 张贺. 计算机模拟三氯生对FabI活性口袋及Loop区的调控机制. 物理化学学报, 2014, 30(3): 559-568. |
| [23] | Milne JLS, Wu XW, Borgnia MJ, Lengyel JS, Brooks BR, Shi D, Perham RN, Subramaniam S. Molecular structure of a 9-MDa icosahedral pyruvate dehydrogenase subcomplex containing the E2 and E3 enzymes using cryoelectron microscopy. The Journal of Biological Chemistry, 2006, 281(7): 4364-4370. |
| [24] | Langlet J, Gresh N, Giessner-Prettre C. A molecular mechanics/continuum reaction field investigation of the interactions between polar amino acid side chains in water and organic solvents. Biopolymers, 1995, 36(6): 765-780. |
| [25] | Kato S, Oikawa T. A novel bifunctional amino acid racemase with multiple substrate specificity, maly from Lactobacillus sakei LT-13:genome-based identification and enzymological characterization. Frontiers in Microbiology, 2018, 9: 403. |
| [26] | Ferrer M, Cruces MA, Plou FJ, Bernabé M, Ballesteros A. A simple procedure for the regioselective synthesis of fatty acid esters of maltose, leucrose, maltotriose and n-dodecyl maltosides. Tetrahedron, 2000, 56(24): 4053-4061. |
| [27] | 夏玉林. β-葡萄糖苷酶基因的筛选及性质分析.广东药科大学硕士学位论文, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10573-1016730523.htm |
| [28] | Buchko GW, Litvinova O, Robinson H, Yakunin AF, Kennedy MA. Functional and structural characterization of DR_0079 from deinococcus radiodurans, a novel nudix hydrolase with a preference for cytosine (deoxy) ribonucleoside 5'-Di-and triphosphates. Biochemistry, 2008, 47(25): 6571-6582. |
| [29] | Siddiqui KS, Cavicchioli R. Cold-adapted enzymes. Annual Review of Biochemistry, 2006, 75: 403-433. |
| [30] | Florindo RN, Souza VP, Manzine LR, Camilo CM, Marana SR, Polikarpov I, Nascimento AS. Structural and biochemical characterization of a GH3β-glucosidase from the probiotic bacteria Bifidobacterium adolescentis. Biochimie, 2018, 148: 107-115. |
