颜朗1, 张义正2, 清源1, 方志荣1, 赖先军1


1. 西昌学院农业科学学院, 四川马铃薯高等学校重点实验室, 四川凉山 615013;
2. 四川大学生命科学学院, 四川省分子生物学及生物技术重点实验室, 四川成都 610064
收稿日期:2019-03-28;修回日期:2019-07-04;网络出版日期:2019-08-15
基金项目:四川省科技厅应用基础项目(2019YJ0546);四川省教育厅资助项目(17ZB0398);西昌学院高层次人才引进科研启动项目(50180108)
*通信作者:赖先军, Tel/Fax:+86-834-2580688;E-mail:laixianj@hotmail.com.
摘要:[目的] 陆生植物根际环境与土壤中的微生物菌群关系密切,其根际微生物群落动态极可能直接影响着植物健康及养分高效利用。虽然根际益生菌已被证实可用于提高作物生产力,但由于缺乏对这些菌群组成动态变化规律的认识了解,它们的开发受到限制。研究马铃薯全生育期根际菌群的动态变化规律,探讨根际菌群变化与马铃薯发育时期的相关性,为针对马铃薯不同生长时期开发专用生物益生菌肥奠定理论基础。[方法] 本研究着眼于马铃薯田间全生命周期微生物组动态变化,通过Illumina MiSeq高通量测序技术对不同时间点马铃薯根际细菌16SrRNA基因V3-V4区和真菌ITS区测序并对操作分类单位(OTU)进行聚类,分析样品间微生物群落的多样性特征,并通过机器学习的方法建立模型,将根际菌群与田间马铃薯发育时间相关联。[结果] 根际菌群在马铃薯各个发育阶段随时间变化明显,营养生长阶段的微生物群落结构发生了显著变化,随着结薯期的开始逐渐稳定,直到块茎成熟后期根际菌群再次出现较大变化,且在不同施肥处理间呈现较大差异。进一步基于模型挖掘了与马铃薯发育时间相关联的22个特征细菌类群和16个特征真菌类群,其中苗期和结薯末期的特征类群分别为梭菌(Clostridium)和放线菌(Actinobacteria)。[结论] 马铃薯的生长发育时期是影响根际微生物群落组成的主要因素,益生菌肥的添加主要影响马铃薯结薯末期的细菌微生物菌群结构。
关键词:马铃薯根际微生物组生育期标记群落动态
Community rhythms of rhizosphere microbiome during the whole life cycle of potato
Lang Yan1, Yizheng Zhang2, Yuan Qing1, Zhirong Fang1, Xianjun Lai1


1. Sichuan Key Laboratory of Potatoes, College of Agriculture Science, Xichang College, Liangshan 615013, Sichuan Province, China;
2. Sichuan Key Laboratory of Molecular Biology&Biotechnology, College of Life Sciences, Sichuan University, Chengdu 610064, Sichuan Province, China
Received: 28 March 2019; Revised: 4 July 2019; Published online: 15 August 2019
*Corresponding author: Lai, Tel/Fax:+86-834-2580688;E-mail:laixianj@hotmail.com.
Foundation item: Supported by Application Foundation Project of Sichuan Science and Technology Department (2019YJ0546), by Sichuan Provincial Department of Education Funded Project (17ZB0398) and by Xichang College High-level Talents Introduction Research Project (50180108)
Abstract: [Objective] The rhizosphere environment of terrestrial plants is closely related to the microbe in the soil. Accumulating evidences indicate that dynamics of rhizosphere microbial community directly affect plant health and nutrients utilization. Although rhizosphere microbes are useful for increasing crop productivity, their development has been limited due to a lack of understanding of the dynamics of microbiome. The dynamic changes of rhizosphere microbiome in the whole growth period of potato were studied, and the correlation between rhizosphere biomarkers and potato developmental stage was discussed here. This study will lay foundation for the development of special bio-probiotic fertilizer for different developmental stages of potatoes. [Methods] This study focused on the microbial dynamics of the whole life cycle of potato in field. The Illumina MiSeq high-throughput sequencing technology was used to sequence the 16S rRNA gene V3-V4 region and the fungal ITS region of potato rhizosphere microbe at different time points and to classify the OTUs, in order to analyze the diversity characteristics of microbial communities between samples, and we also established a model through machine learning to correlate rhizosphere microbes with potato development stages in the field. [Results] The rhizosphere microbiome changed significantly with developmental stages. The microbial community structure in the vegetative growth stage changed significantly and it gradually stabilized at beginning of the reproductive stage, and the rhizosphere microbiome varied a lot in the late stage of tuber maturity. In addition, 22 bacterial biomarkers and 16 fungal biomarkers associated with potato development stages were identified based on the model, which are the biomarker Clostridium in seedling stage and Actinobacteria in tuber matured stage. [Conclusion] The growth and development period of potato is the main factor affecting the composition of rhizosphere microbial community. The addition of probiotic fertilizer has a certain effect on maintaining and stabilizing the rhizosphere bacterial community in the late development stage.
Keywords: potatorhizosphere microbemicrobial diversityrhizosphere microbiomebiomarkerscommunity dynamics
动植物内外环境中都存在着数量庞大且种类繁多的微生物群落(微生物组)。陆生植物根系微生物组随着植物生命周期的变化规律对植物健康非常重要,特别是与农作物连作、轮作、营养高效利用等问题密切相关[1]。根际是一个独特的环境,是受植物根系和根系分泌物直接影响的薄层土壤,植物和土壤微生物在这里发生着广泛且复杂的相互作用。一方面,根际微生物对促进作物生长、减少病原微生物侵害以及维持根际微生态平衡等具有重要作用,反过来,植物为根际微生物提供根系分泌物作为生长基质与信号分子[2-3]。随着高通量测序的发展,根际微生物组已在几种模式植物和作物中广泛研究,如拟南芥、水稻和玉米[4-6]。在陆生植物中,根际微生物主要与变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteriodetes)和厚壁菌门(Firmicutes)相关[7]。研究表明,根际微生物组受到植物基因型和环境因素的影响,包括土壤类型、地理位置、栽种方式等[1]。然而,我们对田间条件下根际微生物组在植物全生命周期中的变化过程知之甚少。
与研究土壤中根际微生物群落组成不同,根际微生物的定殖是一个动态过程。最初的细菌群落与其土壤来源相似,随着植物的生长变得更具宿主特异性[8]。目前的证据支持植物从土壤中召集根际细菌的两步选择假设。首先,根系分泌物和细胞壁促进了一定比例的土壤微生物的生长,从而导致根际细菌群落的转变。其次,宿主-微生物相互作用对根部细菌群落的组成进行了微调[5, 9]。在一年生禾本科植物和大豆研究中,根际微生物群落在整个生长周期中变化,其趋势是土壤来源的微生物菌群与特定的某些微生物菌群逐渐分化[10-11]。在多年生植物小花南芥(Arabis alpine)的一项研究显示,持续28周的温室实验中3个时间点的根际微生物群落显著不同[12]。在水稻中,苗期的根际微生物菌群与其他生长阶段的根系微生物群结构显著不同。该实验中的温室数据显示,13日龄的植株根际微生物菌群结构接近于42日龄植株的微生物菌群的丰度和多样性[5]。另有研究在拟南芥和水稻中发现,现花期和结实期的根际微生物组间没有显著差异[13-14]。然而,这些研究是在温室条件下进行的,田间条件根际微生物组的动态变化情况鲜有报道。虽然人们已知根际微生物与提高作物生产力和抗病性相关,但由于缺乏对这些群落组成动态的了解,因此限制了专用微生物菌剂的开发。
马铃薯是四川凉山州广大彝区世代相传的主食作物,也是我国西南贫困山区脱贫致富的优势作物。随着栽培面积的不断扩大,马铃薯在全生育期中遭遇的幼苗生长发育不良、产量降低、畸形薯比例增高、病虫害严重等问题日益突出。已有研究指出,土壤中微生物数量变化直接或间接影响着土壤养分的吸收和转化,根际微生物种群结构的失衡是导致土壤质量下降、马铃薯等作物减产和病害发生的主要原因。例如有研究报道了土壤微生物组与马铃薯疮痂病发生间的相互关系,表明薯表微生物的群落功能影响着疮痂病的发生。虽然目前国内外对马铃薯根系分泌物影响根际微生物的研究报道较少,但这些研究均表明根际微生物组对马铃薯高效增产、病虫害及连作障碍防控等问题具有重要意义。马铃薯在全生育期中经历了几个关键的生育时期,即出苗期(块茎出苗至顶端现蕾)、块茎形成期(地下茎的顶端相继膨大形成块茎)、淀粉积累期(地上茎叶生长基本停止,基部叶片自下而上逐渐衰老变黄枯萎,块茎大小基本定型)和成熟收获期(地上、地下部分均已停止生长)。本文通过对马铃薯在整个生命周期不同生育时期的根际微生物组进行细菌16S rRNA基因V3-V4区和真菌ITS区的高通量测序,研究马铃薯根际微生物菌群随时间变化的规律,为针对不同的马铃薯不同生长发育时期开发专用有益菌剂奠定理论基础。
1 材料和方法 1.1 马铃薯田间试验及样品采集 本试验选取马铃薯代表性品种米拉(Solanum tuberosum cv. mira)为实验材料,以追踪其在整个生命周期中根际微生物群落的变化过程。试验地点为四川省凉山彝族自治州冕宁县西昌学院马铃薯科研繁种基地(坐标:东经102.158825,北纬28.553074),试验时间为2018年3–8月。试验地为地势平坦且规整的农用地,前作为玉米,土质为轻质壤土,基础土壤样品碱解氮为57.08 mg/kg、有效磷30.69 mg/kg、速效钾174.6 mg/kg、有机质21.92 g/kg。实验采取3种施肥处理以分析不同施肥方式对马铃薯根际微生物组的影响。对照组采用有机肥+复合肥+油枯作底肥,混合肥料样品(以下简称底肥)的养分为碱解氮1.36 g/kg、有效磷1.08 g/kg、速效钾3.82 g/kg、有机质148.32 g/kg,底肥施用量为30000 kg/hm2。两个实验组则在对照组底肥用量基础上增施不同的益生菌拌种剂,其一为马铃薯专用菌肥,施用量为75 kg/hm2,主要活性成分为精制有机质、中微量元素以及固氮菌、磷钾菌、乳酸菌、酵母菌、植物促生菌等,该实验组中总肥料养分含量为碱解氮1.59 g/kg、有效磷1.24 g/kg、速效钾4.28 g/kg、有机质154.13 g/kg;其二为自制植物促生菌(PGPR),其主要活性成分为枯草芽孢杆菌(Bacillus subtilis)、地衣形芽孢杆菌(Bacillus licheniformis)以及多黏类芽孢杆菌(Paenibacillus polymyxa),PGPR按照150 kg/hm2与底肥混施,总肥料养分为碱解氮1.35 g/kg、有效磷1.10g/kg、速效钾4.03 g/kg、有机质151.2 g/kg。土壤碱解氮含量采用碱解扩散法测定,全氮含量采用半微量凯氏法测定;有效磷含量采用碳酸氢钠浸提-钼锑抗比色法测定;速效钾含量采用乙酸铵浸提-火焰光度法测定,土壤有机质含量采用重铬酸钾氧化法测定[15]。对照组和实验组在同一地块中随机相邻设置,每组设3个重复小区。
首先于3月22日播种当天采用多点混合采样法对基础土壤和各组肥料进行取样,然后各小区以均等施肥量施底肥。为了避免种薯内生菌和表面相关的微生物影响,将种薯表面用无菌水冲洗干净,用1%次氯酸钠溶液消毒10 min,70%乙醇浸泡30 s后立刻除去乙醇,无菌水冲洗5次,避光晒干后播种。采用间隔取样法对每个生长点取根际土样,即小区内每隔4株植株取样,取5株混合为一个重复。取样时期为马铃薯全生育期内4个标志性时期,即苗期(4月12日,此时马铃薯植株第6–8片叶已展平)、块茎形成期(5月12日,此时主茎封顶叶已展平,地下块茎已具雏形)、淀粉积累期(6月12日,此时开始侧生茎叶生长,叶面积逐渐达到最大值)和块茎成熟期(7月12日,此时植株茎叶开始衰老变黄,出现消苗现象)。采用破坏性取样法将马铃薯整株挖出,不要伤害根系,抖落根系土壤表层未分解的凋落物层后用无菌刷刷取根际区域约1 mm的紧密粘附在根表面的土壤。每个样品采集5 g左右的根际土壤并搜集至50 mL无菌离心管中带回,于实验室中过2 mm筛后分装至冻存管中迅速置于液氮中冷冻3–4 h,冰上备用或转移至–80 ℃长期保存。
1.2 土壤样品总DNA提取与测序 样品总DNA提取采用美国MOBIO公司的Power Soil DNA Isolation Kit试剂盒。称取0.5 g保存于–80 ℃冰箱中的土壤样品,使用Precellys缓冲液(Bertin Technologies,France)将样品在7200 r/min下均质化30 s 2次,并按试剂盒说明书过程提取总DNA。通过超微量分光光度计(Nanodrop 2000)检测DNA浓度≥20 ng/mL,OD260/280为1.8-2.0,OD260/230为1.8-2.0即为合格。提取的总DNA稀释至3.5 ng/μL并保存于在–20 ℃条件下用于后续PCR扩增。用通用引物338F (5′-ACTCCTACGGGAGGCAGCA-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)扩增细菌16S rRNA基因的V3-V4区域,采用特异性引物扩增真菌ITS1区(5′-CTTGGTCATTTAGAGG AAGTAA-3′,5′-GCTGCGTTCTTCATCGATGC-3′),并采用Illumina MiSeq 2×300测序平台对PCR扩增产物进行双端测序。测序部分委托北京百迈客生物科技有限公司完成。测序原始数据已提交至中国科学院北京基因组研究所建立的组学原始数据归档库(Genome Sequence Archive,http://gsa.big.ac.cn/),数据访问编号为CRA001577。
1.3 数据质控与分析 对测序原始数据进行质控(Trimmomatic软件,version 0.33)和软件拼接(FLASH软件,version 1.2.11)[16-17],过滤掉低质量的Reads序列并将得到的双端序列数据拼接成Tags,同时对拼接效果进行质控,主要包括去除低质量Tags和嵌合体(UCHIME软件,version 8.1)[18]。使用QIIME (version 1.8.0)[19]软件中的UCLUST对有效Tags在97%的相似度水平下聚类成为操作分类单元(OTU,Operational Taxonomic Units),并以测序总序列数的0.005%作为阈值过滤OTU[20]。使用R/BioConductor包edgeR中trimmed mean of M values (TMM)方法对OTU矩阵进行标准化[21]。基于Silva[22](细菌)和UNITE[23] (真菌)分类学数据库对OTU进行分类学注释(RDP Classifier软件,version 2.2,置信度阈值为0.8)[24],得到每个OTU对应的物种分类信息,进而在各水平统计各样品群落组成。
基于R语言包中负二项式广义线性模型进行差异的OTU丰度分析。首先使用calcNormFactors函数获得标准化因子,然后使用GLMCommonDisp和GLMTagwiseDisp函数估计负二项广义线性模型的常规和标记离散。通过glmFit函数拟合OTU读数负二项式广义对数线性模型以测试OTU丰度的差异是否显著,并通过多次测试使用0.05的假阳性率校正相应的P值。通过cor()函数计算Pearson相关系数,使用每个时间点每个条件下3个根际微生物群落数据的平均值,并使用corrplot包进行可视化。通过vegan包中的adonis()函数进行微生物菌群的比较。
为了获得马铃薯生命周期中微生物分类群的最佳标记方法,我们使用R包中默认参数对纲分类水平下细菌类群相对于生长时间的丰度进行了回归(R包:age‘randomForest’,ntree=1000,默认参数mtry=p/3)。随机森林是一种用于分类或回归的机器学习方法,能够通过重新组合样本和特征,基于多个弱分类器投票获得较准确的分类器。基于单分类树的原则,随机森林法产生具有不同样本和不同初始变量的多决策树[21]。每棵树都给出了一个分类,多个树选择具有最多票数的分类来执行最终预测[7]。根据分类群列表中特征显著性顺序进行100次迭代。使用R包‘randomForest’中的rfcv()函数实现10倍交叉验证来确定标记分类群的数量。当细菌中使用22个分类群,真菌中使用16个分类群时,交叉验证误差最小,因此选择22个细菌分类群和16个真菌分类群作为与马铃薯生长发育时间相关的生物标记,生物标记的丰度水平通过R包中的Pheatmap函数绘制的热图进行展示。
2 结果和分析 2.1 马铃薯全生育期内土壤养分元素变化规律 我们对三种施肥处理下马铃薯种植前后的土壤养分进行了测定。与种植前的基础土壤养分含量相比,收获期混施了马铃薯专用菌肥组中碱解氮增加34.96 mg/kg (P=5.99e-06,T检验,下同),有效磷增加7.19 mg/kg (P=5.5e-03),速效钾增加182.27 mg/kg (P=8.42e-06),有机质增加13.89 g/kg (P=2.36e-06);收获期混施了PGPR的实验组中碱解氮增加35.2 mg/kg (P=6.70e-06),有效磷增加5.07 mg/kg (P=1.20e-02),速效钾增加153.19 mg/kg (P=1.14e-04),有机质增加14.36 g/kg (P=7.90e-04);在收获期对照组中,碱解氮增加22.05 mg/kg (P=5.39e-05),有效磷增加4.79 mg/kg (P=8.70e-03),速效钾增加120.57 mg/kg (P=3.09e-04),有机质增加10.64 g/kg (P=1.57e-03)。总体来说,收获期的实验组土样相对于对照组来说土壤养分变化差异显著,马铃薯专用菌肥组中碱解氮增加12.91 mg/kg (P=4.82e-06),有效磷增加2.4 mg/kg (P=4.61e-03),速效钾增加61.7 mg/kg (P=2.36e-04),有机质增加3.25 g/kg (P=1.59e-02);收获期混施了PGPR的实验组中碱解氮增加13.15 mg/kg (P=5.67e-05),有效磷增加0.28 mg/kg (P=0.46),速效钾增加32.62 (P=1.42e-03),有机质增加3.72 g/kg (P=6.84e-03)。
2.2 马铃薯生命周期中根际微生物组的变化规律 基于细菌16S rRNA基因V3-V4和真菌ITS1区高通量测序,我们对马铃薯全生育期5个生长点根际微生物群落多样性进行分析,即取样播种当天的基础土壤和肥料样品(T0期,0 d)、马铃薯苗期(T1期,20 d)、块茎形成期(T2期,50 d)、淀粉积累期(T3期,80 d)、成熟收获期(T4期,110 d)根际土壤(图 1-A)。本实验共计采集样品48个,细菌16S rRNA基因测序共获得3702155对双端序列(Reads),经Reads拼接过滤后得到3190222条高质量序列(Clean tags),每个样本中Clean tags数为46765–77084;真菌ITS测序共获得3840757对Reads,经拼接过滤后共产生3443975条Clean tags,每个样本中Clean tags数为69795–72969。
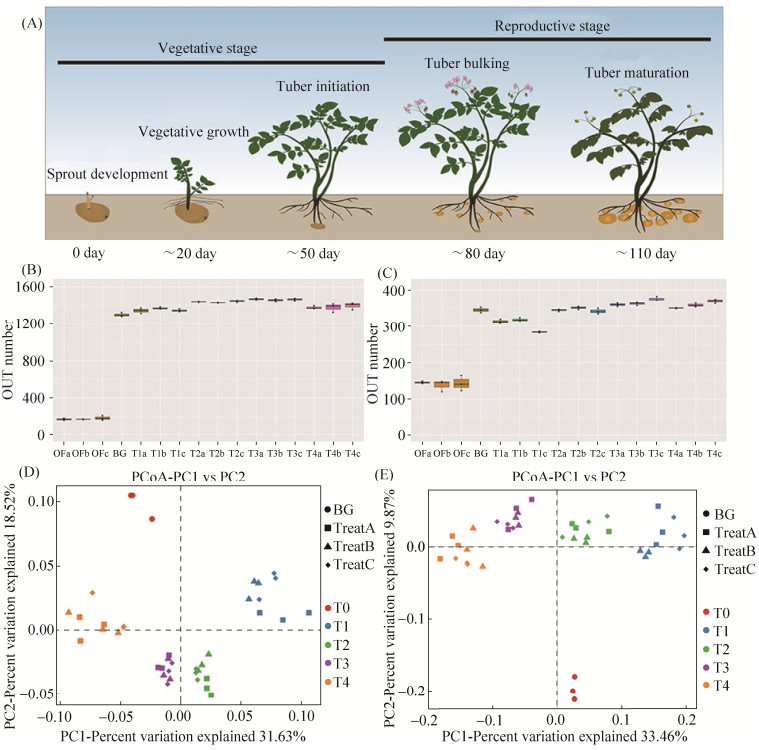 |
| 图 1 马铃薯全生育期根际微生物菌群多样性 Figure 1 Diversity of rhizosphere microbiome in the whole life cycle of potato. A: Schematic diagram of phenotypes of different growth stages of potato, vegetative stage includes sprout development, vegetative growth and tuber initiation; reproductive stage includes tuber bulking and tuber maturation. B: Total number of bacterial OTUs in different samples (abbreviations OF: organic fertilizer; BG: background; T1–T4: time series of T1–T4; TreatA (a): only organic fertilizer; TreatB (b): organic fertilizer mix with commercial bacterial fertilizer; TreatC(c): organic fertilizer mix with PGPR). C: Total number of rhizosphere fungi OTUs in different samples, the abbreviations are identical with B. D: Principal coordinate analysis based on bacterial diversity Bray-Curtis distance. E: Principal coordinate analysis based on Bray-Curtis distance of fungal diversity. |
| 图选项 |
质控后的序列依据97%的序列相似性聚类获得细菌OTU数1565个,基础土样和肥料中分别获得了1298和179个,不同生长期根际土壤中OTU数量在1312和1479个之间(图 1-B)。使用M值方法对每个样本中OTU数量进行标准化,所有样本中OTU的覆盖率均 > 99.5%,说明该测序量能够反映样本中微生物群落的真实情况。使用相同方法,我们通过聚类共获得了470个真菌有效OTU,基础土样和肥料中分别获得了345和142个,不同生长点根际土壤中OTU数量在281–382个之间(图 1-C),所有OTU的覆盖率均 > 99.9%。
我们比较了不同生长时期和不同施肥方式对根际微生物群落结构的影响,发现根际微生物菌群在马铃薯各个发育阶段随着时间变化明显。在基于细菌多样性Bray-Curtis距离的主坐标分析(principal coordinate analysis,PCoA)中,基础土壤样品聚集在一起,根际样品远离基础土样且在第一个坐标轴上随发育阶段不同而区分开来(图 1-D);在真菌多样性PCoA分析中同样呈现出根际样品远离基础土样且在第一主坐标上的随发育阶段不同而分隔的趋势(图 1-E)。该结果表明本研究中马铃薯的生长发育阶段是影响根际微生物群落组成的主要因素,且该因素对根际微生物组的影响大于不同施肥处理对其造成的影响。
2.3 不同施肥方式对结薯末期根际微生物菌群结构的影响 我们基于Pearson相关性系数分析了不同施肥方式下马铃薯各生长时期根际微生物组两两之间的相关性(图 2)。随着时间的推移,根际微生物菌群结构在薯块形成后的T2期开始稳定,且所有生长期中根际微生物组均与基础土样中微生物组的相关性较低,而与肥料中的微生物相关性较高,表明根际微生物在马铃薯全生长期中都会受到肥料中微生物菌群的影响,且这种影响大于基础土壤中微生物菌群对植株根际的影响。两两间的相关性分析还显示,不同的施肥方式主要影响了马铃薯结薯末期根际微生物菌群结构,主要表现为对照组中根际细菌结构在T4期出现了较大改变,T4期与其他时期的菌群相关性均较低,而添加专用菌肥和益生菌的实验组中则延续了T3期的根际细菌群落结构(图 2A–C)。我们从真菌菌群结构变化中证实了上述结论,在3种施肥方式下,T4期中真菌菌群结构均发生了较大改变,这是由于实验组中添加的益生菌均是细菌来源,对真菌的菌群结构影响甚微(图 2-D–F)。
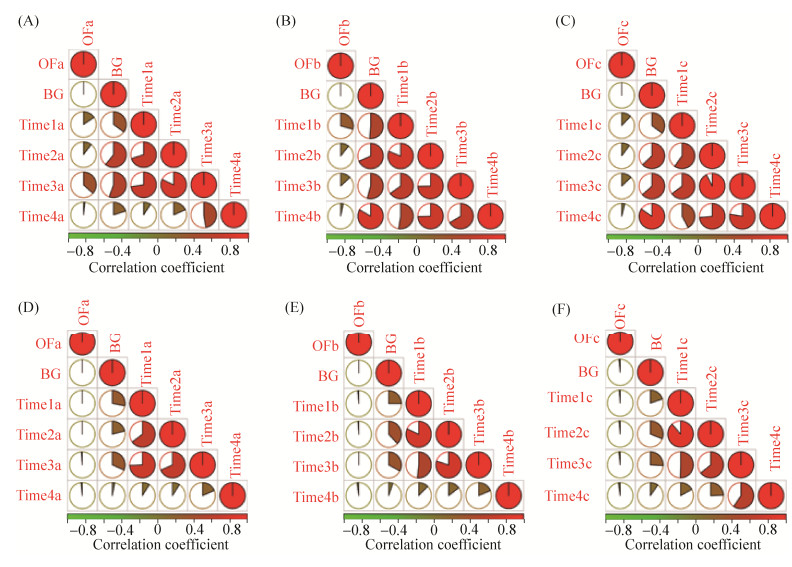 |
| 图 2 马铃薯全生育期不同时间点根际微生物群落间的相关性 Figure 2 Correlation of rhizosphere microbiome between different time point. A–C: Correlation of bacterial community in rhizosphere under three fertilization treatments, pie slice and the color represent the value of Pearson correlation coefficient. D–F: Correlation of fungal community in rhizosphere under three fertilization treatments, pie slice and the color represent the value of Pearson correlation coefficient. Abbreviations OF: organic fertilizer; BG: background; Time1–Time4: time series of Time1–Time4; a: only organic fertilizer; b: organic fertilizer mix with commercial bacterial fertilizer; c: organic fertilizer mix with self-developed bacterial fertilizer. |
| 图选项 |
此外,我们比较了不同施肥方式下T4时间点与其他3个时间点间根际细菌菌群的Bray-Curtis距离,从整体上看Bray-Curtis距离随着马铃薯在田间生长时间的延长而减小,特别是在马铃薯结薯开始后的T2和T3期根际微生物菌群经历了相对较小的变化。值得注意的是,在不同施肥方式下实验组和对照组间Bray-Curtis距离模式出现较大差异,表明在马铃薯中益生菌肥的添加对维持和稳定马铃薯结薯末期的根际细菌群落具有一定的作用(图 3-A)。同样地,真菌的菌群结构受不同施肥方式的影响较小,3种施肥方式下结薯末期均出现了较大的菌群结构变化(图 3-B)。
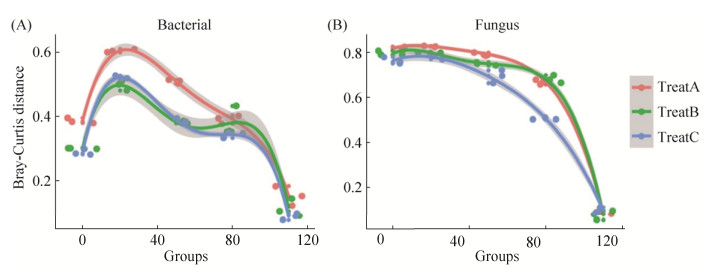 |
| 图 3 马铃薯结薯末期与其他时间点样本根际细菌(A)和根际真菌(B)的Bray-Curtis距离分布 Figure 3 Bray-Curtis distances between the rhizosphere bacterial (A) and rhizosphere fungal (B) of the last collected samples and samples taken at each time point, TreatA represent organic fertilizer only, TreatB represent organic fertilizer mix with commercial bacterial fertilizer, TreatC represent organic fertilizer mix with self-developed bacterial fertilizer. A forth-order polynomial curve was fitted following the formula=y~poly(x, 4) with confidence intervals 95%. |
| 图选项 |
2.4 马铃薯不同生长期的根际微生物特异类群 为了进一步研究马铃薯整个生命周期中特定分类群的变化,我们比较了门水平上的根际微生物群落相对丰度。通过根际细菌群落丰度比例可知,即便是在不同的施肥处理中,根际细菌群落结构在马铃薯全生命周期中随生长点的不同而产生变化,主要表现为基础土壤中相对丰度较高的酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)在马铃薯苗期丰度骤降,但随着结薯期开始其菌群丰度比例逐渐增高,直到收获期时与基础土样中持平;然而,在基础土壤中并不丰富的厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes),由于肥料的施用致使其在苗期丰度比例增加,但随着时间的推移被逐渐消耗;值得注意的是,在肥料中占绝大多数的蓝藻细菌(Cyanobacteria),虽然在马铃薯生育前期的根际环境中丰度比例明显增高,但在结薯期之后其丰度比例降至很低,几乎回到基础土壤状态(图 4-A)。
 |
| 图 4 马铃薯全生育期根际微生物群落在菌门水平上的动态变化 Figure 4 The relative abundance of potato rhizospheric microbiome in phyla change over resident time. A: bacterial change over resident time at phyla level; B: fungal change over resident time at phyla level. |
| 图选项 |
另外,通过根际真菌群落丰度比例可知,子囊菌门(Ascomycota)的丰度占目前可鉴别真菌类群的绝大比例,且根际真菌群落结构主要在马铃薯结薯期发生较大变化,主要表现为从块茎形成期开始担子菌门(Basidiomycota)丰度增加,到薯块成熟期陡增到最大丰度;然而,在苗期和块茎形成期菌群丰度都较为稳定的油壶菌门(Olpidiomycota)在马铃薯生育后期的菌群丰度骤降。值得注意的是,基础土壤中菌群丰度较高的壶菌门(Chytridiomycota)并未出现在马铃薯生长的任何时期的根际土壤中,亦可说明马铃薯根际环境排斥了这类真菌的生长(图 4-B)。
为了尽量减少施肥方式对根际微生物菌群的影响,我们对所有样品中根际微生物的相对丰度进行了回归。使用随机森林机器学习算法建立模型将根际微生物菌群组成与马铃薯生命周期相关联。为了揭示与马铃薯生命周期相关的重要菌群类型,并将其作为生物标记分类群,我们进行了10倍交叉验证以评估关联的显著性。在细菌分类群中,在使用22个重要菌群时的交叉验证错误率最小,因此,我们将这22个菌群定义为模型中的细菌生物标记分类群,并按准确性水平排列如图 5-A所示。我们发现本模型鉴定的生物标记类群均显示出与马铃薯生长时间一致的高丰度。例如,变形菌门的δ变形菌(Deltaproteobacteria)和装甲菌门的装甲细菌(Armatimonadia)被鉴定为与马铃薯生长发育阶段相关的生物标记,其菌群丰度在马铃薯T4期保持较高水平(图 5-B)。另外,在真菌中,我们发现当使用16个分类群时,交叉验证误差曲线最为稳定。这些生物标记分类群中主要分为T1期高丰度生物标记子囊菌门中的粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes),T2期高丰度生物标记担子菌门的银耳纲(Tremellomycetes)、子囊菌门的锤舌菌纲(Leotiomycetes),以及T4期高丰度的生物标记球囊菌门的球囊菌纲(Glomeromycota)、担子菌门的伞菌纲(Agaricomycetes)、油壶菌门的油壶菌纲(Olpidiomycete)等(图 5-C,D)。
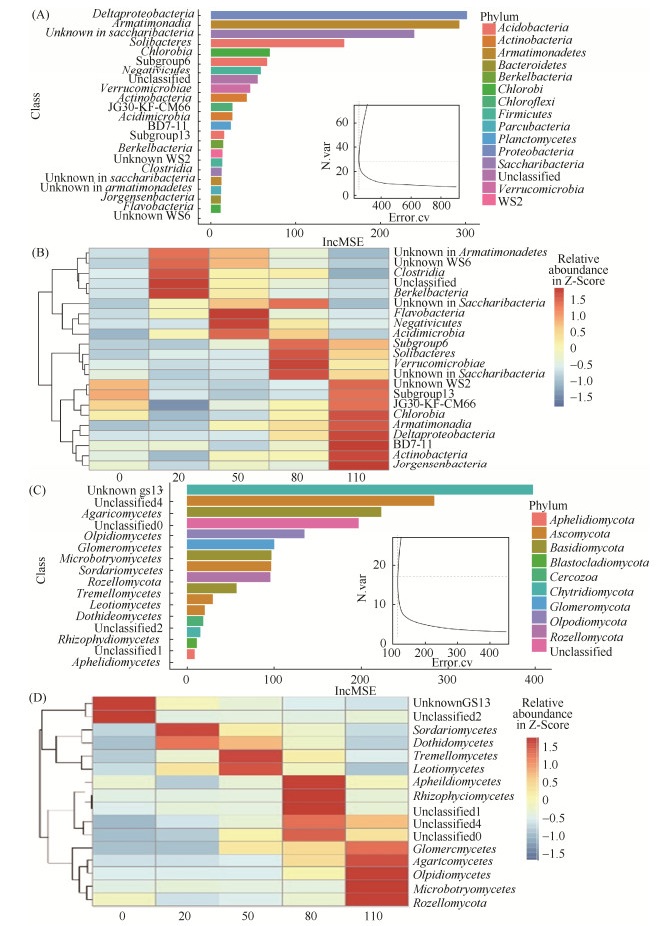 |
| 图 5 马铃薯不同生长发育时期生物标记分类群 Figure 5 Taxonomic biomarkers of potato residence time in field. A: The top 22 bacterial taxonomic biomarkers associated with potato development period identified by applying random forests regression. B: Heatmap showing the relative abundances of bacterial biomarkers against potato development period. C: The top 16 fungal taxonomic biomarkers associated with potato development period. D: Heatmap showing the relative abundances of fungal biomarkers against potato development period. |
| 图选项 |
3 讨论 随着高通量测序技术在微生物研究领域的发展应用,已有许多研究工作表明植物根际微生物菌群会随着植物生长时间的不同发生变化,但由于取样条件限制和田间环境的不可控性,这些研究一般在温室条件下进行[5, 10, 12, 14]。另一方面,目前根际微生物研究大多集中于拟南芥、水稻、玉米等模式植物,而对马铃薯等根茎类作物的报道较少。本研究针对马铃薯在田间条件下不同生长发育阶段根际微生物种群动态问题,采用Illumina MiSeq高通量测序技术分析样品间微生物群落的多样性特征,发现马铃薯的生长发育时期是影响根际微生物群落组成的主要因素且益生菌肥的添加主要影响马铃薯结薯末期细菌微生物的菌群结构。
3.1 田间条件下马铃薯全生命周期中根际微生物群落变化 本研究数据表明,田间条件下马铃薯根际微生物组结构在整个生命周期中发生变化。从种薯芽条生长期(T0期)开始由于受到底肥中微生物菌群影响,在整个营养生长阶段(T1–T2期)根际微生物菌群结构出现较大变化(图 3)。在此阶段中,基础土壤和底肥中的微生物在根系分泌物的影响下在根际区域定殖,根际中优势菌群开始形成,反之不适宜生长的菌群被排斥,这一动态过程一直持续到结薯期(T2–T3期)。然而,马铃薯成熟后期(T4期)根际微生物菌群结构发生较大变化,且在不同施肥处理间出现较大差异,表明薯块在成熟后期招募不同的根际微生物以适应植株消苗后的正常生命需求。这一种群动态变化规律与在水稻根际微生物组研究中的结论基本一致,即田间条件下的水稻根际微生物菌群在全生命期中变化,在营养生长阶段变化很大,并在植物转移到田间后8–10周稳定,随后微生物菌群经历了相对较小的变化,直到水稻成熟[7]。然而,与水稻生命过程不同,在马铃薯地下部分还经历了薯块形成、膨大发育和最终成熟的过程,因此在本研究中马铃薯在结薯末期出现了根际微生物菌群大幅度变动的现象,这可能与马铃薯在薯块成熟以后薯块分泌物影响根际微生物菌群结构有关,也可能是马铃薯成熟后期根际微生物菌群结构不稳定,还需后期进一步实验验证。
3.2 马铃薯典型生长期的特征根际微生物类群 在本研究中,我们使用随机森林模型进一步确定了与马铃薯生育时间相关的特征微生物类群,这些特征类群有助于下一步作为马铃薯特定发育时期的有益菌接种于根际环境。例如,在马铃薯苗期中高丰度的生物标记梭菌属(Clostridium)被认为具有固氮作用且能够促进作物幼苗生长。有研究认为,梭菌属与芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、克雷白氏杆菌属(Klebsiella)并称为对植物生长具有促进作用的植物根际促生菌(PGPR),且梭菌属细菌被进一步归类为固氮类细菌[25]。梭菌属细菌异养生活在土壤中,在不与其他生物直接相互作用下参与植物固氮作用[26]。Tsavkelova等报道梭菌属细菌能够产生促进植物生长的赤霉素[27]。同时,Polyanskaya等进行的一项研究也表明梭菌属细菌接种黄瓜和大麦后显著增强了作物的生长[28]。Doni等近期分离到的一株梭菌属细菌FWM1(Clostridium sp. FWM1)能够显著提高水稻苗期的幼苗高度、根长、植株湿重及植株生物量[25]。然而,梭菌属细菌对马铃薯结薯期的块茎生长却具有负面影响。有研究发现,包括梭菌属细菌在内的至少4种细菌与马铃薯黑胫病和软腐病有关,且可能在任何发育阶段攻击块茎,在某些环境条件下从受感染的块茎中扩散[29]。另有研究表明,存在于贮藏期马铃薯中的3种梭菌属细菌菌株具有强烈的果胶溶性,在20 ℃时,梭状芽孢杆菌在块茎中诱导腐烂[30]。因此,梭菌属细菌可作为一种潜在的微生物肥料菌剂,适合于马铃薯苗期而非结薯期施用。
值得注意的是,我们在马铃薯结薯末期发现了高丰度的生物标记放线菌(Actinobacteria)。放线菌广泛分布于土壤中,参与自然界物质循环,是抗生素的主要生产菌,也是修复马铃薯连作障碍、拮抗马铃薯真菌病原菌的一种重要的生防菌。有研究表明,利用生防微生物对土壤微生态系统进行调整是减轻作物连作障碍的重要措施,生防放线菌拌土接种对盆栽马铃薯根区土壤微生物区系具有显著影响,拌种接入Act11+Act12混合放线菌剂后,马铃薯根际土壤真菌总数较对照减少,降低真菌病害的发生风险[31]。同时,有研究通过使用放线菌的生物控制手段在各种栽培种马铃薯切片上证实了放线菌拮抗菌株降低软腐病症状的能力[32],以及放线菌群通过抗生素产生或酶活性介导手段与马铃薯疮痂病病原菌发生竞争和拮抗作用[33]。因此,筛选有应用价值的马铃薯土传真菌病害生防放线菌,并在结薯期向土壤或根区中接种能够有效防止结薯期土传病害的发生。
3.3 基于作物生长时期不同增施专用益生菌肥有利于作物高效栽培 对于作物高效栽培而言,根际微生物的变化与作物营养高效利用、连作、轮作等重要问题密切相关,因此,探讨作物根际微生物组随全生命周期生长的变化规律非常重要。本研究对马铃薯全生命周期中不同发育阶段的根际微生物组进行分析后发现根际微生物组随马铃薯的生长时间逐渐变化,同时,通过机器学习领域的随机森林算法,鉴定了22类与马铃薯生育期变化相关联的根际特征细菌类群,这些微生物在根际的丰度与马铃薯生长时间呈现明显的相关性。本研究揭示了益生菌在农业上的施用过程中需要考虑的重要因素之一是农作物的生长时期,将农作物生殖生长期需要的益生菌在幼苗期施用,很难取得理想效果,反之亦然。因此,在今后的马铃薯高效栽培技术研究中,需要重点考虑如何合理施肥才能有效提高有益微生物对作物的影响,特别是施肥后有益微生物如何快速形成优势菌群,这不仅与施肥量和施肥次数有关,也受土壤环境如土壤酸碱度和有机质成分等因素的影响。同时,对于马铃薯而言,拌种、拌土、浇灌和叶片喷施等不同的施肥方式也直接关系到有益微生物的定殖效率,为后期进一步研究益生微生物对马铃薯高效栽培的影响提供了参考。
为探究不同施肥处理对马铃薯全生命周期中根际微生物组的影响,本研究两个实验组在有机肥基础上混入了不同的微生物促生菌剂,对照组则单施有机肥。为区分肥料中引入的益生菌对马铃薯根际微生物动态的影响,我们分别对3种肥料单独进行了微生物多样性测序。对单施有机肥样品进行微生物多样性测序后发现肥料中菌群结构相对简单,且占比80%以上的光合细菌菌群被马铃薯根际环境排斥,实验组中促生菌剂施用比例较低使得肥料样品中的PGPR并未形成优势菌群,因此马铃薯生长期内检测到的根际微生物组受到肥料源菌群干扰的可能性较小。本文中菌群结构相关性分析结果也表明实验组与对照组之间在马铃薯生长期T1–T3阶段菌群结构相关性较为一致。但是,促生菌剂的施加与否对马铃薯结薯末期的根际微生物菌群结构造成较大影响,暗示本实验中PGPR虽未直接定殖于根际环境,但可能与结薯末期根系(薯块)分泌物产生互作关系以促进根际菌群环境的改善。因此,未来有必要开展PGRP对马铃薯产量、品质和抗逆特性等方面的促生作用分析,研究其代谢产物对作物根际环境的刺激作用、微量元素供给以及PGPR与根系分泌物的互作机制。另外,本研究中不同施肥处理对根际微生物菌群结构的影响规律仅是短期效应,这些结果仍需通过长期定位试验明确特异微生物类群及其在马铃薯促生方面发挥的作用。
References
| [1] | Müller DB, Vogel C, Bai Y, Vorholt JA. The plant microbiota:systems-level insights and perspectives. Annual Review of Genetics, 2016, 50: 211-234. DOI:10.1146/annurev-genet-120215-034952 |
| [2] | Massart S, Martinez-Medina M, Jijakli MH. Biological control in the microbiome era:challenges and opportunities. Biological Control, 2015, 89: 98-108. DOI:10.1016/j.biocontrol.2015.06.003 |
| [3] | Wu XQ, Zhou FY, Zhang XJ. Enlightenment from microbiome research towards biocontrol of plant disease. Acta Microbiologica Sinica, 2017, 57(6): 867-875. (in Chinese) 吴晓青, 周方园, 张新建. 微生物组学对植物病害微生物防治研究的启示. 微生物学报, 2017, 57(6): 867-875. |
| [4] | Bulgarelli D, Rott M, Schlaeppi K, ver Loren van Themaat E, Ahmadinejad N, Assenza F, Rauf P, Huettel B, Reinhardt R, Schmelzer E, Peplies J, Gloeckner FO, Amann R, Eickhorst T, Schulze-Lefert P. Revealing structure and assembly cues for Arabidopsis root-inhabiting bacterial microbiota. Nature, 2012, 488(7409): 91-95. DOI:10.1038/nature11336 |
| [5] | Edwards J, Johnson C, Santos-Medellín C, Lurie E, Podishetty NK, Bhatnagar S, Eisen JA, Sundaresan V. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(8): E911-E920. DOI:10.1073/pnas.1414592112 |
| [6] | Peiffer JA, Spor A, Koren O, Jin Z, Tringe SG, Dangl JL, Buckler ES, Ley RE. Diversity and heritability of the maize rhizosphere microbiome under field conditions. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(16): 6548-6553. DOI:10.1073/pnas.1302837110 |
| [7] | Zhang JY, Zhang N, Liu YX, Zhang XN, Hu B, Qin Y, Xu HR, Wang H, Guo XX, Qian JM, Wang W, Zhang PF, Jin T, Chu CC, Bai Y. Root microbiota shift in rice correlates with resident time in the field and developmental stage. Science China Life Sciences, 2018, 61(6): 613-621. DOI:10.1007/s11427-018-9284-4 |
| [8] | Hamonts K, Trivedi P, Garg A, Janitz C, Grinyer J, Holford P, Botha FC, Anderson IC, Singh BK. Field study reveals core plant microbiota and relative importance of their drivers. Environmental Microbiology, 2018, 20(1): 124-140. DOI:10.1111/1462-2920.14031 |
| [9] | Bulgarelli D, Schlaeppi K, Spaepen S, Ver Loren van Themaat E, Schulze-Lefert P. Structure and functions of the bacterial microbiota of plants. Annual Review of Plant Biology, 2013, 64: 807-838. DOI:10.1146/annurev-arplant-050312-120106 |
| [10] | Sugiyama A, Ueda Y, Zushi T, Takase H, Yazaki K. Changes in the bacterial community of soybean rhizospheres during growth in the field. PLoS One, 2014, 9(6): e100709. DOI:10.1371/journal.pone.0100709 |
| [11] | Shi SJ, Nuccio E, Herman DJ, Rijkers R, Estera K, Li JB, da Rocha UN, He ZL, Pett-Ridge J, Brodie EL, Zhou JZ, Firestone M. Successional trajectories of rhizosphere bacterial communities over consecutive seasons. mBio, 2015, 6(4): e00746-15. |
| [12] | Dombrowski N, Schlaeppi K, Agler MT, Hacquard S, Kemen E, Garrido-Oter R, Wunder J, Coupland G, Schulze-Lefert P. Root microbiota dynamics of perennial Arabis alpina are dependent on soil residence time but independent of flowering time. The ISME Journal, 2017, 11(1): 43-55. DOI:10.1038/ismej.2016.109 |
| [13] | Lundberg DS, Lebeis SL, Paredes SH, Yourstone S, Gehring J, Malfatti S, Tremblay J, Engelbrektson A, Kunin V, Del Rio TG, Edgar RC, Eickhorst T, Ley RE, Hugenholtz P, Tringe SG, Dangl JL. Defining the core Arabidopsis thaliana root microbiome. Nature, 2012, 488(7409): 86-90. DOI:10.1038/nature11237 |
| [14] | Chaparro JM, Badri DV, Vivanco JM. Rhizosphere microbiome assemblage is affected by plant development. The ISME Journal, 2014, 8(4): 790-803. DOI:10.1038/ismej.2013.196 |
| [15] | He ZG, Wang XJ, Dong H, Lou CR, Niu SW, Yu T. A preliminary study of the application of PGPR fertilizer on the potato. Soils and Fertilizers Sciences in China, 2013(2): 100-103. (in Chinese) 何志刚, 王秀娟, 董环, 娄春荣, 牛世伟, 于涛. PGPR菌肥对马铃薯产量与肥料利用率影响的初步研究. 中国土壤与肥料, 2013(2): 100-103. |
| [16] | Mago? T, Salzberg SL. FLASH:fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [17] | Bolger AM, Lohse M, Usadel B. Trimmomatic:a flexible trimmer for Illumina sequence data. Bioinformatics, 2014, 30(15): 2114-2120. DOI:10.1093/bioinformatics/btu170 |
| [18] | Edgar RC, Haas BJ, Clemente JC, Quince C, Knight R. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194-2200. DOI:10.1093/bioinformatics/btr381 |
| [19] | Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pe?a AG, Goodrich JK, Gordon JI, Huttley GA, Kelley ST, Knights D, Koenig JE, Ley RE, Lozupone CA, McDonald D, Muegge BD, Pirrung M, Reeder J, Sevinsky JR, Turnbaugh PJ, Walters WA, Widmann J, Yatsunenko T, Zaneveld J, Knight R. QIIME allows analysis of high-throughput community sequencing data. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [20] | Bokulich NA, Subramanian S, Faith JJ, Gevers D, Gordon JI, Knight R, Mills DA, Caporaso JG. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing. Nature Methods, 2013, 10(1): 57-59. DOI:10.1038/nmeth.2276 |
| [21] | Robinson MD, McCarthy DJ, Smyth GK. edgeR:a bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics, 2010, 26(1): 139-140. |
| [22] | Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P, Peplies J, Gl?ckner FO. The SILVA ribosomal RNA gene database project:improved data processing and web-based tools. Nucleic Acids Research, 2013, 41(D1): D590-D596. |
| [23] | Rustgi S, Boex-Fontvieille E, Reinbothe C, Von Wettstein D, Reinbothe S. Serpin1 and WSCP differentially regulate the activity of the cysteine protease RD21 during plant development in Arabidopsis thaliana. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(9): 2212-2217. DOI:10.1073/pnas.1621496114 |
| [24] | Wang Q, Garrity GM, Tiedje JM, Cole JR. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [25] | Doni F, Anizan I, Che Radziah CMZ, Ahmed WNW, Ashari A, Suryadi E, Yusoff WMW. Enhanced rice seedling growth by Clostridium and Pseudomonas. Biotechnology, 2014, 13(4): 186-189. DOI:10.3923/biotech.2014.186.189 |
| [] | Gamalero E, Glick BR. Mechanisms used by plant growth-promoting bacteria//Maheshwari DK. Bacteria in Agrobiology:Plant Nutrient Management. Berlin, Heidelberg:Springer, 2011:17-46. |
| [27] | Tsavkelova EA, Klimova SY, Cherdyntseva TA, Netrusov AI. Microbial producers of plant growth stimulators and their practical use:a review. Applied Biochemistry and Microbiology, 2006, 42(2): 117-126. DOI:10.1134/S0003683806020013 |
| [28] | Polyanskaya LM, Vedina OT, Lysak LV, Zvyagintsev DG. The growth-promoting effect of Beijerinckia mobilis and Clostridium sp. cultures on some agricultural crops. Microbiology, 2002, 71(1): 109-115. |
| [29] | Doan CH, Davidson PM. Microbiology of potatoes and potato products:a review. Journal of Food Protection, 2000, 63(5): 668-683. DOI:10.4315/0362-028X-63.5.668 |
| [30] | Pérombelon MCM, Gullings-Handley J, Kelman A. Population dynamics of Erwinia carotovora and Pectolytic clostridium spp. in relation to decay of potatoes. Phytopathology, 1979, 69: 167-173. |
| [31] | Chen J, Zhu WB, Guo TW, Tan XL, Wang DS, Ma YY, Xue QH. Colonization of actinomycetes and their effect on microorganisms in rhizosphere soil of potato. Acta Agriculturae Boreali-Occidentalis Sinica, 2015, 24(10): 150-158. (in Chinese) 陈杰, 朱渭兵, 郭天文, 谭雪莲, 王东胜, 马云艳, 薛泉宏. 放线菌定殖及其对马铃薯根区土壤微生物的影响. 西北农业学报, 2015, 24(10): 150-158. DOI:10.7606/j.issn.1004-1389.2015.10.022 |
| [32] | Baz M, Lahbabi D, Samri S, Val F, Hamelin G, Madore I, Bouarab K, Beaulieu C, Ennaji MM, Barakate M. Control of potato soft rot caused by Pectobacterium carotovorum and Pectobacterium atrosepticum by Moroccan actinobacteria isolates. World Journal of Microbiology and Biotechnology, 2012, 28(1): 303-311. |
| [33] | Kopecky J, Samkova Z, Sarikhani E, Kyselková M, Omelka M, Kristufek V, Divis J, Grundmann GG, Moenne-Loccoz Y, Sagova-Mareckova M. The effect of susceptible and resistant potato cultivars on bacterial communities in the tuberosphere of potato in soil suppressive or conducive to common scab disease. bioRxiv, 2018, doi: 10.1101/340257. |
