杨婧, 林宇星, 刘莘轶, 张珩琳, 裴晓芳, 曲媛媛


大连理工大学环境学院, 工业生态与环境工程教育部重点实验室, 辽宁 大连 116024
收稿日期:2019-07-02;修回日期:2019-10-10;网络出版日期:2020-03-10
基金项目:哈尔滨工业大学城市水资源与水环境国家重点实验室开放课题(QAK201943)
*通信作者:曲媛媛, Tel:+86-411-84706251;Fax:+86-411-84706252;E-mail:qyy@dlut.edu.cn.
摘要:[目的] 近年来,纳米银由于其自身独特的抗菌活性而受到越来越多的关注,有研究表明纳米银是一种广谱的抗菌剂,其对数十种致病微生物都有强烈的抑制和杀灭作用。相较于传统的合成方法而言,具有反应条件温和、环境友好等优势的生物合成法是目前的研究热点。[方法] 本研究利用真菌Mariannaea sp.HJ的胞内提取物合成纳米银,并对其合成条件进行优化调控,还进一步考察了合成的纳米银颗粒的抗菌性能。[结果] 胞内提取物浓度350 mg/L、AgNO3浓度5 mmol/L、pH 7.0为菌株HJ胞内提取物合成纳米银的最优条件;TEM图像表明合成的纳米银颗粒主要为球形和伪球形,分散性良好,无明显的团聚现象;XRD表明合成的纳米银晶体结构为面心立方体结构;通过FTIR分析结果推测提取物中的羟基、羧基等官能团可能参与了纳米银的还原和稳定过程。此外,在本实验条件下合成的纳米银颗粒对革兰氏阴性菌Escherichia coli BL21和革兰氏阳性菌Arthrobacter sp.W1都有较好的抗菌活性。[结论] 真菌Mariannaea sp.HJ胞内提取物能合成尺寸均一且分散性良好的球形纳米银颗粒,合成的纳米银颗粒在抗菌方面具有潜在的研究价值。
关键词:Mariannaea sp.HJ生物合成纳米银抗菌活性
Biosynthesis of silver nanoparticles by the cell-free extracts of Mariannaea sp. HJ and their antimicrobial characteristics research
Jing Yang, Yuxing Lin, Xinyi Liu, Henglin Zhang, Xiaofang Pei, Yuanyuan Qu


Key Laboratory of Industrial Ecology and Environmental Engineering, Ministry of Education, School of Environmental Science and Technology, Dalian University of Technology, Dalian 116024, Liaoning Province, China
Received: 2 July 2019; Revised: 10 October 2019; Published online: 10 March 2020
*Corresponding author: Qu Yuanyuan, Tel:+86-411-84706251;Fax:+86-411-84706252;E-mail:qyy@dlut.edu.cn.
Foundation item: Supported by the Open Project of State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology (QAK201943)
Abstract: [Objective] Due to their unique antibacterial activity, silver nanoparticles (AgNPs) have attracted great attention recently. And it is said that AgNPs are extensively antibacterial agents which have strong inhibition and toxic effects on dozens of pathogenic microorganisms. Compared with traditional synthetic methods, biosynthesis way has the advantages of mild reaction conditions and environmental-friendliness and is becoming a hot research topic. [Methods] In this study, we have used the cell-free extracts of fungal Mariannaea sp. HJ to synthesize AgNPs. The conditions for synthesis and the antibacterial activity were also investigated. [Results] Study has shown that the cell-free extracts of 350 mg/L, AgNO3 5 mmol/L and pH 7.0 were the optimal synthesis conditions for this reaction. Transmission Electron Microscope (TEM) images showed that the as-synthesized AgNPs were mainly spherical and pseudo spherical with good dispersibility. Diffraction of x-rays (XRD) analysis indicated that the crystal structure of AgNPs were face-centered cubic. The Fourier Transform Infrared Spectrometer (FTIR) analysis results suggested that the hydroxyl, carboxyl and other functional groups in the extracts might have played a functional role in the reduction or stabilization process. Besides, it has been verified that the AgNPs synthesized under the optimal experimental conditions had good antibacterial activity against both Gram-negative bacteria Escherichia coli BL21 and Gram-positive bacteria Arthrobacter sp. W1. [Conclusion] In brief, the cell-free extracts of Mariannaea sp. HJ could greenly synthesize spherical AgNPs with uniform size and good dispersion. The synthesized AgNPs might have potential research value in antibacterial advances.
Keywords: Mariannaea sp. HJbiosynthesissilver nanoparticlesantibacterial activity
近年来,纳米银由于其自身独特的抗菌特性而受到广泛关注。有研究表明纳米银是一种广谱的抗菌剂,其对大肠杆菌、淋球菌、沙眼衣原体等数十种致病微生物都具有强烈的抑制和杀灭作用[1],且与传统的抗生素药物相比较,纳米银的抗菌活性更强且不会产生耐药性[2]。此外,由于纳米银颗粒稳定的物理和化学性能,其在电子、光学、抗菌、催化等方面的应用受到越来越多的关注[3]。
对于纳米银的合成而言,传统的合成方法主要是利用还原剂(硼氢化钠、柠檬酸钠等)将银离子还原成单质银,紧接着再用稳定剂(PVP等)来控制纳米颗粒的粒径生长,最后得到一定尺寸的纳米银颗粒[4]。除此之外,物理合成法也是较为常用的一种合成方法,该合成方法是一种“自上而下”的合成方法,即在高温高压条件下通过外加条件的作用将大块的单质银颗粒转化为纳米级别的颗粒从而获得纳米银[5]。尽管物理和化学方法合成纳米材料正蓬勃发展,但几乎所有化学和物理合成技术均会对环境造成一定的污染,特别是很多方法存在着使用有毒或易燃的前体、反应条件苛刻、生成的纳米颗粒不稳定等问题。近年来,生物法合成纳米银因其具有环境友好、绿色低毒等特点备受研究者关注,目前已分离得到多种细菌、真菌等微生物资源用于纳米材料的合成研究[6-9],并取得了较大的研究进展。
本实验前期筛选得到一株真菌Mariannaea sp. HJ[10],通过实验验证其具有合成纳米金和纳米银颗粒的能力。相比于全细胞,真菌的细胞提取物由于无菌丝及细胞结构,合成的纳米银易于分离,回收率高,具有更好的实用性,因此本研究拟利用菌株HJ胞内提取物合成纳米银,并进一步考察了胞内提取物浓度、AgNO3浓度以及pH值对菌株HJ胞内提取物合成纳米银的影响。利用紫外可见分光光度计(UV-vis)、透射电子显微镜(TEM)、X射线衍射(XRD)以及傅立叶转换红外线光谱(FTIR)对合成的纳米银进行表征,最后利用革兰氏阴性菌Escherichia coli BL21和革兰氏阳性菌Arthrobacter sp. W1对合成的纳米银颗粒的抗菌特性进行考察。
1 材料和方法 1.1 菌株 本实验所用菌株Mariannaea sp. HJ为本实验室从反应器活性污泥中筛选分离得到。现已鉴定并保存于中国普通微生物菌种保藏中心。菌株HJ的26S rRNA基因序列被储存在GenBank数据库,保存号为KP3302049[11]。
1.2 主要试剂和仪器 硝酸银(AgNO3,分析纯,天津博迪化工股份有限公司),Escherichia coli BL21,Arthrobacter sp. W1;紫外可见分光光度计(V-560日本JASCO公司),高速低温冷冻离心机(Avanti-30型,美国E Beckman公司),X射线衍射仪(XPERTPRO荷兰Panalvtical分析仪器公司),透射电子显微镜(FEITECNAIT12.美国FEI公司),傅立叶转换红外线光谱(FTIR) (irprestige-21.日本岛津公司)。
1.3 培养基 本实验采用改良马丁培养基[11],其组成为(NH4)2SO4 1 g/L,KH2PO4 1 g/L,葡萄糖1 g/L,MgSO4 0.5 g/L,pH为7。培养基在115 ℃高温蒸汽灭菌15 min后使用。
1.4 纳米银的生物合成及其优化调控 取100 mL菌液过滤,去离子水清洗2次后重悬于适量pH为7.0的磷酸盐缓冲溶液中。将重悬的菌液超声破碎40 min,然后在10000 r/min的条件下,离心5 min,取上清液过0.22 μm膜3次,使用考马斯亮蓝调节蛋白浓度为200 mg/mL,加入AgNO3使其最终浓度为1 mmol/L,将混合液在30 ℃、150 r/min的摇床中避光培养。
为了探究不同胞内提取物浓度对纳米银合成的影响,使用考马斯亮蓝法[12]分别调节蛋白浓度为10、50、100、150、250、350 mg/L,按上述方法合成纳米银。为了探究不同AgNO3浓度对纳米银合成的影响,分别调节AgNO3浓度为0.1、0.5、1.0、2.0、3.0、5.0 mmol/L,按上述方法合成纳米银。在最适胞内提取物浓度和AgNO3浓度条件下,分别调节溶液pH为5.0、6.0、7.0、8.0和9.0,按上述方法合成纳米银,探究溶液pH的变化对纳米银合成的影响。
1.5 纳米银的表征 (1) 紫外可见分光光度计(UV-vis)。在400–800 nm的波长范围内取2 mL待测液进行全波扫描,检测纳米银的特征吸收峰。(2)透射电子显微镜(TEM)。取适量纳米银溶液,超声振荡10 min,移液适量纳米银在铜网上,晾干,重复15–20次后获得样品。在透射电子显微镜下观察纳米银的形貌及尺寸。(3) X射线衍射(XRD)。取适量纳米银溶液,在10000 r/min的条件下离心5 min,除去上清液,得到纳米银的沉淀。将该沉淀在70 ℃的条件下进行真空干燥6 h,干燥后的样品用玛瑙研钵充分研磨,使固体粉末粒径减小到45 μm以下。使用全自动X射线衍射仪D/max-2400对样品进行表征,Cu靶Ka辐射,波长λ=0.154056 nm,工作电压12 kW,精度0.01,2θ扫描区间20°–80°,扫描速度5 °/min。(4)傅立叶转换红外线光谱(FTIR)。取适量纳米银溶液,在12000 r/min条件下离心30 min,去上清,得到纳米银沉淀。然后在70 ℃条件下烘干6 h,得到较为纯净的纳米银样品,另取菌株HJ破碎后的提取物在相同条件下烘干。将上述2个待测样品分别与溴化钾混合,于玛瑙研钵中充分混合研磨,将研磨好的粉末压片,在室温下用傅立叶转换红外线光谱400–4000 cm–1测量其吸收光谱,扫描速度为5 kHz,每2 nm采集1次数据。
1.6 纳米银抗菌特性研究 首先将菌株Arthrobacter sp. W1和Escherichia coli BL21均匀地涂布在改良马丁固体培养基上,放置2–3片灭菌的滤纸片于平板上。分别取5 μL纳米银样品、去离子水和AgNO3溶液滴在滤纸片上,在30 ℃条件下恒温培养。通过观察滤纸片周围的抑菌圈判断纳米银的抗菌特性。
2 结果和讨论 2.1 不同反应时间对纳米银合成的影响 如图 1所示,加入AgNO3后,反应体系的颜色逐渐从无色变为红棕色。且由于纳米银颗粒的表面等离子体共振效应(surface plasma resonance,SPR)使其在UV-vis图中出现相应的特征吸收峰,从UV-vis图中可以发现反应体系2 d后在435 nm左右处出现明显峰,通过查阅相关文献[13]证明此时反应体系中有纳米银的生成。随着反应时间的延长,该处的特征吸收峰值逐渐增强,直至5 d后达到最高值并趋于稳定,由此说明体系中纳米银颗粒的浓度达到最大值,反应已基本完成。
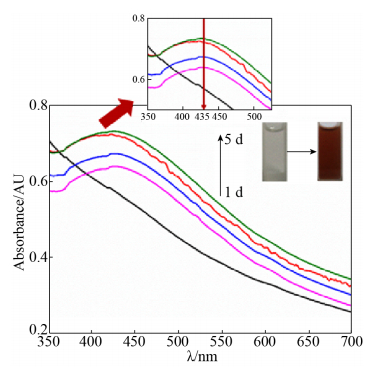 |
| 图 1 不同反应时间下菌株HJ胞内提取物合成纳米银的UV-vis光谱图 Figure 1 UV-vis spectra and colors of AgNPs synthesized by strain HJ cell-free extracts at different times. Reaction conditions: pH 7, 200 mg/L cell-free extract and 1 mmol/L AgNO3. |
| 图选项 |
2.2 不同pH对纳米银合成的影响 由于溶液pH值的不同会影响到细胞提取物中酶的活性,进而会对纳米银的合成造成一定的影响,因此本实验通过设置了5个不同的pH梯度,分别考察了该反应在酸性、中性以及碱性条件下合成纳米银的情况。其UV-vis结果如图 2所示,当pH为5.0时,其UV-vis图中无明显的特征吸收峰出现,证明在此条件下反应体系中无纳米银合成。当pH为6.0–8.0时,其UV-vis图中均在435 nm左右出现了明显的特征吸收峰,且随着pH的增加,该处的特征吸收峰值逐渐增加,有文献表明特征吸收峰值的大小与溶液中纳米银颗粒的浓度成正比关系[14],因此当pH为6.0–8.0时,随着pH值的增加,反应体系中纳米银的浓度在逐渐增加。然而当pH增加到9.0时,此时的特征吸收峰值急剧下降,由此可以推测在较高的碱性条件下可能会对细胞提取物中的蛋白质产生一定的影响,进而影响到纳米银的整个合成过程。罗应等在探究基于柠檬提取液的银纳米颗粒绿色制备工艺优化时发现,添加碱度最大的NaOH会使得合成纳米银的紫外吸收峰蓝移量最大且吸收度最大[15],这与本实验结果一致。
 |
| 图 2 不同pH条件下菌株HJ胞内提取物合成纳米银的UV-vis光谱图 Figure 2 UV-vis spectra and colors of AgNPs synthesized by strain HJ cell-free extracts at different pH. Reaction conditions: pH 5.0–9.0, 100 mg/L cell-free extract and 1 mmol/L AgNO3. |
| 图选项 |
2.3 不同提取物浓度对纳米银合成的影响 在本实验中,考察10、50、100、150、250、350 mg/L 6种胞内提取物浓度对菌株HJ胞内提取物合成纳米银的影响,结果如图 3所示。通过颜色观察发现,随着胞内提取物浓度的增加,反应体系的颜色逐渐加深,从浅灰色逐渐变为棕色。相应的其UV-Vis图中显示当提取物浓度为10 mg/L或50 mg/L时,在300–800 nm波长范围内,没有出现明显的特征吸收峰;而当提取物浓度大于100 mg/L时,反应体系均在420 nm处出现特征吸收峰,且随着浓度的增加,特征吸收峰的峰强逐渐增加。当胞内提取物浓度为350 mg/L时,特征吸收峰峰强达到最大,根据特征吸收峰与纳米银浓度之间的关系可知在该浓度范围内此时合成的纳米银浓度最大。
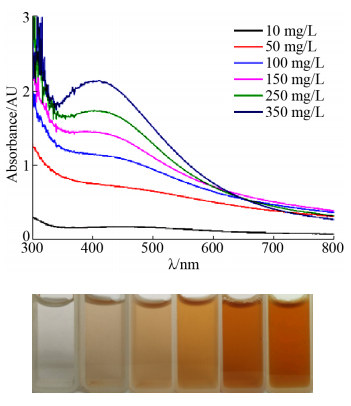 |
| 图 3 不同浓度胞内提取物合成纳米银的UV-vis光谱图 Figure 3 UV-vis spectra and colors of AgNPs synthesized by different concentrations of strain HJ cell-free extracts. Reaction conditions: pH 7.0, 10–350 mg/L cell-free extract and 3 mmol/L AgNO3. |
| 图选项 |
2.4 不同银离子浓度对纳米银合成的影响 有文献表明溶液中初始的银离子浓度对纳米银合成会产生一定的影响[16]。本研究考察了不同AgNO3浓度对纳米银合成的影响,结果如图 4所示。随着银离子浓度的增加,溶液的颜色从浅黄色逐渐变为红棕色。UV-vis结果表明,当AgNO3浓度为0.1 mmol/L时,反应体系在400–800 nm范围内无明显的特征吸收峰,由此证明反应体系中无纳米银的合成。当AgNO3浓度大于0.5 mmol/L时,反应体系均在415 nm处出现明显的特征吸收峰,而随着银离子浓度的增加,峰值逐渐增加,由此可推测合成的纳米银的浓度也在逐渐增加。当AgNO3浓度为5 mmol/L时,特征吸收峰峰值达到最大,因此选择5 mmol/L作为本实验的AgNO3浓度。Singh等使用印度印楝叶提取物为原料合成纳米银时,发现随着AgNO3浓度的增加合成的纳米银浓度增加且对燃料降解效果增强[17],这与本实验结果一致。
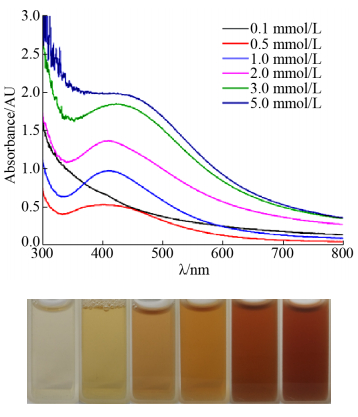 |
| 图 4 不同浓度银离子合成纳米银的UV-vis光谱图 Figure 4 UV-vis spectra and colors of AgNPs synthesized bystrain HJ cell-free extracts at different concentrations of AgNO3. Reaction conditions: pH 7.0, 350 mg/L cell-free extract and 0.1–5.0 mmol/L AgNO3. |
| 图选项 |
2.5 纳米银的表征 为了考察合成的纳米银的尺寸和形貌,本实验利用TEM进行表征,结果如图 5所示。由图可知真菌HJ胞内提取物合成的纳米银主要为球形或伪球形,少数为棒状,颗粒尺寸较为均一,分散性较好且无明显的团聚现象。使用粒径分析软件分析250个纳米颗粒可知合成的纳米银颗粒的平均尺寸为15 nm,其中尺寸小于10 nm的颗粒约占55%,尺寸为10–20 nm的占40%,而大于20 nm的颗粒仅占5%。为确定合成物质的化学组成,我们使用了EDS对其进行元素分析,如图 5-C所示合成物质中只存在明显的银元素的峰,故证明了真菌HJ合成的物质为纳米银颗粒。
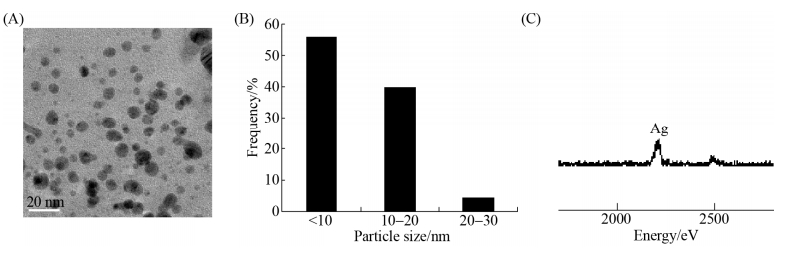 |
| 图 5 合成纳米银的TEM图(A)、粒径分布图(B)和EDS元素分析(C) Figure 5 TEM image (A), size distribution histogram (B) and EDS analysis (C) of AgNPs. Reaction conditions: pH 7.0, 350 mg/L cell-free extract and 3 mmol/L AgNO3. |
| 图选项 |
对合成的纳米银颗粒进行X射线衍射分析,结果如图 6所示。与银标准卡(JCPDSL LE 03-0921)进行比对可知,2θ在25.74°、32.50°、38.16°、44.32°、64.84°以及77.30°处出现4个明显的衍射峰,分别与面心立方(FCC)结构的(111)、(200)、(220)和(311)晶面相对应[18],并且(111)面的衍射峰强度明显高于其他峰,证明合成产物为纳米银并以(111)面为主导。
 |
| 图 6 合成纳米银的XRD分析 Figure 6 XRD analysis of AgNPs. |
| 图选项 |
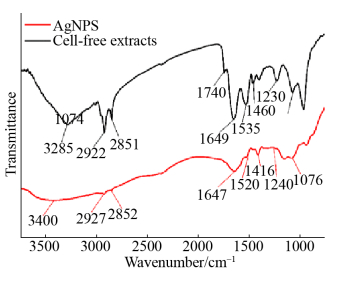
为了对真菌HJ胞内提取物合成纳米银的机理进行初步的探索,本实验利用FTIR对合成的纳米银颗粒以及真菌HJ的胞内提取物进行了表征分析,结果如图 7所示。从图中可知菌株HJ的胞内提取物及纳米银颗粒均于–3300 cm–1、–2920 cm–1、–2850 cm–1、–1650 cm–1、–1520 cm–1、–1450 cm–1、–1230 cm–1、–1080 cm–1处出现特征吸收峰。查阅文献可知,–3300 cm–1是O–H的伸缩振动峰[19];–2920 cm–1和–2850 cm–1是C–H伸缩振动产生的特征吸收峰[20];–1650 cm–1和–1520 cm–1分别对应氨基Ⅰ与氨基Ⅱ的特征吸收峰[21];–1450 cm–1是C–H变形振动产生的特征吸收峰[22];–1080 cm–1是C–N的伸缩振动的特征吸收峰[23]。由此说明菌株HJ胞内提取物和合成的纳米银表面均存在氨基、羟基等官能团,这些官能团可能在银离子的还原和合成纳米银的稳定过程中起到一定的作用。然而值得注意的是,纳米银颗粒在1740 cm–1出现了一个明显的特征吸收峰,该处的吸收峰对应的官能团为–COOH基团,而在胞内提取物中却没有该类特征吸收峰的出现,由此推测纳米银表面的–COOH可能为银离子还原过程中的氧化产物,由此可推断–COOH等物质可能参与了纳米银的还原过程。Zhang等[24]在利用Cupriavidus metalliduransSHE胞内提取物合成纳米金的研究中发现,胞内提取物中的羟基、羧基、氨基等官能团参与了纳米金的合成过程,这与本实验结果一致。
 |
| 图 7 合成纳米银的FTIR图 Figure 7 FTIR analysis of AgNPs. |
| 图选项 |
2.6 纳米银的抗菌性 有文献表明银离子和纳米银均有一定的抗菌性,这类物质通过改变微生物细胞的形态和结构,使细胞失活,从而达到抗菌的作用[25]。对于纳米银的抗菌机制而言[26],首先,纳米银颗粒能够附着在细胞膜的表面与细胞膜表面含硫蛋白质或含磷物质产生较强的相互作用,从而改变了细胞膜的通透性并进一步影响细胞的呼吸功能;其次,纳米银颗粒也可以穿过细胞膜进入细胞内[27],攻击呼吸链,阻碍细胞代谢和细胞分裂,促进细胞凋亡;此外,纳米银颗粒对细胞中酶的活性及DNA性质有较大影响,易诱发细胞凋亡或失去活性[28-29]。但目前大多被应用为抗菌剂的纳米银颗粒均是利用化学或物理的方法合成的,因此本实验对利用菌株HJ胞内提取物合成的纳米银颗粒的抗菌性进行了初步的考察,实验结果如图 8所示。
 |
| 图 8 纳米银对Arthrobacter sp. W1 (A)和Escherichia coli BL21 (B)的抗菌活性 Figure 8 Antibacterial activity of as-synthesized AgNPs against Arthrobacter sp. W1 (A) and Escherichia coli BL21 (B). |
| 图选项 |
本实验利用AgNO3和水作为对照组,利用革兰氏阴性菌Escherichia coli BL21和革兰氏阳性菌Arthrobacter sp. W1对合成的纳米银的抗菌性进行了考察。查阅相关文献以及相关抗菌性实验的标准测试方法(SNV 195920-1992)可知,当平板上抑菌圈直径大于1 mm时可认为该种样品具有明显的抑菌活性[30-31]。在本实验中,从图 8-B中可知在Escherichia coli BL21固体培养基中,当加入5 μL适量的纳米银溶液培养数天后,培养基上均出现直径为2.8 mm的抑菌圈,显著大于1 mm,因此可说明在本实验条件下合成的纳米银颗粒对革兰氏阴性菌Escherichia coli BL21有很好的抑菌活性。而在Arthrobacter sp. W1固体培养基中,从图 8-A中可知培养基上抑菌圈直径为1.1 mm,说明该纳米银颗粒对革兰氏阳性菌Arthrobacter sp. W1具有明显的抗菌性能,但相较于革兰氏阴性菌Escherichia coli BL21而言,抗菌性能更差。但对于Escherichia coli BL21和Arthrobacter sp. W1而言,该方法合成的纳米银颗粒其抗菌能力小于硝酸银溶液。
3 结论 本研究在前期研究的基础上,进一步考察了胞内提取物浓度、AgNO3浓度以及pH值对菌株HJ胞内提取合成纳米银的影响。利用紫外可见分光光度计(UV-vis)、透射电子显微镜(TEM)、X射线衍射(XRD)以及傅立叶转换红外线光谱(FTIR)对合成的纳米银进行表征,最后利用革兰氏阴性菌E. coli BL21和革兰氏阳性菌Arthrobacter sp. W1对合成的纳米银颗粒的抗菌特性进行考察。实验结论如下。
(1) 真菌HJ胞内提取物具有较好的纳米银合成能力,且pH、胞内提取物浓度及AgNO3浓度对纳米银的合成均会产生一定影响。
(2) 使用AgNO3浓度为5 mmol/L,胞内提取物浓度为350 mg/L时合成的纳米银颗粒主要为球形和伪球形,少数为棒状,颗粒尺寸较为均一,其中55%的纳米银颗粒尺寸 < 10 nm;通过XRD分析可得合成的纳米银颗粒的晶体结构为面心立方体结构;FTIR表征分析可得羧基、氨基、羟基等官能团可能参与了纳米银的合成及稳定过程。
(3) 在本实验条件下合成的纳米银颗粒对革兰氏阴性菌Escherichia coli BL21和革兰氏阳性菌Arthrobacter sp. W1都有较好的抗菌活性,且其对革兰氏阳性菌Arthrobacter sp. W1的抗菌活性明显大于对革兰氏阴性菌Escherichia coli BL21的抗菌活性。
References
| [1] | Liu Y, Xia J, Wang Y, Guo J, Zhang YK. Antibacterial effect of nanomaterials. Chemical Engineering Design Communications, 2018, 44(7): 70, 194. (in Chinese) 刘银, 夏季, 王颖, 郭娇, 张亚昆. 纳米材料的抗菌作用. 化工设计通讯, 2018, 44(7): 70, 194. |
| [2] | Cao XL, Lu SL, Zhang DJ, Liu FX. Study on antimicrobial activity of nano silver as antimicrobial agents. Journal of Ji Lin Institute of Chemical Technology, 2017, 34(11): 30-34. (in Chinese) 曹雪玲, 陆书来, 张东杰, 刘发现. 纳米银作为抗菌剂的抗菌性能研究. 吉林化工学院学报, 2017, 34(11): 30-34. |
| [3] | Ye WJ, Chen KH, Cai SL, Chen LK, Zhong TS, Wang XY. Progress in research on synthesis and antibacterial applications of silver nanoparticles. Journal of Materials Engineering, 2017, 45(9): 22-30. (in Chinese) 叶伟杰, 陈楷航, 蔡少龄, 陈利科, 钟同苏, 王小英. 纳米银的合成及其抗菌应用研究进展. 材料工程, 2017, 45(9): 22-30. |
| [4] | Liu YT, Zhang QP, Xu M, Yuan H, Chen Y, Zhang JX, Luo KY, Zhang JQ, You B. Novel and efficient synthesis of Ag-ZnO nanoparticles for the sunlight-induced photocatalytic degradation. Applied Surface Science, 2019, 476: 632-640. DOI:10.1016/j.apsusc.2019.01.137 |
| [5] | Singh N, Khanna PK. In situ synthesis of silver nano-particles in polymethylmethacrylate. Materials Chemistry and Physics, 2007, 104(2/3): 367-372. |
| [6] | Elemike EE, Onwudiwe DC, Fayemi OE, Botha TL. Green synthesis and electrochemistry of Ag, Au, and Ag-Au bimetallic nanoparticles using golden rod (Solidago canadensis) leaf extract. Applied Physics A, 2019, 125(1): 42. DOI:10.1007/s00339-018-2348-0 |
| [7] | Some S, Sen IK, Mandal A, Aslan T, Ustun Y, Yilmaz E?, Kat? A, Demirbas A, Mandal AK, Ocsoy I. Biosynthesis of silver nanoparticles and their versatile antimicrobial properties. Materials Research Express, 2019, 6(1): 012001. |
| [8] | Kim M, Jee SC, Shinde SK, Mistry BM, Saratale RG, Saratale GD, Ghodake GS, Kim DY, Sung JS, Kadam AA. Green-synthesis of anisotropic peptone-silver nanoparticles and its potential application as anti-bacterial agent. Polymers, 2019, 11(2): 271. DOI:10.3390/polym11020271 |
| [9] | Qin DZ, Yang GR, Wang YB, Zhou YB, Zhang L. Green synthesis of biocompatible trypsin-conjugated Ag nanocomposite with antibacterial activity. Applied Surface Science, 2019, 469: 528-536. DOI:10.1016/j.apsusc.2018.11.057 |
| [10] | Pei XF, Qu YY, Shen WL, Li HJ, Zhang XW, Li SZ, Zhang ZJ, Li XY. Green synthesis of gold nanoparticles using fungus Mariannaea sp. HJ and their catalysis in reduction of 4-nitrophenol. Environmental Science and Pollution Research, 2017, 24(27): 21649-21659. DOI:10.1007/s11356-017-9684-z |
| [11] | Li SZ, Shen WL, Liu YY, Deng Y, You SN, Pei XF, Li HJ, Zhang ZJ, Qu YY. Research advances in fungi-mediated biosynthesis of gold nano-particle and its application. Environmental Science and Technology, 2016, 39(9): 82-87, 158. (in Chinese) 厉舒祯, 沈文丽, 刘洋荧, 邓晔, 由胜男, 裴晓芳, 李会杰, 张照婧, 曲媛媛. 真菌介导的纳米金合成及其应用研究进展. 环境科学与技术, 2016, 39(9): 82-87, 158. |
| [12] | de St, Groth SF, Webster RG, Datyner A. Two new staining procedures for quantitative estimation of proteins on electrophoretic strips. Biochimica et Biophysica Acta, 1963, 71: 377-391. DOI:10.1016/0006-3002(63)91092-8 |
| [13] | He HY, He Z, Shen Q. Eco-friendly synthesis and characterizations of single-wall carbon nanotubes/Ag nanopaticle hybrids for environmental decontamination. Materials Research Express, 2019, 6(3): 035002. |
| [14] | Khattak A, Ahmad B, Rauf A, Bawazeer S, Farooq U, Ali J, Patel S, Ramadan El-Sharkawy E, Ikram R, Huang LF. Green synthesis, characterisation and biological evaluation of plant-based silver nanoparticles using Quercus semecarpifolia Smith aqueous leaf extract. IET Nanobiotechnology, 2019, 13(1): 36-41. |
| [15] | Luo Y, Li YQ, Li YC, Cheng H, Kong HX, Li LJ. Optimization of preparation technology for silver nanoparticles using lemon juice. Science and Technology of Food Industry, 2018, 39(12): 194-199. (in Chinese) 罗应, 李彦青, 李永川, 程昊, 孔红星, 李利军. 基于柠檬提取液的银纳米颗粒绿色制备工艺优化. 食品工业科技, 2018, 39(12): 194-199. |
| [16] | Yu JL, Xu D, Wang T, Chen X. Synthesis of silver nanoparticles using Amakusa peel extract. Journal of Food Safety and Quality, 2018, 9(12): 3053-3060. (in Chinese) 于嘉伦, 徐丹, 王婷, 陈晓. 采用天草柑果皮提取液制备纳米银. 食品安全质量检测学报, 2018, 9(12): 3053-3060. DOI:10.3969/j.issn.2095-0381.2018.12.031 |
| [17] | Singh J, Kukkar P, Sammi H, Rawat M, Singh G, Kukkar D. Enhanced catalytic reduction of 4-nitrophenol and congo red dye By silver nanoparticles prepared from Azadirachta indica leaf extract under direct sunlight exposure. Particulate Science and Technology, 2019, 37(4): 434-443. DOI:10.1080/02726351.2017.1390512 |
| [18] | Mawaddah MO, Pambudi AB, Pratiwi AR, Kurniawan F. Green synthesis of silver nanoparticles using photo-induced reduction method//Proceedings of the 3rd International Seminar on Chemistry: Green Chemistry and its Role for Sustainability. Surabaya, Indonesia: AIP, 2018. |
| [19] | Zahoor A, Qiu T, Wang HQ, Choudhry MA, Li XY. Synthesis and characterization of Ag@polycarbazole coaxial nanocables and their enhanced dispersion behavior. Metals and Materials International, 2011, 17(3): 417-423. DOI:10.1007/s12540-011-0618-x |
| [20] | Subbiah KS, Beedu SR. Biogenic synthesis of biopolymer-based Ag-Au bimetallic nanoparticle constructs and their anti-proliferative assessment. IET Nanobiotechnology, 2018, 12(8): 1047-1055. DOI:10.1049/iet-nbt.2018.5135 |
| [21] | Jehan M, Saeed F, Khan Z, Shah M, Sikandar A, Inayat A, Ali S, Mehmood Khan A, Talib A, Aasim M, Ali Khan A. Investigative evaluation of Cassia absus for antibacterial capacity and biomimetic synthesis of silver nanoparticles. IET Nanobiotechnology, 2018, 12(8): 1062-1066. DOI:10.1049/iet-nbt.2018.5054 |
| [22] | Sampaio S, Viana JC. Production of silver nanoparticles by green synthesis using artichoke (Cynara scolymus L.) aqueous extract and measurement of their electrical conductivity. Advances in Natural Sciences:Nanoscience and Nanotechnology, 2018, 9(4): 045002. DOI:10.1088/2043-6254/aae987 |
| [23] | Taheri M. Green synthesis of silver/silica nanocomposite in seconds at room temperature using reducing agents obtained from silicon nanoparticles. Laser Physics, 2018, 28(12): 125401. DOI:10.1088/1555-6611/aae5a4 |
| [24] | Zhang HL, Yang J, Zhou H, Li Z, Li Y, Dai CX, Qu YY. Biosynthesis of gold nanoparticles by the cell-free extracts of Cupriavidus metallidurans SHE and its catalytic applications. Chinese Journal of Applied and Environmental Biology, 2019, 25(2): 457-462. (in Chinese) 张珩琳, 杨婧, 周浩, 李政, 李严, 戴春晓, 曲媛媛. Cupriavidus metallidurans SHE胞内提取物合成纳米金及其催化应用. 应用与环境生物学报, 2019, 25(2): 457-462. |
| [25] | Liu B, Shen SQ, Luo JW, Wang XY, Sun RC. One-pot green synthesis and antimicrobial activity of exfoliated Ag NP-loaded quaternized chitosan/clay nanocomposites. RSC Advances, 2013, 3(25): 9714-9722. DOI:10.1039/c3ra41270a |
| [26] | Kumar R, Münstedt H. Silver ion release from antimicrobial polyamide/silver composites. Biomaterials, 2005, 26(14): 2081-2088. DOI:10.1016/j.biomaterials.2004.05.030 |
| [27] | Feng QL, Wu J, Chen GQ, Cui FZ, Kim TN, Kim JO. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus. Journal of Biomedical Materials Research, 2000, 52(4): 662-668. DOI:10.1002/1097-4636(20001215)52:4<662::AID-JBM10>3.0.CO;2-3 |
| [28] | Paná?ek A, Kvítek L, Prucek R, Kolá? M, Ve?e?ová R, Pizúrová N, Sharma VK, Nevě?ná T, Zbo?il R. Silver colloid nanoparticles:synthesis, characterization, and their antibacterial activity. The Journal of Physical Chemistry B, 2006, 11(33): 16248-16253. |
| [29] | Morones JR, Elechiguerra JL, Camacho A, Holt K, Kouri JB, Ramírez JT, Yacaman MJ. The bactericidal effect of silver nanoparticles. Nanotechnology, 2005, 16(10): 2346-2353. DOI:10.1088/0957-4484/16/10/059 |
| [30] | Raghavendra GM, Jayaramudu T, Varaprasad K, Sadiku R, Ray SS, Mohana Raju K. Cellulose-polymer-Ag nanocomposite fibers for antibacterial fabrics/skin scaffolds. Carbohydrate Polymers, 2013, 93(2): 553-560. DOI:10.1016/j.carbpol.2012.12.035 |
| [31] | Jayaramudu T, Varaprasad K, Raghavendra GM, Sadiku ER, Mohana Raju K, Amalraj J. Green synthesis of tea Ag nanocomposite hydrogels via mint leaf extraction for effective antibacterial activity. Journal of Biomaterials Science, Polymer Edition, 2017, 28(14): 1588-1602. DOI:10.1080/09205063.2017.1338501 |
