包红朵1,2, 朱树娇1, 张辉1, 周艳1, 张旭晖2, 庞茂达1, 孙利厂1, 李维3, 王冉1


1. 江苏省农业科学院农产品质量安全与营养研究所, 江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地, 农业部农产品质量安全风险评估实验室(南京), 江苏 南京 210014;
2. 南京林业大学林学院, 江苏 南京 210037;
3. 中粮饲料有限公司, 北京 100020
收稿日期:2019-07-16;修回日期:2019-09-30;网络出版日期:2020-03-09
基金项目:国家自然科学基金(31701725);江苏省自然科学基金(BK20161373,BK20170600)
*通信作者:王冉, Tel/Fax:+86-25-84391617. E-mail:ranwang@jaas.ac.cn.
摘要:[目的] 筛选鉴定沙门菌噬菌体侵染裂解过程中的抗性菌株,研究抗性菌株的生物学特性及致病力的差异,为解决噬菌体治疗应用中的抗性菌问题提供理论依据。[方法] 本研究通过次级感染法和双层平板法筛选沙门菌噬菌体抗性菌,通过生物学特性和毒力基因检测比较宿主菌ATCC 13076及其噬菌体抗性菌株R3之间的差异,并通过小鼠攻毒实验和细胞粘附实验比较致病力强弱。[结果] 噬菌体抗性菌株R3的生长速度较宿主菌略慢;生化及毒力基因检测均表明抗性菌株与宿主菌无差异;与宿主菌相比,抗性菌R3的LD50增加了74.8%(P>0.05);对MODE-K细胞粘附能力稍弱,但是差异不显著。[结论] 该研究表明,与噬菌体宿主菌相比,噬菌体抗性菌株的生物学特性和毒力基因并没有改变,对小鼠致病力减弱,但是对MODE-K细胞粘附能力差异不显著。
关键词:沙门菌噬菌体抗性菌毒力基因生物学特性致病力
Screening, identification and pathogenicity of phage-resistant strain of Salmonella
Hongduo Bao1,2, Shujiao Zhu1, Hui Zhang1, Yan Zhou1, Xuhui Zhang2, Maoda Pang1, Lichang Sun1, Wei Li3, Ran Wang1


1. Key Laboratory of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base, Key Laboratory of Agro-product Safety Risk Evaluation(Nanjing) of Ministry of Agriculture, Institute of Agricultural Product Safety and Nutrition, Jiangsu Academy of Agricultural Science, Nanjing 210014, Jiangsu Province, China;
2. College of Forestry, Nanjing Forestry University, Nanjing 210037, Jiangsu Province, China;
3. COFCO Feed Co., Ltd., Beijing 100020, China
Received: 16 July 2019; Revised: 30 September 2019; Published online: 9 March 2020
*Corresponding author: Wang Ran, Tel/Fax: +86-25-84391617.E-mail:WangRan, ranwang@jaas.ac.cn.
Foundation item: Supported by the National Natural Science Foundation of China (31701725) and by the Natural Science Fundation of Jiangsu Province (BK20161373, BK20170600)
Abstract: [Objective] To screen and identify resistant strains of Salmonella phage in the process of lysis, the differences of biological characteristics and the pathogenicity between resistant strains and the host strains were studied, to provide theoretical basis for solving the problem of presence of resistant bacteria in the phage therapy. [Methods] Salmonella phage-resistant bacteria were screened by secondary infection method and double-layer plate method. The differences between host strain ATCC 13076 and its phage-resistant strain R3 were compared by biological characteristics and virulence genes detection. The virulence of the bacteria was compared using mice challenge test and cell adhesion test. [Results] The growth curve of phage-resistant strain R3 was slightly slower than that of host strain; biochemical and virulent genetic tests showed that there was no difference between the resistant strain and host strain; compared to the host strain, the pathogenicity of the resistant strain to mice (Lethal Dose, 50%, LD50) increased by 74.8% (P>0.05); and the adhesion ability to MODE-K cells were slightly weaker, but the difference was not significant. [Conclusion] Compared with the host strain, the biological characteristics and virulence genes of the bacteriophage-resistant strains did not change, and the pathogenicity of the strains was weakened in mice, but the adhesion ability to MODE-K cells was not significantly different.
Keywords: Salmonellaphage-resistant bacteriavirulence genesbiological characteristicspathogenicity
尽管现代技术不断进步,食品工业仍面临着病原菌污染的威胁。抗生素的过度使用进一步加剧了这一问题,导致耐药食源性病原菌的出现日益增多,全球每年由食源性病原菌引发的疾病影响成百万人的健康。大多数普遍存在的沙门菌的血清型,对动物和人类都有致病性,它们可以引起人畜共患病。在欧盟调查的动物源性病原菌中,沙门菌通常排在弯曲杆菌之后[1]。鸡蛋和蛋制品是主要的沙门菌污染源(感染率,6%),其次是家禽和猪肉(感染率,3%)及奶酪(感染率,1%) (EFSA和ECDC,2017年)[2]。
近年来,随着大量多重药耐药菌的出现,噬菌体及其相关产品在预防和控制细菌性疾病方面与抗生素相比显示出突出优势。早在2005年,第一种噬菌体产品,由Omnilytics公司生产的AgriPhageTM,是由美国环境保护局正式批准用于控制叶斑点野油菜黄单胞菌和丁香假单胞菌引起的番茄和辣椒的斑点溃烂病。2006年,美国政府批准了Intralytix公司生产的第一种与食品安全相关的噬菌体制剂ListShieldTM (LMP-102TM),用于控制肉类和家禽产品等即食食品中的单核细胞增生性李斯特菌,该事件是欧美噬菌体应用历史上的一个重要里程碑[3]。这一事件标志着食品和药物管理局首次认为噬菌体是安全的。近几年,噬菌体治疗研究开始得到各个国家政策的支持和鼓励,噬菌体制剂已经进入各国市场。
噬菌体被认为是地球上最丰富的微生物,也可能是最多样的。这种多样性主要是来源于它们在面临选择性压力时的动态适应,如细菌宿主中广泛存在的噬菌体抗性机制。当噬菌体感染细菌细胞时,它们面临着一系列的细菌抗性机制,细菌对噬菌体的抗性机制也同样控制着噬菌体的繁殖,因此,形成了细菌与噬菌体之间的动态平衡。经典的细菌抗性机制主要有:干扰噬菌体吸附、阻止噬菌体DNA注入、限制性修饰系统、超感染排斥、CRISPR系统、组装干扰和流产感染等[4]。噬菌体裂菌过程中,细菌很容易对噬菌体产生抗性[5]。虽然,溶源性噬菌体在提高细菌毒力中的作用已被广泛研究[6-7],然而,裂解性噬菌体对抗性菌株毒力的影响仍然知之甚少,尚未见文献报道。噬菌体抗性菌的出现是噬菌体治疗前必须研究并克服的一个重要问题。产生的抗性菌株是否与宿主菌具有相同的生物学特性以及其对动物和细胞的致病力是否产生变化,回答这些问题将为深入探讨细菌抗噬菌体感染的机制及噬菌体治疗细菌性疾病的效果提供理论依据,具有重要的理论与实践意义。只有真正解决了这些潜在的问题,噬菌体才能真正成为一种有效的抗细菌感染的治疗手段。
1 材料和方法 1.1 材料
1.1.1 菌株、实验动物和细胞: 菌株采用江苏省农业科学院农产品质量安全与营养研究所畜产品污染监测与预防研究室保藏的肠炎沙门菌标准菌株ATCC 13076及其噬菌体PA13076。
实验动物:5周龄清洁级ICR小鼠,体重20–22 g,雌雄各半,购自扬州大学比较医学中心。小鼠适应饲养1周后进行攻毒试验。
细胞:小鼠肠道上皮细胞(MODE-K),本研究室保存于液氮罐中。
1.1.2 主要试剂: Luria-Bertani培养基(LB培养基),用于沙门菌及其噬菌体的扩增培养,购自北京陆桥技术有限责任公司;1 mol/L Tris-HCl (pH 7.5)、2×Taq Master Mix、DL2000、琼脂粉、琼脂糖等均购自生工生物工程(上海)股份有限公司;DMEM细胞培养液;胎牛血清;根据GenBank中收录的沙门菌与毒力相关的质粒、肠毒素、毒力岛基因,并参照文献[8-9]设计引物,所有引物均由生工生物工程(上海)股份有限公司合成,见表 1。
表 1. 主要毒力基因PCR引物序列 Table 1. PCR amplification primers
| Genes | Primers | Sequences | Annealing temperature/℃ | Product size/bp |
| invA | invA-F | GTGAAATTATCGCCACGTTCGGGCAA | 57 | 284 |
| invA-R | TCATCGCACCGTCAAAGGAACC | |||
| invH | invH-F | AGCAACTGGCCAACGCAAAT | 56 | 153 |
| invH-R | TGCAGTCTTTCATGGGCAGCAA | |||
| sscA | sscA-F | ATGAAAAAAGACCCGACCTA | 46 | 474 |
| sscA-2 | TTAGCTCCTGTCAGAAAGTT | |||
| sseC | sseC-F | ATGAATCGAATTCACATGAA | 46 | 1455 |
| sseC-R | TTAAGCGCGATAGCCAGCTA | |||
| sseD | sseD-F | ATGGAAGCGAGTAACGTAGC | 50 | 588 |
| sseD-R | TTACCTCGTTAATGCCCGGA | |||
| sseE | sseE-F | ATGGTGCAAGAAATAGAGCA | 46 | 417 |
| sseE-R | TTAAAAACGTCGCTGGATAA | |||
| mgtC | mgtC-F | AAAGACAATGGCGTCAACGTATGG | 52 | 500 |
| mgtC-2 | TTCTTTATAGCCCTGTTCCTGAGC | |||
| sopB | sopB-F | TCAGAAGRCGTCTAACCACTC | 52 | 517 |
| sopB-R | TACCGTCCTCATGCACACTC | |||
| fimA | fimA-F | AGACCGCCAGCAAATTAGTGT | 48 | 341 |
| fimA-R | TGACCTCTACTATTGCGAGTCTG | |||
| spvA | spvA-F | GCTAACTGTCGGGCAAAG | 50 | 432 |
| spvA-R | GGACAATGGCACGAACCT | |||
| spvB | spvB-F | CCTGATGTTCCACCACTTTC | 50 | 590 |
| spvB-R | ATGCCTTATCTGGCGATGT | |||
| spvC | spvC-F | AAGGTCGTTCAACAAGCC | 50 | 252 |
| spvC-R | CATTTCACCACCATCACG | |||
| spvD | spvD-F | CCCCTGATGATGAGAAGT | 45 | 316 |
| spvD-R | ACAGTGGGATTAGACAGC | |||
| spvR | spvR-F | AGGAAATCGGACCTACGG | 50 | 473 |
| spvR-R | TAACATCGCCAGCCCTTG | |||
| rfaQ | rfaQ-F | ATGCGTTTTCATGGAGACAT | 48 | 1014 |
| rfaQ-R | ATAGCAGGCTGTCCAAATCTA | |||
| rfbA | rfbA-F | ATGGAAATGAAAACGCGTAAG | 48 | 885 |
| rfbA-R | TTATAAACCTTTCACCATCTTCA | |||
| rfaJ | rfaJ-F | ATGGATTCATTTCCTGAGATAGA | 48 | 1006 |
| rfaJ-R | GGAAAAGTTTACGATAAAGATAT | |||
| rfaG | rfaG-F | ATTTTCCTTTTGGCGGTCTGC | 48 | 1125 |
| rfaG-R | CAACCATCTAAATCACCTGT | |||
| rfaF | rfaF-F | TTAAACGCCCTCTTCCGACAACA | 52 | 1047 |
| rfaF-R | ATGAAAATTTTGGTCATTGGCCC |
表选项
1.1.3 主要仪器: 恒温振荡器(HYL-C),太仓市强乐实验设备有限公司;生物安全柜(BHC-1000HA/B),苏净安泰仪器设备有限公司;离心机(5424R),德国Eppendorf公司;凝胶成像分析仪(Gel DocTM XR+),美国Bio-Rad公司;二氧化碳培养箱(BPN-80CW),美国Thermo公司;PCR仪(C1000 TouchTM),美国Bio-Rad公司;电泳仪(DYY-8C),北京六一仪器厂;二氧化碳培养箱(BPN-80CW),美国Thermo公司。
1.2 抗沙门菌噬菌体突变菌的筛选 参照文献[10]的次级感染法,筛选在无诱变剂作用下产生的沙门菌噬菌体抗性菌。
取斜面保藏的肠炎沙门菌ATCC 13076在LB琼脂平板上划线,37 ℃培养24 h,挑取单菌落接种于5 mL LB液体培养基中,37 ℃、200 r/min振荡培养过夜;将过夜菌液以1:100的接种量接种至新鲜的LB培养基培养至OD600=0.5;以感染复数(MOI)为1.0接入噬菌体PA13076,37 ℃培养至培养液完全裂解(约5 h),继续置于37 ℃培养至24 h。次日取100 μL裂解液涂布LB琼脂平板,37 ℃培养24 h,挑取单菌落接种至LB液体培养基中,将培养液连续划线3次纯化细菌,获得纯化沙门菌噬菌体抗性菌株。
1.3 沙门菌噬菌体抗性菌的鉴定 点样实验:取100 μL新鲜的沙门菌ATCC 13076及沙门菌噬菌体抗性菌液滴在平板上,用灭菌涂布棒将其均匀涂布在平板表面,待平板干燥,滴加10 μL的效价为108 PFU/mL沙门菌噬菌体PA13076,待其自然晾干后,倒置于37 ℃恒温培养箱中培养12 h,观察蚀斑情况。
吸附率测定:将宿主菌沙门菌ATCC 13076或者抗性菌株分别接种于LB肉汤中培养,对数生长期(OD600=0.5)的细菌培养液用新鲜LB肉汤调整至108 CFU/mL,分别加入105 PFU/mL的沙门菌噬菌体PA13076,混匀,置于37 ℃孵育吸附,于0、5、10、15、20、25和30 min分别取1 mL噬菌体培养液样品,立即离心(15000×g,1 min,4 ℃),测定上清中未吸附的噬菌体效价。实验重复3次。计算出不同时间点的未吸附噬菌体的百分比。
遗传稳定性:将抗性菌株与噬菌体感染培养于LB肉汤中,并连续转接培养20次,测定抗性菌株的生长情况。以抗性菌培养在未添加噬菌体的LB培养基中为对照。每次培养后,分别以双层平板法检测噬菌体。结果判定:在噬菌体存在时菌液发生裂解,说明该菌株对噬菌体抗性丧失。
1.4 宿主菌及抗性菌的生长曲线测定 取过夜培养的沙门菌ATCC 13076或者抗性菌R3,以1:100的比例接种于LB肉汤中,每株细菌设3个重复,在摇床中以37 ℃、200 r/min培养,每隔1 h测定1次OD600值,共测定10 h,根据测定结果绘制生长曲线。
1.5 主要毒力基因检测 挑取细菌单克隆于3 mL LB中,37 ℃、200 r/min过夜培养。热裂解法提取总DNA,同时按照质粒小提试剂盒的说明提取质粒,用于spv基因检测。PCR扩增:2×PCR mix 12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O 8.5 μL。PCR条件:94 ℃ 2 min;94 ℃ 30 s,退火30 s,72 ℃ 35 s,35个循环;72 ℃ 2 min。将PCR扩增产物1%琼脂糖电泳,凝胶紫外成像仪观察拍照。
1.6 小鼠LD50的测定 将ATCC 13076或者抗性菌R3对小鼠进行腹腔攻毒,通过预实验,先确定LD0、LD100及组间剂量。取过夜菌液2 mL,1:10接种于LB肉汤中,待其OD600值达到1.0时,参考文献[11]制备各菌液的5个浓度梯度,并分装在10 mL离心管中,4 ℃、8000 r/min离心10 min,弃上清,用冰预冷PBS洗3次,最终用PBS重悬,并对每个浓度的菌液进行平板计数。
每组10只小鼠,共分为5组,每只小鼠腹腔注射200 μL不同浓度的菌液,对照组腹腔注射200 μL PBS。每天观察并记录小鼠死亡情况,连续观察7 d。用改良寇氏法[11]计算沙门菌及抗性菌株的半数致死量(LD50)。
1.7 细胞粘附力测定 将对数生长期的细菌离心,PBS洗3次,用含10%胎牛血清的DMEM细胞培养液重悬,调整细菌浓度并平板计数,以感染复数(MOI)=100,即107 CFU/孔的菌悬液感染105 cell/孔贴壁MODE-K细胞。接种细菌后,细胞培养板室温800×g离心5 min使细菌与细胞充分接触。24孔板置37 ℃,5% CO2培养箱培养2 h,弃培养液,PBS洗涤5次。每孔加入100 μL的0.25%胰酶消化1 min,再加800 μL含10%胎牛血清的DMEM终止消化,细胞充分吹匀后加入100 μL 1% Triton X100裂解细胞1 min,反复吹打使细胞裂解。裂解液稀释后平板计数,比较标准菌株ATCC 13076和抗性菌株对MODE-K细胞粘附力的差别,每个菌株做5个复孔,试验重复3次。
2 结果和分析 2.1 沙门菌噬菌体抗性菌的筛选及鉴定 初筛获得抵抗沙门菌噬菌体PA13076裂解的抗性菌10株,命名为R1–R10。遗传稳定性结果表明,接入噬菌体PA13076并连续传代培养至第20代时,仅R3对沙门菌噬菌体具有抗性。R3在LB琼脂平板上生长良好,菌落表面光滑,呈乳白色,革兰氏染色为阴性杆菌。为了进一步鉴定R3的抗性,进行点样实验,如图 1所示,沙门菌噬菌体PA13076可以裂解其宿主菌沙门菌ATCC 13076,但是不能裂解抗性菌R3。噬菌体双层平板显示,宿主菌ATCC 13076被噬菌体PA13076裂解,形成空斑,抗性菌R3不被噬菌体PA13076裂解,无空斑形成。
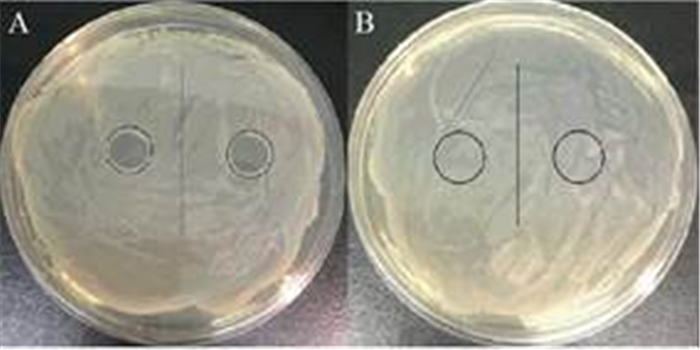 |
| 图 1 沙门菌噬菌体对宿主菌(ATCC 13076)及抗性菌(R3)的裂解情况 Figure 1 Spotting test of Salmonella enteritidis phage on its host (A) and the resistant bacteria (B). A: ATCC 13076; B: R3. |
| 图选项 |
沙门菌噬菌体PA13076对宿主菌ATCC 13076和抗性菌R3的吸附结果如图 2所示。随着吸附时间的增加,噬菌体对宿主菌ATCC 13076的吸附效率提高,20 min时吸附率最高,为63.89%±1%,但是噬菌体对抗性菌R3无吸附功能。
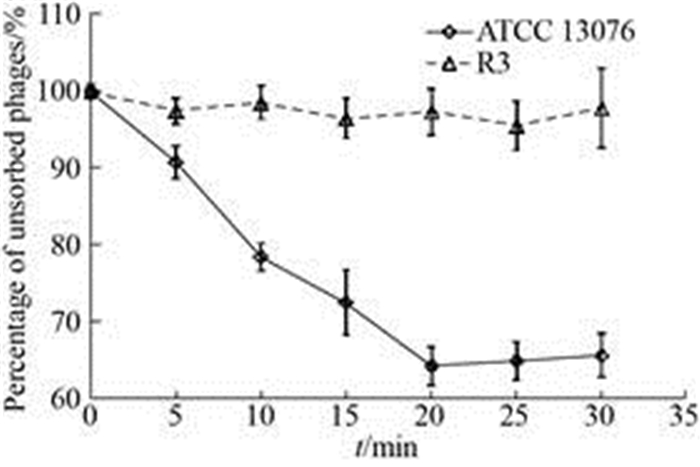 |
| 图 2 噬菌体对宿主菌(ATCC 13076)及抗性菌(R3)吸附特性的比较 Figure 2 Comparison of adsorption curve of Phage to its host (ATCC 13076) and the resistant strain (R3). |
| 图选项 |
2.2 生长曲线 宿主菌ATCC 13076和抗性菌R3的生长曲线如图 3所示。宿主菌ATCC 13076和抗性菌R3的生长曲线均呈S形,前7 h,与宿主菌ATCC 13076相比,抗性菌R3的生长略慢。
 |
| 图 3 细菌的生长曲线 Figure 3 Growth curve of the host strain (ATCC 13076) and the resistant strain (R3). |
| 图选项 |
2.3 毒力基因扩增 对宿主菌ATCC 13076和抗性菌R3的毒力基因进行PCR扩增,两株细菌均检出这些毒力基因,检测的目的条带的大小与预期目的条带的片段大小一致,毒力基因的PCR扩增见图 4。
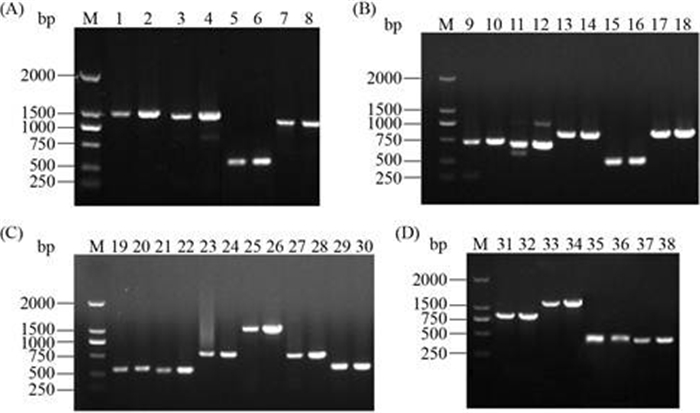 |
| 图 4 宿主菌及抗性菌的毒力基因扩增 Figure 4 PCR amplification of Salmonella strains ATCC 13076 and resistant Strain R3. The odd numbers represent ATCC 13076, the even numbers represent R3; M: DL2000 DNA marker; 1 and 2: rfaQ; 3 and 4: rfaJ; 5 and 6: fimA; 7 and 8: rfbA; 9 and 10: spvR; 11 and 12: spvA; 13 and 14: sseD; 15 and 16: spvC; 17 and 18: spvB; 19 and 20: invA; 21 and 22: invH; 23 and 24: sopB; 25 and 26: rfaF; 27 and 28: mgtC; 29 and 30: spvD; 31 and 32: rfaG; 33 and 34: sseC; 35 and 36: sscA; 37 and 38: sseE. |
| 图选项 |
2.4 LD50 通过寇氏法测定分析宿主菌ATCC 13076和抗性菌R3的LD50,比较两株细菌对小鼠毒力大小。结果如表 2所示,宿主菌ATCC 13076对小鼠的LD50为2.14×107 CFU,抗性菌R3对小鼠的LD50为3.74×107 CFU。抗性菌R3的LD50与宿主菌相比增加了74.8%,毒力减弱(P > 0.05)。
2.5 细胞粘附试验比较 宿主菌ATCC 13076和抗性菌R3对肠道上皮细胞MODE-K粘附能力结果见图 5,ATCC 13076对细胞MODE-K的粘附数量为(6.125±2.0073)× 105 CFU/孔,R3对细胞MODE-K的粘附数量为(4.850±1.8877)×105 CFU/孔;ATCC 13076的粘附率为6.125%,R3的粘附率为4.850%,宿主菌和抗性菌株粘附细胞的能力差异不显著(P > 0.05)。
 |
| 图 5 宿主菌及抗性菌对肠道上皮细胞MODE-K粘附率 Figure 5 The adherence rate of the host and the mutant to the intestinal epithelial cell MODE-K. |
| 图选项 |
表 2. 宿主菌及抗性菌的半数致死量(LD50) Table 2. The LD50 of host strain and mutant strain on mice
| Strains | LD50/ (CFU/mL) | 95% confidential intervals/(CFU/mL) | Standard error |
| ATCC 13076 | 1.07×108 | 7.7×107–1.48×108 | 0.1734 |
| R3 | 1.87×108 | 1.6×108–2.2×108 | 0.1359 |
表选项
3 讨论 本研究采用次级感染法和琼脂平板法从沙门菌噬菌体侵染裂解试验中分离到1株自发性且稳定遗传的噬菌体抗性菌。自然突变法是以噬菌体为选择压力,筛选噬菌体抗性菌株。次级培养法是获得抗噬菌体突变株最有效的方法[12]。本研究中抗性菌R3与宿主菌ATCC 13076的菌落都是圆形乳白色菌落,两者都是革兰氏阴性杆菌,菌落形态和菌体形态相比较无明显区别。于美玲等(2018)[13]同样采用次级感染方法,筛选出自发突变的干酪乳杆菌噬菌体抗性菌株,该噬菌体抗性菌株BIM在噬菌体存在条件下,连续传代3次均能正常生长,而且菌落形态、菌体形态、生化反应、ERIC-PCR鉴定、16S rDNA鉴定结果与宿主菌的结果一致,抗性菌BIM与敏感菌L. casei的鉴定结果表明两者都是干酪乳杆菌。但是,王绍花等(2010)[14]经自发突变选育的德氏乳杆菌噬菌体抗性菌的菌体形态与宿主菌不一致。我们最初筛选出10株噬菌体不敏感菌株,但是在随后的遗传稳定性实验中发现,其中的9株菌可以被噬菌体裂解,这种抗性不稳定的现象同样发生在Cluzel等(1987)[15]分离的自发突变的抗性保加利亚乳杆菌中,其抗性极不稳定,在培养3代后又表现为对噬菌体敏感的菌株。而本研究筛选的1株沙门菌噬菌体R3可完全抵抗噬菌体PA13076感染,抗性具有遗传稳定性。细菌与噬菌体相互作用的过程是基于噬菌体尾丝受体结合蛋白和宿主菌受体的特异性识别完成的,噬菌体完成杀菌过程的第一步是其必须具有识别功能,而完成识别吸附必须具备2个基本要素:噬菌体尾丝受体结合蛋白和宿主菌表面的受体。细菌细胞表面受体包括脂多糖(LPSs)、包膜多糖(CPSs)、表面附属物(Fagella、Fmbriae和Pili)、外膜蛋白(OMPs)等[16]。本研究的吸附实验结果表明,噬菌体PA13076对抗性菌R3无吸附功能,这说明有可能抗性菌表面的受体发生了改变,从而导致了噬菌体对其无吸附功能。细菌进化出多种策略来阻止噬菌体的吸附,如通过基因突变改变受体结构,或在受体外部通过物理性屏障隐藏受体等。这一结论已经被Marti等(2013)的研究所证实[17],外膜蛋白OmpC是沙门菌噬菌体S16的首选受体,与野生型相比,?OmpC突变体对噬菌体S16感染的敏感性降低了约20万倍,吸附率下降60%。细菌产生对噬菌体的抗性现象通常与细菌表面受体和噬菌体尾丝受体蛋白的改变有关[18]。
本研究比较了噬菌体抗性菌株与宿主菌的小鼠致病力及细胞粘附率,均发现噬菌体抗性菌株的致病力和粘附率变弱,本研究结果与Gu等(2012)[10]的研究结果一致。针对肺炎克雷伯菌的噬菌体抗性菌的研究,也得出同样的结论,这些噬菌体抗性菌在动物体内的毒性持续性降低。与野生型肺炎克雷伯氏菌K7(MLD)=2.56103 CFU/小鼠相比,这些抗性菌株的毒力要弱得多[最小致死剂量(MLD)=1.36109 CFU/小鼠]。也许因为噬菌体抗性菌很容易被动物机体吞噬细胞和免疫系统清除,才导致其动物体内毒性降低[19]。
与细菌耐药性相比,细菌与噬菌体共进化过程中,噬菌体抗性菌株的出现是一个自然的过程。尽管在实验室中,细菌对噬菌体的抗性普遍存在,但迄今为止,抗性菌株的出现只是噬菌体治疗有效性的一个小问题[20]。体外实验表明,与单噬菌体相比,噬菌体混合物能显著降低突变频率,并显示出较高的裂解效果[21]。虽然在使用鸡尾酒时也出现了抗噬菌体突变菌,但该过程需要更长的时间[22]。而且,Khalifa等(2018)[23]分离出一种新的噬菌体EFLK1,该噬菌体对噬菌体抗性株EFDG1R及其亲本VRE(粪肠球菌v583)均有效。今后,在噬菌体治疗实验中,将两种噬菌体组合在一种鸡尾酒中,无论噬菌体抗性菌株抗性如何,都能被裂解。与宿主菌相比,噬菌体作用后的细菌表面受体改变可能导致抗性菌毒力降低,但是这种抗性改变存在一定的不稳定性,从噬菌体治疗的角度,使用噬菌体鸡尾酒可以更有效抑制抗性菌出现问题。在噬菌体鸡尾酒中,许多不同类型的噬菌体感染同一细菌物种或菌株,从而使抗性菌出现的可能性大大降低。
尽管新抗生素的研发速度远跟不上超级细菌的“升级”速度,但当前随着噬菌体生物学的高速发展,对目标细菌具有无限期裂解作用的噬菌体的发现却显示出噬菌体应用的巨大前景。
References
| [1] | LeLièvre V, Besnard A, Schlusselhuber M, Desmasures N, Dalmasso M. Phages for biocontrol in foods:what opportunities for Salmonella sp. control along the dairy food chain? Food Microbiology, 2018, 78: 89-98. |
| [2] | European Food Safety Authority, European Centre for Disease Prevention and Control. The European Union summary report on trends and sources of zoonoses, zoonotic agents and food-borne outbreaks in 2016. EFSA Journal, 2017, 15(12): e05077. |
| [3] | Bren L. Bacteria-eating virus approved as food additive. FDA Consumer, 2007, 41(1): 20-22. |
| [4] | Labrie SJ, Samson JE, Moineau S. Bacteriophage resistance mechanisms. Nature Reviews Microbiology, 2010, 8(5): 317-327. DOI:10.1038/nrmicro2315 |
| [5] | Górski A, Jończyk-Matysiak E, ?usiak-Szelachowska M, Mi?dzybrodzki R, Weber-D?browska B, Borysowski J, Letkiewicz S, Bagińska N, Sfanos KS. Phage therapy in prostatitis:recent prospects. Frontiers in Microbiology, 2018, 9: 1434. |
| [6] | Wagner PL, Waldor MK. Bacteriophage control of bacterial virulence. Infection and Immunity, 2002, 70(8): 3985-3993. DOI:10.1128/IAI.70.8.3985-3993.2002 |
| [7] | Brüssow H, Canchaya C, Hardt WD. Phages and the evolution of bacterial pathogens:from genomic rearrangements to lysogenic conversion. Microbiology and Molecular Biology Reviews, 2004, 68(3): 560-602. DOI:10.1128/MMBR.68.3.560-602.2004 |
| [8] | Cheng Q, Pang RL, Wang RC, Su FC, Liu JJ, Li Y. Comparative study on pathogenicity of Salmonella isolates from different sources of laboratory mice and the detection of their virulence genes. Chinese Journal of Zoonoses, 2013, 29(5): 460-465. (in Chinese) 程琼, 庞瑞亮, 王若晨, 苏方超, 刘军军, 李郁. 不同源沙门氏菌对小鼠致病力的比较与毒力基因检测. 中国人兽共患病学报, 2013, 29(5): 460-465. DOI:10.3969/cjz.j.issn.1002-2694.2013.05.008 |
| [9] | Liu SH, Wu KM, Zhou CY, Liang JZ, Wei P. Foodborn Salmonella isolates:pathogenicity evaluation and detection of virulence genes. Food Science, 2018, 39(17): 182-186. (in Chinese) 刘书宏, 吴科敏, 周辰瑜, 梁竞臻, 韦平. 食源性沙门氏菌分离株致病性研究和毒力相关基因检测. 食品科学, 2018, 39(17): 182-186. DOI:10.7506/spkx1002-6630-201817030 |
| [10] | Gu JM, Liu XH, Li Y, Han WY, Lei LC, Yang YJ, Zhao HL, Gao J, Song J, Lu R, Sun CJ, Feng X. A method for generation phage cocktail with great therapeutic potential. PLoS One, 2012, 7(3): e31698. DOI:10.1371/journal.pone.0031698 |
| [11] | Huang XD, Cai JX, Lin HH. Toxicological study on volatile oil of Geranium. Lishizhen Medicine and Materia Medica Research, 2012, 23(1): 138-139. (in Chinese) 黄晓冬, 蔡建秀, 林海鸿. 天竺桂挥发油的毒理学研究. 时珍国医国药, 2012, 23(1): 138-139. DOI:10.3969/j.issn.1008-0805.2012.01.061 |
| [12] | Denes T, den Bakker HC, Tokman JI, Guldimann C, Wiedmann M. Selection and Characterization of phage-resistant mutant strains of Listeria monocytogenes reveal host genes linked to phage adsorption. Applied and Environmental Microbiology, 2015, 81(13): 4295-4305. DOI:10.1128/AEM.00087-15 |
| [13] | 于美玲.干酪乳杆菌噬菌体抗性菌株抗性机制研究.东北农业大学博士学位论文, 2018. |
| [14] | 王绍花.乳杆菌噬菌体的分离、功能基因表达及抗噬菌体菌株的选育.山东大学博士学位论文, 2010. |
| [15] | Cluzel PJ, Serio J, Accolas JP. Interactions of Lactobacillus bulgaricus temperate bacteriophage 0448 with host strains. Applied and Environmental Microbiology, 1987, 53(8): 1850-1854. DOI:10.1128/AEM.53.8.1850-1854.1987 |
| [16] | Uddin MJ, Dawan J, Ahn J. Assessment of the alteration in phage adsorption rates of antibiotic-resistant Salmonella typhimurium. Archives of Microbiology, 2019, 201(7): 983-989. DOI:10.1007/s00203-019-01667-3 |
| [17] | Marti R, Zurfluh K, Hagens S, Pianezzi J, Klumpp J, Loessner MJ. Long tail fibres of the novel broad-host-range T-even bacteriophage S16 specifically recognize Salmonella OmpC. Molecular Microbiology, 2013, 87(4): 818-834. DOI:10.1111/mmi.12134 |
| [18] | Dunne M, Denyes JM, Arndt H, Loessner MJ, Leiman PG, Klumpp J. Salmonella phage S16 tail fiber adhesin features a rare polyglycine rich domain for host recognition. Structure, 2018, 26(12): 1573-1582. DOI:10.1016/j.str.2018.07.017 |
| [19] | Capparelli R, Nocerino N, Iannaccone M, Ercolini D, Parlato M, Chiara M, Iannelli D. Bacteriophage therapy of Salmonella enterica:a fresh appraisal of bacteriophage therapy. The Journal of Infectious Diseases, 2010, 201(1): 52-61. DOI:10.1086/648478 |
| [20] | rm l AM, Jalasvuori M. Phage therapy:should bacterial resistance to phages be a concern, even in the long run?. Bacteriophage, 2013, 3(1): e24219. |
| [21] | Yu L, Wang S, Guo ZM, Liu HT, Sun DG, Yan GM, Hu DL, Du CT, Feng X, Han WY, Gu JM, Sun CJ, Lei LC. A guard-killer phage cocktail effectively lyses the host and inhibits the development of phage-resistant strains of Escherichia coli. Applied Microbiology and Biotechnology, 2018, 102(2): 971-983. DOI:10.1007/s00253-017-8591-z |
| [22] | Tanji Y, Shimada T, Yoichi M, Miyanaga K, Hori K, Unno H. Toward rational control of Escherichia coli O157:H7 by a phage cocktail. Applied Microbiology and Biotechnology, 2004, 64(2): 270-274. |
| [23] | Khalifa L, Gelman D, Shlezinger M, Dessal AL, Coppenhagen-Glazer S, Beyth N, Hazan R. Defeating antibiotic- and phage-resistant Enterococcus faecalis using a phage cocktail in vitro and in a clot model. Frontiers in Microbiology, 2018, 9: 326. DOI:10.3389/fmicb.2018.00326 |
