吴少鹏1#, 王国华1#, 赵效南1, 杨杰1, 鞠孜敬1, 蒋智宇1, 孙淑红1,2,3


1. 山东农业大学动物科技学院, 山东 泰安 271000;
2. 山东省动物生物工程与疾病防治重点实验室, 山东 泰安 271000;
3. 山东省畜禽疫病防治工程技术研究中心, 山东 泰安 271000
收稿日期:2019-05-14;修回日期:2019-09-04;网络出版日期:2019-09-17
基金项目:国家十三五重点研发计划(2016YFD0501608);泰山****计划(201511023);山东省"双一流"计划资金(SYL2017YSTD11)
*通信作者:孙淑红, E-mail:sunshuhong@sdau.edu.cn.
#共同第一作者。
摘要:[目的] 旨在对从山东省某地区4个健康奶牛养殖场分离到的大肠埃希菌进行优势血清型、耐药特性、Ⅰ类整合子基因盒携带情况以及系统进化群分析。[方法] 采集194份来自山东省某地区4个规模化奶牛场奶牛新鲜粪便样品,进行大肠埃希菌分离和鉴定,利用常用大肠埃希菌诊断血清进行血清型鉴定;利用10%的绵羊血平板检测溶血性;利用K-B法检测对14种常规抗菌药物的敏感性;利用聚合酶链式反应(PCR)检测革兰阴性菌常见的6大类24种耐药基因、Ⅰ类整合子基因盒结构并对目的条带测序分析;利用细菌多位点序列分型(Multilocus sequence typing,MLST)技术分析大肠埃希菌的ST型并使用eBURST v3软件分析菌株之间的克隆关系。[结果] 从194份新鲜粪便样品中分离到171株大肠埃希菌,其中主要为致病性(19.9%)和侵袭性大肠埃希菌(17.0%),优势血清型分别为O128:K67(12/171)和O143:K7(12/171)。另外,具有溶血性的大肠埃希菌阳性率为9.4%(16/171);药敏试验结果显示多重耐药菌株的比率为22.2%,其中对氨苄西林耐药率最高为33.9%,四环素次之,为24.0%;PCR检测耐药基因和整合子结果显示,59.1%的菌株携带β-内酰胺类耐药基因blaTEM,59.1%的菌株携带氨基糖苷类耐药基因ant(2'),未检测到四环素耐药基因tetA和tetB;Ⅰ类整合子的阳性率为4.1%(7/171),dfrA12-aadA2-sul1为优势基因盒结构(4/171);MLST将大肠埃希菌分为8种ST型,其中,ST155(10/171)和ST58(45/171)形成一个克隆复合物且没有发现新的ST型。[结论] 本研究证实,从该地区规模化健康奶牛场新鲜粪便中分离到的大肠埃希菌优势血清型为O128:K67和O143:K7;少部分大肠埃希菌具有溶血性;仅对氨苄西林、四环素等具有较高的耐药率;优势基因盒结构为dfrA12-aadA2-sul1;MLST分型显示不同奶牛场分离出亲缘关系较近的菌株,其分布具有多态性,血清型与ST型之间无相关性。本研究表明源自表观健康的奶牛的大肠埃希菌存在多重耐药现象,具有食品公共卫生安全隐患,该研究对于提升规模化奶牛场奶制品的安全生产与质量评估具有一定的理论指导意义。
关键词:奶牛源大肠埃希菌血清型耐药特点Ⅰ类整合子MLST
Serotyping, drug resistance and molecular characteristics of Escherichia coli from dairy cows in a region of Shandong province
Shaopeng Wu1#, Guohua Wang1#, Xiaonan Zhao1, Jie Yang1, Zijing Ju1, Zhiyu Jiang1, Shuhong Sun1,2,3


1. College of Animal Science and Technology, Shandong Agricultural University, Tai'an 271000, Shandong Province, China;
2. Shandong Provincial Key Laboratory of Animal Biotechnology and Disease Control and Prevention, Tai'an 271000, Shandong Province, China;
3. Shandong Provincial Engineering Technology Research Center of Animal Disease Control and Prevention, Tai'an 271000, Shandong Province, China
Received: 14 May 2019; Revised: 4 September 2019; Published online: 17 September 2019
*Corresponding author: Shuhong Sun, E-mail: sunshuhong@sdau.edu.cn.
Foundation item: Supported by the National Key Research and Development Program of China (2016YFD0501608), by the Taishan Scholars Project (201511023) and by the Funds of Shandong "Double Tops" Program (SYL2017YSTD11)
#These authors contributed equally to this work.
Abstract: [Objective] To analyze the dominant serotype, class Ⅰ integrons gene cassette, drug resistance characteristics and phylogenetic of Escherichia coli isolated from four large-scale healthy dairy farms in Shandong Province. [Methods] We collected 194 samples of fresh feces from dairy cows in 4 large-scale dairy farms. The isolation and identification of E. coli was tested by using laboratory method, and the serotype was identified by the E. coli diagnostic serums commonly used. The hemolysis of E. coli was detected by 10% sheep blood plate while the sensitivity of 14 conventional antibiotics was detected by K-B method and the ST type of E. coli was analyzed by MLST technique and the cloning relationship among the strains was analyzed by eBURST v3 software. [Results] The results showed that 171 strains of E. coli were isolated from 194 fresh feces samples, mainly pathogenic E. coli (19.9%) and invasive E. coli (17.0%), and the dominant serotypes were O128:K67 (12/171) and O143:K7 (12/171). In addition, the positive rate of hemolytic E. coli was 9.4% (16/171) and the drug susceptibility test showed that the ratio of multi-drug resistant strains was 22.2%, among which the highest resistance rate to ampicillin was 33.9%, followed by tetracycline, which was 24.0%. The results of PCR detection of drug resistance genes and integrons showed that 59.1% of the strains carried the β-lactam resistance gene blaTEM, 59.1% of the strains carried the aminoglycoside resistance gene ant(2'), and no tetracycline resistance gene (tetA and tetB) was detected. The positive rate of integron I was 4.1% (7/171), dfrA12-aadA2-sul1 was the dominant gene cassette structure (4/171); MLST divided E. coli into 8 ST types, of which ST155 (10/171) and ST58 (45/171) formed a clonal complex and no new ST type was found. [Conclusion] This study confirmed that the dominant serotypes of E. coli isolated from fresh feces in large-scale healthy dairy farms in the region were O128:K67 and O143:K7. Some E. coli were hemolytic and the resistance rate was only high in ampicillin and tetracycline. Moreover, the dominant gene cassette structure is dfrA12-aadA2-sul1. The MLST classification showed that the isolates from different dairy farms were closely related, indicating that the distribution of E. coli in cattle origin was polymorphic, and there was no correlation between serotype and ST type. There is a multi-drug resistance phenomenon in E. coli from dairy cows which is potential dangers of food public safety. This research has certain theoretical guiding significance for improving the safe production and quality evaluation of dairy products in large-scale dairy farms.
Keywords: Escherichia coli from dairy cattleserotypedrug resistanceclass Ⅰ integrantMLST
大肠埃希菌是一种常见的人畜共患病病原,严重威胁人类和畜禽的健康[1],并作为饮水和食物是否被污染的重要评判指标。致病性大肠埃希菌包括产肠毒素、肠致病性、肠出血性大肠埃希菌等,是畜禽养殖业中细菌病的常见病原,给养殖业带来不可估量的经济损失[1]。动物的粪便被认为是致病性大肠埃希菌的主要来源。对于养牛业而言,致病性大肠埃希菌引起犊牛白痢[2]、肠毒血症、奶牛乳房炎[3-4]等一系列疾病。随着养殖业的快速发展和养殖规模的不断扩大,为了提高奶牛生长效率以及预防、治疗奶牛疾病等,抗生素的使用率逐年提高,抗生素的滥用使得大肠埃希菌出现耐药现象[5-6]。多重耐药致病性大肠埃希菌的出现,不仅增加了治疗的困难,而且易引发公共卫生安全问题[7-8]。尽管致病性大肠埃希菌集中于某些特定的血清型,但不同地区血清型差异较大[9]。对牛场致病血清型大肠埃希菌的监控,尤其是掌握不同血清型所占的比例和流行情况,对发展健康的牛养殖业有着重要的意义。大肠埃希菌血清型、致病性和菌株分子流行特征及相关关系方面的研究也愈来愈受到关注[10]。山东省作为奶牛养殖大省,是全国主要的奶源供应地。大肠杆菌病在奶牛群中一旦暴发,严重影响奶牛养殖业的健康发展。目前对致病性大肠埃希菌在山东省内规模化奶牛场流行情况的研究不多,为防止其对牛奶产品的污染,掌握大肠埃希菌在奶牛场的流行情况十分必要。
本试验拟对2017年从山东某地4个规模化奶牛场采集奶牛新鲜粪便,分离鉴定奶牛源大肠埃希菌,对其进行血清型、耐药性、耐药基因、Ⅰ类整合子和MLST分型检测,旨在了解山东地区奶牛源致病性大肠埃希菌优势血清型、耐药特点和MLST分型,为该地区奶牛源大肠埃希菌病的致病机理和防控提供试验依据以及抗生素的合理使用提供参考,同时对公共卫生安全起到指示作用。
1 材料和方法 1.1 样品和菌株 194份来自山东省某地区4个规模化奶牛场奶牛新鲜粪便样品。质控大肠埃希菌(菌株编号为ATCC25922),由山东农业大学家禽疫病防控研究室保存。
1.2 主要试剂 革兰染色液、肠杆菌科细菌生化鉴定盒、试验用药敏纸片购自杭州滨和微生物试剂有限公司;大肠埃希菌诊断血清购自宁波天润生物药业有限公司;PCR试剂、DNA Marker DL2000购自上海生工生物工程公司;DH5α购自北京全式金生物技术有限公司;pMD18-T购自大连宝生物生物工程有限公司;细菌基因组DNA提取试剂盒、胶回收试剂盒购自北京天根生物科技有限公司。
1.3 大肠埃希菌的分离与鉴定 将粪便样品用无菌生理盐水进行适当的稀释,然后取100 μL涂布伊红美兰培养基,37 ℃恒温培养18–24 h后,挑取平板上紫黑色、有金属光泽的典型菌落在麦康凯培养基平板上划线培养,37 ℃恒温培养18–24 h后,挑取粉红色菌落利用API 20E系统(Sysmex-bioMerieux, Tokyo, Japan)做生化鉴定。
1.4 血清型鉴定 通过平板凝集试验,按照致病性、产毒性、侵袭性大肠埃希菌诊断血清试剂盒,出血性大肠埃希菌O104、O157诊断血清试剂盒以及H4、H7诊断血清试剂盒的说明书对大肠埃希菌分离株进行血清型鉴定。
1.5 β-溶血环实验 取20 μL大肠埃希菌菌液加入含有5 mL灭菌的LB液体培养基的无菌摇管内,37 ℃摇床内恒温培养12 h。采用涂布法将菌液接种于绵羊血培养基上放置37 ℃恒温培养箱中进行培养,培养12–24 h,每隔8 h观察1次菌落,在之后继续培养中仔细观察培养基上菌落的形态,观察是否带有圆形湿润半透明乳白色可疑菌落。
1.6 药敏试验 采用美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的K-B法进行14种常用抗菌药物的敏感性检测。本试验用大肠埃希菌ATCC25922作为药敏试验质控菌株,实验过程做一个平行重复,药敏试验结果所表现出的敏感(Sensitive,S)、耐药(Resistance,R)、中介(Intermediary,I)参照CLSI 2018判定标准。对3类及3类以上药物产生耐药的菌株被定义为多重药耐药菌株(MDR)。
1.7 扩增耐药基因和Ⅰ类整合子基因盒序列PCR检测 参照GenBank的大肠埃希菌不同耐药基因和已发表的文献设计24对耐药基因和Ⅰ类整合子基因盒序列(表 1)由生工生物工程(上海)股份有限公司合成。
表 1. 耐药基因和Ⅰ类整合子基因盒的引物序列 Table 1. Primer sequences of drug resistance genes and class Ⅰ integrons gene cassette
| Drug resistance gene | Primer name | Sequences (5′→3′) | Product length/bp | References |
| β-lactam | blaTEM | F: CAGCGGTAAGATCCTTGAGA | 734 | [12] |
| R: ACTCCCCGTCGTGTAGATAA | ||||
| blaSHV | F: ATGCGTTATATTCGCCTGTG | 860 | [12] | |
| R: TTAGCGTTGCCAGTGCTCGA | ||||
| blaPSE | F: ATGCTTTTATATAAAATGTG | 914 | [12] | |
| R: TCAGCGCGACTGTGATGTAT | ||||
| blaOXA | F: ACACAATACATATCAACTTCGC | 813 | [12] | |
| R: AGTGTGTTTAGAATGGTGATC | ||||
| blaCTX-M | F: ACGTTGCATATATCGACGTTG | 544 | [12] | |
| R: GCAGCGACTGTCGTACCCTAT | ||||
| blaCMY-2 | F: TAATTACGGAACTGATTTC | 1250 | [12] | |
| R: CCTTGCTGTATTTTTGTTA | ||||
| Quinolones | qnrA | F: ATTTCTCACGCCAGGATTTG | 519 | [13] |
| R: GATCGGCAAAGGTCAGGTCA | ||||
| qnrB | F: GATCGTGAAAGCCAGAAAGG | 469 | [13] | |
| R: ACGATGCCTGGTAGTTGTCC | ||||
| qnrC | F: ATTTCTCACAGGCAAACT | 666 | [13] | |
| R: CTGGAATAACAATCACCC | ||||
| qnrD | F: TTTTCGCTAACTAACTCGC | 984 | [13] | |
| R: GAAAG1`GATAAACAGGCAAAT | ||||
| qnrS | F: ACGACATTCGTCAACTGCAA | 417 | [13] | |
| R: TAAATTGGCACCCTGTAGGC | ||||
| oqxA | F: GCAGGTCCAGCAGCGGGTAG | 218 | [13] | |
| R: CTTCCTGCCCGAGTATCGTG | ||||
| aac(6')-Ib-cr | F: TTGCGATGCTCTATGAGTGGCTA | 482 | [13] | |
| R: CTCGAATGCCTGGCGTGTTT | ||||
| Aminoglycosides | aac(3)-Ⅰ | F: ACCTACTCCCAACATCAGCC | 169 | [6] |
| R: ATATAGATCTCACTACGCGC | ||||
| aac(3)-Ⅱ | F: ACTGTGATGGGATACGCGTC | 237 | [6] | |
| R: CTCCGTCAGCGTTTCAGCTA | ||||
| aac(3)-Ⅲ | F: CACAAGAACGTGGTCCGCTA | 185 | [6] | |
| R: AACAGGTAAGCATCCGCATC | ||||
| aac(3)-Ⅳ | F: CTTCAGGATGGCAAGTTGGT | 286 | [6] | |
| R: TCATCTCGTTCTCCGCTCAT | ||||
| ant(2”) | F: ATGTTACGCAGCAGGGCAGTCG | 187 | [6] | |
| R: CGTCAGATCAATATCATCGTGC | ||||
| Tetracycline | tetA | F: GCGCCTTTCCTTTGGGTTCT | 831 | [6] |
| R: CCACCCGTTCCACGTTGTTA | ||||
| tetB | F: CATTAATAGGCGCATCGCTG | 930 | [6] | |
| R: TGAAGGTCATCGATAGCAGG | ||||
| Sulfonamide | sul1 | F: TGGTGACGGTGTTCGGCATTC | 789 | [14] |
| R: GCGAGGGTTTCCGAGAAGGTG | ||||
| sul2 | F: CGGCATCGTCAACATAACC | 722 | [14] | |
| R: GTGTGCGGATGAAGTCAG | ||||
| sul3 | F: CATTCTAGAAAACAGTCGTAGTTCG | 990 | [14] | |
| R: CATCTGCAGCTAACCTAGGGCTTTGA | ||||
| Amide alcohol | cmlA | F: CTGAGGGTGTCGTCATCTAC | 517 | [15] |
| R: GCTCCGACAATGCTGACTAT | ||||
| Cassette | FP: TCATGGCTTGTTATGACTGT | [16] | ||
| RP: GTAGGGCTTATTATGCACGC |
表选项
利用本实验室建立的检测耐药基因和整合子的PCR方法对奶牛源大肠埃希菌分离株进行耐药基因及整合子的检测。细菌DNA提取试剂盒提取细菌总DNA作为反应模板,退火温度依据扩增引物的Tm值的不同而定。将PCR产物于1%的琼脂糖凝胶进行电泳,电泳结果在凝胶成像仪上观察并保存结果。之后利用天根生物科技有限公司胶回收试剂盒回收扩增产物,将胶回收产物连接pMD18-T载体。连接产物转化DH5α感受态细胞,经PCR鉴定,选取阳性菌株提取质粒,送生工生物工程(上海)股份有限公司进行测序。然后进行BLAST比对,最终确定耐药基因和Ⅰ类整合子可变区耐药基因盒所含耐药基因种类。
1.8 MLST分子分型 根据参考文献[11]合成7对管家基因(adk、fumC、gyrB、Icd、mdh、purA和recA)引物(表 2),并进行PCR扩增,将PCR扩增产物送生工生物工程(上海)股份有限公司进行测序,测序结果使用Chromas及DNA Star软件进行修正后,提交Pasteur在线数据库进行处理(http://enterobase.warwick.ac.uk/species/ecoli/allele_st_search),获得各管家基因的等位基因编码(allele coding),并形成各菌株的序列型(ST型)。
表 2. 管家基因引物序列 Table 2. Primer sequences of house-keeping genes
| Gene | Primer pair sequences (5′→3′) | Product length/bp | Annealing temperature/℃ |
| adk | F: ATTCTGCTTGGCGCTCCGGG R: CCGTCAACTTTCGCGTATTT | 583 | 54 |
| fumC | F: TCACAGGTCGCCAGCGCTTC R: GTACGCAGCGAAAAAGATTC | 806 | 54 |
| gyrB | F: TCGGCGACACGGATGACGGC R: ATCAGGCCTTCACGCGCATC | 911 | 60 |
| icd | F: ATGGAAAGTAAAGTAGTTGTTCCGGCACA R: GGACGCAGCAGGATCTGTT | 878 | 54 |
| mdh | F: ATGAAAGTCGCAGTCCTCGGCGCTGCTGGCGG R: TTAACGAACTCCTGCCCCAGAGCGATATCTTTCTT | 932 | 60 |
| purA | F: CGCGCTGATGAAAGAGATGA R: CATACGGTAAGCCACGCAGA | 816 | 54 |
| recA | F: CGCATTCGCTTTACCCTGACC R: TCGTCGAAATCTACGGACCGGA | 780 | 58 |
表选项
2 结果和分析 2.1 大肠埃希菌的分离鉴定 在4个奶牛场按泌乳期奶牛存栏量随机采集新鲜粪便样品,采样时,用无菌PE手套抓取新鲜牛粪中心,编号后低温运输并及时处理。在伊红美蓝培养基上为紫黑色、有金属光泽的圆形菌落;在麦康凯培养基上形成中等大小、表面光滑、边缘整齐的粉红色菌落,染色镜检为短杆状、两端略圆的革兰阴性菌。生化试验结果与相对应的生化鉴定编码手册及参照《伯杰氏细菌鉴定手册第八版》标准作比较,判定为大肠埃希菌。根据培养特性和形态学观察共鉴定出171株符合大肠埃希菌特性的奶牛源大肠埃希菌(表 3)。
表 3. 奶牛源大肠埃希菌分离结果 Table 3. Separation results of E. coli from dairy cows
| Number | Dairy farm 1 | Dairy farm 2 | Dairy farm 3 | Dairy farm 4 |
| Samples | 45 | 30 | 50 | 69 |
| Positive strains | 43 | 27 | 46 | 55 |
| Positive rate | 95.6% | 90.0% | 92.0% | 80.9% |
表选项
2.2 菌株血清型的鉴定 通过平板凝集实验我们对分离的171株大肠埃希菌进行血清型鉴定(表 4),其中致病性大肠埃希菌占19.9%,优势血清型为:O128:K67(12株)和O86:K61(10株);侵袭性大肠埃希菌占17.0%,优势血清型为:O128:K67(11株)和O143:K7(12株);产肠毒素大肠埃希菌占2.9%;出血性大肠埃希菌血清型中没有检测到O104、O157血清型,H4、H7血清型大肠埃希菌各占4.1%和2.3%。
表 4. 大肠埃希菌血清型鉴定结果 Table 4. Serotype identification results of E. coli
| Serotype | Classification | Proportion/% |
| EPEC | O128:K67(B12) | 7.0(12/171) |
| O86:K61(B7) | 5.9(10/171) | |
| O26:K60(B6) | 3.5(6/171) | |
| O44:K74(L) | 1.2(2/171) | |
| O142:K86(B) | 1.2(2/171) | |
| O28:K60(B60) | 1.2(2/171) | |
| IEC | O29:K | 3.5(6/171) |
| O28:K73 | 6.4(11/171) | |
| O143:K7 | 7.0(12/171) | |
| ETEC | O6:K15 | 1.8(3/171) |
| O7:K1(L) | 1.2(2/171) | |
| EHEC | O104, O157 | 0(0/171) |
| H4 | 4.1(7/171) | |
| H7 | 2.3(4/171) |
表选项
2.3 溶血环试验结果 将分离到的大肠埃希菌做绵羊血平板培养,结果显示,171份大肠埃希菌分离株中产生β-溶血环的为16株,阳性率为9.4%。产溶血环现象如图 1所示。
 |
| 图 1 产生β-溶血环的大肠埃希菌血平板 Figure 1 Blood plate of E. coli producing β-hemolytic ring. |
| 图选项 |
2.4 耐药表型 采用CLSI推荐的K-B法检测了大肠埃希菌分离株对14种常规药物的敏感性(表 5),结果显示大肠埃希菌对氨苄西林耐药率最高为33.9%,其次为四环素,耐药率为24.0%,但对大部分药物例如氟苯尼考、头孢曲松等抗生素表现为敏感或者中度敏感。多重耐药菌株的比率占22.2% (图 2),产生多重耐药菌株的菌株中多重耐药种类往往集中在3–7种药物之间,占多重耐药菌株的86.8%。
表 5. 奶牛源大肠埃希菌药敏试验结果 Table 5. Results of drug sensitivity test of E. coli from dairy cows
| Antibacterial medicine | S/% | R/% | I/% |
| Penicillin | |||
| Ampicillin | 33.9(58/171) | 37.4(64/171) | 28.7(49/171) |
| Ogmentin | 8.8(15/171) | 17.5(30/171) | 73.7(126/171) |
| Cephalosporins | |||
| Ceftriaxone | 4.1(7/171) | 7.0(12/171) | 88.9(152/171) |
| Cefotaxime | 7.0(12/171) | 5.9(10/171) | 87.1(149/171) |
| Cefoxitin | 7.0(12/171) | 7.6(13/171) | 85.4(146/171) |
| Aminoglycosides | |||
| Butamine | 7.1(13/171) | 8.8(15/171) | 83.6(143/171) |
| Gentamicin | 12.9(22/171) | 16.4(28/171) | 70.8(121/171) |
| Tobramycin | 21.6(37/171) | 21.6(37/171) | 66.1(113/171) |
| Tetracycline | |||
| tetracycline | 24.0(41/171) | 40.4(69/171) | 35.7(61/171) |
| Sulfonamide | |||
| Compound sulfamethoxazole | 11.1(19/171) | 3.5(6/171) | 85.4(146/171) |
| Quinolones | |||
| Ciprofloxacin | 5.3(9/171) | 7.6(13/171) | 87.1(149/171) |
| Nalidixic acid | 7.0(12/171) | 8.2(14/171) | 84.8(145/171) |
| Amide alcohol | |||
| Chloramphenicol | 5.9(10/171) | 7.6(13/171) | 86.6(148/171) |
| Florfenicol | 4.1(7/171) | 3.5(6/171) | 92.4(158/171) |
表选项
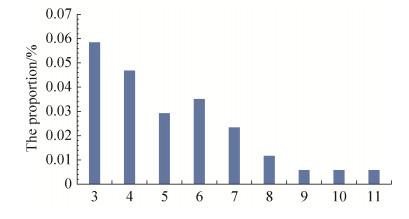 |
| 图 2 171株大肠埃希菌中多重耐药大肠埃希菌的占比 Figure 2 The proportion of multidrug-resistant E. coli in 171 strains. 3–11 in the abscissa indicates the number of resistant strains of E. coli. |
| 图选项 |
2.5 耐药基因的检测结果 利用PCR方法检测大肠埃希菌耐药基因,结果显示,β-内酰胺类耐药基因中blaTEM (blaTEM-1占36.3%,blaTEM-116占22.8%)携带率最高为59.1% (图 3-A),其次为blaCTX-M-15(4.7%)、blaOXA-1(1.8%)和blaCMY-2(0.6%),没有检测到blaPSE、blaSHV;喹诺酮类耐药基因中aac(6′)-Ib-cr携带率最高为4.1% (图 3-B),其次为qnrS(1.8%)、oqxA(1.2%)和qnrD(0.6%),没有检测到qnrA、qnrB、qnrC耐药基因;氨基糖苷类耐药基因中以携带ant(2′)为主检出率为40.9%(图 3-C),其次为AAC2(2.3%),没有检测到AAC1、AAC3和AAC4;磺胺类耐药基因以携带sul2为主检出率为16.4% (图 3-D),其次为sul3(10.5%)和sul1(3.5%);酰胺醇类耐药基因cmlA为0.6% (图 3-E),另外,在本研究中没有检测到四环素耐药基因tetA (图 3-F)和tetB。
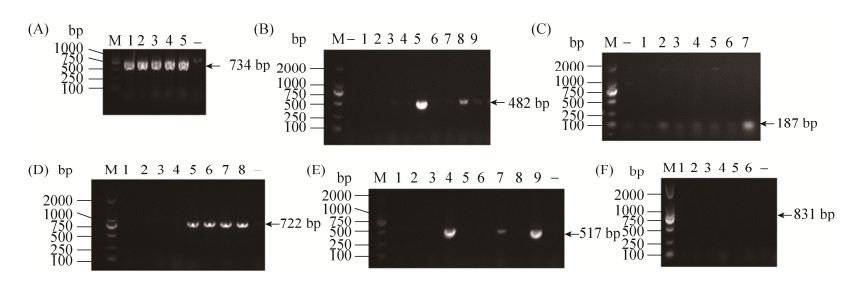 |
| 图 3 PCR检测部分耐药基因的部分结果图 Figure 3 Partial results of PCR detection of partially resistant genes. |
| 图选项 |
2.6 整合子的检测结果 171株大肠埃希菌进行Ⅰ类整合子检测(图 4),其中7株大肠埃希菌检测到携带Ⅰ类整合子基因盒,检出率为4.1%。这7株大肠埃希菌共鉴定出携带4种耐药基因盒结构,分别为dfrA12- aadA2-sul1 (4/7)、dfrA12-aadA2 (1/7)、dfrA7 (1/7)以及dfrA17 (1/7)。
 |
| 图 4 PCR检测Ⅰ类整合子的部分结果图 Figure 4 Partial results of PCR detection of class Ⅰ integrons. |
| 图选项 |
2.7 MLST分型结果 171株奶牛源大肠埃希菌分离株通过MLST分型分为8种ST型,分别为ST58(45/171)、ST5 (32/71)、ST23(29/171)、ST1146(20/171)、ST172 (15/171)、ST155(10/171)、ST661(12/171)和ST3096 (8/171)。通过对本试验中不同ST型大肠埃希菌构成的eBURST图分析,ST58和ST155是一个克隆复合物,仅相差一个等位基因gyrB(图 5)。
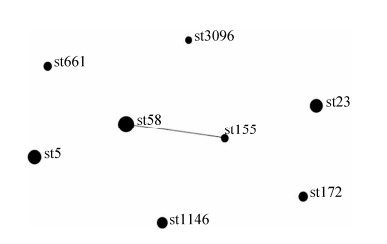 |
| 图 5 本研究中不同ST型大肠埃希菌构成的eBURST图 Figure 5 eBURST diagram of different ST-type E. coli in this study. This figure contains the ST type of all strains and the control ST type, in which the black dots represent different ST strains. The larger the black spots, the more strains of the same ST type. The black line between the black dots represents an allele, and two points and one line form a clonal complex. |
| 图选项 |
3 讨论 大肠埃希菌是肠道常驻菌,广泛存在于自然界中。对奶牛而言,致病性血清型的大肠埃希菌在一定条件下,会造成腹泻、肠炎、乳房炎等疾病,给奶牛业造成巨大的经济损失。为了解山东某地区奶牛源大肠埃希菌的表型特征研究,通过采集4个规模化奶牛场的新鲜粪便,分离并鉴定出171株奶牛源大肠埃希菌,并进行后续试验。
通过分析血清型的结果我们发现,171株大肠埃希菌共鉴定出13个与致病相关的大肠埃希菌血清型,O128、O86、O28和O143占比相对较高,其中O128与报道的腹泻病人血清型是一致的[17],提示可能存在人畜间的交叉感染。另外,本实验结果与其他地区报道的牛源大肠埃希菌优势血清型不同,如南京地区牛源大肠埃希菌优势血清型为O15、O26、O36和O78[18];新疆地区报道的优势血清型为O6、O78、O101和O114[19];内蒙古优势血清型为O18、O146、O152[20]等。以上研究结果表明同一个地区存在多种血清型,且多数地方有本地的优势血清型;不同地区优势血清型有所不同,甚至同一省份的不同地区优势血清有较大差异。这也体现了了解某地的大肠埃希菌血清型的重要性。
细菌耐药性从被发现至今已过去几十年,最近几年成为人类公共卫生以及畜禽养殖业密切关注的热点问题。在奶牛养殖过程中,由于抗生素的不规范使用使得奶牛肠道和养殖场环境内的大肠埃希菌产生抗生素耐药。而这些耐药基因又可以通过质粒或转座子等在大肠埃希菌之间,大肠埃希菌与其他病原菌之间相互传播,例如,磺胺药物耐药基因sul1、sul2、sul3可以通过质粒或转座子在细菌之间传播[21]。携带耐药基因的大肠埃希菌又可以通过食物链传递给人类,从而对人类健康造成危害。通过分析耐药性检测结果发现奶牛源大肠埃希菌对氨苄西林耐药率最高为33.9%,其次为四环素,耐药率为24.0%,其他大部分药物表现为敏感或者中度耐药,并存在多重耐药现象。由此可见,该地奶牛源大肠埃希菌对部分常用抗生素存在耐药性,尤其对青霉素类药物耐药性最严重。但相比国内其他报道的牛源大肠埃希菌耐药率低[22],与宁夏地区奶牛乳房炎大肠埃希菌对氨苄西林耐药率54.7%相比略低[23],与张星星检测新疆犊牛源大肠埃希菌多重耐药比率(85.0%)相比较低[24]。这与动物饲养模式和用药方式是否存在一定的关系,有待于进一步的研究。针对常见耐药基因的PCR检测结果显示,磺胺类的2个耐药基因sul2、sul3检出率较高分别为16.4%和10.5%,而姚伟等[25]对辽宁地区奶牛乳房炎大肠杆菌调查中发现sul1、sul3检出率最高。β-内酰胺类耐药基因的检出率在几类耐药基因中最高,其中blaTEM基因携带率达到59.1%,略低于新疆牛源大肠埃希菌携带率86.2%[26],说明大肠埃希菌易对β-内酰胺类药物产生耐药性。四环素类耐药基因在本次试验中没有被筛查到,不符合药敏试验中大肠埃希菌对四环素耐药率为24.0%。可能是由于本研究中针对四环素耐药基因仅检测了tatA和tatB两种基因,大肠埃希菌对四环素的耐药性有可能是由于携带其他四环素的耐药基因。其他几类耐药基因的检出结果,例如喹诺酮类耐药基因检测结果、氨基糖苷类耐药基因检测结果等与报道的其他地区的检测结果具有很大差异[27-29]。这可能是由于不同地区用药情况和治疗习惯不同造成的,也可能是因为本地区奶牛养殖业兽用抗生素的使用越来越规范。
整合子捕获、整合和表达耐药基因盒,引起细菌耐药性广泛扩散;目前已发现有9类整合子,最常见的是Ⅰ类整合子[30]。本研究171株奶牛源大肠埃希菌分离株中检测到7株大肠埃希菌携带Ⅰ类整合子,分别为dfrA12-aadA2-sul1、dfrA12- aadA2、dfrA7和dfrA17,携带率为4.1%。与王海生检测牛源大肠埃希菌分离株Ⅰ类整合子阳性率(31.5%)相比较低[31]。李晓娜等[32]从牛源大肠埃希菌中检测到dfrA17,但未从奶牛源大肠埃希菌中检测到。这说明耐药基因盒可能会随着整合子的整合作用而进行转移,呈现越来越广泛的分布趋势,应引起我们的重视。本试验整合子检出率虽低于其他地区,但还是要加强该地区规模化奶牛场大肠埃希菌整合子-基因盒的检测,注重监控细菌耐药性的流行趋势,为临床控制多重耐药性的形成和传播提供依据,提升规模化奶牛场奶制品的安全生产与质量评估。
本研究利用MLST对大肠埃希菌进行分型,将171株牛源大肠埃希菌分离株分为8种ST型,其中ST58分离率最高为20.5% (35/171),这与华中地区报道的不同,ST297在牛中是最常见的ST型[33]。我们还发现ST58和ST155是一个克隆复合物,仅相差一个等位基因gyrB,而4个奶牛场均存在ST58和ST155,说明不同奶牛场分的菌株有较高同源性,不同奶牛场有可能存在交叉传播。另有****报道[34]牦牛54株产志贺毒素大肠埃希菌MLST分型结果显示共有31个ST型,其中ST56 (7/54)为优势型。盖文燕等[35]研究山东地区42株鸡源大肠埃希菌通过MLST分型获得18个ST型,体现出大肠埃希菌多态性的特点。不同地区克隆群之间存在着以耐药质粒的结合、转化、转导等方式的传递可使敏感菌成为耐药菌,也使得大肠埃希菌在临床上更加难以选择合适的抗生素用以预防与治疗。MLST是通过分析细菌DNA中7个管家基因的片段核苷酸序列,对每个基因点指定1个等位基因数值,最终建立对应的等位基因图谱。由于其高度的可重复性和可比性,在细菌进化分析和分子流行病学调查研究中发挥重要作用[36-37]。
奶牛的肠道是致病性大肠埃希菌的天然寄生地,而未消毒的牛奶可以直接经过人的消化道感染人,存在公共卫生安全隐患。因此,在奶牛饲喂、生长、泌乳的各个阶段,都需要强有力的管理措施,建立并不断完善生物安全体系。加强致病性大肠埃希菌的流行病学调查,分析不同地区菌株间的亲缘关系,了解其血清型特征以及MLST分型,对于防止动物源细菌与人源细菌交叉感染和有效防治人类细菌性疾病具有重要的意义。
References
| [1] | Zeng B, Wang HN, Zou LK, Xu CW, Zhang AY, Yang X, Zhou YS, Huang K. Virulence gene detection and antibiotic sensitivity of swine extraintestinal Eschericha coli from southwest China. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(2): 126-129. (in Chinese) 曾博, 王红宁, 邹立扣, 徐昌文, 张安云, 杨鑫, 周英顺, 黄康. 西南地区猪肠外大肠杆菌毒力基因检测及耐药性研究. 中国预防兽医学报, 2013, 35(2): 126-129. |
| [2] | Xu YM. Treatment of newborn yak colibacillosis with integrated traditional Chinese and Western medicine. Scientific Breeding, 2012(11): 48. (in Chinese) 许英民. 中西医结合治疗新生犊牛大肠杆菌病. 科学种养, 2012(11): 48. |
| [3] | Cui YD, Liu GQ, Zhao SL, Piao FZ, Hou XL, Wang LX, Han ZL, Cao SG, Cen FY. Isolation and identification of the pathogen of enterococci enterotoxin. Chinese Journal of Veterinary Medicine, 1994, 20(1): 9-10. (in Chinese) 崔玉东, 刘桂清, 赵淑兰, 朴范泽, 侯喜林, 王龙祥, 韩宗烈, 曹舜珪, 岑福英. 育成牛大肠杆菌肠毒血症病原分离鉴定. 中国兽医杂志, 1994, 20(1): 9-10. |
| [4] | Yu WW, Qiao J, Meng QL, Peng YL, Zhang JS, Wang HS, Cai XP, Chen CF. Phylogenetic grouping, antimicrobial resistance and virulence factors of Escherichia coli isolated from bovine mastitis in Xinjiang. China Dairy Cattle, 2017(10): 30-35. (in Chinese) 于伟伟, 乔军, 孟庆玲, 彭叶龙, 张金生, 王辉胜, 才学鹏, 陈创夫. 奶牛乳房炎大肠杆菌新疆分离株系统分群及其耐药特性与毒力因子分布研究. 中国奶牛, 2017(10): 30-35. |
| [5] | 韦嫔.贵州省猪源大肠杆菌四环素耐药基因检测及转移的研究.贵州大学硕士学位论文, 2016. |
| [6] | Liu BG, Li SL, Yang DD, Yang YC, Zhao YH, Li P, Wu H. Molecular detection of resistance genes to aminoglycosides, tetracyclines and sulfonamides among Escherichia coli strains isolated from rabbits in He'nan province. Acta Ecologiae Animalis Domastici, 2016, 37(7): 60-63. (in Chinese) 刘保光, 李胜利, 杨东东, 杨育才, 赵艺涵, 李品, 吴华. 河南省兔源大肠杆菌氨基糖苷类、四环素类和磺胺类耐药基因检测. 家畜生态学报, 2016, 37(7): 60-63. |
| [7] | Bulman ZP, Chen L, Walsh TJ, Satlin MJ, Qian YL, Bulitta JB, Peloquin CA, Holden PN, Nation RL, Li J, Kreiswirth BN, Tsuji BT. Polymyxin combinations combat Escherichia coli harboring mcr-1 and blaNDM-5: preparation for a postantibiotic era. mBio, 2017, 8(4): e00540-17. |
| [8] | Huynh BT, Padget M, Garin B, Herindrainy P, Kermorvant-Duchemin E, Watier L, Guillemot D, Delarocque-Astagneau E. Burden of bacterial resistance among neonatal infections in low income countries: how convincing is the epidemiological evidence?. BMC Infectious Diseases, 2015, 15: 127. DOI:10.1186/s12879-015-0843-x |
| [9] | 刘华.多重PCR检测禽致病性大肠杆菌毒力基因方法的建立及应用.安徽农业大学硕士学位论文, 2007. |
| [10] | Koczura R, Mokracka J, Barczak A, Krysiak N, Kaznowski A. Association between the presence of class 1 integrons, virulence genes, and phylogenetic groups of Escherichia coli isolates from river water. Microbial Ecology, 2013, 65(1): 84-90. DOI:10.1007/s00248-012-0101-3 |
| [11] | Wirth T, Falush D, Lan R, Colles F, Mensa P, Wieler LH, Karch H, Reeves PR, Maiden MC, Ochman H, Achtman M. Sex and virulence in Escherichia coli: an evolutionary perspective. Molecular Microbiology, 2010, 60(5): 1136-1151. |
| [12] | Nan HC, Di LN, Xia LN. Detection and analysis of resistance genes in quinolone-resistant Escherichia coli isolates from different livestocks in Xinjiang. Scientia Agricultura Sinica, 2014, 47(20): 4096-4108. (in Chinese) 南海辰, 底丽娜, 夏利宁. 新疆多源喹诺酮类耐药大肠杆菌耐药基因检测及分析. 中国农业科学, 2014, 47(20): 4096-4108. |
| [13] | Ji XQ, Li SJ, Wen M, Zhang RJ, Liu TJ, Chen JQ, Lei Y, Chen Q. Detection of β-lactamases-resistant genes in Escherichia coil isolated from ducks. Guangdong Agricultural Sciences, 2015, 42(15): 88-91. (in Chinese) 嵇辛勤, 李世静, 文明, 张人俊, 刘廷江, 陈佳琪, 雷云, 陈强. 鸭源大肠杆菌β-内酰胺类耐药基因的检测. 广东农业科学, 2015, 42(15): 88-91. |
| [14] | 羊云飞.多重PCR检测沙门氏菌、大肠杆菌对磺胺类、氯霉素类药物耐药基因的研究.四川农业大学硕士学位论文, 2004. http://cdmd.cnki.com.cn/Article/CDMD-10626-2004123711.htm |
| [15] | Navajas-Benito EV, Alonso CA, Sanz S, Olarte C, Martínez-Olarte R, Hidalgo-Sanz S, Somalo S, Torres C. Molecular characterization of antibiotic resistance in Escherichia coli strains from a dairy cattle farm and its surroundings. Journal of the Science of Food and Agriculture, 2017, 97(1): 362-365. DOI:10.1002/jsfa.7709 |
| [16] | White PA, McIver CJ, Deng YM, Rawlinson WD. Characterisation of two new gene cassettes, aadA5 and dfrA17. FEMS Microbiology Letters, 2006, 182(2): 265-269. |
| [17] | Xu JY, Shen XY, Yang YB, Yan P, Zhang DY, Hu RH. Etiological surveillance and analysis of diarrhea of foodborne bacterial pathogens in Ningbo city. Chinese Rural Health Service Administration, 2015, 35(4): 469-473. (in Chinese) 徐景野, 沈玄艺, 杨元斌, 闫鹏, 章丹阳, 胡荣华. 宁波地区腹泻病人中食源性致病菌检测与分析. 中国农村卫生事业管理, 2015, 35(4): 469-473. |
| [18] | Fang GY, Zhang L, Lu YC, Gu YF, Dai DZ. Isolation, identification and resistance testing of E. coli isolated from diarrheal calves. China Animal Husbandry & Veterinary Medicine, 2014, 41(9): 273-277. (in Chinese) 方光远, 张莉, 陆宇超, 顾亚凤, 戴鼎震. 犊牛腹泻大肠杆菌的分离鉴定和耐药性检测. 中国畜牧兽医, 2014, 41(9): 273-277. |
| [19] | Hao YL, Yan GQ, Wang JM, Liu ZG, Zhou L. Isolation and identification of E. coli inducing diarrhea of calf and its biological characteristics in Northern Xinjiang. Chinese Journal of Veterinary Science, 2012, 32(6): 848-851. (in Chinese) 郝彦龙, 剡根强, 王静梅, 刘振国, 周林. 新疆北疆地区致犊牛腹泻大肠杆菌的分离鉴定及部分生物学特性. 中国兽医学报, 2012, 32(6): 848-851. |
| [20] | Yang SQ, Aori GL, Wang CJ, Zhou T. Prevalence of serotypes virulence genes and antimicrobial susceptibility of bovine pathogenic Escherichia coli isolates in Inner Mongolia. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(10): 761-764. (in Chinese) 杨斯琴, 敖日格乐, 王纯洁, 周婷. 内蒙古呼和浩特地区牛源致病性大肠杆菌的血清型、毒力基因检测及耐药性分析. 中国预防兽医学报, 2015, 37(10): 761-764. |
| [21] | Gu B, Tong MQ, Liu GY, Ni F, Zhao WS, Mei YN, Wen Y, Wei YH, Huang PJ, Pan SY. Study on the mechanism of integron mediated multi-resistance in E. coli and Klebsiella. Chinese Journal of Laboratory Medicine, 2006, 29(8): 725-729. (in Chinese) 顾兵, 童明庆, 刘根焰, 倪芳, 赵旺胜, 梅亚宁, 文怡, 魏源华, 黄珮珺, 潘世扬. 整合子介导大肠埃希菌和克雷伯菌多重耐药机制的研究. 中华检验医学杂志, 2006, 29(8): 725-729. |
| [22] | Luo TT, Wang ZB, Lei YP, Shi XY, Zhang ZP, Li HQ. Investigation on the isolation and drug resistance of the main pathogens of E. coli in the northern part of Shanxi Province. China Journal of Animal Quarantine, 2012, 29(3): 42-44. (in Chinese) 罗甜甜, 王仲兵, 雷宇平, 史夏云, 张仲萍, 李宏全. 山西省北部地区舍饲犊牛大肠杆菌病主要病原的分离和耐药性调查研究. 中国动物检疫, 2012, 29(3): 42-44. |
| [23] | Zhang JB, Ma CF, Yu T, Li XN, Wei XP, Wang GQ. Detection of virulence genes and antimicrobial resistance analysis of Escherichia coli isolated from dairy cow mastitis in Ningxia. Acta Veterinaria et Zootechnica Sinica, 2016, 47(1): 177-182. (in Chinese) 张金宝, 马春芳, 余婷, 李晓娜, 魏小平, 王桂琴. 宁夏地区奶牛乳房炎大肠杆菌毒力基因检测和耐药性分析. 畜牧兽医学报, 2016, 47(1): 177-182. |
| [24] | Zhang XX, Qiao J, Meng QL, Chen C, Liu TL, Meng D, Yu WW, Cai XP, Chen CF. Phylogenetic analysis and resistance characteristics of Escherichia coli from calves in Xinjiang. Acta Ecologiae Animalis Domastici, 2016, 37(6): 60-64. (in Chinese) 张星星, 乔军, 孟庆玲, 陈诚, 刘田莉, 孟丹, 于伟伟, 才学鹏, 陈创夫. 新疆犊牛源大肠杆菌系统进化及其耐药特性. 家畜生态学报, 2016, 37(6): 60-64. |
| [25] | Yao W, Gao F, Cao MH, Gu GB, Zhao XT, Yu XW, Chen Y, Shen GN, Wei YY. Detection and analysis of virulence genes and drug resistance genes in E. coli strains isolated from dairy cows with clinical mastitis in Liaoning region. China Animal Husbandry & Veterinary Medicine, 2017, 44(6): 1832-1839. (in Chinese) 姚伟, 高锋, 曹明慧, 顾贵波, 赵晓彤, 于学武, 陈瑶, 申贯男, 魏园园. 辽宁地区奶牛乳房炎源大肠杆菌毒力基因及耐药基因检测分析. 中国畜牧兽医, 2017, 44(6): 1832-1839. |
| [26] | 王宏.牛源大肠杆菌耐药性及耐药机制研究.东北农业大学硕士学位论文, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10224-1011226573.htm |
| [27] | Zhang W, Cui BB, Sun WW, Li MH, Wang JJ, Chen L, Shan XF, Qian AD. Detection and analysis of drug resistance and drug-resistance gene carrying rate of yak diarrhea in different areas of northern China. Heilongjiang Animal Science and Veterinary Medicine, 2016(11): 162-165. (in Chinese) 张伟, 崔冰冰, 孙武文, 李茂辉, 王姣姣, 陈龙, 单晓枫, 钱爱东. 北方不同地区犊牛腹泻大肠杆菌耐药性和耐药基因携带率的检测分析. 黑龙江畜牧兽医, 2016(11): 162-165. |
| [28] | 卢婷.牛源大肠杆菌耐药性和耐药基因检测及对喹诺酮类药物防突变浓度的测定.东北农业大学硕士学位论文, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1015396348.htm |
| [29] | 郭锐.华中地区猪源与牛源肠出血性大肠杆菌分离鉴定及生物学特性研究.华中农业大学硕士学位论文, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10504-1014213718.htm |
| [30] | Zhao XN, Yang J, Ju ZJ, Chang WS, Sun SH. Molecular characterization of antimicrobial resistance in Escherichia coli from rabbit farms in Tai'an, China. BioMed Research International, 2018, 2018: 8607647. |
| [31] | Wang HS, Hu RP, Gao YM, Yang Z, Deng XL, Zhang JY, Wu RB, Huhe B. Study on molecular characterization of class Ⅰ integron and integron-associated antimicrobial resistance in Escherichia coli from beef cattle. China Animal Husbandry & Veterinary Medicine, 2014, 41(9): 63-68. (in Chinese) 王海生, 扈瑞平, 高玉敏, 杨钟, 邓秀玲, 张建宇, 武瑞兵, 呼和巴特尔. 牛源大肠杆菌Ⅰ类整合子分子特征及其与耐药性关系的研究. 中国畜牧兽医, 2014, 41(9): 63-68. |
| [32] | Li XN, Yang HJ, Yu T, Wang GQ. Correlation between antimicrobial resistance and class Ⅰ integron-gene cassette of Escherichia coli isolated from cow. Chinese Journal of Veterinary Science, 2017, 37(3): 438-442. (in Chinese) 李晓娜, 杨慧君, 余婷, 王桂琴. 牛源大肠杆菌耐药表型与Ⅰ型整合子-基因盒的关系. 中国兽医学报, 2017, 37(3): 438-442. |
| [33] | 郭锐.华中地区猪源与牛源肠出血性大肠杆菌分离鉴定及生物学特性研究.华中农业大学硕士学位论文, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10504-1014213718.htm |
| [34] | Sun H, Bai XN, Zhao AL, Meng Q, Xiong YW, Lu S. Multilocus sequence typing of Shiga toxin-producing Escherichia coli isolated from yaks. Chinese Journal of Zoonoses, 2013, 29(12): 1137-1142. (in Chinese) 孙晖, 白向宁, 赵爱兰, 孟琼, 熊衍文, 卢珊. 牦牛携带的产志贺毒素大肠杆菌分离株的多位点序列分型研究. 中国人兽共患病学报, 2013, 29(12): 1137-1142. |
| [35] | Gai WY, Wang J, Qu ZN, Wang JW, Huang XM, Wang YD, Zhao SJ, Hong J. Molecular classification and drug resistance analysis of Escherichia coli in Shandong province. Chinese Journal of Food Hygiene, 2015, 27(2): 109-114. (in Chinese) 盖文燕, 王娟, 曲志娜, 王君玮, 黄秀梅, 王玉东, 赵思俊, 洪军. 山东地区大肠杆菌的耐药性及分子分型研究. 中国食品卫生杂志, 2015, 27(2): 109-114. |
| [36] | Zurfluh K, Wang J, Klumpp J, Nüesch-Inderbinen M, Fanning S, Stephan R. Vertical transmission of highly similar blaCTX-M-1-harboring IncI1 plasmids in Escherichia coli with different MLST types in the poultry production pyramid. Frontiers in Microbiology, 2014, 5: 519. |
| [37] | Zhang SH, Yang GZ, Lai ZB, Wu QP, Zhang JM. Distribution and molecular typing (MLST) of Non-O157 diarrheagenic Escherichia coli isolated from retail foods in South China. Modern Food Science and Technology, 2017, 33(3): 266-273. (in Chinese) 张淑红, 杨广珠, 赖泽冰, 吴清平, 张菊梅. 华南地区食品中非O157致泻大肠杆菌分布特点及分型研究. 现代食品科技, 2017, 33(3): 266-273. |
