 , 张佳勇1, 胡晓晓2, 阮琴2, 欧阳玮3
, 张佳勇1, 胡晓晓2, 阮琴2, 欧阳玮3
 , 章子贵2
, 章子贵2

1. 浙江师范大学化学与生命科学学院, 金华 321004;
2. 浙江师范大学行知学院, 金华 321004;
3. 浙江师范大学体育与健康科学学院, 金华 321004
收稿日期: 2019-11-14; 修回日期: 2020-01-05; 录用日期: 2020-01-05
基金项目: 国家自然科学基金(No.81573101)
作者简介: 唐乐(1994-), 女, E-mail:1254483966@qq.com
通讯作者(责任作者): 欧阳玮, E-mail:wouyang@zjnu.cn
章子贵, E-mail:zzg@zjnu.cn
摘要:探讨了慢性氟暴露致小鼠海马损伤及L-型钙通道拮抗剂的干预作用.将140只初断乳ICR雄性小鼠随机分为7组:对照组(C组)、高氟组(HF组,饮用30 mg·L-1 NaF溶液)、低氟组(LF组,饮用5 mg·L-1 NaF溶液)、高/低氟+L-型钙通道激动剂组(FPL64176)(HF/LF+FPL)、高/低氟+L-型钙通道拮抗剂组(Nifedipine)(HF/LF+NIF).染氟6个月,染氟结束前1周,HF/LF+FPL和HF/LF+NIF组分别每天腹腔注射激动剂或拮抗剂(5 mg·kg-1·d-1).用TUNEL法检测小鼠海马CA1区细胞凋亡水平,用Western Blot法检测细胞膜L-型钙通道Cav1.2、Ca2+信号通路分子和下游凋亡调节相关分子蛋白表达水平等.结果表明,与对照组比,HF/LF组小鼠海马组织抗氧化能力显著降低(p < 0.05或p < 0.01),细胞凋亡水平极显著上升(p < 0.01),Cav1.2与Bcl-2蛋白表达水平显著下降(p < 0.05或p < 0.01),Ca2+信号转导通路CaM、CaMKII和促凋亡Bax、Bax/Bcl-2蛋白表达水平显著上升(p < 0.05或p < 0.01).注射FPL64176的小鼠海马细胞和上述分子指标的损伤加剧,而注射NIF对海马细胞和上述分子蛋白表达有一定的逆转作用.提示L-型钙离子通道介导了氟暴露致小鼠海马损伤,氟暴露致海马细胞膜L-型钙离子通道Cav1.2蛋白、细胞内Ca2+信号转导通路分子和下游凋亡调节相关蛋白表达异常是其分子机制之一,而L-型钙通道拮抗剂NIF可能是一种新型有效的抗氟药物.
关键词:氟暴露学习记忆细胞凋亡Cav1.2CaM
Hippocampal injury induced by chronic fluoride exposure and the intervention effect of L-type calcium inhibitor in mices
TANG Le1
 , ZHANG Jiayong1, HU Xiaoxiao2, RUAN Qin2, OUYANG Wei3
, ZHANG Jiayong1, HU Xiaoxiao2, RUAN Qin2, OUYANG Wei3
 , ZHANG Zigui2
, ZHANG Zigui2

1. College of Chemistry and Life Science, Zhejiang Normal University, Jinhua 321004;
2. College of Xing Zhi, Zhejiang Normal University, Jinhua 321004;
3. College of Sports and Health Science, Zhejiang Normal University, Jinhua 321004
Received 14 November 2019; received in revised from 5 January 2020; accepted 5 January 2020
Abstract: The study aimed to investigate the hippocampal injury induced by chronic fluoride exposure and the intervention effects of L-type calcium inhibitor in mice.140 ICR male mice were randomly divided into 7 groups:control (C group), high-fluoride group (HF group, drink 30 mg·L-1 NaF solution), low-fluoride group (LF group, drink 5 mg·L-1 NaF solution), HF/LF+L-type calcium channel (LTCC) agonist (FPL64176) group (HF/LF+FPL group), HF/LF+LTCC inhibitor (Nifedipine) group (HF/LF+NIF group).The fluoride exposure continued for 6 months, one week before the end of fluoride exposure, each mice in HF/LF+FPL and HF/LF+NIF group was injected FPL or NIF (5 mg·kg-1·d-1).The apoptosis of hippocampal CA1 region cell was observed by TUNEL, and the protein expression levels of cell membrane L-calcium channel Cav1.2 and Ca2+ signaling pathway molecules, and downstream apoptosis-regulating protein related proteins were detected by Western blot.Compared with the C group, the anti-oxidation ability of hippocampus was significantly decreased (p < 0.05 or p < 0.01), the level of apoptosis was significantly increased (p < 0.01), the protein expression level of Cav1.2, and Bcl-2 significantly decreased (p < 0.05 or p < 0.01), and CaM, CaMKII, Bax and Bax/Bcl-2 significantly increased (p < 0.05 or p < 0.01) in LF and HF group.Compared with the fluoride exposure group, FPL and NIF could aggravate or reversed the damage of hippocampal and the above-mentioned molecular proteins.In conclusion, LTCC may mediate the hippocampal injury induced by fluoride exposure in mice.The abnormal expression of the Cav1.2 protein, Ca2+ signal transduction pathway, and apoptosis-regulated proteins may be the molecular mechanisms of the fluoride induced hippocampal injury.NIF may be a new and effective anti-fluoride drug.
Keywords: fluoride exposurelearning and memoryapoptosisCav1.2CaM
1 引言(Introduction)氟(Fluoride, 简称F)是机体微量元素之一, 但长期过量摄入会导致机体全身性病理改变(Chong et al., 2011), 称为地氟病(Sivasankar et al., 2012).氟能透过血-脑屏障蓄积在脑组织中, 影响脑功能(Li et al., 2009;张璟等, 2010), 但其具体分子机制尚待阐明.
Ca2+是神经细胞内重要的信息分子(孙天水等, 2016), 参与神经细胞突触传递和神经毒性等病理生理过程.氟暴露会导致脑细胞内Ca2+超载, 引起钙信号转导通道一些与学习记忆功能相关基因/蛋白表达异常, 从而影响脑的高级神经功能(Zhang et al., 2011).本课题组前期研究表明, 亚慢性氟暴露致小鼠学习记忆损伤与海马细胞内钙超载、细胞内Ca2+信号通路CaMKII分子及下游凋亡相关分子表达异常有关(年未未等, 2018).但慢性氟暴露致脑细胞内Ca2+超载机制及Ca2+信号通路诱导CaMKII活化的激活分子表达水平的变化尚未见报道.鉴于L-型钙离子通道是细胞膜调节Ca2+内流的主要通道(Wang et al., 2001), 海马是学习记忆主要脑区, 对氟暴露敏感(章子贵等, 2015).本研究在前期工作的基础上, 拟通过小鼠5 mg·L-1和30 mg·L-1 NaF溶液与L-型钙离子通道激动剂/拮抗剂联合慢性暴露, 检测小鼠海马组织抗氧化能力及其海马CA1区细胞凋亡、细胞膜L-型钙通道Cav1.2和Ca2+信号转导通路CaM/CaMKII分子及下游凋亡调节相关蛋白表达水平, 进一步探讨慢性氟暴露对小鼠海马的影响及分子机制, 并筛选新型有效抗氟药物.
2 材料与方法(Materials and methods)2.1 主要试剂与仪器主要试剂:NaF购自金华试剂公司;FPL64176购自Sigma公司;Nifedipine购自BOMEI公司;Bax、Bcl-2、钙调蛋白激酶(CaMKII)和钙调蛋白(CaM)抗体(一抗)、辣根过氧化物酶标记的山羊抗兔抗体(二抗)购自上海氟博蕴公司.
主要仪器:酶标仪(SPECTRA MAX 190);蛋白质转膜仪、垂直电泳槽、平行电泳(美国Bio-Rad公司);Olympus光学显微镜(美国Bio-Rad公司);组织切片机(Shandon Finesse ME+, 美国).
2.2 实验方法2.2.1 实验动物选用健康初断乳ICR雄性小鼠140只(购自浙江省实验动物中心, SCYK(Zhejiang)20030001), 体重15~20 g.饲养房温度(23±2) ℃, 湿度40%~70%, 光暗周期为12 h, 小鼠标准饮食, 自由饮水, 所有程序均根据《NIH实验动物的护理和使用指南》进行.
2.2.2 动物分组140只ICR小鼠适应1周后, 随机分为7组(表 1):对照组(C组)、高氟组(HF组, 饮用30 mg·L-1 NaF溶液)、低氟组(LF组, 饮用5 mg·L-1 NaF溶液)、高氟注射L-型钙通道激动剂组(FPL64176) (HF+FPL)、高氟注射L-型钙通道拮抗剂组(Nifedipine) (HF+NIF)、低氟注射L-型钙通道激动剂组(FPL64176) (LF+FPL)、低氟注射L-型钙通道拮抗剂组(Nifedipine) (LF+NIF).对照组饮用自来水(氟化物浓度 < 0.2 mg·L-1)、高氟组和低氟组分别饮用30 mg·L-1和5 mg·L-1的NaF溶液, 氟暴露6个月.慢性氟暴露结束前1周, 对照组腹腔内注射生理盐水, 各氟暴露组分别腹腔注射生理盐水配制的L-型钙通道激动剂或拮抗剂(5 mg·kg-1·d-1) (苏林博等, 2016).
表 1(Table 1)
| 表 1 慢性氟暴露小鼠分组 Table 1 The group of chronic fluoride exposed mice | ||||||||||||||||||||||||
表 1 慢性氟暴露小鼠分组 Table 1 The group of chronic fluoride exposed mice
| ||||||||||||||||||||||||
2.2.3 小鼠脑组织脂质过氧化酶检测迅速处死小鼠, 冰上取新鲜脑组织, 匀浆后, 以3500 r·min-1离心15 min, 然后取脑组织匀浆上清液置于4 ℃冰箱保存备用.根据试剂盒说明进行海马组织GSH-Px、SOD酶活性和MDA含量检测.
2.2.4 各组小鼠海马细胞凋亡水平观测冰上快速取小鼠脑组织, 10%福尔马林固定海马, 海马组织梯度酒精脱水, 石蜡包埋、切片、苏木精染色(Liu et al., 2015)等.按照凋亡检测试剂盒的方法, 用TUNEL法测定各组海马细胞凋亡水平.先对海马组织石蜡切片进行常规脱蜡和蛋白酶K消化、反应、孵育和着色, 然后用苏木素复染细胞核、脱水、封片(Lou et al., 2013).阳性标记的凋亡细胞核是棕色的, 在光学显微镜下观察阳性标记细胞的数目.用ImageJ软件计算凋亡细胞数量.
2.2.5 Western Blot检测蛋白表达水平用Western Blot法检测小鼠海马CA1区细胞膜L-型钙通道Cav1.2、Ca2+信号通道分子和下游凋亡调节相关分子蛋白表达水平, 选取10只小鼠海马组织进行检测.主要实验步骤包括总蛋白提取、蛋白上样、电泳、转膜、封闭、一抗孵育、洗膜、二抗孵育、洗膜、显影、定影、扫描仪扫描, 蛋白条带用Quantityone软件分析扫描目的蛋白灰度值与内参蛋白灰度值, 内参调整值为目的蛋白灰度值与β-actin灰度值之比.计算每一组内参调整值与对照组内参调整值的比值用以表征该孔样品蛋白表达量.
2.3 统计分析用SPSS20.0软件对实验数据进行统计学分析.结果以平均值±标准差(Mean±SD)表示, 进行单因素方差分析(One Way ANOVA)和两两比较LSD检验.以p < 0.05表示表示具有统计显著性, p < 0.01具有统计极显著性.
3 结果与分析(Results and analysis)3.1 慢性氟暴露对小鼠海马组织抗氧化能力的影响慢性氟暴露对小鼠海马组织抗氧化能力的影响见表 2.表 2结果表明, 与C组比, 各试验组GSH-Px酶活力显著或极显著降低(p < 0.05或p < 0.01), HF、LF+NIF和HF+FPL组SOD酶活力显著或极显著降低(p < 0.05或p < 0.01), HF、LF组、HF+FPL组和LF+FPL组MDA含量极显著或显著升高(p < 0.01或p < 0.05);与HF组比, HF+FPL组SOD酶活力显著降低(p < 0.05), HF+FPL和HF+NIF组MDA含量显著下降(p < 0.05);与LF组比, LF+NIF组MDA含量显著下降(p < 0.05), 各氟暴露加药物注射组GSH-Px、SOD酶活力均无显著性变化(p>0.05).
表 2(Table 2)
| 表 2 小鼠海马组织抗氧化酶GSH-Px、SOD活性及MDA含量检测统计结果(Mean±SD, n=10) Table 2 The statistical results of antioxidant enzyme GSH-Px, SOD activity and MDA content in hippocampal tissue of mice | ||||||||||||||||||||||||||||||||
表 2 小鼠海马组织抗氧化酶GSH-Px、SOD活性及MDA含量检测统计结果(Mean±SD, n=10) Table 2 The statistical results of antioxidant enzyme GSH-Px, SOD activity and MDA content in hippocampal tissue of mice
| ||||||||||||||||||||||||||||||||
3.2 慢性氟暴露对小鼠海马CA1区细胞凋亡的影响3.2.1 小鼠海马CA1区细胞凋亡观察结果各组小鼠海马CA1区细胞凋亡状况见图 1.图 1表明, C组海马CA1区细胞排列整齐, 凋亡细胞数较少;HF、LF、HF+FPL、LF+FPL组凋亡细胞明显增多, 而HF+NIF和LF+NIF组凋亡细胞有所减少.
图 1(Fig. 1)
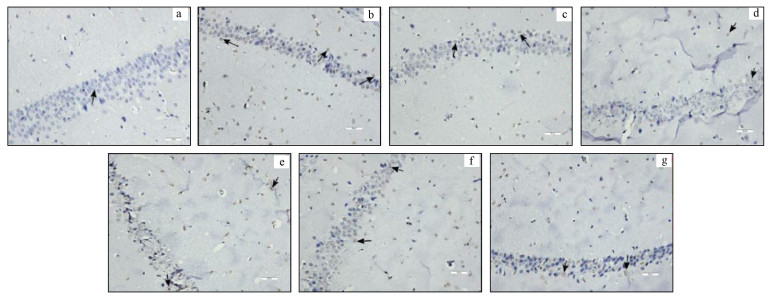 |
| 图 1 小鼠海马CA1区细胞凋亡状况(×400)(a.C组, b.HF组, c.LF组, d.HF+FPL组, e.HF+NIF组, f.LF+FPL组, g.LF+NIF组, 黑色箭头所示为显微镜下细胞核呈棕褐色的凋亡细胞) Fig. 1The apoptosis of hippocampal CA1 region in mice(×400) |
3.2.2 小鼠海马CA1区细胞凋亡率统计结果慢性氟暴露对小鼠海马CA1区细胞凋亡率影响观测统计结果见图 2.图 2结果表明, 与C组比, 各试验组小鼠细胞凋亡率均极显著升高(p < 0.01);与HF组比, HF+FPL组细胞凋亡率显著升高(p < 0.05), 而HF+NIF组细胞凋亡率无显著性变化(p>0.05).与LF组比, LF+NIF组海马CA1区细胞凋亡率显著降低(p < 0.05).
图 2(Fig. 2)
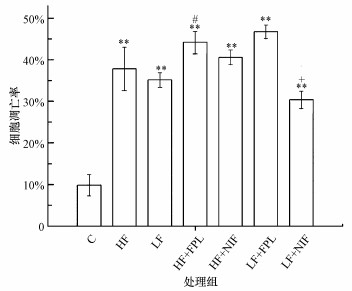 |
| 图 2 小鼠海马CA1区细胞凋亡率统计结果(*p < 0.05, **p < 0.01, 与C组比; #p < 0.05, ##p < 0.01, 与HF组比; +p < 0.05, ++p < 0.01, 与LF组比, 下同) Fig. 2The statistical results of Apoptosis rate in the hippocampal CA1 region of mice |
3.3 慢性氟暴露对小鼠海马CA1区细胞膜L-型钙通道Cav1.2、Ca2+信号通道分子CaM、CaMKII蛋白表达水平影响慢性氟暴露对小鼠海马CA1区细胞膜L-型钙通道Cav1.2、CaM、CaMKII蛋白表达水平影响检测统计结果见图 3.由图 3可见, 与C组比, 各试验组Cav1.2蛋白表达水平均极显著或显著降低(p < 0.01或p < 0.05), 各试验组CaM蛋白表达均显著或极显著升高(p < 0.05或p < 0.01), HF、HF+FPL、HF+NIF组CaMKII蛋白表达极显著升高(p < 0.01), LF组CaMKII蛋白表达显著升高(p < 0.05);与HF组比, HF+FPL组Cav1.2蛋白表达显著降低(p < 0.05), HF+NIF组CaMKII蛋白表达显著升高(p < 0.05);与LF组比, LF+NIF组CaMKII蛋白表达显著降低(p < 0.05).
图 3(Fig. 3)
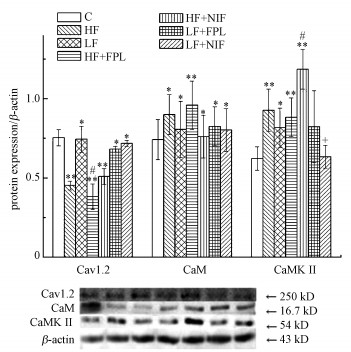 |
| 图 3 小鼠海马Cav1.2、CaM、CaMKII蛋白表达水平检测统计结果 Fig. 3The detection results of Cav1.2, CaM and CaMKII protein expression in the hippocampus of mice |
3.4 慢性氟暴露对小鼠海马CA1区细胞内下游凋亡调节相关分子蛋白表达水平的影响慢性氟暴露对小鼠海马CA1区细胞内促凋亡Bax、Bcl-2、Bax/Bcl-2蛋白表达水平影响检测结果见图 4.由图 4可见, 与C组比, HF、HF+FPL、HF+NIF组Bax蛋白表达水平极显著升高(p < 0.01), LF、LF+FPL组显著升高(p < 0.05), 各试验组Bcl-2蛋白表达水平显著或极显著降低(p < 0.05或p < 0.01), 各试验组Bax/Bcl-2蛋白表达水平比值均显著或极显著升高(p < 0.05或p < 0.01);与HF组比, HF+FPL组Bax、Bax/Bcl-2蛋白表达水平比值显著升高(p < 0.05), HF+NIF组Bcl-2蛋白表达极显著升高(p < 0.01);与LF组比, LF+NIF组Bcl-2蛋白表达显著升高(p < 0.05), LF+FPL组Bax/Bcl-2蛋白表达水平比值极显著升高(p < 0.01).
图 4(Fig. 4)
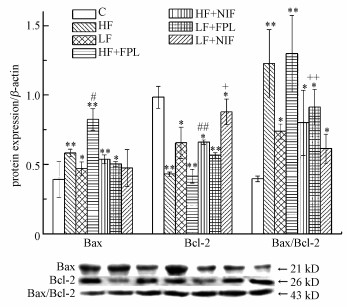 |
| 图 4 各组小鼠海马Bax、Bcl-2、Bax/Bcl-2蛋白表达水平检测结果 Fig. 4The detection results of Bax, Bcl-2 and Bax/Bcl-2 protein expression in the hippocampus of mice |
4 讨论(Discussion)我国地氟病分为饮水型、燃煤型(Ando et al., 2001)和饮茶型(Cao et al., 2003)3类, 其中以饮水型地氟病影响最为广泛, 分布于山西、浙江等30个省市, 饮用高氟水的6300多万人中有近3000万人出现病症, 已成为我国重大公共卫生问题, 但其发病机理迄今未明.深入开展饮水型地氟病发病机理和防治研究具有重要的科学和实际意义.
目前, 有关氟中毒的学说众说纷纭, 但没有一个学说能完整解释地氟病的发病机制, 氟致氧化应激是比较公认的学说之一(Hassan et al., 2009).本研究得到的高氟暴露使小鼠海马组织抗氧化酶GSH-Px和SOD活性极显著或显著降低, 而脂质过氧化产物MDA含量极显著提高的实验结果再次为该学说提供了实验佐证.
由于地氟病发病机制十分复杂, 众多研究已表明, 除氧化应激机制外, 可能还涉及其它机制.细胞凋亡(Apoptosis)是基因调控程序性死亡.近年来, 细胞凋亡在疾病发生/发展过程中的生理/病理学意义已引起关注(Susan et al., 2007).Bcl-2家族成员在细胞凋亡中具有重要作用, 抗凋亡蛋白Bcl-2可能通过抑制DNA转录抑制凋亡相关基因的激活机制(Sun et al., 2017).而促凋亡蛋白Bax高表达时, Bax与Bcl-2形成异二聚体, Bcl-2蛋白失活, 使细胞凋亡加剧.Bax/Bcl-2蛋白比例决定了细胞存活或凋亡(王长松等, 2003).贾丽玲等(2010)研究结果表明, Bax与Bcl-2蛋白表达比值升高会导致细胞凋亡数增加.本研究结果得到的高氟暴露致小鼠海马CA1区细胞凋亡率、促凋亡蛋白表达水平和Bax/Bcl-2蛋白表达比值均极显著升高, 而抗凋亡蛋白Bcl-2表达水平极显著下降的实验结果与有关氟中毒可导致细胞结构异常、诱导细胞凋亡的文献报道(张爱君等, 2003;韩璐等, 2010;Teng et al., 2017)相一致.提示细胞凋亡异常可能也是氟暴露致小鼠海马损伤机制之一, 但氟致脑细胞凋亡的上游一些分子事件迄今仍有待阐明.
早在1981年, Siesj?等(1981;1985)的研究就已表明, 细胞内钙超负荷会引起缺血性神经元损伤.近些年来研究已逐步表明, 氟暴露确能改变骨相器官钙平衡, 机体整体低钙-靶细胞内Ca2+超载参与了氟骨症发生发展过程(Duan et al., 2014), 这就是“钙矛盾疾病”学说的主要内容(Fujita et al., 2000).本课题组前期研究亦已证明, 氟暴露能引起脑细胞内Ca2+超载(Zhang et al., 2011), 但氟暴露致脑细胞内Ca2+超载机制却鲜有报道.钙离子通道是Ca2+进出细胞的主要途径, Ca2+通道分为电压依赖型(Voltage-dependent calcium Channal, VDCCs)、受体操纵型(Receptor operated calcium channal, ROCCs)和机械门控型(MGCCs)三大类.根据VDCCs对电压和传导性的不同, VDCCs又分为N、T、L、P/Q、R型等5类(Catterall et al., 2005).其中, L-型(L-type calcium channel, LTCC)备受关注, LTCC普遍存在海马CA1区锥体细胞膜上, 所产生的电流占所有钙通道电流的30%~50%, 是Ca2+内流的主要通道, 不仅在调节胞质内Ca2+水平中发挥重要作用, 还能将钙调信号传至细胞核(Deissemth et al., 2003), 参与神经细胞钙稳态、突触可塑性、学习记忆等的调控(Stefan et al., 2014).LTCC又可分Cav1.1(α1S)、Cav1.2(α1C)、Cav1.3(α1D)和Cav1.4(α1F) 4类, Cav1.2是细胞膜上最常见钙通道拮抗剂结合靶点和Ca2+流入细胞内的通道(Serysheva et al., 2002).已有文献表明, 氟中毒对成骨细胞膜Cav1.2蛋白/基因表达水平有显著影响(Duan et al., 2014).本课题组前期研究也证明, 氟暴露致PC12细胞内Ca2+超载与Cav1.2钙通道分子表达水平异常有关(Liao et al., 2017).本研究首次探讨了慢性氟暴露对在体动物海马CA1区细胞膜L-型钙通道Cav1.2蛋白表达水平的影响, 所得到高氟暴露能使小鼠海马细胞L-型钙离子通道Cav1.2蛋白表达水平显著下降的实验结果提示, L-型钙通道Cav1.2分子可能是氟暴露致脑细胞Ca2+超载的重要靶分子.
当前, 细胞内Ca2+超载所引发的细胞一系列病理生理反应已逐渐成为衰老性脑功能障碍机制(章子贵等, 2000)和地氟病机理研究(Duan et al., 2014)的热点.Ca2+-CaM-CAMKII是参与脑高级神经活动的重要信号转导通路, 与学习记忆、LTP等密切相关(马婧等, 2018).CaMKII是钙/钙调蛋白激酶CaMK的主要成员之一, 能被Ca2+/CaM结合而激活, 活化的CaMKII通过多种途径调节细胞内Ca2+平衡, 具有广泛的生物学活性, 且与凋亡细胞等密切相关(Robison et al., 2014).本课题组前期研究已表明, 氟暴露致神经细胞内Ca2+超载一方面引起钙信号转导系统主要途径之一—非PKC途径即钙调蛋白激酶成员CaMKII和c-fos蛋白表达异常, 从而引起Ca2+信号转导通路的失调和紊乱;另一方面, Ca2+信号转导通路失调和紊乱使受Ca2+调节的核转录因子Nuclear Factor-κB(NF-κB)表达异常(Zhang et al., 2011), NF-κB表达异常又影响促凋亡Bcl-2和抗凋亡Bax蛋白表达(Zhang et al., 2013), 诱导神经细胞凋亡的增强, 最终导致脑损伤.本研究不仅得到了与本课题组前期研究相一致的结果(年未未等, 2018), 即氟暴露使海马细胞CAMKII蛋白表达水平明显上升, 还首次得到了氟暴露使小鼠海马神经细胞CAMKII蛋白的活化分子CaM蛋白表达水平也显著上升的重要实验结果.提示Ca2+-CaM-CAMKII信号转导通路功能异常可能是氟致海马细胞凋亡异常的重要环节.
饮水氟安全阈值问题一直备受争议(戴力维等, 2017;熊传龙等, 2017).当前, 我国饮水氟标准为1.0~1.2 mg·L-1.近年来, 随着毒理学领域中分子生物学检测技术的不断应用, 低氟暴露对机体分子水平的损害逐渐引起关注.本课题组前期电生理研究已表明, 低氟暴露(5 mg·L-1, 根据药理试验大小鼠与人体等效剂量换算约为10:1(黄继汉等, 2004), 可知5 mg·L-1 NaF溶液在人体中约为0.5 mg·L-1)也能影响小鼠海马细胞L-型钙通道, 引起海马细胞内钙超载(Yu et al., 2019).本研究结果表明, 低氟暴露能使小鼠海马组织抗氧化能力、细胞凋亡率、Cav1.2和Ca2+信号转导通路分子及凋亡调节相关分子表达水平呈现异常改变, 提示低氟暴露具有脑健康风险.
迄今国内外尚无治疗氟中毒的特效药.近年来, 本课题组实验室进行了一些抗氟药/剂的筛选工作, 如一定剂量硒及膳食高钙对氟神经毒性有一定干预作用(Zheng et al., 2016;Sun et al., 2017).氟中毒能够造成细胞内钙离子超载(Zhang et al., 2011), 因此, 抑制细胞内钙超载可能成为氟中毒治疗研究的新领域.已有研究发现, 利用L-型钙通道拮抗剂心痛定等处理原代培养孕妇子宫平滑肌细胞, 在钙波形成前可明显抑制细胞钙波的形成(张荣荣等, 2003).而L-型钙通道兴奋剂FPL64176则与L-型钙通道拮抗剂呈相反的作用(Fan et al., 2000).根据Cav1.2钙离子通道具有药理特性及与药物结合的功能特性(Serysheva et al., 2002)和上述文献报道的提示, 本研究首次较为系统地探讨了L-型钙通道激动剂FPL64176和拮抗剂Nifedipine对氟暴露致小鼠海马损伤的影响.海马组织抗氧化能力检测结果表明, 虽然Nifedipine对氟暴露致海马抗氧化酶GSH-Px和SOD活性降低的干预作用不明显, 但能显著地降低海马组织MDA含量.与氟暴露相比, 高/低氟和FPL64176联合暴露对海马细胞凋亡水平、L-型钙通道Cav1.2和Ca2+信号转导通路分子及下游凋亡调节相关分子表达水平的影响加剧;而高/低氟和Nifedipine联合暴露对海马细胞凋亡率和上述蛋白表达趋势有一定的逆转作用.这不仅进一步验证了L-型钙离子通道、Ca2+信号转导通路分子在氟暴露致海马损伤过程中的作用, 同时也提示, FPL64176对氟暴露有协同毒性作用, 而L-型钙离子通道拮抗剂Nifedipine对氟暴露致海马损伤则有一定的干预作用, 可能是一种新型有效的抗氟药物.
总之, 慢性氟暴露致海马损伤机理涉及多机制级联反应, 除氟致氧化应激外, 细胞凋亡异常和钙代谢失衡可能也参与了氟致脑损伤, 其具体的分子机制可能是(图 5):慢性氟暴露使脑组织内氧化应激过强, 产生过多的自由基, 影响海马细胞膜, 使海马细胞膜L-型钙离子通道Cav1.2蛋白表达改变, 细胞内钙超载, 引起下游Ca2+-CaM-CAMKII信号转导通路功能异常, 使细胞核内核转录因子NF-κB表达异常, 促凋亡Bax蛋白表达水平升高, 抗凋亡Bcl-2蛋白表达水平下降, 细胞凋亡加剧, 最终损伤海马细胞, 而注射L-型钙离子通道拮抗剂(Nifedipine)能够逆转氟暴露致海马损伤, 可能是一种新型有效的抗氟药物.
图 5(Fig. 5)
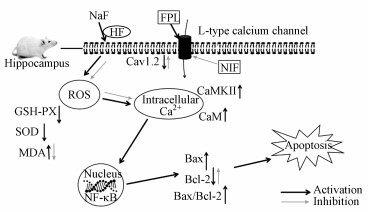 |
| 图 5 慢性氟暴露致海马损伤的分子机制 Fig. 5Molecular mechanism of hippocampus injury induced by chronic fluoride exposure |
参考文献
| Ando M, Tadano M, Yamamoto S, et al. 2001. Health effects of fluoride pollution caused by coal burning[J]. The Science of the Total Environment, 271(1/3): 107-116. |
| Cao J, Zhao Y, Liu J W, et al. 2003. Prevention and control of brick-tea type fluorosis a 3-year observation in Dang xiong, Tibet[J]. Ecotoxicology and Environmental Safety, 56(2): 222-227. DOI:10.1016/S0147-6513(03)00065-4 |
| Catterall W A, Perez-Reyes E, Snutch T P, et al. 2005. International union of pharmacology.XLVIII.Nomenclature and structure function relationships of voltage-gated calcium channels[J]. Pharmacol Rev, 57: 411-425. DOI:10.1124/pr.57.4.5 |
| Chong G T F, Tseng P. 2011. A review of the uses of fluoride and outcomes of dental caries control in Singapore[J]. Singapore Dental Journal, 32(1): 14-18. DOI:10.1016/S0377-5291(12)70011-1 |
| 戴力维. 2017. 饮水氟含量与人体健康[J]. 中国城乡企业卫生, (11): 34-37. |
| Deissemth K, Mermelstein P G, Xia H, et al. 2003. Signaling from synapse to nucleus:the logic behind the mechanism[J]. Current opinion in Neumbiology, 13(3): 354-265. DOI:10.1016/S0959-4388(03)00076-X |
| Duan X Q, Zhao Z T, Zhang X Y, et al. 2014. Fluoride affects calcium homeostasis and osteogenictranscription factor expressions through L-type calcium channels in osteoblast cell line[J]. Biol Trace Elem Res, 162: 219-226. DOI:10.1007/s12011-014-0118-1 |
| Fan J S, Yuan Y, Palade P. 2000. Kinetic effects of FPL 64176 on L-type Ca2+ channels in cardiac myocytes[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 361(5): 465-476. DOI:10.1007/s002100000219 |
| Fujita T, Palmieri G M A. 2000. Calcium paradox disease:calcium deficiency prompting secondary hyperparathyroidism and cellular calcium overload[J]. J Bone Miner Metab, 18(3): 109-125. DOI:10.1007/s007740050101 |
| Hassan H A, Yousef M I. 2009. Mitigating effects of antioxidant properties of black berry juice on sodium fluoride induced hepatotoxicity and oxidative stress in rats[J]. Food Chem Toxicol, 47: 2332-2337. DOI:10.1016/j.fct.2009.06.023 |
| 韩璐, 韩博. 2010. 氟对体外培养绵羊成骨细胞Bcl-2和Bax基因表达的影响[J]. 中国兽医杂志, 46(7): 3-6. DOI:10.3969/j.issn.0529-6005.2010.07.001 |
| 黄继汉, 黄晓晖, 陈志扬, 等. 2004. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 9(9): 1069-1072. DOI:10.3969/j.issn.1009-2501.2004.09.026 |
| 贾丽玲. 2010. 瑞芬太尼预处理对大鼠脑缺血再灌注后神经细胞凋亡及Bcl-2 Bax表达的影响[J]. 中国药物与临床, 10(2): 171-173. DOI:10.3969/j.issn.1671-2560.2010.02.019 |
| Li H R, Liu Q B, Wang W Y, et al. 2009. Fluoride in drinking water, brick tea infusion and human urine in two counties in Inner Mongolia, China[J]. Journal of Hazardous Materials, 167(1/3): 892-895. |
| Liao Q X, Zhang R, Wang X W, et al. 2017. Effect of fluoride exposure on mRNA expression of cav1.2 and calcium signal pathway apoptosis regulators in PC12 cells[J]. Environmental Toxicology and Pharmacology, 54: 74-79. DOI:10.1016/j.etap.2017.06.018 |
| Liu L, Zhang Y, Gu H F, et al. 2015. Fluorosis induces endoplasmic reticulum stress and apoptosis in osteoblasts in vivo[J]. Biol Trace Elem Res, 164: 64-71. DOI:10.1007/s12011-014-0192-4 |
| Lou D D, Guan Z Z, Liu Y J, et al. 2013. The influence of chronic fluorosis on mitochondrial dynamics morphology and distribution in cortical neurons of the rat brain[J]. Arch Toxicol, 87: 449-457. DOI:10.1007/s00204-012-0942-z |
| 马婧, 刘晓莉, 乔德才. 2018. 钙/钙调蛋白依赖性蛋白激酶Ⅱ在突触可塑性和神经精神疾病中的作用[J]. 中国药理学通报, 34(11): 1485-1488. DOI:10.3969/j.issn.1001-1978.2018.11.002 |
| 年未未, 汪晓宇, 邵丹丹, 等. 2018. 亚慢性氟暴露致小鼠海马损伤的影响及分子机制研究[J]. 环境科学学报, 38(11): 1-8. |
| Robison A J. 2014. Emerging role of CaMK Ⅱ in neuropsychiatric disease[J]. Trends Neurosci, 37(11): 653-62. DOI:10.1016/j.tins.2014.07.001 |
| Serysheva I I, Ludtke S J, Baker M R, et al. 2002. Structure of the voltage-gated L-type Ca2+ channel by electron cryomicroscopy[J]. Proc Natl Acad Sci U S A, 99: 10370-10375. DOI:10.1073/pnas.162363499 |
| Siesj? B K. 1981. Cell damage in the brain:a speculative synthesis[J]. Journal of the International Society of Cerebral Blood Flow & Metabolism, 1(2): 155-185. |
| Siesj? B K, Wieloch T. 1985. Cerebral metabolism in ischaemia:neurochemical basis for therapy[J]. British Journal of Anaesthesia, 57(1): 47-62. DOI:10.1093/bja/57.1.47 |
| Sivasankar V, Rajkumar S, Murugesh S, el a1. 2012. Tamarind (Tamarindus indica) fruit shell carbon:A calcium-rich promising adsorbent for fluoride removal from groundwater[J]. Journal of Hazardous Materials, 225: 164-172. DOI:10.1016/j.jhazmat.2012.05.015 |
| Stefan M B, Dusan B. 2014. The role of L-type voltage-gated calcium channels Cav1.2 and Cav1.3 in normal and pathological brain function[J]. Cell Tissue Res, 357: 463-476. DOI:10.1007/s00441-014-1936-3 |
| 苏林博, 谢莲娜, 王凯君, 等. 2016. 阿托伐他汀对冠脉痉挛大鼠心肌超微结构及RhoA活性的影响[J]. 中国心血管病研究, 14(11): 1052-1055. DOI:10.3969/j.issn.1672-5301.2016.11.024 |
| Susan E. 2007. Apoptosis:a review of programmed cell death[J]. Toxicol Pathol, 35(4): 495-516. DOI:10.1080/01926230701320337 |
| Sun Y, Ke L L, Zheng X R, el al. 2017. Effects of different levels of calcium intake on brain cell apoptosis in fluorosis rat offspring and its molecular mechanism[J]. Biol Trace Elem Res, 176: 355-366. DOI:10.1007/s12011-016-0850-9 |
| 孙天水, 席淑华. 2016. 高氟对中枢神经系统损伤机制的研究进展[J]. 环境境与健康杂志, 33(4): 368-371. |
| Teng Y, Zhang J, Zhang Z G, et al. 2017. The effect of chronic fluorosis on calcium ions and CaMKIIα, and c-fos expression in the rat hippocampus[J]. Biological Trace Element Research, 182(6): 1-8. DOI:10.1007/s12011-017-1098-8 |
| Wang S Q, Song L S, Lakatta E G, et al. 2001. Ca2+ signalling between single L-type Ca2+ channels and ryanodine receptors in heart cells[J]. Nature, 410(6828): 592-596. DOI:10.1038/35069083 |
| 王长松, 刘家骝, 于燕妮, 等. 2003. 氟化物对细胞凋亡的影响及其分子机制[J]. 国外医学医学地理分册, 24(4): 145-147. |
| 熊传龙, 李卫东, 范中学, 等. 2017. 饮水氟含量与儿童氟斑牙剂量反应关系的研究[J]. 中华地方病学杂志, 36(2): 100-103. DOI:10.3760/cma.j.issn.2095-4255.2017.02.006 |
| Yu Q L, Shao D D, Zhang R., et al. 2019. Effects of drinking water fluorosis on L-type calcium channel of hippocampal neurons in mice[J]. Chemosphere, 220: 169-175. DOI:10.1016/j.chemosphere.2018.12.078 |
| Zheng X R, Sun Y, Ke L L, el al. 2016. Molecular mechanism of brain impairment caused bydrinking-acquired fluorosis and selenium intervention[J]. Environmental Toxicology and Pharmacology, 43: 134-139. DOI:10.1016/j.etap.2016.02.017 |
| 张爱君, 吴占河. 2003. 细胞凋亡与氟中毒[J]. 中国地方病防治杂志, (1): 31-34. DOI:10.3969/j.issn.1001-1889.2003.01.015 |
| 张璟, 祝文静, 章子贵. 2010. 慢性氟中毒与脑损伤关系研究进展[J]. 中国公共卫生, 26(2): 251-252. |
| Zhang J, Zhang Z G. 2013. Effects of chronic fluorosis on camkIIα, c-fos, bax, and bcl-2 channel signalling in the hippocampus of rats[J]. Fluoride, 46(3): 135-141. |
| Zhang J, Zhu W J, Xu X H, et al. 2011. Effect of fluoride on calcium ion concentration and expression of nuclear transcription factor kappa-B ρ65 in rat hippocampus[J]. Experimental and Toxicologic Pathology Official Journal of the Gesellschaft Fur Toxikologische Pathologie, 63(5): 407-411. DOI:10.1016/j.etp.2010.02.017 |
| 张荣荣, 杨祖菁. 2003. L-型钙通道拮抗剂治疗早产机制的研究[J]. 上海交通大学学报(医学版), 23(1): 31-34. DOI:10.3969/j.issn.1674-8115.2003.01.009 |
| 章子贵, 郑祥仁, 孙岩. 2015. 慢性氟中毒致学习记忆损伤的脑内神经机制[J]. 浙江师范大学学报(自然科学版), 38(1): 1-8. DOI:10.16218/j.issn.1001-5051.2015.01.001 |
| 章子贵, 徐晓虹, 杜红燕, 等. 2000. 衰老性记忆障碍与脑突触体内[Ca2+]i的相关性[J]. 生理学报, 52(1): 85-88. DOI:10.3321/j.issn:0371-0874.2000.01.018 |
