 , 丁国斌2, 苏瑞军2, 晋小婷1,3
, 丁国斌2, 苏瑞军2, 晋小婷1,3
 , 李卓玉2,4
, 李卓玉2,41. 山西大学生物医学研究院, 太原 030006;
2. 山西大学生物技术研究所, 化学生物学与分子工程教育部重点实验室, 太原 030006;
3. 中国科学院生态环境研究中心, 环境化学与生态毒理学国家重点实验室, 北京 100085;
4. 山西大学生命科学院, 太原 030006
收稿日期: 2019-06-13; 修回日期: 2019-08-07; 录用日期: 2019-08-07
基金项目: 国家自然科学基金青年基金(No.21707085);国家自然科学基金(No.31770382);山西省青年科技基金(No.201701D221244)
作者简介: 薛彬(1994-), 女, E-mail:1181226215@qq.com
通讯作者(责任作者): 晋小婷(1987—), 女, 山西大学生物医学研究院副教授, 研究方向为环境毒理学, 环境因子的健康效应及分子标靶的研究.主持承担的科研项目2项, 以第一作者或通讯作者发表SCI收录论文10余篇.E-mail: jinxiaoting2016@sxu.edu.cn.
摘要:鉴于PM2.5组分呈现多样性和复杂性,其引起心力衰竭的主要毒性组分尚不清楚.由于采样地区、季节和污染源的不同,PM2.5不同组分的占比也会有巨大差异,但不同浓度无法比较其不同组分间的毒性差异.因此,为了揭示大气PM2.5引起心肌毒性作用的关键组分,分离复合型PM2.5的3种主要组分(有机组分、金属组分和水溶性组分),综合两种浓度暴露方式,即实际占比浓度和与复合型PM2.5相同的暴露浓度,染毒H9C2大鼠心肌细胞24 h和48 h,选择心肌细胞的细胞存活和炎症反应为主要评价指标,旨在揭示PM2.5对心肌造成毒性损伤的关键性成分.CCK-8法检测存活结果显示,不同组分在实际环境比重下,对心肌细胞存活率没有造成显著影响.相同浓度暴露下,高剂量组分(30 μg·cm-2)引起心肌细胞存活率显著降低,且有机组分毒性大于其他组分.根据细胞活力测定结果,选择低染毒浓度(10 μg·cm-2)暴露细胞,采用qRT-PCR和ELISA试剂盒检测炎症因子变化.与对照组相比,金属组暴露后,炎症因子TNF-α和IL-1β显著升高,而有机组则显著升高TNF-α的含量.结果表明,造成心肌细胞存活毒性和炎症损伤的主要PM2.5组分可能为有机组分和金属组分,而炎性反应对这两种组分的响应存在显著差异.
关键词:大气细颗粒物心肌细胞毒性组分细胞存活炎性反应
The main toxic components of fine particulate matters on cardiocytes: Focused on the cell viability and inflammatory response
XUE Bin1
 , DING Guobin2, SU Ruijun2, JIN Xiaoting1,3
, DING Guobin2, SU Ruijun2, JIN Xiaoting1,3
 , LI Zhuoyu2,4
, LI Zhuoyu2,41. Institutes of Biomedical Sciences, Shanxi University, Taiyuan 030006;
2. Key Laboratory of Chemical Biology and Molecular Engineering of National Ministry of Education, Institute of Biotechnology, Shanxi University, Taiyuan 030006;
3. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
4. School of Life Science, Shanxi University, Taiyuan 030006
Received 13 June 2019; received in revised from 7 August 2019; accepted 7 August 2019
Abstract: Considering the diversity and complexity of fine particulate matters (PM2.5), its key toxic components causing heart failure are still unclear. The differences of area, season and pollution source sampling PM2.5 lead to the huge discrepancies in the proportion of different components, which is the reason of why it is difficult to compare the myocardial toxicity among all kinds of components in a variety of concentrations. Hence, to investigate the key toxic components, the samples, including organic components of PM2.5(O-PM2.5), water-soluble components of PM2.5 (WS-PM2.5) and metal components of PM2.5 (M-PM2.5), were extracted from whole PM2.5 (W-PM2.5), and then exposed to H9C2 cells for 24 h and 48 h at two types of exposure concentrations (actual air proportion and the same concentrations of W-PM2.5). To identify the key toxic components of PM2.5, the effects of PM2.5 exposure on the cell viability and inflammatory were explored. The data from CCK-8 assay indicated that all components had no significant effect on the viability of myocardial cells in the actual air proportion. In the same concentrations, decreased viability was observed in the high dose (30 μg·cm-2) PM2.5-exposed H9C2 cells. Specially, the toxic of O-PM2.5 was higher than that of M-PM2.5. According to the above results, the expressions and activities of enzymes known to take part in heart failure were analyzed by qPCR and ELISA assay. The levels of TNF-α and IL-1β were conspicuously increased upon exposure to M-PM2.5 as compared with control group. Meanwhile, O-PM2.5 treatment remarkably caused the increase of TNF-α. These results demonstrated that O-PM2.5 and M-PM2.5 may be the key components to cause cardiotoxicity through the evaluation of viability and inflammation, and there is significant difference between O-PM2.5 and M-PM2.5 on inflammatory response.
Keywords: fine particulate mattermyocardial celltoxic componentscell viabilityinflammatory
1 引言(Introduction)大气细颗粒物(Fine Particulate Matter, PM2.5)是指空气动力学直径≤2.5 μm的颗粒物, 也是导致雾霾形成的主要原因(朱成章, 2015).环境监测数据显示, 随着我国"大气污染防治行动计划"的实施, 2013—2017年74个重点城市中, 京津冀地区、长江三角地区、珠三角地区的PM2.5年均浓度逐年下降, 但除珠三角地区PM2.5年均浓度低于国家GB 3095—2012《环境空气质量标准》以外, 其他地区均未达标(于浩等, 2018).因此, PM2.5引起的毒理学效应和潜在的健康风险仍值得关注.研究表明, PM2.5引起的死亡原因中相关性最强的不是肺部呼吸疾病, 而是心血管疾病(Simkhovich et al., 2008).PM2.5可通过呼吸系统进入血液循环, 导致血栓形成、凝血功能障碍、心力衰竭、高血压和粥样动脉硬化等心血管疾病(Brook et al., 2010; Nawrot et al., 2011; Dabass et al., 2016).Xu等(2017)研究发现, 北京市PM2.5浓度每增加10 μg·m-3, 心力衰竭患者住院率增加1.21%, 95%的置信区间为0.27%~2.15%;Lipset等(2011)对空气污染因子和心力衰竭的相关性调查分析发现, 大气PM2.5浓度每上升10 μg·m-3, 人群冠心病死亡率平均增加2.1%.由此可见, 大气PM2.5诱发的心力衰竭对人体健康构成了严重威胁.
PM2.5是复合型颗粒物, 主要包括金属组分、有机组分、水溶性组分和不溶性组分等(Han et al., 2010; 王少毅等, 2013; Wang et al., 2019).目前针对PM2.5对心肌细胞产生的毒性效应研究多集中在总颗粒物上, 而PM2.5组分呈现多样性和复杂性, 其引起心肌细胞毒性的不同组分尚不清楚.同时, 由于采样地区、季节和污染源的不同, PM2.5不同组分的占比也会有巨大差异, 但不同浓度无法比较其不同组分间的毒性差异.因此, 本研究综合采用两种浓度暴露方式, 即实际占比浓度和与复合型PM2.5相同的暴露浓度, 旨在揭示PM2.5对心肌造成毒性损伤的关键性成分.
目前大气PM2.5诱发心力衰竭的主要毒理机制之一为引发机体炎症反应(Riva et al., 2011; Valavanidis et al., 2013).炎症是机体对于刺激的一种防御性反应, 是疾病的发病基础.国外研究表明, 无论是长期或短期暴露于PM2.5, 发生心血管的风险都会增加, 而其中重要因素为引发了炎症反应(Brook et al., 2004; Pope et al., 2004).罗斌等(2014)研究发现, PM2.5暴露后的大鼠心脏组织中炎症因子IL-6显著升高, 且在低温PM2.5组升高最为明显.袁凌珂等(2016)对大鼠进行不同浓度的PM2.5暴露后发现, 暴露组中大鼠心肌组织IL-6、TNF-α表达水平较对照组显著升高, 且随着染毒剂量的增加而上升, 引起了心肌组织产生炎性反应.因此, 本研究将围绕炎性因子含量的变化, 揭示大气细颗粒物暴露干扰心肌炎性反应的主要毒性组分.
本研究采用复合型PM2.5及不同组分对大鼠心肌细胞H9C2进行暴露, 评估PM2.5不同组分对H9C2细胞的活性和炎症反应的影响.旨在揭示PM2.5对心肌造成毒性损伤的关键性成分, 为进一步研究大气PM2.5不同组分引起心力衰竭的作用机制提供理论基础.
2 材料与方法(Materials and methods)2.1 实验材料和仪器2.1.1 细胞大鼠心肌细胞H9C2购自中国科学院上海生科院细胞资源中心.
2.1.2 主要仪器及试剂仪器主要包括XT-1025大流量PM2.5采样器(美国Thermal Anderson公司)、FD-1冷冻干燥机(无锡德普仪器制造有限公司)、CP224电子天平(上海天平仪器技术有限公司)、CO2培养箱(美国Thermo公司)、5333型RT-PCR仪(德国Eppendorf公司)、NanoDrop 2000酶标仪(美国Thermo公司)、二氧化碳培养箱(德国Eppendorf公司)、倒置显微镜(日本Nikon公司)、超净工作台(中国亚泰科隆公司)、旋转蒸发仪(巩义市予华仪器有限责任公司)、氮吹仪(济南海能仪器股份有限公司)、SH230N重金属消解仪(济南海能仪器股份有限公司); 试剂包括台盼蓝染料(北京索莱宝科技有限公司)、ELISA试剂盒(上海西塘生物科技有限公司)、CCK-8试剂盒(武汉博士德生物工程有限公司)、荧光定量PCR引物(上海生工公司), Trizol、PrimeScript RT reagent Kit及SYBR green PCR master mix试剂均购自日本Takara公司.
2.2 复合型PM2.5(W-PM2.5)的采集与制备采样地点设立在山西大学环境与资源学院楼顶(30°15'N, 112°33'E, 海拔802 m), 距离地面25 m.周围是学校、住宅和交通繁忙区, 无工厂.使用中流量PM2.5采样器, 采用石英纤维滤膜采集2018年冬季太原市大气细颗粒物, 采样流量为1.13 m3·min-1.采样膜在400 ℃马沸炉中灼烧2 h后, 放入干燥器中干燥平衡, 并称重平衡后的质量.将称重后的采样膜放于采样器中, 每日固定时间更换新的采样膜.采样后将富集PM2.5的滤膜置于干燥器中干燥24 h, 称重后用锡箔纸封包, -20 ℃保存.制备PM2.5悬液时, 先将富集PM2.5的滤膜剪成1 cm2大小, 放置在纯水中超声3次, 每次20 min; 再将PM2.5悬浮液低温冷冻干燥24 h后称重; 最后用去离子水配成5 mg·mL-1的PM2.5溶液, 紫外除菌.
2.3 大气PM2.5不同组分分离方法2.3.1 有机组分(O-PM2.5)的提取取PM2.5石英膜剪去无颗粒物的边缘, 其余部分剪成1 cm2大小的正方形放入圆底瓶中并加入100 mL二氯甲烷/丙酮(体积比1 : 1)提取剂, 冰浴超声振荡20 min, 重复3次; 在旋转蒸发仪中蒸发到5~10 mL时, 将液体倒入15 mL离心管中, 4000 r·min-1离心5 min; 取上清液在氮气下吹干, 收集残留在管壁上的黄褐色物质即为PM2.5有机成分的固体, 计算出PM2.5有机成分质量, 用DMSO配制成一定浓度的液体, 4 ℃保存备用.
2.3.2 水溶组分(WS-PM2.5)的提取将采样膜剪成1 cm2大小正方形置于烧杯中, 加入100 mL去离子水, 冰浴超声3次, 每次20 min; 将混悬液用医用纱布过滤除去样品膜, 并分装到50 mL干燥离心管中, 4 ℃、4000 r·min-1离心5 min, 重复2次; 将上清液再转移至称重过的50 mL干燥离心管中, 采用冷冻干燥机冻干样品后, 收集粉末并计算质量.根据实验所需浓度用去离子水配制成样品液, 4 ℃保存.
2.3.3 金属组分(M-PM2.5)的提取剪成1 cm2大小的正方形的PM2.5石英膜置于平底烧杯中, 加入20 mL HNO3、8 mL HClO4, 瓶口用保鲜膜封口, 放置过夜; 然后在电热板上70 ℃加热至有浓厚HClO4白烟时, 加盖使黑色有机碳化物充分分解; 待烧杯内黑色物质消失后, 将保鲜膜取下, 驱赶HClO4白烟并蒸发内容物至粘稠状; 将烧杯从加热板上取下冷却, 用10 mL 1%HNO3淋洗瓶内壁; 所获溶液放入仪器配套玻璃管中, 用重金属消解仪于300 ℃下恒温加热, 蒸干后得到的淡黄色粉末即为PM2.5金属组分; 收集淡黄色粉末并称重, 4 ℃保存.
2.4 细胞培养及染毒实验将大鼠心肌细胞H9C2培养于含10%胎牛血清的DMEM培养基中, 于37 ℃、5% CO2条件下培养, 每隔2~3 d进行换液或传代.取生长状态良好的细胞分成4组(混合型组、有机组、金属组和水溶组), 将不同组分的PM2.5分别配置为1、5、10、20、30 μg·cm-2暴露于H9C2细胞中24 h或48 h.取生长状态良好的细胞分成3组, 分别暴露于实际环境比重剂量下的不同组分PM2.5中24 h或48 h.具体剂量为有机组分0、1、2、4、6、8 μg·cm-2, 金属组分0、0.5、1、1.5、2、2.5 μg·cm-2, 水溶组分0、0.6、1.5、4.5、7.5、9 μg·cm-2.
2.5 CCK-8检测细胞存活将处于对数生长期的H9C2细胞以每孔5000个接种于96孔板中, 过夜贴壁后, 每孔加入100 μL相同浓度的不同PM2.5组分, 或加入100 μL不同浓度的PM2.5金属组分, 或加入100 μL不同浓度的PM2.5有机组分, 或加入100 μL不同浓度的PM2.5水溶组分, 在培养箱中暴露24和48 h后, 每孔加入10 μL CCK-8溶液.在培养箱中继续孵育2 h, 用酶标仪测定在450 nm处吸光值(OD).细胞存活率=(实验组A450/对照组A450)×100%, 每组设置6个平行.
2.6 台盼蓝染色将1×106个H9C2细胞接种于12孔板, 贴壁后用同一浓度的不同PM2.5组分分别暴露细胞48 h.暴露结束后, 弃去培养液, PBS清洗2次, 加入500 μL 0.4%台盼蓝溶液染色3 min.弃去台盼蓝染液, 用PBS清洗多余染液, 并在显微镜下观察计数.死细胞被染色成淡蓝色, 活细胞拒染.活细胞率=活细胞总数/(活细胞总数+死细胞总数)×100%.
2.7 qPCR检测将H9C2细胞接种在6孔板中, 贴壁后分别使用不同组分的PM2.5暴露48 h, 收集细胞, 加入Trizol提取细胞总RNA, 并采样逆转录试剂盒形成cDNA, 然后将合成的cDNA进行qPCR分析.mRNA表达量以β-actin为内参, 基因表达变化的计算采用倍增变化率表示, 倍增变化率= 2- ΔΔCt(ΔCt =目的基因Ct值-内参基因Ct值, ΔΔCt =实验组ΔCt -对照组ΔCt (n=3)).实验所使用的引物序列如表 1所示.
表 1(Table 1)
| 表 1 引物序列 Table 1 Primer sequences | |||||||||||||||||||||||||||
表 1 引物序列 Table 1 Primer sequences
| |||||||||||||||||||||||||||
2.8 ELISA检测H9C2细胞暴露于不同组分的PM2.5中48 h后, 取细胞培养上清液, 3000 r·min-1离心10 min去除颗粒, 按照ELISA试剂盒检测说明书分别检测大鼠肿瘤坏死因子-α(TNF-α)和大鼠白介素-1β(IL-1β)的表达水平, 并在实验加入终止液后的30 min内用酶标仪测定450 nm处吸光值(OD)(n=3).以浓度梯度稀释标准品OD值做出标准曲线, 根据样品OD值计算出相应含量.
2.9 统计学分析实验数据采用SPSS 17.0软件进行分析, 用GraphPad Prism 8软件作图, 用t检验对样本均数进行比较, 结果以均值±标准误(Mean±SD)的形式来表示, p < 0.05表示差异有统计学意义.
3 结果(Results)3.1 复合型PM2.5对心肌细胞存活率的影响根据实际环境复合型PM2.5浓度暴露心肌细胞24 h和48 h后采用CCK-8法测定细胞存活率.如图 1所示, 与对照组相比, 复合型PM2.5浓度越大, 细胞的存活率越低, 并且在不同浓度暴露48 h后, 存活率下降更为明显.综上可知, 细胞存活率与复合型PM2.5浓度呈剂量和时间-效应关系, 浓度越高, 细胞存活率降低越明显; 暴露时间越长, 细胞存活率越低.
图 1(Fig. 1)
 |
| 图 1 复合型PM2.5 (W-PM2.5)暴露对H9C2细胞存活率的影响 Fig. 1Effect of whole particle of PM2.5 (W-PM2.5) exposure on H9C2 cells viability rate |
3.2 不同组分PM2.5实际比重剂量对心肌细胞存活率的影响复合型PM2.5的主要成分有金属组分、有机组分和水溶组分, 每种组分在总PM2.5中所占的比例不同(Huang et al., 2014).根据实际采样分离得到的不同组分PM2.5的质量, 计算求出每种组分在总PM2.5中的占比, 结果如表 2所示.采用CCK-8法检测了H9C2细胞分别暴露于3种组分PM2.5实际环境比重剂量中24和48 h后的细胞存活率, 结果如图 2所示.在PM2.5有机组分和金属组分作用下, 与对照组相比, PM2.5浓度和时间与细胞存活率成负相关, 但无统计学差异.水溶组分随浓度的升高对细胞存活率无明显影响(图 2c).
表 2(Table 2)
| 表 2 PM2.5不同组分实际环境浓度占比 Table 2 The ratio of different compositions of PM2.5 in the real environment | ||||||||
表 2 PM2.5不同组分实际环境浓度占比 Table 2 The ratio of different compositions of PM2.5 in the real environment
| ||||||||
图 2(Fig. 2)
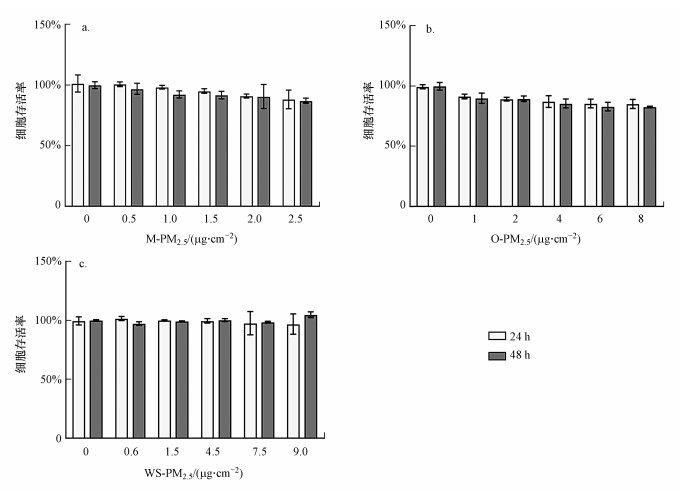 |
| 图 2 不同组分PM2.5实际比重暴露对H9C2细胞存活率的影响(a.金属组分, b.有机组分, c.水溶性组分) Fig. 2Effect of environment dose of the different compositions of PM2.5 exposure on H9C2 cells viability rate |
3.3 不同组分PM2.5相同剂量下对心肌细胞存活率的影响以上数据是根据不同组分的实际环境占比设置的浓度范围来暴露, 然而, 不同浓度无法比较PM2.5不同组分间的毒性差异, 因此, 进一步采用了与复合型PM2.5相同的剂量暴露心肌细胞, 用CCK-8检测了细胞存活率, 结果如图 3所示.不同组分暴露H9C2细胞24 h后, 细胞存活率与PM2.5浓度呈负相关, 浓度越高, 细胞存活率降低越明显; 在浓度达到10 μg·cm-2以后, 相同浓度下PM2.5的有机组分造成的细胞死亡率大于金属组分; 与对照组相比, 有机组分和金属组分在30 μg·cm-2时细胞存活率有显著性下降(p<0.05);细胞在暴露48 h后, 有机组分的细胞存活率为60%左右(p<0.05), 明显低于其他组分的存活率.通过台盼蓝染色检测30 μg·cm-2下不同组分暴露后的细胞死亡率, 与上述结果保持一致(图 4).综上表明, PM2.5有机组分和金属组分呈浓度和时间依赖式影响H9C2细胞存活率, 即时间越长, 浓度越高效果越明显.PM2.5的不同组分对细胞存活毒性为有机组分>金属组分>水溶性组.
图 3(Fig. 3)
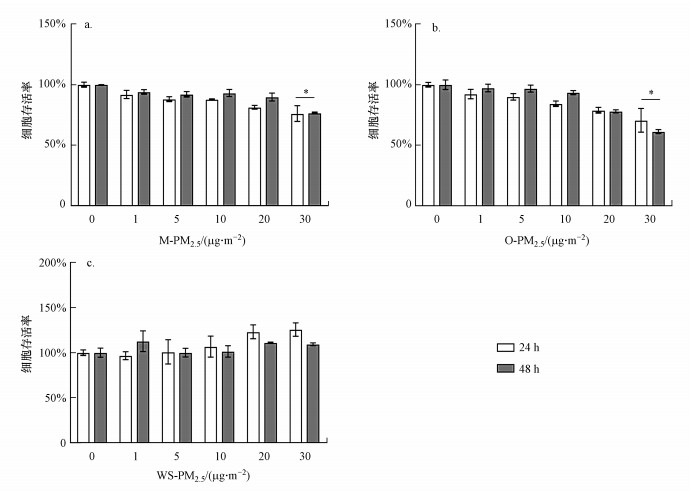 |
| 图 3 CCK-8实验检测不同组分PM2.5相同剂量暴露对H9C2细胞存活率的影响(a.金属组分; b.有机组分; c.水溶性组分; 与对照组相比, *p < 0.05, **p < 0.01) Fig. 3Effect of same dose of the different compositions of PM2.5 exposure on H9C2 cells viability rate with CCK-8 assay(Compared to the control) |
图 4(Fig. 4)
 |
| 图 4 台盼蓝染色实验检测不同组分PM2.5相同剂量暴露对H9C2细胞存活率的影响 Fig. 4Effect of same dose of the different compositions of PM2.5 exposure on H9C2 cells viability rate by Trypan blue staining |
3.4 不同组分PM2.5对心肌细胞炎性的影响PM2.5引起心血管疾病的主要因素是诱导炎症因子反应及炎症因子的表达, 而PM2.5为复合型颗粒物, 不同组分对细胞造成的损伤不同, 引发的炎症因子表达也有差异.在相同暴露剂量下, 不同组分的PM2.5对细胞炎症因子的影响如图 5所示.由图 5a可知, 与对照组相比, 炎症因子TNF-α的mRNA水平在金属组分、有机组分和复合型PM2.5暴露下均显著升高(p<0.01), 分别为对照组的3.0、2.6和2.3倍.iNOS和COX-2在PM2.5不同组分暴露后, 无显著性变化.由图 5b可知, 炎症因子NF-κB和STAT3在不同组分暴露后的细胞中没有升高, 相反在水溶性组分暴露后略有下降(p<0.05或0.01).由图 5c可知, IL-1β的mRNA水平在金属组分暴露下显著升高(p<0.01), 其它组分暴露后无显著差异.IL-6在各组中均无显著性变化.将具有显著性升高的TNF-α和IL-1β进行ELISA实验, 进一步检测二者在蛋白水平的变化趋势.由图 5d可知, TNF-α在金属组分暴露后为417 pg·mL-1, 有机组中为350 pg·mL-1, 混合组中为200 pg·mL-1, 与对照组的136 pg·mL-1相比, 均显著升高(p<0.01), 水溶组无显著变化.同时, 蛋白水平与mRNA水平变化趋势相吻合, 即金属组>有机组>复合型组.由图 5e可知, IL-1β在金属组中为201 pg·mL-1(p<0.01), 有机组中为198 pg·mL-1(p<0.05), 水溶组中为110 pg·mL-1, 复合型组中为115 pg·mL-1, 均高于对照组的99.95 pg·mL-1.综上, 不同组分对心肌细胞的炎症影响为金属组分>有机组分>复合型组分>水溶组分.
图 5(Fig. 5)
 |
| 图 5 不同组分PM2.5对H9C2细胞炎性因子表达情况的qPCR (a~c)和ELISA (d~e)分析(与对照组相比, *p < 0.05, **p < 0.01) Fig. 5Effect of the different compositions of PM2.5 exposure on inflammatory cytokinesn by qPCR(a~c) and ELISA(d~e) assay |
4 讨论(Discussion)研究表明, PM2.5暴露浓度和时间与人群的心血管病发生率和死亡率呈线性相关(Dominici et al., 2006).太原市是重化工城市, PM2.5污染严重且呈现季节性分布, 尤以冬季污染最为严重(周静等, 2018), 因此, 本实验选择太原市冬季PM2.5作为实验材料.Wang等(2019)的实验结果表明, 人神经母细胞瘤细胞(SH-SY5Y)在暴露太原冬季PM2.5 24 h和48 h后有明显毒性损伤效应, 细胞存活率呈时间和剂量依赖式下降.因此, 本实验最终选择24 h和48 h作为暴露时间.本研究结果表明, 不同浓度的实际环境比重复合型PM2.5暴露24 h或48 h后, 大鼠心肌细胞H9C2的存活率影响呈浓度和时间依赖式下降, 与Wang等的研究结果一致.而PM2.5由多种组分组成, 并根据时间和空间差异, 不同组分所占比例有所不同(王雪君等, 2017; 刘佳澍, 2018).本实验分别从相同质量的复合型PM2.5上提取有机组分、金属组分和水溶组分, 计算出不同组分之间的质量之比.根据复合型PM2.5暴露细胞后的存活实验, 选择低染毒计量10 μg·cm-2, 按比例计算出各成分的暴露计量范围, 进而研究影响PM2.5对H9C2细胞造成损伤的毒性成分.通过分离太原冬季PM2.5不同组分发现, 有机组分占26%±4.5%, 金属组分占17%±2.1%, 水溶组分占44%±5.2%.从本课题组的研究结果可以看出, 环境实际比重下的不同组分PM2.5暴露后, 金属组和有机组的H9C2细胞存活率下降, 而水溶组分没有影响, 但均未显示出显著性差异.因此, 为了比较不同组分对心肌细胞存活率的差异, 又使用相同浓度的不同组分暴露心肌细胞.结果显示, 在相同浓度暴露下, 有机组分和金属组分的细胞存活率呈下降趋势, 且有机组分在高浓度的暴露下存活率比金属组分低, 不同组分在相同浓度暴露下对细胞的毒性为:复合型组分>有机组分>金属组分>水溶组分.此前, 焦周光等(2018)研究发现, 复合型PM2.5对H9C2细胞存活率损伤效应大于有机组分, 而水溶性组分对细胞生长没有表现出显著的促进或抑制作用.郑灿军等(2006)研究也同样发现, 大于10 μg·mL-1不同组分PM2.5暴露大鼠心肌细胞时表现为抑制作用, 且有机组分大于水溶组分.这些结果都与本实验结论有一定的一致性.
PM2.5作为机体外来物, 可以促进细胞释放炎症因子, 引起炎症反应.有研究显示, PM2.5暴露后, 大鼠心脏组织IL-6、IL-1β和TNF-α的mRNA和蛋白表达较对照组显著上升(赵利芳等, 2017).本研究发现, 在PM2.5金属组分暴露后, 心肌细胞的炎症因子TNF-α、IL-1β显著升高, 而在有机组分和复合型PM2.5暴露后, 仅有TNF-α显著升高.提示不同组分的PM2.5对心肌细胞产生的炎症效应有所不同.而之前的报道表明复合型PM2.5促进了大鼠心肌细胞TNF-α mRNA的表达, 水溶性组分抑制了IL-6 mRNA的表达, 而有机组分促进了IL-6和TNF-α mRNA的表达, 对促进IL-6 mRNA表达的作用尤其显著(焦周光等, 2018).孙哲琳等(2016)发现PM2.5有机组分处理肺上皮细胞(BEAS-2B)后, 炎症因子TNF-α、IL-1β和IL-8的mRNA表达量与有机组分浓度成计量依赖关系, 而IL-1β只在高剂量下表达显著增加.但Zhao等(2011)研究表明, PM2.5暴露后的人脐静脉内皮细胞(HUVEC)存活率下降, 且相同剂量下水溶组分大于有机组分.这些结果之间存在着差异, 且与本实验结果也有所不同, 提示PM2.5不同组分由于来源和时间及暴露细胞类型不同, 从而影响的关键炎症因子也有可能存在差异.此外, 对PM2.5金属组分引起细胞炎症反应的相关报道较少, 因此, 本实验也提供了金属组分对H9C2细胞在炎症反应中影响的促炎因子种类的一种可能性.
总体来说, 根据太原市冬季PM2.5不同组分环境实际剂量占比暴露细胞后, 与不同组分相比, 复合型PM2.5暴露对细胞存活率的影响比较大, 可能是因为复合型PM2.5包含的组分多样, 对心肌细胞产生的毒性影响更强; 也可能是另外环境实际占比设置的不同组分的暴露剂量较小, 不足以表现出较强的毒性作用.此外, 针对炎症反应, 本研究只是检测了关键炎症因子mRNA水平的变化, 证据并不全面, 因此, 仅是提供了太原市冬季PM2.5及不同组分暴露对心肌细胞造成炎症损伤效应的一种可能性, 然而直接作用机制仍然需要进一步探讨.同时, 需要进一步通过研究PM2.5在不同地点和时间的分布特征和理化性质, 更全面地阐明不同组分对心肌细胞毒性损伤的贡献, 为空气质量综合治理及大气细颗粒物对心血管疾病不良影响评估提供科学依据.
5 结论(Conclusions)1) 实际环境浓度比重的太原市冬季不同组分PM2.5对心肌细胞存活率影响不明显.
2) 相同浓度下的太原市冬季不同组分PM2.5暴露后, 心肌细胞存活率在高浓度的有机组中显著下降, 表现为复合组>有机组分>金属组分>水溶性组分.
3) 太原市冬季PM2.5通过激活炎症因子TNF-α、IL-1β, 引发心肌炎症损伤, 相同浓度下, 金属组分和有机组分单独暴露更为显著, 表现为金属组分>有机组分>复合组分>水溶组分.
4) 本实验由于仅进行了mRNA水平的变化分析, 所以该结果仅是提供了太原市冬季PM2.5及不同组分暴露对心肌细胞造成炎症损伤效应的一种可能性, 仍需进行其他实验进一步验证.
参考文献
| Brook R D, Franklin B, Cascio W, et al. 2004. Air pollution and cardiovascular disease:a statement for healthcare professionals from the expert panel on population and prevention science of the american heart association[J]. Circulation, 109(21): 2655-2671. DOI:10.1161/01.CIR.0000128587.30041.C8 |
| Brook R D, Rajagopalan S, Pope C A, et al. 2010. Particulate matter air pollution and cardiovascular disease[J]. Circulation, 121(21): 2331-2378. DOI:10.1161/CIR.0b013e3181dbece1 |
| Dabass A, Talbott E O, Venkat A, et al. 2016. Association of exposure to particulate matter (PM2.5) air pollution and biomarkers of cardiovascular disease risk in adult NHANES participants (2001-2008)[J]. Int J Hyg Environ Health, 219(3): 301-310. DOI:10.1016/j.ijheh.2015.12.002 |
| Dominici F, Peng R D, Bell M L, et al. 2006. Fine particulate air pollution and hospital admission for cardiovascular and respiratory diseases[J]. JAMA, 295(10): 1127. DOI:10.1001/jama.295.10.1127 |
| Han W, Dan W, Shuo Y, et al. 2010. Oxidative stress induced by urban fine particles in cultured EA.hy926 cells[J]. Hum Exp Toxicol, 30(7): 579-590. |
| Huang R J, Zhang Y, Bozzetti C, et al. 2014. High secondary aerosol contribution to particulate pollution during haze events in China[J]. Nature, 514(7521): 218-222. DOI:10.1038/nature13774 |
| 焦周光, 胡凌飞, 李娜, 等. 2018. 大气PM2.5对大鼠心肌细胞的毒性作用[J]. 环境科学研究, 31(9): 1636-1644. |
| Lipsett M J, Ostro B D, Reynolds P, et al. 2011. Long-term exposure to air pollution and cardiorespiratory disease in the california teachers study cohort[J]. Am J Respir Crit Care Med, 184(7): 828-835. DOI:10.1164/rccm.201012-2082OC |
| 刘佳澍, 顾远, 马帅帅, 等. 2018. 常州夏冬季PM2.5中无机组分昼夜变化特征与来源解析[J]. 环境科学, 39(3): 980-989. |
| 罗斌, 王丽娜, 晚亚雄, 等. 2015. 低温条件下大气PM2.5对大鼠心脏抗氧化能力及炎症反应的影响[J]. 中国应用生理学杂志, 31(1): 11-13. |
| Mustafic H, Jabre P, Caussin C, et al. 2012. Main air pollutants and myocardial infarction:A systematic review and meta-analysis[J]. JAMA, 307(7): 713-721. DOI:10.1001/jama.2012.126 |
| Nawrot T S, Perez L, Künzli N, et al. 2011. Public health importance of triggers of myocardial infarction:A comparative risk assessment[J]. Lancet, 377(9767): 732-740. DOI:10.1016/S0140-6736(10)62296-9 |
| Pope R C, Burnett R T, Thurston G D, et al. 2004. Cardiovascular mortality and long-term exposure to particulate air pollution:Epidemiological evidence of general pathophysiological pathways of disease[J]. Circulation, 109(1): 71-77. DOI:10.1161/01.CIR.0000108927.80044.7F |
| Riva D R, Magalhaes C B, Lopes A A, et al. 2011. Low dose of fine particulate matter (PM2.5) can induce acute oxidative stress, inflammation and pulmonary impairment in healthy mice[J]. Inhal Toxicol, 23: 257-267. DOI:10.3109/08958378.2011.566290 |
| Simkhovich B Z, Kleinman M T, Kloner R A, et al. 2008. Air pollution and cardiovascular injury epidemiology, toxicology and mechanisms[J]. J Am Coll Cardiol, 52: 719-726. DOI:10.1016/j.jacc.2008.05.029 |
| 孙哲琳, 陈重军, 杨令延, 等. 2016. PM2.5水溶性和有机组分对肺上皮细胞损伤及COPD相关基因和蛋白表达影响[J]. 环境科学学报, 36(11): 4262-4271. |
| Thurston G D, Ahn J, Cromar K R, et al. 2016. Ambient particulate matter air pollution exposure and mortality in the NIH-AARP diet and health cohort[J]. Environ Health Perspect, 124(4): 484-490. DOI:10.1289/ehp.1509676 |
| Valavanidis A, Vlachogianni T, Fiotakis K, et al. 2013. Pulmonary oxidative stress, inflammation and cancer:Respirable particulate matter, fibrous dusts and ozone asmajor causes of lung carcinogenesis through reactive oxygen species mechanisms[J]. Int J Environ Res Public Health, 10: 3886-3907. DOI:10.3390/ijerph10093886 |
| 王少毅, 曾燕君, 琚鸿, 等. 2013. 广州地区秋冬季细颗粒物PM2.5化学组分分析[J]. 环境监测管理与技术, 25(4): 9-12. DOI:10.3969/j.issn.1006-2009.2013.04.003 |
| 王雪君, 高志岭, 刘学军, 等. 2017. 养殖场、农田和道路大气PM2.5中金属元素的污染特征分析[J]. 河北农业大学学报, (5): 18-24. |
| Wang Y, Zhang M, Li Z, et al. 2019. Fine particulate matter induces mitochondrial dysfunction and oxidative stress in human SH-SY5Y cells[J]. Chemosphere, 218: 577-588. DOI:10.1016/j.chemosphere.2018.11.149 |
| Xu Q, Wang S, Guo Y, et al. 2017. Acute exposure to fine particulate matter and cardiovascular hospital emergency room visits in Beijing, China[J]. Environ Pollut, 220: 317-327. DOI:10.1016/j.envpol.2016.09.065 |
| 袁凌珂, 章明徐, 朱娱, 等. 2016. 不同浓度大气细颗粒污染物PM2.5对心脏组织功能的影响[J]. 现代医药卫生, 32(19): 2942-2944. DOI:10.3969/j.issn.1009-5519.2016.19.002 |
| 于浩, 冯利红, 侯常春, 等. 2018. 中国空气颗粒物污染改善背景下的人群健康收益研究进展[J]. 公共卫生与预防医学, 29(5): 87-90. |
| 赵利芳, 张书源, 佟金龙, 等. 2017. PM2.5和SO2复合暴露对大鼠心脏病理学及炎症因子表达的影响[J]. 环境科学学报, 37(5): 2006-2011. |
| Zhao J, Xie Y, Jiang R, et al. 2011. Effects of atorvastatin on fine particle-induced inflammatory response, oxidative stress and endothelial function in human umbilical vein endothelial cells[J]. Hum Exp Toxicol, 30(11): 1828-1839. DOI:10.1177/0960327111401050 |
| 郑灿军, 王菲菲, 郭新彪. 2006. 大气PM2.5对原代培养大鼠心肌细胞的毒性[J]. 环境与健康杂志, 23(1): 17-20. DOI:10.3969/j.issn.1001-5914.2006.01.005 |
| 朱成章. 2013. 我国防止雾霾污染的对策与建议[J]. 中外能源, 18(6): 1-4. |
| 周静, 张岳军, 相栋, 等. 2018. 太原市PM2.5周期性特征及其成因分析[J]. 生态环境学报, (3): 527-532. |
