 , 陈悟1#
, 陈悟1# , 陈曦1,2, 韩逸群1,3, 朱彤1
, 陈曦1,2, 韩逸群1,3, 朱彤1

1. 北京大学工程科学与新兴技术高精尖创新中心, 北京大学环境科学与工程学院环境模拟与污染控制国家重点联合实验室, 北京 100871;
2. 深圳市建筑科学研究院股份有限公司, 研创中心, 深圳 518049;
3. MRC-PHE Centre for Environment and Health, School of Population Health & Environmental Sciences, King's College London, London SE1 9NH
收稿日期: 2019-05-08; 修回日期: 2019-06-21; 录用日期: 2019-06-21
基金项目: 国家自然科学基金(No.81571130100,41421064,21190051,41121004);国家重点基础研究发展(973)计划(No.2015CB553401)
作者简介: 姚媛(1995-), 女, E-mail:yuanyao@pku.edu.cn;
陈悟(1993-), 女, E-mail:cwvivian511@163.com
通讯作者(责任作者): 朱彤, 男, 教授, 博士生导师, 研究领域为大气化学、环境与健康, 主要研究方向为大气化学反应动力学、地-气物质交换、青藏高原大气化学、大气环境与健康和超大城市空气污染控制, E-mail:tzhu@pku.edu.cn
摘要:RNA是在基因表达层面探究分子生物学机制的重要研究对象.由于RNA化学性质活泼、结构不稳定,并且内外源RNA酶无处不在,如何从环境流行病学研究收集到的全血样本中提取出高质量的总RNA是困扰研究人员的一大难题.本研究旨在建立一种能长期保存全血样本并从中提取出高质量总RNA的方法.通过将环境流行病学研究中采集到的少量新鲜全血立即与10倍体积的TRIzol试剂混匀后置于-80℃冰箱中,可保护RNA在长期保存过程中不发生降解.针对长期保存的全血-TRIzol混合体系,在经典的TRIzol一步法基础上,无需将全血样本分装至不含RNA酶的1.5 mL离心管,直接在较大操作空间(不含RNA酶的15 mL离心管)中进行总RNA相分离、沉淀、洗涤等操作,并在总RNA晾干前再增加离心并吸取少量残留液体操作,缩短自然晾干时间.本方法无需离心、分离血浆、裂解红细胞等繁杂的前处理步骤,极大地简化了操作步骤,减少了采样工作量,实现了对全血样本的低成本长期保存.通过增大操作空间、改进晾干操作,本方法显著提高了总RNA样本的完整性和纯度.使用本方法提取出保存一年的全血总RNA产率为(9.18±2.10)μg·mL-1,完整性指标RIN值和28S/18S分别为8.98±0.18和1.08±0.08,纯度指标OD260/OD280和OD260/OD230分别为2.18±0.04和1.70±0.00.保存两年的全血提取出总RNA的产率、完整性及纯度仍然可以满足下游实验要求.
关键词:环境流行病学全血长期保存RNA提取产率完整性纯度
Long-term storage of whole blood samples and RNA isolation in environmental epidemiological studies
YAO Yuan1#
 , CHEN Wu1#
, CHEN Wu1# , CHEN Xi1,2, HAN Yiqun1,3, ZHU Tong1
, CHEN Xi1,2, HAN Yiqun1,3, ZHU Tong1

1. Beijing Innovation Center for Engineering Science and Advanced Technology, State Key Joint Laboratory for Environmental Simulation and Pollution Control, College of Environmental Sciences and Engineering, Peking University, Beijing 100871;
2. Center of Research and Innovation, Shenzhen Institute of Building Research Co., Ltd., Shenzhen 518049;
3. MRC-PHE Centre for Environment and Health, School of Population Health & Environmental Sciences, King's College London, London SE1 9NH
Received 8 May 2019; received in revised from 21 June 2019; accepted 21 June 2019
Abstract: RNA is an important research object to explore the molecular biological mechanism at the level of gene expression. Due to the unstable structure and active chemical property of RNA and the influence of endogenous and exogenous RNase,how to isolate high-quality total RNA from whole blood samples in environmental epidemiological studies is a critical issue. The purpose of this study is to establish a method for long-term storage of whole blood samples and isolation of high-quality total RNA. A small amount of fresh whole blood was immediately mixed with 10 times the volume of TRIzol reagent and stored in a -80℃ refrigerator to protect RNA from degradation in long-term storage. Based on the conventional one-step method,instead of aliquoting the whole blood-TRIzol mixture into 1.5 mL RNase-free centrifuge tubes,total RNA phase separation,precipitation and washing were performed directly in the original mixture. Additionally,centrifugation and discarding residual liquid before total RNA drying helped shorten the natural drying time. This method eliminated the need for centrifugation,separation of plasma,lysis of red blood cells and other time-consuming pretreatment steps,and achieved low-cost and long-term storage of whole blood samples. This method significantly improved the integrity and purity of the total RNA by increasing the operating space (15 mL RNase-free centrifuge tubes) and improving the drying procedure. The results showed that for whole blood stored for one year,the yield of total RNA was (9.18±2.10) μg·mL-1,the RIN value and 28S/18S were 8.98±0.18 and 1.08±0.08,respectively,and OD260/OD280 and OD260/OD230 were 2.18±0.04 and 1.70±0.00,respectively. The yield,integrity and purity of the total RNA isolated from whole blood stored for two years could still meet the requirements of downstream experiments.
Keywords: environmental epidemiologywhole bloodlong-term storageRNA isolationyieldintegritypurity
1 引言(Introduction)随着工业化和城市化进程的加速, 环境污染问题日趋严重.据估计, 2015年全球约有900万人死于由污染引发的疾病, 占总死亡数的16%(Landrigan et al., 2018).在中国, 空气污染和水污染等环境危险因素与疾病发病和死亡存在密切关联(Zhang et al., 2010).以大气污染为例, 污染物暴露与人体健康之间的关联呈“金字塔”分布, 位于金字塔顶的死亡率只是复杂健康效应中的“冰山一角”(Ezzati et al., 2004).在人群患病或者死亡之前, 一些功能性指标/临床症状及分子水平的亚临床指标可能已经发生改变(Han et al., 2015).目前介导污染物暴露与人体健康效应之间关联性的分子生物学机制尚不明确, 通过分子水平的研究, 可能帮助阐明这一重要的科学问题, 为污染物控制标准的制定提供科学依据, 实现对人群健康更加有效的防护.
在中心法则中, RNA是连接DNA与蛋白质的桥梁, 反映了细胞功能状态的动态变化(Liu et al., 2018).从RNA层面上研究基因表达情况, 在探究疾病的生物学机制中发挥了重要作用(Minshall et al., 1997; Ezzie et al., 2012; Batista et al., 2013; Schmitz et al., 2016).近年来, 一些流行病学研究开始以多种生物标志物结合组学方法来研究大气污染健康效应的机制(Wang et al., 2018), 其中包括以RNA为研究对象来探究污染物暴露与基因表达之间的关联, 并进一步结合代谢组学的方法揭示污染物暴露引发不良健康效应的生物学机制(Vrijens et al., 2017; Gruzieva et al., 2017).RNA的提取是研究基因表达的基础, RNA的质量对下游实验有很大的影响, 只有提取出总量足够、完整性较好、纯度较高的RNA才能进行后续转录组测序、微阵列检测、即时聚合酶链锁反应、诺瑟杂交等分析(Jiang et al., 2013; Van Dyck et al., 2013).
以RNA为对象的基因表达研究中, 全血是一种侵入性较低的RNA来源, 是常见的用于提取RNA的生物样本(Gaarz et al., 2010; Schwochow et al., 2012).与DNA不同, RNA为单链结构, 化学性质活泼、结构不稳定(张义等, 2004).同时由于内源性和外源性的RNA酶无处不在, 使得RNA在保存、运输、提取等过程中非常容易降解, 这给RNA的提取带来了很大的困难(Debey et al., 2004; Kim et al., 2007).目前人全血总RNA提取方法主要有TRIzol一步法、PAXgene血液RNA试剂盒法等(Asare et al., 2008; Sim?es et al., 2013; Wang et al., 2004).PAXgene血液RNA试剂盒价格非常昂贵, 且需配套使用PAXgene静脉真空采血管, 对于样本量较大的环境流行病学研究来说, 成本较高、难以推广.而TRIzol一步法是一种经典的总RNA抽提方法, 操作简单且价格相对较低(Chomczynski et al., 2006).
高效且快速收集和保存生物样本是环境流行病学研究中至关重要的一环.多数研究在收集全血后, 为避免全血长期冻存后提取出的总RNA降解严重、无法满足下游实验对样本质量的要求(Kim et al., 2014), 通常会尽快对总RNA进行提取(Chu et al., 2016; Chen et al., 2018).然而, 对于某些特定类型的研究, 如巢式病例对照研究等, 研究者收集生物样本后, 可能需要长期保存后再进行分析, 这对生物样本的稳定性提出了非常高的要求(Hebels et al., 2013), 也由此产生了长期保存全血样本用于RNA提取的需求.对于全血长期保存及总RNA提取来说, 现有的TRIzol一步法还存在以下不足:①由于RNA自身结构及RNA酶等因素的影响, 全血保存时间增长, RNA降解风险增加;②全血采集后需经离心、分离血浆、裂解红细胞等步骤得到白细胞, 对于在短时间内收集大量生物样本的研究而言工作量非常繁重;③操作空间较小, 洗涤等过程中可能导致碳水化合物(糖类)、盐类或有机溶剂残留, 使得提取出全血总RNA的纯度较低;④自然晾干时间长, RNA样本长时间暴露于空气中, 与RNA酶接触的风险高.
本研究的目的是建立一种可在全血样本长期保存后提取高质量总RNA的方法.本方法的全血样品前处理过程无需离心、分离血浆、裂解红细胞, 也无需对全血进行分装, 而是直接将少量全血样本与TRIzol试剂混匀, 均质化后长期保存, 进而提取出高质量的总RNA.
2 材料与方法(Materials and methods)2.1 试剂与仪器全血长期保存及总RNA提取过程中使用的试剂、仪器等信息如表 1所示.
表 1(Table 1)
| 表 1 实验中所需试剂及仪器等信息 Table 1 Information of reagents and instruments used in the experiment | ||||||||||||||||||||||||||||||||||||||||||||||||
表 1 实验中所需试剂及仪器等信息 Table 1 Information of reagents and instruments used in the experiment
| ||||||||||||||||||||||||||||||||||||||||||||||||
2.2 全血采集及保存样本来源为本课题组2016—2017年期间开展的空气污染对高血压和慢性阻塞性肺疾病人群健康效应及其易感性的环境流行病学研究, 该研究获得北京大学医学部生物医学伦理委员会的批准(批件号:IRB00001052-16028;IRB00001052-15088), 受试者签署知情同意书后纳入研究.
将5 mL TRIzol试剂加入不含RNA酶的15 mL离心管中.由医院专业护士采集受试者空腹静脉血, 立即将0.5 mL全血转移至装有5 mL TRIzol试剂的离心管中, 吹吸混匀, 得到5.5 mL全血-TRIzol混合体系, 保护RNA不被降解.均质化后将混合体系置于-80 ℃冰箱中, 可长期保存待后续提取全血总RNA.
2.3 全血总RNA提取2.3.1 实验准备① 实验环境:人全血总RNA提取实验在超净实验室进行, 超净实验室内配备超净工作台.实验开始前及结束后, 用紫外灯灭菌处理.实验过程中用RNA酶去除试剂及75%乙醇擦拭超净工作台、移液枪、离心机等.
② 试剂准备:将异丙醇置于-20 ℃冰箱, 使用焦碳酸二乙酯(Diethy pyrocarbonate, DEPC)处理水与无水乙醇配制75%乙醇溶液作为洗涤液.
2.3.2 总RNA提取① 样本解冻:将5.5 mL全血-TRIzol混合体系从-80 ℃冰箱中取出, 在4 ℃冰箱中完全融化, 吹吸混匀后转移至新的不含RNA酶的15 mL离心管中.
② 相分离:加入1 mL氯仿, 大力上下振荡1 min, 涡旋振荡15 s, 室温孵育3 min; 将混合体系以12000 g转速在4 ℃条件下离心20 min, 混合体系分层, RNA存在于上层水相中.
③ 上层水相吸取:用移液枪(1 mL枪头前端套20 μL枪头)将水相转移至新的不含RNA酶的15 mL离心管中.
④ 总RNA沉淀:加入预冷的异丙醇(TRIzol量的1/2), 轻轻上下颠倒混匀后, 在-20 ℃条件下孵育30 min; 然后以12000 g转速在4 ℃条件下离心30 min, 生成总RNA沉淀.
⑤ 总RNA洗涤:去除上清后用75%乙醇溶液洗涤总RNA 3次, 第1次洗涤过程:加入3 mL 75%乙醇溶液, 轻轻摇动使沉淀重新悬浮, 涡旋振荡15 s, 以7500 g转速在4 ℃条件下离心8 min后去除上清;第2次洗涤过程:加入1 mL 75%乙醇溶液, 用1 mL移液枪枪头将15 mL离心管中的RNA沉淀转移至不含RNA酶的1.5 mL离心管, 涡旋振荡15 s, 以7500 g转速在4 ℃条件下离心5 min后去除上清;第3次洗涤过程:加入1 mL 75%乙醇溶液, 涡旋振荡15 s, 以7500 g转速在4 ℃条件下离心5 min后去除上清.
⑥ 总RNA晾干:将装有RNA沉淀和少量残留洗涤液的1.5 mL离心管以7500 g转速在4 ℃条件下继续离心2 min, 用20 μL移液枪吸取管内少量残留液体后, 将总RNA晾干.
⑦ 重新溶解总RNA:加入20 μL DEPC处理水, 吹吸使总RNA溶解, 保存在-80 ℃冰箱中或进行质量检测.
2.4 实验分组情况根据全血保存时间、实验条件分为A、B、C、D 4组, 每组各5个全血样本.A组编号A1~A5, 全血保存时间为一年, 按照本研究中建立的方法提取总RNA, 参见本文2.3节全血总RNA提取部分;B组编号B1~B5, 全血保存时间为两年, 按照本研究中建立的方法提取总RNA;C组编号C1~C5, 全血保存时间为一年, 与A组相比, 样本解冻后, 将混合体系等分为5份, 在不含RNA酶的1.5 mL离心管中进行总RNA提取后将总RNA合并;D组编号D1~D5, 全血保存时间为一年, D组与C组均将混合体系等分为5份提取后再将总RNA合并, 但D组在总RNA最后一次洗涤离心并弃去上清液后, 不增加对含有RNA沉淀和少量残留洗涤液的离心管再离心2 min并吸取残留液体的操作, 使离心并弃去上清液的总RNA自然晾干.
2.5 总RNA质量检测2.5.1 产率及完整性检测使用Agilent 2100生物分析仪、Agilent RNA 6000 Nano Kit(Agilent Technologies, CA, USA)对总RNA产率及完整性进行检测.根据样本的浓度、加入DEPC处理水体积和全血体积计算总RNA产率.当RNA总量较低时, 无法达到下游实验对样本量的要求.RIN值(RNA Integrity Number)和28S/18S是衡量RNA完整性的重要指标.RIN值范围为0~10, 其数值大小与样本的完整性成正相关(Schroeder et al., 2006).Agilent 2100生物分析仪生成的电泳图谱基线平整, 没有多余的降解杂峰, 28S和18S的峰形突出, 则RNA样本完整性较好.若样本降解则可能导致下游实验数据重复比例高, 随机性差, 结果误差大.
2.5.2 纯度检测使用NanoDrop8000微量分光光度计(Thermo Scientific, MA, USA)对总RNA纯度进行检测, OD260/OD280和OD260/OD230是评价RNA纯度的重要指标.纯RNA的OD260/OD280范围为1.7~2.0.纯RNA的OD260/OD230为2.5, 污染情况下比值小于2.0.由于受到蛋白质或其他杂质污染, RNA样本纯度低, 也可能导致下游实验数据重复比例高, 随机性差.
2.6 数据分析通过R(3.5.3)进行数据分析, 总RNA质量检测指标用均值±标准差表示.使用T检验进行组间差异比较, p < 0.01表示差异具有统计学意义.
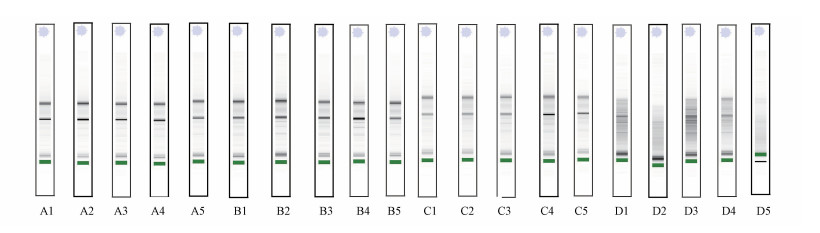
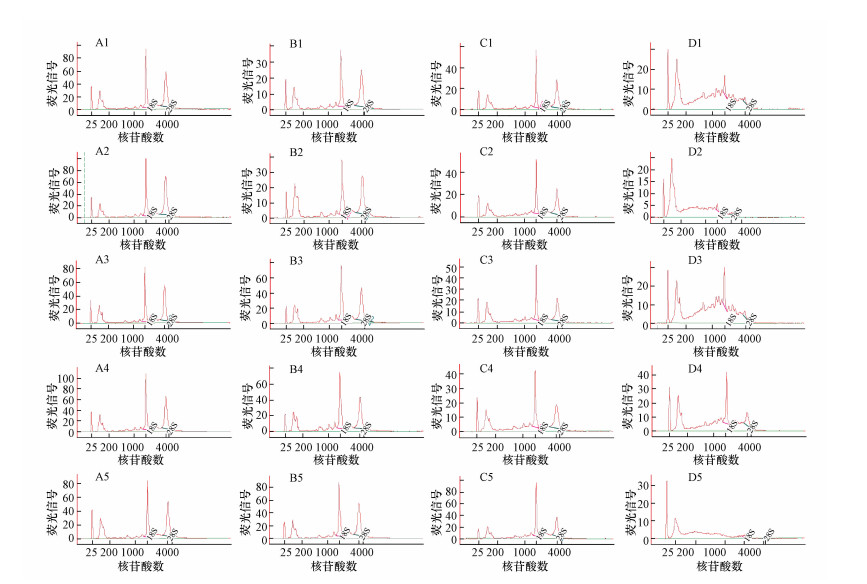
3 结果(Results)3.1 总RNA质量评估表 2为4组样本提取出的总RNA质量检测结果, 图 1和图 2分别是Agilent 2100生物分析仪中总RNA的凝胶样图谱和电泳图谱.
表 2(Table 2)
| 表 2 总RNA产率、完整性及纯度指标 Table 2 The yield, integrity and purity of total RNA | |||||||||||||||||||||||||||||||||||||||||||
表 2 总RNA产率、完整性及纯度指标 Table 2 The yield, integrity and purity of total RNA
| |||||||||||||||||||||||||||||||||||||||||||
图 1(Fig. 1)
 |
| 图 1 Agilent 2100生物分析仪中总RNA凝胶样图谱 Fig. 1Gel-like images of total RNA from the Agilent 2100 bioanalyzer |
图 2(Fig. 2)
 |
| 图 2 Agilent 2100生物分析仪中总RNA电泳图谱 Fig. 2Electropherograms of total RNA from the Agilent 2100 bioanalyzer |
表 2中A组总RNA产率为(9.18±2.10) μg·mL-1, 即从保存一年的0.5 mL全血中提取出约4.6 μg总RNA, 满足下游分析对RNA总量的要求.A组样本的完整性指标RIN值和28S/18S分别为8.98±0.18和1.08±0.08.RIN值较高, 满足高通量测序RIN值大于7.0的要求.28S/18S均值大于1.0, 但相对偏低, 与理论值相差较大, 说明样品完整性受到一定影响.但综合RIN值和28S/18S两项指标, 说明全血按本方法保存一年后提取出的总RNA完整性较好.图 1显示A组样本凝胶样图谱中28S和18S条带清晰, 图 2中A组样本电泳图谱基线平整, 没有降解杂峰, 28S和18S的峰形清晰且突出.A组样本的OD260/OD230和OD260/OD280分别为2.18±0.04和1.70±0.00, 表明本方法提取出的总RNA纯度较高.总的来说, 全血按本方法保存一年后提取出的总RNA产率高, 完整性较好且纯度较高, 满足下游分析对RNA的质量要求.
3.2 保存时间对总RNA质量的影响A组和B组分别为全血保存一年、两年后, 按照本研究中建立的方法提取出的全血总RNA.由表 2可知, 与A组相比, 随着保存时间的增加, 提取出总RNA的产率、28S/18S及OD260/OD230无显著性变化, RIN值略有降低, OD260/OD280略有增加.图 1中B组样本凝胶样图谱28S和18S条带较为清楚, 图 2中B组样本电泳图谱与A组相近.各指标达到一般实验要求, 说明本研究建立的方法可以实现少量全血保存两年并提取出较高质量的总RNA.
3.3 操作空间对总RNA质量的影响A组和C组均为保存一年的全血样本, A组直接在较大的操作空间中(不含RNA酶的15 mL离心管)提取总RNA, C组全血-TRIzol混合体系解冻后, 等分为5份, 在不含RNA酶的1.5 mL离心管中进行总RNA提取后将总RNA合并.与A组相比, 使用分管再合管的方法提取总RNA产率明显降低, 为(4.86±1.03) μg·mL-1, 可能是分管和再合管损失了部分总RNA.C组样本的完整性指标RIN值显著低于A组, 说明分管再合管使得RNA与RNA酶接触的机会增加, RNA降解风险增大.分管再合管后, 纯度指标OD260/OD230降低最显著, 说明样本存在碳水化合物(糖类)、盐类或有机溶剂污染.
3.4 晾干方式对总RNA质量的影响A组、C组和D组全血保存时间为一年, A组和C组第3次洗涤离心并弃去上清后, 将含有RNA沉淀和少量残留洗涤液的1.5 mL离心管以7500 g转速在4 ℃条件下继续离心2 min后, 用20 μL移液枪吸取管内残留液体, 将总RNA晾干.D组总RNA第3次洗涤离心并弃去上清后, 不再次离心并吸取少量残留液体, 使总RNA自然晾干.D组样本的RIN值和28S/18S分别为3.76±1.43和0.28±0.15, 均低于A组和C组(p < 0.001), 图 1中D组样本观察不到清晰的28S和18S条带, 图 2中D组样本无突出的28S和18S峰, 降解的杂峰增多, 表明分管提取和自然晾干这两个过程使得RNA降解非常严重.由于RNA发生降解, 降解的核酸片段对OD260值有贡献, OD260吸收值升高, 基于OD260计算的总RNA浓度会增高, 因此, 观察到D组样本的总RNA产率略高于C组.
4 讨论(Discussion)RNA保存和提取过程受多种因素的影响, 以往研究中, 若不能尽快进行RNA提取, 研究人员需将采集到的全血直接冻存于低温冰箱中, 以减缓RNA的降解(Liu et al., 2015).Kim等(2014)通过TRI试剂盒、PAXgene试剂盒和NucleoSpin试剂盒对直接冻存于-80 ℃冰箱5年的全血样本进行总RNA提取, 3种方法提取出总RNA的RIN值分别为3.2±0.8、6.0±1.1和6.4±0.9, 结果表明, 直接将全血长期冻存于低温冰箱中, 提取出的总RNA降解非常严重.Debey-Pascher等(2011)评估了不同保存方式对于基因表达谱的影响, 发现低温保存的外周血单核细胞与新鲜外周血单核细胞提取出的RNA的基因表达谱有显著差异, 且低温保存的外周血单核细胞基因表达谱随着保存时间的延长而发生显著变化, 而低温冻存前加入RNA保护剂后, 保存时间对全血样本的基因表达谱的稳定性没有显著影响.由此可见, 若要实现全血样本的长期保存, 需要在低温冻存前加入RNA保护剂.随着含有RNA保护剂的血液采集系统及与之配套的RNA提取试剂盒的出现, 从血液中提取出的RNA的质量得到了显著提高, 但这些试剂价格非常昂贵(Thach et al., 2003), 在有大量样本分析需求的环境流行病学研究中难以推广.而TRIzol试剂既可以当作RNA的释放剂又可以当作RNA的保护剂(Ma et al., 2010), 并且价格相对低廉.本研究尝试将少量新鲜全血与10倍体积TRIzol试剂混合后保存于-80 ℃冰箱, 再针对全血-TRIzol混合体系进行全血总RNA提取, 从而实现了以低成本长期保存用于提取RNA的全血样本.
全血中RNA含量极少, TRIzol一步法一般需要从全血中先分离出有核细胞, 操作较为繁琐且会损失部分白细胞, 使得此方法提取出的总RNA产率较低且对样本的需求量较大, 通常需要2.5 mL以上的全血以获得满足下游分析需要的足量RNA(于柏峰等, 2010).Liu等(2015)探究了不同全血前处理方式对RNA质量的影响, 采血后离心去除血浆再加入红细胞裂解液得到白细胞, 或直接在全血中加入红细胞裂解液后得到白细胞, 经TRIzol一步法提取白细胞中RNA的产率分别为(3.50±0.32) μg·mL-1和(3.29±0.30) μg·mL-1.Khymenets等(2005)从全血中先分离出白细胞、外周血单核细胞, 通过Ultraspec法、QIAamp试剂盒、Ribo-Pure试剂盒提取出总RNA产率均值介于1.54~5.89 μg·mL-1之间.以往研究中提取出总RNA的产率远低于本方法提取出总RNA的产率, 说明本方法有助于实现少量全血直接提取足量的总RNA用于下游分析, 且前处理过程简化了操作步骤, 可以减少环境流行病学研究中的采样工作量.
多数研究采血后对全血进行分装, 在不含RNA酶的1.5 mL离心管中进行总RNA提取(Kim et al., 2007;吴苗等, 2016).穆龙龙等(2010)利用TRIzol一步法从0.2 mL全血中提取总RNA, 不同组别的纯度指标OD260/OD280均较低, 存在一定的污染.Palmirotta等(2012)使用MagNA、Qiagen和Trizol LS法提取0.2 mL外周血单核细胞中的RNA, 3种方法提取RNA的OD260/OD230指标均低于2.0, 其中, Trizol LS法提取出的RNA污染最为严重, OD260/OD230约为0.5.本研究探索了不同的提取参数对RNA质量的影响, 全血未经过分管提取再合管, 减少了操作步骤和时间, 也避免因分管引入导致总RNA降解的风险因素, 同时, 洗涤离心弃去上清液后, 增加离心并吸取少量残留液体这一步骤, 缩短总RNA晾干时间, 降低了总RNA与环境中RNA酶接触发生降解的可能性, 使提取出的总RNA完整性高.此外, 在较大的操作空间(不含RNA酶的15 mL离心管)中进行提取, 增加洗涤液量和洗涤次数, 进一步使总RNA的完整性和纯度全面提高.
5 结论(Conclusions)本研究为需要快速收集大量生物样本且需要长期保存后再进行分析的环境流行病学研究提供了简便有效的样品保存与较高质量总RNA提取策略.
1) 将环境流行病学研究中采集到的少量新鲜全血立即与10倍体积的TRIzol试剂混匀并保存于-80 ℃冰箱, 可简化前处理步骤, 减少采样工作量, 实现以低成本长期保存全血.
2) 本研究建立了针对长期保存的全血-TRIzol混合体系的总RNA提取方法, 通过增大操作空间, 改进晾干操作, 使提取出总RNA的产率、完整性及纯度指标满足下游实验对样本质量的要求.
参考文献
| Asare A L, Kolchinsky S A, Gao Z, et al. 2008. Differential gene expression profiles are dependent upon method of peripheral blood collection and RNA isolation[J]. BMC Genomics, 9: 474. DOI:10.1186/1471-2164-9-474 |
| Batista P J, Chang H Y. 2013. Long noncoding RNAs: cellular address codes in development and disease[J]. Cell, 152(6): 1298-1307. DOI:10.1016/j.cell.2013.02.012 |
| Chen R, Li H, Cai J, et al. 2018. Fine particulate air pollution and the expression of microRNAs and circulating cytokines relevant to inflammation, coagulation, and vasoconstriction[J]. Environmental Health Perspectives, 126(1): 017007. DOI:10.1289/EHP1447 |
| Chomczynski P, Sacchi N. 2006. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction:twenty-something years on[J]. Nature Protocols, 1(2): 581-585. DOI:10.1038/nprot.2006.83 |
| Chu J H, Hart J E, Chhabra D, et al. 2016. Gene expression network analyses in response to air pollution exposures in the trucking industry[J]. Environmental Health. DOI:10.1186/s12940-016-0187-z |
| Debey-Pascher S, Hofmann A, Kreusch F, et al. 2011. RNA-stabilized whole blood samples but not peripheral blood mononuclear cells can be stored for prolonged time periods prior to transcriptome analysis[J]. The Journal of Molecular Diagnostics, 13(4): 452-460. |
| Debey S, Schoenbeck U, Hellmich M, et al. 2004. Comparison of different isolation techniques prior gene expression profiling of blood derived cells:impact on physiological responses, on overall expression and the role of different cell types[J]. The Pharmacogenomics Journal, 4(3): 193-207. |
| Ezzati M, Lopez A D, Rogers A, et al.2003.Comparative Quantification of Health Risks: Global and Regional Burden of Disease Attributable to Selected Major Risk Factors[M].Geneva: World Health Organization.1378-1380 |
| Ezzie M E, Crawford M, Cho J H, et al. 2012. Gene expression networks in COPD:microRNA and mRNA regulation[J]. Thorax, 67(2): 122-131. |
| Gaarz A, Debey-Pascher S, Classen S, et al. 2010. Bead array-based microRNA expression profiling of peripheral blood and the impact of different RNA isolation approaches[J]. The Journal of Molecular Diagnostics, 12(3): 335-344. |
| Gruzieva O, Merid S K, Gref A, et al. 2017. Exposure to traffic-related air pollution and serum inflammatory cytokines in children[J]. Environmental Health Perspectives, 125(6): 067007. DOI:10.1289/EHP460 |
| Han Y Q, Zhu T. 2015. Health effects of fine particles (PM2.5) in ambient air[J]. Science China:Life sciences, 58(6): 624-626. DOI:10.1007/s11427-015-4878-4 |
| Hebels D G, Georgiadis P, Keun H C, et al. 2013. Performance in omics analyses of blood samples in long-term storage:opportunities for the exploitation of existing biobanks in environmental health research[J]. Environmental Health Perspectives, 121(4): 480-487. DOI:10.1289/ehp.1205657 |
| Jiang Z, Uboh C E, Chen J, et al. 2013. Isolation of RNA from equine peripheral blood cells:Comparison of methods[J]. SpringerPlus. DOI:10.1186/2193-1801-2-478 |
| Khymenets O, Ortu?o J, Fitó M, et al. 2005. Evaluation of RNA isolation procedures from human blood and its application for gene expression studies (Sod-1, Sod-2)[J]. Analytical Biochemistry, 347(1): 156-158. |
| Kim J H, Jin H O, Park J A, et al. 2014. Comparison of three different kits for extraction of high-quality RNA from frozen blood[J]. SpringerPlus. DOI:10.1186/2193-1801-3-76 |
| Kim S J, Dix D J, Thompson K E, et al. 2007. Effects of storage, RNA extraction, genechip type, and donor sex on gene expression profiling of human whole blood[J]. Clinical Chemistry, 53(6): 1038-1045. |
| Landrigan P J, Fuller R, Acosta N J R, et al. 2018. The Lancet Commission on pollution and health[J]. The Lancet, 391(10119): 462-512. DOI:10.1016/S0140-6736(17)32345-0 |
| Liu C C, Jewett M C, Chin J W, et al. 2018. Toward an orthogonal central dogma[J]. Nature Chemical Biology, 14(2): 103-106. DOI:10.1038/nchembio.2554 |
| Liu X, Li Q, Wang X, et al. 2015. Comparison of six different pretreatment methods for blood RNA extraction[J]. Biopreservation and Biobanking, 13(1): 56-60. DOI:10.1089/bio.2014.0090 |
| Ma W, Wang M, Wang Z Q, et al. 2010. Effect of long-term storage in TRIzol on microarray-based gene expression profiling[J]. Cancer Epidemiology Biomarkers & Prevention, 19(10): 2445-2452. |
| Minshall E M, Leung D Y M, Martin R J, et al. 1997. Eosinophil-associated TGF-β1 mRNA expression and airways fibrosis in bronchial asthma[J]. American Journal of Respiratory Cell and Molecular Biology, 17(3): 326-333. DOI:10.1165/ajrcmb.17.3.2733 |
| 穆龙龙, 赵志英, 朱立. 2010. 全血标本保存条件对人总RNA提取效率的影响[J]. 北京医学, 32(10): 837-840. |
| Palmirotta R, De Marchis M L, Ludovici G, et al. 2012. Impact of preanalytical handling and timing for peripheral blood mononuclear cells isolation and RNA studies:the experience of the Interinstitutional Multidisciplinary BioBank (BioBIM)[J]. The International Journal of Biological Markers, 27(2): 90-98. DOI:10.5301/JBM.2012.9235 |
| Schmitz S U, Grote P, Herrmann B G, et al. 2016. Mechanisms of long noncoding RNA function in development and disease[J]. Cellular and Molecular Life Sciences, 73(13): 2491-2509. DOI:10.1007/s00018-016-2174-5 |
| Schroeder A, Mueller O, Stocker S, et al. 2006. The RIN:an RNA integrity number for assigning integrity values to RNA measurements[J]. BMC Molecular Biology. DOI:10.1186/1471-2199-7-3 |
| Schwochow D, Serieys L E K, Wayne R K, et al. 2012. Efficient recovery of whole blood RNA-a comparison of commercial RNA extraction protocols for high-throughput applications in wildlife species[J]. BMC Biotechnology. DOI:10.1186/1472-6750-12-33 |
| Sim?es A E, Pereira D M, Amaral J D, et al. 2013. Efficient recovery of proteins from multiple source samples after trizol or trizol LS RNA extraction and long-term storage[J]. BMC Genomics. DOI:10.1186/1471-2164-14-181 |
| Thach D C, Lin B, Walter E, et al. 2003. Assessment of two methods for handling blood in collection tubes with RNA stabilizing agent for surveillance of gene expression profiles with high density microarrays[J]. Journal of Immunological Methods, 283(1/2): 269-279. |
| Van Dyck C J, Timmermans J P, Fransen E, et al. 2013. Isolation of high-quality RNA from stented blood vessels[J]. Microvascular Research, 89: 161-163. DOI:10.1016/j.mvr.2013.06.001 |
| Vrijens K, Winckelmans E, Tsamou M, et al. 2017. Sex-specific associations between particulate matter exposure and gene expression in independent discovery and validation cohorts of middle-aged men and women[J]. Environmental Health Perspectives, 125(4): 660-669. DOI:10.1289/EHP370 |
| Wang J, Robinson J F, Khan H M, et al. 2004. Optimizing RNA extraction yield from whole blood for microarray gene expression analysis[J]. Clinical Biochemistry, 37(9): 741-744. DOI:10.1016/j.clinbiochem.2004.03.013 |
| Wang Y W, Han Y Q, Zhu T, et al. 2018. A prospective study (SCOPE) comparing the cardiometabolic and respiratory effects of air pollution exposure on healthy and pre-diabetic individuals[J]. Science China:Life sciences, 61(1): 46-56. DOI:10.1007/s11427-017-9074-2 |
| 吴苗, 闫林, 张红梅. 2016. 萃取和保存条件对人外周血细胞RNA提取效果的影响[J]. 环境与健康杂志, 33(3): 249-251. |
| 于柏峰, 刘玲丽. 2010. 少量外周血提取RNA方法的研究[J]. 中国热带医学, 10(10): 1226. |
| Zhang J, Mauzerall D L, Zhu T, et al. 2010. Environmental health in China:Progress towards clean air and safe water[J]. The Lancet, 375(9720): 1110-1119. DOI:10.1016/S0140-6736(10)60062-1 |
| 张义, 邹雄, 单宁宁. 2004. 介绍一种外周血单个核细胞RNA提取方法[J]. 临床检验杂志, 22(1): 71. |
