 , 冯鑫1,2, 单捷1,2, 潘杨1,2,3
, 冯鑫1,2, 单捷1,2, 潘杨1,2,3

1. 苏州科技大学环境科学与工程学院, 苏州 215009;
2. 苏州科技大学环境生物技术研究所, 苏州 215009;
3. 江苏省环境科学与工程重点实验室, 苏州 215009
收稿日期: 2019-03-26; 修回日期: 2019-04-22; 录用日期: 2019-04-22
基金项目: 国家自然科学基金(No.51778390);国家重点研发计划项目(No.2016YFC0401108);江苏省自然科学基金(No.BK20171219)
作者简介: 章豪(1994—), 男, E-mail:1442273765@qq.com
通讯作者(责任作者): 潘杨, E-mail:panyang@mail.usts.edu.cn
摘要: 在同步去除及富集磷酸盐的基础上,通过研究水力停留时间(8 h、6 h、4 h)及不同的进水磷浓度考察磷负荷对于反应器的运行效能和微生物群落结构的影响,探究生物膜反应器所能承受的最大磷负荷,并探究微生物种群与工艺性能的响应关系,获取高效生物膜驯化的最优进水磷条件,以及分析该条件下的种群结构.结果表明,在驯化阶段,在磷负荷低于0.18 kg·m-3·d-1时,磷负荷的提升不会影响磷去除率,磷去除率保持在98.3%;当磷负荷达到0.24 kg·m-3·d-1时,磷去除率下降到84.3%,但Prel/Cupt依旧从最初的0.06上升至0.121.MiSeq测序结果表明优势菌门为变形菌门(Proteobacteria),从59.2%增长至83.5%,反应器中的优势聚磷菌科为红环菌科(Rhodocyclaceae),从11.8%增长至27.3%.在回收阶段,在保证好氧出水达标的情况下,磷酸盐浓度升高至56.4 mg·L-1,富集液浓度达到鸟粪石法回收磷的标准.通过增加进水磷负荷可使聚磷菌丰度提高,进而提高了回收液磷浓度.
关键词:生物膜磷负荷聚磷菌高通量测序
Microbial community analysis in a phosphorus biofilm reactor during enhanced phosphorus loading
ZHANG Hao1,2
 , FENG Xin1,2, SHAN Jie1,2, PAN Yang1,2,3
, FENG Xin1,2, SHAN Jie1,2, PAN Yang1,2,3

1. School of Environmental Science and Engineering, Suzhou University of Science and Technology, Suzhou 215009;
2. Environment Biotechnology Research Institute, Suzhou University of Science and Technology, Suzhou 215009;
3. Jiangsu Key Laboratory of Environment Science and Engineering, Suzhou 215009
Received 26 March 2019; received in revised from 22 April 2019; accepted 22 April 2019
Abstract: On the basis of simultaneous removal and enrichment of phosphate,this experiment investigated the operational efficacy of the reactor and the microbial community structure under different hydraulic retention time (8 h,6 h,4 h) and influent phosphorus concentrations,to explore the maximum phosphorus load that a biofilm reactor can withstand and the response of microbial populations to different conditions for efficient biofilm domestication. The results show that during the acclimation stage,with the phosphorus load increase within 0.18 kg·m-3·d-1,the phosphorus removal rate remained at 98.3%,suggesting that the increase of phosphorus load did not affect the phosphorus removal rate. On the contrary,the phosphorus removal dropped to 84.3%,but the Prel/Cupt still rose from 0.06 to 0.121 under the conditions of the phosphorus load with 0.24 kg·m-3·d-1. MiSeq sequencing resluts show that the dominant phylum was Proteobacteria,which increased from 59.2% to 83.5%. The dominant polyphosphate family in the reactor was Rhodocyclaceae,which increased from 11.8% to 27.3%. In the recovery stage,the phosphorus-rich concentrate is raised to 56.4 mg·L-1,and the concentration of the recovered liquid reaches the standard for recovering phosphorus by the struvite method,ensuring that the aerobic effluent reaches the standard. when increasing the influent phosphorus load,the population abundance of the polyphosphate bacteria increased,then increasing the phosphorus concentration of the recovered liquid.
Keywords: biofilmphosphorus loadPAOsMiseq high-throughput sequencing
1 引言(Introduction)磷是一种重要的资源, 同时具有污染性和稀缺性的双重特性(Desmidt et al., 2015).从污水中回收有机物和磷源有利于资源的持续循环, 实现社会生态友好发展(Mayer et al., 2016).这表示在未来城市污水处理厂将对有机物及磷源进行回收(Li et al., 2015).因此, 本课题组构建了未来城市污水处理厂的模式之一:有机物回收、磷回收, 而后采用低能耗的脱氮工艺进行氮去除, 例如厌氧氨氧化工艺(Lotti et al., 2014).目前, 在回收磷工艺中, 强化生物除磷系统(Enhanced Biological Phosphorus Removal, EBPR)是基于悬浮式活性污泥法, 通过测流磷工艺从剩余污泥中回收磷, 但需要大量有机物, 远不能达到回收有机物的目标, 且悬浮式活性污泥法具有剩余污泥多、污泥膨胀等缺点.而附着生长系统需要较少的有机物(Wong et al., 2018), 且剩余污泥较少, 更重要的是它世代期长, 系统中的生物相较活性污泥法更为丰富, 聚磷菌可以有效地富集在生物膜上.在此前提下, 本课题组采用聚磷生物膜法直接在主流工艺中同步去除及富集磷酸盐, 且在前期研究中证实了此工艺的可行性(郑莹等, 2017;孟璇等, 2018).在EBPR工艺中, 最大磷负荷是反应该系统所能承载的运行能力(Sudiana et al., 1999).也有研究表明, 磷负荷对除磷效果及聚磷菌有较大的影响, 这就意味着磷负荷必然是聚磷生物膜反应器运行效能优化的关键调控因子.具有高进水磷负荷的长期培养抑制了聚磷菌(phosphorus accumulating organisms, PAOs)的增殖(Hsu et al., 2013), 并富集了聚糖菌(glycogen accumulating organisms, GAOs), 而文献表明较高进水磷浓度有利于聚磷菌的生长(Liu et al., 1997), 这存在着较大的矛盾, 值得进一步研究.
本研究以尼龙填料作为生物膜载体构成聚磷生物膜反应器, 在主流工艺中进行磷去除及回收实验.采用合成废水, 在驯化阶段磷负荷提升过程中, 考察高磷负荷对生物除磷系统的影响, 探究磷负荷提升与COD消耗之间的量化联系, 综合分析聚磷生物膜培养驯化的最佳磷负荷条件以及分析该条件下的微生物种群结构, 为聚磷生物膜培养驯化创造条件, 为未来污水处理厂的构建及运行提供技术支撑.通过MiSeq高通量测序技术探究微生物种群特性及群落变化, 并利用canoco5分析微生物种群与水质之间的相关性.
2 材料与方法(Materials and methods)2.1 反应器装置实验装置如图 1所示, 系统由一个6 L的反应容器i, 2串尼龙填料、一个30 L好氧进水容器a和一个30 L的厌氧富集罐e组成.在好氧阶段进行空压机曝气, 促进有氧环境, 在好/厌阶段进行搅拌使水质均匀, 所有装置的开闭由计时器控制.驯化阶段:好氧阶段, 打开阀b, 综合废水在重力作用下从好氧罐流入反应器i, 空压机d曝气, 打开搅拌机h使水质均匀, 实际进水为5 L后, 关闭阀b, 待好氧阶段结束后, 关闭空压机d, 打开阀j, 废水在重力作用下排出.在好氧阶段结束时, 系统切换到厌氧阶段, 通过泵f将厌氧进水泵入反应器i中, 待厌氧阶段结束后, 打开阀j, 废水在重力作用下排出.富集阶段:好氧阶段如驯化阶段, 在厌氧过程中, 通过泵f将厌氧进水泵入反应器i中, 同时将厌氧基质罐l中的碳源通过泵k泵入反应器i中, 反应器的厌氧出水经重力作用流回厌氧富集罐, 通过好氧厌氧重复交替操作, PAOs在生物膜反应器中被富集, 且厌氧富集罐中的磷酸盐浓度也越来越高.
图 1(Fig. 1)
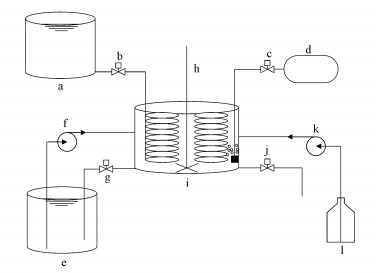 |
| 图 1 实验装置示意 (a.好氧罐;b、c、g、j.调节阀;d.曝气装置;e.厌氧富集罐;f、k.泵;i.反应罐;h.搅拌机;l.厌氧基质) Fig. 1Experimental device |
2.2 进水和运行条件2.2.1 进水条件好、厌氧进水为合成废水, 采用无水乙酸钠作为碳源.合成废水指标:好氧进水为200 mg·L-1COD、15 mg·L-1 PO43--P、40 mg·L-1NH4+-N、少量CaCl2·2H2O、MgSO4·7H2O、EDTA·2Na和微量元素;厌氧进水为200 mg·L-1COD、40 mg·L-1NH4+-N、少量CaCl2·2H2O、MgSO4·7H2O、EDTA·2Na和微量元素(Liu et al., 1997).回收阶段模拟城市生活污水, 进水磷浓度为5 mg·L-1, 调节pH至7.5±0.3.
2.2.2 运行时间和条件反应器厌氧和好氧交替运行, 驯化过程主要分为5个阶段(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ), 好氧进水磷负荷分别为0.09、0.12、0.18、0.24、0.06 kg·m-3·d-1, Ⅰ、Ⅱ段水力停留时间分别为8 h(好氧4 h+厌氧4 h)、6 h(好氧3 h+厌氧3 h), Ⅲ、Ⅳ、Ⅴ段水力停留时间为4 h(好氧2 h+厌氧2 h), 在Ⅴ阶段进行磷富集回收实验.反应器进水流量500 mL·min-1, 进水时间约10 min.同时, 在厌氧/好氧段均打开搅拌机使废水均匀混合.好氧阶段的溶解氧控制在(3±0.5) mg·L-1.通过水浴加热使温度控制在20 ℃.
2.3 分析方法2.3.1 取样计划与常规监测项目本研究中所有进水或出水水样取自反应器样品进水及出水口, 并在厌氧/好氧阶段取进水及出水.反应器液面保持在填料上表面0.1 m.水质监测指标有:COD、PO43--P、NH4+-N均采用标准方法测定;DO采用Inlab OXI7300溶氧仪测定;pH采用Inlab OXI7300 pH计测定, ORP采用HQ14D ORP测定仪.
2.3.2 MiSeq高通量测序分析方法本实验使用样品均来自尼龙生物膜反应器.污泥取样时间点为系统运行的第0、27、37、47、63 d的厌氧段污泥, 置于离心管中, 经离心机14000 g离心5 min, 去除上清液, 将污泥置于- 80 ℃保存.采用试剂盒(Fast DNA Spin kit for soil, MP, USA)对污泥进行DNA提取.提取后的DNA通过Nanodrop Spectrophotometer ND-1000 (Thermo Fisher Scientic, USA)测量核酸浓度及纯度, 而后通过1%的琼脂糖凝胶电泳检测.
而其中PCR扩增采用细菌的16S V3~V4区通用引物, PCR体系采用25 μL的反应体系, 包括2.5 μL 10×Buffer、2 μL dNTP、2 μL DNA模板、引物各0.5 μL(10 μmmol·L-1)、0.5 μL Taq酶和17 μL无菌水.PCR扩增采用94 ℃预变性5 min;94 ℃变性30 s, 低温退火54 ℃ 30 s, 72 ℃ 1 min, 共35个循环, 72 ℃延伸10 min, 形成扩增产物, 扩增产物通过2%琼脂糖凝胶电泳检测.将DNA样品置于-20 ℃冷冻保存, 而后将DNA样品送出, 采用Illumina MiSeq测序仪进行PE 300测序.
2.3.3 数据分析常规数据及绘图处理采用origin2017软件, 微生物群落结构与水质的相关性采用Canoco5进行分析.
3 结果与讨论(Results and discussion)3.1 磷负荷提升对反应器的运行效能的影响3.1.1 磷负荷提升对磷去除率的影响首先当进水磷浓度为15 mg·L-1时, 通过逐渐缩短HRT考察氮负荷对反应器磷去除效率的影响.结果如图 2a所示, 在驯化阶段, 反应器运行20 d后性能较稳定, 在1~32 d, 磷酸盐负荷为0.09 kg·m-3·d-1, 磷去除率达到99.06%;在33~42 d, 增加进水磷酸盐负荷至0.12 kg·m-3·d-1, 磷酸盐负荷的提升并没有对磷去除率产生显著影响, 且出水磷酸盐浓度在此过程中均保持在较低水平.为了进一步提高反应器负荷, 在43~47 d, 将进水磷负荷提升至0.18 kg·m-3·d-1, 此阶段磷去除率依旧保持在98.3%, 出水磷酸盐浓度均在0.5 mg·L-1以下.为了探讨本聚磷生物膜反应器所能承受的最大磷负荷, 在停留时间不变的情况下, 在48~63 d时, 增加进水中的磷酸盐浓度至20 mg·L-1, 磷去除率下降到84.3%, 好氧出水达到3.07 mg·L-1.在此工况下, 进水磷负荷的提升降低了磷去除率, 当进水磷负荷为0.24 kg·m-3·d-1时, 这表明微生物的磷积累代谢减弱, 高负荷进水磷浓度使得EBPR中聚磷菌活性受到抑制, 已经对聚磷生物膜效能造成较为明显的影响, 此负荷为反应器能接受的最大负荷.在好氧折流板反应器中, 当逐渐增加进水磷浓度至20 mg·L-1时, 磷去除效率保持在90%以上, 而当进水磷浓度提升至30和40 mg·L-1时, 磷去除效率分别下降至68%和33%(Kodera et al., 2013).在研究磷负荷对EBPR工艺的影响时, 描述了EBPR系统中的“磷限制”和“磷储存容量限制”情况.他们将EBPR系统中的“磷限制”描述为由于PAOs的过剩磷储存能力而具有额外的磷吸收潜力, 而“磷储存容量限制”是指PAOs不能吸收足够的磷来制造好氧阶段的出水低磷浓度.随着磷浓度的增加, 系统将保持在磷限制条件下, 直到PAOs达到最大磷储存能力(Yadav et al., 2016).在此之后, EBPR系统无法吸收过量的磷, 导致出水不达标.从除磷效率看, 磷去除率在一定进水磷浓度范围内能保持稳定, 而当超过限值后, 磷去除率会下降.
图 2(Fig. 2)
 |
| 图 2 好氧阶段(a)和厌氧阶段(b)常规数据监测 Fig. 2The performance of aerobic phase(a) and anaerobic phase(b) |
在65~85 d时, 经过63 d的驯化培养, 开展磷回收研究.合成废水模拟城市生活污水作为进水, 好氧段磷浓度为5 mg·L-1, 厌氧段条件不变, 厌氧出水作为下阶段的厌氧进水重复回收利用.回收初期, 好氧阶段磷去除率显著下降至16.7%, 好氧出水磷浓度上升至4.125 mg·L-1, 而厌氧出水磷浓度一直上升, 在65~75 d时回收液浓度由0 mg·L-1上升至50 mg·L-1左右, 经过8 d左右的适应, 好氧出水磷浓度稳定在0.5 mg·L-1左右, 磷去除率达到93.7%.厌氧回收液浓度缓慢上升, 达到56.4 mg·L-1, 此时回收液磷浓度已经达到瓶颈, 如图 2b所示, 但回收液浓度达到鸟粪石法回收磷的标准(P浓度>50 mg·L-1)(Artan et al., 2002).在好氧阶段生物膜能吸收磷储存到细胞内, 而在厌氧阶段会将体内的磷释放, 如此好/厌氧交替后, 当回收液中磷浓度逐渐升高, 在厌氧阶段, 生物膜会受到高磷浓度溶液的胁迫, 磷的释放会受到抑制, 回收液中磷浓度也会达到瓶颈.
3.1.2 磷负荷提升对于Prel/Cupt的影响在厌氧段, 有机物通过微生物的发酵作用产生挥发性脂肪酸, 聚磷菌利用糖原和聚磷产生的能量将脂肪酸摄入, 转化为内贮物.在厌氧阶段, 需要外加碳源刺激聚磷菌体内磷的释放, 但是碳源的增加意味着大量的费用, 且文献表明反应器中的聚糖菌会摄取反应器中的碳源用于自身繁殖(Cornel et al., 2009), 这就意味着消耗的碳源不能全部用于包含P回收的工艺中, 所以在回收磷时应当提升Prel/Cupt的比值(每消耗单位COD释放的磷).在0~32 d时, Prel/Cupt比值从0.06上升到0.0994;在43~47 d时, 通过缩短停留时间至进水磷负荷为0.18 kg·m-3·d-1, Prel/Cupt比值上升至0.115;在48~63 d时, 通过增加磷浓度至进水磷负荷为0.24 kg·m-3·d-1, Prel/Cupt比值也上升到0.121.当65~85 d时, 降低进水磷负荷为0.06 kg·m-3·d-1, Prel/Cupt比值下降至0.0255, 如图 3所示.在磷负荷上升过程中, Prel/Cupt比值从0.06上升到0.121, 这就表明进水磷负荷提升促进Prel/Cupt比值的增加.有文献表明增加磷负荷能提高Prel/Cupt比值.当提升进水磷浓度从6 mg·L-1增长到14.4 mg·L-1的情况下, Prel/Cupt比值也从0.07上升到0.13(Choi et al., 2011).在回收过程中, 降低进水磷负荷时, Prel/Cupt比值也随之降低, 这也进一步说明了进水磷负荷提升促进Prel/Cupt比值的增加.但是这个比值是大大低于传统EBPR-r反应器中报道的的Prel/Cupt典型值0.50~0.75(Panswad et al., 2007;Filipe et al., 2010), 可能是因为反应器中含有较多的聚糖菌, 消耗了大部分碳源, 导致Prel/Cupt比值偏低, 而Sphingomonadaceae为反应器中的聚糖菌, 在初始阶段, 其含量为2.5%, 如图 4所示.在好氧阶段, 聚磷菌有蓄磷的行为, 当微生物体中的蓄磷量越多, 可能会减少其与外界磷之间的释磷阻力, 增加厌氧阶段磷的释放量, 从而提高厌氧回收液中磷浓度及减少碳源的消耗.
图 3(Fig. 3)
 |
| 图 3 磷释放量与碳源吸收量曲线 Fig. 3Phosphorus release and carbon source absorption curve |
3.2 磷负荷提升过程中微生物群落的动态变化3.2.1 磷负荷提升过程中细菌丰度及多样性分析从表中可以得到, shannon指数、simpson指数、chao 1指数都随着进水磷负荷的增加整体呈逐渐降低趋势, shannon指数由6.84下降至5.22, simpson指数由0.98下降至0.94, chao 1指数由1240.91下降至689.75.结果显示, 在磷负荷提升过程中, 反应器中的微生物一直被筛选富集, 且微生物种群多样性随着磷负荷的提升逐渐减小, 反应器中的物种更均一化.
表 1(Table 1)
| 表 1 微生物多样性指标 Table 1 The diversity indices of bacterial community | ||||||||||||||||||||||||||||||
表 1 微生物多样性指标 Table 1 The diversity indices of bacterial community
| ||||||||||||||||||||||||||||||
3.2.2 磷负荷提升过程中细菌种群特性分析在厌/好氧交替条件下, 提升好氧进水磷浓度有利于聚磷菌的富集, 抑制其他普通异养菌和硝化菌的生长, 强化了聚磷生物膜的筛选机制.在门的水平上共测到25个门, 如图 4a所示, 排序为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、Ignavibacteriae门等.在磷负荷提升过程中, Proteobacteria占比由起始的59.2%增长至83.5%, 随后进入稳定期.Bacteroidetes由4.3%上升至10.3%, 放线菌门(Actinobacteria)由2.8%增长至7.3%, 其他门类都出现大幅度的下降.Chloroflexi由17.6%下降至2.5%, 而酸杆菌门(Acidobacteria)、Ignavibacteriae门、硝化螺旋菌门(Nitrospirae)分别下降了79%、76.9%、90%.Proteobacteria是常见的聚磷菌(假单胞菌、红环菌、不动杆菌、气单胞菌)所在的门类, 可能是在磷负荷提升过程中, 聚磷菌含量随之增加.文献表明Bacteroidetes具有非常强的营养物质代谢能力, 可以消耗碳源进行厌氧发酵(López-Vázquez et al., 2007), 这可能也是反应器中Prel/Cupt比值低于典型值的原因之一.硝化螺旋菌门和浮酶菌门是脱氮菌所在的门类, 由于磷负荷逐渐提高, 好氧周期逐渐缩短, 可能不满足于世代期较长的脱氮菌的生长, 导致两种菌门数量大幅度减小.
图 4(Fig. 4)
 |
| 图 4 门级别(a)和科级别(b)的微生物分布图 Fig. 4Distribution of bacterial community at phylum(a) and family(b) level |
为进一步阐明在磷负荷提升过程中优势功能菌及群落变化, 在科的水平上对相对丰度大于2%的微生物进行分析研究, 共检测到137科, 如图 4b所示, 排序为unclassified_γ-proteobacteria、红环菌科(Rhodocyclaceae)、unclassified_Proteobacteria、unclassified_Bacteroidetes、着色菌科(Chromatiaceae)、黄杆菌科(Flavobacteriaceae)、厌氧绳菌科(Anaerolineaceae)等.在磷负荷提升至0.18 kg·m-3·d-1过程中, 红环菌科(Rhodocyclaceae)由11.8%增长至27.3%, 而当磷负荷增加至0.24 kg·m-3·d-1时, 红环菌科含量下降至14%, 说明过高的进水磷负荷将抑制红环菌的生长.Rhodocyclaceae的除磷功能已经被证实.文献报道, 红环菌是强化生物除磷系统中的优势聚磷菌, 发挥着主要除磷作用(Zilles, 2002).根据该菌所占比例的变化以及本系统中的除磷效果推测, Rhodocyclaceae是本系统中的优势聚磷菌.同时, 文献表明黄单胞菌科(Xanthomonadaceae)为聚磷菌(Jorgensen et al., 1995), 其含量从0.25%增长至2.1%, 说明高进水磷负荷促进黄单胞菌科的生长.从以上可以得到, 进水磷负荷的提升有助于某些聚磷菌的生长.文献表明, 提升系统中的进水磷负荷可以促进生物除磷系统中聚磷菌的生长, 从而能有效地提高系统的稳定性(Sudiana, 1999;Schuler et al., 2003).在厌氧/好氧交替生物滤池进行磷回收实验, 在碳源为800 mg·L-1的条件下, 当进水磷浓度从10 mg·L-1增加到15 mg·L-1时, 通过测序得到聚磷菌的含量占98.03%(Tian et al., 2016), 采用强化除磷工艺在序批式SBR反应器中进行聚磷菌驯化实验, 当进水磷浓度从5 mg·L-1增加至10 mg·L-1的过程中, 通过FISH得到的聚磷菌含量从41%增加到89%(苗志加, 2013).而本实验中聚磷菌含量与苗志加及Tian有较大差别, 有文献表明在EBPR工艺中, 碳源及磷源浓度会影响聚磷菌的筛选富集(Yadav et al., 2016).可能本实验进水磷酸盐过高导致反应器中磷酸盐含量与Tian及苗志加不一致.Anaerolineaceae是专性厌氧菌, 可以在厌氧条件下可以氧化碳氢化合物供自身生长, 在系统给定的厌氧/好氧交替的环境下, 不适宜其增长, 数量由14.7%下降至1.2%.Sphingomonadaceae是一类聚糖菌, 在磷负荷提升过程中, 其含量从2.5%下降至0.5%, 说明磷负荷的提升抑制了Sphingomonadaceae的生长, 可能是磷负荷的提升刺激聚磷菌吸收碳源, 使得聚糖菌可利用的碳源变少, 抑制了聚糖菌的生长.在EBPR工艺中开展了关于聚磷菌与聚糖菌的研究, 发现当进水磷浓度较高时, PAOs能够积累大量的聚磷, 同时也具备了快速吸收乙酸的能力, 而GAOs则被淘汰(Liu et al., 1997).在序批式SBR反应器中进行聚磷菌驯化实验, 当进水磷浓度从5 mg·L-1增加至10 mg·L-1的过程中, 通过FISH分析得到聚糖菌的含量从39%下降至6%(苗志加等, 2013).其他菌科由于不能适应反应器运行环境, 数量均出现不同程度的下降, 而在反应器运行过程中聚磷菌一直被筛选富集.说明在磷负荷提升过程中, 微生物发生了筛选, 聚磷菌在厌/好氧交替环境下适应生长, 不断被富集, 不适应实验环境的微生物逐步被淘汰.
3.2.3 磷负荷提升过程中群落结构和水质的相关性分析在磷负荷提升过程中, 采用蒙特卡洛检验对水质进行检验, 最终筛选出具有显著差异的水质进行RDA分析, 解释在磷负荷影响作用下处于科级别的微生物种群与水质之间的相关性.结果如图 5所示, RDA1和RDA2分别可以代表 80.12%和17.83%的总差异, 从微生物种群与水质之间的夹角可以得到, 在磷负荷提升中, 好氧出水磷浓度与Rhodospirillaceae、Chromatiaceae、unclassified_Betaproteobacteria正相关, Prel/Cupt比值rolixibacteraceae、Xanthomnadaceae、unclassified_Proteobacteria正相关, 厌氧出水磷浓度与unclassified_Gammaproteobacteria正相关, Cupt与Flavobacteriaceae、Rhodocyclaceae正相关.磷负荷提升过程中, 驯化出不同的微生物群落, 对出水水质产生了较大影响.文献表明, Flavobacteriaceae是一类有机化能菌, 能利用有机物进行自身繁殖(Hollender et al., 2002).从以上可以得到, 好氧出水磷浓度、Prel/Cupt和厌氧出水磷浓度分别与未被分类的β-变形杆菌、变形杆菌、γ-变形杆菌正相关, 这表明在本实验系统中存在未被分类的属于变形菌的与磷去除有关的细菌, 这将是本课题组下一步深入研究的重点.
图 5(Fig. 5)
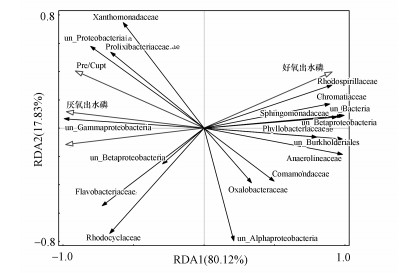 |
| 图 5 RDA分析微生物群落与水质的关系(Prel/Cupt:磷释放量与碳源吸收量之比;Cupt:碳源吸收量) Fig. 5RDA analysis of microbial community and water quality |
4 结论(Conclusions)1) 在磷负荷提升过程中, 当进水磷负荷低于0.18 kg·m-3·d-1时, 磷负荷的提升对磷去除率没有较大的影响, 磷去除率保持在98.3%;当磷负荷过高达到0.24 kg·m-3·d-1时, 磷负荷的提升会抑制磷去除率, 磷去除率下降到84.3%.
2) 好氧进水磷负荷的提升有利于Prel/Cupt的增长.在磷负荷从0.09 kg·m-3·d-1提升至0.24 kg·m-3·d-1时, 实现了Prel/Cupt比值0.06~0.121的2倍增长, 进水磷负荷的增加能更有效地在进行磷富集的同时节约碳源.
3) 好氧进水磷浓度的提升有利于聚磷菌的富集, 抑制其他普通异养菌和硝化菌的生长, 强化了聚磷生物膜的筛选机制.测序结果表明在门水平上, 本系统中优势菌为变形菌门(Proteobacteria), 其含量从59.2%增长至83.5%;在科水平上, 红环菌科(Rhodocyclaceae)是反应器中的优势聚磷菌, 其含量从11.8%增长至27.3%.测序及RDA分析表明, 在变形菌门中, 本系统中存在未被分类与磷去除有关的细菌.
4) 综合分析磷负荷提升过程中各阶段的运行效能及微生物群落, 在保证好氧出水达标的情况下, 进水磷负荷为0.18 kg·m-3·d-1是驯化生物膜最佳条件.
参考文献
| Artan N, Wilderer P, Orhon D, et al. 2002. Model evaluation and optimisation of nutrient removal potential for sequencing batch reactors[J]. Water Sa, 28(4): 423–432. |
| Choi H J, Lee H, Lee S M. 2011. Effect of phosphorus concentration on phosphorus removal and biomass[J]. Water Science and Technology, 64(4): 887–891.DOI:10.2166/wst.2011.656 |
| Cornel P, Schaum C. 2009. Phosphorus recovery from wastewater: Needs, technologies and costs[J]. Water Science and Technology, 59(6): 1069–1076.DOI:10.2166/wst.2009.045 |
| Desmidt E, Ghyselbrecht K, Zhang Y, et al. 2015. Global phosphorus scarcity and full-scale p-recovery techniques: A review[J]. Biocontrol Science and Technology, 45(4): 336–384. |
| Filipe C D, Daigger G T, Jr G C. 2010. A metabolic model for acetate uptake under anaerobic conditions by glycogen accumulating organisms: Stoichiometry, kinetics, and the effect of pH[J]. Biotechnology and Bioengineering, 76(1): 17–31. |
| Hollender J, Dreyer U, Kornberger L, et al. 2002. Selective enrichment and characterization of a phosphorus-removing bacterial consortium from activated sludge[J]. Applied Microbiology and Biotechnology, 58(1): 106–111. |
| Hsu C, Chang W, Chen J, et al. 2013. Comparing the long-term effect of high P/COD influent on enhancement of phosphate-accumulating organisms between acetate- and propionate-fed reactors[J]. Journal of Chemical Technology and Biotechnology, 88: 1071–1079.DOI:10.1002/jctb.3942 |
| Jorgensen K S, Pauli S L. 1995. Polyphosphate accumulation among denitrifying bacteria in activated sludge[J]. Anaerobe, 1(3): 161–168.DOI:10.1006/anae.1995.1014 |
| Kodera H, Hatamoto M, Abe K, et al. 2013. Phosphate recovery as concentrated solution from treated wastewater by a PAO-enriched biofilm reactor[J]. Water Research, 47(6): 2025–2032.DOI:10.1016/j.watres.2013.01.027 |
| Liu W T, Nakamura K, Matsuo T, et al. 1997. Internal energy-based competition between polyphosphate- and glycogen-accumulating bacteria in biological phosphorus removal reactors-effect of P /C feeding ratio[J]. Water Research, 31(6): 1430–1438.DOI:10.1016/S0043-1354(96)00352-1 |
| Li W W, Yu H Q, Rittmann B E. 2015. Chemistry: Reuse water pollutants[J]. Nature, 528(7580): 29–31.DOI:10.1038/528029a |
| López-Vázquez C M, Hooijmans C M, Brdjanovic D, et al. 2007. A practical method for quantification of phosphorus- and glycogen-accumulating organism populations in activated sludge systems[J]. Water Environment Research, 79(13): 2487–2498.DOI:10.2175/106143007X220798 |
| Lotti T, Kleerebezem R, Van E T K C, et al. 2014. Anammox growth on pretreated municipal wastewater[J]. Environmental Science and Technology, 48(14): 7874.DOI:10.1021/es500632k |
| Mayer B K, Baker L A, Boyer T H, et al. 2016. Total value of phosphorus recovery[J]. Biocontrol Science and Technology, 50(13): 6606–6620. |
| 孟璇, 潘杨, 章豪, 等. 2018. 同步去除并富集磷酸盐生物膜驯化过程中微生物种群分析[J]. 环境科学, 2018, 39(6): 2803–2809. |
| 苗志加, 彭永臻, 王淦, 等. 2013. 强化生物除磷工艺富集聚磷菌及其微生物菌群分析[J]. 北京工业大学学报, 2013, 39(5): 742–748. |
| Oxmann J F, Pham A Q H A A B R J L. 2010. Quantification of individual phosphorus species in sediment: A sequential conversion and extraction method[J]. European Journal of Soil Science, 59(6): 1177–1190. |
| Panswad T, Tongkhammak N, Anotai J. 2007. Estimation of intracellular phosphorus content of phosphorus-accumulating organisms at different P:COD feeding ratios[J]. Journal of Environmental Management, 84(2): 141–145.DOI:10.1016/j.jenvman.2006.05.013 |
| Schuler A J, Jenkins D. 2003. Enhanced biological phosphorus removal from wastewater by biomass with different phosphorus contents, Part Ⅰ: Experimental results and comparison with metabolic models[J]. Water Environment Research, 75(6): 485–498.DOI:10.2175/106143003X141286 |
| Sudiana I M, Mino T, Sat oh H, et al. 1999. Metabolism of enhanced biological phosphorus removal and non-enhanced biological phosphorus removal sludge with acetate and glucose as carbon source[J]. Water Science & Technology, 39(6): 29–35. |
| Tian Q, Ong S K, Xie X, et al. 2016. Enhanced phosphorus recovery and biofilm microbial community changes in an alternating anaerobic/aerobic biofilter[J]. Chemosphere, 144: 1797–1806.DOI:10.1016/j.chemosphere.2015.10.072 |
| Wong P Y, Cheng K Y, Bal Krishna K C, et al. 2018. Improvement of carbon usage for phosphorus recovery in EBPR-r and the shift in microbial community[J]. Journal of Environmental Management, 218: 569–578.DOI:10.1016/j.jenvman.2018.03.130 |
| Yadav D, Pruthi V, Kumar P. 2016. Influence of varying COD and total phosphorus loading on EBPR performed in aerobic baffled reactor using dried powdered sludge[J]. Journal of Environmental Chemical Engineering, 4(3): 3580–3592.DOI:10.1016/j.jece.2016.08.002 |
| 郑莹, 潘杨, 周晓华, 等. 2017. 一种新型生物膜法除磷工艺中聚磷菌的富集培养过程[J]. 环境科学, 2017, 38(1): 276–282. |
| Zilles J L, Hung C H, Noguera D R. 2002. Presence of Rhodocyclus in a full-scale wastewater treatment plant and their participation in enhanced biological phosphorus removal[J]. Water Science and Technology, 46(1/2): 123–128. |
