 , 王旭1, 王瑾丰1, 丁丽丽1,2
, 王旭1, 王瑾丰1, 丁丽丽1,2
 , 任洪强1,2
, 任洪强1,2

1. 南京大学环境学院, 污染控制与资源化研究国家重点实验室, 南京 210023;
2. 南京大学宜兴环保研究院, 宜兴 214200
收稿日期: 2019-06-28; 修回日期: 2019-08-20; 录用日期: 2019-08-20
基金项目: 国家科技支撑计划课题(No.2014BAC08B04)
作者简介: 朱颖楠(1997—), 女, E-mail:yingnan_zhu@163.com
通讯作者(责任作者): 丁丽丽, E-mail:dinglili@nju.edu.cn
任洪强, E-mail:hqren@nju.edu.cn
摘要: 重点研究了外源添加高AHLs调控能力的群体感应-异养硝化好氧反硝化菌(QS-HNAD)过程中生物膜反应器的运行、生物膜生理生化特征、信号分子浓度、脱氮功能基因含量、群落组成和空间结构的变化.结果表明,高C/N比(8~14)条件更有利于其促进反应器脱氮效能:添加群体感应Pseudomonas mendocina促进了反应器的反硝化,而添加Pseudomonas putida提高了氨氮的去除.与水相比,生物膜相信号分子对于环境变化具有更灵敏的响应,C6-HSL是潜在调控生物膜修复和强化脱氮的信号分子.荧光定量qPCR表明,外源添加QS-HNAD有效促进了氨氧化、硝酸盐还原和一氧化氮还原过程.微生物群落结构分析表明,添加不同外源QS-HNAD菌的生物膜微生物群落结构差异较大,P.mendocina菌促进了放线菌、TM7、变形菌在生物膜中富集.
关键词:生物膜脱氮N-酰化高丝氨酸内酯脱氮功能基因群落结构
Insight into enhancing nitrogen removal in biofilm by exogenous quorum sensing-aerobic denitrifier (QS-HNAD)
ZHU Yingnan1
 , WANG Xu1, WANG Jinfeng1, DING Lili1,2
, WANG Xu1, WANG Jinfeng1, DING Lili1,2
 , REN Hongqiang1,2
, REN Hongqiang1,2

1. State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023;
2. Yixing Environmental Research Institute of Nanjing University, Yixing 214200
Received 28 June 2019; received in revised from 20 August 2019; accepted 20 August 2019
Abstract: The study aims to investigate the changes of reactor operation performance, biofilm physiological and biochemical characteristics, signal molecule levels, nitrogen removal function genes, composition and spatial structures of microbial community in biofilm through exogenous addition of QS-HNAD with high AHLs regulation capacity. Results showed that the high C/N ratio (8~14) conditions were more favorable for bacteria to promote the nitrogen removal efficiency:Pseudomonas mendocina could improve the denitrification performance of the reactor while Pseudomonas putida increased the ammonia nitrogen removal rate. The signal molecules in biofilm had a more sensitive response to environment change, compared to those in aqueous solution. C6-HSL was a kind of signal molecule that potentially regulates biofilm repair and enhances denitrification. The qPCR analysis of denitrification genes reveals that exogenously added QS-HNAD effectively promoted ammonia oxidation, nitrate reduction and nitric oxide reduction. The microbial community structure indicated that the microbial community structures of different exogenous QS-HNAD bacteria differed greatly, and P. mendocina promoted the enrichment of Actinobacteria, TM7 and Proteobacteria in biofilm.
Keywords: biofilmnitrogen removalN-acyl homoserine lactonesnitrogen removal function genesmicrobial community
1 引言(Introduction)生物膜因其可成功将生物量保留在反应器而成为有效促进生物脱氮的手段.然而, 由于脱氮细菌对pH、DO、温度、底物浓度等较为敏感, 非适宜环境下微生物会产生有毒有害中间代谢产物, 导致处理效率降低(Laureni et al., 2016; Tomaszewski et al., 2017).传统的强化生物膜脱氮方法主要有:①优化工艺参数(载体、环境因素、水力停留时间等) (Xiao et al., 2016; Yan et al., 2019);②添加化学物质(Fe2+、Mg2+、鼠李糖脂等) (Zhang et al., 2015; Peng et al., 2018; Huang et al., 2018);③投加脱氮菌(贫营养好氧反硝化菌、Zoogloea sp.、Acinetobacter sp.等) (Chen et al., 2015; Huang et al., 2015).但其仍存在促进生物膜挂膜和强化脱氮效果有限等问题.因此是否可通过调控和优化脱氮群落结构和功能以强化废水生物脱氮处理成为目前的研究焦点.
近年来, 基于群体感应(Quorum sensing, QS)促进生物膜成膜和脱氮的方法逐步见于报道(Shrout et al., 2012).群体感应是用于描述环境感知系统的术语, 即细菌通过产生信号分子以细胞密度依赖的方式调整基因表达和行为表型, 从而影响生物膜细胞间聚集、粘附和生物降解性能(Keller et al., 2006; Mukherjee et al., 2019).生物膜脱氮过程中, 许多编码硝化和反硝化脱氮酶的基因受到信号分子N-酰化高丝氨酸内酯类化合物(N-acyl homoserine lactones, AHLs)调控, 如氨氧化基因amoA的表达受到C4-HSL、C6-HSL、C8-HSL、C14-HSL等信号分子的调控(Sun et al., 2018), 硝酸盐还原基因napA、narG的表达均受C14-HSL与3OC14-HSL的调控(Burton et al., 2005), 亚硝酸盐还原基因nirS、nirK则与C6-HSL、C12-HSL、C14-HSL等信号分子有关(Ma et al., 2015).目前报道的群体感应强化生物膜脱氮方法有:①外源投加信号分子(C8-HSL、OHHL、3OC12-HSL、C14-HSL等) (De et al., 2011; 侯保连等, 2015; Li et al., 2015);②投加群感菌(S. ruba) (傅慧敏, 2018).
然而, 在某些条件下, 信号分子会在化学、代谢和群体感应淬灭酶(如内酯酶、酰化酶、氧化还原酶)的作用下被降解(Li et al., 2016), 该过程即群体淬灭(Quorum quenching, QQ), 群体淬灭的存在增加了调控生物膜脱氮的复杂性(Jiang et al., 2013).生物膜中脱氮菌丰度仅有6%~20%(Gonzalez et al., 2016), 根据信号分子产生或降解能力, 可分为4类:群感菌、淬灭菌、既可群感又可淬灭的细菌以及既非群感也非淬灭的细菌(Tan et al., 2015).考虑到信号分子的成本高、稳定性差、易降解, 是否可能筛选出具有高信号分子AHLs产生能力的脱氮菌, 将其外源投加入生物膜反应器中进行强化?但如何利用脱氮菌的群体感应能力对其脱氮行为进行调控, 目前机理研究尚不清晰.此外, 作为环境系统感知的AHLs信号分子, 其在水质组分复杂多变的废水生物处理系统中, 如何响应外界条件(如C/N、有机负荷)变化, 仍有待进一步研究.
本研究采用实验室筛选出的2株高AHLs调控能力的群体感应-好氧反硝化菌(QS-HNAD), 外源投加到移动床生物膜反应器中, 以未加菌组为对照考察了其强化脱氮效果、生物膜生理生化特征(生物膜厚度、粘附力、粗糙度、EPS)、信号分子含量、脱氮功能基因丰度, 并解析了微生物群落组成与空间结构变化, 以揭示群体感应调控脱氮菌群与其他物种之间的相互作用机制, 为群感调控在生物脱氮工程实践中的应用提供理论基础.
2 材料与方法(Materials and methods)2.1 菌种来源实验所用2株群体感应-好氧反硝化菌均由本实验室分离筛选出, 筛选过程采用BTB培养基(溴麝香草酚蓝);随后在反硝化培养基(DM)中, 培养条件为25 ℃, 150 r·min-1, 接种量为2%, 对其进行生长特性、代谢水平、信号分子、胞外聚合物以及比底物利用速率等生理生化性能的比较与皮尔逊相关性分析, 选择高生长代谢速率、高群体感应调控能力的2株菌(Pseudomonas mendocina、Pseudomonas putida)进行本实验研究.
2.2 接种污泥接种污泥来自南京市某污水处理厂好氧段活性污泥, 其悬浮固体浓度(Mixed Liquid Suspended Solids, MLSS)为2000~3000 mg·L-1, 再将稀释后污泥与填料投入各组MBBR中混合接触曝气24 h, 之后将接种污泥全部排出.
2.3 实验设计采用实验室规模的圆柱形移动床生物膜反应器(MBBR), 有效容积9 L(高45 cm, 直径16 cm), 内设填料为空心圆柱状、高密度聚乙烯.设置了3组反应器:R0(空白对照组)、R1(投加B1菌株)、R2(投加B2菌株).R0未外源投加菌株, 空白填料填充比(填料总体积与反应器容积之比)为30%;R1和R2分别向MBBR反应器中投加固定化有Pseudomonas mendocina和Pseudomonas putida菌株的填料(培养36 h), 该填料数量占其反应器总填料数的10%, 反应器总填充比为30%.将接种污泥与空白填料投入各组MBBR中混合接触曝气24 h后, 将污泥全部排出;随后R1、R2中加入固定化QS-HNAD填料, 3组反应器加入废水进行曝气处理.
配水采用人工模拟生活污水, 碳源和氮源采用葡萄糖、氯化铵和硝酸钾, 根据进水C/N的不同, 浓度变化划分为4个阶段, 如表 1所示, 此外另添加45 mg·L-1 KH2PO4、100 mg·L-1 KCl、15 mg·L-1 CaCl2、15 mg·L-1 Na2SO4、4.19 mg·L-1 MgCl2以及微量元素(FeSO4 2.49 mg·L-1、MnCl2 0.28 mg·L-1、CuSO4 0.39 mg·L-1、ZnCl2 0.44 mg·L-1、CoCl2 0.50 mg·L-1、Na2MoO4 0.23mg·L-1、EDTA 5.0 mg·L-1), 使用40 g·L-1碳酸钠(Na2CO3)溶液调节进水pH在7.0~8.0之间, 溶解氧浓度(DO)为5~7 mg·L-1、HRT为24 h.反应器常温运行40 d, 分别对3组反应器出水水质指标(COD、氨氮、亚硝氮、硝氮、总氮)、生物膜生理生化性能(生物膜厚度、粘附力、粗糙度、胞外聚合物)以及微生物群落结构等进行测定.
表 1(Table 1)
| 表 1 反应器各阶段模拟废水的进水碳源与氮源 Table 1 Carbon and nitrogen concentrations of influents for MBBRs | |||||||||||||||||||||||||
表 1 反应器各阶段模拟废水的进水碳源与氮源 Table 1 Carbon and nitrogen concentrations of influents for MBBRs
| |||||||||||||||||||||||||
2.4 分析项目和方法2.4.1 常规指标的测定实验中COD、NO3--N、NO2--N、NH4+-N、TN等常规水质指标的测定均参照国标法(国家环境保护总局, 2002), pH测定利用pH计, 溶解氧DO测定利用溶氧仪.
2.4.2 信号分子的提取与检测生物膜和水相中信号分子的分析采用超声萃取和HLB固相萃取结合UPLC-MS进行检测(Wang et al., 2017), 生物膜中信号分子采用乙酸乙酯加超声提取, 旋转蒸发后定容;水相中信号分子通过液液萃取和SPE萃取柱提取, 即先向SPE柱中加入甲醇和超纯水, 然后加入样品, 5:95(v/v)甲醇-水溶液(2%氢氧化铵)清洗, 5:95(v/v)甲醇-水溶液(2%乙酸)清洗, 最后用甲醇(2%乙酸)洗脱后氮吹浓缩.提取后的信号分子采用UPLC-MS/MS(Waters Corp., Milford, MA, USA)进行检测, 色谱条件如下:色谱柱:Waters Sunfire C18色谱柱(50 mm × 2.1 mm, 3.5 μm);流速: 0.2 mL·min-1;进样量: 10 μL;分析时间:12 min;柱温:35 ℃;流动相A为甲醇(0.1%甲酸), 流动相B为水(2 mmoI·L-1乙酸铵, 0.1%甲酸).
2.4.3 生物膜生理生化性能采用光学显微镜(Nikon SMZ1000, 日本尼康公司)测定生物膜厚度, 采用原子力显微镜AFM(Multimode 8, 德国布鲁克公司)测定粗糙度、粘附力, EPS的提取方法采用热碱提法(Bassin et al., 2012), 含量主要以蛋白质(proteins, PN)和多糖(polysaccharides, PS)的浓度来表示, 蛋白质测定采用BCA法(Liu et al., 2017), 多糖测定采用硫酚法(DuBois et al., 1956).
2.4.4 脱氮功能基因定量分析采用实时定量基因扩增荧光法(Real-time Quantitative PCR Detecting System, qPCR)分析了脱氮功能基因(amoA、nxrA、napA、narG、nirS、nirK、norB、nosZ), 主要参考He等(2018)的方法, 并进行部分修改.采用7500Real Time PCR System(Applied Biosystems)和荧光染料SYBR-Green, 对PCR纯化后的DNA功能基因进行定量聚合酶链反应(qPCR), 在20 μL反应体系中进行了qPCR扩增, 包括10 μL的SYBRGreenⅠPCR主混合物(应用生物系统)、1.6 μL的模板DNA(样本DNA或用于制作标曲的质粒DNA)、0.4 μL的正、反向引物以及7.6 μL的无菌水.每个qPCR扩增共40个循环, 最终根据循环结束时基因的拷贝数计算相应功能基因的丰度.
2.4.5 群落结构分析采用16S rRNA基因高通量测序(Miseq, Illumina)进行检测.污泥样品DNA的提取及PCR扩增采用周莉娜等(2016)报道的方法.经琼脂糖凝胶电泳鉴定PCR产物后, 采用纯化试剂盒(Cycle-Pure Kit, OMEGA Bio-tek, Inc.)纯化后送至生工生物工程(上海)股份有限公司进行Miseq测序.
2.5 数据统计与分析利用R程序(3.1.0版)绘制热图;采用Origin9.1软件对基础数据进行汇总、绘图;采用CANOCO4.5软件(ScientiaPro, 匈牙利)对MBBR生物膜微生物群落结构与出水水质、生物膜生理生化特征之间的相关性进行冗余分析(Redundancy Analysis, RDA);Miseq数据经Sickle及Mothur降噪后, 通过RDP分类处理采用SPSS StatisticsV19.0软件对基本水质、生长特性、生理生化特征、微生物群落等相关指标进行Pearson相关性分析.
3 结果与讨论(Results and discussion)3.1 QS-HNAD菌的脱氮与群体感应能力图 1是QS-HNAD培养过程中OD600、TN与信号分子变化情况, 由图 1可见, 群体感应-好氧反硝化菌(Pseudomonas mendocina、Pseudomonas putida)不仅具有高生长能力和脱氮能力, 而且以柠檬酸为碳源时可产生C6-HSL、3OC8-HSL、3OC6-HSL、3OC10-HSL信号分子和高浓度胞外聚合物(48 h, P. mendocina多糖浓度为85.21 mg·g-1;P. putida为95.89 mg·g-1).Li等研究则证明3OC-8HSL也可以促进EPS的分泌、同时会影响活性污泥颗粒化进程和微生物群落结构(Li et al., 2017).Burton等报道, C6-HSL、C8-HSL是亚硝化单胞菌Nitrosomonas europaea中常见的信号分子(Burton et al., 2005).
图 1(Fig. 1)
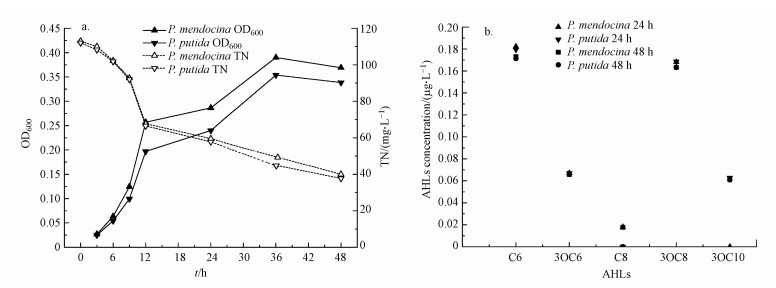 |
| 图 1 QS-HNAD菌培养过程中的OD600 TN(a)与信号分子(b) Fig. 1OD600, TN removal (a) and signal molecules (b) during cultivation of QS-HNAD |
3.2 外源QS-HNAD菌强化反应器的运行效果据文献报道, 生物膜形成过程中早期到达载体表面的微生物具有优先效应(Nemergut et al., 2013), 因此将群感菌P. mendocina和P. putida先挂膜在填料上, 在闷曝排泥结束后分别添加到反应器R1和R2中, 然后开始启动挂膜.为了考查进水条件对投加QS-NHAD菌的强化效果以及信号分子对于环境变化的响应效果, 根据进水C/N的不同, 将反应器的运行划分为4个阶段, 共运行40 d.
图 2比较了外源QS-HNAD菌强化生物膜反应器的运行效果.由图 2可见, 3个反应器各阶段的COD平均去除率均在90%以上, 但随着C/N的变化, 外源添加不同QS-HNAD菌呈现不同的脱氮效果.第Ⅰ阶段(1~10 d), 添加P. mendocina的反应器R1具有最高的反硝化效能, 其硝氮去除率达95.91%, 比R0和R2分别高出26.31%、16.65%;添加P. putida的反应器R2氨氧化能力更好.第Ⅱ、Ⅲ阶段(11~27 d), 提升进水氨氮和硝氮浓度, 降低C/N.虽然Ⅱ阶段(C/N=9.44)中R1反硝化性能较好, R2保持较好的氨氮去除率, 3个反应器TN去除效果相近.第Ⅲ阶段(C/N=5.79)时, 3个反应器TN去除率均显著下降, 原因在于3个反应器由于碳源不足分别出现了不同程度的NO2--N积累, 对反应器内的微生物造成毒害作用, 但R2在此阶段的出水NO3--N浓度逐渐降低, 菌株P. putida在此阶段的反硝化作用表现出良好的适应性.第Ⅳ阶段(28~40 d), 提升C/N, 碳源得到补充, 快速促进了3个反应器含氮物质去除.其中, R1的NH4+-N与NO3--N平均去除率均为最高, NO2--N积累最少, 最高时为4.92 mg·L-1, 仅为对照组R0(20.30 mg·L-1)的24.24%, 整个第Ⅳ阶段R1的TN去除率(73.30%)比对照组R0(70.28%)高出3.02%, 表明添加P. mendocina菌株的反应器可在适宜条件下快速恢复脱氮能力.
图 2(Fig. 2)
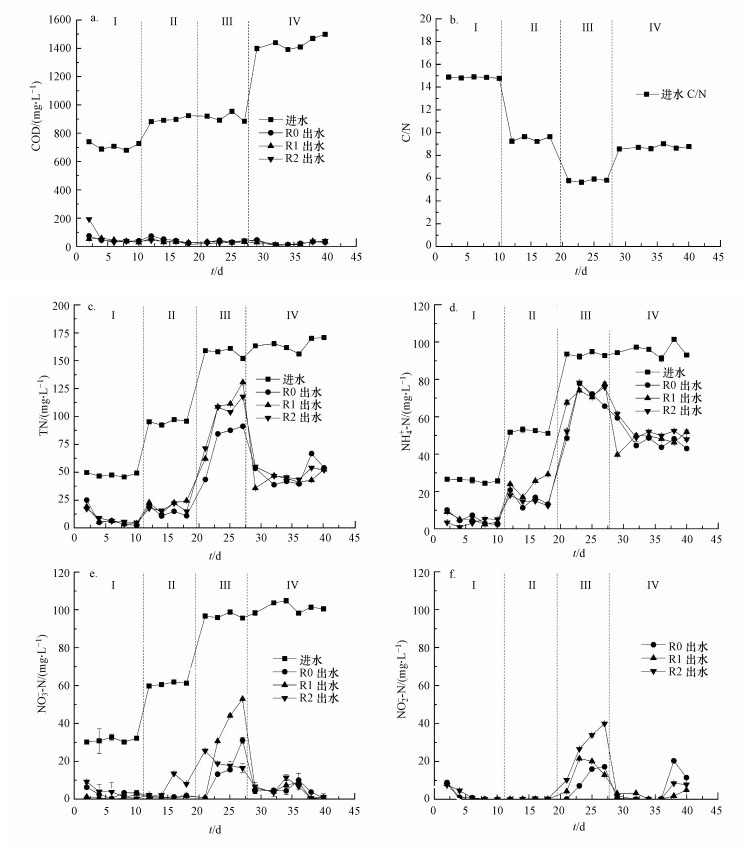 |
| 图 2 MBBR进出水COD (a)、C/N (b)、TN (c)、NH4+-N (d)、NO3--N (e)、NO2--N (f)变化 Fig. 2Changes of COD (a), C/N (b), TN (c), ammonia (d), nitrate (e), nitrite (f) in MBBRs |
整个运行过程中, 随着C/N的变化, 尽管3组反应器对各价态氮的去除呈现相似的变化趋势, 但R1在高C/N比(第Ⅰ和Ⅳ阶段)条件下呈现出更高的反硝化脱氮能力, R2在高C/N比的Ⅰ阶段氨氧化效果好、Ⅳ阶段的反硝化脱氮效果更好.这表明添加的P. mendocina和P. putida菌株均更适应高有机物浓度和高C/N比条件.
3.3 外源QS-HNAD对生物膜相和水相信号分子组成影响图 3为不同C/N比条件下3组反应器的生物膜相和水相信号分子变化.由图 3可见, 第Ⅰ阶段和第Ⅱ阶段前期, 生物膜相和水相中的信号分子浓度强化组均高于对照组, 这表明高C/N比条件下, 添加QS-HNAD菌促进了生物膜和水相信号分子表达.
图 3(Fig. 3)
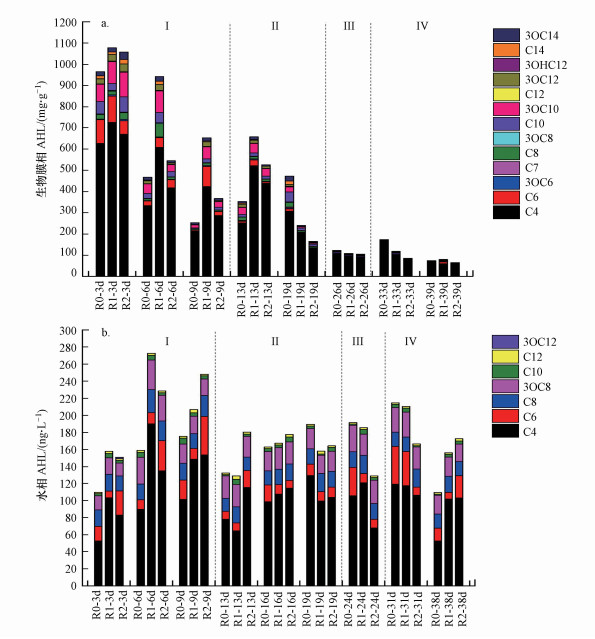 |
| 图 3 MBBR运行过程中生物膜相信号分子(a)和水相(b)浓度变化 Fig. 3Concentrations of signal molecules in biofilm (a) and water (b) in MBBRs |
随着C/N降低(第Ⅰ~ Ⅲ阶段), 3组反应器的生物膜相的信号分子总浓度和种类快速下降.在第Ⅰ阶段, R1、R2的信号分子浓度始终高于对照组R0.第Ⅱ阶段, 随着C/N比降低, R1和R2生物膜相信号分子主要成分C4-HSL、C6-HSL快速下降;第Ⅲ阶段, R1中C6-HSL、C10-HSL、C8-HSL消失;第Ⅳ阶段, C/N升高到8.72, 第39 d时强化组R1生物膜信号分子总浓度超过R0, C6-HSL重新出现在R1反应器生物膜中, 并且该组分恢复仅出现在R1组, 考虑到此时R1反硝化脱氮能力和生物膜厚度快速提升, 推测C6-HSL在生物膜恢复和底物代谢中起关键作用, 添加群体感应菌Pseudomonas mendocina的系统R1环境感知更敏感, 响应度更快.值得注意的是, R1生物膜中C12-HSL、3OC12-HSL、C14-HSL等长链信号分子在C/N较低的Ⅱ、Ⅲ阶段(13~26 d)迅速降低, 推测是由于碳源不足情况下被Pseudomonas mendocina降解, 这一猜想与后续验证实验Pseudomonas mendocina可以降解C12-HSL具有群体淬灭作用一致.C6-HSL被证明可以促进好氧污泥EPS的产生(Tan et al., 2014), 向厌氧颗粒污泥添加适量的C6-HSL还可以提高厌氧氨氧化细菌的生长速率和活性(Gamage et al., 2011).3OC6-HSL和C8-HSL对于生物膜脱氮效果同样具有强化作用, 外源添加3OC6-HSL和C8-HSL可以增加生物膜中硝化细菌的数量, 并促进受损生物膜的恢复.此外, C14-HSL和3OC14-HSL在反应器水相中未发现, 但生物膜相均测出一定浓度C14-HSL和3OC14-HSL (R2>R1>R0), C14-HSL可以表征异养菌和亚硝酸盐还原活性的强弱, 但长链信号分子难溶于水.
水相信号分子在MBBR启动运行过程中种类无明显变化, 浓度呈先升高后降低的趋势.第Ⅰ阶段, 强化组信号分子总浓度比对照组(R0)高出1.18~1.72倍(R1)、1.20~1.44倍(R2).第Ⅱ、Ⅲ阶段, 随着C/N降低, R0信号分子浓度显著升高.此时, 而R1、R2水相仍持有一定比例C6-HSL、C8-HSL, 考虑到其生物膜相相关信号分子已经消失, 推测生物膜相信号分子在调控成膜和代谢中占主导作用, 并具有更灵敏的响应性;第Ⅳ阶段, 提升C/N后, 第38 d时R1和R2的信号分子浓度分别比R0高出43%、56%, 主成分C4-HSL显著升高.C4-HSL是脱氮过程的关键信号分子, Sun等(2018)在其研究发现常温好氧条件下C4-HSL与序批式硝化生物膜反应器内氨氧化细菌的活性呈现显著正相关性.
综上所述, 生物膜中信号分子变化比水相具有更高灵敏度和响应性;高C/N比条件下, 添加QS-HNAD菌有效上调信号分子形成;C6-HSL在强化生物膜修复和脱氮过程, 可能起关键调控作用.
3.4 QS-HNAD强化的生物膜生理生化特征图 4为3个反应器中生物膜厚度、粘附力与粗糙度、胞外聚合物浓度情况.由图 4a可知, 3个反应器的生物膜厚度总体呈现不断增长的趋势, 外源添加QS-HNAD菌促进了生物膜的生长.第Ⅰ~Ⅲ阶段, R1的生物膜厚度最高, 并在第19 d达到第一个峰值261.896 μm, 与菌株P. mendocina生长速率快结论一致, 其次是R2, R0最低;在第Ⅲ~Ⅳ阶段, 随着总氮浓度提高、C/N降低, R0和R2迅速增长并超过R1.第38 d时, R2(562.30 μm)比对照组R0(466.81 μm)高20.46%;而R1生物膜厚度仅为437.52 μm, 推测碳源缺乏时反应器R1中的微生物部分利用生物膜中碳氮类物质以适应变化的环境.Lade等(2014)曾在活性污泥中筛选出32种菌株对生物膜形成与感应信号分子的关系进行研究, 确定了AHLs的产生可以促进生物膜的形成, Costerton等(1999)的研究也表明, 细菌会通过调整特异性粘附基因的表达, 促进EPS的分泌, 从而粘结更多的微生物到细菌表面, 促进生物膜厚度的增长.
图 4(Fig. 4)
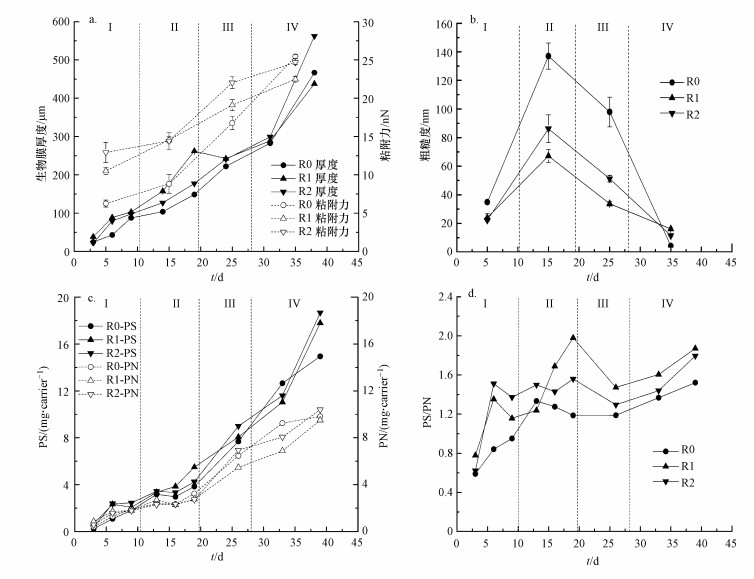 |
| 图 4 MBBR运行过程中生物膜厚度、粘附力、粗糙度、多糖和蛋白变化情况 Fig. 4Changes in biofilm thickness, adhesion, roughness, polysaccharides and protein contents in MBBRs |
由图 4b~4c可知, 第Ⅰ~Ⅲ阶段, QS-HNAD菌添加组R1和R2的粘附力均高于对照组R0.Byrd等(2009)以假单胞菌属为研究对象, 分析了胞外多糖对于生物膜的影响, 发现胞外多糖在细胞与载体粘附过程以及维持生物膜稳定过程中起关键作用, 推测本实验结果的高粘附力可能是由于R1和R2生物膜EPS中多糖的增加.另外, R0的粗糙度高于R1、R2, 也进一步证实添加QS-HNAD菌株促进了生物膜中微生物生长和细胞密度, 因此降低了表面粗糙度.
由图 4c~4d可知, 整个运行过程中多糖浓度高于蛋白浓度, 且多糖与蛋白浓度呈现不断增长趋势.第Ⅰ、Ⅱ阶段, R1和R2的多糖浓度均高于对照组R0;进入第Ⅲ阶段, 随着C/N降低, 尽管R1多糖浓度下降(仍高于R0), 而蛋白质浓度增长幅度低于R2和R0(即PS/PN升高), 这证实了R1粘附力增加主要源于多糖比例升高;EPS组分中的胞外多糖(如黏附素、藻酸盐、Pel、Psl等)与微生物细胞的粘合性能与附着作用有关, 对于生物膜形成初期微菌落的建立、生物膜结构的维护以及成熟生物膜的力学稳定性都起着重要作用(Colvin et al., 2012).第Ⅳ阶段, 当C/N和COD提高后, R1和R2的多糖浓度快速增长, 第9 d分别达到比R0高出24.97%、19.07%.这可能是由于部分蛋白质以侧链的形式与具有分支结构的长链多糖结合, 同时该结合物的存在使得多糖的分子量增加, 促进了微生物的聚集和生物膜的形成(Seviour et al., 2010).
3.5 不同QS-HNAD强化的生物膜脱氮功能基因含量比较采用qPCR分析了氨氧化、硝化和反硝化脱氮基因(amoA、nxrA、napA、narG、nirS、nirK、norB、nosZ)随时间变化情况, 结果如图 5所示.
图 5(Fig. 5)
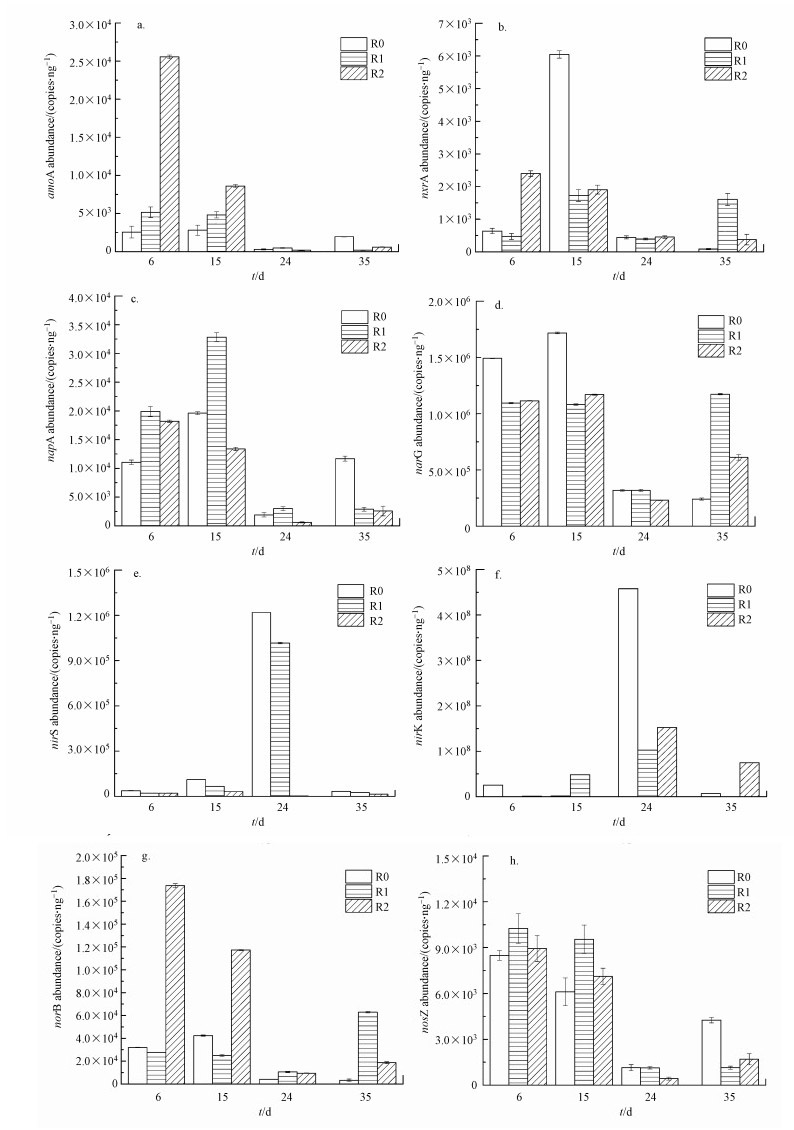 |
| 图 5 MBBR运行过程中脱氮功能基因含量变化 Fig. 5Changes in the abundance of nitrogen-removal function genes in MBBRs |
由图 5可知, 第Ⅰ、Ⅱ阶段, R1、R2的氨氧化基因amoA、好氧反硝化基因napA和一氧化二氮还原基因nosZ含量显著高于对照组R0, 这表明反应器中氨氧化作用和好氧反硝化作用在添加QS-HNAD菌后得到强化.缺氧反硝化基因narG含量是好氧反硝化基因napA的100倍左右, 说明生物膜中的硝酸盐还原作用主要在缺氧环境下进行;第Ⅲ阶段, 随着C/N比降低, 一方面亚硝氮积累对氨氧化作用的毒性抑制, 3个反应器中amoA含量降低, 与氨氮去除率变化趋势一致;另一方面, 该阶段亚硝酸盐还原基因nirS与nirK相应含量上升, R0含最高浓度nirS与nirK;第Ⅳ阶段补充碳源, R1、R2的缺氧反硝化则强于对照组R0;第Ⅳ阶段末期, R1的反硝化基因nxrA丰度和一氧化氮还原基因norB最高, 与此时R1高脱氮能力一致.
综合比较不同C/N阶段下QS-HNAD菌对于脱氮基因丰度的影响, 投加强化菌Pseudomonas putida强化前期的硝化作用与NO还原作用, 投加强化菌Pseudomonas mendocina强化前期的反硝化作用与后期的亚硝酸盐氧化作用.
3.6 不同QS-HNAD强化的微生物群落结构比较为揭示外源添加QS-HNAD菌强化MBBR过程中微生物群落的演变规律, 采用MiSeq高通量测序分析了各组生物膜中群落结构随时间变化, 图中属水平相对丰度以10为底取对数.
门水平上, MBBR在启动运行过程中微生物群落结构的变化如图 6所示.接种污泥主要优势菌由变形菌门(57.95%)、拟杆菌门(11.26%)和放线菌门(3.61%)等组成.反应器启动5 d后, 与接种污泥优势菌群相比, 优势细菌变形菌门均有较大增加(R0:84.21%;R1:69.67%;R2:84.95%).此外, 外源添加QS-HNAD组比对照组R0的放线菌门丰度分别高出10.58%、3.95%, 从而可以分泌更多的EPS, 有利于微生物在填料表面形成紧密纤维状的生物膜结构, 促进早期挂膜.
图 6(Fig. 6)
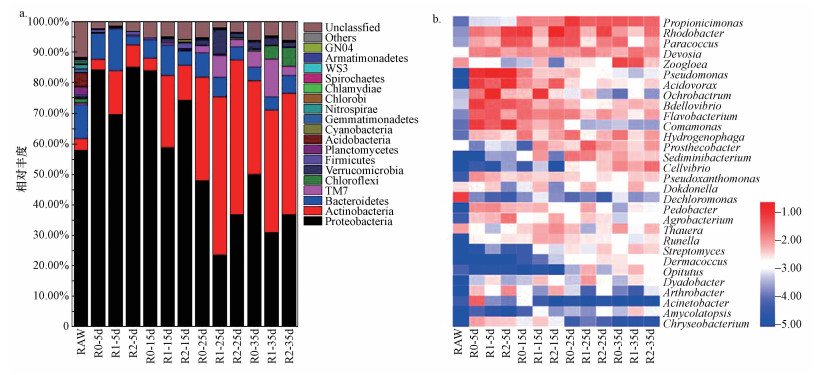 |
| 图 6 MBBR运行过程中微生物群落在门水平(a)和属水平(b)的变化 Fig. 6Variations of biofilm microbial community in MBBRs at phylum (a) and genus level (b) |
第Ⅱ、Ⅲ阶段(降低C/N比), 第15 d时, R0群落组成变化不大, 但R1的放线菌门(23.76%)丰度进一步上升, 疣微菌门(1.63%)也成为优势菌群之一;R2的放线菌门和拟杆菌门有少量增加, 厚壁菌门(1.66%)在微生物竞争中同样占有一定优势.据研究报道, 许多厚壁菌门的细菌可以产生芽孢来抵抗干旱和极端环境等不适胁迫.第25 d时, 反应器中放线菌门逐渐在与变形菌门的竞争中取得优势, TM7和疣微菌门丰度均有较为明显的提高.TM7属于革兰氏阳性菌, 细胞壁厚, 肽聚糖和磷壁酸含量多, 有利于生物膜形成紧密纤维结构(Bhatia et al., 2013), 维持生物膜稳定性, 同时TM7还具有较强的分泌EPS的能力.第Ⅳ阶段, 提升C/N, 第35 d时, 3个反应器的变形菌门丰度均增加, 说明变形菌门的生长更加依赖高C/N环境条件.与对照组R0相比, 强化组R1和R2的绿弯菌门(4.49%、5.90%)成为新的优势群之一, 绿弯菌门微生物多为丝状细菌, 对污泥颗粒结构的形成具有一定促进作用, 同时具有降解大分子有机物的能力.群落演变的角度来看, 强化组(尤其是R1)的变形菌门、放线菌门和拟杆菌门等优势菌群种类更为丰富, 并且占有更高的比例.
属水平上, 反应器启动5 d后, 3个反应器中优势菌属主要为Pseudomonas、Comamonas、Bdellovibrio、Flavobacterium、Ochrobactrum、Rhodobacter, 其中Pseudomonas、Flavobacterium被报道具有一定的反硝化作用(Li et al., 2017), 有利于水中氮的去除, Pseudomonas对于污水中的有机物也具有极强的降解能力, Flavobacterium同时还具有较强的群体感应淬灭能力, 可以降解信号分子, Comamonas是群体感应菌属, 被报道能够产生信号分子(Abdullah et al., 2013).由于投加了Pseudomonas sp.群体感应-好氧反硝化菌, R1、R2的Pseudomonas分别比对照组R0高出8.80%、6.79%, R1的Ochrobactrum比R0高出14.53%, R2的Rhodobacter比R0高出5.26%.Ochrobactrum对信号分子具有降解作用, 是常见的群体感应淬灭菌属, Rhodobacter既能产生信号分子也能降解信号分子, 同时具有一定的有机物代谢能力.
第Ⅱ阶段, 15 d时, 与R0相比, R1的Ochrobactrum、Sediminibacterium、Zoogloea丰度相对较高, R2的Acidovorax丰度较高, 强化组的Thauera分别比对照组高出0.33%(R1)、0.93%(R2).Zoogloea细胞内含有大量功能基因, 可编码参与生物合成的糖基转移酶和其他蛋白质的合成, 具有较强的EPS分泌能力, 在活性污泥颗粒的形成与生物膜的形成过程中起到关键作用(Zhu et al., 2015).许多文献报道Acidovorax既能够产生也可以降解信号分子, 参与废水处理中的反硝化过程以及重金属离子的氧化和去除, 并且还可以代谢一些有机污染物(如三氯乙烯, 甲苯和苯酚等)(Quan et al., 2017).Thauera不仅具有较强的反硝化作用, 同时也与反应器内的群体感应密切相关, 尽管不具备AHL合成酶基因, 不能合成AHL, 但含有AHL受体蛋白, 也可以参与AHL调控作用(Jiang et al., 2012).
第Ⅲ阶段, 25 d时, Pseudomonas、Acidovorax、Ochrobactrum、Bdellovibrio、Comamonas等菌株丰度下降, Propionicimonas、Rhodobacter、Paracoccus、Devosia、Sediminibacterium等丰度增加, 成为新的优势菌属, Chryseobacterium在反应器中基本消失.Paracoccus可以甲醇为碳源进行脱氮, 是重要的反硝化聚磷菌.Devosia属包括多种能够降解芳烃的物种, 在促进颗粒形成过程中细菌的粘附方面也具有重要作用(Ramos et al., 2015).R1的Propionicimonas比R0高出3.46%, R2的Rhodobacter比R0高出1.95%.
第Ⅳ阶段, 35 d时, 各反应器物种组成无明显变化, 与对照组相比, 强化组R1的Devosia丰度略高, R2的Cellvibrio丰度略高, 比R0高出1.04%.25 d后反应器内Pseudomonas丰度持续下降.MBBR启动运行过程中, R1和R2优势菌属组成更为丰富, 优势菌群更加平衡, R1中较早出现新的优势菌属, 投加群体感应-好氧反硝化菌促进了MBBR生物膜内微生物群落的发展, 增强了生物膜稳定性.
为考察生物膜不同分层的微生物功能差异, 在不同转速下对生物膜样品进行分离, 分别标记为S-biofilm(2000×g)、LB-biofilm(5000×g)、TB-biofilm(10000×g), 对3层生物膜样品分别进行微生物DNA的提取与高通量测序, 得到微生物在门水平和属水平的分布结果.
由图 7可知, 在生物膜的内层(即紧密结合生物膜, TB-biofilm)中, 含有更高丰度的放线菌门, 与载体表面丝状菌的附着生长一致.添加QS-HNAD的R1、R2放线菌门和绿弯菌门含量高于对照组;在中间层(即松散结合生物膜, LB-biofilm)中, 变形菌门丰度高于其内外层, 同时强化组的绿弯菌门丰度显著高于对照组(R1:10.07%;R2:7.92%;R0:1.62%), 进一步证明外源QS-HNAD加速了丝状菌的生长和成膜;在生物膜的外层(即表面生物膜, S-biofilm)中, 含有更高丰度的TM7;R1的TM7含量比R0高4.44%.此外, 其他丰度较低的微生物种群(如拟杆菌门、绿弯菌门、疣微菌门等)主要分布在生物膜外层居多.
图 7(Fig. 7)
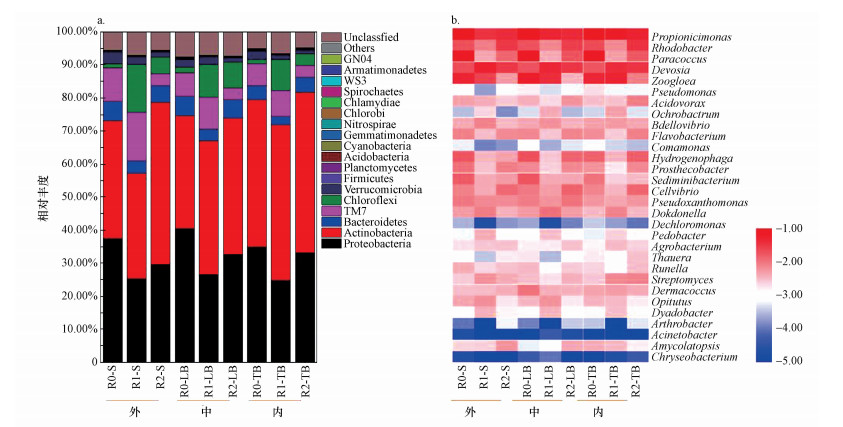 |
| 图 7 40 d时MBBR生物膜微生物群落在门水平(a)和属水平(b)的分层情况 Fig. 7Stratification of biofilm microbial community in MBBRs at phylum (a) and genus (b) level at 40 days |
属水平分层结果表明, Pseudomonas在各反应器内生物膜不同位置丰度均保持较低, 生物膜内层(紧密结合生物膜, TB-biofilm)相对略高, 推测反应器内生物膜初始成膜阶段, R1和R2中投加的强化菌可能主要在生物膜内层集中生长.强化组R1和R2的微生物群落更多的分布于生物膜的内层(紧密结合生物膜, TB-biofilm), 由内向外微生物丰度逐渐降低, 而对照组R0的微生物群落更多的分布于生物膜的外层(表面生物膜, S-biofilm), 由内向外, 微生物丰度逐渐升高.
3.7 微生物群落与MBBR运行效果及生物膜特征的相关性分析冗余分析(redundancy analysis, RDA)被用来研究微生物群落与反应器出水水质指标及生物膜生理生化指标之间的相关关系, 结果如图 8所示, RDA1和RDA2分别代表了66.1%和14.7%的总差异.
图 8(Fig. 8)
 |
| 图 8 MBBR启动运行过程中RDA分析 Fig. 8RDA analysis during the operation of MBBRs |
由图 8可知, 不同反应器在不同阶段群落结构差异较大, 随着时间推移差距逐渐减小, MBBR启动运行后期R2和R0较为接近, 外源添加菌株P. mendocina通过显著改变反应器R1内微生物群落组成及演替强化了MBBR挂膜及脱氮效果.TN去除率与COD去除率之间呈负相关性(p < 0.01), 即碳源不足可能是导致Ⅱ、Ⅲ阶段总氮去除率低的主要原因.已有报道表明, 在营养基质的限制作用下, 微生物会通过内源呼吸维持生存, 期间会发生蛋白质的降解从而产生脱氨作用, 使系统中总氮浓度升高.生物膜厚度(BT)、多糖浓度(PS)、蛋白浓度(PN)之间呈显著的正相关性(p < 0.01), 均随着时间延长不断增长, 与COD去除率呈正相关(p < 0.01), 表明微生物消耗利用有机物合成大量EPS, 同时EPS可能参与了有机物的去除, 因为生物膜EPS中含有许多功能性胞外酶, 它们可以降解水溶性聚合物、不溶性化合物以及生物膜束缚的有机颗粒(Flemming et al., 2010).以AHL-short、AHL-medium、AHL-long分别表示短链(C4-HSL、C6-HSL、3OC6-HSL、C7-HSL)、中链(C8-HSL、3OC8-HSL、C10-HSL、3OC10-HSL)和长链(C12-HSL、3OC12-HSL、3OHC12-HSL、C14-HSL、3OC14-HSL)信号分子浓度, 图中显示生物膜相信号分子浓度随时间逐渐降低, 与前述结论一致, AHLs浓度与TN去除率显示出较为明显的正相关性(p < 0.05), 这表明不同链长的信号分子均可能调控促进总氮去除.
由环境与物种之间进行相关性分析可知, 硝氮去除主要与Dokdonella呈正相关(p < 0.05);氨氮的去除主要与Pseudomonas、Acidovorax、Bdellovibrio、Comamonas、Agrobacterium、Arthrobacter呈正相关(p < 0.01);总氮的去除主要与与Pseudomonas、Acidovorax、Bdellovibrio、Comamonas、Chryseobacteriu呈正相关(p < 0.01);有机物去除主要与Cellvibrio、Dermacoccus、Opitutus呈正相关(p < 0.01);BT、PS、PN与Propionicimonas、Zoogloea、Sediminibacterium、Cellvibrio、Streptomyces、Dermacoccus、Opitutus、Amycolatopsis呈正相关(p < 0.05), 与Chryseobacterium、Acidovorax、Ochrobactrum、Bdellovibrio、Comamonas、Flavobacterium、Arthrobacter、Pseudomonas、Agrobacterium、Pedobacter呈负相关(p < 0.05).AHLs浓度与Ochrobactrum、Pseudomonas呈正相关(p < 0.01), 考虑到Pseudomonas菌与TN去除正相关, 但与PS和PN负相关, 这表明外源添加Pseudomonas菌可提升AHLs含量促进生物膜脱氮, 但碳源不足时会消耗生物膜EPS.
4 结论(Conclusions)1) 高C/N比(8~14)条件更有利于P. mendocina和P. putida菌株促进反应器脱氮效能.外源添加QS-HNAD菌促进了生物膜的生长, R1组多糖比例的提升是其粘附力升高的重要原因;各组生物膜中多糖含量高于蛋白含量.
2) 生物膜中信号分子变化比水相具有更高灵敏度和响应性;高C/N比条件下, 添加QS-HNAD菌有效上调信号分子形成, C6-HSL是潜在调控生物膜修复和强化脱氮的信号分子.
3) 脱氮功能基因丰度表明, 外源添加QS-HNAD有效促进了氨氧化、好氧反硝化和一氧化氮还原作用.
4) 微生物群落结构分析表明, 添加Pseudomonas sp.群体感应-好氧反硝化菌的反应器, 促进了载体表面丝状菌、TM7和绿弯菌门富集, 各组间空间结构差异较大.
参考文献
| Abdullah N, Yuzir A, Curtis T P, et al. 2013. Characterization of aerobic granular sludge treating high strength agro-based wastewater at different volumetric loadings[J]. Bioresource Technology, 127(1): 181–187. |
| Bassin J P, Kleerebezem R, Rosado A S, et al. 2012. Effect of different operational conditions on biofilm development, nitrification, and nitrifying microbial population in moving-bed biofilm reactors[J]. Environmental Science & Technology, 46(3): 1546–1555. |
| Bhatia D, Bourven I, Simon S, et al. 2013. Fluorescence detection to determine proteins and humic-like substances fingerprints of exopolymeric substances (EPS) from biological sludges performed by size exclusion chromatography (SEC)[J]. Bioresource Technology, 131(2): 159–165. |
| Burton E O, Read H W, Pellitteri M C, et al. 2005. Identification of acyl-homoserine lactone signal molecules produced by Nitrosomonas europaea strain Schmidt[J]. Applied and Environmental Microbiology, 71(8): 4906–4909.DOI:10.1128/AEM.71.8.4906-4909.2005 |
| Byrd M S, Sadovskaya I, Vinogradov E, et al. 2009. Genetic and biochemical analyses of the Pseudomonas aeruginosa Psl exopolysaccharide reveal overlapping roles for polysaccharide synthesis enzymes in Psl and LPS Production[J]. Molecular Microbiology, 73(4): 622–638.DOI:10.1111/j.1365-2958.2009.06795.x |
| Chen Q, Ni J, Ma T, et al. 2015. Bioaugmentation treatment of municipal wastewater with heterotrophic-aerobic nitrogen removal bacteria in a pilot-scale SBR[J]. Bioresource Technology, 183: 25–32.DOI:10.1016/j.biortech.2015.02.022 |
| Colvin K M, Irie Y, Tart C S, et al. 2012. The Pel and Psl polysaccharides provide Pseudomonas aeruginosa structural redundancy within the biofilm matrix[J]. Environmental Microbiology, 14(8): 1913–1928.DOI:10.1111/j.1462-2920.2011.02657.x |
| Costerton J W. 1999. Introduction to biofilm[J]. International Journal of Antimicrobial Agents, 11(3-4): 217–221.DOI:10.1016/S0924-8579(99)00018-7 |
| De Clippeleir H, Defoirdt T, Vanhaecke L, et al. 2011. Long-chain acylhomoserine lactones increase the anoxic ammonium oxidation rate in an OLAND biofilm[J]. Applied Microbiology and Biotechnology, 90(4): 1511–1519.DOI:10.1007/s00253-011-3177-7 |
| DuBois M, Gilles K A, Hamiton J K, et al. 1956. Colorimetric method for fetermination of sugars and related substances[J]. Analytical Chemistry, 28(3): 350–356.DOI:10.1021/ac60111a017 |
| Flemming H C, Wingender J. 2010. The biofilm matrix[J]. Nature Reviews Microbiology, 8(9): 623–633.DOI:10.1038/nrmicro2415 |
| 傅慧敏. 2018.移动床生物膜反应器微生物强化生物膜形成应用基础研究[D].南京: 南京大学 |
| Gamage A M, Shui G H, Wenk M R, et al. 2011. N-Octanoylhomoserine lactone signalling mediated by the BpsI-BpsR quorum sensing system plays a major role in biofilm formation of Burkholderia pseudomallei[J]. Microbiology, 157: 1176–1186.DOI:10.1099/mic.0.046540-0 |
| Gonzalez-Silva B M, Jonassen K R, Bakke I, et al. 2016. Nitrification at different salinities:biofilm community composition and physiological plasticity[J]. Water Research, 95: 48–58.DOI:10.1016/j.watres.2016.02.050 |
| He S, Ding L, Pan Y, et al. 2018. Effect of hydraulic retention time on nitrogen removal and functional gene quantity/transcription in biochar packed reactors at 5℃:A control-strategy study[J]. Bioresource Technology, 264: 400–405.DOI:10.1016/j.biortech.2018.06.006 |
| 侯保连, 李安婕, 孙趣. 2015. AHLs群体感应信号分子对硝化污泥附着生长及硝化效果的影响[J]. 环境科学学报, 2015, 35(9): 2773–2779. |
| Huang H, Lin Y, Peng P, et al. 2018. Calcium ion- and rhamnolipid-mediated deposition of soluble matters on biocarriers[J]. Water Research, 133: 37–46.DOI:10.1016/j.watres.2018.01.010 |
| Huang T, Zhou S, Zhang H, et al. 2015. Nitrogen removal from micro-polluted reservoir water by indigenous aerobic denitrifiers[J]. International Journal of Molecular Sciences, 16(4): 8008–8026. |
| Jiang K, Sanseverino J, Chauhan A, et al. 2012. Complete genome sequence of Thauera aminoaromatica strain MZ1T[J]. Standards in Genomic Sciences, 6(3): 325–335.DOI:10.4056/sigs.2696029 |
| Jiang W, Xia S, Liang J, et al. 2013. Effect of quorum quenching on the reactor performance, biofouling and biomass characteristics in membrane bioreactors[J]. Water Research, 47(1): 187–196.DOI:10.1016/j.watres.2012.09.050 |
| Keller L, Surette M G. 2006. Communication in bacteria:an ecological and evolutionary perspective[J]. Nature Reviews Microbiology, 4(4): 249–258.DOI:10.1038/nrmicro1383 |
| Klausen M, Aaes-Jorgensen A, Molin S, et al. 2010. Involvement of bacterial migration in the development of complex multicellular structures in Pseudomonas aeruginosa biofilms[J]. Molecular Microbiology, 50(1): 61–68. |
| Lade H, Paul D, Kweon J. 2014. Isolation and molecular characterization of biofouling bacteria and profiling ofquorum sensing signal molecules from membrane bioreactor activated sludge[J]. International Journal of Molecular Sciences, 15(2): 2255–2273.DOI:10.3390/ijms15022255 |
| Laureni M, Falas P, Robin O, et al. 2016. Mainstream partial nitritation and anammox:long-term process stability and effluent quality at low temperatures[J]. Water Research, 101: 628–639.DOI:10.1016/j.watres.2016.05.005 |
| Li A, Hou B, Li M. 2015. Cell adhesion, ammonia removal and granulation of autotrophic nitrifying sludge facilitated by N-acyl-homoserine lactones[J]. Bioresource Technology, 196: 550–558.DOI:10.1016/j.biortech.2015.08.022 |
| Li L, Tian Y, Zhang J, et al. 2017. Insight into the roles of worm reactor on wastewater treatment and sludge reduction in anaerobic-anoxic-oxic membrane bioreactor (A2O-MBR):Performance and mechanism[J]. Chemical Engineering Journal, 330: 718–726.DOI:10.1016/j.cej.2017.08.010 |
| Li Y, Cao J, Li B, et al. 2016. Outcompeting presence of acyl-homoserine-lactone (AHL)-quenching bacteria over AHL-producing bacteria in aerobic granules[J]. Environmental Science & Technology Letters, 3(1): 36–40. |
| Li Y, Pan X, Cao J, et al. 2017. Augmentation of acyl homoserine lactones-producing and -quenching bacterium into activated sludge for its granulation[J]. Water Research, 125: 309–317.DOI:10.1016/j.watres.2017.08.061 |
| Liu J, Wang F, Wu W, et al. 2017. Biosorption of high-concentration Cu(Ⅱ) by periphytic biofilms and the development of a fiber periphyton bioreactor (FPBR)[J]. Bioresource Technology, 248(Part B): 127–134. |
| Ma F, Sun Y, Li A, et al. 2015. Activation of accumulated nitrite reduction by immobilized Pseudomonas stutzeri T13 during aerobic denitrification[J]. Bioresource Technology, 187: 30–36.DOI:10.1016/j.biortech.2015.03.060 |
| Mukherjee S, Bossier B L. 2019. Bacterial quorum sensing in complex and dynamically changing environments[J]. Nature Reviews Microbiology, 17(6): 371–382.DOI:10.1038/s41579-019-0186-5 |
| Nemergut D R, Schmidt S K, Fukami T, et al. 2013. Patterns and processes of microbial community assembly[J]. Microbiology and Molecular Biology Reviews, 77(3): 342–356.DOI:10.1128/MMBR.00051-12 |
| Peng P, Huang H, Ren H. 2018. Effect of adding low-concentration of rhamnolipid on reactor performances and microbial community evolution in MBBRs for low C/N ratio and antibiotic wastewater treatment[J]. Bioresource Technology, 256: 557–561.DOI:10.1016/j.biortech.2018.02.035 |
| Quan Y, Wu H, Yin Z, et al. 2017. Effect of static magnetic field on trichloroethylene removal in a biotrickling filter[J]. Bioresource Technology, 239: 7–16.DOI:10.1016/j.biortech.2017.04.121 |
| Ramos C, Suarez-Ojeda M E, Julian C. 2015. Long-term impact of salinity on the performance and microbial population of an aerobic granular reactor treating a high-strength aromatic wastewater[J]. Bioresource Technology, 198: 844–851.DOI:10.1016/j.biortech.2015.09.084 |
| Seviour T, Donose B C, Pijuan M, et al. 2010. Purification and conformational analysis of a key exopolysaccharide component of mixed culture aerobic sludge granules[J]. Environmental Science & Technology, 44(12): 4729–4734. |
| Shrout J D, Nerenberg R. 2012. Monitoring bacterial twitter:Does quorum sensing determine the behavior of water and wastewater treatment biofilms?[J]. Environmental Science & Technology, 46(4): 1995–2005. |
| Sun Y, Guan Y, Wang D. 2018. Potential roles of acyl homoserine lactone based quorum sensing in sequencing batch nitrifying biofilm reactors with or without the addition of organic carbon[J]. Bioresource Technology, 259: 136–145.DOI:10.1016/j.biortech.2018.03.025 |
| Tan C H, Koh K S, Xie C, et al. 2014. The role of quorum sensing signalling in EPS production and the assembly of a sludge community into aerobic granules[J]. Isme Journal, 8(6): 1186–1197.DOI:10.1038/ismej.2013.240 |
| Tomaszewski M, Cema G, Ziembinska-Buczynska, et al. 2017. Influence of temperature and pH on the anammox process:a review and meta-analysis[J]. Chemosphere, 182: 203–214.DOI:10.1016/j.chemosphere.2017.05.003 |
| Wang J, Ding L, Li K, et al. 2017. Development of an extraction method and LC-MS analysis for N-acylated-l-homoserine lactones (AHLs) in wastewater treatment biofilms[J]. Journal of Chromatography B-Analytical Technologies in the Biomedica and Life Sciences, 1041: 37–44. |
| Xiao K, Zhou L, He B, et al. 2016. Nitrogen and phosphorus removal using fluidized-carriers in a full-scale A2O biofilm system[J]. Biochemical Engineering Journal, 115: 47–55.DOI:10.1016/j.bej.2016.08.004 |
| Yan L, Liu S, Liu Q, et al. 2019. Improved performance of simultaneous nitrification and denitrification via nitrite in an oxygen-limited SBR by alternating the DO[J]. Bioresource Technology, 275: 153–162.DOI:10.1016/j.biortech.2018.12.054 |
| Zhang Y, Shi Z, Chen M, et al. 2015. Evaluation of simultaneous nitrification and denitrification under controlled conditions by an aerobic denitrifier culture[J]. Bioresource Technology, 175: 602–605.DOI:10.1016/j.biortech.2014.10.016 |
| 周莉娜, 苏润华, 马思佳, 等. 2016. 基于PLFA法分析亚硝氮、硝氮和氨氮对厌氧微生物细菌群落的影响[J]. 环境科学学报, 2016, 36(2): 499–505. |
| Zhu Y, Zhang Y, Ren H, et al. 2015. Physicochemical characteristics and microbial community evolution of biofilms during the start-up period in a moving bed biofilm reactor[J]. Bioresource Technology, 180: 345–351.DOI:10.1016/j.biortech.2015.01.006 |
