 , 陈川1
, 陈川1
 , 徐熙俊1, 王爱杰1, 李笃中2,3
, 徐熙俊1, 王爱杰1, 李笃中2,31. 哈尔滨工业大学环境学院, 城市水资源与水环境国家重点实验室, 哈尔滨 150090;
2. 台湾大学化工学院, 台北106;
3. 台湾科技大学化工学院, 台北 106
收稿日期: 2019-07-01; 修回日期: 2019-08-25; 录用日期: 2019-08-25
基金项目: 国家自然科学基金面上项目(No.51676057, 51576057);黑龙江博士后科学基金资助项目(No.AUGA413090317, AUGA413100318);哈尔滨工业大学博士后科学基金资助项目(No.AUGA411002617);城市水资源与环境国家重点实验室自主课题(No.2015DX04)
作者简介: 王雪廷(1992-), 女, E-mail:hitxueting@163.com
通讯作者(责任作者): 陈川(1982—), 男, 教授, 博士生导师, 主要研究方向为:废水处理技术及资源化、烟道尾气脱硫脱硝、微生物代谢硫和氮元素的新途径和新机制、油田微生物驱油技术与管道腐蚀控制等.E-mail: cchen@hit.edu.cn
摘要: 微氧强化硫酸盐还原-反硝化脱硫(SR-DSR)工艺因具有同步处理废水中COD、NO3-、SO42-生成S0且运行成本低、流程短的优势而受到关注.但因不同曝气方式而在反应器中形成的不同微氧区的位置对反应器运行效能、S0转化率和群落结构的影响尚不明确.因此,本文以5 mL·min-1·L-1曝气速率、10.4 mmol·L-1硫酸钠、31 mmol·L-1乳酸钠和8 mmol·L-1硝酸钾连续运行膨胀颗粒污泥床(EGSB)反应器,对比研究了回流槽中(底部)曝气(微氧区位于反应器下部)和反应区上部曝气(微氧区分别位于反应器上部和下部但DO更低)运行稳定后,反应器的运行效能、S0转化率和功能微生物的演替规律.结果表明,上部曝气时乳酸盐去除率为100%,出水中乙酸盐浓度为9.1 mmol·L-1,丙酸盐浓度为3.7 mmol·L-1,NO3-去除率为100%,出水中NO2-浓度为0.35 mmol·L-1,SO42-去除率为84%,出水中S2-浓度为2.6 mmol·L-1,S0转化率为59%.与底部曝气相比,上部曝气时出水中乙酸盐和丙酸盐浓度分别升高2.2和1.9 mmol·L-1,NO2-浓度下降0.15 mmol·L-1,S2-浓度降低0.5 mmol·L-1,SO42-去除率和S0转化率分别下降6%和1%.上部曝气时,反应器下部和上部均存在相对减弱的微氧环境,使得反应器中硫酸盐还原菌(SRB)Desulfomicrobium和Desulfobulbus的总丰度分别增加9%和5%,硫氧化反硝化菌(soNRB)Halothiobacillaceae和Sulfurovum的丰度均减小3.1%,异养反硝化菌(hNRB)Comamonas的丰度升高0.2%,互营菌Synergistaceae的丰度减少37%.其中,反应器下部的SRB和soNRB总丰度分别升高28%和3%,为SO42-还原和S0转化提供了充分条件,而反应器上部的微氧环境又减弱了SO42-还原过程,从而降低了反应器出水中的S2-.因此,在碳源充足的条件下,可以采取反应器上部曝气的方式创造微氧环境,既可以保证较高的S0转化率,又可以减少出水中S2-和NO2-的浓度.
关键词:硫酸盐还原-反硝化脱硫微氧曝气位点运行效能群落演替
Effects of aeration position on performance and microbial zonation of SR-DSR process under the micro-aerobic condition
WANG Xueting1
 , CHEN Chuan1
, CHEN Chuan1
 , XU Xijun1, WANG Aijie1, LEE Duujong2,3
, XU Xijun1, WANG Aijie1, LEE Duujong2,3 1. State Key Laboratory of Urban Water Resource and Environment, School of Environment, Harbin Institute of Technology, Harbin 150090;
2. Department of Chemical Engineering, "National" Taiwan University, Taipei 106;
3. Department of Chemical Engineering, "National" Taiwan University of Science and Technology, Taipei 106
Received 1 July 2019; received in revised from 25 August 2019; accepted 25 August 2019
Abstract: It has attracted wide attention for the advantages of sulfate reduction-denitrifying sulfide removal (SR-DSR) under micro-aerobic for simultaneous treatment of COD, NO3-, SO42- to S0 in wastewater with low operation cost and short process. However, it is still unclear that the effect of different micro-aerobic zones formed in the bioreactor due to different aeration modes on the bioreactor operation efficiency, S0 transformation efficiency and microorganism community. Therefore, an EGSB bioreactor was continuously operated as SR-DSR progress with the aeration rate of 5 mL·min-1·L-1 and the influent of 10.4 mmol·L-1 NaSO4, 31 mmol·L-1 sodium lactate and 8 mmol·L-1 KNO3. Compared and studied the operation efficiency, S0 transformation efficiency and functional microorganism succession rule of the bioreactor when the quality of effluent was stable with the aeration in the reflux tank (micro-aerobic zone at the bottom of the bioreactor) and aeration in the top of the reaction zone (micro-aerobic zone at the top and bottom of the bioreactor with lower DO). The results showed that the removal efficiency of lactate, NO3- and SO42- were respectively 100%, 100% and 84%, with the concentration of acetate, propionate, NO2- and S2- in effluent were respectively 9.1 mmol·L-1, 3.7 mmol·L-1, 0.35 mmol·L-1 and 2.6 mmol·L-1 and 59% S0 transformation. The relatively weak micro-aerobic environment at lower and upper parts of the bioreactor, which due to aeration in the top of the reaction zone, increased the total abundances of SRB Desulfomicrobium and Desulfobulbus by 9% and 5%, respectively, and both decreased the abundances of soNRB Halothiobacillaceae and Sulfovum by 3.1%, respectively, increased the abundance of hNRB Bacteroidetes_vadin HA17 and Comamonas by 3.5% and 0.2%, respectively, and decreased the abundance of Synergistaceae by 37%. Further more, the total abundance of SRB and soNRB in the lower part of the bioreactor increased by 28% and 3%, respectively, which provided sufficient conditions for SO42- reduction and S0 transformation. At the same time, the micro-aerobic environment in the upper part of the bioreactor weakened the SO42- reduction process, reduced the concentration of SO42- in the effluent. As a result, compared with aeration in the reflux tank, the concentration of acetate and propionate in effluent increased 2.2 and 1.9 mmol·L-1, respectively, the concentration of NO2- and S2- decreased 0.15 and 0.5 mmol·L-1, respectively, the removal rate of SO42- and the conversion rate of S0 decreased 6% and 1%, respectively in the aeration in the top of the reaction zone one. Therefore, under the condition of sufficient carbon source, aeration at the upper part of the bioreactor can not only ensure a high transformation of S0, but also reduce the concentration of S2- and NO2- in the effluent.
Keywords: SR-DSRmicro-aerobicaeration positionoperational efficiencycommunity succession
1 引言(Introduction)制药及化工废水中常含有大量的硫酸盐、硝酸盐及COD, 若不经过有效处理直接排放到水体中, 将对环境健康造成极大的破坏, 因此, 其处理处置受到了国内外****的广泛关注.而常规的处理技术不仅工艺流程长、成本高, 且调控较困难(Cadena et al., 1988; Ding et al., 2014).在厌氧或缺氧条件下, 硫酸盐可被硫酸盐还原菌(SRB)还原为硫化物, 硝酸盐被自养或异养反硝化菌经反硝化途径转化为氮气, COD不仅可以在硫酸盐还原和异养反硝化过程中被消耗, 而且可以被发酵细菌和产甲烷菌代谢为甲烷和二氧化碳而被去除, 因此, 理论上在同一体系中可以实现碳、氮、硫共脱除(Maree et al., 1987).然而, 产生的硫化物可能对环境产生二次污染.通过自养反硝化菌和异养反硝化菌的协作实现的同步脱硫反硝化过程(DSR), 可使硫化物氧化(S2-→S0)和硝酸盐还原(NO3-→N2)两个过程中的电子转移达到平衡, 实现在一个反应体系中同时去除有机物、硝酸盐和硫化物并产生单质硫, 从而有效降低出水中的硫化物浓度(王爱杰等, 2004; Chen et al., 2008c).因此, 王爱杰等(2005)将硫酸盐还原、硫化物氧化、硝酸盐反硝化和有机物降解集成于同一反应器中, 以单质硫、氮气、CO2的形式实现碳、氮、硫的同步去除, 并首次提出了碳、氮、硫共脱除(SR-DSR)工艺的概念.在此基础上, Yuan等(2014)利用硫酸盐还原单元(SR)、反硝化脱硫单元(DSR)和硝化单元(AN)的耦合工艺, 成功处理TOC、SO42--S、NH4+-N容积负荷分别为1.61、1.00、0.55 kg·m-3·d-1的7-ACA制药废水, 最终COD、硫酸盐和氨氮的去除率分别为98%、98%和78%.此外, Wang等(2009)证明了硫酸盐还原、自养反硝化和硝化一体化(SANI)工艺具有处理含盐污水的潜力, 对自配的含盐废水中COD和氮的去除率分别达到95%和74%.总体而言, SR-DSR工艺具有运行成本低、流程短的优点, 但其单质硫转化率低、出水中硫化物浓度较高的短板阻碍了其被进一步应用.
课题组前期研究发现, 在SR-DSR反应器中, 活细菌聚集于颗粒污泥表面, 主要的微生物群落有硫酸盐还原菌(SRB, Desulfomicrobium sp.)、异养菌(Pseudomonas aeruginosa和Sulfurospirillum sp.)和自养反硝化菌属(Paracoccus denitrificans), 并提出Desulfomicrobium sp.是反应器启动的主导微生物(Chen et al., 2008b), 而硝酸盐通过硫氧化反硝化菌(soNRB)反硝化途径反硝化的效能远低于异养反硝化菌的反硝化途径, 从而导致生物硫转化率较低(Chen et al., 2008a).为了解决该工艺生物硫产率较低的问题, 课题组又引入了微氧调控的手段(Xu et al., 2012), 研究发现, 在溶解氧为0.1~0.4 mg·L-1的条件下, 可将生物硫的转化率从原来的30%提高到69%.徐熙俊(2015)从微氧刺激硫氧化细菌的硫化物氧化酶活性的角度揭示了这一现象的机理;此外, 他们发现将反应器从微氧状态切换至厌氧状态后, 由于soNRB等功能微生物的丰富性, S0转化率仍高于原始的厌氧状态(Xu et al., 2018).因此, 微氧是提高SR-DSR工艺中S0转化率的有效手段, 但前期研究中微氧环境的创造方式为在回流槽中(底端)曝气, 即反应器底部为微氧区, 而目前有关微氧区的位置对反应器运行效能、S0转化率和群落结构的影响尚不明确, 有待深入研究.
因此, 本研究利用连续流运行反应器, 采用两种曝气方式(先在回流槽中曝气, 然后切换至反应器反应区上部曝气)为反应器提供不同的微氧区域, 考察和比较反应器运行效能、S0转化率和群落结构的变化.以明确微氧区域对反应器中功能微生物组成和分布及S0转化率的影响, 为SR-DSR工艺设定更合理的曝气方式提供科学依据.
2 材料与方法(Materials and methods)2.1 实验装置本实验采用反应区容积1 L、总有效容积4 L的膨胀颗粒污泥床(EGSB)反应器作为SR-DSR工艺的实验装置, 具体如图 1所示.高压空气瓶作为气源, Vogtlin质量流量计控制曝气量, 两个磨砂曝气头分别放置于回流瓶及反应区上部, 用三通阀控制气路走向.3个取样口将反应器反应区由下至上等分为3个部分, 每个取样口对侧插入一支ORP探头, 用于监测反应器不同条件、不同位置氧化还原电位的变化情况.装置三相分离器出气口连接洗气瓶, 内装有500 mL含有氯化锌的1 mol·L-1的氢氧化钠溶液, 用于吸收及检测反应器气相中硫化物浓度, 洗气瓶后端接有集气袋, 用于收集检测反应中气相物质, 如氮气、氢气和甲烷.
图 1(Fig. 1)
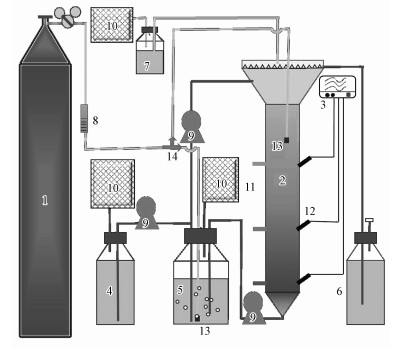 |
| 图 1 微氧强化SR-DSR系统实验装置示意图 (1.高压空气瓶, 2.EGSB反应器, 3.无纸记录仪, 4.进水瓶, 5.汇流瓶, 6.出水瓶, 7.洗气瓶, 8.质量流量计, 9.蠕动泵, 10.气袋, 11.取样口, 12.ORP探头, 13.曝气头, 14.三通阀) Fig. 1Schematic diagram of the SR-DSR reactor |
2.2 反应器的启动与运行反应器的接种污泥来源于哈尔滨文昌污水处理厂二沉池, 浓缩过筛(40目)后进行接种, 接种量为0.5 L, 接种时污泥的生物量为:悬浮物浓度(SS) 35.80 g·L-1、挥发性悬浮物(VSS) 20.94 g·L-1、VSS/SS=0.58.反应器启动及运行的进水均为人工配水, 其主要成分为10.4 mmol·L-1 SO42-、31 mmol·L-1乳酸和8 mmol·L-1 NO3-, 其他营养源为0.22 g·L-1 K2HPO4、0.1 g·L-1 MgCl2和0.1 g·L-1 CaCl2.此外, 在每升进水中添加1 mL微量元素, 以满足微生物的正常生长需求(Chen et al., 2014).
以2.5 mL·min-1·L-1的曝气速率向回流槽中曝气的方式启动反应器, HRT为18 h, 回流比为6:1.待反应器出水中各项指标稳定后, 即为反应器启动成功.保持其他条件不变, 只加大曝气量至5 mL·min-1·L-1, 继续运行至出水成分稳定, 作为实验第1阶段, 而后将曝气头移至反应器反应区上部作为实验第2阶段.期间每2 d测量出水水质, 并在每阶段实验最后一天从3个取样口中留取生物样本, 进行16S rRNA测序.
2.3 分析检测方法2.3.1 常规水质监测项目及方法从出水口取8 mL出水, 在10000 r·min-1下离心3 min, 经0.2 μm水系膜过滤后进行水质检测, 主要的监测指标及方法如表 1所示.由于反应产生的S0主要附着在污泥中, 出水中难以检测, 因此, 本文根据物料平衡理论计算得出S0的转化率(R):
表 1(Table 1)
| 表 1 主要检测指标及方法 Table 1 Components and detection methods | ||||||||||||
表 1 主要检测指标及方法 Table 1 Components and detection methods
| ||||||||||||
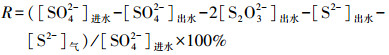 | (1) |
3 结果与讨论(Results and discussion)3.1 曝气位置对反应器运行效能的影响在底部曝气及上部曝气条件下, 反应器中碳、氮、硫的去除率及S0转化率如图 2所示.其中, 碳的转化及去除情况如图 2a所示, 当曝气方式为底部(回流)曝气时, 乳酸盐的去除率为100%, 出水中乙酸盐浓度由16 mmol·L-1逐渐降低并稳定至6.9 mmol·L-1, 出水中丙酸盐浓度由2.5 mmol·L-1逐渐降低并稳定至1.8 mmol·L-1.曝气头切换至反应器反应区上部后, 乙酸盐浓度升高至13 mmol·L-1, 然后逐渐降低并稳定在9.1 mmol·L-1, 丙酸盐浓度逐渐升高并稳定在3.7 mmol·L-1, 乳酸盐浓度经短暂上升后被完全去除.
图 2(Fig. 2)
 |
| 图 2 不同曝气方式下反应器的运行效能 (a.进出水中有机物浓度变化, b.进出水中含氮化合物浓度变化, c.进出水中含硫化合物的变化) Fig. 2Operating efficiency of reactor under different aeration positions (a. organics, b. NO2- and NO3-, c. sulfur-containing material) |
氮的转化及去除情况如图 2b所示, 两种曝气方式下, NO3-的去除率均为100%, 即曝气方式不会对NO3-反硝化造成影响.当曝气方式为底部(回流)曝气时, 反应器运行稳定后出水中的NO2-浓度为0.55 mmol·L-1.而当曝气方式为反应器上部曝气时, NO2-浓度下降并稳定为0.35 mmol·L-1.这可能由于NO2-反硝化为N2的过程比NO3-反硝化为NO2-的过程对氧气更敏感(Xu et al., 2014), 而前期研究中发现反硝化过程主要在反应区底部进行, 因此, 底部曝气产生的NO2-较多, 而以NO2-作为电子受体的DSR过程难以NO3-作为电子受体, 因此, 在反应器中上部的去除量较小, 导致出水中NO2-剩余量较多.相应地, 上部曝气可以减小底部曝气时氧气对反应器下部区域反硝化过程的影响, 同时氧气可促进反应器上部硫化物的氧化, 降低高浓度硫化物对NO2-还原的抑制作用, 从而降低出水中NO2-浓度.
硫的转化及去除情况如图 2c所示, SO42-在SRB作用下以有机物为电子受体还原为S2-, 而NO3-在hNRB作用下的异养反硝化与SRB竞争电子受体, 且hNRB的竞争力更强.S2-在SOB和soNRB的作用下分别以O2和NO3-/NO2-作为电子受体生成S0或SO42-, 微量氧气通过减缓hNRB反硝化, 直接及间接地为soNRB提供更多的电子受体, 提高S0转化率.当曝气方式为底部(回流)曝气时, 反应器运行稳定后SO42-的去除率为90%, 出水中S2-浓度为3.1 mmol·L-1, S0转化率为60%.而当曝气方式为反应器上部曝气时, SO42-的去除率波动下降并最终稳定在84%, 出水中S2-浓度逐渐降低并稳定在2.6 mmol·L-1, S0转化率在曝气方式切换初期有明显下降, 然后恢复至59%.
3.2 不同曝气位置下微生物群落结构特征及其演替规律3.2.1 不同曝气位置下微生物群落丰富度及多样性分析通过对2种曝气位置下6个污泥样品的16S rRNA测序结果进行统计分析, 得到其多样性和丰度指数如表 2所示.可以看出, 转为上部曝气后, 反应器对应部位的Chao指数均有不同程度的减小, 说明上部曝气使得反应器中的微生物群落丰富度降低, 其中上部的Chao指数由547.63减小至449.14, 底部的Chao指数由431.28减小至410.18, 上部Chao指数的变化幅度显高于下部, 说明微氧环境对微生物具有选择性.而将曝气位置切换至上部后, 反应器下部的Shannon指数由3.01减少至2.74(Simpson指数由0.10增大至0.15), 反应器中部这两个指数的变化较小, 上部的Shannon指数由3.05增加至3.45(Simpson指数由0.08减小至0.06), 说明微氧环境可以提高微生物群落的多样性, 厌氧环境切换为微氧环境微生物群落多样性会随之升高, 反之降低.
表 2(Table 2)
| 表 2 微生物多样性指标 Table 2 The diversity indices of bacterial community | |||||||||||||||||||||||||||||||||||||||||
表 2 微生物多样性指标 Table 2 The diversity indices of bacterial community
| |||||||||||||||||||||||||||||||||||||||||
将样本OTU抽平后, 采用weighted-unifrac算法对两种曝气方式下的6个污泥样品进行聚类分析.由图 3可以看出, 上部曝气时, 反应器上部的群落组成与中部和下部产生了明显的区别, 相应地, 改变曝气位置后反应器对应部位的群落也发生明显变化, 且聚类情况与表 2中的多样性指标变化一致, 说明微氧环境对反应器的群落组成具有较大的影响.
图 3(Fig. 3)
 |
| 图 3 不同曝气位置下的样本层级聚类分析 Fig. 3Hierarchical clustering tree on OUT level under different aeration position |
3.2.2 不同曝气位置下微生物群落的组成分析细菌与两种曝气位置条件的共线性关系如图 4所示.两种曝气条件下, 反应器中主要的功能微生物为Desulfomicrobium、Desulfobulbus、Halothiobacillaceae、Sulfurovum、Bacteroidetes_vadin HA17、Comamona、Anaerolineaceae、Anaerovorax和Synergistaceae.其中, Desulfobulbus是以乳酸、乙醇、丙酮酸及其他某些脂肪酸为电子受体及能源物质将硫酸盐还原为硫化物并产生乙酸的不完全氧化型的硫酸盐还原菌(Sorokin et al., 2012).Desulfomicrobium除可以用一些小分子有机酸外还可以利用氢气为电子供体(Hippe et al., 2003; Dias et al., 2008).Halothiobacillaceae是一种利用CO2为碳源, 将硫、硫化物、硫代硫酸盐等氧化为硫酸盐的硫氧化菌属, 代表菌种为Thiovirga sulfuroxydans gen. nov.、Halothiobacillus gen. nov.等(Kelly et al., 2000; Ito et al., 2005).有文献指出, Sulfurovum中的部分种, 如Sulfurovum lithotrophicum gen. nov., sp. nov.能以单质硫、硫化物和硫代硫酸盐作为电子供体, 以硝酸盐作为电子受体进行自养反硝化硫氧化过程(Odintsova et al., 1996; Inagaki et al., 2004).Comamonas中部分种具有异养反硝化菌功能.Bacteroidetes_vadin HA17是一种常见于厌氧发酵产甲烷系统及A/O-BAF缺氧区的发酵细菌(Baldwin et al., 2015; Feng et al., 2016; Ji et al., 2018).
图 4(Fig. 4)
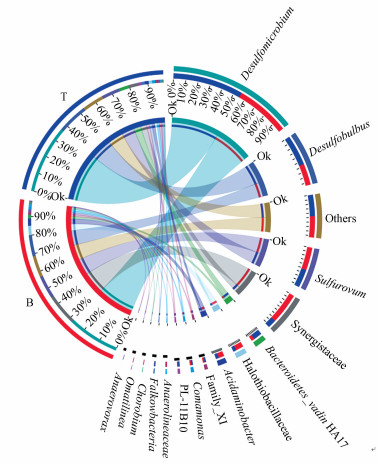 |
| 图 4 两种曝气条件与反应器中细菌种类的共线性 Fig. 4Collinearity between samples and specie(Circos) |
曝气位置由反应器底部切换至上部后, SRB中Desulfomicrobium和Desulfobulbus的丰度分别由28%和12%增加至37%和17%, soNRB中Halothiobacillaceae和Sulfurovum的丰度分别由5.1%和13.0%减小至2.0%和9.9%, 而该条件下出水中的硫酸盐浓度升高, 说明上部曝气由于气体向上运动, 大部分氧气直接将硫化物化学氧化为硫酸盐后出水, 而污泥取样口位于曝气头以下, 接触到的氧气量少于底部曝气时下部取样口的氧气接触量, 因此, 硫酸盐还原菌丰度升高, 硫化物氧化菌丰度降低, SRB丰度的升高也一定程度上解释了上部曝气出水中乙酸盐浓度的升高.Bacteroidetes_vadin HA17和Comamonas的丰度分别由2.0%和1.4%升高至5.5%和1.6%, 这与切换曝气位置后反应器出水中乙酸盐浓度升高而亚硝酸盐浓度降低的现象相一致.由于上部曝气时部分氧气随着回流液至反应器下部, 反应器上部和底部的DO均小于底部曝气时的DO, 使得发酵细菌和异养反硝化菌丰度升高.而hNRB的丰度上升使得反应器中异养反硝化占上风, 这是导致soNRB丰度下降的另一个因素.
3.2.3 曝气位置改变后微生物群落演替分析两种曝气位置条件下, 反应器内与硫、氮、碳转化相关的主要功能微生物在反应器上、中、下部均有分布, 但丰度有一定的差别.从图 5可以看出, 底部曝气的反应器由下至上3个取样口的SRB总丰度依次为37%(16% Desulfobulbus和21% Desulfomicrobium)、53%(5% Desulfobulbus和47% Desulfomicrobium)和30%(13% Desulfobulbus和17% Desulfomicrobium).soNRB总丰度依次为7%(4% Sulfurovum和3% Halothiobacillaceae)、22%(20% Sulfurovum和2% Halothiobacillaceae)和23%(13% Sulfurovum和10% Halothiobacillaceae).hNRB Comamonas丰度依次为0.97%、1.2%和2.0%.在反应器不同高度处都分布有大量的SRB和soNRB, hNRB丰度较低, 因此, 该条件下硫酸盐去除率及单质硫转化率较高.
图 5(Fig. 5)
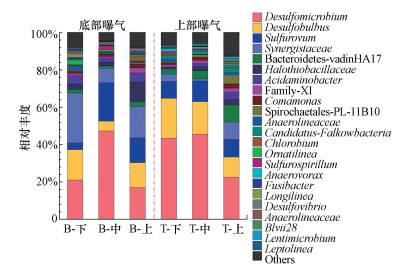 |
| 图 5 属(科)级别的细菌分布 (B:底部曝气;T:上部曝气) Fig. 5Bacteria taxonomic classification of sequences at the genus & family level |
曝气位置切换至上部后, 上部曝气时, 反应器中的氧气部分在上部, 部分经回流液至底部, 微氧区的界限被打破, 反应器底部的DO明显减小, 因此, 由下至上3个取样口的SRB总丰度依次上升为65%(21% Desulfobulbus和44% Desulfomicrobium)、63%(17% Desulfobulbus和46% Desulfomicrobium)和33%(11% Desulfobulbus和22% Desulfomicrobium).同时, DO的降低减弱了DO对hNRB的抑制作用, Comamonas丰度依次上升为0.99%、1.6%和2.3%, 这使得soNRB在竞争硝酸盐过程中处于劣势, 其总丰度依次下降为10%(9% Sulfurovum和1% Halothiobacillaceae)、13%(11% Sulfurovum和2% Halothiobacillaceae)和12%(9% Sulfurovum和3% Halothiobacillaceae).该曝气方式下, 反应区上部SRB相对较少, soNRB相对较多, 且为微氧环境, 大量硫化物被氧化为单质硫甚至过度氧化为硫酸盐, 而硫还原过程相对较少, 使得单质硫转化率没有明显下降, 且水中硫酸盐浓度较高.
该体系中的古菌主要为Methanosaeta、Methanocorpusculum、Methanobacterium和Methanosarcina. Methanosaeta为嗜乙酸型产甲烷菌, 虽然只能以乙酸为唯一碳源, 产生等物质的量的CH4和CO2(Patel a et al., 1990), 但竞争力强于既能利用乙酸又能利用H2和CO2的Methanosarcina(Leahy et al., 2013), 从而在两种曝气方式下均为优势菌(底部曝气时其在古菌中的相对丰度均大于95%, 上部曝气时丰度降低至78%以上), 这与该体系中乙酸浓度较高的现象一致.上部曝气时, 嗜氢型产甲烷菌Methanocorpusculum和Methanobacterium(Wasserfallen, 2000; Nakamura et al., 2013; Sun et al., 2015)的丰度明显升高, 在反应器中由下至上依次由0.3%、3.0%和1.6%升高为14%(11% Methanocorpusculum和3% Methanobacterium)、13%(9% Methanocorpusculum和4% Methanobacterium)和21%(17% Methanocorpusculum和4% Methanobacterium).结合图 5中曝气位置切换至反应器上方后互营菌Synergistaceae的丰度依次由27%、7%和17%下降至4%、1%和9%可知, 嗜乙酸型产甲烷菌丰度的升高及嗜氢型产甲烷菌丰度的下降可能是由于上部曝气时反应器中DO降低, 使得SRB丰度增加, 硫化氢浓度升高, 从而抑制了互营菌的活性, 为嗜氢型产甲烷菌留下更多的氢气, 使得嗜氢型产甲烷菌丰度升高(Xu et al., 2018; 张小元等, 2016).
图 6(Fig. 6)
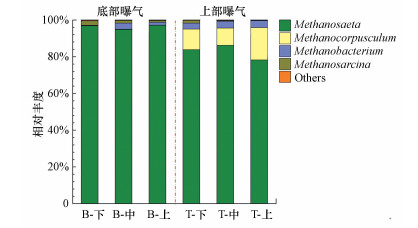 |
| 图 6 属级别的古菌分布 (B:底部曝气;T:上部曝气) Fig. 6Archaea taxonomic classification of sequences at the genus level |
4 结论(Conclusions)1) 底部曝气时, 乳酸盐去除率为100%, 出水中乙酸盐浓度为6.9 mmol·L-1, 丙酸盐浓度为1.8 mmol·L-1, NO3-去除率为100%, 出水中NO2-浓度为0.55 mmol·L-1, SO42-去除率为90%, 出水中S2-浓度为3.1 mmol·L-1, S0转化率为60%.反应器中由下至上, SRB(Desulfobulbus和Desulfomicrobium)总丰度依次为37%、53%和30%, soNRB总丰度依次为7%、22%和23%, hNRB Comamonas丰度依次为0.97%、1.2%和2.0%.
2) 上部曝气时, 乳酸盐去除率为100%, 出水中乙酸盐浓度为9.1 mmol·L-1, 丙酸盐浓度为3.7 mmol·L-1, NO3-去除率为100%, 出水中NO2-浓度为0.35 mmol·L-1, SO42-去除率为84%, 出水中S2-浓度为2.6 mmol·L-1, S0转化率为59%.反应器中由下至上, SRB(Desulfobulbus和Desulfomicrobium)总丰度依次为65%、63%和33%, soNRB(Sulfurovum和Halothiobacillaceae)总丰度依次为10%、13%和12%, hNRB Comamonas丰度依次为0.99%、1.6%和2.3%.
3) 曝气位置由下部切换至上部后, 反应器底部和上部均存在相对减弱的微氧环境, 使得反应器中Desulfomicrobium和Desulfobulbus总丰度分别增加9%和5%, Halothiobacillaceae和Sulfurovum总丰度均减小3.1%, Comamonas总丰度升高0.2%, Synergistaceae丰度减小37%.其中, 反应器底部的SRB和soNRB总丰度分别升高28%和3%, 为SO42-还原和S0转化提供了充分条件, 而反应器上部的微氧环境又减弱了SO42-还原过程, 从而降低了反应器出水中的S2-.与底部曝气相比, 出水中乙酸盐和丙酸盐浓度分别升高2.2和1.9 mmol·L-1, NO2-浓度下降0.15 mmol·L-1, S2-浓度降低0.5 mmol·L-1, SO42-去除率和S0转化率分别下降6%和1%.因此, 在碳源充足的条件下, 可以采取反应器上部曝气的方式创造微氧环境, 既可以保证较高的S0转化率, 又可以减小出水中的S2-和NO2-浓度.
参考文献
| Baldwin S A, Khoshnoodi M, Rezadehbashi M, et al. 2015. The microbial community of a passive biochemical reactor treating arsenic, zinc, and sulfate-rich seepage[J]. Frontiers in Bioengineering & Biotechnology, 3: 27–27. |
| Cadena F, Peters R. 1988. Evaluation of chemical oxidizers for hydrogen-sulfide control[J]. Journal Water Pollution Control Federation, 60(7): 1259–1263. |
| Chen C, Liu L, Lee D J, et al. 2014. Integrated simultaneous desulfurization and denitrification (ISDD) process at various COD/sulfate ratios[J]. Bioresource Technology, 155: 161–169.DOI:10.1016/j.biortech.2013.12.067 |
| Chen C, Ren N Q, Wang A J, et al. 2008a. Simultaneous biological removal of sulfur, nitrogen and carbon using EGSB reactor[J]. Appl Microbiol Biotechnol, 78(6): 1057–1063.DOI:10.1007/s00253-008-1396-3 |
| Chen C, Ren N Q, Wang A J, et al. 2008b. Microbial community of granules in expanded granular sludge bed reactor for simultaneous biological removal of sulfate, nitrate and lactate[J]. Appl Microbiol Biotechnol, 79(6): 1071–1077.DOI:10.1007/s00253-008-1503-5 |
| Chen C, Wang A J, Ren N Q, et al. 2008c. Biological breakdown of denitrifying sulfide removal process in high-rate expanded granular bed reactor[J]. Applied Microbiology and Biotechnology, 81(4): 765–770.DOI:10.1007/s00253-008-1720-y |
| Chen C, Ren N Q, Wang A J, et al. 2010. Enhanced performance of denitrifying sulfide removal process under micro-aerobic condition[J]. Journal of Hazardous Materials, 179(1): 1147–1151. |
| Dias M, Salvado J C, Monperrus M, et al. 2008. Characterization of Desulfomicrobium salsuginis sp. nov. and Desulfomicrobium aestuarii sp. nov., two new sulfate-reducing bacteria isolated from the Adour estuary (French Atlantic coast) with specific mercury methylation potentials[J]. Systematic and Applied Microbiology, 31(1): 30–37.DOI:10.1016/j.syapm.2007.09.002 |
| Ding J, Zhong Q, Zhang S. 2014. Simultaneous removal of NOx and SO2 with H2O2 over Fe based catalysts at low temperature[J]. Rsc Advances, 4(11): 5394–5398.DOI:10.1039/c3ra46418k |
| Feng Y, Li Xing, Yu Y, et al. 2016. Production of unburned calcium silicon filter material (UCSFM) from oyster shell and its performance investigation in an A/O integrated biological aerated filter reactor (A/O-BAF)[J]. Rsc Advances, 6(88): 85324–85332.DOI:10.1039/C6RA16331A |
| Hippe H, Vainshtein M, Gogotova G I, et al. 2003. Reclassification of Desulfobacterium macestii as Desulfomicrobium macestii comb.nov[J]. International Journal of Systematic and Evolutionary Microbiology, 53: 1127–1130.DOI:10.1099/ijs.0.02574-0 |
| Inagaki F, Takai K, Nealson K H, et al. 2004. Sulfurovum lithotrophicum gen.nov., sp nov., a novel sulfur-oxidizing chemolithoautotroph within the epsilon-Proteobacteria isolated from Okinawa trough hydrothermal sediments[J]. International Journal of Systematic and Evolutionary Microbiology, 54: 1477–1482.DOI:10.1099/ijs.0.03042-0 |
| Ito T, Sugita K, Yumoto I, et al. 2005. Thiovirga sulfuroxydans gen.nov., sp nov., a chemolithoautotrophic sulfur-oxidizing bacterium isolated from a microaerobic waste-water biofilm[J]. International Journal of Systematic and Evolutionary Microbiology, 55: 1059–1064.DOI:10.1099/ijs.0.63467-0 |
| Ji Y, Liu P, Conrad R. 2018. Response of fermenting bacterial and methanogenic archaeal communities in paddy soil to progressing rice straw degradation[J]. Soil Biology and Biochemistry, 124: 70–80.DOI:10.1016/j.soilbio.2018.05.029 |
| Kelly D P, Wood A P. 2000. Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen.nov., Halothiobacillus gen.nov and Thermithiobacillus gen.nov[J]. International Journal of Systematic and Evolutionary Microbiology, 50: 511–516.DOI:10.1099/00207713-50-2-511 |
| Leahy S C, Kelly W J, Ronimus R S, et al. 2013. Genome sequencing of rumen bacteria and archaea and its application to methane mitigation strategies[J]. Animal, 7: 235–243.DOI:10.1017/S1751731113000700 |
| Maree J, Strydom W. 1987. Biological sulfate removal from industrial effluent in an upflow packed-bed reactor[J]. Water Research, 21(2): 141–146.DOI:10.1016/0043-1354(87)90042-X |
| Nakamura K, Takahashi A, Mori C, et al. 2013. Methanothermobacter tenebrarum sp.nov., a hydrogenotrophic, thermophilic methanogen isolated from gas-associated formation water of a natural gas field[J]. International Journal of Systematic and Evolutionary Microbiology, 63(2): 715–722. |
| Odintsova E V, Jannasch H W, Mamone J A, et al. 1996. Thermothrix azorensis sp nov, an obligately chemolithoautotrophic, sulfur-oxidizing, thermophilic bacterium[J]. International Journal of Systematic Bacteriology, 46(2): 422–428.DOI:10.1099/00207713-46-2-422 |
| Patel G, Sprott G. 1990. Methanosaeta concilii gen.nov., sp-nov (Methanothrix concilii) and Methanosaeta thermoacetophila nom.rev., comb.nov.[J]. International Journal of Systematic Bacteriology, 40(1): 79–82.DOI:10.1099/00207713-40-1-79 |
| Sorokin D Y, Tourova T P, Panteleeva A N, et al. 2012. Desulfonatronobacter acidivorans gen.nov., sp nov and Desulfobulbus alkaliphilus sp nov., haloalkaliphilic heterotrophic sulfate-reducing bacteria from soda lakes[J]. International Journal of Systematic and Evolutionary Microbiology, 62: 2107–2113.DOI:10.1099/ijs.0.029777-0 |
| Sun R, Zhou A, Jia J, et al. 2015. Characterization of methane production and microbial community shifts during waste activated sludge degradation in microbial electrolysis cells[J]. Bioresource Technology, 175: 68–74.DOI:10.1016/j.biortech.2014.10.052 |
| Wang A J, Du D Z, Ren N Q, et al. 2005. An innovative process of simultaneous desulfurization and denitrification by Thiobacillus denitrificans[J]. Journal of Environmental Science and Health, Part A, 40(10): 1939–1949.DOI:10.1080/10934520500184590 |
| Wang J, Lu H, Chen G, et al. 2009. A novel sulfate reduction, autotrophic denitrification, nitrification integrated (SANI) process for saline wastewater treatment[J]. Water Research, 43: 2363–2372.DOI:10.1016/j.watres.2009.02.037 |
| Wasserfallen A, Nolling J, Pfister, et al. 2000. Phylogenetic analysis of 18 thermophilic Methanobacterium isolates supports the proposals to create a new genus, Methanothermobacter gen.nov., and to reclassify several isolates in three species, Methanothermobacter thermautotrophicus comb.nov., Methanothermobacter wolfeii comb.nov., and Methanothermobacter marburgensis sp nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 50: 43–53.DOI:10.1099/00207713-50-1-43 |
| 王爱杰, 杜大仲, 任南琪. 2004. 脱氮硫杆菌在废水脱硫、脱氮处理工艺中的应用[J]. 哈尔滨:哈尔滨工业大学学报, 2004, 36(4): 423–425. |
| 徐熙俊. 2015.微氧碳氮硫共脱除工艺的运行效能及数学模拟[D].哈尔滨: 哈尔滨工业大学http://cdmd.cnki.com.cn/Article/CDMD-10213-1015957708.htm |
| Xu X J, Chen C, Wang A J. 2012. Enhanced elementary sulfur recovery in integrated sulfate-reducing, sulfur-producing reactor under micro-aerobic condition[J]. Bioresource Technology, 116: 517–521.DOI:10.1016/j.biortech.2012.03.095 |
| Xu S, Han R, Zhang Y, et al. 2018. Differentiated stimulating effects of activated carbon on methanogenic degradation of acetate, propionate and butyrate[J]. Waste Management, 76: 394–403.DOI:10.1016/j.wasman.2018.03.037 |
| Xu X J, Chen C, Wang A J, et al. 2014. Kinetics of nitrate and sulfate removal using a mixed microbial culture with or without limited-oxygen fed[J]. Appl Microbiol Biotechnol, 98(13): 6115–6124.DOI:10.1007/s00253-014-5642-6 |
| Xu X J, Shao B, Chen C, et al. 2018. Response of the reactor performance and microbial community to a shift of ISDD process from micro-aerobic to anoxic condition[J]. Chemosphere, 212: 837–844.DOI:10.1016/j.chemosphere.2018.08.160 |
| Yuan Y, Chen C, Liang B, et al. 2014. Fine-tuning key parameters of an integrated reactor system for the simultaneous removal of COD, sulfate and ammonium and elemental sulfur reclamation[J]. Journal of Hazardous Materials, 269: 56–67.DOI:10.1016/j.jhazmat.2013.12.014 |
| 张小元, 李香真, 李家宝. 2016. 微生物互营产甲烷研究进展[J]. 应用与环境生物学报, 2016, 22(1): 156–166. |
