 , 陈雷1, 姜玉2,3, 高绍博2,4, 李鸣晓2, 许铮1,2, 席北斗2,3,4, 李瑞2
, 陈雷1, 姜玉2,3, 高绍博2,4, 李鸣晓2, 许铮1,2, 席北斗2,3,4, 李瑞2

1. 吉林建筑大学, 市政与环境工程学院, 长春 130118;
2. 中国环境科学研究院, 国家环境保护地下水污染模拟与控制重点实验室, 北京 100012;
3. 上海大学, 环境与化学工程学院, 上海 200444;
4. 中国地质大学(北京), 水资源与环境学院, 北京 100083
收稿日期: 2019-06-25; 修回日期: 2019-08-20; 录用日期: 2019-08-20
基金项目: 国家自然科学基金(No.21606214);国家水体污染控制与治理科技重大专项(No.2018ZX07109-003)
作者简介: 杨予宁(1994-), 女, E-mail:18240062058@163.com
通讯作者(责任作者): 李瑞(1987—), 男, 博士, 助理研究员, 主要从事地下水污染防治、农产品产地环境污染防治等相关技术与政策研究.作为项目/课题负责人先后承担国家自然科学基金青年基金1项、中央公益性科研院所专项1项、中国工程院重大咨询专项1项.在Water Research、Journal of Hazardous Materials、Ecological Engineering等国内外核心期刊上发表论文共17篇, 授权专利8项, 出版专著4部.先后获2016年环保部科学技术一等奖、2017年中国产学研合作创新成果奖.E-mail:lirui01234@yeah.net
摘要: 赤铁矿生物可利用性弱、污染物去除效率低,但因其具有价格低廉、存在广泛的特点而常被用于环境污染治理与修复.本研究通过向赤铁矿生物还原体系中添加硝酸改性后的活性炭,以强化矿石中Fe(Ⅲ)的生物可利用性.同时,以Fe(Ⅲ)还原率与有机物降解率为响应值,通过响应曲面法探究了赤铁矿浓度、有机物浓度与硝酸改性剂浓度对赤铁矿生物可利用性的影响机制.结果表明,硝酸改性活性炭可以提高赤铁矿的生物可利用性,促进有机物的降解,赤铁矿浓度对反应的影响最为显著.生物反应过程的最佳条件为:赤铁矿初始浓度8.35 mmol·L-1、有机物初始浓度13.41 mmol·L-1、硝酸改性剂浓度5.07%.硝酸改性活性炭强化赤铁矿生物体系虽能降解高浓度有机物,但有机物去除效率仅为20%~50%,证明该体系适用于低有机物浓度的水环境.本研究对促进水、土壤环境中有机物的降解具有重要科学意义.
关键词:硝酸改性活性炭赤铁矿生物可利用性效果影响因素
The enhancement and influencing factors of hematite bioavailability by nitric acid modified activated carbon
YANG Yuning1,2
 , CHEN Lei1, JIANG Yu2,3, GAO Shaobo2,4, LI Mingxiao2, XU Zheng1,2, XI Beidou2,3,4, LI Rui2
, CHEN Lei1, JIANG Yu2,3, GAO Shaobo2,4, LI Mingxiao2, XU Zheng1,2, XI Beidou2,3,4, LI Rui2

1. Municipal and Environmental Engineering College, Jilin Jianzhu University, Changchun 130118;
2. State Environmental Protection Key Laboratory of Simulation and Control of Groundwater Pollution, Chinese Research Academy of Environmental Sciences, Beijing 100012;
3. Environmental and Chemical Engineering College, Shanghai University, Shanghai 200444;
4. Water Resources and Environment, China University of Geosciences(Beijing), Beijing 100083
Received 25 June 2019; received in revised from 20 August 2019; accepted 20 August 2019
Abstract: Hematite has weak bioavailability and low efficiency of pollutant removal, but it is widely used for environmental remediation because of its low price. In this study, nitric acid-modified activated carbon was added to the hematite bioreduction system to enhance the bioavailability of Fe(Ⅲ). Based on the Fe(Ⅲ) reduction rate and organic matter degradation rate, the effects of hematite, organic matter and nitric acid modifier concentrations on the bioavailability of hematite was investigated with response surface methodology. The results show that nitric acid-modified activated carbon can improve the bioavailability of hematite and promote the degradation of organic matter, and the concentration of hematite has the most significant effect on the reaction. The optimal conditions for the bioprocess were 8.35 mmol·L-1 of hematitle, 13.41 mmol·L-1 of organic matter, and 5.07% of nitric acid modifier. However, The nitric acid-modified activated carbon only can enhance the high-strength organics removal in the range of 20%~50%, which indicates that the system is suitable for the water environment containing low organic matter. This study has scientific significance for promoting organic matter degradation in water and soil environment.
Keywords: nitric acid modified activated carbonhematitebioavailabilityeffectinfluencing factors
1 引言(Introduction)铁在地壳中的含量排名第四, 且多以赤铁矿(α-Fe2O3)的形式存在, 赤铁矿的生物还原过程可降解地下水(Liang et al., 2009)、垃圾渗滤液中大分子有机物(Li et al., 2018), 氧化土壤和水体中的氨氮(Park et al., 2009; Yang et al., 2012), 分解深水湖泊和深海中的有机物(贡献率分别可达44%和75%)(Roden et al., 2002; Thomsen et al., 2004).赤铁矿具有分布广泛、价格低廉、用途广泛等优势, 因而具有一定的环境修复应用前景(Lovley et al., 1991).相较于弱晶型与无定型Fe(Ⅲ)氧化物(如水铁矿、纤铁矿等), 赤铁矿的晶型结构更强、热力学稳定性更高(Hansel et al., 2004), 因而生物可利用性较弱(Zachara et al., 1998).近年来, 如何强化赤铁矿Fe(Ⅲ)的生物可利用性、进而提高还原态污染物的去除效率, 已逐渐成为研究热点之一.
目前, Fe(Ⅲ)生物还原去除污染物的强化途径包括:①螯合促溶, 但Fe(Ⅱ)的生成对有机质与Fe(Ⅲ)氧化物的络合有抑制作用, 进而影响反应进程(Lovley et al., 1996);②外加定向电场(张景新, 2013), 但此方法能耗大且控制条件严格;③投加氧化还原活性物质, 形成可循环的电子穿梭体, 间接促进微生物与Fe(Ⅲ)氧化物之间的电子传输效率, 提高Fe(Ⅲ)生物可利用性(Hernandez et al., 2001), 这种方法的优势在于绿色、经济、高效、电子穿梭体可循环再利用.例如, 腐殖质(Lovley et al., 1996)和醌类化合物(O′Loughlin, 2008)等水溶性有机质作为氧化还原活性物质, 可加快污染物的降解速率, 缺陷是无法提高降解反应程度;而生物炭(Zhou et al., 2017)和活性炭(AC)(Wu et al., 2017)可同时提高污染物的降解速率和反应程度;此外, 腐殖质和醌类化合物的制备过程往往更繁杂、造价较高, 在环境领域的工程应用前景有限.低浓度生物炭(0.5~1.0 g·L-1)会抑制污染物分解(Xu et al., 2016);与其相比, 相近浓度水平的活性炭可促使水铁矿中20%的Fe(Ⅲ)进一步被微生物利用, 硝酸改性后的活性炭可使水铁矿中Fe(Ⅲ)还原率接近100%(Wu et al., 2017).硝酸改性活性炭对Fe(Ⅲ)氧化物生物可利用性的促进效果较为突出, 且制备工艺简单、成本较低.
硝酸改性活性炭对弱晶型水铁矿的生物可利用性的促进作用与机制已被研究证实, 在硝酸改性剂浓度为60%、水铁矿浓度为10 mmol·L-1、碳源浓度为10 mmol·L-1时水铁矿的还原率接近100%(吴松, 2018), 但这些影响因素仍有待进一步优化分析.此外, 硝酸改性活性炭对强晶型结构如赤铁矿的生物可利用性的促进效果与影响因素仍不明确.基于此, 本研究通过添加硝酸改性活性炭, 强化赤铁矿生物可利用性, 提高有机物降解率;通过响应曲面法探究实验变量(赤铁矿浓度、有机物浓度与硝酸改性剂浓度)对赤铁矿生物可利用性的影响机制, 并分析得出每个影响因素的最佳条件.以期为促进有机物的降解及环境中碳元素的转化调控提供参考.
2 研究材料与方法(Materials and methods)2.1 改性活性炭的制备将活性炭粉末分别加入到33%和66%的硝酸溶液中, 制成10 g·L-1活性炭悬浮液, 并在90 ℃条件下改性2 h.经硝酸改性后得到不同的改性活性炭样本:AC-33(活性炭在33%硝酸中改性2 h)和AC-66(活性炭在66%硝酸中改性2 h).
2.2 微生物培养条件本研究选择腐败希瓦氏菌用于实验, 将腐败希瓦氏菌在营养肉汁琼脂培养基(蛋白胨10 g·L-1, 牛肉浸取物3 g·L-1, 氯化钠5 g·L-1)中培养16 h(150 r·min-1, 30 ℃).通过离心(5000 g, 5 min)收集细胞, 并用厌氧碳酸盐缓冲溶液洗涤, 将洗涤后的细胞重悬于厌氧磷酸盐缓冲液(2×1012 cells·mL-1)中.
厌氧培养过程中厌氧矿物培养基的组成如下:0.6 g·L-1 KH2PO4、0.3 g·L-1 NH4Cl、0.5 g·L-1 MgSO4·7H2O、0.1 g·L-1 CaCl2·2H2O、30 mmol·L-1 NaHCO3, 1 mL维生素溶液, 1 mL微量元素溶液, pH=7.0±0.1.在本研究中, 10~30 mmol·L-1的葡萄糖和10 mmol·L-1的赤铁矿被用作电子供体和电子受体, 用于微生物代谢.
2.3 批实验方案在100 mL血清瓶中进行硝酸改性活性炭强化赤铁矿降解有机物实验, 将10 mmol·L-1赤铁矿加入到40 mL葡萄糖配制的水溶液(pH=7.0), 取2 mL 50 g·L-1 AC或厌氧去离子水分别加入到反应介质中, 然后加入1 mL腐败希瓦氏菌(2×1012 cells·mL-1)或1 mL缺氧水(用于非生物对照实验).将反应体系置于30 ℃、80 r·min-1恒温振荡箱中反应5 d后, 分别取出1 mL矿物细胞悬浮液, 测试液相中的Fe(Ⅱ)和化学需氧量(COD).
2.4 响应曲面法本实验选取赤铁矿浓度、有机物浓度、活性炭改性时的硝酸浓度为优化因素, 分别记为自变量A、B、C.根据相关研究, 结合实际情况及经济因素, 选取3个影响因素的范围分别为:赤铁矿浓度5~15 mmol·L-1, 有机物浓度4~200 mmol·L-1, 活性炭改性时硝酸浓度0~66%(最高浓度), 以Fe(Ⅲ)与COD降解率为响应值, 记为变量Y.采用Design-Expert 10软件中Box-Behnken design(BBD)中心组合设计实验方案, 对考察因素及其水平进行设计, 每个因素有3个水平取值, 并对其进行编码, 其中, 水平编码中-1代表实验设计中各因素的最低取值, 0代表实验设计中各因素的中间取值, 1代表实验设计中各因素的最高取值, 实验因素编码与水平设计见表 1.
表 1(Table 1)
| 表 1 实验值与编码值的对照 Table 1 Comparison of experimental values and coded values | |||||||||||||||||||||||||||
表 1 实验值与编码值的对照 Table 1 Comparison of experimental values and coded values
| |||||||||||||||||||||||||||
通过回归分析, 建立了适合Fe(Ⅲ)还原率与COD降解率响应的最佳数学模型.Fe(Ⅲ)还原率与COD降解率的预测响应Y可用二阶多项式方程(1)表示.
 | (1) |
3 结果与讨论(Results and discussion)3.1 Fe(Ⅲ)还原率及其影响因素分析Fe(Ⅲ)还原率的预测响应Y可用二阶多项式方程(2)表示.方程(2)显示的图形是特定的对应因素构成的三维空间在二维平面上的等高图, 可以直观反映各因素对响应值的影响, 从实验所得的响应面分析图上可以找到它们在反应过程中交互作用的强弱(Rai et al., 2009).本研究中各因素对Fe(Ⅲ)还原率的影响及相关关系如图 1~3所示.可以明显看出, 在硝酸改性活性炭强化赤铁矿降解环境有机物的实验中, Fe(Ⅲ)还原率与COD降解率对实验变量(赤铁矿浓度、有机物浓度和活性炭改性时硝酸浓度)的微小变化很敏感.
图 1(Fig. 1)
 |
| 图 1 赤铁矿浓度、有机物浓度与Fe(Ⅲ)还原率互动效应图 Fig. 1Interactive effect of hematite concentration, organic matter concentration and Fe(Ⅲ) reduction rate |
图 2(Fig. 2)
 |
| 图 2 赤铁矿浓度、硝酸浓度与Fe(Ⅲ)还原率互动效应图 Fig. 2Interaction effect between hematite concentration, nitric acid concentration and Fe(Ⅲ) reduction rate |
图 3(Fig. 3)
 |
| 图 3 硝酸浓度、有机物浓度与Fe(Ⅲ)还原率互动效应图 Fig. 3Interaction effect between nitric acid concentration, organic matter concentration and Fe(Ⅲ) reduction rate |
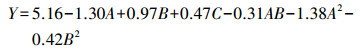 | (2) |
此外, 有机物浓度对Fe(Ⅲ)还原率的影响也是显著的, 在赤铁矿浓度一定时, 随着有机物浓度的上升, 赤铁矿中Fe(Ⅲ)还原率呈现一定幅度的上升.孙丽蓉(2007)利用不同有机物(葡萄糖、淀粉、纤维素)浓度验证了赤铁矿中Fe(Ⅲ)的还原效果, 结果为溶液中有机物浓度越大, Fe(Ⅱ)累积越快, 与本研究结论一致.这可能是有机物作为赤铁矿生物还原反应的电子供体, 参与了赤铁矿生物还原反应, 促进了该反应的电子转移, 进而提高了赤铁矿中Fe(Ⅲ)还原率.
图 2为赤铁矿浓度、硝酸浓度与Fe(Ⅲ)还原率互动效应的3D响应曲面及3D等高线图.从图 2可以看出, 赤铁矿浓度与赤铁矿改性时的硝酸浓度交互作用不明显.在赤铁矿浓度一定时, Fe(Ⅲ)还原率随着硝酸改性剂浓度的增加有一定程度的上升.当硝酸浓度为0时, Fe(Ⅲ)还原率为4.31%;当硝酸浓度为66%时, Fe(Ⅲ)还原率为5.73%.这可能是因为活性炭经硝酸改性后, 表面含氧官能团数量增加, 且含氧官能团随着硝酸浓度的增加而大幅度升高(侯方等, 2011), 促进了赤铁矿与微生物的电子转移, 进而提高了Fe(Ⅲ)还原率(Wu et al., 2017).在硝酸浓度一定时, Fe(Ⅲ)还原率随着赤铁矿浓度的上升大幅度降低, 这说明赤铁矿浓度与硝酸改性剂浓度对Fe(Ⅲ)还原率的影响是显著的.
图 3为硝酸浓度、有机物浓度与Fe(Ⅲ)还原率互动效应的3D响应曲面及3D等高线图.从图 3可以看出, 有机物浓度与硝酸改性剂浓度的交互作用不显著.在有机物浓度一定时, Fe(Ⅲ)还原率随着硝酸改性剂浓度的增加而有一定程度的上升.在硝酸浓度一定时, Fe(Ⅲ)还原率随着有机物浓度的提高而上升, 但两者均小于赤铁矿浓度对Fe(Ⅲ)还原率的影响程度.
3.2 有机物降解率及其影响因素分析COD降解率的预测响应Y可用二阶多项式方程(3)表示.方程(3)显示的各因素对COD降解率的影响及相关关系如图 4~6所示, COD降解率对实验变量(赤铁矿浓度、有机污染物浓度和活性炭改性时的硝酸浓度)的微小变化很敏感.
图 4(Fig. 4)
 |
| 图 4 赤铁矿浓度、有机物浓度与COD降解率互动效应图 Fig. 4Interaction effect of hematite concentration, organic matter concentration and COD degradation rate |
图 5(Fig. 5)
 |
| 图 5 赤铁矿浓度、硝酸改性剂浓度与COD降解率互动效应图 Fig. 5Interactive effect diagram of hematite concentration, nitric acid modifier concentration and COD degradation rate |
图 6(Fig. 6)
 |
| 图 6 硝酸改性剂浓度、有机物浓度与COD降解率互动效应图 Fig. 6Interaction effect between nitric acid modifier concentration, organic matter concentration and COD degradation rate |
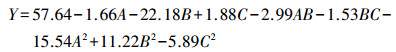 | (3) |
有机物浓度对COD降解率的影响也是显著的, 有机物浓度越高, COD降解率越低, 当有机物浓度为4 mmol·L-1时, COD降解率为77.2%, 当有机物浓度为200 mmol·L-1时, COD降解率为27.86%.这可能是因为高浓度有机物负荷抑制了微生物活性(李敬杰, 2012), 生物反应周期变长, 在反应体系内, 功能微生物驱动赤铁矿还原有机物的能力有限, 即微生物利用有机物作为碳源时, 微生物新生代谢能力有限, 过高的COD超过了微生物降解有机物的能力, 从而导致反应周期较长, 有机物生物降解不完全(姜玉, 2017).
图 5为赤铁矿浓度、硝酸改性剂浓度与COD降解率互动效应的3D响应曲面及3D等高线图.从图 5可以看出, 赤铁矿浓度与硝酸改性剂浓度的交互作用不明显.在赤铁矿浓度一定时, 随着硝酸改性剂浓度增加, Fe(Ⅲ)还原率先有一定程度的上升后缓慢下降, 当硝酸浓度为0时, COD降解率为82.1%, 当硝酸浓度为40%时, COD降解率达到最大值91.47%.这可能是因为经硝酸改性后的活性炭表面含氧官能团数量增加, 促进赤铁矿与微生物的电子转移, 提高了赤铁矿还原程度(Wu et al., 2017), 进而提高了COD降解率.此外, 贾建国等(2009)研究得出, 低浓度硝酸改性活性炭尽管比表面积与孔径变化不大, 但高浓度硝酸改性会增加表面含氧官能团, 导致部分微孔堵塞, 阻碍氮气的扩散, 使活表面微孔塌陷, 导致比表面积降低.因此, 活性炭经高浓度硝酸改性后吸附性能存在很大差距, 浓硝酸对活性炭进行改性会基本丧失其吸附性能, 降低COD吸附去除率, 进而降低COD降解率(范延臻等, 2001).在硝酸浓度一定时, 随着赤铁矿浓度的上升, COD降解率先升高后降低, 说明赤铁矿浓度与硝酸改性剂浓度对COD降解率的影响是显著的.
图 6为硝酸改性剂浓度、有机物浓度与COD降解率互动效应的3D响应曲面及3D等高线图.从图 6可以看出, 赤铁矿浓度与赤铁矿改性时的硝酸浓度的交互作用显著.在有机物浓度一定时, 随着硝酸改性剂浓度的增加, COD降解率先出现一定程度的上升后有少许下降.在硝酸浓度一定时, 随着有机物浓度的上升, COD降解率先大幅度降低后趋于平缓, 说明该体系虽对高浓度有机物有一定的降解能力, 但能力较小, 因此, 仅适用于有机物浓度较低的受污染水体.
3.3 强化生物反应条件的优化与确定通过响应面模型得出, 在硝酸改性活性炭强化赤铁矿降解有机物实验中, 最佳实验条件为赤铁矿浓度8.35 mmol·L-1、有机物浓度13.41 mmol·L-1、活性炭改性时硝酸浓度5.07%, 预测结果中Fe(Ⅲ)还原率为3.65%, COD降解率为77.73%.为确保预测结果不偏离实际值, 选择赤铁矿浓度8.3 mmol·L-1、有机物浓度13.4 mmol·L-1、活性炭改性时硝酸浓度5%进行验证实验, 此条件下Fe(Ⅲ)还原率为3.46%, COD降解率为78.12%, 实验值与预测值相差较小, 证明响应面模型足以反映预期, 并且优化结果较为满意.
通过优化结果得出在降解COD时, 活性炭改性时浓度应选择为5%;当硝酸改性活性炭添加浓度为1 g·L-1时, 改性活性炭与赤铁矿的最佳投加比例为1:0.67.硝酸改性活性炭-赤铁矿体系适宜的有机物浓度约为13 mmol·L-1, 证明该体系仅适用于地下水等低有机物浓度污水的处理应用.
4 结论(Conclusions)1) 不同浓度硝酸改性后的活性炭均可强化赤铁矿的生物可利用性, 进而提高有机物降解率.随着硝酸改性剂浓度的升高, 赤铁矿的生物可利用性促进效果越好, 当硝酸改性剂浓度为66%时, Fe(Ⅲ)还原率为6.15%;而COD降解率在硝酸改性剂浓度为40%时较好, 为91.47%.
2) 利用响应曲面分析法分析影响因素的结果表明, 赤铁矿浓度、有机物浓度、硝酸改性剂浓度对Fe(Ⅲ)还原率与COD降解率的影响并不是简单的线性关系.生物强化反应的最佳条件为:赤铁矿浓度8.35 mmol·L-1、有机物浓度13.41 mmol·L-1、硝酸改性剂浓度为5.07%, 并预测该实验条件下Fe(Ⅲ)还原率为3.65%, COD降解率为77.73%.
3) 通过优化结果得出在降解COD时, 硝酸改性剂浓度宜采用5%, 硝酸改性活性炭-赤铁矿的投加量比例为1:0.67.
参考文献
| Bonneville S, Cappellen P V, Behrends T. 2004. Microbial reduction of iron(Ⅲ) oxyhydroxides:effects of mineral solubility and availability[J]. Chemical Geology, 212: 255–268.DOI:10.1016/j.chemgeo.2004.08.015 |
| Chun L C, Penn R L, Arnold W A. 2006. Kinetic and microscopic studies of reductive transformations of organic contaminants on goethite[J]. Environmental Science & Technology, 40(10): 3299–3304. |
| Elsner M, Haderlein S B, Kellerhals T, et al. 2004. Mechanisms and products of surface-mediated reductive dehalogenation of carbon tetrachloride by Fe(Ⅱ) on goethite[J]. Environmental Science & Technology, 38(7): 2058–2066. |
| Fasiska E J. 1967. Structural aspects of the oxides and hydroxides of iron[J]. Corrosion Science, 7: 833–839.DOI:10.1016/S0010-938X(67)80116-1 |
| 范延臻, 王宝贞, 王琳, 等. 2001. 改性活性炭对有机物的吸附性能[J]. 环境化学, 2001, 20(5): 444–448.DOI:10.3321/j.issn:0254-6108.2001.05.005 |
| Hernandez M, Newman D. 2001. Extracellular electron transfer[J]. Cellular and Molecular Life Sciences, 58(11): 1562–1571.DOI:10.1007/PL00000796 |
| 侯方, 陈明, 佟明友. 2011. 硝酸处理对活性炭性质的影响[J]. 化学与生物工程, 2011, 28(5): 70–73+76.DOI:10.3969/j.issn.1672-5425.2011.05.018 |
| 姜玉.2017.垃圾渗滤液污染地下水原位厌氧生物氧化修复技术研究[D].长春: 吉林建筑大学http://cdmd.cnki.com.cn/Article/CDMD-10191-1017186387.htm |
| Li R, Jiang Y, Xi B, et al. 2018. Raw hematite based Fe(Ⅲ) bio-reduction process for humified landfill leachate treatment[J]. Journal of Hazardous Materials, 355: 10–16.DOI:10.1016/j.jhazmat.2018.05.002 |
| Liang T, Zhou S, Li F. 2009. Interactive reaction of polychlorinated compound dechlorinating transformation at the soil interface[J]. Progress in Chemistry, 21(4): 1262–1263. |
| Lovley D R, Phillips E J, Lonergan D J. 1991. Enzymic versus nonenzymic mechanisms for iron(Ⅲ) reduction in aquatic sediments[J]. Environmental Science & Technology, 25(6): 1062–1067. |
| Lovley D R, Woodward J C. 1996. Mechanisms for chelator stimulation of microbial Fe(Ⅲ)-oxide reduction[J]. Chemical Geology, 132(1/4): 19–24. |
| Lovley D R, Woodward J C, Chapelle F H. 1996. Rapid anaerobic benzene oxidation with a variety of chelated Fe(Ⅲ) forms[J]. Applied and Environmental Microbiology, 62(1): 288–291. |
| 李敬杰.2012.微生物异化还原Fe(Ⅲ)耦合氧化BTEX研究[D].长春: 吉林大学http://cdmd.cnki.com.cn/Article/CDMD-10183-1012367656.htm |
| O'Loughlin E J. 2008. Effects of electron transfer mediators on the bioreduction of lepidocrocite(γ-FeOOH) by Shewanella putrefaciens CN32[J]. Environmental Science & Technology, 42(18): 6876–6882. |
| Park W, Nam Y K, Lee M J., et al. 2009. Anaerobic ammonia-oxidation coupled with Fe3+ reduction by an anaerobic culture from a piggery wastewater acclimated to NH4+/Fe3+ medium[J]. Biotechnology and Bioprocess Engineering, 14(5): 680–685.DOI:10.1007/s12257-009-0026-y |
| Roden E E, Wetzel R G. 2002. Kinetics of microbial Fe(Ⅲ) oxide reduction in freshwater wetland sediments[J]. Limnology and Oceanography, 47(1): 198–211.DOI:10.4319/lo.2002.47.1.0198 |
| Rai S K, Konwarh R, Mukherjee A K. 2009. Purification, characterization and biotechnological application of an alkaline β-keratinase produced by Bacillus subtilis RM-01 in solid-state fermentation using chicken-feather as substrate[J]. Biochemical Engineering Journal, 45(3): 218–225.DOI:10.1016/j.bej.2009.04.001 |
| Stumm W, Sigg L, Sulzberger B. 1992. Chmistry of the solid-water interface:processes at the mineral-water and particle-water interface in natural systems[J]. Soil Science, 156(3): 205–207. |
| 孙丽蓉.2017.水稻土中异化铁还原过程及其影响因素研究[D].杨凌: 西北农林科技大学http://cdmd.cnki.com.cn/Article/CDMD-10712-2007189314.htm |
| Thomsen U, Thamdrup B, Stahl D A, et al. 2004. Pathways of organic carbon oxidation in a deep lacustrine sediment, Lake Michigan[J]. Limnology and Oceanography, 49(6): 2046–2057.DOI:10.4319/lo.2004.49.6.2046 |
| Wu S, Fang G, Wang Y, et al. 2017. Redox-active oxygen-containing functional groups in activated carbon facilitate microbial reduction of ferrihydrite[J]. Environmental Science & Technology, 51(17): 9709–9717. |
| Xu S, Adhikari D, Huang R, et al. 2016. Biochar-facilitated microbial reduction of hematite[J]. Environmental Science & Technology, 50(5): 2389–2395. |
| Yang W H, Weber K A, Silver W L. 2012. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 5(8): 538–541.DOI:10.1038/ngeo1530 |
| Zachara J M, Fredrickson J K, Li S, et al. 1998. Bacterial reduction of crystalline Fe3+ oxides in single phase suspensions and subsurface materials[J]. American Mineralogist, 83(11): 1426–1443. |
| Zhou G W, Yang X R, Marshall C W, et al. 2017. Biochar addition increases the rates of dissimilatory iron reduction and methanogenesis in ferrihydrite enrichments[J]. Frontiers in Microbiology, 8: 1–14. |
| 张景新.2013.铁强化微生物-电催化厌氧污水处理技术的研究[D].大连: 大连理工大学http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2501827 |
