
 , 陈燕飞1, 仪慧兰2, 乔宏萍1, 赵文婧1
, 陈燕飞1, 仪慧兰2, 乔宏萍1, 赵文婧11. 太原师范学院生物系, 晋中 030619;
2. 山西大学生命科学学院, 太原 030006
收稿日期: 2019-02-24; 修回日期: 2019-05-06; 录用日期: 2019-05-06
基金项目: 国家自然科学基金(No.21307087);山西省应用基础研究计划项目(No.201601D021104)
作者简介: 吴丽华(1981-), 女, 副教授(博士), E-mail:wlh1981622_510@163.com
通讯作者(责任作者): 吴丽华(1981—), 女, 博士, 副教授, 主要从事环境毒理学方面的研究.主持国家级和省部级研究课题共3项, 发表学术论文近20篇, 出版学术著作1部
摘要: 以模式生物酵母为材料,研究了不同浓度硫酸锌对酵母细胞的致死效应,以及活性氧(ROS)在硫酸锌诱导酵母凋亡中的作用.结果显示,低浓度处理组中,酵母细胞的相对生长率、超氧化物歧化酶活性和总抗氧化能力升高,超氧化物歧化酶相关基因SOD1和SOD2表达增强,而细胞存活率和MDA含量无明显变化.高浓度(3和5 mmol·L-1)处理组中,野生株酵母超氧化物歧化酶活性和总抗氧化能力明显下降,SOD1和SOD2基因表达受到明显抑制,胞内ROS水平和MDA含量升高,细胞死亡率显著上升;在相同锌处理组中,突变体ΔSOD1对硫酸锌的耐受性明显差于野生株BY4741,ΔSOD1胞内ROS水平和细胞凋亡率显著高于野生株,而ΔSOD2与野生株间无显著差异.结果表明,低浓度硫酸锌可促进酵母细胞生长,可能诱导了酵母细胞生长的Hormesis效应;高浓度硫酸锌可引起酵母细胞氧化损伤,而锌胁迫诱导的胞内ROS水平升高是酵母细胞死亡的一个诱因.该研究结果可为锌化物的毒性作用及其健康风险评估提供理论依据.
关键词:硫酸锌酵母凋亡活性氧超氧化物歧化酶
Oxidative stress contributes to zinc sulfate-induced cell death in yeast
WU Lihua1

 , CHEN Yanfei1, YI Huilan2, QIAO Hongping1, ZHAO Wenjing1
, CHEN Yanfei1, YI Huilan2, QIAO Hongping1, ZHAO Wenjing1 1. Department of Biology, Taiyuan Normal University, Jinzhong 030619;
2. School of Life Science, Shanxi University, Taiyuan 030006
Received 24 February 2019; received in revised from 6 May 2019; accepted 6 May 2019
Abstract: In this study,yeast was used as a model organism to understand the lethal effects of zinc sulfate at various concentrations on the cells and to investigate the role of reactive oxygen species (ROS) in zinc sulfate-induced apoptosis. The results showed that the low concentration treatment groups exhibited an increase in the relative growth rate,superoxide dismutase activity,and the total antioxidant capacity. Additionally,the expression of superoxide dismutase genes,SOD1 and SOD2,was enhanced,whereas cell viability and malondialdehyde (MDA) content did not change significantly. In the high concentration (3 and 5 mmol·L-1) treatment groups,the superoxide dismutase activity and the total antioxidant capacity of the wild-type yeast significantly decreased. Besides,the expression of SOD1 and SOD2 genes was significantly inhibited,and the levels of intracellular ROS and MDA were elevated. Additionally,the cell mortality rate increased significantly. In the same treatment groups,the tolerance of the ΔSOD1 mutant towards zinc sulfate was significantly lower than that of the BY4741 wild-type strain. The intracellular ROS levels and cell mortality of the ΔSOD1 mutant were particularly higher than those of the wild-type strain. However,no remarkable difference was noted between the ΔSOD2 mutant and the wild-type strain. Thus,the results demonstrated that zinc sulfate at low concentrations could induce a hermetic effect on yeast cell growth,whereas high concentrations of zinc sulfate could lead to oxidative damage in yeast cells,and zinc sulfate-induced intracellular ROS elevation is one of the contributors to yeast cell death. The information discussed above provides evidence for assessing the toxic effects and health risk estimation of zinc in the environment.
Keywords: zinc sulfateyeastapoptosisreactive oxygen speciessuperoxide dismutase
1 引言(Introduction)锌是生物维持正常生理功能必需的微量营养元素之一(Zhao et al., 2012), 在细胞代谢网络的转录调控中发挥着重要作用(MacPherson et al., 2006).近年来, 由于锌化物在日常护理用品、抗菌药物及生物医学等领域(Sruthi et al., 2016)的广泛使用, 导致中国很多河流及土壤中锌含量严重超标(王权等, 2012; 梁雅雅等, 2019), 如浙江师范大学周边某水体底泥风干后锌含量为187.52 mg · kg-1(乔云蕾等, 2016);云南某矿区土壤锌含量平均值高达38178 mg · kg-1, 比《土壤环境质量标准》的三级标准高75倍(肖青青等, 2009).环境中高浓度锌可改变细胞周期相关基因表达, 抑制植物生长, 引起细胞氧化损伤和遗传损伤(Barrameda-Medina et al., 2014; Zhang et al., 2017;Khan et al., 2019; Sun et al., 2019).动物研究表明, 高浓度锌可损伤动物脏器, 抑制体重的正常增长, 引起机体氧化损伤(Piao et al., 2003; Wang et al., 2017).
活性氧(Reactive oxygen species, ROS)是生物体内重要的信号分子之一, 过量ROS可引发生物大分子氧化损伤, 导致细胞代谢功能紊乱(Ryter et al., 2007; Wang et al., 2017);并引起DNA损伤, 诱导微核生成, 甚至导致细胞死亡(Lin et al., 2009; Wu et al., 2010).本课题组前期研究发现, 高浓度锌可使蚕豆根尖胞内ROS水平显著升高, 诱发细胞遗传损伤, 而抗氧化剂可在一定程度上缓解硫酸锌引起的遗传损伤(吴丽华等, 2015).
现有研究表明, 锌缺乏在一定程度上可导致糖尿病的发生, 而糖尿病患者可通过补充锌制剂缓解糖尿病症状并减少糖尿病并发症的发生(Ruz et al., 2013; Li et al., 2014; Liang et al., 2015).然而, 长期暴露于高浓度硫酸锌可引起人体腹痛、恶心、铜缺乏症等疾病的发生, 甚至死亡(Plum et al., 2010;Motooka et al., 2016).在酵母细胞中, 锌缺乏可引起胞内ROS升高(Wu et al., 2007);培养基中添加一定浓度的锌(0.03 g · L-1 Zn2+, 约0.46 mmol · L-1)可显著降低外界胁迫引起的酵母胞内ROS水平的升高(Wan et al., 2015).但高浓度硫酸锌对酵母细胞的毒性作用尚不清楚.因此, 本实验选用模式生物酵母为研究材料, 探讨硫酸锌的毒性作用, 以期为锌化物的毒性作用机制及其健康风险评估提供实验依据.
2 材料与方法(Materials and methods)2.1 实验材料酵母菌(Saccharomyces cerevisiae)野生株BY4741(MATa; his3Δ1;leu2Δ0;met15Δ0;ura3Δ0)及其突变体ΔSOD1(sod1::KanMX4)、ΔSOD2(sod2::KanMX4)购自Invitrogen公司.
2.2 酵母细胞活化挑取酵母细胞单菌落接种于YPD(Yeast Extract Peptone Dextrose)液体培养基中, 28 ℃、180 r · min-1下恒温振荡培养至对数期后, 用于毒性实验.
2.3 药物处理及细胞相对生长率检测取适量对数期酵母细胞接种于含不同浓度ZnSO4的YPD培养液中, 将各处理组培养液初始OD600调整在0.05左右, 恒温振荡培养24 h后, 以培养液OD600为主要指标, 计算出生长完全抑制浓度为10 mmo · L-1;而0.46 mmol · L-1的Zn2+可以提高酵母细胞的抗氧化能力(Wan et al., 2015).因此, 本实验设置处理浓度分别为0.05、0.1、0.5、1、3、5和10 mmol · L-1, 对照组为YPD培养基.
酵母细胞经染毒培养24 h后, 检测细胞相对生长率、超氧化物歧化酶(SOD)活性和总抗氧化能力(T-AOC)、SOD1和SOD2基因相对表达量、ROS水平、MDA含量和细胞凋亡率.所有实验均设置3次重复.
2.4 细胞相对存活率检测将相同数量的对数期细胞涂布至含有不同浓度硫酸锌的平板上, 使每个平板含有细胞数约200个, 28 ℃恒温培养48 h后, 观察计数, 并计算细胞相对存活率(处理组单菌落数/对照组单菌落数×100%).检测时间效应时, 取对数期细胞接种至含有硫酸锌的YPD液体培养基中, 培养一定时间后, 取相同数量的酵母细胞涂布至YPD平板中, 48 h后计数并计算(Zheng et al., 2007).
2.5 细胞耐受性检测收集并洗涤对数期细胞, 用无菌磷酸盐缓冲溶液(PBS)将细胞悬液调整至OD600为2;然后用PBS将菌液以10倍梯度逐级稀释, 每个梯度取5 μL并依次点样至固体培养基上(浓度由高到低);28 ℃恒温培养48 h后观察并拍照.
2.6 ROS水平、T-SOD、T-AOC和MDA含量检测MDA含量检测参照潘军航(2005)的方法;T-SOD、T-AOC和胞内ROS检测参照吴丽华等(2016)的方法.
2.7 细胞凋亡检测收集酵母细胞并用PBS洗涤, 用适量异硫氰酸荧光素标记的膜联蛋白V(Fluorescein Isothiocyanate-labeled Annexin V, Annexin V-FITC)结合液重悬细胞后加入Annexin V-FITC和碘化丙啶(Propidium Iodide, PI)染液, 混匀, 室温避光孵育20 min后, 流式细胞仪检测细胞凋亡率.每个样品的细胞数不少于50000个.
2.8 qRT-PCR检测采用Lyticase酶将酵母细胞去壁后, 用植物总RNA提取试剂盒(天根)提取酵母细胞总RNA, 以oligo dT为引物反转录合成cDNA.参照qRT-PCR试剂说明建立20 μL反应体系, 用ABI StepOne Plus对靶基因进行基因扩增, 并采用2-ΔΔCt法计算每个靶基因的相对表达量(Livak et al., 2001).其中, ACT1作为内参, 引物序列见表 1.
表 1(Table 1)
| 表 1 qRT-PCR引物 Table 1 Primer sequences for qRT-PCR reactions | ||||||||||||
表 1 qRT-PCR引物 Table 1 Primer sequences for qRT-PCR reactions
| ||||||||||||
2.9 数据统计分析采用SPSS 18.0对结果进行统计分析, 处理组与对照组间的差异显著性用“*”表示(*p < 0.05, **p < 0.01).
3 结果(Results)3.1 硫酸锌对酵母细胞生长的影响从图 1可以看出, 较高浓度(1~10 mmol · L-1)的硫酸锌可抑制酵母细胞生长, 且随着浓度的升高, 细胞相对生长率逐渐降低;较低浓度(0.05~0.5 mmol · L-1)的硫酸锌可促进酵母细胞生长, 0.5 mmol · L-1处理组中细胞生长率显著高于对照组, 为对照组的108.75%.从这种高浓度抑制、低浓度促进的现象推测硫酸锌对酵母细胞的生长可能存在Hormesis效应.
图 1(Fig. 1)
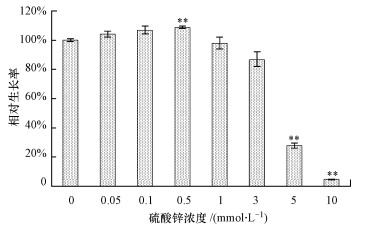 |
| 图 1 硫酸锌对酵母细胞生长的影响 Fig. 1Effect of zinc sulfate on the cell growth in yeast cells |
3.2 硫酸锌对酵母细胞相对存活率的影响由图 2可知, 随着硫酸锌浓度的升高, 酵母细胞相对存活率逐渐下降(图 2a).在3~10 mmol · L-1处理组中, 细胞相对存活率显著低于对照组, 在10 mmol · L-1处理组中, 细胞存活率仅为7.71%.酵母细胞经5 mmol · L-1硫酸锌胁迫3 h后, 酵母细胞相对存活率为94.75%, 与对照组间无显著差异(图 2b);胁迫12 h和24 h后, 相对存活率显著低于对照组.结果表明, 硫酸锌可抑制酵母细胞分裂和生长, 诱导细胞死亡, 且具有剂量和时间依赖性.
图 2(Fig. 2)
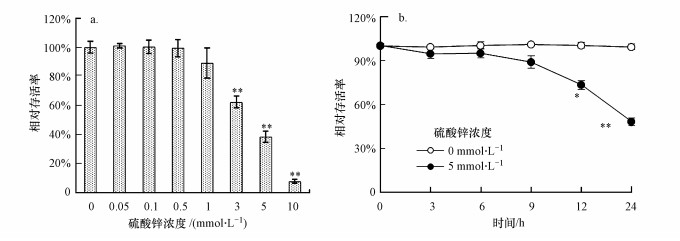 |
| 图 2 硫酸锌对酵母细胞相对存活率的影响 Fig. 2Effect of zinc sulfate on the clonogenic survival rate in yeast cells |
3.3 硫酸锌对酵母细胞氧化损伤效应酵母细胞经硫酸锌胁迫24 h后, 随着浓度的升高, MDA含量(以鲜重计)逐渐升高, 5 mmol · L-1锌处理组中MDA含量为对照组的2倍(图 3a).T-SOD活性(以蛋白计)和T-AOC(以蛋白计)呈先升高后降低趋势, 在0.5和1 mmol · L-1锌处理组中均显著升高;3和5 mmol · L-1锌处理组中T-SOD活性和T-AOC均低于对照组(图 3b和3c).结果表明, 低浓度锌可激活酵母细胞内的抗氧化防御系统, 而高浓度硫酸锌抑制了酵母细胞的抗氧化能力, 破坏了细胞氧化/还原平衡, 从而引起细胞氧化损伤.
图 3(Fig. 3)
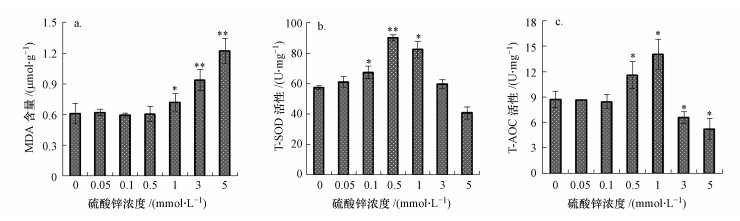 |
| 图 3 硫酸锌对酵母细胞MDA含量(a)、T-SOD活性(b)和T-AOC (c)的影响 Fig. 3Effects of zinc sulfate on MDA content(a), T-SOD activity(b) and T-AOC(c) in yeast cells |
3.4 硫酸锌对酵母细胞SOD1和SOD2基因表达的影响酵母细胞经硫酸锌胁迫24 h后, SOD1和SOD2基因表达水平随硫酸锌浓度的升高呈现先升高后降低的趋势(图 4).从图中可以看出, 在0.5 mmol · L-1锌处理组中, SOD1和SOD2基因相对表达量分别为对照组的1.51和1.25倍;5 mmol · L-1锌处理组中, SOD1和SOD2基因相对表达量分别为对照组的64.34%和9.63%.此结果与酵母细胞T-SOD活性结果一致(图 3b), 说明硫酸锌可改变超氧化物歧化酶基因表达, 进而影响酶活性.
图 4(Fig. 4)
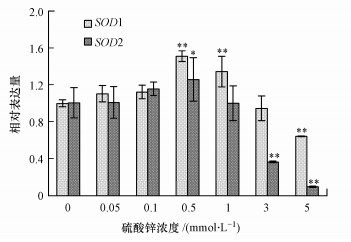 |
| 图 4 硫酸锌对酵母细胞超氧化物歧化酶基因表达的影响 Fig. 4Effects of zinc sulfate on the gene expression of superoxide dismutase in yeast cells |
3.5 硫酸锌胁迫下野生株BY4741与ΔSOD1、ΔSOD2突变株耐受性研究如图 5所示, 在不含硫酸锌的培养基中, 野生株与突变株生长状况无明显差异, 均在稀释倍数为104时生长状况良好.在3 mmol · L-1处理组中, ΔSOD1突变株生长状况显著差于野生株BY4741, 仅在稀释倍数为100处长出浓密的菌斑, 说明ΔSOD1突变株对硫酸锌的敏感性较高.在5 mmol · L-1处理组中, 所有菌株的生长状况都明显差于对照组.因此, 后续实验中选取3 mmol · L-1作为硫酸锌处理浓度.
图 5(Fig. 5)
 |
| 图 5 BY4741与ΔSOD1、ΔSOD2对硫酸锌的耐受性分析 Fig. 5Evaluation of the zinc sulfate tolerance of yeast strains BY4741, ΔSOD1 and ΔSOD2 |
3.6 ROS参与硫酸锌诱导的酵母细胞凋亡采用DCFH-DA荧光探针标记, 检测酵母胞内ROS水平时发现, 酵母细胞经3 mmol · L-1硫酸锌处理24 h后, 野生株BY4741、突变株ΔSOD1和ΔSOD2胞内荧光强度分别为对照组的2.38、4.98和2.15倍, 而ΔSOD1突变株胞内ROS水平显著高于野生株BY4741(图 6a).同时, 采用Annexin V/PI双染法检测细胞凋亡, 发现硫酸锌可诱导酵母细胞早期凋亡率显著升高, 且ΔSOD1突变株早期凋亡率为野生株BY4741的3.55倍, 与野生株间具有显著差异(图 6b);而ΔSOD2突变株与野生株间胞内ROS水平和早期凋亡率均无显著差异.结果表明, SOD1可有效降低酵母胞内ROS水平, 且ROS在硫酸锌诱导的酵母细胞凋亡中起重要作用.
图 6(Fig. 6)
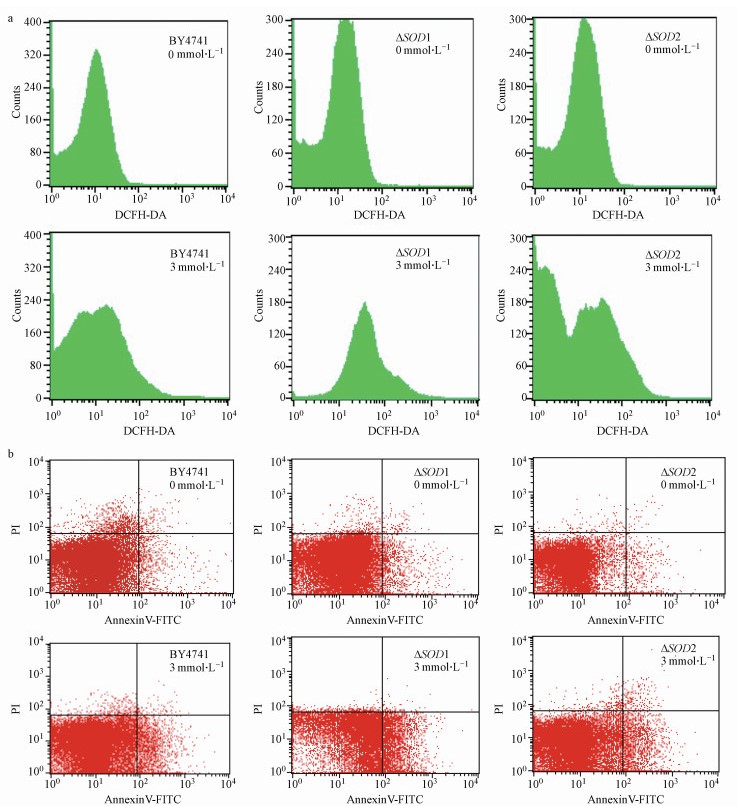 |
| 图 6 硫酸锌对酵母胞内ROS水平(a)和细胞凋亡(b)的影响 Fig. 6Effect of zinc sulfate on intracellular ROS level (a) and apoptosis rate (b) in yeast cells |
4 讨论(Discussion)锌是酵母细胞生长和代谢的必需微量元素之一(Wan et al., 2015).但由于含锌化合物的过度使用及铅锌矿的广泛开发, 导致环境中锌大量积累, 从而对人类健康造成了极大威胁.肖青青等(2009)调查发现, 我国部分地区土壤中锌含量高达38178 mg · kg-1, 约为本实验中所选用的最高浓度10 mmol · L-1的58.74倍.因此, 本研究结果可为锌的生态毒性效应和健康风险评估提供实验依据.
本研究发现, 低浓度硫酸锌可在一定程度上促进酵母细胞生长, 而高浓度硫酸锌则会抑制酵母细胞生长, 且具有浓度和时间依赖性, 10 mmol · L-1处理组中, 酵母细胞几乎完全停止生长.此结果与多数****在植物和动物研究中的结果一致(Bishop et al., 2007;Solanki et al., 2012;Tang et al., 2016);酵母细胞具有生长周期短、易于培养、遗传背景简单等优点(Wu et al., 2013; Deng et al., 2016), 可作为研究锌毒性的模式生物.
ROS是细胞在有氧代谢过程中一部分氧不能被完全还原而生成的产物.当机体受到外源物质刺激时, 可通过抑制多种抗氧化物酶活性, 最终引起胞内ROS水平的升高(Li et al., 2005).SOD是体内重要的抗氧化物酶之一, 可将毒性较高的超氧阴离子(O2- ·)转化为毒性较低的过氧化氢(H2O2);T-AOC可反映机体防御体系总抗氧化能力的强弱, 包括酶促和非酶促两个体系;MDA作为脂质过氧化产物, 其含量可间接反映细胞发生氧化损伤的情况.本研究结果显示, 0.05和0.1 mmol · L-1处理组中, T-SOD活性和细胞相对生长率均高于对照组, 说明低浓度硫酸锌可引起细胞内氧化应激水平代偿性的提高.在0.5 mmol · L-1处理组中, 细胞相对生长率、SOD活性及其基因相对表达量均达到最高, 推测细胞中抗氧化水平代偿达到最大, 同时细胞内的氧化应激因子参与细胞内多条信号的转导途径, 以防御氧自由基对酵母细胞的损伤并加快细胞修复周期, 促进细胞生长(袁雪峰, 2013).随着硫酸锌浓度的进一步升高, 细胞相对生长率和SOD酶活性均开始下降, MDA含量升高, 表明硫酸锌开始对酵母细胞产生毒害效应, 抑制了抗氧化酶活性, 使机体清除自由基的能力下降, 引起细胞氧化损伤, 最终诱导酵母细胞死亡.本研究结果提示, 一定范围的低剂量锌化物促进酵母细胞生长呈Hormesis效应, 这可能与细胞内抗氧化酶活性的能力及细胞氧化/还原平衡状态有关.
模式生物酵母细胞中, 超氧化物歧化酶主要包括SOD1(Cu/Zn superoxide dismutase, SOD1)和SOD2(Mn superoxide dismutase, SOD2), SOD1位于细胞质中和线粒体内膜上, SOD2位于线粒体基质中, 它们均能特异性清除超氧阴离子, 以避免ROS对细胞的损伤(Longo et al., 1996).张小华等(2012)报道, ΔSOD1对高温、高渗透压、高盐及多种化学物质的耐受性均明显差于野生株.Kwolek-Mirek等(2015)研究发现, 酵母细胞经维生素K胁迫后, ΔSOD1胞内ROS水平显著高于野生株.本研究发现, 硫酸锌可影响酵母细胞SOD1和SOD2基因的表达, 在相同的锌处理组中, ΔSOD1耐受性明显低于野生株, 胞内ROS水平和细胞凋亡率显著高于野生株, 而各检测指标在ΔSOD2与野生株间无显著差异.因此, 推断本研究中高浓度锌胁迫引起的酵母细胞凋亡与其诱导的氧化损伤有关.
5 结论(Conclusions)1) 低浓度硫酸锌会促进酵母细胞生长, 而高浓度锌则显著抑制细胞生长, 推测硫酸锌对酵母细胞的毒性可能存在Hormesis效应, 该研究可为锌化物的生态毒性效应和健康风险评估提供实验依据.
2) 高浓度硫酸锌可抑制酵母细胞抗氧化物酶活性及超氧化物歧化酶基因的表达, 引起胞内ROS水平与MDA含量升高, 诱导细胞死亡.SOD1基因缺失菌株在硫酸锌处理后, ROS水平和细胞凋亡率显著高于野生株, 说明氧化胁迫参与了高浓度硫酸锌诱导的酵母细胞凋亡.
参考文献
| Barrameda-Medina Y, Montesinos-Pereira D, Romero L, et al. 2014. Role of GSH homeostasis under Zn toxicity in plants with different Zn tolerance[J]. Plant Science, 227: 110–121.DOI:10.1016/j.plantsci.2014.07.010 |
| Bishop G M, Dringen R, Robinson S R. 2007. Zinc stimulates the production of toxic reactive oxygen species (ROS) and inhibits glutathione reductase in astrocytes[J]. Free Radical Biology & Medicine, 42(8): 1222–1230. |
| Deng M Y, Sun Y H, Li P, et al. 2016. The phytopathogenic virulent effector protein Ripl induces apoptosis in budding yeast Saccharomyces cerevisiae[J]. Toxicon, 121: 109–118.DOI:10.1016/j.toxicon.2016.09.006 |
| Khan A R, Wakeel A, Muhammad N, et al. 2019. Involvement of ethylene signaling in zinc oxide nanoparticle-mediated biochemical changes in Arabidopsis thaliana leaves[J]. Environmental Science-Nano, 6: 341–355.DOI:10.1039/C8EN00971F |
| Kwolek-Mirek M, Zadr?g-T?cza R, Bednarska S, et al. 2015. Acrolein-induced oxidative stress and cell death exhibiting features of apoptosis in the yeast saccharomyces cerevisiae deficient in SOD1[J]. Cell Biochemistry and Biophysics, 71(3): 1525–1536.DOI:10.1007/s12013-014-0376-8 |
| Liang T, Zhang Q, Sun W, et al. 2015. Zinc treatment prevents type 1 diabetes-induced hepatic oxidative damage, endoplasmic reticulum stress, and cell death, and even prevents possible steatohepatitis in the OVE26 mouse model:important role of metallothionein[J]. Toxicology Letters, 233: 114–124.DOI:10.1016/j.toxlet.2015.01.010 |
| Li B, Cui W, Tan Y, et al. 2014. Zinc is essential for the transcription function of Nrf2 in human renal tubule cells in vitro and mouse kidney in vivo under the diabetic condition[J]. Journal of Cellular and Molecular Medicine, 18: 895–906.DOI:10.1111/jcmm.12239 |
| Li L J, Liu X M, Guo Y P, et al. 2005. Activity of the enzymes of the antioxidative system in cadmium-treated Oxyachinensis (Orthoptera acridoidae)[J]. Environmental Toxicology and Pharmacology, 20(3): 412–416.DOI:10.1016/j.etap.2005.04.001 |
| 梁雅雅, 易筱筠, 党志, 等. 2019. 某铅锌尾矿库周边农田土壤重金属污染状况及风险评价[J]. 农业环境科学学报, 2019, 38(1): 103–110. |
| Lin C C, Chang M C, Chang H H, et al. 2009. Areca nut-induced micronuclei and cytokinesis failure in Chinese hamster ovary cells is related to reactive oxygen species production and actin filament deregulation[J]. Environmental and Molecular Mutagenesis, 50(5): 367–374.DOI:10.1002/em.20463 |
| Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCT and the 2-ΔΔCT method[J]. Methods, 25: 402–408.DOI:10.1006/meth.2001.1262 |
| Longo V D, Gralla E B, Valentine J S. 1996. Superoxide dismutase activity is essential for stationary phase survival in Saccharomyces cerevisiae.Mitochondrial production of toxic oxygen species in vivo[J]. The Journal of Biological Chemmistry, 271(21): 12275–12280.DOI:10.1074/jbc.271.21.12275 |
| Lopez E, Arce C, Oset-Gasque M J, et al. 2006. Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture[J]. Free Radical Biology and Medicine, 40(6): 940–951.DOI:10.1016/j.freeradbiomed.2005.10.062 |
| MacPherson S, Larochelle M, Turcotte B. 2006. A fungal family of transcriptional regulators:the zinc cluster proteins[J]. Microbiology and Molecular Biology Reviews, 70(3): 583–604. |
| Motooka R, Yamamo S. 2016. Copper deficiency myelopathy probably caused by long-lasting daily excessive intake of zink[J]. Rinsho Shinkeigaku, 56(10): 690–693.DOI:10.5692/clinicalneurol.cn-000926 |
| 潘军航, 2005.酿酒酵母耐铝机制中可能包含抗氧化作用[D].杭州: 浙江大学.17 |
| Piao F, Yokoyama K, Ma N, et al. 2003. Subacute toxic effects of zinc on various tissues and organs of rats[J]. Toxicology Letters, 145(1): 28–35.DOI:10.1016/S0378-4274(03)00261-3 |
| Plum L M, Rink L, Haase H. 2010. The essential toxin:impact of zinc on human health[J]. International Journal of Environmental Research and Public Health, 7(4): 1342–1365.DOI:10.3390/ijerph7041342 |
| 乔云蕾, 李铭红, 谢佩君, 等. 2016. 沉水植物对受重金属镉、锌污染的水体底泥的修复效果[J]. 浙江大学学报(理学版), 2016, 43(5): 601–609. |
| Ruz M, Carrasco F, Rojas P, et al. 2013. Zinc as a potential coadjuvant in therapy for type 2 diabetes[J]. Food and Nutrition Bulletin, 34: 215–221.DOI:10.1177/156482651303400210 |
| Solanki R, An ju, Poonam, et al. 2012. Zinc and copper induced changes in physiological characteristics of Vigna mungo (L.)[J]. Journal of Environmental Biologgy, 32: 747–751. |
| Sruthi S, Mohanan P V. 2016. Engineered zinc oxide nanoparticles; biological interactions at the organ level[J]. Current Medicine Chemistry, 23: 4057–4068.DOI:10.2174/0929867323666160607224628 |
| Sun Z, Xiong T, Zhang T, et al. 2019. Influences of zinc oxide nanoparticles on Allium cepa root cells and the primary cause of phytotoxicity[J]. Ecotoxicology, 28(2): 175–188.DOI:10.1007/s10646-018-2010-9 |
| Tang M, Xu C, Lin N, et al. 2016. Toxic effects of trace elements on newborns and their birth outcomes[J]. The Science of the Total Environment, 550: 73–79.DOI:10.1016/j.scitotenv.2016.01.071 |
| Wan C, Zhang M M, Fang Q, et al. 2015. The impact of zinc sulfate addition on the dynamic metabolic profiling of Saccharomyces cerevisiae subjected to long term acetic acid stress treatment and identification of key metabolites involved in the antioxidant effect of zinc[J]. Metallomics, 7(2): 322–332.DOI:10.1039/C4MT00275J |
| Wang C, Cheng K, Zhou L, et al. 2017. Evaluation of long-term toxicity of oral zinc oxide nanoparticles and zinc sulfate in mice[J]. Biology Trace Element Research, 178: 276–282.DOI:10.1007/s12011-017-0934-1 |
| 王权, 王建国, 陆宏达, 等. 2012. 硫酸锌慢性毒性胁迫下克氏原螯虾的组织病理[J]. 中国水产科学, 2012, 19(1): 126–137. |
| Wang X, Yi M, Liu H, et al. 2017. Reactive oxygen species and Ca2+ are involved in cadmium-induced cell killing in yeast cells[J]. Canadian Journal of Microbiology, 63(2): 153–159.DOI:10.1139/cjm-2016-0258 |
| Wu C Y, Bird A J, Winge D R, et al. 2007. Regulation of the yeast TSA1 peroxiredoxin by ZAP1 is an adaptive response to the oxidative stress of zinc deficiency[J]. Journal of Biological Chemmistry, 282: 2184–2195.DOI:10.1074/jbc.M606639200 |
| Wu L H, Yi H L, Yi M. 2010. Assessment of arsenic toxicity using Allium/Vicia root tip micronucleus assays[J]. Journal of Hazardous Materials, 176(1/3): 952–956. |
| Wu L H, Yi H L, Zhang H F. 2013. Reactive oxygen species and Ca2+ are involved in sodium arsenite-induced cell killing in yeast cells[J]. FEMS Microbiology Letters, 343(1): 57–63.DOI:10.1111/1574-6968.12131 |
| 吴丽华, 陈燕飞, 陈鹏. 2015. 硫酸锌对蚕豆根尖细胞的遗传损伤效应[J]. 太原师范学院学报(自然科学版), 2015, 14(3): 81–84. |
| 吴丽华, 陈燕飞, 陈鹏, 等. 2016. 亚砷酸钠对酵母细胞抗氧化酶活性和脂质过氧化的影响[J]. 生态毒理学报, 2016, 11(3): 302–307. |
| 肖青青, 王宏镔, 王海娟, 等. 2009. 滇白前(Silene viscidula)对铅、锌、镉的共超富集特征[J]. 生态环境学报, 2009, 18(4): 1299–1306.DOI:10.3969/j.issn.1674-5906.2009.04.018 |
| 袁雪峰.2013.低剂量氯化镉诱导L929细胞增殖hormesis效应的研究[D].广州: 暨南大学.33-34http://cdmd.cnki.com.cn/Article/CDMD-10559-1013027795.htm |
| Zhang J, Chen K, Pang YL, et al. 2017. QTL mapping and candidate gene analysis of ferrous iron and zinc toxicity tolerance at seedling stage in rice by genome-wide association study[J]. BMC Genomics, 18(1): 828–842.DOI:10.1186/s12864-017-4221-5 |
| 张小华, 刘向勇, 王群林, 等. 2012. 酿酒酵母SOD1、SOD2基因缺失对胁迫耐受性的影响[J]. 中国酿造, 2012, 31(9): 115–118.DOI:10.3969/j.issn.0254-5071.2012.09.033 |
| Zhao X Q, Bai F W. 2012. Zinc and yeast stress tolerance:micronutrient plays a big role[J]. Journal of Biotechnology, 158(4): 176–183.DOI:10.1016/j.jbiotec.2011.06.038 |
| Zheng K, Pan J W, Ye L, et al. 2007. Programmed cell death-involved aluminum toxicity in yeast alleviated by antiapoptotic members with decreased calcium signals[J]. Plant Physiology, 143(1): 38–49. |
