
 , 郝丽伟, 马晓妍, 王永坤, 王晓昌, 郑凯
, 郝丽伟, 马晓妍, 王永坤, 王晓昌, 郑凯西安建筑科技大学, 西北水资源与环境生态教育部重点实验室, 国家城市非传统水资源开发利用国际科技合作基地, 陕西省环境工程重点实验室, 西安 710055
收稿日期: 2018-12-19; 修回日期: 2019-01-17; 录用日期: 2019-01-17
基金项目: 国家自然科学基金(No.51508449, 51778522);陕西省教育厅科研计划项目(No.18JK0468);西安建筑科技大学预研基金项目(No.ZR18025)
作者简介: 袁宏林(1965-), 男, 教授(博士), E-mail:hlyuan@xauat.edu.cn
通讯作者(责任作者): 袁宏林
摘要: 为了考察复杂体系的二级处理出水在UV光解及UV/TiO2光催化反应过程中生物效应的变化,本文探究了反应前后发光细菌的荧光抑制毒性、SOS/umu遗传毒性、小球藻光合抑制效应3种生物效应的变化,并分析了物化指标的变化与生物效应之间的关系.结果表明,UV光降解过程并不能高效削减二级处理出水的荧光抑制毒性,但可以高效削减遗传毒性和光合抑制效应,其削减率分别达到61%和81%;在低辐照强度下,UV/TiO2光催化过程对3种生物效应的削减率分别为38%、84%和80%.增大辐照强度后,3种生物效应的削减率进一步提高,尤其是荧光抑制毒性,其削减率可提高至62%.在UV光降解条件下,二级处理出水的遗传毒性、光合抑制效应与荧光强度、UV254之间存在很好的线性关系;在UV/TiO2光催化条件下,二级处理出水的3种生物效应都与荧光强度、UV254之间具有很好的线性关系.这为二级处理出水生物效应的控制及生态安全的保障提供了一定的依据.
关键词:光催化二级处理出水荧光抑制毒性遗传毒性光合抑制效应
The reduction of multiple biological effects of secondary treatment effluent by UV/TiO2 photocatalysis
YUAN Honglin

 , HAO Liwei, MA Xiaoyan, WANG Yongkun, WANG Xiaochang, ZHENG Kai
, HAO Liwei, MA Xiaoyan, WANG Yongkun, WANG Xiaochang, ZHENG Kai Key Laboratory of Northwest Water Resources and Environmental Ecology, Ministry of Education, International Science & Technology Cooperation Center for Urban Alternative Water Resources Development, Key Lab of Environmental Engineering, Shaanxi Province, Xi'an University of Architecture and Technology, Xi'an 710055
Received 19 December 2018; received in revised from 17 January 2019; accepted 17 January 2019
Abstract: To investigate the variation of biological effects of secondary treatment effluent by UV/TiO2 photocatalysis process, the fluorescence inhibition toxicity based on luminescent bacteria, genotoxicity using SOS/umu test, and photosynthetic inhibition effect based on Chlorella vulgaris were conducted on the secondary treatment effluent before and after treatment. The relationships between physicochemical indices and biological effects were analyzed. The results show that UV photolysis process could not decrease the fluorescence inhibition toxicity, but could effectively decrease the genotoxicity and photosynthetic inhibition effect. The removal could reach 61% and 81%, respectively. At low irradiation intensity, the removal of three biological effects were 38%, 84% and 80%, respectively, during UV/TiO2 photocatalysis process. When the irradiation intensity increased, the removal of three biological effects were all improved, especially for fluorescence inhibition toxicity whose removal could achieve 62%. During UV photolysis process, genotoxicity and photosynthetic inhibition effect had good correlation with physicochemical indices (fluorescence intensity and UV254). While, during UV/TiO2 photocatalysis process, the three biological effects had obvious liner relationship with physicochemical indices (fluorescence intensity and UV254). This could help to control the biological effect posed by secondary treatment effluent and to guarantee the ecological safety.
Keywords: photocatalysissecondary treatment effluentfluorescence inhibition toxicitygenotoxicityphotosynthetic inhibition effect
1 引言(Introduction)生活污水经二级生物处理之后, 仍残留有一些难生物降解的有毒有害污染物, 如内分泌干扰物、农药、药物及个人护理品等, 进而影响水生态系统的健康(Fal?s et al., 2016; Grandclément et al., 2017).随着我国对污水厂排放水水质要求的提高, 越来越多的高级氧化工艺被用来进一步深度处理污水厂的二级处理出水.其中, 基于羟基自由基(HO·)的高级氧化技术近年来被广泛用于水中难生物降解有机物的氧化处理(Altmann et al., 2012; Freitas et al., 2016).HO·是一种极强的氧化剂, 具有非特异性, 可与绝大部分有机物发生反应.当前, 以紫外光(UV)活化各类催化剂产生HO·的反应因条件温和、成本低廉而具有较好的应用前景.大量研究证实, 烃类、卤化芳烃类、表面活性剂、染料、农药、油类、氰化物等有害物质都能有效地进行光催化反应从而得到降解, 甚至矿化为无机小分子物质(Li et al., 2016; Szczepanik, 2017; Khalid et al., 2017).纳米TiO2具有催化活性高、性能稳定、价格低廉等特点, 被广泛应用于UV催化降解水中污染物(黄兵华等, 2014, Magnone et al., 2018).
在UV/TiO2降解复杂结构有机物的过程中, 难以将物质完全矿化, 往往会产生大量的中间产物.对降解产物的化学分析存在定性和定量困难的问题, 对于实际的混合体系的生活污水或工业废水尤其如此, 并且其催化降解处理出水的综合毒性并不明确(罗从伟等, 2017, Haolat et al., 2018).在应用UV/TiO2技术降低水中COD、TOC及特定的某种有机污染物(Haolat et al., 2018)的过程中, 可使处理水的生物毒性升高或者降低(Niu et al., 2013; Zheng et al., 2018; Wang et al., 2018).UV辐照强度、处理时间及水质等参数会对化合物的降解速率、降解产物、降解路径等产生影响, 从而影响处理出水的综合生物毒性(Deniz et al., 2011).基于生态和健康的考虑, 本研究对污水厂二级处理出水进行UV/TiO2处理, 分析不同辐照强度和辐照时间对二级处理出水水质及生物毒性的影响, 这对污水厂出水的排放、回用及生态健康都具有重要意义.
2 材料与方法(Materials and methods)2.1 实验试剂4-硝基喹啉-1-氧化物(4-NQO)、敌草隆(Diuron)和邻硝基酚β-D-半乳糖苷(ONPG)购自Sigma公司.苯酚(Phenol)、二甲基亚砜(DMSO)、甲醇、正己烷和二氯甲烷均为HPLC级, 购自天津科密欧公司.实验用水均为超纯水.
2.2 UV/TiO2光催化实验为了考察复杂体系的UV/TiO2光催化降解特性, 本研究采用西安市某污水处理厂二沉池出水作为处理原水.水样首先经0.8 μm Whatman GF/C玻璃纤维膜(Maidstone, UK)过滤, 以去除水中大颗粒悬浮物.在批量反应器上进行光催化实验, 该反应器装配了有效体积为5 L的圆柱形烧杯(内径18 cm, 高度20 cm), 以及磁力搅拌器和位于反应堆中心的3个16 W浸入式低压汞灯.辐射源主要在254 nm发射光, 将每个反应器置于(25±1) ℃的冷却设备中.UV光催化实验分别设定在3.17 mW·cm-2的低辐照度和5.16 mW·cm-2的高辐照度下, 使用UV-C型辐射计(北京师范大学光电仪器, 中国)在254 nm测量辐照度.在UV辐照之前, 加入不同浓度的纳米TiO2并打开磁力搅拌器, 黑暗搅拌2 h, 让TiO2悬浮在污水中并与被光解物充分接触, 然后开启紫外灯进行设定时间的水样处理.
2.3 样品预处理将收集的UV/TiO2处理水进行过滤, 测定DOC和UV254.采用固相萃取对样品进行萃取浓缩, 以进行生物毒性实验.具体的样品处理步骤如下:依次用10 mL正己烷和二氯甲烷(1:1)混合物、10 mL甲醇、10 mL超纯水活化Oasis HLB固相萃取柱(500 mg, 6 mL, Waters);然后利用真空泵使水样以5~10 mL·min-1的速度流过柱子;待上样完成后, 用10 mL的超纯水清洗柱子, 抽真空30 min, 以去除柱子里面的水分;分别用10 mL甲醇、10 mL正己烷和二氯甲烷(1:1)混合物洗脱柱子;在氮吹仪上45 ℃水浴加热条件下缓缓吹至尽干, 用DMSO溶解, 使DMSO浓度为1%, 用于生物毒性实验.
2.4 生物毒性检测2.4.1 荧光抑制毒性检测发光细菌(Virbio fischeri)购自中国工业微生物菌种保藏管理中心(CMCC), 试验参照修正的ISO 11348国际标准进行(ISO, 2008).将样品用2%NaCl按照0.6667倍进行稀释, 获得不同浓缩倍数的样品.每个浓度设置3个平行, 每个样品重复测定两次.样品检测在白色96孔板(美国Corning公司)中进行, 取100 μL培养至对数期的菌液加入到不同浓度的样品或空白溶液(2% NaCl溶液)中, 然后将96孔板放入微孔板发光检测仪内高速振荡30 s, 摇匀, 暴露15 min后测其发光值, 并计算荧光抑制率.以苯酚作为荧光抑制毒性检测的阳性参照物, 通过剂量-效应曲线获得样品或者阳性对照的EC50值.
2.4.2 SOS/umu遗传毒性检测SOS/umu遗传毒性试验采用鼠伤寒沙门氏菌Salmonella typhimurium TA1535/pSK1002菌株为试验菌种, 试验参照ISO 13829遗传毒性检测方法(ISO, 2000).样品检测在96孔酶标板(美国Corning公司)中进行, 以1%的DMSO溶液作为空白.将样品用1%DMSO溶液以0.5倍系数梯度稀释, 形成不同浓度梯度样品用于检测.以4-NQO作为SOS/umu遗传毒性检测的阳性参照物, 通过剂量-效应曲线获得样品或者阳性对照的IR1.5值(即诱导比率IR=1.5时样品的浓度).
2.4.3 光合抑制效应检测蛋白核小球藻(Chlorella pyrenoidesa)购自中国科学院野生生物种质库—淡水藻种库(FACHB-1227), 参考Schreiber等建立的基于叶绿素荧光成像技术的光合抑制毒性的检测方法(Muller et al., 2008).样品检测在96孔平底黑色聚苯乙烯微板(美国Corning公司)上进行, 将50 μL样品或空白对照(1% DMSO溶液)暴露于处于对数期的300 μL藻液中, 待在恒温光照振荡培养箱中培养2 h后, 在大面积叶绿素荧光成像系统Maxi-Imaging-PAM(德国WALZ公司)测定荧光量子产率Y(Ⅱ)值, 并计算抑制率.敌草隆(diuron)作为光合抑制效应检测的阳性参照物, 通过剂量-效应曲线获得样品或者阳性对照的EC50值.
2.4.4 生物毒性检测的定量表征荧光抑制毒性检测、SOS/umu遗传毒性检测和光合抑制效应检测分别采用苯酚、4-NQO和敌草隆作为阳性对照.样品的3种生物毒性通过式(1)转换为相应阳性对照的毒性当量浓度, 分别为TEQphenol、TEQ4-NQO和TEQdiuron, 用于样品生物效应的定量表征.
 | (1) |
表 1(Table 1)
| 表 1 UV光解物化指标的变化 Table 1 Changes of physicochemical indices under UV photolysis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 1 UV光解物化指标的变化 Table 1 Changes of physicochemical indices under UV photolysis
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
采用Chen等(2003)的方法将三维荧光光谱图分为5个区域.如图 1所示, 二沉池出水明显的特征荧光峰有4个, 特征荧光峰中心位置分别在λex/λem=235 nm/370 nm、λex/λem=245 nm /405 nm、λex/λem=285 nm /365 nm、λex/λem=265 nm /400 nm附近, 依次属于蛋白质Ⅱ类、富里酸类、微生物代谢产物类、腐殖酸类.随着光解时间的延长, 特征峰的位置基本不变, 但荧光强度明显降低(表 1), 说明光降解过程对溶解性有机物有明显的降解作用.
图 1(Fig. 1)
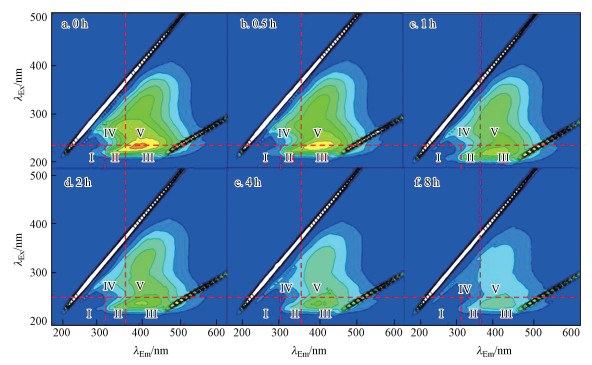 |
| 图 1 不同光解时间的三维荧光光谱图谱 Fig. 1Three-dimensional fluorescence spectra of different photolysis time |
3.1.2 UV光解过程中生物效应的变化不同辐照时间下, 二级处理出水的荧光抑制毒性变化如图 2a所示.随着UV光照时间的延长, TEQphenol在一定范围内波动(9.67~12.24 mg·L-1), 表明在辐照时间内没有观察到显著的荧光抑制毒性的削弱(降低 < 20%), 甚至在初始阶段略微增加(~10%).对于遗传毒性和光合抑制效应(图 2b、2c), TEQ4-NQO从3.20 μg·L-1降至1.25 μg·L-1(去除率为61%), TEQdiuron从68.57 ng·L-1降至13.23 ng·L-1(去除率为81%).这表明UV光解过程对二级处理出水遗传毒性和光合抑制毒性具有良好的抑制效果.Jia等(2015)研究了UV光解过程对再生水生物毒性的影响, 发现UV光解作用可使荧光抑制毒性降低71%, 光合抑制毒性降低35%, 遗传毒性增加35%.Javier等(2013)采用UV照射废水中的非极性污染物, 发现处理后出水对小球藻的光合抑制毒性明显增加.Iria等(2018)对新烟碱类杀虫剂硝苯吡喃(NPY)进行紫外光降解, 发现最终产物对鱼类、大型蚤和小球藻的毒性均有所增加.UV光解作用对不同样品生物毒性降低效率的差异可能归因于UV辐照强度、污染物的特性及浓度水平等因素的差异(Jia et al., 2015).
图 2(Fig. 2)
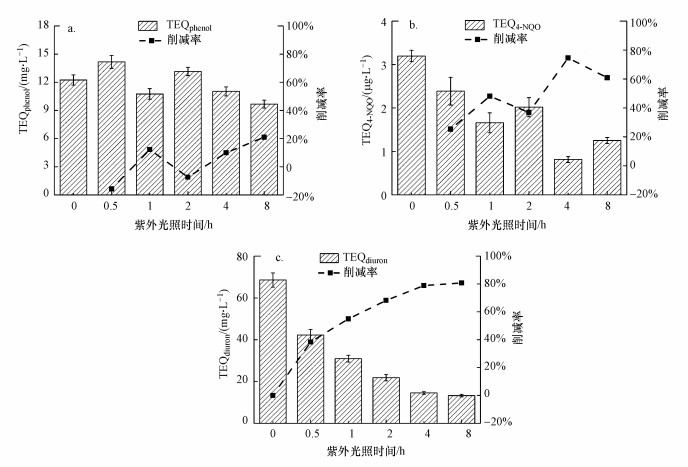 |
| 图 2 不同辐照时间下二级处理出水的荧光抑制毒性(a)、遗传毒性(b)和光合抑制毒性(c)变化 Fig. 2Changes of fluorescence inhibition toxicity(a), genotoxicity(b) and photosynthesis inhibitory toxicity(c) of secondary treatment effluent under different irradiation time |
3.2 UV/TiO2光催化作用对生物效应的削减3.2.1 UV/TiO2光催化作用下物化指标的变化如表 2所示, 加入纳米TiO2催化剂, 在低辐照强度和高辐照强度条件下, UV254、DOC和SUVA都随着辐照时间的延长而逐渐降低, 尤其是在高辐照强度条件下, UV254的去除率最高可达98%.与低辐照强度相比, UV254和DOC的去除率在高辐照强度下更高.由图 3和表 2可以看出, 在UV/TiO2光催化作用下, 4个特征荧光峰强度随着辐照时间的延长都明显降低, 尤其是在高辐照强度下.这说明UV/TiO2光催化过程对溶解性有机物有明显的降解作用, 并且水样的可生化性显著提高.
表 2(Table 2)
| 表 2 UV/TiO2光催化作用下二级处理出水物化指标的变化 Table 2 Changes of physicochemical indices of secondary treated effluent under UV/TiO2 photocatalysis | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 2 UV/TiO2光催化作用下二级处理出水物化指标的变化 Table 2 Changes of physicochemical indices of secondary treated effluent under UV/TiO2 photocatalysis
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
图 3(Fig. 3)
 |
| 图 3 低辐照强度(Ⅰ-0 h~Ⅰ-8 h)和高辐照强度(Ⅱ-0 h~Ⅱ-8 h)下不同辐照时间的二级处理出水的三维荧光光谱图谱 Fig. 3Three-dimensional fluorescence spectra of secondary treated effluent at low irradiation intensity (Ⅰ-0 h~Ⅰ-8 h) and high irradiation intensity (Ⅱ-0 h~Ⅱ-8 h) for different irradiation time |
3.2.2 低辐照强度下生物效应的变化为了考察纳米TiO2的吸附作用对二级处理出水生物毒性削减的功效, 本研究在二级处理出水中加入不同浓度的TiO2, 在无光照的条件下搅拌2 h, 并对样品进行收集, 研究其毒性变化.由图 4可以看出, 在0~200 mg·L-1 TiO2浓度范围内, TEQphenol、TEQ4-NQO和TEQdiuron变化不明显, 即TiO2的吸附作用对二级处理出水的荧光抑制毒性、遗传毒性和光合抑制毒性的去除几乎不起作用.
图 4(Fig. 4)
 |
| 图 4 只加入催化剂TiO2时二级处理出水的荧光抑制毒性、遗传毒性和光合抑制毒性变化 Fig. 4Changes of fluorescence inhibition toxicity, genotoxicity and photosynthesis inhibition toxicity of secondary effluent treated with titanium dioxide only |
以纳米TiO2作为光催化剂, 在低辐照强度下, 不同辐照时间的二级处理出水3种生物毒性的变化如图 5所示.在0~8 h的辐照时间内, TEQphenol从11.87 mg·L-1降低至7.32 mg·L-1(削减率为38%), TEQ4-NQO从2.50 μg·L-1降低至0.41 μg·L-1(削减率为84%), TEQdiuron从82.66 ng·L-1降低至16.50 ng·L-1(削减率为80%).这说明在低辐照强度下UV/TiO2处理可明显削减二级处理出水的遗传毒性和光合抑制毒性, 但对发光细菌荧光抑制毒性的削减较为缓慢.与UV光降解相比, 在低照射强度下UV光催化可使荧光抑制毒性的削减率提高至38%.除此之外, 样品的遗传毒性和光合抑制毒性削减效果显著.
图 5(Fig. 5)
 |
| 图 5 低辐照强度下UV/TiO2处理二级处理出水过程中荧光抑制毒性(a)、遗传毒性(b)和光合抑制毒性(c)变化 Fig. 5Changes of fluorescence inhibition toxicity(a), genotoxicity(b) and photosynthesis inhibitory toxicity(c) in secondary effluent of UV/titanium dioxide treatment at low irradiation intensity |
Kim等(2013)采用循环式UV/TiO2反应器对甲基对硫磷进行光催化降解, 研究发现, 在光催化条件下甲基对硫磷的降解效果优于光降解, 并且光降解仅使发光细菌荧光抑制毒性降低83%, 大型溞毒性降低65%, 而90 min的UV/TiO2光催化可使发光细菌荧光抑制毒性完全降低, 大型溞毒性消失.Ziolli等(2001)对水溶性原油组分进行了光降解和UV/TiO2光催化处理, 发现光解过程中荧光抑制毒性在一定范围内波动, 5 d后荧光抑制毒性并没有得到显著的削减, 反而比原水的毒性略微上升;在光催化过程中, 最初的24 h内荧光抑制毒性显著增加, 而3 d后毒性几乎完全消失.Ho等(1998)对五氯苯酚进行光降解和UV/H2O2光催化处理, 发现光解作用可使发光细菌荧光抑制毒性降低46%, 鲦鱼毒性降低79%;UV/H2O2光催化作用可使发光细菌毒性降低99%, 鲦鱼毒性降低96%, 这与本研究是一致的.
3.2.3 高辐照强度下生物效应的变化在高辐照强度下, UV/TiO2处理二级处理出水过程中3种生物毒性变化如图 6所示.随着UV辐照时间的延长, TEQphenol从9.51 mg·L-1降至3.62 mg·L-1, 削减率为62%;TEQ4-NQO从3.33 μg·L-1降至0.66 μg·L-1, 削减率为80%;TEQdiuron从145.47 ng·L-1降至39.80 ng·L-1, 削减率为73%.与低辐照强度的UV/TiO2光催化相比, 高辐照强度下荧光抑制毒性的削减率由38%可提高至62%.这是由于在光催化反应中, 吸收的光子与光强呈正比关系, 所以在弱光的情况下, 光催化过程的反应速率随光强增强而增加.因此, 高辐照强度下的UV光催化对生物毒性的削减效果更好.
图 6(Fig. 6)
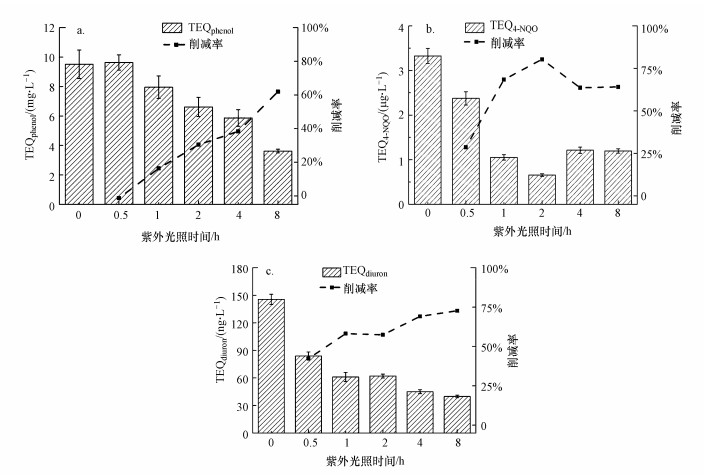 |
| 图 6 高辐照强度下UV/TiO2处理二级处理出水过程中荧光抑制毒性(a)、遗传毒性(b)和光合抑制毒性(c)变化 Fig. 6Changes of fluorescence inhibition toxicity (a), genotoxicity (b) and photosynthesis inhibitory toxicity (c) in secondary effluent of UV/titanium dioxide treatment at high irradiation intensity |
Niu等(2013)研究了利用TiO2光催化降解磺胺甲噁唑的毒性变化, 发现荧光抑制毒性在此过程中是非线性变化的, 呈现出先升高、再降低、再升高、再降低的趋势.Zheng等(2018)采用炭基TiO2纳米复合材料光催化降解环丙沙星, 发现荧光抑制毒性呈先降低、再升高、再降低的趋势.Fabiola等(2008)也对TiO2光催化降解非甾体类抗炎药物的毒性进行了研究, 发现荧光抑制毒性在初期先升高, 直到120 min以后才出现下降趋势.本研究中, 在低辐照强度和高辐照强度下, UV/TiO2光催化过程中二级处理出水的生物效应也有波动的现象(如遗传毒性).这可能是因为母体化合物的初始氧化及难氧化有机中间体的后续形成造成了样品综合毒性的波动(Niu et al., 2013).
3.3 物化指标与生物效应之间的关系若以污水中代表性的荧光有机污染物特征荧光强度之和ΣIF(ex/em)表征污水中溶解性有机物的综合含量, 即ΣIF(ex/em)=If(ex/em), 其中, If(ex/em)为特征荧光峰中心最大荧光强度, 简称特征荧光强度, 作为表征污水中某类溶解性有机物含量的指标;∑IF(ex/em)为污水中各类有机物的特征荧光强度之和, 表示污水中荧光类有机物的综合含量(郝瑞霞等, 2017).各个样品的峰强如表 1和表 2所示.从图 7a~7c可以看出, 在UV/TiO2光催化条件下二级处理出水的荧光抑制毒性、遗传毒性、光合抑制效应和荧光强度存在很好的线性关系, 而在UV光降解条件下, 二级处理出水的遗传毒性和光合抑制效应和荧光强度存在很好的线性关系.UV光降解条件下, 二级处理出水的荧光抑制毒性和荧光强度之间的线性关系较差, 可能是由于其生物效应较难去除.且从图 7d可以看出, 在UV光解和UV/TiO2光催化条件下, 二级处理出水的荧光强度与UV254具有很好的线性关系, 这说明UV254与各生物效应之间仍具有相对应的关系.
图 7(Fig. 7)
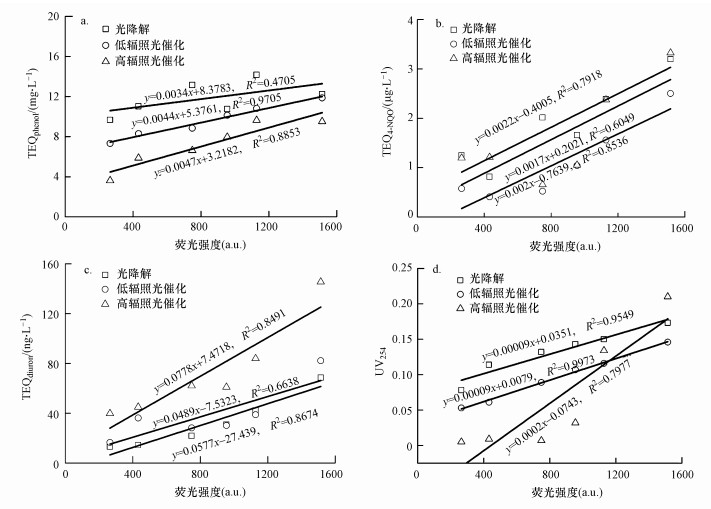 |
| 图 7 荧光强度与荧光抑制毒性(a)、遗传毒性(b)、光合抑制毒性(c)和UV254(d)的相关性 Fig. 7The correlation between fluorescence intensity and fluorescence inhibition toxicity(a), genotoxicity(b), photosynthetic inhibition toxicity(c) and UV254(d) |
4 结论(Conclusions)1) UV光解过程对二级处理出水的荧光抑制毒性的削减效果很微弱, 而在降低遗传毒性和光合抑制效应方面削减效果显著.
2) 与光解相比, UV/TiO2光催化过程可以提高二级处理出水荧光抑制毒性、遗传毒性和光合抑制效应的削减效果, 尤其是荧光抑制毒性, 并且辐照强度增强, 削减效果也随之增强.
3) 在UV光降解条件下, 二级处理出水的遗传毒性、光合抑制效应和荧光强度存在很好的线性关系;在UV/TiO2光催化条件下, 二级处理出水的荧光抑制毒性、遗传毒性、光合抑制效应和荧光强度存在很好的线性关系;同时, 二级处理出水的荧光强度与UV254具有很好的线性关系.
参考文献
| Altmann D, Schaar H, Bartel C, et al. 2012. Impact of ozonation on ecotoxicity and endocrine activity of tertiary treated wastewater effluent[J]. Water Research, 46(11): 3693–3702.DOI:10.1016/j.watres.2012.04.017 |
| Barrett S E, Krasner S W, Amy G L. 2000. Natural organic matter and disinfection by-products:Characterization and control in drinking water-an overview[J]. Acs Symposium, 761: 2–14.DOI:10.1021/symposium |
| Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 37(24): 5701–5710. |
| Deniz N, Viviane Y, Dimitrios B. 2011. Photo-removal of sulfamethoxazole (SMX) by photolytic and photocatalytic processes in a batch reactor under UV-C radiation (λmax=254 nm)[J]. Journal of Hazardous Materials, 186: 67–75.DOI:10.1016/j.jhazmat.2010.10.080 |
| Fabiola M A, Santiago E, Jaime G. 2008. Photocatalytic degradation of non-steroidal anti-inflammatory drugs with TiO2 and simulated solar irradiation[J]. Water Research, 42: 585–594.DOI:10.1016/j.watres.2007.08.002 |
| Fal?s P, Wick A, Castronovo S, et al. 2016. Tracing the limits of organic micropollutant removal in biological wastewater treatment[J]. Water Research, 95: 240–249.DOI:10.1016/j.watres.2016.03.009 |
| Freitas A M, Rivas G, Camposma?as M C, et al. 2016. Ecotoxicity evaluation of a WWTP effluent treated by solar photo-Fenton at neutral pH in a raceway pond reactor[J]. Environmental Science & Pollution Research, 24(2): 1093–1104. |
| Grandclément C, Seyssiecq I, Piram A, et al. 2017. From the conventional biological wastewater treatment to hybrid processes, the evaluation of organic micropollutant removal:A review[J]. Water Research, 111: 297–317.DOI:10.1016/j.watres.2017.01.005 |
| 郝瑞霞, 曹可心, 邓亦文. 2007. 城市污水处理过程中有机污染物三维荧光特性的变化规律[J]. 分析测试报, 2007, 26(6): 789–792. |
| Haolat J O, George A, Issa Suleiman M, et al. 2018. UV-TiO2 treatment of the cooling water of an oil refinery[J]. Journal of Water Process Engineering, 26: 176–181.DOI:10.1016/j.jwpe.2018.10.013 |
| Ho T F, Bolton J R. 1996. Toxicity changes during the UV treatment of pentachlorophenol in dilute aqueous solution[J]. Water Research, 32(2): 488–497. |
| 黄兵华, 张晓飞, 宋磊, 等. 2014. TiO2光催化水处理技术综述[J]. 水处理技术, 2014, 40(3): 11–17+21. |
| Iria G M, Isaac R, Lorena R, et al. 2018. Photodegradation of nitenpyram under UV and solar radiation.Kinetics, transformation products identification and toxicity prediction[J]. Science of the Total Environment, 644: 995–1005.DOI:10.1016/j.scitotenv.2018.06.318 |
| ISO.2008. ISO 11348.Water quality-determination of the inhibitory effect of water samples on the light emission of Vibrio fischeri (Luminescent bacteria test), European Norm[S].Geneva: ISO |
| ISO.2000. ISO 13829.Water quality-determination of the genotoxicity of water and waste water using the umu-test[S]. Geneva: ISO |
| Javier S M, Maria J G, Sonia H L, et al. 2013. Energy efficiency for the removal of non-polar pollutants during ultraviolet irradiation, visible light photocatalysis and ozonation of a wastewater effluent[J]. Water Research, 47: 5546–5556.DOI:10.1016/j.watres.2013.06.030 |
| Jia A, Escher B I, Leusch F D L, et al. 2015. In vitro bioassays to evaluate complex chemical mixtures in recycled water[J]. Water Research, 80: 1–11.DOI:10.1016/j.watres.2015.05.020 |
| Khalid N R, Majid A, Tahir M B, et al. 2017. Carbonaceous-TiO2 nanomaterials for photocatalytic degradation of pollutants:A review[J]. Ceramics International, 43(17): 14552–14571.DOI:10.1016/j.ceramint.2017.08.143 |
| Kim T S, Kim J K, Choi K, et al. 2006. Degradation mechanism and the toxicity assessment in TiO2 photocatalysis and photolysis of parathion[J]. Chemosphere, 62(6): 926–933.DOI:10.1016/j.chemosphere.2005.05.038 |
| Li D, Shi W. 2016. Recent developments in visible-light photocatalytic degradation of antibiotics[J]. Chinese Journal of Catalysis, 37(6): 792–799.DOI:10.1016/S1872-2067(15)61054-3 |
| 罗从伟, 马军, 江进. 2017. UV/H2O2降解2, 4, 6-三氯苯甲醚动力学及产物研究[J]. 中国环境科学, 2017, 37(5): 1831–1837.DOI:10.3969/j.issn.1000-6923.2017.05.028 |
| Magnone E, Kim M K, Lee H J, et al. 2018. Testing and substantial improvement of TiO2/UV photocatalysts in the degradation of Methylene Blue[J]. Ceramics International, 45(3): 3359–3367. |
| Muller R, Schreiber U, Escher B I, et al. 2008. Rapid exposure assessment of PSⅡ herbicides in surface water using a novel chlorophyll a fluorescence imaging assay[J]. Science of the Total Environment, 401(1/3): 51–59. |
| Niu J, Zhang L, Li L, et al. 2013. Effects of environmental factors on sulfamethoxazole photodegradation under simulated sunlight irradiation:Kinetics and mechanism[J]. Journal of Environmental Sciences, 25(6): 1098–1106.DOI:10.1016/S1001-0742(12)60167-3 |
| Szczepanik B. 2017. Photocatalytic degradation of organic contaminants over clay-TiO2 nanocomposites:A review[J]. Applied Clay Science, 141: 227–239.DOI:10.1016/j.clay.2017.02.029 |
| Wang W L, Wu Q Y, Huang N, et al. 2018. Potential risks from UV/H2O2 oxidation and UV photocatalysis:A review of toxic, assimilable, and sensory-unpleasant transformation products[J]. Water Research, 141: 109–125.DOI:10.1016/j.watres.2018.05.005 |
| Zheng X, Xu S, Wang Y, et al. 2018. Enhanced degradation of ciprofloxacin by graphitized mesoporous carbon (GMC)-TiO2 nanocomposite:Strong synergy of adsorptionphotocatalysis and antibiotics degradation mechanism[J]. Journal of Colloid and Interface Science, 527: 202–213.DOI:10.1016/j.jcis.2018.05.054 |
| Ziolli R L, Jardim W F. 2001. Photocatalytic decomposition of seawater-soluble crude oil fractions using high surface area colloid nanoparticles of TiO2[J]. Journal of Photochemistry and Photobiology A:Chemistry, 5887: 1–8. |
