 , 向玉萍1, 王永敏2, 陈华1, 曹丹1, 王定勇1,2, 申鸿1,3
, 向玉萍1, 王永敏2, 陈华1, 曹丹1, 王定勇1,2, 申鸿1,3

1. 西南大学资源环境学院, 重庆 400716;
2. 重庆市三峡库区农业面源污染控制工程技术研究中心, 重庆 400716;
3. 西南大学前沿交叉学科研究院生物学研究中心, 重庆 400716
收稿日期: 2018-12-06; 修回日期: 2019-03-04; 录用日期: 2019-03-04
基金项目: 国家自然科学基金(No.41573104,41773073,41877384)
作者简介: 米前芬(1993-), 女, E-mail:miqianfen@163.com
通讯作者(责任作者): 申鸿, E-mail:shenhong@swu.edu.cn
摘要: 从三峡库区消落带土壤中分离、纯化得到1株具有汞甲基化能力的细菌,对其形态、生理生化特征及16S rRNA基因序列进行分析后,鉴定为土生拉乌尔菌,并命名为RaouLtella terrigena TGRB3.研究发现,菌株TGRB3具有强酸碱和盐度适应能力,为中高温型菌,在pH=4~9和盐度0.2%~4.0%范围内均能正常生长,最适生长温度为25℃.在Hg2+浓度为1000 μg·L-1时,菌株生长受到显著抑制.此外,在初始Hg2+浓度为300 ng·L-1的条件下探讨了该菌在不同氧气浓度(0、7%、14%和21%)下的生长情况及汞甲化能力.结果表明,该菌的生长不受氧气浓度的制约,但在有氧条件下生长更好,且在厌氧或低氧浓度条件下具有更强且稳定的汞甲基化能力.在氧气浓度为14%和21%的条件下,该菌的最大甲基汞含量分别为(0.54±0.01)和(1.62±0.08)ng·L-1,试验后期表现出较强的去甲基化现象,培养54 h后的甲基汞含量显著降低为(0.08±0.02)和(0.05±0.00)ng·L-1;而在氧气浓度为0和7%的条件下,最大甲基汞含量分别为(6.75±1.75)和(3.24±0.74)ng·L-1,且在试验周期内甲基汞持续产生,平均浓度分别为(3.23±1.39)和(1.66±0.71)ng·L-1.本试验结果可望为三峡库区消落带土壤汞生物甲基化机理的深入研究及汞污染风险评价等提供全新的试验材料.
关键词:土生拉乌尔菌氧气浓度汞甲基化三峡库区消落带土壤分离鉴定
The characteristics of RaouLtella terrigena TGRB3 and its mercury methylation under different oxygen concentrations
MI Qianfen1
 , XIANG Yuping1, WANG Yongmin2, CHEN Hua1, CAO Dan1, WANG Dingyong1,2, SHEN Hong1,3
, XIANG Yuping1, WANG Yongmin2, CHEN Hua1, CAO Dan1, WANG Dingyong1,2, SHEN Hong1,3

1. College of Resources and Environment, Southwest University, Chongqing 400716;
2. Chongqing Engineering Research Center for Agricultural Non-point Source Pollution Control in the Three Gorges Region, Chongqing 400716;
3. Biological Science Research Center, Southwest University, Chongqing 400716
Received 6 December 2018; received in revised from 4 March 2019; accepted 4 March 2019
Abstract: A bacterial strain capable of Hg methylation was isolated from the soil of the water-level-fluctuation-zone (WLFZ) of the Three Gorge Reservoir, in Shibaozhai, Zhongxian Country, Chongqing, Southwest China. Through morphological and physiological characterization, and 16S rRNA gene sequence analysis, this isolate was identified as RaouLtella terrigena sp. and named as R. terrigena TGRB3 (accession number:MK102091). Strain TGRB3 has strong acid-base and salinity tolerance, and could survive under pH from 4 to 9, and 0.2%~4.0% of salinity. It is a mesophilic strain, with the optimum growth temperature of 25℃. When Hg2+ concentration was 1000 μg·L-1, the growth of strain TGRB3 was significantly inhibited. In addition, its Hg methylation ability under different oxygen concentrations (0, 7%, 14% and 21%) was studied at the initial Hg2+ concentration of 300 ng·L-1. Results show that the growth of strain TGRB3 was not restricted by oxygen concentration, but grew better under aerobic conditions. Besides, it had a stronger and more stable Hg methylation ability under anaerobic and low oxygen concentration. Under the oxygen concentration of 14% and 21%, the maximum MeHg levels were (0.54±0.01) and (1.62±0.08) ng·L-1, which decreased significantly to (0.08±0.02) and (0.05±0.00) ng·L-1 at the 54 h, respectively. When the oxygen concentration was 0 and 7%, MeHg were produced continuously during the whole incubation period, reaching the maximum MeHg levels at (6.75±1.75) and (3.24±0.74) ng·L-1, respectively, and (3.23±1.39) and (1.66±0.71) ng·L-1, in average. This study might be expected to provide new experimental data for in-depth study of the Hg bio-methylation mechanism and the risk assessment of Hg pollution in the WLFZ of the Three Gorge Reservoir.
Keywords: RaouLtella terrigenaoxygen concentrationmercury methylationThree Gorge Reservoirwater-level-fluctuation-zoneisolationidentification
1 引言(Introduction)汞(Hg)是环境中最危险的重金属污染物之一, 其中又以有机态的甲基汞(MeHg)为最(Ramamoorthy et al., 1982;阴皎阳等, 2014).研究表明, 甲基汞在水生环境中经食物链的逐级放大, 会对环境和人体健康造成极大危害(Lindberg et al., 1995;孟紫强, 2000;高亚辉等, 2002).自然界中, 非生物和生物途径都能使无机汞转化为甲基汞, 其中以微生物作用占主导(胡海燕, 2012).大量研究表明, 硫酸盐还原菌(SRB)、铁还原菌(FeRB)及产甲烷菌(methanogens)等严格厌氧菌是主要的汞甲基化微生物(Fleming et al., 2006; Hamelin et al., 2011; Janssen et al., 2016; Lu et al., 2016).但Vonk和Sijpesteijn (1973)对常见的细菌和真菌进行纯培养试验研究, 发现某些好氧细菌也具有汞甲基化能力, 如大肠杆菌(Escherichia coli)和产气杆菌(Aerobacter aerogenes), 且其在有氧条件下的汞甲基化能力强于无氧条件(Bisogni et al., 1975; Hamelin et al., 2015).然而, 这些早期的研究都是在汞浓度很高(3~5 mg·L-1)的条件下进行的, 与实际环境不符(Kearns et al., 2010).
在自然环境中, 沉积物、土壤和沉积物-水界面是汞甲基化的主要场所, 原位甲基化是甲基汞的主要来源(丁振华等, 2005;Heyes et al., 2006).研究表明, 在湿地、酸化湖泊、沼泽河流中, 汞通过活化、甲基化、食物链的吸收传递和逐级放大在水生生物区富集, 即使在低浓度汞环境条件下, 也可能在鱼类等高营养层次生物体内出现很高浓度的甲基汞, 使人类或者食用鱼类的动物受到甲基汞的污染危害(Bowles et al., 2001; Brunberg et al., 2001).水库环境有利于汞活化、甲基化和生物累积, 是一个典型的“汞敏感生态系统” (冯新斌, 2011).三峡水库是世界瞩目的特大型年调节水库, 面积为1084 km2, 淹没区面积达632 km2.水库正常蓄水位高程175 m, 每年5月底降至防洪限制水位145 m.这种水库调度方式使得库区周围形成垂直高度为30 m、面积超过400 km2的水库消落带(袁辉等, 2006).研究发现, 三峡水库这种人为的周期性水位消涨过程导致消落带土壤中的微生物群落结构和功能发生变化(康义等, 2010), 淹水条件形成的被淹没土壤和植物会释放大量的有机质和营养元素, 从而刺激汞甲基化微生物的生长, 并且淹水形成的还原环境更有利于促进微生物汞甲基化.在落干期, 消落带土壤的甲基汞含量在初期逐渐降低, 但随着落干时间延长, 土壤甲基汞含量呈上升趋势(何熙, 2013).对于落干后期的消落带土壤而言, 由于其长时间暴露在空气中, 因而并不是一个严格的厌氧环境.而本课题组在前期的研究中发现, 落干时期三峡库区消落带10~20 cm土层土壤中可培养微生物与甲基汞含量呈显著正相关关系, 推测存在某些对汞甲基化起主导作用的好氧微生物(Xiang et al., 2014), 并筛选鉴定出1株兼具好、厌氧汞甲基化能力的菌株(陶兰兰等, 2016).前期对厌氧菌的大量研究发现, 氧气含量是影响其汞甲基化过程的一个重要因素.研究表明, 土壤中水分饱和区域的氧分压在0.15 cm距离内可急剧下降0.20个大气压(Zhang et al., 2004);三峡水库消落带土壤中氧浓度在淹水时期极低甚至处于厌氧状态, 在落干时期土壤中的氧浓度逐渐提高(Nalewajko et al., 1980;邱权等, 2013).三峡库区干湿交替过程导致厌氧和有氧环境的周期性变化, 那么, 是否存在对氧气变化有良好适应的汞甲基化细菌?这个问题值得深入探讨.基于此, 本文在前期研究的基础上, 从库区消落带土壤中分离、纯化获得1株对不同浓度氧气具有良好适应能力, 且具有高效汞甲基化能力的菌株(TGRB3).同时, 在对该菌株进行汞离子浓度、酸碱度、温度和盐度等环境因素的生物学响应研究的基础上, 以三峡库区周期性落干-淹水导致的氧气浓度不断变化为背景, 定量分析比较该菌在0、7%、14%和21%氧气浓度条件下的生长情况及汞甲基化效能, 为深入开展菌株汞甲基化机理研究提供理论依据和材料.
2 材料与方法(Materials and methods)2.1 菌株分离为保证研究体系的技术重复性, 本试验的采样点、供试土壤(表 1)等与文献中(陶兰兰等, 2016)一致.但菌株分离纯化采用KB培养基(蛋白胨20.0 g, 甘油10.0 mL, K2HPO4·3H2O 1.5 g, MgSO4·7H2O 1.5 g, pH 7.2±0.2, 定容至1 L).
表 1(Table 1)
| 表 1 供试土壤基本理化性质 Table 1 Basic physical and chemical properties of the tested soil | |||||||||||||||||
表 1 供试土壤基本理化性质 Table 1 Basic physical and chemical properties of the tested soil
| |||||||||||||||||
2.2 菌株鉴定2.2.1 形态学及生理生化鉴定将纯化后于-80 ℃保藏的菌种, 经KB液体培养基活化, 在固体培养基上观察其菌落的形态特征.通过对菌株的形态观察和革兰氏染色, 参照《伯杰细菌鉴定手册》(第八版)(R.E.布坎南, 1984)进行生理生化鉴定.
2.2.2 16S rRNA基因鉴定采用试剂盒Bacterial DNA isolation kit (Omega)对纯化菌株进行DNA抽提.以此为模板, 选用细菌通用引物(27f:5′-AGAGTTTGATCMTGGCTCAG-3′和1492R:5′-TACGGYTACCTTGTTACGACTT-3′)进行16S rRNA基因扩增.PCR反应体系(30 μL)为:10×Taq Bffer 3 μL(TaKaRa), d NTP 2 μL, 模板DNA 1 μL, 引物各3 μL(10 μmol·L-1), Taq 0.2 μL(TaKaRa, 5 U·μL-1), 灭菌超纯水定容.PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 35个循环;72 ℃最终延伸10 min.PCR产物经2%琼脂糖凝胶电泳验证为单一条带, 将此PCR扩增产物送至重庆宏诺生物技术有限公司测序.测序结果用BLAST软件与GenBank中已收录的16S rRNA基因序列进行同源性比较, 并采用MEGA6.06软件中的Nighbor-joining法构建系统发育树.
2.3 菌株生物学特性的试验设计2.3.1 汞对菌株生长的影响设置初始终汞(Hg2+)浓度分别为0、500、1000、1500和2000 μg·L-1的培养体系.称取0.1354 g HgCl2(优级纯), 用硝酸-重铬酸钾溶液溶解, 转入1 L容量瓶中, 再用硝酸-重铬酸钾溶液定容, 即为100 mg·L-1汞标准贮备液.取l mL标准贮备液, 用超纯水稀释定容至100 mL, 即为l mg·L-1的试验用汞溶液.100.0 mL三角瓶中加入50.0 mL培养基, 再加入不同体积试验用汞溶液, 使培养基初始终汞浓度(Hg2+)分别为0、500、1000、1500和2000 μg·L-1, 以1%接种量(1×1010 cfu·mL-1)接入对数期的TGRB3菌, 于30 ℃、120 r·min-1下培养27 h.
2.3.2 pH对菌株生长的影响设置pH值分别为4、5、6、7、8和9的KB液体培养体系.100.0 mL三角瓶中加入50.0 mL培养基, 用HCl(1 mol·L-1)和NaOH(1 mol·L-1)调节pH, 调节测定得pH分别为4.07、5.08、6.07、7.01、8.01和9.00.经121 ℃、15 min灭菌后, 最终获得初始pH分别为4.39、5.39、6.20、7.03、7.97和8.88的接种培养基, 并以接种量1%(1×1010 cfu·mL-1)接入对数期的TGRB3菌, 于30 ℃、120 r·min-1下培养27 h.
2.3.3 温度对菌株生长的影响设置温度分别为5、15、25、30、35和40 ℃的培养体系.100.0 mL三角瓶中加入50.0 mL培养基, 以1%接种量(1×1010 cfu·mL-1)接入对数期的TGRB3菌, 在温度分别为5、15、25、30、35和40 ℃的摇床中, 120 r·min-1恒温摇育培养27 h.
2.3.4 盐度对菌株生长的影响配置NaCl浓度分别为0.2%、0.5%、0.9%、2%和4%的培养体系.100.0 mL三角瓶中加入50.0 mL培养基, 加入NaCl(优级纯)并使其终浓度分别为0.2%、0.5%、0.9%、2%和4%.并以1%接种量(1×1010 cfu·mL-1)接入对数期的TGRB3菌, 于30 ℃、120 r·min-1下培养27 h.
上述试验均严格无菌操作, 培育27 h取样, 采用分光光度法测定菌体密度(OD600).每处理设3个重复.
2.4 菌株在不同氧浓度条件下的汞甲基化试验设计2.4.1 不同氧气浓度菌株培养体系的建立试验共设计4个氧气(O2)浓度处理, 分别为0、7%、14%和21%.其中, O2浓度为0时为厌氧培养体系:250.0 mL厌氧瓶中加入150.0 mL KB培养基, 按Hungate厌氧操作系统处理(Miller et al., 1974; Yang et al., 2012);O2浓度为7%、14%和21%培养体系:250.0 mL厌氧瓶中加入150.0 mL KB培养基, 采用标准氧气浓度分别为7%、14%和21%的气体(氧气和氮气, 购于重庆朝阳气体有限公司), 置换培养瓶上部的气体, 气体流速为60.0 mL· min-1, 持续置换5 min (Kumano et al., 2013;Jackson, 2016).
2.4.2 不同氧气浓度对菌株生长及甲基汞生成的影响按上述方法配制不同氧气浓度的KB培养体系, 分别接种1%对数生长期的菌株TRGB3, 添加无菌HgCl2溶液, 使其终浓度为300.0 ng·L-1;然后在120 r·min-1、30 ℃下恒温避光培养, 并分别于0、3、6、9、15、21、27、36、45、54 h时取样, 测定菌体密度及甲基汞(MeHg)和总汞(THg)含量.以不接菌的空白为对照(CK), 每个处理设置3个重复.
2.5 分析方法与质量控制试验所用器皿均由硼硅玻璃材质制成, 用25%(体积分数)硝酸水溶液浸泡24 h以上, 经超纯水洗净, 450 ℃下高温灼烧30 min, 在洁净无汞的环境中冷却待用.菌体密度(OD600)采用分光光度法测定;MeHg测定采用蒸馏-乙基化结合GC-CVAFS法(蒋红梅等, 2004);THg测定采用二次金汞齐-冷原子荧光光谱法(冯新斌等, 1997).上述分析过程采用空白试验、平行样等进行质量控制, 所有样品分析中均带有标准样品以控制结果的准确性, 水样采用加标回收, 本试验标准样品的加标回收率为80%~120%, 平行样变异系数 < 10%.此外, 试验对5%的样品进行重复测定.
2.6 数据分析试验数据采用SPSS、Origin 9.0、Excel 2016进行处理.
3 结果与分析(Results and analysis)3.1 菌株分离及鉴定3.1.1 菌株形态及生理生化特性分离的菌株于30 ℃培养24 h后, 菌落呈规则的圆球形, 湿润凸起, 表面光滑透明;菌体呈杆状, 单个或短链状排列, 不形成芽孢, 长×宽约为(1~2) μm × 0.5 μm(图 1).生理生化特征结果表明(表 2), 该菌株属于革兰氏阴性菌, 接触酶、淀粉水解及吲哚等试验均为阳性, M.R、V.P、丙二酸钠、柠檬酸盐利用、明胶和氧化酶等试验为阴性, 并且在培养15 h后产气.
图 1(Fig. 1)
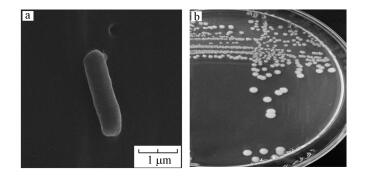 |
| 图 1 分离菌株的扫描电镜图(a, 20000×)及其菌落形态图(b) Fig. 1The morphological characteristics of isolated strains observed under SEM(a, 20000×) and the shape of bacterial colony(b) |
表 2(Table 2)
| 表 2 分离菌株的生理生化特征 Table 2 Physiological and biochemical characteristics of the isolated strain | ||||||||||||||||||||||||
表 2 分离菌株的生理生化特征 Table 2 Physiological and biochemical characteristics of the isolated strain
| ||||||||||||||||||||||||
3.2 菌株16S rRNA基因系统发育分析对分离的菌株进行16S rRNA基因测序, 其序列长度为1442 bp(GenBank登录号为MK10 2091).通过Blast比对, 选取具有代表性的菌株, 构建系统发育树(图 2).结果表明, 菌株TGRB3与Raoultella terrigena具有99%的同源性, 结合形态和生理学特性, 判断该菌属于土生拉乌尔菌, 故将其命名为Raoultella terrigena TGRB3.
图 2(Fig. 2)
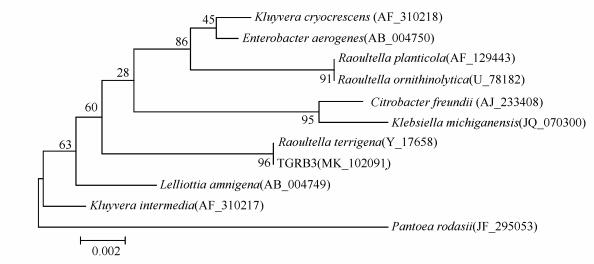 |
| 图 2 分离菌株基于16S rRNA基因的系统进化树 Fig. 2Phylogenetic tree of isolated strain based on 16S rRNA gene sequence |
3.3 菌株的生物学特性3.3.1 不同汞离子浓度对菌株生长的影响Hg2+浓度为0 μg·L-1的空白对照处理中, 培养27 h时菌体密度为(2.33±0.06) Abs (图 3a);而在Hg2+浓度为500 μg·L-1的处理中, 菌体密度为(1.27±0.19) Abs, 显著低于不加汞的对照处理;Hg2+浓度为1000 μg·L-1的处理中, 菌株生长受到显著抑制, 仅在培养后期有少量菌体增长;而在Hg2+浓度分别为1500和2000 μg·L-1的处理中, 菌株基本不生长.该结果表明菌株TGRB3在1000 μg·L-1的处理中生长受到明显抑制, 其对无机汞的耐受浓度在500~1000 μg·L-1范围内.
图 3(Fig. 3)
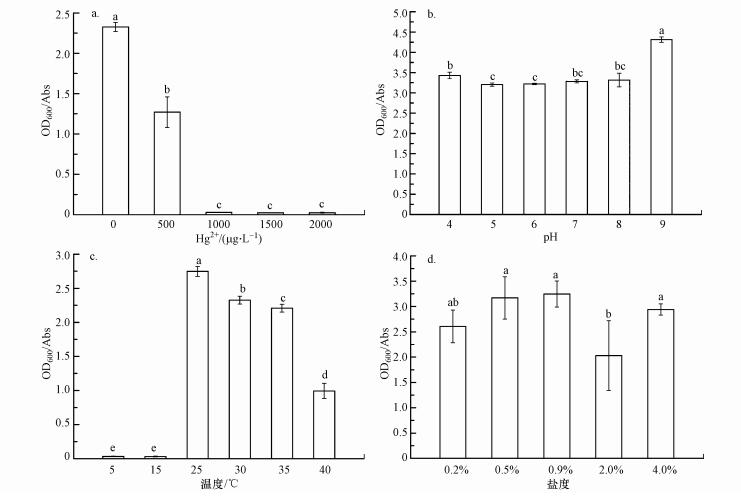 |
| 图 3 TGRB3菌在不同Hg2+浓度(a)、初始pH(b)、温度(c)和盐度(d)下的生长量 Fig. 3The growth yield of strain TGRB3 under different Hg2+ concentrations(a), initial pH(b), temperature(c) and salinity(d) conditions |
3.3.2 不同酸碱度对菌株生长的影响菌株TGRB3在pH=4~9条件下都能正常生长(图 3b), 在pH=9的处理中, 菌株生长量显著高于其余5个处理, 培养27 h时菌体密度达到(4.31±0.07) Abs;其次为pH=4处理, 菌体密度为(3.43±0.08) Abs;菌体在pH=5和6的处理中生长最低, 其菌体密度分别为(3.21±0.04)和(3.22±0.02) Abs.
值得注意的是, 菌株TGRB3在培养15 h后, 开始大量产生CO2.培养27 h后, 各处理的酸碱度无显著差异, 在pH=4~9的6个处理中, 培养体系的最终pH值分别为3.55、3.56、3.53、3.64、3.78和3.79.上述结果表明菌株TGRB3具有较强的酸碱适应性.
3.3.3 不同温度对菌株生长的影响环境温度对菌株TGRB3的生长量具有显著影响(图 3c), 各处理的菌株生长总体表现为:25 ℃>30 ℃>35 ℃>40 ℃>15 ℃≈5 ℃.菌株的最适生长温度为25 ℃, 培养27 h时其菌体密度达到(2.75±0.07) Abs.温度低于15 ℃或超过30 ℃时, 菌株生长受到显著抑制, 15 ℃和5 ℃处理的菌体密度分别仅为(0.03±0.00)和(0.03±0.00) Abs;而在30、35和40 ℃条件下, 菌体密度分别为(2.33±0.06)、(2.21±0.06)和(0.99±0.11) Abs.据报道, 细菌最适生长温度范围在25~30 ℃之间的为中温型细菌(马诗淳等, 2009), 因此, 本试验结果表明菌株TGRB3属于中温型细菌.
3.3.4 不同盐度对菌株生长的影响盐度对TGRB3菌生长的影响如图 3d所示, 菌株TGRB3在5个盐度条件下都能正常生长, 各处理的菌株生长总体表现为:0.9%盐度≈0.5%盐度≈4.0%盐度≥0.2%盐度>2.0%盐度, 其最适生长盐度为0.9%, 该处理下菌体密度达到(3.25±0.26) Abs;但即使是生长最弱的2.0%盐度条件下, 菌体密度仍能达到(2.03±0.69) Abs.该结果表明菌株TGRB3具有较高盐度适应能力.
3.4 氧气浓度对菌株TGRB3汞甲基化能力的影响3.4.1 不同氧气浓度条件下菌株生长情况如图 4a所示, 菌株TGRB3在不同氧气浓度下均能生长, 总体表现为:7%氧浓度>14%氧浓度≈21%氧浓度>0%氧浓度.厌氧(氧浓度为0%)条件下, 菌株在培养3 h后进入对数生长期, 到第27 h进入平稳期, 菌体密度为(1.43±0.10) Abs;在氧浓度分别为7%、14%和21%条件下, 菌株生长相对较快, 不到3 h即进入对数生长期, 且均在第21 h进入稳定期, 菌体密度分别为(2.15±0.19)、(1.71±0.05)和(1.65±0.10) Abs.上述结果表明, 好氧或兼性好氧更有利于菌株TGRB3生长, 但总体而言, 该菌生长并不受环境氧气浓度变化的制约.
图 4(Fig. 4)
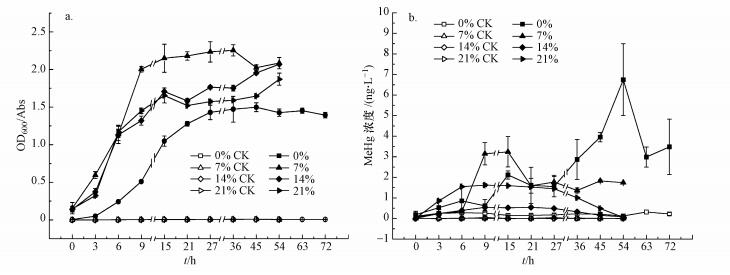 |
| 图 4 不同氧气浓度条件下TGRB3菌的生长曲线(a)及其汞甲基化特征(b) Fig. 4The bacterial growth curve of strain TGRB3(a) and Hg methylation characteristics of strain TGRB3(b) under different oxygen concentrations |
3.4.2 不同氧气浓度条件下菌株TGRB3的汞甲基化菌株TGRB3在4个氧浓度处理中均表现出汞甲基化能力(图 4b), 总体表现为:0%氧浓度>7%氧浓度>21%氧浓度>14%氧浓度.
在氧浓度为7%的处理中, 甲基汞浓度在0~6 h时缓慢增加, 在6~9 h时呈指数增高, 在9~15 h时达到最大甲基汞产量, 其最大甲基汞浓度为(3.24±0.74) ng·L-1, 最大甲基化率为1.24%;21 h后甲基汞浓度显著下降, 在(1.66±0.71) ng·L-1左右波动.在氧浓度为14%的处理中, 甲基汞浓度在9 h时达到最大, 最大甲基汞浓度为(0.54±0.01) ng·L-1, 最大甲基化率为0.21%;随后甲基汞保持较稳定的产量, 直到36 h后开始下降, 第54 h时甲基汞浓度仅为0.08 ng·L-1.在氧浓度为21%的处理中, 甲基汞浓度变化趋势与氧浓度为14%的处理基本一致, 但甲基汞产量显著增高:在培养9 h后, 甲基汞浓度达到最大, 为(1.62±0.08) ng·L-1, 最大甲基化率为0.62%, 随后甲基汞保持较稳定的产量, 直到27 h后开始下降, 在54 h时甲基汞浓度仅为0.05 ng·L-1, 较最大值下降96.7%.
值得注意的是, 在厌氧条件下(氧浓度为0%), 菌株甲基汞呈现出两阶段产生模式:9~15 h时, 甲基汞产量表现出第一阶段的增长, 其最大甲基汞浓度为(2.12±0.20) ng·L-1, 最大甲基化率为0.81%, 其后保持基本稳定的水平直至第27 h;第27~54 h时, 甲基汞产量表现出第二阶段的显著增长, 其最大甲基汞浓度为(6.75±1.75) ng·L-1, 最大甲基化率为2.60%;此后, 甲基汞产量则呈现急剧下降, 64 h后甲基汞浓度恢复到(3.23±1.39) ng·L-1的水平.
4 讨论(Discussion)张成等(2014)研究发现, 三峡库区消落带大部分地区土壤汞含量为22.4~393.5 μg·kg-1.本试验通过设置不同汞浓度水平, 证明菌株TGRB3对无机汞具有一定的耐受能力, 纯培养条件下, 菌株对无机汞(Hg2+)的耐受浓度范围为500~1000 μg·L-1.该结果与曾艳等(2009)从受汞污染的土壤中分离、获得的Hg2+耐受浓度达40 mg·L-1的芽孢杆菌(Bacillus sp.)存在较大差异, 可能是由于TGRB3菌株分离至库区消落带土壤, 未遭受环境汞污染形成的选择压所致.
通过菌株TGRB3对环境酸碱度的响应研究发现, 所获得的菌株具有较强的酸碱适应能力.该结果与Yu等(2011)从香港河豚中分离的R. terrigena菌不耐酸、仅在中偏碱性条件下生长的结果不一致, 这可能是因生长环境不同所致.就三峡库区消落带而言, 其土壤pH值随着水位的改变而显著改变, 淹水后酸性土壤pH值升高, 而碱性土壤的pH值降低(张金洋等, 2004).水库周期性的水位交替使得菌株TGRB3对此产生生态适应能力, 导致环境酸碱度对其生长的影响作用不大.此外, 菌株TGRB3在培养15 h后开始大量产生CO2, 由此改变了培养体系的酸碱度, 致使该菌具有较强的酸碱适应能力.
菌株TGRB3属于中温型细菌, 其最适生长温度为25 ℃.马力等(2018)分析了三峡库区局地环境温度的变化, 结果表明, 2004—2014年期间的年均地面温度为20.4 ℃, 最低月平均温度为6.1 ℃;夏季平均温度在30 ℃以上, 最高月平均温度为7月的33.3 ℃.TGRB3菌最适宜生长温度是25 ℃, 表明该菌株具有对三峡库区环境温度的生态适应能力.
盐度在0.2%~4.0%范围内对菌株TGRB3生长的影响不大, 该结果与Yu等(2011)的结果不同, 其分离的R. terrigena菌在盐度大于3%后不生长, 可能原因是后者供试菌株分离自鱼体肠道内, 对环境盐度较敏感所致.
不同氧浓度试验研究表明, 菌株TGRB3生长不受氧浓度变化的限制.三峡库区消落带具有特殊的干-湿交替环境使得土壤中不适应环境的微生物种群被淘汰, 微生物群落分布发生了变化(肖国生等, 2011).由于这种特殊的周期性淹水-落干生态环境, 导致土壤含氧量形成周期性变化的选择压.本试验结果证明, 所分离、获得的土生拉乌尔菌表现为在相对偏好氧生长前提下, 对氧气浓度变化具有广泛适应性.
菌株TGRB3在不同氧浓度处理中均表现出汞生物甲基化能力, 其中, 在3个有氧条件下该菌表现为:随着对数期菌体数量的增加, 培养体系的甲基汞浓度显著增加, 且在细菌生长达到稳定期时维持着较高的甲基汞浓度, 这与E. aerogenes (Hamdy et al., 1975)和Pseudomonas fluorescens XD-MeHg-B2 (陶兰兰等, 2016)相似.但值得注意的是, 其后虽然细菌仍然处于稳定期进行生长, 但却表现出强烈的去甲基化现象, 培养体系中甲基汞浓度呈显著下降.Delaune等(2004)研究发现, 在氧浓度较高(氧化还原电位高)的条件下, 去甲基化作用更容易被加强;此外, 细菌在进行甲基化的同时, 去甲基化作用也在进行(阴皎阳等, 2014);另一方面, 当菌体生长到达平台期后, 大多数细胞停止生长, 而不再生长的活细胞易发生去甲基化(Ramamoorthy et al., 1982), 去甲基化作用的增强导致甲基汞的净累积量减少.而菌株TGRB3表现出的去甲基化机理是什么?对此, 我们将在后续的工作中开展深入研究.
在厌氧条件下, TGRB3虽然表现为菌体的生长和甲基汞的生成呈同步缓慢增高, 但在菌体生长达到稳定期后, 甲基汞的产生则呈现为两阶段产生方式, 且最大甲基汞生成量显著高于3个有氧处理.该试验结果表明, 菌株TGRB3在厌氧或低氧浓度条件下表现出更强的汞生物甲基化能力.该结果与众多研究相一致, 即微生物的汞甲基化能力在厌氧条件下更稳定, 同时也支持了贺春凤(2013)的研究结果, 三峡库区消落带土壤中的甲基汞含量随着淹水时间的延续呈上升趋势, 并且低氧条件比高氧条件更有利于甲基汞的释放.
三峡库区消落带土壤是一个特殊的湿地生态系统, 土壤长期经历周期性的干湿交替, 导致消落带土壤中的重金属元素、氧化还原电位、物理化学特性、土壤微生物活性及群落结构等都发生了巨大的变化(马利民等, 2008), 从而影响土壤中汞释放和甲基汞的生成.土壤干湿交替循环导致土壤甲基汞含量增加(张成等, 2014), 微生物驱动的汞甲基化在这个循环中起到重要作用.三峡水库水位是一个上升和下降的过程, 而目前对水库中汞甲基化微生物的研究主要集中在厌氧菌上, 有关好氧菌的研究甚少, 而对于参与全程水位改变并起汞甲基化作用的微生物研究更少.因此, 本研究通过对菌株TGRB3进行定量氧气浓度试验, 能更能真实地反映三峡库区消落带土壤微生物的生长和汞甲基化情况, 可为三峡库区消落带土壤微生物汞甲基化研究提供理论依据.
5 结论(Conclusions)1) 从三峡库区典型周期性干-湿交替消落带土壤中分离获得1株在不同氧气浓度下具有汞甲基化能力的菌株, 经细菌形态学、生理生化及16S rRNA基因分子生物学分析, 鉴定该菌株为土生拉乌尔菌, 将其命名为RaouLtella terrigena TGRB3.目前, 尚未见有关土生拉乌尔菌汞生物甲基化的研究.
2) 菌株TGRB3属于中温型细菌, 最适生长温度为25 ℃, 能在0.2%~4.0%盐度范围正常生长, 并可在pH=4~9的KB培养基中正常生长, 稳定期可产生CO2;在无机汞浓度为1000 μg·L-1的培养基中生长受到明显抑制.
3) 菌株TGRB3的生长不受环境氧气浓度的影响, 其汞甲基化能力在无氧或兼性厌氧条件下更强, 在初始Hg2+浓度为300 ng·L-1的KB培养体系中, TGRB3菌的最大甲基汞浓度显著高于好氧或兼性好氧处理, 且能保持相对稳定的甲基汞产率;在14%和21%的氧浓度条件下, 菌株生长后期表现出甲基汞含量呈显著下降的现象.
综上, 菌株TGRB3有望作为生物模式菌, 为深入探究好/厌氧条件下汞生物甲基化机理、代谢途径, 以及正确评价三峡库区汞生态风险提供试验材料.
参考文献
| Bisogni J J, Lawrence A W. 1975. Kinetics of mercury methylation in aerobic and anaerobic aquatic environments[J]. Journal of Water Pollution Control Federation, 47(1): 135–152. |
| Bowles K C, Apte S C, Maher W A, et al. 2001. Bioaccumulation and biomagnification of mercury in Lake Murray, Papua New Guinea[J]. Journal Canadien Des Sciences Halieutiques Et Aquatiques, 58(58): 888–897. |
| Brunberg A K, Blomqvist P. 2001. Quantification of anthropogenic threats to lakes in a lowland county of central Sweden[J]. Ambio, 30(3): 127–134.DOI:10.1579/0044-7447-30.3.127 |
| Delaune R D, Jugsujinda A, Devai I, et al. 2004. Relationship of sediment redox conditions to methyl mercury in surface sediment of Louisiana Lakes[J]. Environmental Letters, 39(8): 1925–1933. |
| 丁振华, 王文华, 庄敏. 2005. 汞的界面地球化学研究进展[J]. 海洋科学, 2005, 29(10): 54–57.DOI:10.3969/j.issn.1000-3096.2005.10.013 |
| Fleming E J, Mack E E, Green P G, et al. 2006. Mercury methylation from unexpected sources: molybdate-inhibited freshwater sediments and an iron-reducing bacterium[J]. Applied and Environmental Microbiology, 72(1): 457–464.DOI:10.1128/AEM.72.1.457-464.2006 |
| 冯新斌. 2011. 水库汞的生物地球化学循环研究进展[J]. 环保科技, 2011, 17(1): 1–5.DOI:10.3969/j.issn.1674-0254.2011.01.001 |
| 冯新斌, 洪业汤. 1997. 汞的环境地球化学研究进展[J]. 地球与环境, 1997, 32(4): 503–530. |
| 高亚辉, 荆红梅, 黄德强, 等. 2002. 海洋微藻胞外产物研究进展[J]. 海洋科学, 2002, 26(3): 35–38. |
| Hamdy M K, Noyes O R. 1975. Formation of methyl mercury by bacteria[J]. Appl Microbiol, 30(3): 424–432. |
| Hamelin S, Amyot M, Barkay T, et al. 2011. Methanogens: principal methylators of mercury in Lake Periphyton[J]. Environmental Science & Technology, 45(18): 7693–7700. |
| Hamelin S, Planas D, Amyot M. 2015. Mercury methylation and demethylation by periphyton biofilms and their host in a fluvial wetland of the St.Lawrence River (QC, Canada)[J]. Science of the Total Environment, 512-513: 464–471.DOI:10.1016/j.scitotenv.2015.01.040 |
| Heyes A, Mason R P, Kim E H, et al. 2006. Mercury methylation in estuaries: Insights from using measuring rates using stable mercury isotopes[J]. Marine Chemistry, 102(1): 134–147. |
| 贺春凤.2013.三峡库区消落带土壤淹水过程汞释放与甲基化特征的模拟研究[D].重庆: 西南大学http://cdmd.cnki.com.cn/Article/CDMD-10635-1013270084.htm |
| 胡海燕.2012.厌氧微生物与汞的相互作用: 结合、氧化、还原和甲基化[D].北京: 中国科学院大学http://d.wanfangdata.com.cn/Thesis/Y2368144 |
| 何熙.2013.三峡库区消落带土壤(沉积物)总汞及甲基汞变化特征[D].重庆: 西南大学http://cdmd.cnki.com.cn/Article/CDMD-10635-1013270448.htm |
| Jackson T A. 2016. Historical variations in the stable isotope composition of mercury in a sediment core from a riverine lake: Effects of dams, pulp and paper mill wastes, and mercury from a chlor-alkali plant[J]. Applied Geochemistry, 71(2016): 86–98. |
| Janssen S E, Schaefer J K, Barkay T, et al. 2016. Fractionation of mercury stable isotopes during microbial methylmercury production by iron- and sulfate-reducing bacteria[J]. Environmental Science & Technology, 50(15): 8077. |
| 蒋红梅, 冯新斌, 梁琏, 等. 2004. 蒸馏-乙基化GC-CVAFS法测定天然水体中的甲基汞[J]. 中国环境科学, 2004, 24(5): 568–571.DOI:10.3321/j.issn:1000-6923.2004.05.014 |
| Kearns K D, Hunter M D. 2010. Green algal extracellular products regulate antialgal toxin production in a cyanobacterium[J]. Environmental Microbiology, 2(3): 291–297. |
| Kumano S, Sugiyama M, Yamada M, et al. 2013. Development of a portable mass spectrometer characterized by discontinuous sample gas introduction, a low-pressure dielectric barrier discharge ionization source, and a vacuumed headspace technique[J]. Analytical Chemistry, 85(10): 5033–5039.DOI:10.1021/ac4002904 |
| 康义, 郭泉水, 程瑞梅, 等. 2010. 三峡库区消落带土壤物理性质变化[J]. 林业科学, 2010, 46(6): 1–5. |
| Lindberg S E, Kim K H, Meyers T P, et al. 1995. Micrometeorological gradient approach for quantifying air/surface exchange of mercury vapor: Tests over contaminated soils[J]. Environmental Science and Technology, 29(1): 126–135.DOI:10.1021/es00001a016 |
| Lu X, Liu Y, Johs A, et al. 2016. Anaerobic mercury methylation and demethylation by Geobacter bemidjiensis Bem[J]. Environmental Science & Technology, 50(8): 4366–4373. |
| Miller T L, Wolin M J. 1974. A serum bottle modification of the Hungate technique for cultivating obligate anaerobes[J]. Applied microbiology, 27(5): 985–987. |
| 马力, 于瑞林, 李杰, 等. 2018. 基于时间序列分析并预测三峡库区局地环境温度的变化[J]. 中国农业气象, 2018, 39(1): 9–17.DOI:10.3969/j.issn.1000-6362.2018.01.002 |
| 马利民, 张明, 滕衍行, 等. 2008. 三峡库区消落区周期性干湿交替环境对土壤磷释放的影响[J]. 环境科学, 2008, 29(4): 1035–1039.DOI:10.3321/j.issn:0250-3301.2008.04.032 |
| 马诗淳, 罗辉, 杨丽丽, 等. 2009. 中温厌氧纤维素菌的分离鉴定, 系统发育学分析及其酶学性质的研究[J]. 中国沼气, 2009, 27(3): 3–7.DOI:10.3969/j.issn.1000-1166.2009.03.001 |
| 孟紫强. 2000. 环境毒理学[M]. 北京: 中国环境科学出版社. |
| Nalewajko C, Fay K L. 1980. Significance of algal extracellular products to bacteria in Lakes and in Cultures[J]. Microbial Ecology, 6(3): 199–207.DOI:10.1007/BF02010385 |
| 邱权, 陈雯莉. 2013. 三峡库区小江流域消落区土壤微生物多样性[J]. 华中农业大学学报, 2013, 32(3): 15–20.DOI:10.3969/j.issn.1000-2421.2013.03.003 |
| Ramamoorthy S, Cheng T C, Kushner D J. 1982. Effect of microbial life stages on the fate of methylmercury in natural waters[J]. Bulletin of Environmental Contamination & Toxicology, 29(2): 167–173. |
| R.E.布坎南. 1984. 伯杰细菌鉴定手册[M]. 北京: 科学出版社. |
| 陶兰兰, 向玉萍, 王定勇, 等. 2016. 1株兼具好、厌氧汞甲基化能力细菌的分离鉴定[J]. 环境科学, 2016, 37(11): 4389–4394. |
| Vonk J W, Sijpesteijn A K. 1973. Studies on the methylation of mercuric chloride by pure cultures of bacteria and fungi[J]. Antonie Van Leeuwenhoek, 39(1): 505–513.DOI:10.1007/BF02578894 |
| 肖国生, 胡廷章, 唐华丽, 等. 2011. 三峡水库消落带淹没前后土壤微生物生态分布及优势菌群的鉴定[J]. 江苏农业科学, 2011, 39(4): 493–496.DOI:10.3969/j.issn.1002-1302.2011.04.197 |
| Yang H J, Yue Q. 2012. The modification of glucose levels and N source in the Hungate′s medium to stimulate the production of fibrolytic enzymes of Anaeromyces sp.YQ3 grown on corn stalks[J]. Animal Feed Science & Technology, 171(2/4): 146–153. |
| Yu C H, Yu H F, Ho K C, et al. 2011. Isolation and identification of a new tetrodotoxin-producing bacterial species, Raoultella terrigena, from Hong Kong marine puffer fish Takifugu niphobles[J]. Marine Drugs, 9(12): 2384–2396. |
| Xiang Y P, Xiang, Du H X, Shen H, et al. 2014. Dynamics of total culturable bacteria and its relationship with methylmercury in the soils of the water level fluctuation zone of the Three Gorges Reservoir[J]. Science Bulletin, 59(24): 2966–2972.DOI:10.1007/s11434-014-0324-4 |
| 阴皎阳, 尹大强, 王锐. 2014. 沉积物中汞的甲基化研究进展[J]. 生态毒理学报, 2014, 9(5): 819–831. |
| 袁辉, 王里奥, 詹艳慧, 等. 2006. 三峡库区消落带健康评价指标体系[J]. 长江流域资源与环境, 2006, 15(2): 249–253.DOI:10.3969/j.issn.1004-8227.2006.02.023 |
| Zhang J, Wang F Y, House J D, et al. 2004. Thiols in wetland interstitial waters and their role in mercury and methylmercury speciation[J]. Limnology and Oceanography, 49(6): 2276–2286.DOI:10.4319/lo.2004.49.6.2276 |
| 张成, 陈宏, 王定勇, 等. 2014. 三峡库区消落带土壤汞形态分布与风险评价[J]. 环境科学, 2014, 35(3): 1060–1067. |
| 张金洋, 王定勇, 石孝洪. 2004. 三峡水库消落区淹水后土壤性质变化的模拟研究[J]. 水土保持学报, 2004, 18(6): 120–123.DOI:10.3321/j.issn:1009-2242.2004.06.029 |
| 曾艳, 陈强, 王敏, 等. 2009. 一株高抗汞细菌的分离鉴定及其抗性基因的克隆与表达[J]. 微生物学报, 2009, 49(12): 1628–1633.DOI:10.3321/j.issn:0001-6209.2009.12.013 |
