 , 张衍1,2,3, 龚林林1, 崔敏华1,2,3, 刘和1,2,3
, 张衍1,2,3, 龚林林1, 崔敏华1,2,3, 刘和1,2,3
 , 章湝1, 符波1,2,3, 刘宏波1,2,3
, 章湝1, 符波1,2,3, 刘宏波1,2,31. 江南大学环境与土木工程学院, 无锡 214122;
2. 江苏省厌氧生物技术重点实验室, 无锡 214122;
3. 江苏省水处理技术与材料协同创新中心, 苏州 215011
收稿日期: 2018-11-21; 修回日期: 2019-01-03; 录用日期: 2019-01-03
基金项目: 国家自然科学基金(No.51678280,51708253);江苏省太湖水污染治理专项(No.TH2016201);江南大学自主科研计划
作者简介: 姜倩倩(1994-), 女, E-mail:1664689492@qq.com
通讯作者(责任作者): 刘和, E-mail:liuhe@jiangnan.edu.cn
摘要: 厌氧消化-微生物电解池(Anaerobic digestion-Microbial electrolysis cell,AD-MEC)具有有机物降解速度快、降解率高的优点,但其所产沼气中依然存在CO2含量较高的问题.为降低AD-MEC所产沼气中CO2的含量,本研究将矿物碳酸化耦合入AD-MEC中,研究添加硅灰石对AD-MEC中CO2的固定效果.实验结果表明,添加硅灰石可使AD-MEC中CO2产生量减少40.0%,沼气中CO2含量从10.0%±1.3%减少到4.5%±1.1%;X射线衍射(XRD)及扫描电镜-能谱(SEM-EDS)分析表明了CaCO3沉淀的生成,证明硅灰石介导矿物碳酸化固定了AD-MEC中的CO2.此外,添加硅灰石使Ca2+溶出,缓冲了pH,减轻了厌氧消化产酸阶段对产甲烷菌的抑制,促进了有机物的降解,可溶性化学需氧量(SCOD)去除率提高了11.2%,并使CH4产量提高18.0%,CH4产率达到305 mL·g-1,沼气中CH4含量达到95.5%±1.2%.硅灰石的添加实现了AD-MEC中CO2的原位捕获,同时增益了厌氧消化效果,提高了甲烷产量.
关键词:微生物电解池污泥水解液产甲烷硅灰石二氧化碳固定
Wollastonite mediated carbon dioxide sequestration and methane production promotion in anaerobic digestion-microbial electrolysis cell
JIANG Qianqian1
 , ZHANG Yan1,2,3, GONG Linlin1, CUI Minhua1,2,3, LIU He1,2,3
, ZHANG Yan1,2,3, GONG Linlin1, CUI Minhua1,2,3, LIU He1,2,3
 , ZHANG Jie1, FU Bo1,2,3, LIU Hongbo1,2,3
, ZHANG Jie1, FU Bo1,2,3, LIU Hongbo1,2,3 1. School of Environment and Civil Engineering, Jiangnan University, Wuxi 214122;
2. Jiangsu Key Laboratory of Anaerobic Biotechnology, Wuxi 214122;
3. Jiangsu Collaborative Innovation Center of Water Treatment Technology and Material, Suzhou 215011
Received 21 November 2018; received in revised from 3 January 2019; accepted 3 January 2019
Abstract: Anaerobic digestion-Microbial electrolysis cell (AD-MEC) has the advantages of high degradation rate and high degradation efficiency for organic matters. However, CO2 still exists in its produced biogas with relatively high content. In order to reduce the CO2 content in biogas, mineral carbonation was coupled in AD-MEC with wollastonite addition in this study. The experimental results show that the addition of wollastonite reduced the CO2 production in AD-MEC by 40.0%, decreased CO2 content in biogas from 10.0%±1.3% to 4.5%±1.1%. Results of X-ray diffraction (XRD) and scanning electron microscopy-energy spectroscopy (SEM-EDS) indicate the formation of CaCO3 precipitate, indicating that CO2 was fixed in AD-MEC by wollastonite mediated mineral carbonation. In addition, the release of Ca2+ from the wollastonite buffered pH during VFAs production and alleviated the inhibition of methanogenesis in the AD-MEC, and improved the degradation of organic matters, with SCOD removal increased by 11.2%. The yield of CH4 improved by 18.0%, while the productivity of CH4 reached 305 mL·g-1, and the content of CH4 in biogas reached 95.5%±1.2%. Wollastonite addition simultaneously achieved in-situ CO2 sequestration and CH4 production promotion in AD-MEC.
Keywords: microbial electrolysis cellsludge hydrolysatemethane productionwollastonitecarbon sequestration
1 引言(Introduction)微生物电解池(Microbial electrolysis cell, MEC)是附着在阳极上的微生物氧化分解有机物的同时产生电子和质子, 电子在外加电压的作用下, 通过外电路传递到阴极, 质子通过溶液传递到阴极并在辅助电势和催化剂的作用下与电子结合发生化学反应的装置(Liu et al., 2004; Borole et al., 2011; Wang et al., 2013).利用微生物电解池技术可以实现制氢(Logan et al., 2008)、产甲烷(Cheng et al., 2009)、降解难降解的污染物(Zhang et al., 2018)等过程.与传统厌氧消化相比, 厌氧消化-微生物电解池(Anaerobic digestion-Microbial electrolysis cell, AD-MEC)具有可促进复杂有机底物降解、降解速度快、降解程度高等优势(韩婷婷, 2014; 孙宏扬, 2014; 刘建等, 2017).但AD-MEC所产沼气中CO2含量较高, 通常为10%~18%(Bo et al., 2015;向元英等, 2016; 吴亭亭等, 2017), 沼气需要进一步纯化以便后续利用.
矿物碳酸化是一种新型的具有极大潜力的CO2固定方式(Park et al., 2003), 它模拟了自然界中CO2的矿物吸收过程, 即CO2与CaSiO3、MgSiO3等碱性硅酸盐矿石反应, 生成稳定碳酸盐的过程(包炜军等, 2007).但由于这个过程首先需要在酸性条件下使二价阳离子从矿石释放到溶液中, 随后在中性或碱性条件下使CO2与阳离子反应生成碳酸盐.在自然条件下, 矿物中阳离子的释放速率较慢, 这是矿物碳酸化应用受到限制的主要原因.快速释放二价阳离子也是矿物碳酸化固碳过程的主要挑战之一(Walker et al., 1981).而矿物碳酸化可以与具有产酸和产碱两相反应的生物过程相结合, 在生物反应过程中实现CO2的固定(Bennett et al., 2001).如厌氧消化的产酸阶段可使溶液呈酸性, 从而溶解矿物, 释放金属阳离子; 随后的产甲烷阶段可创造碱性环境, 使金属阳离子与CO2结合生成碳酸盐沉淀, 实现矿物碳酸化固定CO2.在MEC中, 阳极氧化有机物产生质子, 创造酸性环境, 促进金属阳离子的释放; 而阴极反应消耗质子形成碱性环境, 金属阳离子可与溶液中的CO2生成碳酸盐从而固定CO2.因此, 可以将矿物碳酸化与AD-MEC结合起来, 实现原位碳酸化固定CO2, 提升沼气中甲烷纯度.然而, 目前还没有在AD-MEC中运用矿物碳酸化开展原位CO2固定的研究报道.
基于此, 本研究拟构建单室AD-MEC反应器, 以污泥水解液为底物, 以矿物碳酸化常用的硅灰石(CaSiO3)为矿物材料, 研究加入硅灰石对AD-MEC中CO2的原位固定, 探究其对AD-MEC产气效果的改善.
2 材料与方法(Materials and methods)2.1 材料本文所用硅灰石与课题组前期研究(Zhang et al., 2019)一致, 购于江西新余市思远矿业有限公司, 用球磨机研磨粉碎, 然后将粉末样品过120目标准筛, 以备实验使用.该硅灰石X射线衍射(XRD)分析图谱与标准图谱一致, 能谱分析(EDS)得到硅灰石主要元素组成为(质量分数):Ca 29.92%、O 43.82%、C 9.06%、P 0.01%、Si 16.29%、Mg 0.28%、Fe 0.21%、Al 0.30%.
污泥水解液由无锡硕放污水处理厂的脱水污泥制备而来.将脱水污泥TS调为6%, 放入105 ℃烘箱中热处理24 h, 取出搅拌均匀后静置, 取上层液体在8000 r·min-1下离心10 min, 离心后上清液即为本研究所用污泥水解液, 其性质如表 1所示.为使AD-MEC在较适宜的负荷下运行, 将污泥水解液稀释5倍使用.
表 1(Table 1)
| 表 1 污泥水解液性质 Table 1 Properties of sludge hydrolysatem | ||||||||||||||||||
表 1 污泥水解液性质 Table 1 Properties of sludge hydrolysatem
| ||||||||||||||||||
2.2 实验装置本实验使用有机玻璃制成的单室微生物电解池反应器, 反应器的空腔体积为350 mL, 阳极为长5 cm、直径5 cm的碳纤维刷, 阴极为涂有铂碳催化剂的碳纤维布, 其工作直径为8 cm, 载铂含量为0.5 mg·cm-2, 阴阳极之间连接一个10 Ω的电阻, 两电极之间用稳定电压源(3465 A, Array, 南京)提供0.8 V的稳定电压, 各部分之间用导线连接, 在电阻两端用数据采集器(2700, Keithley, 美国)进行电压测量并换算成电流, 同时使用气袋收集装置所产生的沼气.参比电极使用相对于氢标准电位为+0.197 V的Ag/AgCl参比电极(218型, 雷磁, 上海).实验装置如图 1所示.
图 1(Fig. 1)
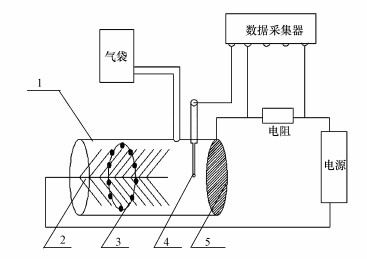 |
| 图 1 实验装置示意图 (1. AD-MEC反应器; 2.阳极碳刷; 3.透析袋包裹的硅灰石; 4. Ag-AgCl参比电极; 5.阴极碳布) Fig. 1Schematic diagram of experimental device |
2.3 反应器的运行启动阶段, 以无锡硕放污水处理厂二沉池出水所含微生物作为接种物, 向二沉池出水中溶入2 g·L-1的乙酸钠作为底物, 加入两个完全相同的反应器后, 用氮气曝气20 min以去除溶液中的氧气.保持温度30 ℃, 每隔24 h测定其SCOD变化, 至SCOD降低至约200 mg·L-1时, 更换新的培养液并进行下一个周期运行.如此反复多次, 直至SCOD的降解率及产气情况逐渐趋于稳定, 反应器启动完成.
在反应器启动完成后, 将底物更换为稀释5倍的污泥水解液, 2个反应器(反应器A、反应器B)平行运行, 每隔24 h取样测定其SCOD变化.根据电势和电流变化情况, 确定每96 h为一个周期, 每个周期结束后测定产气情况.在稳定运行数个周期之后选取反应器A将其开路运行, 作为开路对照运行, 以考察外电路对反应器性能的影响, 随后将反应器恢复闭路运行并稳定几个周期.用3500 D的透析袋包裹5 g 120目的硅灰石粉末, 并将其用鱼线绑成串型.选取反应器A作为硅灰石投加反应器, 每个周期将绑好的硅灰石透析袋悬挂在在阳极碳刷周围, 运行反应器, 反应器B作为无硅灰石添加的对照反应器平行运行.
2.4 测试指标及分析方法可溶性化学需氧量(SCOD)参照我国国家标准方法(GB 11914-89)测定; 蛋白质采用BCA蛋白质浓度测定试剂盒(碧云天, 中国)测定; 钙离子浓度使用岛津原子吸收分光光度计(AA-7000, 日本)测定; 溶液电导率采用电导率仪(DDS-307A型, 雷磁, 上海)测定.
气体组分含量的测定:气体含量使用气相色谱法测定(FULI 9790Ⅱ, 中国).使用手动进样器, 抽取1 mL气体, 在自气相色谱仪进样口处注入气体.气相色谱仪的基本配置情况如下:气相色谱配备使用热导检测器(TCD)和不锈钢填充柱(AE. TDX-01, 2 m×3 mm), 99%的高纯氩气作为气体测定的载气.柱温、进样口和检测器的温度分别为80、150和150 ℃.对于H2, 热导检测器的电流为35 mA, 测定CO2和CH4时, 检测器的电流调节为80 mA.气体体积测定:集气袋集气体积使用玻璃注射器抽取测量.
沉淀产物的形貌特征采用扫描电子显微镜(SU1510, 日立, 日本)观察, 工作电压为3.0 kV, 样品喷金处理后进行检测.元素分析采用EDAX Apollo XL能谱仪, 加速电压为20 kV, 时间常数为7.68 μs, 谱采集时间为20 s.硅灰石和沉淀产物的晶体结构测定采用X-射线衍射仪(D8 Advance, 布鲁克, 德国), 扫描速度为4°·min-1.
3 结果与讨论(Results and discussion)3.1 AD-MEC的稳定运行效果在以污泥水解液为底物稳定运行情况下, 反应器A与反应器B的运行特性如图 2所示.反应器A与反应器B的峰值电流均在11.0 mA左右, SCOD降解率分别为71.2%±0.1%和70.5%±0.5%, 甲烷产量分别为(147.0±2.0)与(146.0±2.0) mL, 甲烷占比分别达到90.0%±1.2%与90.5%±0.5%, 二氧化碳体积分别为15.0 mL与16.0 mL, 占比分别为10.0%±1.3%与9.5%±1.6%.CH4和CO2含量与前人以乙酸盐为底物的研究结果(Bo et al., 2014)相似, 而以污泥为底物时也得出了类似的结果(Ran et al., 2014).在反应开始时, 反应器A的溶液电导率为(1640±30) μS·cm-1, 反应器B的溶液电导率为(1645±20) μS·cm-1; 在结束时, 反应器A的溶液电导率为(1710±10) μS·cm-1, 反应器B的溶液电导率为(1722±5) μS·cm-1.两个反应器的运行效果较好, 反应器间的平行性良好.
图 2(Fig. 2)
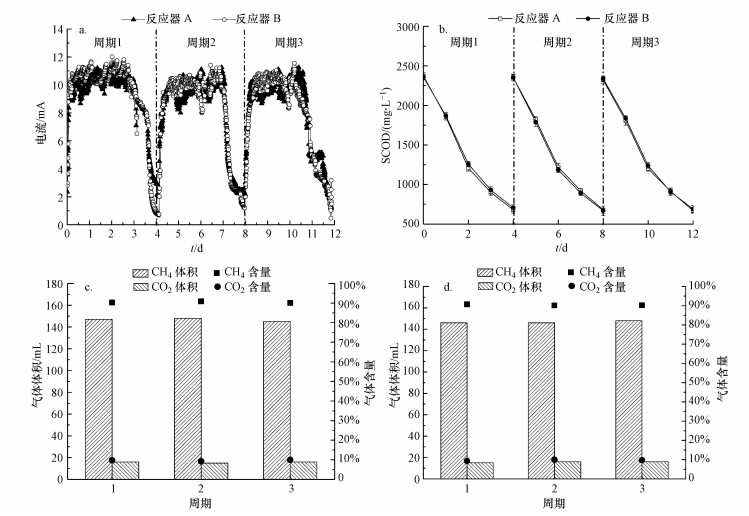 |
| 图 2 AD-MEC反应器稳定运行特性 (a.电流-时间图; b.SCOD降解情况; c.反应器A产气情况; d.反应器B产气情况) Fig. 2The characteristics of the AD-MECs during stable operation |
在有无外加电压的条件下, 反应器的性能差异如图 3所示.施加0.8 V电压的闭路反应器B对SCOD的降解率为68.0%±2.0%, 而开路运行的反应器A对SCOD的降解率仅为55.0%±2.0%.相应的, 闭路反应器B的产气总量为156.0 mL, 甲烷产量为140.0 mL, 占比为90.0%, 二氧化碳体积为15.0 mL, 占比为10.0%;而开路反应器A的产气总量为128.0 mL, 其甲烷产量仅为93.0 mL, 占比为73.0%, 二氧化碳体积则为35.0 mL, 占比高达27.0%.可见, 外加电压显著提升了反应器的有机物降解效果和产气性能, 与以往研究中以含乙酸的废水运行的相关实验结果(薄涛等, 2017)一致, 表明AD-MEC的良好运行特性及外加电压的重要作用.AD-MEC在施加外电压条件下, 一方面在阴极电势的辅助下, 阴极有H2生成, H2与CO2在嗜氢产甲烷菌的作用下生成甲烷; 二是在一定的阴极电势下存在CO2与e-、H+直接结合生成甲烷的途径(Cheng et al., 2009).在这两种途径的作用下, 施加外电压反应器的甲烷产量比开路运行反应器的甲烷产量更高, CO2含量也更低.本研究中开路运行的反应器中甲烷含量略高于常规厌氧消化(CH4含量一般为50%~70%)(尚梦, 2009), 可能是由于反应器A长期处于闭路运行状态, 虽临时切换至开路条件运行, 但反应器内的微生物群落仍存在大量嗜氢产甲烷菌, 可以利用CO2产甲烷, 从而导致其甲烷含量高于一般厌氧消化中的甲烷含量(Liu et al., 2004; Cheng et al., 2008).实验结果表明, 外电路显著提高了有机物的降解率, 促进了厌氧消化的效果, 提高了CH4产量, 同时有效降低了CO2含量, 显示出AD-MEC的良好运行效果.
图 3(Fig. 3)
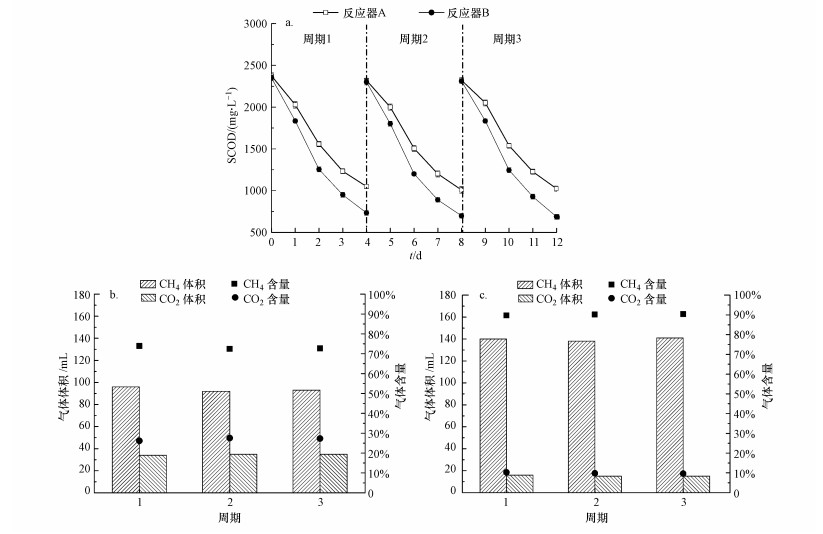 |
| 图 3 开路与闭路对照实验的SCOD降解与产气情况对比 (a. SCOD降解; b.反应器A(开路)产气情况; c.反应器B(闭路)产气情况) Fig. 3Comparison of SCOD degradation and biogas production between open circuit and closed circuit operation |
3.2 硅灰石对MEC运行效果的改善3.2.1 有机物降解投加硅灰石之后, AD-MEC的有机物降解情况如图 4所示.未投加硅灰石的反应器B的SCOD降解量为(1661±19) mg·L-1, SCOD最大降解率为70.0%±0.7%;而投加硅灰石的反应器A的SCOD降解效果得到有效提高, 降解量最高可至(1829±32) mg·L-1, 最大降解率达到77.8%±1.3%, 均高于未投加硅灰石的反应器B.对污泥水解液中主要有机组分多糖和蛋白质的降解进行分析, 发现硅灰石投加使多糖和蛋白质的降解率都有所提高.投加硅灰石的反应器A的多糖降解率可达90.6%±0.5%, 高于未投加硅灰石的反应器B的多糖降解率(85.9%±0.2%), 也远高于报道的以污泥发酵液为底物的MEC中多糖的降解率(Cheng et al., 2007).投加硅灰石对蛋白质降解率的提高相较多糖更为明显:投加硅灰石的反应器A的蛋白质降解率为68.86%±2.14%, 高于报道的AD-MEC反应器对蛋白质的降解率(58%)(蔡伟伟, 2014), 也高于未加硅灰石的反应器B的蛋白质降解率(59.7%±2.1%).研究表明, 硅灰石的加入提升了AD-MEC对有机物的降解性能.
图 4(Fig. 4)
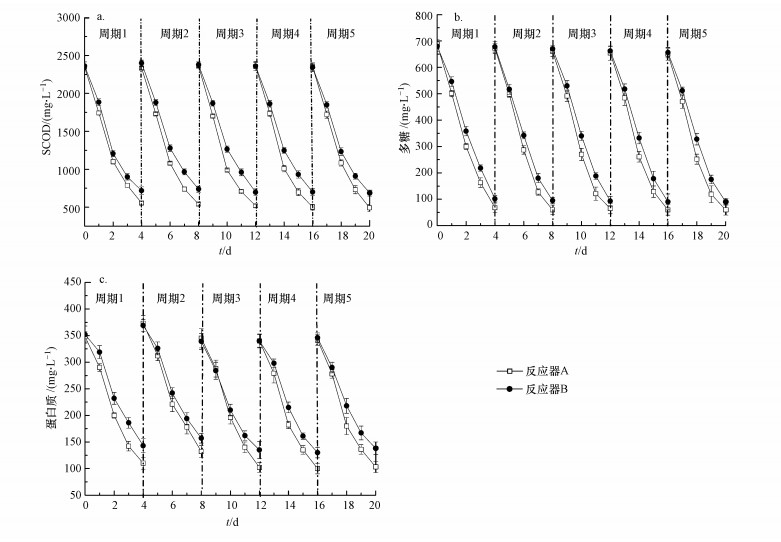 |
| 图 4 投加硅灰石的反应器A与未投加硅灰石的反应器B的有机物降解情况对比 (a.SCOD降解情况, b.多糖降解情况, c.蛋白质降解情况) Fig. 4Comparison of organic matter degradation in wollastonite added reactor A and no wollastonite added reactor B |
3.2.2 产气效果投加硅灰石之后, AD-MEC的产气效果如图 5所示.加入硅灰石的反应器A产生的生物气总量达到(175.0±3.0) mL, 其中, CH4体积为(165.0±5.0) mL, 占比达到95.5%±1.2%, CO2体积为(9.0±1.0) mL, 占比仅为4.5%±1.1%.而未投加硅灰石的反应器B产生的生物气总量仅为(155.0±2.0) mL, CH4体积为(140.0±2.0) mL, 占比为90.0%±0.5%, CO2体积为15.0 mL.硅灰石投加使AD-MEC反应器的甲烷产量提高了18.0%, 并使CO2的产生量减少了40.0%.其中, 18.0%的甲烷产量提高率高于有机物降解率的提高量(11.2%), 可知硅灰石添加提高了AD-MEC的甲烷产率.投加硅灰石的反应器A与未投加硅灰石的反应器B的CH4产率分别为304.5和283 mL·g-1 COD, 甲烷产率提升了7.6%.可见, 添加硅灰石可以促进AD-MEC降解有机物, 并提高甲烷产率, 从而大幅提升反应器的甲烷产量, 同时降低CO2的产生量.
图 5(Fig. 5)
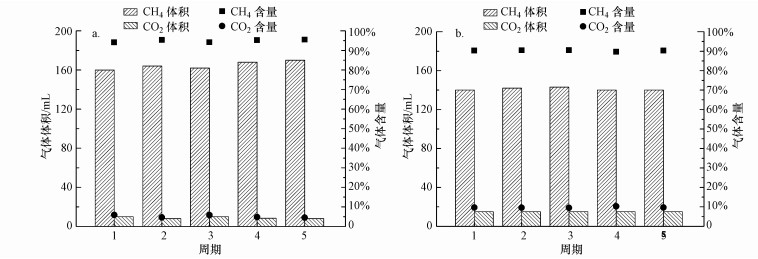 |
| 图 5 投加硅灰石的反应器A(a)与未投加硅灰石的反应器B(b)的产气情况对比 Fig. 5Comparison of biogas production in wollastonite added reactor A(a) and no wollastonite added reactor B(b) |
3.2.3 硅灰石对AD-MEC内部环境的影响AD-MEC运行过程中pH和Ca2+浓度的变化如图 6所示.由于厌氧消化初期产生脂肪酸及阳极微生物迅速降解有机物产生H+, 在每个周期的前6 h内, 未投加硅灰石的反应器B的pH值迅速由初始的7.10±0.02下降至6.50±0.02;随着产甲烷过程的进行, 反应器内pH值迅速回升, 在周期结束时达到7.38±0.03.而如图 6b所示, 投加硅灰石的反应器A中的Ca2+浓度在反应前期快速升高, 可以推测是初期反应器的酸性环境使硅灰石中的Ca2+溶出, 从而消耗溶液中的H+, 缓冲了pH值的下降, 使得投加硅灰石的反应器A的pH值高于未投加硅灰石的反应器B.投加硅灰石的反应器A中的Ca2+浓度随后快速下降, 这是由于反应器在产甲烷阶段不断消耗溶液中的有机酸, 溶液逐渐转变为弱碱性, Ca2+与CO2在弱碱性条件下结合生成碳酸盐沉淀, 从而实现矿物碳酸化固定CO2的作用.这是投加了硅灰石的反应器A中CO2含量明显减少的重要原因.
图 6(Fig. 6)
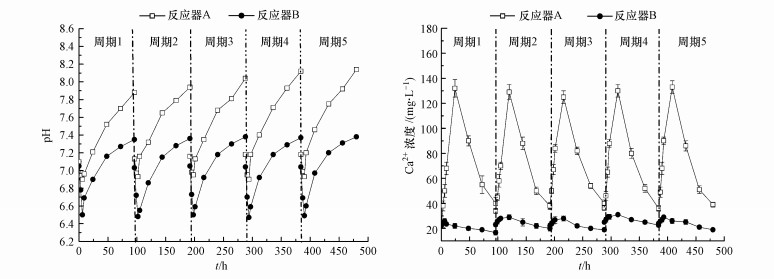 |
| 图 6 投加硅灰石的反应器A与未投加硅灰石的反应器B运行过程中pH(a)与Ca2+浓度(b)变化 Fig. 6Variation of pH(a) and Ca2+ concentration(b) during operation of wollastonite added reactor A and no wollastonite added reactor B |
投加硅灰石可溶出Ca2+, 使得反应器内电导率显著上升.反应初始时, 反应器A和反应器B的电导率分别为(1640±10) μS·cm-1和(1645±10) μS·cm-1; 而在反应结束时, 投加硅灰石的反应器A的电导率升高为(2014±10) μS·cm-1, 未投加硅灰石的反应器B的电导率为(1716±10) μS·cm-1, 硅灰石在酸性环境下溶出Ca2+, 增加了溶液中离子强度, 从而提高了反应器的电导率(谢作甫, 2014).投加硅灰石的反应器A的阳极电势最低可降至约-450 mV, 反应器B的阳极电势最低约为-400 mV(图 7a), 这表明反应器A的阳极积累电子更多.而在运行时期, 反应器A的电流峰值为13 mA, 反应器B的电流峰值为11 mA(图 7b), 说明反应器A的阴极利用电子速度较快, 阴极反应更快, 从而推断阳极电势的降低是由于有机物氧化速度加快导致更多电子积累造成的, 这与加入硅灰石的反应器A对有机物的降解率更高一致(图 4); 而由电流升高推测的阴极CO2还原产甲烷作用的增强也与甲烷产率提高相吻合.因此认为, 硅灰石投加促进了阳极有机物的氧化, 强化了有机物的降解, 一定程度上提高了反应器内传统厌氧消化产甲烷过程的产量, 同时促进了阴极CO2还原产甲烷, 从而增强了AD-MEC的甲烷生成, 同时提高了甲烷产量和产率(图 5).
图 7(Fig. 7)
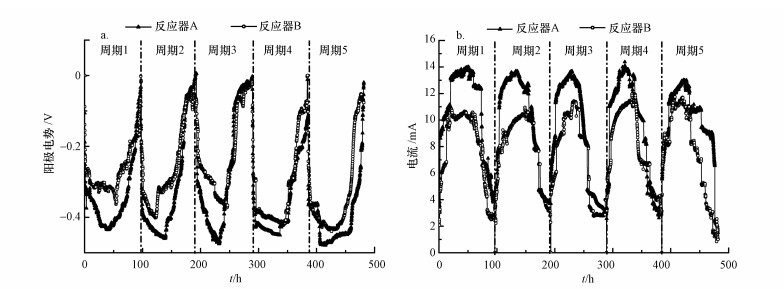 |
| 图 7 投加硅灰石的反应器A与未投加硅灰石的反应器B运行过程中阳极电势(a)与电流(b)变化情况 Fig. 7Variation of anode potential(a) and current(b) during operation of wollastonite added reactor A and no wollastonite added reactor B |
3.3 硅灰石对CO2的捕获反应结束时, 在阴极碳布及溶液中发现了灰白色沉淀.对沉淀进行XRD分析, 并利用扫描电镜(SEM)分析形貌, 结果如图 8所示.发现生成的沉淀为六方体块状晶体, EDS分析表明其主要元素为Ca(48.40%)、C(10.58%)、O(39.78%)和P(1.24%), 且沉淀的XRD谱图与方解石(CaCO3)的标准谱图基本一致, 可以确定生成的沉淀为碳酸钙沉淀.
图 8(Fig. 8)
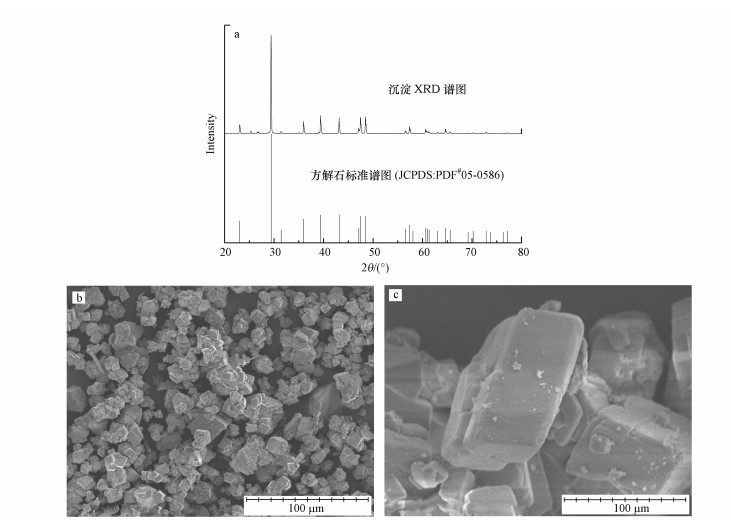 |
| 图 8 沉淀的XRD谱图(a)和SEM图 (b.放大500倍, c.放大5000倍) Fig. 8XRD pattern(a) and SEM images of the precipitate (b.500×, c.5000×) |
投加的硅灰石在AD-MEC运行周期前期的酸性环境中被溶解, 消耗了H+并缓冲了溶液中pH的变化, 溶出的Ca2+使溶液的离子强度增大, 增加了溶液的电导率, 促进了微生物对有机物的降解, 提高了有机物的降解率, 进而提高了甲烷产量.而产甲烷过程使AD-MEC中的pH升高, 释放到溶液中的Ca2+在弱碱性环境下与溶液中的CO2结合生成碳酸盐沉淀, 将CO2在原位捕获为碳酸盐, 有效地减少了所产沼气中CO2的含量, 提升了甲烷纯度.本研究通过添加硅灰石, 实现了矿物碳酸化与AD-MEC的耦合, 使AD-MEC的甲烷纯度得到有效提升.虽然工程上沼气中的CO2和CH4可以实现有效分离, 但本研究通过硅灰石矿物碳酸化与AD-MEC耦合, 使CH4纯度达到95.5%±1.2%, 基本达到国际能源署的管道沼气质量(Shen et al., 2015), 从而可以省去CO2分离的沼气纯化环节, 简化了工艺环节.此外, 硅灰石的添加通过缓冲反应器酸化, 提升pH, 促进有机物降解, 加速厌氧消化过程, 实现甲烷产量和产率的提升, 则是矿物碳酸化耦合AD-MEC在实现CO2捕获之外的附加效果.考虑到工程上沼气中CO2和CH4可以实现有效分离, 那么硅灰石添加促进有机质降解, 提升AD-MEC甲烷产量和产率, 对强化有机质的减量化和资源化具有更重要的意义.
4 结论(Conclusions)本研究构建了硅灰石介导的矿物碳酸化与AD-MEC的耦合体系, 硅灰石添加通过溶出Ca2+并与CO2反应生成CaCO3沉淀, 实现矿物碳酸化捕获CO2.添加硅灰石导致的Ca2+溶出过程缓冲了pH, 减轻了厌氧消化产酸阶段对产甲烷菌的抑制, 促进了有机物降解, 强化了甲烷生成.添加硅灰石使AD-MEC的有机物降解率提高了11.2%, 甲烷产量提高了18.0%, CO2产量降低了40.0%, 甲烷含量高达95.5%±1.2%, 从而实现了AD-MEC原位的CO2捕获和甲烷生产强化, 改善了产气特性.
参考文献
| 包炜军, 李会泉, 张懿. 2007. 温室气体CO2矿物碳酸化固定研究进展[J]. 化工学报, 2007, 58(1): 1–9.DOI:10.3321/j.issn:0438-1157.2007.01.001 |
| Bennett P C, Rogers J R, Choi W J, et al. 2001. Silicates, silicate weathering, and microbial ecology[J]. Geomicrobiology Journal, 18(1): 3–19. |
| 薄涛, 翟洪艳, 季民. 2017. 不锈钢毡电极MEC甲烷原位纯化及原理[J]. 环境科学学报, 2017, 37(11): 4057–4063. |
| Bo T, Zhu X Y, Zhang L X, et al. 2014. A new upgraded biogas production process:Coupling microbial electrolysis cell and anaerobic digestion in single-chamber, barrel-shape stainless steel reactor[J]. Electrochem Communication, 45: 67–70.DOI:10.1016/j.elecom.2014.05.026 |
| Borole A, Reguera G, Ringeisen B, et al. 2011. Electroactive biofilms:Current status and future research needs[J]. Energy & Environmental Science, 4: 4813–4834. |
| 蔡伟伟.2014.MEC电化学体系与WAS厌氧消化体系耦合产能的初步研究[D].沈阳: 辽宁大学http://cdmd.cnki.com.cn/Article/CDMD-10140-1014372868.htm |
| Cheng S A, Logan B E. 2007. Sustainable and efficient biohydrogen production via electrohydrogenesis[J]. Proceedings of the National Academy of Sciences, 104(47): 18871–18873.DOI:10.1073/pnas.0706379104 |
| Cheng S A, Logan B E. 2008. Evaluation of catalysts and membranes for high yield biohydrogen production via electrohydrogenesis in microbial electrolysis cells (MECs)[J]. Water Science & Technology, 58(4): 853–857. |
| Cheng S, Xing D F, Douglas F, et al. 2009. Direct biological conversion of electrical current into methane by electromethanogenesis[J]. Environmental Science & Technology, 43: 3953–3958. |
| 韩婷婷.2014.套筒型厌氧消化-微生物电解耦合反应器产甲烷效能分析[D].哈尔滨: 哈尔滨工业大学http://cdmd.cnki.com.cn/Article/CDMD-10213-1014083204.htm |
| 刘建, 高平, 张艳艳, 等. 2017. 生活污水有机负荷率对连续流单室无膜微生物电解池性能的影响[J]. 应用与环境生物学报, 2017, 23(3): 415–419. |
| Liu H, Logan B E. 2004. Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane[J]. Environmental Science & Technology, 38(14): 4040–4046. |
| Logan B E, Call D, Cheng S A, et al. 2008. Microbial electrolysis cells for high yield hydrogen gas production from Organic matter[J]. Environmental Science & Technology, 42(23): 8630–8640. |
| Min Y J, Li Q Y, Voltolini M, et al. 2017. Wollastonite carbonation in water-bearing supercritical CO2:Effects of particle size[J]. Environmental Science & Technology, 51(21): 13044–13053. |
| Park A H A, Jadhav R, Fan L S, et al. 2003. CO2 Mineral Sequestration:Chemically enhanced aqueous carbonation of serpentine[J]. The Canadian Journal of Chemical Engineering, 81: 885–890. |
| Ran Z, Gefu Z, Kumar J A, et al. 2014. Hydrogen and methane production in a bio-electrochemical system assisted anaerobic baffled reactor[J]. Int J Hydrogen Energy, 39(25): 13498–13504.DOI:10.1016/j.ijhydene.2014.02.086 |
| Rau G H, Carroll S A, Bourcier W L, et al. 2013. Direct electrolytic dissolution of silicate minerals for air CO2 mitigation and carbon-negative H2 production[J]. Proceedings of the National Academy of Sciences, 110(25): 10095–10100.DOI:10.1073/pnas.1222358110 |
| 尚梦.2009.污泥破解预处理技术和破解后污泥厌氧消化效能研究[D].武汉: 武汉大学http://cdmd.cnki.com.cn/Article/CDMD-10486-1011071114.htm |
| Shen Y, Linville J L, Urgun-Demirtas M, et al. 2015. Producing pipeline-quality biomethane via anaerobic digestion of sludge amended with corn stover biochar with in-situ CO2 removal[J]. Applied Energy, 158: 300–309.DOI:10.1016/j.apenergy.2015.08.016 |
| 孙宏扬.2014.污泥厌氧消化-微生物电解耦合工艺产甲烷效能分析[D].哈尔滨: 哈尔滨工业大学http://d.wanfangdata.com.cn/Thesis/D592032 |
| Walker J C G, Hays P B, Kasting J F. 1981. A negative feedback mechanism for the long-term stabilization of Earth's surface temperature[J]. Journal of Geophysical Research:Oceans, 86(C10): 9776–9782.DOI:10.1029/JC086iC10p09776 |
| Wang H, Ren Z J. 2013. A comprehensive review of microbial electrochemical systems as a platform technology[J]. Biotechnology Advances, 31(8): 1796–1807.DOI:10.1016/j.biotechadv.2013.10.001 |
| 吴亭亭, 杨暖, 刘建, 等. 2017. 单室微生物电解池处理黄水产甲烷[J]. 应用与环境生物学报, 2017, 23(5): 907–912. |
| 向元英, 杨暖, 杨霞, 等. 2016. 单室微生物电解池强化混合脂肪酸产甲烷[J]. 应用与环境生物学报, 2016, 22(5): 872–877. |
| 谢作甫.2014.MFC脱氮产电性能及电导率研究[D].杭州: 浙江大学http://cdmd.cnki.com.cn/Article/CDMD-10335-1014361570.htm |
| 杨林军, 张霞, 孙露娟, 等. 2007. 二氧化碳矿物碳酸化固定的技术进展[J]. 现代化工, 2007, 27(8): 13–16.DOI:10.3321/j.issn:0253-4320.2007.08.002 |
| Zhang S H, You J P, Christian Kennes, et al. 2018. Current advances of VOCs degradation by bioelectrochemical systems:A review[J]. Chemical Engineering Journal, 334: 2625–2637.DOI:10.1016/j.cej.2017.11.014 |
| Zhang Y, Zhang L H, Liu H, et al. 2019. Carbon dioxide sequestration and methane production promotion by wollastonite in sludge anaerobi digestion[J]. Bioresource Technology, 272: 194–201.DOI:10.1016/j.biortech.2018.10.004 |
