
 , 颜丽红1, 张仲航2, 武江南1, 王晟1, 郭娜妹1, 陈礼洪1
, 颜丽红1, 张仲航2, 武江南1, 王晟1, 郭娜妹1, 陈礼洪11. 福建工程学院生态环境与城市建设学院, 福州 350118;
2. 中国市政工程中南设计研究总院有限公司福建分院, 福州 350118
收稿日期: 2018-09-19; 修回日期: 2018-10-20; 录用日期: 2018-10-20
基金项目: 国家自然科学基金面上资助项目(No.51878171);福建省产学合作重大项目(No.2016H6003)
作者简介: 蒋柱武(1974-), 男, E-mail:jiangzhuwu@126.com
通讯作者(责任作者): 蒋柱武
摘要: 为探究生物膜脱氮滤池脱氮效能差异的微生物因素,设置组1(包括接种污泥、稳定期滤料、反冲洗后滤料微生物变化)和组2(包括反冲洗前滤料、反冲洗后不同时间段滤料微生物变化)两组实验,通过高通量测序,研究不同阶段微生物群落结构、丰度和多样性的分布情况.结果表明:接种污泥与滤料表面微生物群落结构和多样性在门水平下差异不大,但在属水平下差异显著,而相对丰度在两种分类水平下始终差异显著.反冲洗后0~4 h滤料表面微生物的OTU数目、Shannon指数、Chao1指数变化,在滤池30 cm处先升后降,而在60 cm处曲折上升,也即二者的微生物丰度和多样性变化趋势.反冲洗前后Proteobacteria始终占主导地位,相对丰度为79%~90%,Proteobacteria中Betaproteobacteria占主导优势,反冲洗后Betaproteobacteria数量相对减少,后逐渐恢复.总反硝化优势菌属相对丰度在反冲洗1 h后30 cm处由78%左右下降到70%左右,60 cm处由68%左右下降到64%左右,此时出水总氮达到最高值7.7 mg·L-1,之后总反硝化优势菌属及出水TN浓度逐渐恢复至正常水平,这种消长变化表明滤池脱氮效果与总反硝化优势菌属相对丰度密切相关,滤池运行状态的改变使得反硝化优势菌属的群落结构差异显著.
关键词:生物膜脱氮滤池高通量测序生物群落结构
Characterisitics of microbial community structure of a denitrification biofilm filter
JIANG Zhuwu1

 , YAN Lihong1, ZHANG Zhonghang2, WU Jiangnan1, WANG Sheng1, GUO Namei1, CHEN Lihong1
, YAN Lihong1, ZHANG Zhonghang2, WU Jiangnan1, WANG Sheng1, GUO Namei1, CHEN Lihong1 1. School of Ecological Environment and Urban Construction, Fujian University of Technology, Fuzhou 350118;
2. Central and Southern China Municipial Engineering Design & Research Institute Co., Ltd. Fuzhou branch courts, Fuzhou 350118
Received 19 September 2018; received in revised from 20 October 2018; accepted 20 October 2018
Abstract: In order to investigate the effect of microorganisms on nitrogen removal efficiency of a denitrification biofilm filter, two experiments were conducted, i.e., experiment 1 (inoculated sludge, filter media in a stable period and filter media after backwashing) and experiment 2 (the filter media before backwashing and after backwashing at different periods). High-throughput sequencing was applied to analyze the distribution of microbial community structure, abundance and diversity at different stages. There were no differences of the microbial community structure and diversity of the inoculated sludge and filter media at the phylum level. However, a significant difference at the genus level was observed. Meanwhile, the relative abundance was always significant at the two classification levels. In the first four hours after backwashing, the OTU number, Shannon index and Chao1 index of the microbes on the surface of the filter media were increased first and then decreased at 30 cm. In addition, it ascended with an upward tendency at 60 cm. Proteobacteria was dominant before and after backwashing with a relative abundance of 79%~90%. Betaproteobacteria was dominant in Proteobacteria. Its number decreased after backwashing and then recovered gradually. In the first 1 h after backwashing, the relative abundance of the total dominant denitrifiers decreased from 78% to 70% at 30 cm, from 68% to 64% at 60 cm. At the same time, the total nitrogen of the effluent reached to the highest value of 7.7 mg·L-1. The total dominant denitrifiers and the total nitrogen of the effluent were gradually recovered to its normal level. The results of this study demonstrated that the nitrogen removal efficiency was closely related to the relative abundance of the total dominant denitrifiers. The difference of the community structure of the dominant denitrifiers was due to changes of the operational state of the filter.
Keywords: biofilm filter for nitrogen removalhigh-throughput sequencingbiological community structure
1 引言(Introduction)生物膜脱氮滤池因占地面积省、水力负荷大、脱氮效果好等特点已成为城市污水深度处理领域研究和应用的热点(高建峰等, 2016).滤池运行过程中需周期性进行反冲洗, 针对反冲洗会对反硝化效能造成影响的问题, 传统研究方式主要通过调整反冲洗强度和时间来找到相应滤池的最佳反冲洗参数, 但从微生物角度, 研究滤池反冲洗前后脱氮效能差异和微生物群落结构及丰度变化的内在联系及反硝化优势细菌来源的文献较少.刘水等(2009)研究发现反冲洗前后优势菌在活性炭表面数量变化较小, 而Zheng等(2011)却发现反冲洗会使活性炭表面的细菌种类减少.反冲洗前后微生物数量变化情况值得分析, 反冲洗后滤池内微生物的恢复情况对于滤池脱氮效果的变化也具有重要价值.Feng等(2017)研究三维电极耦合曝气生物滤池时发现, 反冲洗后滤池上半部分微生物菌属逐渐恢复, 而下半部分却出现下降.Xu等(2017)利用接种方式启动SBR-anammox系统时发现, 微生物多样性先增后减, 系统的微生物生态位被重新分配, anammox细菌群落结构在富集过程中发生了变化.此类研究表明, 反冲洗会改变滤池内微生物群落结构和多样性的分布, 而进一步从微观角度研究微生物群落结构和相对丰度的变化与滤池脱氮效果差异的相关性显得尤为必要, 这对合理解释滤池脱氮效果变化的原因具有十分重要的意义.另一方面, 接种污泥对于微生物的富集具有促进作用, 通过研究滤池反硝化优势菌的来源, 分析其与接种污泥的关系, 有助于接种时提高对接种污泥的辨识性和增加所需微生物的富集率.
近年来, 分子生物学手段如变性梯度凝胶电泳(Fischer et al., 1979)、克隆文库和高通量测序(Figuerola et al., 2007)等, 逐渐被用于研究污水处理过程中微生物群落结构特性.其中, 高通量测序技术因具有分析结果准确、高速等特点(王绍祥等, 2014), 被广泛应用于污水处理过程中微生物群落结构和多样性研究(Shen et al., 2013).
本研究利用Miseq高通量测序技术, 将接种污泥、滤池运行稳定期和反冲洗后滤料中微生物进行比较, 同时对反冲洗后不同时间段内滤料中微生物群落结构与多样性变化进行分析, 以期探索滤料内反硝化细菌的来源, 同时考察反冲洗过程中主要反硝化细菌群落结构与多样性的变化, 并分析滤池反冲洗过程中脱氮效率变化与反硝化细菌相对丰度改变的相关性.
2 材料与方法(Materials and methods)2.1 实验装置实验所需生物膜脱氮滤池采用有机玻璃制作, 滤池主体由一根上流式滤柱组成, 外形尺寸为φ100 mm×1200 mm.进水区位于滤柱底部, 高度为150 mm.滤柱内装轻质陶粒滤料, 滤料层厚度为700 mm, 滤层空隙率27%, 滤层容积为1.377×10-3 m3.进水区与滤料区用滤板隔开, 滤板上均匀布置9个直径5 mm滤孔.在滤层300 mm和600 mm所对应的滤柱壁处各设一取样口.滤柱顶端一圈设置三角溢流口, 水向上溢流进入排水槽后流入清水池.外加碳源采用蠕动泵均匀加入到进水管中, 按C/N=5:1投加.反冲洗采用气水联合冲洗, 反冲洗气冲强度为6~8 L·m-2·s-1、水冲强度为4 L·m-2·s-1, 单独气冲2 min, 气水联合冲洗3 min, 单独水冲2 min.实验装置结构见图 1.
图 1(Fig. 1)
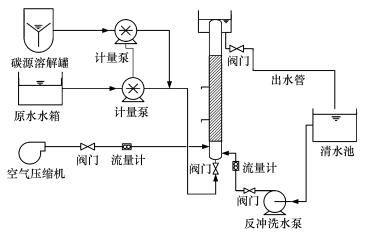 |
| 图 1 实验装置示意图 Fig. 1Schematic diagram of experimental set-up |
2.2 实验用水实验用水采用福州祥坂污水厂二沉池出水, 其出水硝化充分, 氨氮平均含量在0.5 mg·L-1以下.其他实验用水水质指标见表 1.
表 1(Table 1)
| 表 1 实验用水水质指标 Table 1 Test water quality | |||||||||||||||||||||||||||
表 1 实验用水水质指标 Table 1 Test water quality
| |||||||||||||||||||||||||||
2.3 采样实验装置运行时间为2016年10月—2017年2月和2017年3月—2017年12月, 本实验时间为2017年6—12月, 运行期间每天测定滤池进出水水质.于2017年8月取福州祥坂污水厂二沉池回流污泥作为接种污泥, 取10 mL污泥装于洁净的离心管中, 放置于4 ℃的保温箱后转移到实验室进行后续分析.2017年8月中旬滤池接种成功后, 于滤层30 cm处和60 cm处采集滤料样品, 每个采样点取6~8粒样品, 放入装有灭菌超纯水的离心管中, 放置于4 ℃的保温箱后转移到实验室进行后续分析.于2017年10月在滤层30 cm处和60 cm处按照同样操作取滤池运行稳定期滤料样品.于2017年11月取反冲洗滤料样品, 按照同样操作, 每间隔1 h取反冲洗前和反冲洗后滤池30 cm处和60 cm处滤料样品.
2.4 水质指标测定滤池进出水温度、pH(上海雷磁JPBJ-608)和DO(上海雷磁pHS-3C)现场测定.COD采用快速消解分光光度法(HJ/T 399—2007), TN采用碱性过硫酸钾-紫外分光光度法(HJ 636—2012), NO3--N采用酚二磺酸分光光度法(HJ/T 346—2007), NH4+-N采用纳氏试剂分光光度法(HJ 535—2009), NO2--N采用N-(1-萘基)-乙二胺分光光度法(GB 7493-87).
2.5 DNA提取和高通量测序采用DNA提取试剂盒(E.Z.N.ATM Mag-Bind Soil DNA Kit)提取所有样品的DNA, 利用1%琼脂糖凝胶电泳检测抽提样品总的DNA.采用DNA检测试剂盒(Qubit3.0)确定PCR时DNA的应加量, 对16S rDNA基因的V3~V4区域进行PCR扩增, 引物序列为341F(CCCTACACGACGCTCTTCCGATCTG (barcode) CCTACGGGNGGCWGCAG)和805R(GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACT ACHVGGGTATCTAATCC).采用二次PCR法扩增, 即第一轮以总DNA为模板进行扩增, 扩增的产物进行胶回收后作为第二轮的模板进行第二轮扩增.第一轮PCR反应体系体积为30 μL:2×Taq master Mix 15 μL, Bar-PCR primer F(10 μmol·L-1)1 μL, Primer R (10 μmol·L-1)1 μL, Genomic DNA 10~20 ng, 用ddH2O补足至30 μL.第一轮PCR程序:94 ℃预变性3 min;94 ℃变性30 s, 45 ℃退火20 s, 65 ℃延伸30 s, 共运行5个循环;按94 ℃变性20 s, 55 ℃退火20 s, 72 ℃延伸30 s, 共运行20个循环;再用72 ℃延伸5 min, 10 ℃保温.第二轮扩增引入Illumina桥式PCR兼容引物, PCR反应体系体积为30 μL:2×Taq master Mix 15 μL, Primer F(10 μmol·L-1)1 μL, Primer R(10 μmol·L-1)1 μL, Genomic DNA 20 ng, 用ddH2O补足至30 μL.第二轮PCR程序:95 ℃预变性3 min;94 ℃变性20 s, 55 ℃退火20 s, 72 ℃延伸30 s, 共运行5个循环;再用72 ℃延伸5 min, 10 ℃保温.PCR扩增后对其产物进行2%琼脂糖凝胶电泳检测.随后在上海生工生物工程股份公司的Illumina MiSeq测序平台进行高通量测序.
2.6 数据处理Illumina MiseqTM得到的图像数据文件经CASAVA碱基识别分析转化为原始测序序列.利用Mothur对原始序列进行校正, 去除序列中的嵌合体, 得到优化序列.在97%的相似性水平上将序列划分可操作分类单元(operationaltaxonomic units, OTUs).采用RDP Classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类分析, 并在各个分类水平上统计每个样品的群落组成.
2.7 实验计划组1主要由接种污泥、滤池运行稳定期滤料与反冲洗后不同高度处滤料组成, 主要研究稳定期与反冲洗后滤料表面反硝化优势细菌的来源与接种污泥的相关性, 同时研究稳定期和反冲洗后滤池脱氮效能差异与二者反硝化优势细菌丰度与结构变化的内在联系.组1评估系统主要包括:接种污泥(GM1)、稳定期30 cm处滤料(WDQ30)、稳定期60 cm处滤料(WDQ60)、反冲洗后30 cm处滤料(FCX30)和反冲洗后60 cm处滤料(FCX60).
组2由反冲洗前后不同时间、不同高度处滤料组成, 主要研究反冲洗后滤池脱氮效能的恢复与反硝化优势细菌丰度与群落结构变化的相关性.组2评估体系主要包括:反冲洗前30 cm处滤料(30Bw0 h)、反冲洗前60 cm处滤料(60Bw0h)、反冲洗1 h时30 cm处滤料(30Bw1 h)、反冲洗1 h时60 cm处滤料(60Bw1 h)、反冲洗2 h时30 cm处滤料(30Bw2 h)、反冲洗2 h时60 cm处滤料(60Bw2 h)、反冲洗3 h时30 cm处滤料(30Bw3h)、反冲洗3 h时60 cm处滤料(60Bw3 h)、反冲洗4 h时30 cm处滤料(30Bw4 h)、反冲洗4 h时60 cm处滤料(60Bw4 h)、反冲洗20 h时30 cm处滤料(30Bw20 h)、反冲洗20 h时60 cm处滤料(60Bw20 h).
3 结果与讨论(Results and discussions)3.1 组1高通量测序分析3.1.1 微生物OTU韦恩图分析对原始数据进行质量检验(QC)后, 用Usearch 5.2.236软件对数据进行去嵌合体和聚类的操作, 进行聚类时, 先将序列按照丰度从大到小排序, 通过97%相似度的标准聚类, 得到16S rDNA OTU, 每个OTU被认为可代表一个细菌物种(微生物物种)(窦娜莎, 2013).由图 2可知, 接种污泥在5个样品中总OTU数最高, 为3514, 其中特异的OTU数目为2595, 说明其微生物物种总数高于滤料表面微生物.另外, 反冲洗后不同高度处滤料OTU数量均出现上升现象, 反冲洗后30 cm和60 cm处OTU分别比稳定期高464个和410个OTUs, 这一现象与窦娜莎(窦娜莎等, 2011)在研究反冲洗对曝气生物微生物群落结构影响的结果类似.5个样品共有的OTU数量为225, 占所有OTU数目的1.98%.
图 2(Fig. 2)
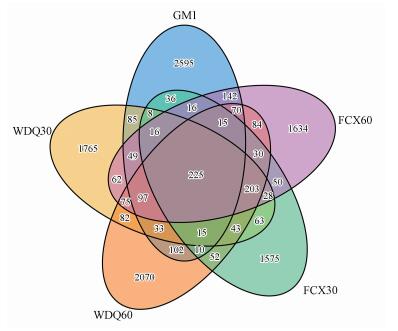 |
| 图 2 组1中微生物OTU韦恩图 Fig. 2Microorganism OTU venn diagram in experiment 1 |
3.1.2 微生物丰度和多样性分析群落生态学中, 通过样品的多样性分析(Alpha多样性)可以反映微生物群落的丰度和多样性.表 2中Alpha多样性指数主要包括计算群落丰度的ACE和Chao1两个指数, 以及计算群落多样性的Shannon、Coverage和Simpson 3个指数.表 2中Coverage值均在0.89以上, 数值较高, 说明样品文库覆盖率高, 数据可靠.根据测序公司提供的结论报告可得, Simpson指数值越大, 说明群落多样性越低;而Shannon值越大, 说明群落多样性越高.表 2中, Shannon指数的变化范围为4.29~6.43, 平均值为5.08, 接种污泥在所有样品中Shannon指数最高, 为6.43, 说明接种污泥的微生物多样性高于滤池运行稳定期和反冲洗后滤料, 同时接种污泥Simpson指数最小, 与Shannon指数表示结果一致.
表 2(Table 2)
| 表 2 接种污泥、稳定期和反冲洗后滤料表面微生物Alpha多样性指数 Table 2 Microbial Alpha diversity index on the surface of filter media after inoculation, stabilization and backwashing | ||||||||||||||||||||||||||||||||||||||||||||||||
表 2 接种污泥、稳定期和反冲洗后滤料表面微生物Alpha多样性指数 Table 2 Microbial Alpha diversity index on the surface of filter media after inoculation, stabilization and backwashing
| ||||||||||||||||||||||||||||||||||||||||||||||||
图 3为接种污泥(16S170847, 即GM1)与滤料总样品(16S170864)的Simpson指数箱式对比图.接种污泥Simpson指数箱式图的中位数和盒子位置均较高, 接种污泥微生物多样性高于滤料, 结果与Shannon指数结果一致.Chao1指数反映微生物群落丰度, Chao1数值越大, 表示样本物种丰度越大, 表 2中接种污泥Chao1最小, 说明接种污泥物种丰度最小, ACE指数反映的趋势与Chao1指数类似.
图 3(Fig. 3)
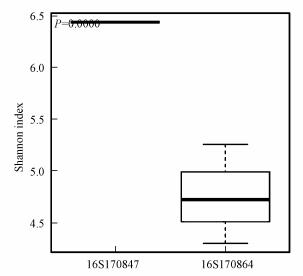 |
| 图 3 接种污泥(16S170847)与滤料总样品Shannon指数箱式对比图 Fig. 3Comparison of inoculated sludge (16S170847) and Shannon index of total filter media |
3.1.3 功能性微生物群落组成分析图 4为门水平下接种污泥和滤料总样品微生物丰度饼状图.由图 4可知门水平下接种污泥中微生物主要包括:变形菌门(Proteobacteria)49.62%、拟杆菌门(Bacteroidetes)11.12%、绿弯菌门(Chloroflexi)6.39%、浮霉菌门(Planctomycetes)10.63%、酸杆菌门(Acidobacteria)5.45%;滤料总样品中微生物主要包括:变形菌门(Proteobacteria)76.11%、拟杆菌门(Bacteroidetes)5.26%、绿弯菌门(Chloroflexi)4.08%.通过比较发现, 变形菌门(Proteobacteria)在两者中均占绝大多数, 为主要优势菌门.接种污泥中变形菌门占比49.62%, 而滤料总样品中变形菌门占比76.11%, 此外, 浮霉菌门和酸杆菌门占比较小, 不具有优势.反硝化脱氮滤池的生存环境适合变形菌门, 不适合浮霉菌门和酸杆菌门.
图 4(Fig. 4)
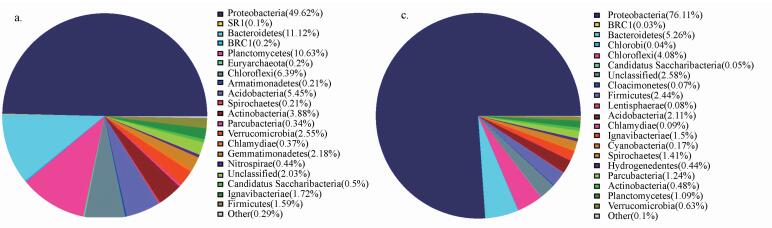 |
| 图 4 接种污泥(a)和滤料总样品(b)在门水平下微生物丰度 Fig. 4Inoculated sluge (a) and total sample filter material (b) microbial abundance at phylum level |
图 5为纲水平下接种污泥和滤料总样品微生物群落结构.由图 5可知GM1、WDQ30、WDQ60、FCX30和FCX60 5个样品中β-变形菌纲(Betaproteobacteria)占主导优势, 对应相对丰度分别为16.63%、75.67%、51.14%、68.42%和62.24%, 在接种污泥中该菌纲相对丰度明显低于滤料中, 这是由于该菌纲类的菌种主要在厌氧环境下生存(路莹, 2013), 而接种污泥所在的好氧环境不适合其生长, 因而其在滤池厌氧和缺氧的环境下成为优势菌.γ-变形菌纲(Gammaproteobacteria)在5个样品中的分布也比较多, 对应相对丰度分别为17.49%、2.54%、8.45%、3.74%和5.26%.Alphaproteobacteria、Deltaproteobacteria、Anaerolineae、Planctomycetia、Bacteroidia等菌纲占有一定比例.在稳定期和反冲洗后各滤料样品中, Alphaproteobacteria、Deltaproteobacteria和Planctomycetia细菌相对丰度与接种污泥相比均有所降低, Anaerolineae和Bacteroidia细菌相对丰度变化不大.
图 5(Fig. 5)
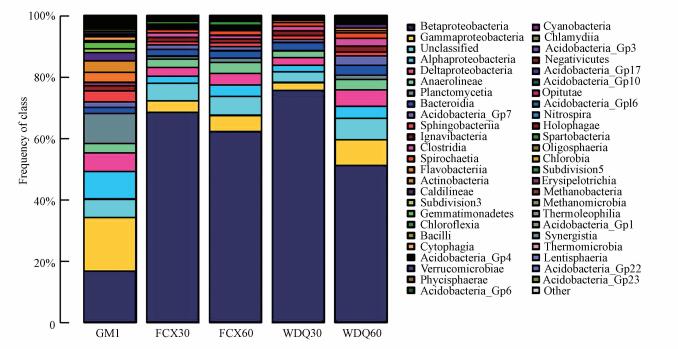 |
| 图 5 接种污泥和滤料总样品在微生物纲水平下群落结构 Fig. 5Distribution of community structure under class level of inoculated sludge and filter media samples |
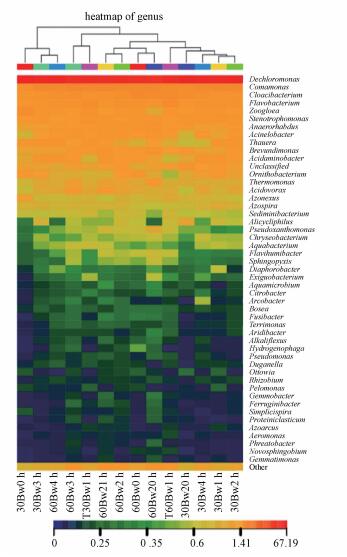
图 6为微生物在属水平下的群落结构分布图.由图 6可知, 组1中接种污泥与滤料在属水平上微生物群落结构存在较大差异.接种污泥中主要微生物属包括:Litorilinea、Methyloversatilis和Gemmatimonas, 而滤料表面微生物主要优势菌属为脱氯单胞菌属(Dechloromonas)(Achenbach et al., 2001)、陶厄氏菌属(Thauera)(Thomsen et al., 2007; Mao et al., 2004)、固氮弓菌属(Azonexus)(Vanden Hoven et al., 2004)和固氮螺菌属(Azospira)(Chou et al., 2008).应是生存环境变化影响微生物的多样性.反冲洗前后滤池30 cm处和60 cm处反硝化菌属相对丰度变化较小, 说明反冲洗不会对反硝化菌种群的丰度产生较大冲击.
图 6(Fig. 6)
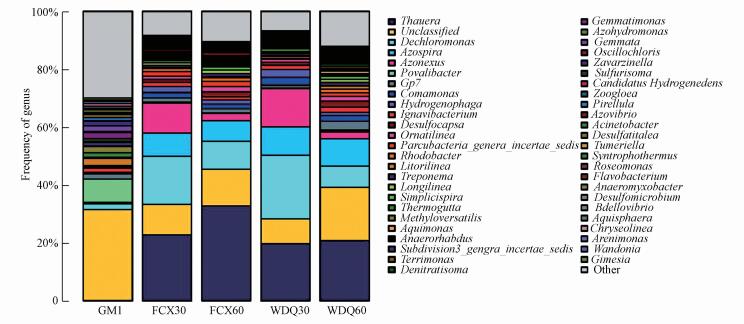 |
| 图 6 组1中微生物在属水平下的群落结构分布 Fig. 6Community structure distribution of microbes under the genus level in experiment 1 |
3.2 组2高通量测序分析3.2.1 反冲洗后滤池脱氮效果分析由图 7可知, 反冲洗后滤池出水TN呈先上升再下降最后趋于水平的趋势, 反冲洗后1 h滤池出水TN达到最高值7.7 mg·L-1, 然后出水TN逐渐下降, 在反冲洗后4 h时达到1.8 mg·L-1后基本保持不变, 这说明滤池脱氮能力在反冲洗后迅速降低, 在反冲洗后1 h时达到最低水平, 然后随时间逐渐上升, 最后恢复到正常水平.由表 3可知, 滤池脱氮效果改变主要发生在前4 h, 4 h之后脱氮效果逐渐恢复到正常水平, 基于此组2主要对反冲洗后0~4 h和恢复到正常水平的反冲洗后20 h的微生物进行对比分析, 研究滤池脱氮效果差异与微生物群落结构和丰度改变的相关性.
图 7(Fig. 7)
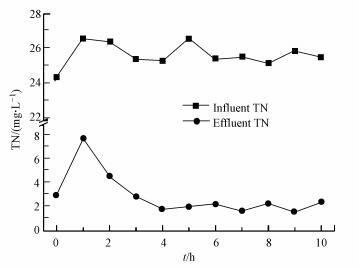 |
| 图 7 反冲洗后0~10 h滤池脱氮效果随时间的变化 Fig. 7The variation of TN in 10 h after backwashing |
表 3(Table 3)
| 表 3 组2中微生物Alpha多样性指数统计 Table 3 Statistics of microbial Alpha diversity index in experiment 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 组2中微生物Alpha多样性指数统计 Table 3 Statistics of microbial Alpha diversity index in experiment 2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2.2 微生物丰度和多样性分析表 3中, 反冲洗后0~20 h, Shannon指数的变化范围为2.55~3.09, 平均值为2.75.反冲洗后Shannon指数30 cm和60 cm处变化趋势均同该处OTU变化趋势, 30 cm处微生物多样性先上升后下降, 而60 cm处微生物多样性呈曲折上升趋势.反冲洗后30 cm和60 cm处Chao1指数变化特征同OTU变化规律, 30 cm处Chao1呈先上升后下降趋势, 60 cm处则呈曲折上升趋势, 说明30 cm处微生物丰度先上升后下降, 60 cm处则曲折上升.
Coverage值均为0.98, 数值接近1, 说明样品文库覆盖率高, 数据可靠.分析反冲洗后30 cm处滤料发现, 反冲洗后0~4 h, OTU数目呈先上升后下降趋势;60 cm处反冲洗后OTU呈先上升后下降之后再上升趋势.由此说明, 在反冲洗后前4 h内, 滤池不同高度处物种总数变化情况不一致;反冲洗后, 物种总数在滤池滤层30 cm处减少, 60 cm处增加.
3.2.3 功能性微生物群落组成分析图 8为组2微生物群落结构在门水平下群落结构分布图.由图 8可知, 反冲洗前和反冲洗过程中Proteobacteria始终占主导地位, 相对丰度为79%~90%, 其次为Bacteroidetes, 相对丰度为9%~20%.由于Proteobacteria为主要优势菌门, Proteobacteria中Betaproteobacteria占主导优势.
图 8(Fig. 8)
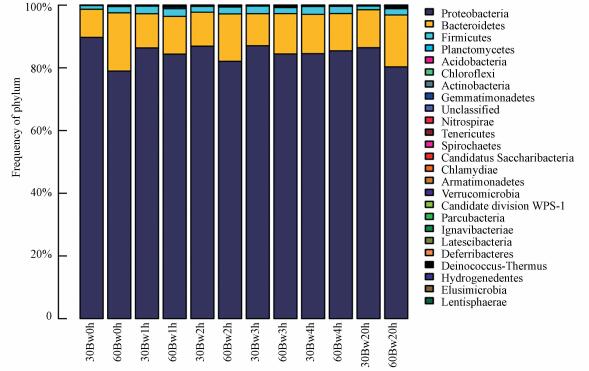 |
| 图 8 组2中微生物在门水平下的群落结构分布 Fig. 8Community structure distribution of microorganism under phylum level in experiment 2 |
图 9为组2微生物在纲水平下群落结构分布, 图中Betaproteobacteria在反冲洗前后不同阶段各样品相对丰度变化范围为67%~85%, 占有较高比例, 说明Betaproteobacteria在滤池中占主导, 反冲洗后Betaproteobacteria数量相对减少, 但随着反冲洗时间的延长, Betaproteobacteria的数量逐渐恢复.此外, 组2中Gammaproteobacteria、Flavobacteriia和Alphaproteobacteria等菌纲占有一定比例, 反冲洗过程后Flavobacteriia和Alphaproteobacteria细菌相对丰度随时间呈逐渐上升趋势.
图 9(Fig. 9)
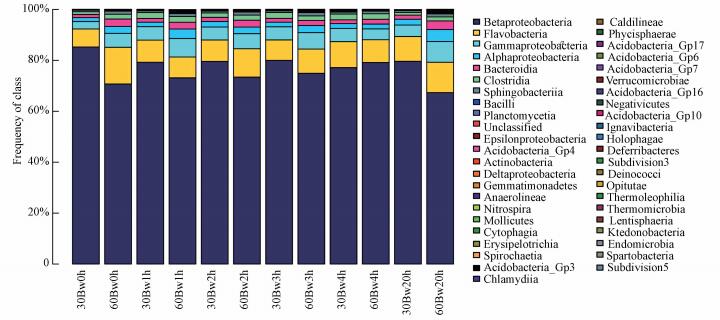 |
| 图 9 组2中微生物在纲水平下的群落结构分布 Fig. 9Community structure distribution of microorganism under class level in experiment 2 |
图 10为组2微生物主要菌属相对丰度百分比.根据图 10可知, 总反硝化优势菌属相对丰度在反冲洗后1 h出现明显下降, 30 cm处由78%左右下降到70%左右, 60 cm处由68%左右下降到64%左右, 此时出水总氮达到最高值7.7 mg·L-1, 说明总反硝化优势菌属相对丰度的降低使得滤池脱氮效果变差.随后滤池脱氮效果逐渐恢复, 总反硝化优势菌属相对丰度也逐渐上升, 30 cm处由反冲洗后1 h时的68%左右逐渐上升到76%左右;60 cm处整体上有所上升, 说明滤池在反冲洗后脱氮效果的改变与总反硝化优势菌属相对丰度的变化有关.
图 10(Fig. 10)
 |
| 图 10 组2微生物主要菌属相对丰度百分比 Fig. 10Relative abundance percentage of major microorganisms in experiment 2 |
通过信息比对后发现, 组2微生物中共有12个反硝化菌属.其中, 包括4个优势菌属:Dechloromonas、Cloacibacterium、Flavobacterium、Zoogloea和8个非优势菌属Thauera、Hydrogenophaga、Azonexus、Azospira、Rhodobacter、Acinetobacter、Hyphomicrobium、Methyloparacoccus.值得一提的是, 组2反硝化优势菌属中Cloacibacterium、Flavobacterium、Zoogloea在组2滤料中均未被检测出, 说明滤池环境的改变, 使得反硝化优势菌属的群落结构会有较大差异.
4 结论(Conclusions)1) 接种污泥的微生物多样性高于滤池运行稳定期和反冲洗后滤料, 但其丰度在三者中最小.
2) 接种污泥与滤料表面微生物群落结构和多样性在门水平下差异不大, 但在属水平下差异显著, 而相对丰度在两种分类水平下始终差异显著.
3) 反冲洗后0~4 h滤料表面微生物的OTU数目、Shannon指数、Chao1指数变化, 滤池30 cm处呈先上升后下降趋势, 滤池60 cm处呈曲折上升趋势, 也即二者的微生物丰度和多样性变化趋势, 且反冲洗后物种总数在滤池30 cm处减少, 60 cm处增加.
4) 反冲洗前后Proteobacteria始终占主导地位, 相对丰度为79%~90%, 其次为Bacteroidetes, 相对丰度为9%~20%, Proteobacteria中Betaproteobacteria占主导优势, 反冲洗后Betaproteobacteria数量相对减少, 但随着反冲洗时间的延长, Betaproteobacteria的数量逐渐恢复.
5) 总反硝化优势菌属相对丰度在反冲洗1 h后30 cm和60 cm处分别下降8%和4%左右, 且此时出水TN达到最高值7.7 mg·L-1, 后随时间推移反硝化优势菌属相对丰度逐渐恢复至正常水平, 且出水TN浓度逐渐下降, 说明滤池脱氮效果与总反硝化优势菌属相对丰度有关.
参考文献
| Achenbach L A, Michaelidou U, Bruce R A, et al. 2001. Dechloromonas Agitata Gen. Nov., Sp. Nov. and Dechlorosoma Suillum Gen. Nov., Sp. Nov., Two Novel Environmentally Dominant (per)chlorate-reducing Bacteria and Their Phylogenetic Position.[J]. International Journal of Systematic and Evol, 51(2): 527–533.DOI:10.1099/00207713-51-2-527 |
| 窦娜莎. 2013.曝气生物滤池处理城市污水的效能与微生物特性研究[D].青岛: 中国海洋大学http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D328985 |
| 窦娜莎, 王琳. 2011. 16S rDNA克隆文库法分析Biostyr曝气生物滤池处理城市污水的细菌多样性研究[J]. 环境科学学报, 2011, 31(10): 2117–2124. |
| Feng Y, Li X, Song T, et al. 2017. Effect of Backwashing on the Microbial Community Structure and Composition of a Three Dimensional Particle Electrode Coupled with Biological Aerated Filter Reactor (tde-baf)[J]. Ecological Engineering, 101: 21–27.DOI:10.1016/j.ecoleng.2017.01.011 |
| Fischer S G, Lerman L S. 1979. Length-independent Separation of Dna Restriction Fragments in Two-dimensional Gel Electrophoresis[J]. Cell, 16(1): 191–200.DOI:10.1016/0092-8674(79)90200-9 |
| Figuerola E L M, Erijman L. 2007. Bacterial Taxa Abundance Pattern in an Industrial Wastewater Treatment System Determined By the Full Rrna Cycle Approach[J]. Environmental Microbiology, 9(7): 1780–1789.DOI:10.1111/j.1462-2920.2007.01298.x |
| 高建锋, 杨碧印, 赵建树, 等. 2016. 反硝化生物滤池用于再生水脱氮效能及动力学研究[J]. 环境工程学报, 2016, 10(1): 199–204. |
| 刘水, 李伟光, 郜玉楠, 等. 2009. 生物因子控制反冲洗对BEAC滤池优势菌稳定性影响研究[J]. 环境科学, 2009, 30(12): 3573–3578.DOI:10.3321/j.issn:0250-3301.2009.12.021 |
| 路莹. 2013.浅层地下水系统石油类污染物的生物降解机制研究[D].吉林: 吉林大学http://cdmd.cnki.com.cn/Article/CDMD-10183-1013192711.htm |
| Mao Y P, Xia Y, Zhang T. 2013. Characterization of Thauera-dominated Hydrogen-oxidizing Autotrophic Denitrifying Microbial Communities By Using High-throughput Sequencing[J]. Bioresource Technology, 128(1): 703–710. |
| Shen Z Q, Zhou Y X, Hu J, et al. 2013. Denitrification Performance and Microbial Diversity in a Packed-bed Bioreactor Using Biodegradable Polymer as Carbon Source and Biofilm Support[J]. Journal of Hazardous Materials, 250(Supplement C): 431–438. |
| Thomsen T R, Kong Y H, Nielsen P H. 2007. Ecophysiology of Abundant Denitrifying Bacteria in Activated Sludge[J]. Fems Microbiology Ecology, 60(3): 370–382.DOI:10.1111/fem.2007.60.issue-3 |
| Vanden Hoven R N, Santini J M. 2004. Arsenite Oxidation By the Heterotroph Hydrogenophaga Sp. Str. Nt-14:the Arsenite Oxidase and Its Physiological Electron Acceptor[J]. Biochimica Et Biophysica Acta:Bioenergetics, 1656(2-3): 148–155.DOI:10.1016/j.bbabio.2004.03.001 |
| 王绍祥, 杨洲祥, 孙真, 等. 2014. 高通量测序技术在水环境微生物群落多样性中的应用[J]. 化学通报, 2014, 77(3): 196–203. |
| Xu X L, Liu G H, Wang Y Y, et al. 2018. Analysis of Key Microbial Community During the Start-up of Anaerobic Ammonium Oxidation Process with Paddy Soil as Inoculated Sludge[J]. Journal of Environmental Sciences, 64: 317–327.DOI:10.1016/j.jes.2017.06.026 |
