 , 郜小龙, 王一帆, 和子杰, 王康, 常缓缓, 贾祺, 王玉明, 曾大庆, 周传江
, 郜小龙, 王一帆, 和子杰, 王康, 常缓缓, 贾祺, 王玉明, 曾大庆, 周传江

河南师范大学水产学院, 新乡 453007
收稿日期: 2018-08-15; 修回日期: 2018-09-12; 录用日期: 2018-09-12
基金项目: 国家自然科学基金(No.31400397);河南省科技厅资助项目(No.172102210345);河南师范大学博士启动金资助项目(No.qd13048)
作者简介: 张曼(1982-), 女, E-mail:zm0378@163.com
通讯作者(责任作者): 周传江(1980—), 男, 副教授, 河南师范大学水产学院教师, 长期从事水域生态环境保护研究, 发表论文20余篇.E-mail:chuanjiang88@163.com
摘要: 为探究安全高效调控水绵生长的方法,本研究利用养殖水桶开展了两次生物操纵实验,分别观测了鲤(Cyprinus carpio)、鲫(Carassius auratus)和鲢(Hypophthalmichthys molitrix)在没有营养加富条件下,以及鲫和日本沼虾(Macrobrachium nipponense)在营养加富条件下,对水体中浮游态和固着态水绵(Spirogyra)生长的抑制效果.结果表明,在没有营养加富的水体中,鲤和鲫对水绵不仅没有调控效应,反而会促进水绵的生长.建议在水绵生长旺盛的水体中,一定程度上移除水体中这些鱼类反而可以有效控制水绵的生长.在营养加富条件下,日本沼虾对水绵的控制效应明显.鲫对水绵发挥的作用与水体营养状态存在交互作用,日本沼虾对水绵的抑制效应是否受水体营养状态的影响值得进一步探究.
关键词:富营养化生物操纵水绵营养加富调控效应
Effects of biomanipulation control on Spirogyra
ZHANG Man
 , GAO Xiaolong, WANG Yifan, HE Zijie, WANG Kang, CHANG Huanhuan, JIA Qi, WANG Yuming, ZENG Daqing, ZHOU Chuanjiang
, GAO Xiaolong, WANG Yifan, HE Zijie, WANG Kang, CHANG Huanhuan, JIA Qi, WANG Yuming, ZENG Daqing, ZHOU Chuanjiang

College of Fisheries, Henan Normal University, Xinxiang 453007
Received 15 August 2018; received in revised from 12 September 2018; accepted 12 September 2018
Abstract: In order to explore the controlling effect on Spirogyra safely and efficiently, we conducted two biomanipulation experiments using buckets in this study. We observed the controlling effect of Cyprinus carpio, Cyprinus carpio, and Hypophthalmichthys molitrix on the planktonic and benthic Spirogyra without nutrients enrichment, and the controlling effect of Carassius auratus and Macrobrachium nipponense on the planktonic and benthic Spirogyra with nutrients enrichment. The results showed that Cyprinus carpio and Cyprinus carpio had no controlling effect on Spirogyra without nutrients enrichment, but promoted Spirogyra biomass instead. We suggest that removal of these fish from the water may be effective in controlling the Spirogyra growth in waters where it blooms. Under the condition of nutrients enrichment, the controlling effect of Macrobrachium nipponense on Spirogyra was obvious. There was an interaction between the effect of Cyprinus carpio and the eutrophic status on Spirogyra. Further studies need to explore whether the controlling effect of Macrobrachium nipponense on Spirogyra is affected by the eutrophic status.
Keywords: eutrophicationbiomanipulationSpirogyranutrients enrichmentcontrolling effect
1 引言(Introduction)水绵(Spirogyra)广泛分布于淡水生态系统, 其在水体中发挥的生态功能受到了人们的广泛关注.一些****指出, 随着水体富营养化程度的加剧, 河道及景观水体中的水绵极易爆发;水绵死亡后漂浮于水表, 进一步腐烂会造成水体严重污染, 并引起水体生态系统失衡(Kravtsova et al., 2014; Timoshkin et al., 2015).然而, 也一些****注意到在水绵生长旺盛的水域, 水体感观良好、水色清澈、浮游藻类浓度较低(Priddle, 1980; Hawes, 1988; Irfanullah et al., 2004).凡传明等(2011)指出, 水绵能够抑制水体中蓝藻的复苏, 同时能够在底泥表面形成垫面, 阻碍光线的射入, 进而降低底泥表面温度及水体中的营养盐浓度, 从而在蓝藻多发水体中发挥重要的生态功能.事实上, 水绵在相对清洁的富营养化水体中非常普遍, 并在一定时期内会以浮游方式生活, 当条件适宜时, 它们会以固着态在水体中产生缠结的细丝.一旦水绵的生长不能得到控制, 其大量死亡后便会形成黄色棉絮状残体漂浮于水面, 散发难闻的气味并对水体造成严重污染.在富营养化的水体中, 有的水体以清水态呈现, 有的水体以浊水态呈现, 甚至蓝藻水化.在营养盐难以控制的水体中, 水体是否能以清水态呈现至关重要.因此, 水绵如能在这样的水体中发展并得到一定程度的抑制, 其对水体生态系统清水态的稳固反而具有一定的有益效应.因此, 研究对水绵的有度调控效应具有重要的应用价值和生态意义.
目前, 应对水绵大量爆发的方法多集中于物理打捞和化学药物投放两方面(陈孝花等, 2011).生物操纵法因具有有效、无污染和可持续等优点逐渐被研究人员关注, 成为应对藻类爆发的重要研究方向(Leibold et al., 1997; Seda et al., 1997; Jeppesen et al., 2007).Shapiro等(1984)首先提出了“生物操纵”理论, 主要是以改善水质为目的, 通过直接捕除滤食性鱼类或放养凶猛的肉食性鱼类的方式, 壮大浮游动物群落并以此遏制藻类.此后, 生物操纵理论被广泛发展为利用种间竞争和捕食关系, 对水体中有害藻类进行摄食、转化、降解及转移, 从而达到控制有害藻华的目的.张饮江等(2015)利用光倒刺鲃(Spinibarbus hollandi)、白鲢(Hypophthalmichthys molitrix)的食性特点, 研究了不同密度与不同投放比例协同作用下对围隔内水体丝状藻水绵的抑制效果, 结果表明, 两种鱼类合适的配比可以有效控制水绵滋生, 且能够兼顾改善水质.可见, 利用生物操纵法调控水体中水绵生长已有一定研究, 然而投放水生生物的种类和水体营养水平可能成为影响生物操纵成败的关键, 值得进一步深入研究.
在亚热带地区, 杂食性鱼类最为常见且在水体中占据优势, 水体中这些鱼类的存在对藻类造成的影响不可忽视.在一些热亚带湖泊和水库的研究中发现, 这些杂食性鱼类能够直接作用于藻类, 通过直接摄食个体较大的藻类在一定程度上抑制其生长, 并改变藻类群落结构(Hambright et al., 2002; Turker et al., 2003).另一方面, 杂食性鱼类可能通过抑制滤食性浮游动物或是通过营养盐再循环途径促进藻类的生长, 同时影响藻类群落结构(Drenner et al., 1996; Vanni, 2002).本研究考虑水绵的主要生活态为固着态, 因此, 主要选取底栖杂食性鱼类(鲤和鲫)和底栖杂食性虾类(日本沼虾), 并选取对水绵抑制效应研究有过报道的杂食性鱼类鲢一并作为研究对象.
为探究安全高效抑制水绵的方法, 本研究利用养殖水桶开展两次生物操纵的调控实验, 分别观测鲤、鲢和鲫在没有营养加富条件下, 以及鲫和日本沼虾在营养加富条件下, 对水体中浮游态水绵和固着态水绵生长的抑制效果及其对水质的影响, 从而探究生物操纵法调控水绵的可行性, 试图为水域环境恢复及保护提供理论依据和重要思路.
2 材料和方法(Materials and methods)2.1 实验设计2.1.1 控制实验1控制实验1在河南师范大学水产养殖基地进行, 实验时间为2017年7月19日—8月15日.实验设置4个观测组:1个空白组和3个处理组.实验开始前先在所有观测组水桶中放入等量水绵培养1周, 然后进行处理前采样(第0次取样).之后投放鲤(Cyprinus carpio)、鲫(Carassius auratus)和鲢(Hypophthalmichthys molitrix), 每桶投放鱼体重共20 g, 控制投放密度为160 g·m-3, 每个观测组设置3个重复.
实验开始后, 不再引入水生生物, 无投饵, 增氧机曝气, 定期注水维持水位稳定.每隔2 d进行水质测定并采样, 测定项目包括水体各项理化指标、浮游水绵生物量、浮游植物生物量, 样品采集共10次.实验末期, 收集固着态水绵和浮游动物并进行测定.
2.1.2 控制实验2控制实验2也在河南师范大学水产养殖基地进行, 实验时间为2017年9月24日—10月21日.实验设置3个观测组:1个空白组和2个处理组(表 1).实验开始前先在所有观测组水桶中放入等量水绵培养1周, 然后进行处理前采样(第0次取样), 取样后加入营养盐(KH2PO4 5.5 mg、NH4NO3 178.6 mg), 将水体的可溶性磷(SRP)浓度调整为0.01 mg·L-1, 可溶性氮(DIN)浓度调整为0.5 mg·L-1.按照表 1的剂量分别投放日本沼虾(Macrobrachium nipponense)和鲫(Carassius auratus), 投放密度为100 g·m-3.每处理组设置3个重复.水体管理、水质测定和样品采集方法与实验1相同.
表 1(Table 1)
| 表 1 控制实验2设计 Table 1 Design of controlled experiment 2 | ||||||||||||||||||||||
表 1 控制实验2设计 Table 1 Design of controlled experiment 2
| ||||||||||||||||||||||
2.2 实验材料实验用鱼(鲤、鲢、鲫)均来自于河南师范大学水产养殖基地同批次鱼苗, 鲤鱼体长6.0~9.1 cm, 鲢鱼体长7.8~9.3 cm, 鲫鱼体长4.4~6.6 cm.日本沼虾采集自南阳市丹江口水库, 筛选体长1.5~2.3 cm的虾进行实验, 虾采集后在清水中饲养1周方可进行实验.
实验水桶总容量为150 L, 实验过程中每桶放入水的体积为120 L, 水深约1 m.实验用水为深层地下水, 经沉淀、曝气后注入实验水桶.
2.3 检测方法水绵分为浮游态和固着态两种生长状态, 分别计算其生物量.对于固着态水绵, 分别在实验初期(9月24日)及实验末期(10月21日)在筒壁内侧刮取100 cm2藻样, 置于尼康E100显微镜下观测, 鉴定, 并计算生物量.浮游态水绵随其他浮游植物样品一起采集、鉴定并测量.
水体中可溶性磷酸盐(SRP)、亚硝氮、氨氮、硝氮浓度的测定方法参照《水和废水检测分析方法》.水体可溶性氮(DIN)为亚硝氮、氨氮、硝氮之和.现场用SensoDirect 150型便携式水质多功能测量仪测定水温和pH.
由于对营养盐的竞争利用, 固着态藻类与浮游态藻类的生长常互相拮抗, 因此, 实验中监测了浮游植物的生长.用1 L深水采水器于水面下0.2 m处采集各实验组水样, 用于检测水体浮游植物.水样中加入1%的鲁格氏液和4%的甲醛溶液固定(章宗涉等, 1991), 在实验室用柱形瓶静置沉淀2~3 d后, 用绑有20 μm筛绢的虹吸管移除上清液, 保留20~30 mL水样, 将水样与沉积物一起摇匀, 用于定量计数.取0.1 mL浓缩样品于浮游植物计数框, 在尼康E100显微镜400×下鉴定并计数, 计数时浮游态水绵单独计数, 不计算在浮游植物样品内.每样品计数3片, 取平均值计算丰度.浮游植物的生物体积根据其近似几何形状的公式计算(Hillebrand et al., 1999), 然后通过细胞体积推算浮游植物生物量.
浮游动物是藻类的主要摄食者, 也是水体中影响藻类生长最关键的生物因子, 因此, 实验中也监测了浮游动物的生长.浮游动物采集水样量大, 本研究仅在试验初期和实验末期各采样一次.使用采水器采集5 L水样, 用25号浮游生物网浓缩收集, 加入5%的甲醛溶液固定, 用于浮游动物的定性检测(蒋燮治等, 1979).样品在尼康E100显微镜下鉴定种类, 在尼康SMZ645解剖镜下计数.每种类测定体长, 然后依据体长推算浮游动物生物量(章宗涉等, 1991).
2.4 数据分析处理前采样(第0次采样), 采用单因素方差分析(ANOVA)统计水绵、水体理化因子和浮游生物的生物量是否存在差异.实验期间第1~9次采样, 使用重复方差分析(Repeated Measures ANOVAs, RMA)分析不同生物操纵对水绵、水体理化指标和浮游生物群落的影响是否存在差异.如RMA检验存在差异时, 再使用多重比较检验各观测组间的差异, 设定p < 0.05具有显著差异.数据统计分析在SPSS 20.0中完成.
3 结果(Results)3.1 控制实验13.1.1 水绵处理前采样, 4个观测组中浮游态水绵和固着态水绵的生物量均无显著差异(ANOVA, p > 0.05).实验期间, 鲫组水体中浮游态水绵生物量显著高于空白组(图 1a, RMA, p=0.032).实验末期, 空白组、鲤组、鲫组和鲢组的固着态水绵生物量分别为440.2、2223.1、989.5和799.1 g·m-2.鲤组中固着态水绵生物量显著高于空白组(图 1b, p=0.036), 鲫组和鲢组中固着态水绵生物量与空白组没有显著差异(p>0.05).
图 1(Fig. 1)
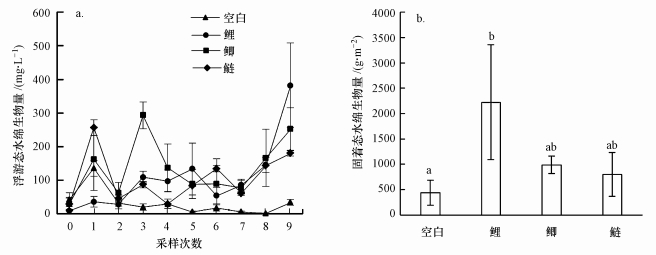 |
| 图 1 实验期间4个观测组浮游态水绵(a)和固着态水绵(b)的生物量 Fig. 1Biomass of planktonic Spirogyra(a) and benthic Spirogyra(b) in 4 observed groups during the experimen |
3.1.2 水体理化指标处理前采样, 4个观测组水体中pH、SRP和DIN均无显著差异(ANOVA, p>0.05).水温在实验周期内上下波动, 介于26.8~32.7 ℃(图 2a).实验期间, 鲤组水体pH显著高于对照组(图 2b, RMA, p=0.005).而鲫组水体SRP显著高于对照组(图 2c, RMA, p=0.029), 鲤组和鲢组与空白组相比没有显著差异(p>0.05).空白组DIN在时间序列上变化不大, 然而3个处理组的DIN却随时间推移呈逐步降低趋势, 表明各实验鱼均可在一定程度上利用水体中的可溶性氮.其中, 鲫组和鲢组水体中DIN显著低于对照组(图 2d, 鲫组:p=0.006;鲢组:p=0.005).
图 2(Fig. 2)
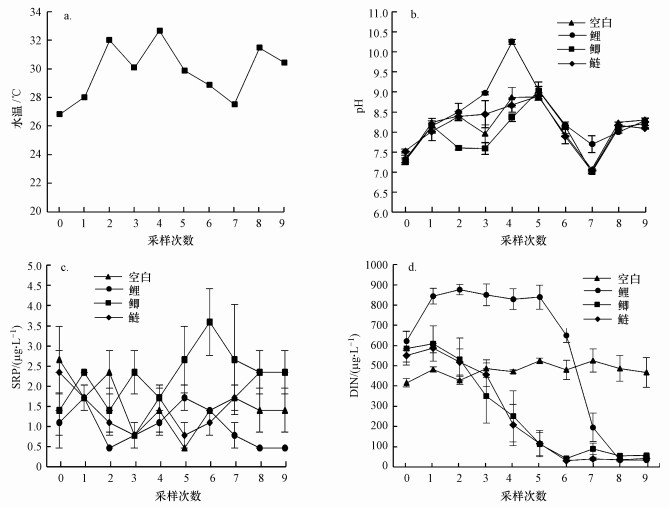 |
| 图 2 实验期间4个观测组水体理化参数指标 (a.水温, b.pH, c.可溶性磷(SRP), d.可溶性氮(DIN)) Fig. 2Water physical and chemical indexes in 4 observed groups during the experiment (a.water temperature, b.pH, c.soluble reactive phosphorus (SRP), d.dissolved inorganic nitrogen (DIN)) |
3.1.3 浮游植物处理前采样, 鉴定到浮游植物共52个种(属), 隶属于5个门, 其中, 绿藻门26属36种, 蓝藻门6属7种, 硅藻门7属7种, 甲藻门1属1种, 裸藻门1属1种.实验期间, 不同观测组中浮游植物的优势种类变化不大, 硅藻和绿藻是浮游植物群落结构的主要组成部分, 蓝藻、裸藻、甲藻在浮游植物群落结构中占比较少.在实验前期, 各组水体中浮游植物生物量差异不显著(ANOVA, p=0.13).实验期间, 鲤组和鲫组中浮游植物生物量显著高于对照组(图 3, RMA, 鲤组:p=0.01;鲫组:p=0.035).
图 3(Fig. 3)
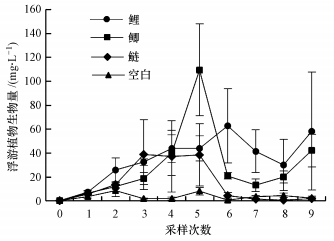 |
| 图 3 实验期间4个观测组浮游植物生物量 Fig. 3Phytoplankton biomass in 4 observed groups during the experiment |
3.1.4 浮游动物实验期间, 鉴定到浮游动物共9个种(属), 其中, 轮虫5属5种, 原生动物1属2种, 枝角类1属1种, 桡足类1属1种.轮虫和原生动物是浮游动物群落的主要组成部分, 枝角类和桡足类种类和数量均较少.实验期间, 大肚须足轮虫(E.dilatata)和轮虫(Rotaria sp.)是优势种类, 不同观测组中浮游动物的优势种类变化不大.在实验前期, 各组水体中浮游动物生物量差异不显著(ANOVA, p=0.728).试验末期, 空白组、鲤组、鲫组和鲢组的浮游动物生物量分别为251.3、3.2、5.3和3.2 μg·L-1.3个处理组浮游动物生物量均显著低于空白组(图 4, ANOVA, p=0.001), 表明处理组中浮游动物主要受到鱼类放养的有效控制, 其对藻类的下行作用可以忽略.
图 4(Fig. 4)
 |
| 图 4 实验期间4个观测组浮游动物生物量 Fig. 4Zooplankton biomass in 4 observed groups during the experiment |
3.2 控制实验23.2.1 水绵处理前采样, 3个观测组水体中浮游态水绵和固着态水绵的生物量均无显著差异(ANOVA, p>0.05).试验期间, 3个观测组水体中浮游态水绵生物量仍没有显著差异(图 5a, RMA, p=0.179).实验末期, 空白组、虾组和鲫组中固着态水绵的生物量分别为1381.2、658.1和1236.6 g·m-2.虾组中固着态水绵的生物量显著低于空白组(图 5b, ANOVA, p < 0.001).
图 5(Fig. 5)
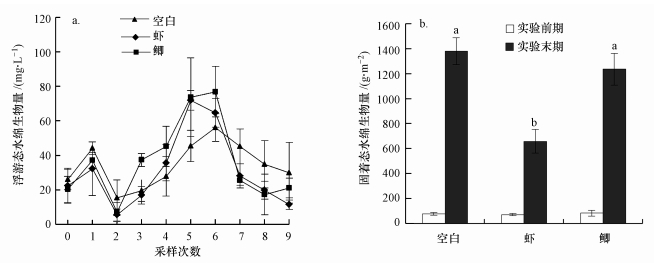 |
| 图 5 实验期间3个观测组浮游态水绵(a)和固着态水绵(b)的生物量 Fig. 5Biomass of planktonic Spirogyra (a) and benthic Spirogyra (b) in 3 observed groups during the experiment |
3.2.2 水体理化指标处理前采样, 3个观测组水体中pH、SRP和DIN均无显著差异(ANOVA, p>0.05).实验期间, 水温有逐步降低趋势, 介于15.5~28.3 ℃(图 6a).观测期间, 空白组水体pH为8.6~10.9, SRP为0.9~6.6 μg·L-1, DIN为1815.8~4248.8 μg·L-1;虾组水体pH为8.4~10.7, SRP为0.9~6.6 μg·L-1, DIN为1438.5~4445.6 μg·L-1;鲫组水体pH为8.6~10.7, SRP为0.9~6.6 μg·L-1, DIN为1949.5~4934.3 μg·L-1.与对照组相比, 2个处理组pH(图 6b, RMA, p=0.57)、SRP(图 6c, RMA, p=0.748)仍无显著差异.虾组水体中DIN与对照组没有显著差异(RMA, p=0.733), 然而却显著低于鲫组(图 6d, RMA, p=0.022).
图 6(Fig. 6)
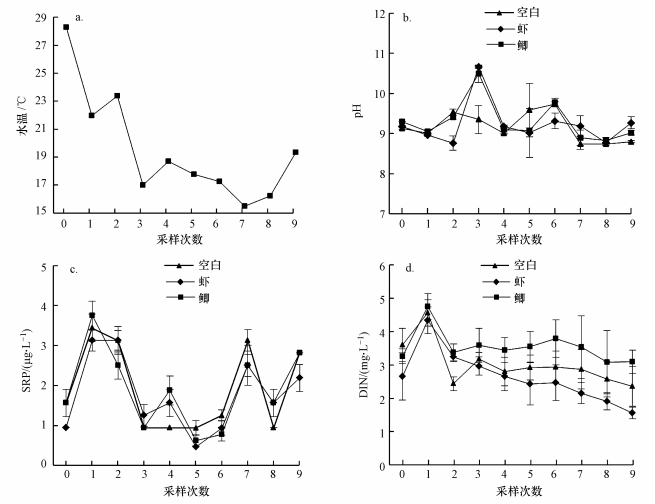 |
| 图 6 实验期间3个观测组水体理化参数指标 (a.水温, b.pH, c.可溶性磷(SRP), d.可溶性氮(DIN)) Fig. 6Water physical and chemical indexes in 3 observed groups during the experiment (a.water temperature, b.pH, c.soluble reactive phosphorus (SRP), d.dissolved inorganic nitrogen (DIN)) |
3.2.3 浮游植物实验期间, 鉴定到浮游植物共63个种(属), 隶属于6个门, 其中, 绿藻门25属32种, 蓝藻门12属15种, 硅藻门11属12种, 甲藻门2属2种, 裸藻门1属1种, 隐藻门1属1种.实验期间, 不同观测组中浮游植物的优势种类变化不大, 硅藻和绿藻是浮游植物群落结构的主要组成部分, 蓝藻、裸藻、隐藻、甲藻在浮游植物群落结构中占比较少.实验前期, 各组水体中浮游植物生物量差异不显著(图 7, ANOVA, p=0.636).实验末期, 空白组、虾组和鲫组的浮游植物生物量分别为7.0、5.6和6.2 mg·L-1.实验期间, 虾组浮游植物生物量显著低于对照组(RMA, p =0.008).
图 7(Fig. 7)
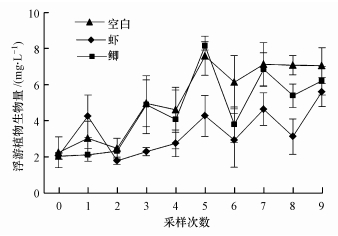 |
| 图 7 实验期间3个观测组浮游植物生物量 Fig. 7Phytoplankton biomass in 3 observed groups during the experiment |
3.2.4 浮游动物实验期间, 鉴定到浮游动物共9种(属), 其中, 轮虫5属5种, 原生动物1属2种, 枝角类1属1种, 桡足类1属1种.轮虫和原生动物是浮游动物的主要组成部分, 枝角类和桡足类种类和数量均较少.实验期间, 大肚须足轮虫(E.dilatata)和轮虫(Rotaria sp.)是优势种类, 不同观测组中浮游动物的优势种类变化不大.在实验前期, 各组水体中浮游动物生物量差异不显著(ANOVA, p=0.47).试验末期, 空白组、虾组和鲫组的浮游动物生物量分别为127.9、10.0和35.5 μg·L-1(图 8).虾组浮游动物生物量显著低于对照组(ANOVA, p=0.028), 表明浮游动物主要受到虾类放养的有效控制, 其对藻类的下行作用可以忽略.
图 8(Fig. 8)
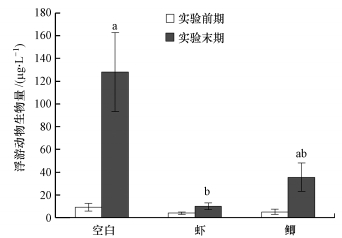 |
| 图 8 实验期间3个观测组浮游动物生物量 Fig. 8Zooplankton biomass in 3 observed groups during the experiment |
4 讨论(Discussion)4.1 无营养加富下实验鱼类对水绵的影响在控制实验1中, 不同鱼类添加对水绵生长的影响有所不同, 这与各种鱼类食性有重要关系.鲤常栖息于水体下层, 属杂食性鱼类;鲫常栖息于水底游动觅食, 也属杂食性鱼类;鲢常栖息于水体上中层, 属于滤食性鱼类(伍献文等, 1963).本实验结果显示, 鲫组浮游态水绵生物量显著高于空白组, 而鲤组固着态水绵生物量显著高于空白组(图 1), 表明鲤和鲫作为两种底栖杂食性鱼类, 在没有营养加富的水体中反而促进水绵的生长.Schaus等(1999)指出, 底栖杂食性鱼类可以起到“营养泵”的作用, 它们可以利用死亡残体和沉积物物质转化为营养盐并释放到水体中.本研究中, 水绵生长周期短暂, 大量生长的水绵没有来得及被水体中放养的鱼类利用, 一部分会死亡脱落并形成沉积物.底栖杂食性鱼类在这样的条件下, 可能加速了沉积物营养盐和水体营养盐间的物质循环速度, 从而促进了水绵的生长.
营养盐可以通过上行效应的途径影响浮游植物群落(McQueen et al., 1989).底栖杂食性鱼类可以加速水体营养盐循环, 并以上行效应的方式增加水绵和其它浮游植物的生物量.本实验结果显示, 鲫组水体SRP显著高于对照组(图 2c), 表明鲫对物质的再利用促进了水体磷的增加, 被释放到水体中的磷进一步被水绵和其它浮游植物利用, 导致促进水绵和其它浮游植物生长的现象出现(图 1、图 3).事实上, 底栖杂食性鱼类对水体生态系统的影响十分重要.一方面, 这些鱼类受浮游动物的限制小, 肉食性鱼类的捕食对其控制能力也十分有限(Fernando, 1994; Jeppesen et al., 2003);另一方面, 杂食性鱼类常具有更快的生长速率, 可以加快营养盐在水体中的循环速率(Drenner et al., 1999).综上所述, 相比鲤和鲫的补充, 无鱼条件下反而显著抑制了水绵的生长;考虑到这两种鱼类广泛分布于自然水体, 建议在水绵生长旺盛的水体中, 一定程度移除水体中的这些鱼类反而可以有效调控水绵的生长.
4.2 营养加富下日本沼虾对水绵的调控效应营养加富条件下, 日本沼虾对水绵的控制效应明显.日本沼虾和鲫同为底栖杂食性水生动物, 但对水绵的影响并不相同.杂食性水生生物加速了水体营养盐的再循环, 并以上行效应的方式作用于藻类, 对藻类具有促进效应.然而, 这种促进效应可能因杂食性水生生物对藻类的直接摄食而受到抑制.因而杂食性水生生物对藻类的总体效应“因人而异”, 必须进行深入的研究才能了解.本实验结果显示, 虾组固着态水绵的生物量显著低于空白组(图 5b), 推测在富营养水体中日本沼虾的补充可以有效调控水绵生长.在养殖性水体中, MacGibbon(2008)观测到在日本沼虾减产的池塘中大量固着态水绵爆发的现象, 这个结果在一定程度上印证了日本沼虾对固着态水绵的抑制关系.
杂食性水生生物对藻类的作用受水体营养状态的影响(Sarnelle, 1992; Drenner et al., 1996).野外观测实验发现, 杂食性水生生物对藻类的影响随水体营养程度的增加而增大(Meijer et al., 1999; Jeppesen et al., 2003).但也有例外, Stephen等对英格兰西北部一个小型湖泊的研究中发现, 在不同的年份杂食性鱼类对藻类的下行效应作用不同:1998年水体磷浓度处于中等水平(99 μg·L-1), 杂食性鱼类对藻类具有较强的控制作用;1999年水体磷浓度处于富营养水平(295 μg·L-1), 杂食性鱼类对藻类的控制作用却非常有限(Stephen et al., 2004).本研究结果表明, 鲫在低营养水体中表现出对水绵生长的促进效应, 却在加富水体中对水绵生长没有显著影响, 表明鲫在水体中对水绵发挥的作用受水体营养状态的影响, 与水体营养状态存在交互作用.日本沼虾对水绵的抑制效应是否受水体营养状态的影响值得进一步探究.
5 结论(Conclusions)1) 在没有营养加富的水体中, 鲤和鲫对水绵不仅没有控制效应, 反而会促进水绵的生长.建议在水绵生长旺盛的水体中, 一定程度移除水体中这些鱼类反而可以有效控制水绵的生长.
2) 在营养加富的水体中, 日本沼虾对水绵的控制效应明显, 推测在富营养水体中日本沼虾的补充可以有效控制水绵生长.
3) 鲫在低营养水体中表现出对水绵生长的促进效应, 却在加富水体中对水绵生长没有显著影响, 表明鲫对水绵发挥的作用与水体营养状态存在交互作用.日本沼虾对水绵的抑制效应是否受水体营养状态的影响值得进一步探究.
参考文献
| 陈孝花, 潘连德, 张饮江. 2011. 水中丝状藻类有害藻华的形成与对策[J]. 南方水产科学, 2011, 7(2): 77–82.DOI:10.3969/j.issn.2095-0780.2011.02.013 |
| Drenner R W, Smith J D, Threlkeld S T. 1996. Lake trophic state and the limnolgoical effects of omnivorous fish[J]. Hydrobiologia, 319: 213–223.DOI:10.1007/BF00013734 |
| Drenner R W, Hambright K D. 1999. Biomanipulation of fish as a lake restoration technique[J]. International Association of Theoretical and Applied Limnology, 146: 129–165. |
| Fernando C H. 1994. Zooplankton, fish and fisheries in tropical freshwaters[J]. Hydrobiologia, 272: 105–123.DOI:10.1007/BF00006516 |
| 凡传明, 刘云国, 郭一明, 等. 2011. 水绵(Spirogyra)对蓝藻复苏及藻类群落结构的影响[J]. 环境科学学报, 2011, 31(10): 2132–2137. |
| Hambright K D, Blumenhine S C, Shapiro J. 2002. Can filter-feeding fishes improve water quality in lakes?[J]. Freshwater Biology, 47: 1173–1182.DOI:10.1046/j.1365-2427.2002.00840.x |
| Hawes I. 1988. The seasonal dynamics of Spirogyra in a shallow, Maritime Antarctic Lake[J]. Polar Biology, 86(6): 429–437. |
| Hillebrand H, Duerselen C D, Kirschtel D, et al. 1999. Biovolume calculation for pelagic and benthic microalgae[J]. Journal of Phycology, 35(2): 403–424.DOI:10.1046/j.1529-8817.1999.3520403.x |
| Irfanullah H M, Moss B. 2004. Factors influencing the return of submerged plants to a clear-water, shallow temperate lake[J]. Aquatic Botany, 80(3): 177–191.DOI:10.1016/j.aquabot.2004.07.010 |
| 蒋燮治, 堵南山. 1979. 中国动物志-甲壳纲[M]. 北京: 科学出版社. |
| Jeppesen E, Meerhoff M, Jacobsen B A, et al. 2007. Restoration of shallow lakes by nutrient control and biomanipulation-the successful strategy varies with lake size and climate[J]. Hydrobiologia, 581: 269–285.DOI:10.1007/s10750-006-0507-3 |
| Jeppesen E, Jensen J P, Jensen C, et al. 2003. The impact of nutrient state and lake depth on top-down control in the pelagic zone of lakes:a study of 466 lakes from the temperate zone to the Artic[J]. Ecosystems, 6: 313–325.DOI:10.1007/PL00021503 |
| Kravtsova L S, Izhboldina L A, Khanaev I V, et al. 2014. Nearshore benthic blooms of filamentous green algae in Lake Baikal[J]. Journal of Great Lakes Research, 40: 441–448.DOI:10.1016/j.jglr.2014.02.019 |
| Leibold M A, Chase J M, Shurin J B, et al. 1997. Species turnover and the regulation of trophic structure[J]. Annual Review of Ecology and Systematics, 28: 467–494.DOI:10.1146/annurev.ecolsys.28.1.467 |
| McQueen D J, Hohannes M R S, Post J R, et al. 1989. Bottom-up and top-down impacts on freshwater pelagic community structure[J]. Ecological Monographs, 59(3): 289–309.DOI:10.2307/1942603 |
| MacGibbon D J.2008.The effects of different water quality parameters on prawn (Macrobrachium rosenbergii) yield, phytoplankton abundance and phytoplankton diversity at New Zealand prawns limited, Wairakei, New Zealand[D].Wellington: Victoria University of Wellington |
| Meijer M L, De Boois I, Scheffer M, et al. 1999. Biomanipulation in shallow lakes in the Netherlands:an evaluation of 18 case studies[J]. Hydrobiologia, 408/409: 13–30.DOI:10.1023/A:1017045518813 |
| Priddle J. 1980. The production ecology of benthic plants in some Antarctic lakes:Ⅰ.In situ production studies[J]. Journal of Ecology, 68(1): 141–153.DOI:10.2307/2259248 |
| Seda J, Kubecka J. 1997. Long-term biomanipulation of Rimov Reservior(Czech Republic)[J]. Hydrobiogia, 345: 95–108.DOI:10.1023/A:1002911103252 |
| Shapiro J, Wright D I. 1984. Lake restoration by biomanipulation[J]. Freshwater Biology, 14: 371–383.DOI:10.1111/fwb.1984.14.issue-4 |
| Schaus M H, Vanni M J, Wissing T E, et al. 1997. Nitrogen and phosphorus excretion by detritivorous gizzard shad in a reservoir ecosystem[J]. Limnology and Oceanography, 42: 1386–1397.DOI:10.4319/lo.1997.42.6.1386 |
| Sarnelle O. 1992. Contrasting effects of Daphnia on ratios of nitrogen to phosphorus in a eutrophic, hard-water lake[J]. Limnology and Oceanography, 37: 1527–1542.DOI:10.4319/lo.1992.37.7.1527 |
| Stephen D, Balayla D M, Collings S E, et al. 2004. Two mesocosm experiments investigating the control of summer phytoplankton growth in a small shallow lake[J]. Freshwater Biology, 49: 1551–1564.DOI:10.1111/fwb.2004.49.issue-12 |
| Timoshkin O A, Bondarenko N A, Volkova Ye A, et al. 2015. Mass development of green filamentous algae of the genera Spirogyra and Stigeoclonium (Chlorophyta) in the littoral zone of the southern part of Lake Baikal[J]. Hydrobiological Journal, 51(1): 13–23.DOI:10.1615/HydrobJ.v51.i1 |
| Turker H, Eversole A G, Brune D E. 2003. Filtration of green algae and cyanobacteria by Nile tilpia, Oreochromis niloticus, in the partitioned aquaculture system[J]. Aquaculture, 215: 93–101.DOI:10.1016/S0044-8486(02)00133-3 |
| Vanni M J, Flecker A S, Hood J M, et al. 2002. Stoichiometry of nutrients cycling by vertebrates in a tropical stream:linking species identity and ecosystem processes[J]. Ecology Letter, 5: 285–293.DOI:10.1046/j.1461-0248.2002.00314.x |
| 伍献文, 杨干荣, 乐佩琦, 等. 1963. 中国经济动物志-淡水鱼类[M]. 北京: 科学出版社. |
| 张饮江, 黎臻, 王芳, 等. 2015. 光倒刺鲃、白鲢协同投放抑制丝状藻(水绵)藻华围隔研究[J]. 环境科学学报, 2015, 35(3): 780–788. |
| 章宗涉, 黄祥飞. 1991. 淡水浮游生物研究方法[M]. 北京: 科学出版社. |
