 , 高磊1, 刘文宗2, 王爱杰1,2
, 高磊1, 刘文宗2, 王爱杰1,2

1. 哈尔滨工业大学, 城市水资源与水环境国家重点实验室, 哈尔滨 150090;
2. 中国科学院生态环境研究中心, 环境生物技术重点实验室, 北京 100085
收稿日期: 2018-03-22; 修回日期: 2018-04-19; 录用日期: 2018-04-19
基金项目: 国家自然科学基金面上项目(No.21577162)
作者简介: 席尚东(1993-), 男, E-mail:xishangdong15@163.com
通讯作者(责任作者): 王爱杰(1972—)女, 博士, 教授, 主要研究方向为污染物生物转化与资源化.E-mail:waj0578@hit.edu.cn
摘要: 构建了厌氧生物处理过程与生物电化学过程耦合(AD-BES)的废水处理系统,以生活污水为碳源,研究了AD-BES系统对偶氮染料橙黄Ⅱ的强化去除效果,分析并优化了AD-BES反应器降解橙黄Ⅱ染料的关键影响因素,包括生活污水所占比例、电解质Na2SO4的浓度等因子.结果表明,生活污水作为廉价碳源能够有效提升橙黄Ⅱ的脱色效率.在8 h降解时间内,生活污水所占比例为1时的脱色效率比生活污水所占比例为1/3时提升了35.8%.进一步研究发现,通过添加电解质Na2SO4能够继续提高橙黄Ⅱ的脱色效率,在0~0.025 mol·L-1 Na2SO4范围内,随着Na2SO4浓度的提高,脱色效率持续升高,通过优化,在0.025 mol·L-1时反应4 h后脱色率达到90.1%,7 h后达到98%,对COD的去除量达到159 mg·L-1.通过对碳纤维电极进行扫描电镜(SEM)测试和电极上的生物膜高通量基因测序,发现在微电流刺激下碳纤维电极上快速富集了相对丰度较大的功能菌群,主要包括具有胞外电子传递能力的Proteobacteria(变形菌门)和降解复杂碳源能力的Bacteroidetes(拟杆菌门)中的功能菌属.
关键词:厌氧-生物电化学耦合系统橙黄Ⅱ废水生活污水电解质脱色率
Domestic sewage enhancing azo dye wastewater treatment in anaerobic digestion-bioelectrochemical system and functional microbial community analysis
XI Shangdong1
 , GAO Lei1, LIU Wenzong2, WANG Aijie1,2
, GAO Lei1, LIU Wenzong2, WANG Aijie1,2

1. State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090;
2. Key Laboratory of Environmental Biotechnology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
Received 22 March 2018; received in revised from 19 April 2018; accepted 19 April 2018
Abstract: Azo dye reductive dechlorination was studied in a constructed anaerobic digestion-bioelectrochemical system(AD-BES) when applying domestic sewage as an efficient electron donor. The key operation factors that influenced Orange Ⅱ reduction efficiencies were investigated and were optimized in AD-BES, including the proportion of domestic sewage and concentration of Na2SO4 as electrolyte. Results show that decolorization efficiency of Orange Ⅱ increased along with the increase of domestic sewage proportion. Decolorization rate was increased by 35.8% when sewage inoculation ratio improved to 1 compared with that of 1/3 at 8 h. Using Na2SO4 as electrolyte can improve the reduction efficiency and the higher efficiency was achieved when the concentration of Na2SO4 was increased among 0~0.025 mol·L-1. Under the optimized Na2SO4 concentration of 0.025 mol·L-1, the decolorization efficiency reached to 90.1% at 4 h, and increased to the maximum of 98% along with COD removal of 159 mg·L-1 at 7 h. Scanning electron microscopic observation results show a great deal of microorganisms attached on the carbon fiber. Bacteroidetes and Proteobacteria played important parts in Orange Ⅱ reduction and extracellular electron transfer.
Keywords: anaerobic digestion-bioelectrochemical systemOrange Ⅱ contained wastewaterdomestic sewageelectrolytedecolorizing efficiency
1 引言(Introduction)纺织印染是我国的传统行业, 同时也是主要的出口创汇产业.纺织印染加工过程中需要消耗大量的水, 同时排放大量污染物, 使其在为我国经济发展做出贡献的同时, 也造成了突出的环境问题, 严重地制约了印染企业整体快速的发展(杨少斌等, 2008).据统计, 我国印染废水日排放量高达400万t, 是当前我国水系环境的重点排污源, 同时也是工业废水处理的难点和焦点之一.其中, 应用最为广泛的偶氮染料, 占全世界染料使用总量的60%(钟琼, 2008).偶氮染料废水是一类排污量大且回用比例低的废水, 具有可生化性差、水质波动大、所含污染物种类多的特性, 从而使其处理难度较大.同时, 该类废水色度较大、具有毒性、致突变性和诱变性(Ayed et al., 2011), 如果直接排放到环境中, 不仅难以降解, 还会通过食物链富集在各种生物体内, 严重威胁人类的健康;同时, 排放的染料还会吸收和反射太阳光, 对水生生物的生长造成严重影响, 导致水体生态环境恶化(Hildenbrand et al., 1999).
目前印染废水的处理方法主要包括物理法(吸附法、气浮法等)、化学法(混凝法、氧化法等)及生物法(好氧生物处理法、厌氧生物处理法).由于印染废水特殊的理化性质, 上述单一处理方法的效果并不理想.随着印染行业的发展, 大量新型染料和染色助剂等难降解物质不断出现, 导致印染废水的成分越来越复杂.尽管传统的厌氧处理法可以降解印染废水, 但为了满足微生物的新陈代谢(Mu et al., 2009), 需要向污水中投加易降解的有机碳源, 如乙酸、乙醇、葡萄糖、甲醇等, 这又会增加污水处理的成本(Rasool et al., 2015), 且厌氧处理耗时长.生物电化学系统(BES)的出现为解决厌氧生物处理过程中存在的不足提供了新思路, 有机物在阳极微生物作用下被氧化, 产生的电子通过外电路转移到阴极, 参与污染物的还原过程(Mu et al., 2009), 对染料和其他难降解污染物, 如硝基化合物(Shen et al., 2014)、卤代污染物(Kong et al., 2015)、硫酸盐化合物(Coma et al., 2013)等均有很好的去除效果.相比于传统的厌氧反应器, 生物电化学系统的引入减小了对有机底物的需求量, 加快了反应速率, 从而提升了处理效率.为了进一步提升难降解染料的高效脱色, 目前会将乙酸盐、葡萄糖、酵母提取物等作为BES的有效电子供体促进阴极污染物还原(Cardenas-Robles et al., 2013).但高成本的外源电子供体与低碳污水处理的发展要求不符, 因此, 亟需寻找廉价而高效的碳源以更有效地推动特种废水的处理.
基于此, 本研究采用厌氧-生物电化学耦合系统降解橙黄Ⅱ染料, 针对电子供体生活污水的混合比例和关键电解质Na2SO4浓度进行分析, 评估染料脱色率、COD去除率及电化学指标, 对碳纤维表面生物膜和微生物群落结构进行解析, 从而为印染废水的实际处理提供理论支持.
2 实验材料与方法(Materials and methods)2.1 实验装置本实验厌氧-生物电化学耦合系统(Anaerobic Digestion-Bioelectrochemical System, AD-BES)装置如图 1所示, 采用完全混合式流态, 续批式操作.该反应器为玻璃容器, 容积为800 mL.采用碳刷(Φ5 cm×L5 cm)作为电极, 电极间距离为4 cm(Cheng et al., 2013;Cui et al., 2016), 碳刷钛丝与电路连接.碳刷中间安置参比电极(SCE+245 mV vs标准氢电极SHE, model-217), 外接500 mV电压.电路中连接10 Ω电阻, 数据记录仪每10 min记录阳极电势及电流.反应器的另一侧从上至下依次设置放气口、取样口及换液口, 反应器采用磁力搅拌器进行混合传质.对照反应器采用两种方式, 一是采用完全混合式厌氧反应器(Anaerobic Digestion, AD), 同样采用两个碳刷为微生物载体, 不接入外电路, 不外加电压;二是电化学反应器(Electrochemical System, ES), 构型、外加电压等条件均与AD-BES完全相同, 通过初始灭菌措施保持无微生物驯化和培养过程.
图 1(Fig. 1)
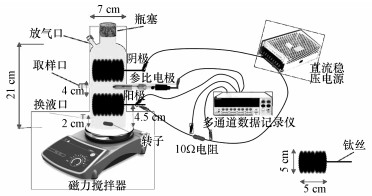 |
| 图 1 反应器装置图 Fig. 1Schematic diagram of reactor |
2.2 实验方法厌氧-生物电化学耦合反应器(AD-BES)以生活污水为基质, 加入5 mL取自污水处理厂的活性污泥和10 mL长期运行效果良好的生物电化学反应器出水为接种源, 配制浓度为50 mg · L-1的橙黄Ⅱ溶液, 加入维生素溶液和矿物质溶液, 配制的溶液经过高纯氮气曝气15 min后经换液口注入反应器内.反应器内置转子, 放置在磁力搅拌器上, 外加电压500 mV, 进行微生物的驯化, 每48 h换液, 观察染料的脱色效率及阳极电势和电流的变化.完全混合式厌氧反应器AD的启动方法除了无外加电压外, 条件与AD-BES相同.反应器启动完成后, 采用生活污水为基质, 分别配制50 mg · L-1橙黄Ⅱ溶液在相同时间进行脱色试验, 将AD-BES、AD、ES系统降解效能及AD和ES降解效能之和(AD+ES)进行对比分析.
探究不同参数对厌氧-生物电化学耦合反应器降解橙黄Ⅱ效能的影响时, 参数包括:生活污水所占比例、Na2SO4电解质的浓度.①设置生活污水体积/溶液总体积的比例分别为1/3(P1/3)、1/2(P1/2)、2/3(P2/3)和1/1(P1), 按此比例配制染料进行4组实验, 分析生活污水所占比例对AD-BES降解染料效能的影响.②处理污水中普遍存在的电解质是NaCl和Na2SO4, 为避免Cl ·活性自由基产生干扰, 选用Na2SO4作为强化电解质, 分别向溶液中加入0、0.005、0.01、0.025、0.05、0.1 mol · L-1的Na2SO4, 分析其对染料脱色的影响.
2.3 分析方法偶氮染料橙黄Ⅱ的浓度根据紫外/可见分光光度计(上海美谱达, UV-1800)在波长484 nm下测定的吸光度换算而得.橙黄Ⅱ染料配置成200 mg · L-1母液, 稀释配置成浓度分别为40、20、10、5、1、0.5和0.1 mg · L-1的样品, 并以纯水做空白, 绘制标准曲线.橙黄Ⅱ的标准曲线为y=0.0435x(x为橙黄Ⅱ的浓度, y为吸光度, R2=0.9998).样品浓度根据标准曲线换算, 浓度较高时的样品需要经过适当的稀释.实验时, 将紫外/可见分光光度计与电脑联机, 采用纯水作为空白, 校正背景值, 而后将样品放入比色皿中, 以1 nm为步长, 在200~700 nm范围内测定吸光度.以吸收峰的位置判断颜色, 以峰高判断色强度, 颜色较深的样品进行适度稀释后检测, 以此来确定反应前后水样中染料的变化情况.
利用电化学工作站对反应器进行循环伏安(CV)扫描, 反应器内装有由50 mmol PBS配制的20 mg · L-1的橙黄Ⅱ溶液, 扫描电压范围为-1.5~-0.2 V, 扫描速度为5 mV · s-1, 通过CV扫描可以看出染料的氧化还原峰, 确定染料能否被电化学还原及外加电压值, 同时, CV曲线也可以在一定程度上反映出生物电化学反应器的性能.使用多通道数据记录仪(Keithley 2700, 美国)在线监测反应器的电流和阳极电位, 监测频率为每10 min记录一次数据.COD采用HJ/T 399—2007快速消解分光光度法进行测定.
对反应器内的碳纤维进行扫描电镜测试(SEM), 在测试前先进行前处理:①固定:用镊子将样品放入5 mL的离心管中, 加入2.5%、pH=6.8的戊二醛至淹没样品, 并置于4 ℃冰箱中固定1.5 h;②冲洗:用0.1 mol pH=6.8的磷酸缓冲溶液冲洗3次, 每次10 min;③脱水:分别用50%、70%、80%、90%的乙醇进行脱水, 每次10~15 min, 再用100%的乙醇脱水3次, 每次10~15 min;④置换:利用100%乙醇:乙酸异戊酯(1 : 1)、纯乙酸异戊酯各置换一次, 每次15 min;⑤干燥:将样品放入用滤纸叠成的小盒中, 置于干燥器中干燥8 h;⑥粘样:用导电胶将样品观察面向上粘贴在扫描电镜样品台上;⑦喷金:用IB-5(Giko)型离子溅射镀膜仪在样品表面镀一层1500 nm厚的金属膜.最后将处理好的样品用ZEISS扫描电镜进行测试.
2.4 计算方法橙黄Ⅱ脱色率计算方法如式(1)所示. COD的消耗量是根据进、出水中COD的变化计算得出, 计算方法如式(2)所示.
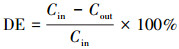 | (1) |
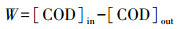 | (2) |
电化学贡献率是假定电路电流中全部电子用于橙黄Ⅱ还原过程的情况下, 经电化学过程还原的橙黄Ⅱ占总橙黄Ⅱ还原量的比例, 用来评价电化学反应对橙黄Ⅱ还原效能的直接贡献, 其计算方法如式(3)所示.
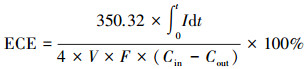 | (3) |
去除橙黄Ⅱ所需能耗(冯玉杰等, 2002)的计算公式如下:
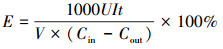 | (4) |
3 结果与讨论(Results and discussion)3.1 AD-BES的启动反应器启动并稳定运行100 h, 阳极电势(图 2a)和系统内的电流(图 2b)基本达到稳定.序批式运行模式下, 受水中COD电子供体消耗的周期变化影响, 电势和电流随着换水呈现出规律性变化, 一段时间后阳极电势会稳定在-0.52 V左右, 电流值稳定在0.25 mA左右, 12 h内几乎脱色完全.而相同条件下的完全混合式厌氧反应器对橙黄Ⅱ的脱色效果依旧很差, 并未完成稳定的驯化启动.说明生物电化学的引入加快了厌氧反应器中对含染料废水处理的功能菌群的驯化和启动.
图 2(Fig. 2)
 |
| 图 2 启动阶段阳极电势(a)和系统电流变化(b) Fig. 2Change of anode potential(a) and current change at start stage(b) |
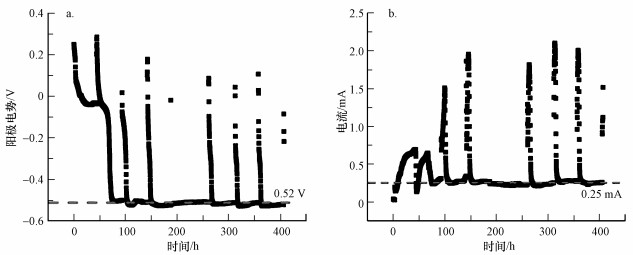
3.2 染料橙黄Ⅱ的电极还原特征及AD-BES系统处理染料废水效果在波长200~700 nm范围内, 通过对反应前后的水样进行紫外-可见光全波段扫描测试, 发现进水的橙黄Ⅱ在484 nm处具有明显的特征吸收峰, 而且在430 nm处有肩峰, 即偶氮峰.随着反应的不断进行, 橙黄Ⅱ在484 nm处的特征吸收峰逐渐降低, 最后消失, 同时产生了新的特征峰.这说明橙黄Ⅱ的偶氮键断裂, 被还原降解而脱色, 同时生成了相应产物(图 3a).
图 3(Fig. 3)
 |
| 图 3 橙黄Ⅱ紫外-可见光全波段扫描图(a)及电极还原峰分析(b) Fig. 3UV-vis full band scanning(a) and cyclic voltammetry scanning diagram(b) of biologic cathode and abiotic cathodic |
对AD-BES的生物阴极和ES的非生物阴极分别进行CV扫描(图 3b), 可以看出, 生物阴极的反应电流大于非生物阴极, 即生物阴极的反应速率大;AD-BES的生物阴极的CV图中, 橙黄Ⅱ的氧化还原峰在-0.66 V处, 而在AD的生物阴极的CV图中, 氧化还原峰在-0.69 V处, 在微生物的作用降低了还原橙黄Ⅱ所需的还原电压, 这也说明了生物阴极对橙黄Ⅱ的还原降解效率高于非生物阴极.
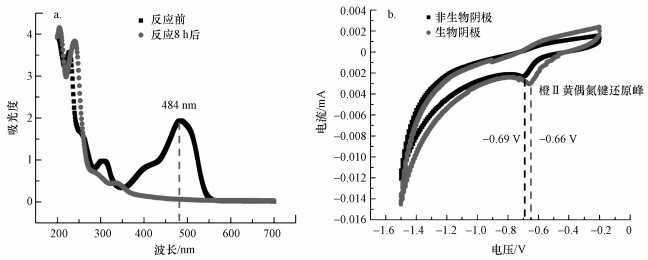
本文分别研究了AD-BES、AD和ES反应器对采用生活污水配置的50 mg · L-1橙黄Ⅱ的降解效能, 同时将AD-BES与AD和ES反应器的降解效果进行比较(图 4).由图可知, 脱色率随时间的增长而变大, 1 h内AD-BES与AD反应器对橙黄Ⅱ的降解效能几乎相同, 均高于ES反应器但相差不大;随着时间的进一步增长, AD-BES反应器的脱色率远高于其他两组反应器, 2 h后AD-BES反应器的降解效能高于AD与ES系统降解效能之和.反应8 h后, AD-BES反应器的脱色率达到97.2%, 橙黄Ⅱ浓度从开始时的50 mg · L-1降至1.4 mg · L-1;而AD和ES反应器对橙黄Ⅱ的脱色效率分别只有57%和22.4%, 橙黄Ⅱ浓度分别只降至21.5和33.8 mg · L-1.
图 4(Fig. 4)
 |
| 图 4 不同反应器中橙黄Ⅱ脱色率随时间的变化曲线 Fig. 4The decolorization rate of Orange Ⅱ in different reactors with time |
由此可见, AD-BES反应器对橙黄Ⅱ的脱色效能远远高于AD和ES反应器.研究发现, AD-BES反应器中一部分附着在碳刷上的厌氧微生物对染料进行降解使其脱色(Wang et al., 2013), 主要反应则通过阳极上的电子传递菌氧化COD为阴极还原染料的偶氮键提供电子实现高效脱色(Kong et al., 2013).在一定的优化条件下, 电化学处理印染废水可提升BOD5/COD的值, 使得废水的可生化降解性得到显著提高(高立新等, 2010), 厌氧-生物电化学耦合系统中电化学作用的同时也提升了微生物的处理能力, 因此, 其处理效能要高于厌氧反应器和电化学系统之和.
3.3 生活污水比例对橙黄Ⅱ降解效果的影响针对AD-BES反应器的优化, 首先研究了不同生活污水比例(1/3、1/2、2/3和1/1, 分别表示为P1/3、P1/2、P2/3和P1)下AD-BES反应器对橙黄Ⅱ脱色率的影响, 其随时间的变化曲线如图 5a所示.由图可知, 橙黄Ⅱ脱色率随时间的增长而提高, 4组实验中整体脱色率从高到低所用的生活污水所占比例依次为1/1、2/3、1/2和1/3, 脱色率随生活污水所占比例的增大而提高.初始1 h内, 生活污水所占比例对橙黄Ⅱ的脱色率几乎无影响, 而随着时间的增加, 生活污水所占比例为1/1的实验组得到最高的脱色率.反应5 h后的脱色率按生活污水占比的减小依次为74.8%、65%、55%和29.6%, 反应8 h后的脱色率依次为97.2%、95.2%、88.6%和71.6%, 其中, 当生活污水所占比例为1/1时, 反应7 h就可得到91.2%的脱色率.
图 5(Fig. 5)
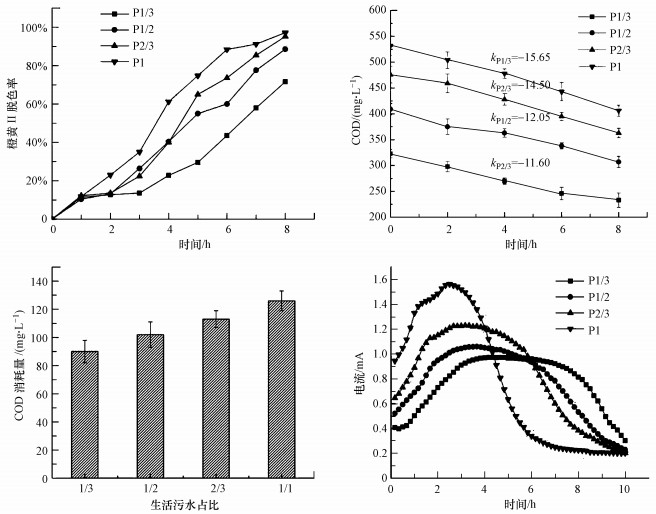 |
| 图 5 不同生活污水比例下的降解结果(a.橙黄Ⅱ脱色率, b.COD变化情况, c.COD消耗量, d.电流变化) Fig. 5The treatment of dye wastewater under different proportion of domestic sewage(a.the decolorization rate of Orange Ⅱ, b. the change of COD, c.the consumption of COD, d.the change of current) |
生活污水是较为复杂的电子供体, 其主要成分是挥发酸、糖类和蛋白, 此外, 还有少量的脂类和淀粉(Kim et al., 2015).废水中挥发酸等简单的有机物含量越丰富, 越利于微生物利用.生活污水所占的比例越大, 废水中的电子供体越多, 越有利于阴极微生物还原降解橙黄Ⅱ, 同时说明生活污水是良好的电子供体.由图 5b可知, COD值随时间的增加而下降, 经拟合可得到下降速率k值, P1/3、P1/2、P2/3和P1的k值分别为-11.6、-12.05、-14.5和-15.65 mg · L-1 · h-1, 其中, 生活污水占比为1/1时, COD值减小速率最大.即去除率最大, 由图 5c可知, 反应8 h后COD的消耗量依次为90、102、113、126 mg · L-1, 同样说明生活污水占比为1/1时, COD消耗量大, 其COD值下降速率随时间增大而变大, 阴极还原橙黄Ⅱ消耗电子反馈到阳极促使阳极消耗更多的有机物, 橙黄Ⅱ降解效果越好, COD消耗量越大.
不同污水占比下厌氧-生物电化学耦合系统处理橙黄Ⅱ废水的电流变化如图 5d所示, 电流随时间的增加先增大后减小.当生活污水占比为1/1时, 10 h时电流值达到稳定, 说明电子充足, 足够体系用于橙黄Ⅱ的还原, 也印证了厌氧-生物电化学耦合系统在去除污染物时需要的电子供体显著低于传统工艺.生活污水所占比例越大, 反应器内部的电流越早达到峰值, 且峰值电流越大.生活污水比例为1/1的反应器电流值在反应进行的第2.5 h达到峰值, 此时的电流大小为1.56 mA, 而生活污水比例为1/3的反应器的电流峰值出现在反应4 h左右, 电流大小为0.97 mA.废水中可供阳极微生物利用的结构简单的电子供体越多, 相应的阴极微生物可获得更多的电子来还原橙黄Ⅱ, 因此, 电子传递更加快速且数量更多, 电流很快达到峰值且峰值较大, 这也是生活污水占比越大橙黄Ⅱ脱色效果越好的原因.
不同条件下厌氧-生物电化学耦合系统反应8 h的生物电化学贡献率和能耗如表 1所示.该系统还原橙黄Ⅱ有两种途径, 即橙黄Ⅱ作为电子受体在阴极被微生物还原的电化学作用, 以及碳刷上附着的厌氧微生物对橙黄Ⅱ进行还原的厌氧作用, 由公式(3)计算得到生物电化学贡献率均高于50%, 因此, 生物电化学作用占主导.
表 1(Table 1)
| 表 1 不同生活污水占比下的生物电化学贡献率及能耗情况 Table 1 The bioelectrochemical contribution rate and energy consumption of different proportions of domestic sewage | |||||||||||||||
表 1 不同生活污水占比下的生物电化学贡献率及能耗情况 Table 1 The bioelectrochemical contribution rate and energy consumption of different proportions of domestic sewage
| |||||||||||||||
3.4 电解质浓度对橙黄Ⅱ降解效果的影响由图 6a可知, 电解质Na2SO4浓度的增加能够提高系统的脱色效果, Na2SO4浓度在0~0.025 mol · L-1之间时, 脱色率随Na2SO4浓度的增加而增大, Na2SO4浓度为0.025 mol · L-1时, 反应4 h的脱色率即可达到90.1%, 反应7 h的脱色率达到98%.继续增加Na2SO4浓度并不会提升橙黄Ⅱ的脱色效果, 反应器脱色率相差不大, Na2SO4浓度最高为0.1 mol · L-1时的脱色效果甚至较差.这是由于一定浓度的Na2SO4的加入增加了溶液中的阴阳离子浓度, 使溶液的电导率增大, 电子传递速率加快, 橙黄Ⅱ被快速还原.但当Na2SO4浓度增大到高浓度后, 橙黄Ⅱ的脱色效率因电极微生物的电子传递数量限制而不能继续提升.在厌氧条件下, 硫酸盐还原菌(SRB)利用硫酸盐和碳源进行代谢(李军等, 2002), 当厌氧体系中的硫酸盐浓度过高时, 厌氧消化会受到抑制, 一方面是因为硫酸盐还原菌与产甲烷菌会竞争基质, 另一方面是因为硫酸盐还原产物硫化氢对微生物具有一定的毒害作用, 会抑制电极微生物的生长(王爱杰等, 2004;贾雪雪, 2017).尽管如此, 与传统反应器相比, 厌氧-生物电化学耦合系统对高浓度的硫酸根离子仍然表现出更高的耐受能力.因此, 在本实验中0.025 mol · L-1为电解质Na2SO4的最佳浓度.
图 6(Fig. 6)
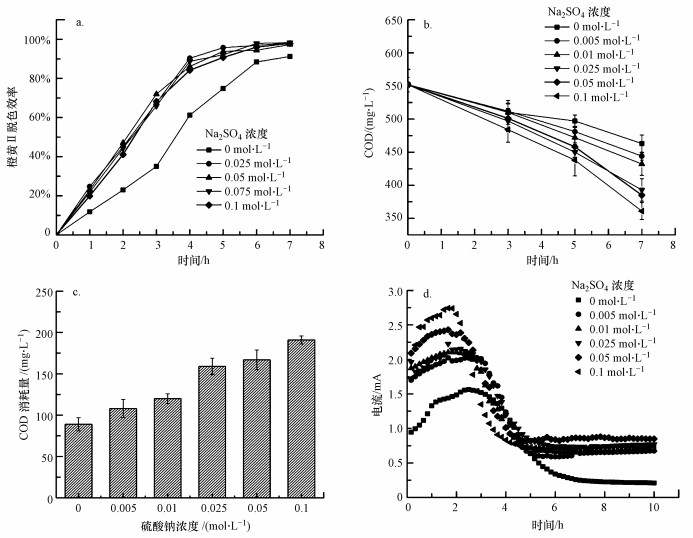 |
| 图 6 不同Na2SO4浓度下的降解结果(a.橙黄Ⅱ脱色率, b.COD变化情况, c.COD消耗量, d.电流变化) Fig. 6The treatment of dye wastewater under different concentration of Na2SO4(a.the decolorization rate of Orange Ⅱ, b.the change of COD, c.the consumption of COD, d.the change of current) |
由图 6b可知, COD值随时间的增加而减小, Na2SO4浓度为0~0.1 mol · L-1、反应7 h时的COD消耗量依次为89、108、120、159、167、191 mg · L-1.与未加入Na2SO4的实验组相比, 高浓度的Na2SO4加快了COD的消耗, 说明Na2SO4可以提高系统降解染料的效能.系统内Na2SO4的浓度会影响污水的电导率, 进而影响电流峰值变化, 电流变化趋势为先增大到峰值, 然后逐渐减小, 6 h左右逐渐平稳.随着Na2SO4浓度的逐渐升高, 电流逐渐提高, 但降解效果并不是一直在提升:当Na2SO4浓度从0.025 mol · L-1提高到0.1 mol · L-1时, 电流的峰值提高了0.31 mA, 但系统对橙黄Ⅱ的去除率却下降了0.2%.这可能是由于微生物的数量一定, 氧化有机物基质和还原橙黄Ⅱ的速率存在阈值, 单位时间内传递的电子有限, 同时过高浓度的硫酸盐会对微生物起到一定的抑制作用.未加入Na2SO4的反应系统的电流峰值仅为1.56 mA(图 6d), 远远低于添加Na2SO4的反应系统, 这也在一定程度上解释了加入电解质Na2SO4可以提高该系统对橙黄Ⅱ的降解效能.
不同Na2SO4浓度下的生物电化学贡献率和能耗如表 2所示, 系统内生物电化学贡献率均高于50%, 生物电化学作用占主导作用, Na2SO4浓度为0.05 mol · L-1时生物电化学贡献率达到了94.52%, 远远高于未加入Na2SO4时的64.31%, Na2SO4的加入在很大程度上提升了该系统的电化学作用.
表 2(Table 2)
| 表 2 不同Na2SO4浓度下的生物电化学贡献率及能耗情况 Table 2 The bioelectrochemical contribution rate and energy consumption of different concentration of sodium sulfate | |||||||||||||||||||||
表 2 不同Na2SO4浓度下的生物电化学贡献率及能耗情况 Table 2 The bioelectrochemical contribution rate and energy consumption of different concentration of sodium sulfate
| |||||||||||||||||||||
3.5 电极生物膜SEM分析通过SEM扫描可以较为直观地看到碳纤维表面的生物生长情况(图 7), 通过对比在5000倍和9000倍条件下AD内碳纤维上的微生物情况可以看出, AD-BES系统阳极碳纤维上附着生长了数量众多的杆菌, 阴极次之, 而AD的碳纤维上附着的菌却很少.由于橙黄Ⅱ具有一定的生物毒性, 这也可以从一定程度上说明在低电压刺激的条件下, AD-BES系统对橙黄Ⅱ具有较强的耐受性, 微生物更易附着在碳纤维上生长, 而AD的微生物生长较慢, 受到了橙黄Ⅱ毒性的抑制, 这也解释了AD-BES系统的降解效果明显优于AD反应器的原因.
图 7(Fig. 7)
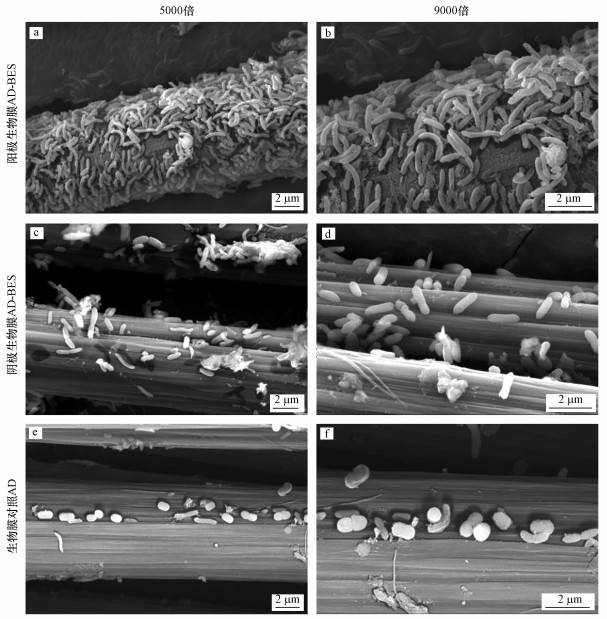 |
| 图 7 AD-BES阳极(a. 5000×, b. 9000×)、阴极(c. 5000×, d. 9000×)生物膜和AD对照生物膜(e. 5000×, f. 9000×)SEM电镜图 Fig. 7The SEM of biofilm on the anode(a, b) and cathode(c, d) in AD-BES and AD(e, f) at 5000 and 9000 times of magnification |
3.6 微生物群落分析从AD反应器和AD-BES反应器的碳刷上采集4种生物膜样品, 各个样品均获得了30000多条高通量序列(序列范围为32567~35589), 说明可从Illumina 16S rDNA Miseq PE 250平台获得大量的微生物信息用于表征微生物群落结构特征.从表征微生物群落的Alpha多样性的指数(表 3)可以看出, AD和AD-BES系统的生物多样性均较大, 这是因为使用生活污水为基质, 而生活污水是较为复杂的电子供体, 主要成分是挥发酸、糖类和蛋白, 此外还有少量的脂类和淀粉, 废水中挥发酸等简单的有机物含量越丰富, 越利于微生物利用.二者相比, AD样品中Chao指数、Shannon指数和Ace指数较大, Simpson指数较小, 结果表明, AD反应器碳刷上的生物膜微生物群落的多样性较高, 而AD-BES反应器碳刷上的生物膜微生物的群落多样性较低, 引入生物电化学系统会引起碳刷微生物群落多样性减少, 诱导电子传递微生物等功能微生物的富集(Liu et al., 2010).
表 3(Table 3)
| 表 3 测序样品的Alpha多样性统计 Table 3 Alpha diversity of the microbial communities | ||||||||||||||||||||||||||||||||||||||||
表 3 测序样品的Alpha多样性统计 Table 3 Alpha diversity of the microbial communities
| ||||||||||||||||||||||||||||||||||||||||
Beta多样性用于微生物群落构成的比较, 评估微生物群落间的差异.比较的基本输出是一个距离矩阵, 表示群落中每两个样本间的差异.从图 8a中4个生物膜样品的PCoA分析结果可以看出, 样品A1和A2的距离较近, B1和B2间的距离较近, 而A1、A2与B1、B2相隔的距离较远, 说明AD与AD-BES的微生物群落之间差异较大, 表明外加电压对微生物群落产生了巨大影响.
图 8(Fig. 8)
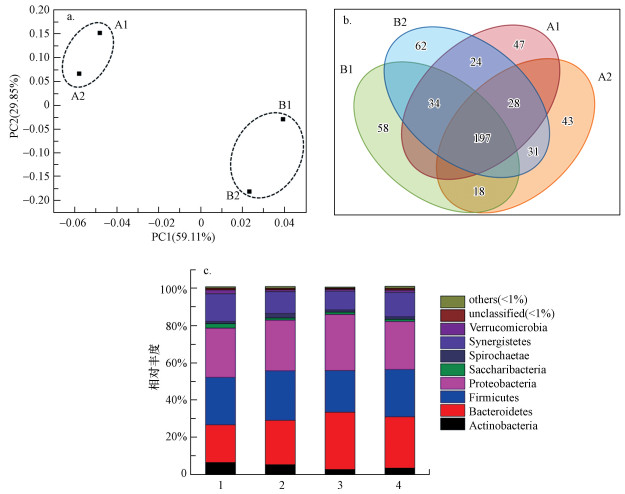 |
| 图 8 AD和AD-BES主成分分析及微生物群落结构分析(a.主成分分析, b. Venn图分析, c.微生物群落结构分析) Fig. 8Principal component analysis and the microbial community structure in each sample of AD and AD-BES(a.principal component analysis, b.Venn analysis, c. the microbial community structure) |
韦恩分析是通过比较不同生物样品中独有的和共享的OTU, 来反映生物群落结构的特征.由图 8b可以看出, 4个生物样品的共享的OTU数量达到了197, 说明4个生物样品微生物群落多样性较为相似, 除了共享的OTU外, 各自的样品均有一定数量独有的OTU, 说明同时存在一定的差异性.
AD-BES与AD微生物群落结构在不同分类水平下的比较如图 8c所示, 可以看出, 两种不同反应器的微生物群落结构具有较大差异.在门的分类水平上, 共鉴定出8个相对丰度较高的门类(相对丰度>1%), 占主导优势的微生物类别主要是Bacteroidetes(拟杆菌门)、Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)及Verrucomicrobia(疣微菌门), 但它们的相对丰度具有明显差异.丰度最高的微生物门类是具有胞外电子传递能力的Bacteroidetes和降解复杂碳源能力的Proteobacteria, Bacteroidetes在BES系统中较为常见(Quan et al., 2012).Bacteroidetes在AD和AD-BES反应器中的丰度平均值分别是22.0%和29.2%;Proteobacteria是细菌中最大的一门, 且多为专性和兼性厌氧, 广泛存在于厌氧反应器中(Franciscon et al., 2009), Proteobacteria在AD和AD-BES反应器中的丰度平均值分别是26.9%和28.0%.
4个微生物样品中一共测出25个菌属, 其中至少一个样品相对丰度>1%, 具体如表 5所示.典型Proteobacteria门的电子传递菌包括Geobacter和Shewanella, 在本实验中有明显富集.研究表明, 多种偶氮染料可以被Geobacter降解(Liu et al., 2013);Shewanella同时兼具偶氮染料还原的功能((Liu et al., 2016;Chen et al., 2015;Li et al., 2010).此外, Desulfovibrio菌属在A1、A2、B1和B2中的相对丰度分别为2.99%、3.60%、6.73%和7.60%.研究表明, Desulfovibrio在阳极具有胞外电子传递的能力(Kang et al., 2014), 也有文献指出其在阴极能够利用产生的氢气作为单一的能源, 并在乙酸、二氧化碳和广谱有机物作为电子供体和碳源的条件下进行生长(Pankhania et al., 1986), 这说明该菌属具有双向的电子传递能力.更重要的是,Desulfovibrio 被报道在实现或强化偶氮染料去除方面发挥着重要作用(Kim et al., 2007).Acinetobacter菌属亦具有偶氮染料的脱色能力(Cai et al., 2015;孔春雷等, 2013), 4个样品的相对丰度分别为2.30%、1.96%、3.08%和4.81%.
表 5(Table 5)
| 表 5 微生物群落在菌属水平的比较 Table 5 Microbial community comparison at genus level | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 5 微生物群落在菌属水平的比较 Table 5 Microbial community comparison at genus level
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 结论(Conclusions)本研究选择生活污水作为廉价碳源, 用于厌氧-生物电化学耦合反应器降解偶氮染料橙黄Ⅱ, 对橙黄Ⅱ进行脱色的同时, COD也有所下降.与AD反应器相比, AD-BES反应器对橙黄Ⅱ染料具有较强的耐受性, 启动时间短, 100 h即可启动完成.本研究证明了生活污水作为电子供体可以高效驱动偶氮类染料还原脱色效率, 当生活污水所占比例为1/1时, 反应7 h的脱色率可以达到91.2%;与此同时, 生活污水中的COD也得到有效去除.电解质Na2SO4的添加对AD-BES反应器具有较强的促进作用, Na2SO4浓度为0.025 mol · L-1时, AD-BES反应器4 h时的脱色率达到90.1%, 7 h时达到98%.与AD反应器相比, AD-BES反应器碳纤维电极表面生长着大量微生物, 其中,Bacteroidetes(拟杆菌门)、Proteobacteria(变形菌门)丰度最高, 其中包括富集到的Desulfovibrio、Acinetobacter、Geobacter、Shewanella等具有电子传递、降解去除偶氮染料等特定功能的菌属.
参考文献
| Ayed L, Mahdhi A, Cheref A, et al. 2011. Decolorization and degradation of azo dye Methyl Red by an isolated Sphingomonas paucimobilis:Biotoxicity and metabolites characterization[J]. Desalination, 274(1): 272–277. |
| Cardenas-Robles A, Martinez E, Rendon-Alcantar I, et al. 2013. Development of an activated carbon-packed microbial bioelectrochemical system for azo dye degradation[J]. Bioresource Technology, 127: 37–43.DOI:10.1016/j.biortech.2012.09.066 |
| Cai Z, Zhang W, Ma J, et al. 2015. Biodegradation of azo dye disperse Orange S-RL by a newly isolated strain Acinetobacter sp.SRL8[J]. Water Environment Research, 87(6): 516–523.DOI:10.2175/106143014X13975035526068 |
| Chen J, Deng F, Hu Y, et al. 2015. Antibacterial activity of graphene-modified anode on Shewanella oneidensis MR-1 biofilm in microbial fuel cell[J]. Journal of Power Sources, 290: 80–86.DOI:10.1016/j.jpowsour.2015.03.033 |
| Cheng S, Liu H, Logan B E. 2006. Increased power generation in a continuous fow MFC with advective flow through the porous anode and reduced electrode spacing[J]. Environmental Science Technology, 40(7): 2426–2432.DOI:10.1021/es051652w |
| Coma M, Puig S, Pous N, et al. 2013. Biocatalysed sulphate removal in a BES cathode[J]. Bioresource Technology, 130: 218–223.DOI:10.1016/j.biortech.2012.12.050 |
| Cui M H, Cui D, Gao L, et al. 2016. Efficient azo dye decolorization in a continuous stirred tank reactor(CSTR) with built-in bioelectrochemical system[J]. Bioresource Technology, 218: 1307–1311.DOI:10.1016/j.biortech.2016.07.135 |
| Franciscon E, Zille A, Fantinatti-Garboggini F, et al. 2009. Microaerophilic-aerobic sequential decolourization/biodegradation of textile azo dyes by a facultative Klebsiella sp.strain VN-31[J]. Process Biochemistry, 44(4): 446–452.DOI:10.1016/j.procbio.2008.12.009 |
| 冯玉杰, 李晓岩. 2002. 电化学技术在环境工程中的应用[M]. 北京: 化学工业出版社. |
| 高立新, 王燕, 张大全. 2010. 电化学法处理印染废水[J]. 印染, 2010(10): 12–15. |
| Hildenbrand S, Schmahl F W, Wodarz R, et al. 1999. Azo dyes and carcinogenic aromatic amines in cell culture[J]. International Archives of Occupational and Environmental Health, 72(3): 52–56. |
| 贾雪雪.2017.含硫酸盐有机废水厌氧消化研究[D].杨凌: 西北农林科技大学 |
| Kang C S, Eaktasang N, Kwon D Y, et al. 2014. Enhanced current production by Desulfovibrio desulfuricans biofilm in a mediator-less microbial fuel cell[J]. Bioresource Technology, 165: 27–30.DOI:10.1016/j.biortech.2014.03.148 |
| Kim K Y, Yang W, Logan B E. 2015. Impact of electrode configurations on retention time and domestic wastewater treatment efficiency using microbial fuel cells[J]. Water Research, 80: 41–46.DOI:10.1016/j.watres.2015.05.021 |
| Kim S Y, An J Y, Kim B W. 2007. Improvement of the decolorization of azo dye by anaerobic sludge bioaugmented with Desulfovibrio desulfuricans[J]. Biotechnology & Bioprocess Engineering, 12(3): 222–227. |
| Kong D Y, Liang B, Yun H, et al. 2015. Cathodic degradation of antibiotics:characterization and pathway analysis[J]. Water Research, 72: 281–292.DOI:10.1016/j.watres.2015.01.025 |
| Kong F Y, Wang A J, Liang B, et al. 2013. Improved azo dye decolorization in a modified sleeve-type bioelectrochemical system[J]. Bioresource Technology, 143: 669–673.DOI:10.1016/j.biortech.2013.06.050 |
| 孔春雷, 孙晓蕾, 周豪, 等. 2013. 菌株Acinetobacter sp.C-2对酸性红GR的脱色研究[J]. 环境科学与技术, 2013, 36(3): 83–88. |
| 李军, 杨秀山, 彭永臻. 2002. 微生物与水处理工程[M]. 北京: 化学工业出版社. |
| Li T, Guthrie J T. 2010. Colour removal from aqueous solutions of metal-complex azo dyes using bacterial cells of Shewanella strain J18 143[J]. Bioresource Technology, 101(12): 4291–4295.DOI:10.1016/j.biortech.2010.01.024 |
| Liu G, Zhou J, Chen C, et al. 2013. Decolorization of azo dyes by Geobacter metallireducens[J]. Applied Microbiology and Biotechnology, 97(17): 7935–7942.DOI:10.1007/s00253-012-4545-7 |
| Liu T, Yu Y Y, Li D, et al. 2016. The effect of external resistance on biofilm formation and internal resistance in Shewanella inoculated microbial fuel cells[J]. RSC Advances, 6(24): 20317–20323.DOI:10.1039/C5RA26125B |
| Liu W Z, Wang A J, Cheng S A, et al. 2010. Geochip-based functional gene analysis of anodophilic communities in microbial electrolysis cells under different operational modes[J]. Environmental Science & Technology, 44: 7729–7735. |
| Mu Y, Rabaey K, Rozendal R A, et al. 2009. Decolorization of azo dyes in bioelectrochemical systems[J]. Environmental Science & Technology, 43(13): 5137–5143. |
| Pankhania I P, Moosavi A N, Hamilton W A, et al. 1986. Utilization of cathodic hydrogen by Desulfovibrio vulgaris(Hildenborough)[J]. Microbiology, 132(12): 3357–3365.DOI:10.1099/00221287-132-12-3357 |
| Quan X C, Quan Y P, Tao K. 2012. Effect of anode aeration on the performance and microbial community of an air-cathode microbial fuel cell[J]. Chemical Engineering Journal, 210: 150–156.DOI:10.1016/j.cej.2012.09.009 |
| Rasool K, Mahmoud, K A, Lee D S. 2015. Influence of co-substrate on textile wastewater treatment and microbial community changes in the anaerobic biological sulfate reduction process[J]. Journal of Hazardous Materials, 299: 453–461.DOI:10.1016/j.jhazmat.2015.07.044 |
| Shen J, Xu X, Jiang X, et al. 2014. Coupling of a bioelectrochemical system for p-nitrophenol removal in an upflow anaerobic sludge blanket reactor[J]. Water Research, 67: 11–18.DOI:10.1016/j.watres.2014.09.003 |
| 王爱杰, 王丽燕, 任南琪, 等. 2004. 硫酸盐废水生物处理工艺研究进展[J]. 哈尔滨工业大学学报, 2004, 36(11): 1446–1449.DOI:10.3321/j.issn:0367-6234.2004.11.005 |
| Wang Y Z, Wang A J, Liu W Z, et al. 2013. Accelerated azo dye removal by biocathode formation in single-chamber biocatalyzed electrolysis systems[J]. Bioresource Technology, 146: 740–743.DOI:10.1016/j.biortech.2013.07.082 |
| 杨少斌, 费学宁, 张建博. 2008. 工业废水处理技术的进展及其发展方向[J]. 广东化工, 2008, 35(2): 66–69.DOI:10.3969/j.issn.1007-1865.2008.02.023 |
| 钟琼. 2008. 废水处理技术及设施运行[M]. 北京: 中国环境科学出版社. |
