
 , 牛漾聃1, 王鹏2, 王仕琴3
, 牛漾聃1, 王鹏2, 王仕琴31. 山西大学环境与资源学院, 太原 030006;
2. 江西师范大学鄱阳湖湿地与流域研究教育部重点实验室, 南昌 330022;
3. 中国科学院遗传所农业资源研究中心, 石家庄 050021
收稿日期: 2018-06-01; 修回日期: 2018-09-20; 录用日期: 2018-09-20
基金项目: 国家自然科学基金(No.41301033)
作者简介: 袁瑞强(1980-), 男, 副教授, E-mail:rqyuan@sxu.edu.cn
通讯作者(责任作者): 袁瑞强
摘要: 人类活动可明显降低地表水体水环境质量,同时对水生态系统产生深刻的影响.本文基于16S rRNA高通量测序技术,研究了引黄调水对汾河受水河段沉积物微生物群落组成、结构和多样性的影响,探讨了引水对沉积物中微生物群落的影响机制.结果表明,黄河水的引入使汇入口处沉积物中微生物群落多样性水平升高,并带来新微生物物种硫杆菌属、厌氧绳菌属和亚硝化单胞菌属,新增菌种不仅在下游逐渐适应环境,而且通过上溯扩张使汇入口上游河段沉积物微生物群落发生改变.引黄间歇期受水河段沉积物微生物群落逐渐恢复,优势菌转化为芽孢杆菌,乳球菌的丰度相应增加,硫杆菌属消失.丛毛单胞菌在汾河受水河段沉积物环境中较为稳定,而硫杆菌、芽孢杆菌和乳球菌容易受到引黄的影响,其主要环境影响因素为水体矿物质含量及沉积物有机质、全氮、碱解氮和全钾.间歇期支流汇入使芽孢杆菌退化,丧失绝对优势地位,而蓝藻大量繁殖成为优势种.引黄期支流汇入后,硫杆菌属和厌氧绳菌属分别成为汇入点下游的优势菌和亚优势菌.
关键词:16S rRNA高通量测序汾河引黄入晋跨流域调水河流沉积物
Effects of the Yellow River diversion on microbial communities in sediments of the receiving reach
YUAN Ruiqiang1

 , NIU Yangdan1, WANG Peng2, WANG Shiqin3
, NIU Yangdan1, WANG Peng2, WANG Shiqin3 1. School of Environment and Resource, Shanxi University, Taiyuan 030006;
2. Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, Jiangxi Normal University, Nanchang 330022;
3. Center for Agricultural Resources Research, Institute of Genetics and Developmental Biology, CAS, Shijiazhuang 050021
Received 1 June 2018; received in revised from 20 September 2018; accepted 20 September 2018
Abstract: Human activities can significantly reduce the quality of surface water environment and have profound impacts on water ecosystems. In this paper, the effects of water diverting from the Yellow River on the composition, structure and diversity of microbial communities in sediments of the Fen River are studied based on the 16S rRNA high-throughput sequencing technology. The influence mechanism and the effects of tributaries confluence are discussed. Results show that the injection of the Yellow River water brings new microbial species including Thiobacillus, Nitrosomonadaceae and Anaerolineaceae into sediments of the Fen River elevating the level of microbial community diversity. These new strains gradually adapt to the environment in the downstream, and change microbial communities in sediments of the nearby upstream through the backward expansion. The microbial communities in sediments of the receiving river gradually recover during the intermittent stage, and the dominant bacteria group is transformed into Bacillus. The abundance of Lactococcus increases correspondingly, and Thiobacillus disappears. Comamonadaceae is more stable in sediments of the Fen River, while Thiobacillus, Bacillus and Lactococcus are easily disturbed by the Yellow River water. The major environmental factors are recognized as mineral content of water, soil organic matter (SOM), total nitrogen (TN), alkali-nitrogen (AN) and total kalium (TK). The confluence of tributaries makes Bacillus degradation with the loss of absolute dominance during the injection suspension, while Cyanobacter blooms and becomes one of dominant species. After the injection, Thiobacillus becomes the dominant species in the downstream of the confluence point, and Anaerolineaceae becomes the subdominant species due to the confluence of tributaries.
Keywords: 16S rRNAhigh-throughput sequencingFen Riverthe Yellow River water transform into Shanxiinterbasinwater diversionriver sediments
1 引言(Introduction)河流沉积物微生物群落是流域生态系统的重要组成部分(Cébron et al., 2005), 分布广泛, 且具有高效的酶促活性及多样的代谢能力, 在生物地球化学循环中具有极其重要的意义.河流沉积物是微生物的天然载体, 是物质发生迁移和转化的重要场所, 在水生态系统中充当着“源”或“汇”的角色.细菌作为微生物的重要组成部分, 能参与到碳、氮、硫等元素的循环过程中(Francis et al., 2007; Oelgeschlager et al., 2008), 对促进河流沉积物中污染物的分解、减少污染积累、维持良好水质具有重要的作用.微生物群落在不同的生态环境下呈一定规律的分布, 当环境改变时会表现出几乎同步的变化(王鹏, 2005; Baniulyte et al., 2009; 刘睿等, 2017).引水、筑坝、排污及土地利用方式变化等人类活动改变了自然的水文过程和水环境演化, 对河流生态系统产生了深刻影响.
近年来, 人类活动对河流中水和沉积物微生物群落的影响受到广泛关注.研究发现,三峡大坝对香溪河流域回水区和河流区的底栖微生物群落结构和多样性产生了显著影响, 芽孢杆菌属所占的比例从回水区的河口处至中游处逐渐减少至河流区消失;回水区的微生物多样性指数均高于河流区(赵媛莉等, 2017).人类活动造成的营养物浓度上升、动物粪便污染等导致九龙江河口区变形菌门、放线菌门的比例及变形菌在纲水平的细菌呈现出极大的空间变化(洪璇等, 2017).再生水补水对永定河麻峪湿地河道沉积物细菌群落组成和功能产生了明显的影响, 造成优势菌群和碳、氮、磷循环方式的改变(邸琰茗等, 2017).河流沉积物微生物群落结构和多样性对沉积物重金属污染也会产生明显的响应(江玉梅等, 2016).农业区水质退化引起水样中的基因官能团丰度变化, 具有较高营养代谢的菌类和噬菌体群增加, 反映了农业面源污染(Van Rossum et al., 2015).城镇附近河流沉积物中致病性菌和抗生素代谢标志物明显增加, 表明人类驱动因素显著改变了微生物群落结构和功能潜力(Gibbons et al., 2014).
跨流域调水是解决我国水资源空间分布不均匀问题的重要工程手段.跨流域调水对受水区水环境产生了明显的影响(路娜等, 2010; 周潮晖等, 2016; 罗昊等, 2017; 袁瑞强等, 2018), 然而尚缺乏人类调水活动对河流沉积物微生物群落影响的认识.引黄入晋工程实施后, 受水区汾河水库的高锰酸盐指数、五日生化需氧量等水质理化指标发生了明显改变(姚清晨等, 2008), 汾河出现水质退化(盛夏等, 2013).河流沉积物中的微生物对环境变化非常敏感, 因此, 亟需研究跨流域调入的黄河水对汾河受水河段沉积物微生物群落结构的影响.
微生物鉴别的常规方法和16S rDNA-DGGE指纹图谱分析等新方法存在明显的不足(邢德峰等, 2006; Rinke et al., 2013).基于16S rRNA的分类结果与基于全基因组的结果相似(刘驰等, 2015), 且高通量测序技术可便捷地获得环境样品的16S rRNA基因序列(Sun et al., 2015).因此, 本文采用16S rRNA高通量测序技术分析汾河引黄河段沉积物微生物的物种组成、群落结构和多样性, 识别沉积物中哪些微生物容易受到影响, 探讨引水影响受水河段沉积物中微生物群落的机制, 以揭示河流沉积物中微生物对引黄调水引起的环境变化的响应情况, 加深跨流域调水对受水区河流环境、生态影响的认识, 为可持续发展和管理提供科学依据.
2 材料与方法(Materials and methods)2.1 样品采集和测定引黄入晋工程汾河受水河段位于山西省宁武县和静乐县, 属于水源补给区和保护区.从2003年11月开始, 该工程向汾河输水3.2×108m3 · a-1.每年汛期(7月中旬—9月中旬)及冬季2—3月(间歇期), 暂停引黄.2016年9月(间歇期)和2017年6月(引黄期)对该受水河段进行实地调查采样, 沿汾河干流设置4个采样断面(FR01~FR04)采集河水和河流沉积物样品.FR01位于受水河段上游, 距汾河源头1 km左右, 距引黄入口约10 km, FR02位于引黄入口上游100 m处, FR03位于引黄入口下游约4 km处, FR04位于FR03下游约22 km处.在FR02附近采集黄河来水的水样(YR), 并采集FR03和FR04之间的支流水样(FZ01~FZ07).上述断面可分别代表汾河源头、引黄前、引黄后、黄河来水和接受支流汇入后河流的情况(图 1).
图 1(Fig. 1)
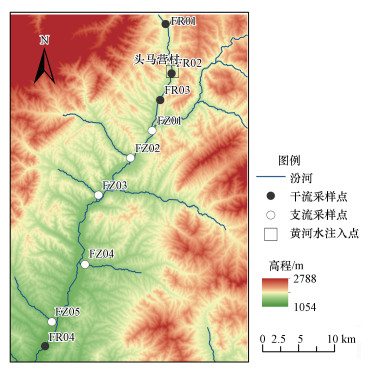 |
| 图 1 采样地点示意图 Fig. 1The distribution of sampling sites |
采集的河水样品装入到60 mL聚乙烯瓶中, 实验室内储存于4 ℃冰箱.分别在FR01~FR04断面的3个不同位置采集沉积物表层下1~3 cm的样品, 分别编号并放置于10 mL离心管中.另取无菌自封袋混合采集沉积物约1 kg.沉积物样品在现场用干冰冷冻, 使用便携式水质测定仪(HORIBA U-51)现场测定水温、pH、氧化还原电位(ORP)及溶解氧(DO).
实验室内使用离子色谱仪(Dionex ICS-900)测定水样中主要离子含量.沉积物样品保持冷冻并由上海美吉生物医药科技有限公司使用Illumina公司的Miseq PE300平台进行16S rRNA高通量测序.原始数据上传至NCBI数据库中, 序列号为SRP158824.
2.2 Alpha多样性分析Alpha多样性指数是对单一样品物种多样性的度量.通过FLASH和Trimmomatic软件去除嵌合体筛选有效序列, 将有效序列相似性≥97%的序列归为同一分类操作单元(OTU)(江玉梅等, 2016).使用Mothur软件, 在OTU水平上计算Coverage、Sobs、Chao、Ace、Simpson、Shannon等多样性指数并绘制微生物的稀释性曲线图.将所得序列与数据库进行比对, 得出在门、纲、属水平的细菌群落物种组成图, 反映相对丰度大于1%的菌种组成, 相对丰度小于1%的菌类归入其它(others).
2.3 统计检验根据群落丰度数据, 在属水平上进行组(样本)间差异显著性检验.检测不同组(样本)微生物群落中表现出丰度差异的物种, 并评估差异的显著性.采用非加权组平均法对样本距离矩阵进行聚类分析, 构建样本属水平的层级聚类树以分析不同时期样本间微生物群落结构的相似与差异状况.
2.4 环境因子对微生物群落结构的影响分析将丰度排名前15的物种按属水平分类与环境变量比较, 评估微生物与环境变量之间的相关性.相关性Heatmap图由R软件(pheatmap package)计算环境因子与所选物种之间的相关性系数(Spearman等级相关系数)获得.
3 结果(Results)3.1 水体与沉积物理化性质6月与9月各采样点水样均呈弱碱性, pH均值在8.6左右, 空间变化不大.干流与支流的DO约为10 mg · L-1.黄河来水的EC值为1320 μS · cm-1, 引黄期(6月)黄河水汇入使汾河受水河段EC增加了近2倍, 达1270 μS · cm-1, 矿物质含量显著增高.除FR01外, 引黄期河流主要离子浓度明显高于间歇期(9月).黄河水汇入引入了大量的SO42-、Cl-和Na+(图 2), 而间歇期这3种离子的浓度在FR01~FR03各处均处于相似水平.引黄间歇期河流流量明显小于引黄时段, 河水EC、ORP及主要离子含量基本恢复至与上游相近的水平.
图 2(Fig. 2)
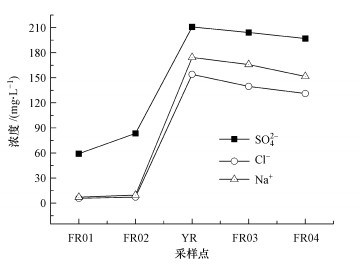 |
| 图 2 6月汾河受水河段河水SO42-、Cl-、Na+浓度 Fig. 2Contents of SO42-, Cl- and Na+ in the Fen River receiving reach on June |
6月与9月各干流采样点沉积物呈碱性, pH均值为8.4.沉积物中全氮和有机质含量从FR01~FR04持续增加, 而全钾含量持续下降, 其中, 有机质含量在FR04处达到中等丰富水平(20~30g · kg-1).9月碱解氮含量自FR01向下游保持增大趋势, 6月黄河水引入后FR01与FR02处碱解氮含量是下游两样点的2倍多, FR03处最低(66 mg · kg-1), 到FR04处均达到中等丰富水平(90 mg · kg-1).两个时期速效钾含量在FR04处显著增高, 9月FR04处速效钾含量达到丰富水平(134 mg · kg-1).沉积物养分含量在整体上表现为引黄时期高于间歇期, 且引黄时期沉积物土壤粒度及平均粒径均明显高于间歇期.
3.2 Alpha多样性评估稀释性曲线主要利用各样本的测序量在不同测序深度时的微生物多样性指数构建, 以说明样本的测序数据量是否合理.样品Shannon指数和Coverage指数稀释性曲线随着测序深度增大趋于平缓.两次采样的样品覆盖度均在97.9%之上, 表明序列信息能充分代表样本总体.
Ace和Chao指数是用来估计群落中OTU数目的常用指数, Sobs指数用于表明样本可观测到的OTU个数.6月非引水河段(FR01和FR02)各样点的Ace指数、Chao指数和Sobs指数整体低于9月(图 3), 显示出季节变化.然而, 6月黄河水引入后引黄河段(FR03和FR04)上述指数与9月接近, 表明引黄使得沉积物微生物种类和数量增加, 季节性变化减弱.
图 3(Fig. 3)
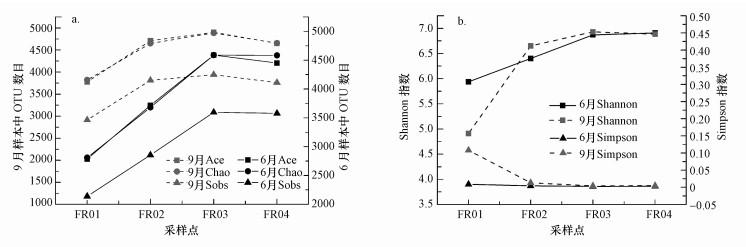 |
| 图 3 不同月份各采样点物种多样性指数(a.Ace、Chao和Sobs指数; b.Shannon和Simpson指数) Fig. 3Species diversity indexes of sampling points in different months (a.Ace index, Chao index and Sobs index; b.Shannon index and Simpson index) |
Simpson和Shannon指数均用于表征群落物种的多样性, 其中, Simpson指数表示随机抽取的两个个体属于不同种的概率, Shannon指数考虑物种数和物种间个体分配的均匀性两个方面.不同月份FR01处的Simpson指数明显低于其他样点, 而Shannon指数明显高于其他样点(图 3), 表明FR01处微生物多样性水平最低, 下游方向沉积物微生物多样性水平升高, 这与Shannon指数的稀释性曲线反映的规律一致.除FR01外, 其余采样点Simpson指数和Shannon指数的季节性变化受引黄影响而明显削弱.
3.3 细菌群落组成引黄河段沉积物微生物物种数目和丰度具有明显的异质性, 且各个样本细菌群落在门和纲(图 4)分类水平上具有较高的多样性.门种类超过15个, 主要包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacter)、疣微菌门(Verrucomicrobia)和蓝细菌门(Cyanobacteria), 其中,前4种门类占测序总量的70.6%~83.1%.除9月的FR01样品外, 变形菌门种类最多, 占总量的38.9%~50.2%.
图 4(Fig. 4)
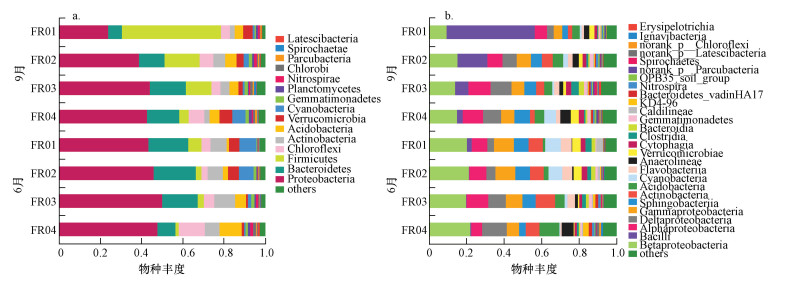 |
| 图 4 基于门(a)和纲(b)水平的样本物种组成 Fig. 4Composition of species at level of phylum(a) andclass(b) |
纲种类超过27个, 主要包括β-变形菌纲(Betaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、芽孢杆菌纲(Bacillus)、δ-变形菌纲(Deltaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、鞘脂杆菌纲(Sphingobacteria)、放线菌纲(Actinobacteria)、蓝细菌纲(Cyanobacteria)、黄杆菌纲(Flavobacteria)、厌氧绳菌纲(Anaerolineae)、疣微菌纲(Verrucomicrobiae), 其中, β-变形菌纲和α-变形菌纲为普遍的优势类群, 分别占各样本测序总量的9.3%~22.2%和5.7%~12.0%.然而, 9月FR01样品中芽孢杆菌纲(Bacillus)为优势菌, 占总量的47.2%.
淡水水体沉积物中优势菌种主要是变形菌门、酸杆菌门、放线菌门、拟杆菌门、蓝藻菌、厚壁菌门、浮霉菌门等(张旭, 2016).汾河受水河段沉积物中优势菌群主要是变形菌门, 符合河流微生物细菌群落结构的一般特征(Zwart et al., 2002).莱尔马淡水湖泊沉积物中主要为放线菌门、变形菌门(Brito et al., 2015), 受重金属污染的日内瓦湖沉积物中主要为变形菌门、拟杆菌门(Haller et al., 2011).与之相比, 汾河引黄河段沉积物中出现了更多的微生物种类.
3.4 引黄期沉积物微生物群落变化丛毛单胞菌(Comamonadaceae)是引黄期FR01~ FR03样本中的优势菌, 引黄水注入使FR03处该菌的数量稍有下降(p>0.05), 到下游FR04处不再成为优势菌(图 5).FR01、FR02处的亚优势菌分别为蓝细菌门的Tychonema和蓝藻(Cyanobacter), 分别占6.02%和5.67%.黄杆菌(Flavobacterium)的含量从FR01到FR04持续降低(p < 0.05), 但在FR03处成为亚优势菌, 占2.96%.此外, 噬氢菌(Hydrogenophaga)、暖绳菌(Caldilineaceae)、Luteolibacter、假单胞菌属(Pseudomonas)沿河显著减少(p < 0.05), 到FR04处几乎消失.这4种菌类均为革兰氏阴性, 在好氧环境中生存.噬氢菌和暖绳菌参与环境中氮循环, 受水体中氮浓度影响显著, 假单胞菌有极强的有机物分解能力.菌群相对数量的变化可反映出在引黄影响下受水河段水质与沉积物的沿程变化.
图 5(Fig. 5)
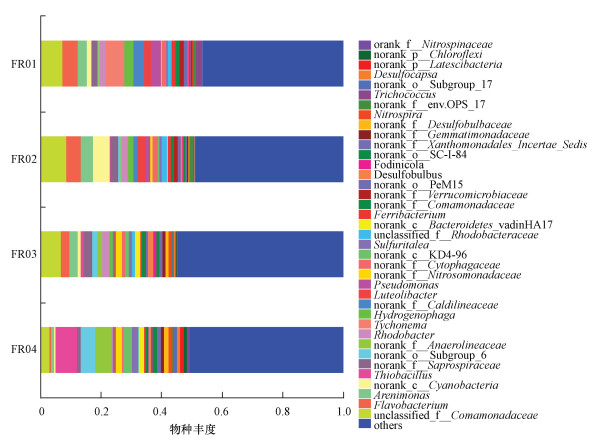 |
| 图 5 基于属水平的6月份样本物种组成 Fig. 5Composition of species at genus level on June |
硫杆菌属(Thiobacillus)、厌氧绳菌属(Anaerolineaceae)和亚硝化单胞菌属(Nitrosomonadaceae)是引黄带来的新菌群, 在FR03处出现, 到FR04处大幅增加.其中,硫杆菌属和厌氧绳菌属分别成为FR04处的优势菌和亚优势菌.在距离引黄汇入口上游约100 m的FR02处也检测到少量的厌氧绳菌属和亚硝化单胞菌属.同时, 韦恩图显示FR02与FR03共有的OTU数量(539)远大于其与FR01共有的OTU数量(191), 表明FR02与FR03的微生物种群更接近(图 6).引黄不仅对下游河段有影响,而且通过微生物上溯扩张对临近的上游河段的沉积物微生物群落产生影响.
图 6(Fig. 6)
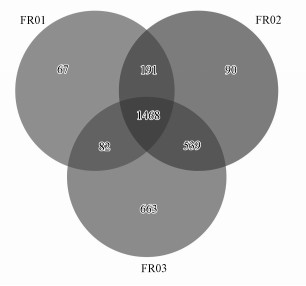 |
| 图 6 FR01~FR03样本中OTU分布韦恩图 Fig. 6Venn diagram of OTU in samples of FR01~FR03 |
3.5 引黄间歇期沉积物微生物群落变化对引黄期与间歇期FR01~FR03样本属水平丰度排名前15的物种进行组间差异显著性检验(图 7).芽孢杆菌属(Bacillus)和乳球菌属(Lactococcus)的丰度差异显著(p <0.05).在间歇期内芽孢杆菌成为FR01~FR03的优势菌, 在FR01处的丰度甚至达到31.23%.同时, 乳球菌在FR01中也占有较大比重(11.46%), 是该处的亚优势菌.但二者的丰度从FR01至下游同比例急剧减少, FR02和FR03样本的亚优势菌为转变丛毛单胞菌属.
图 7(Fig. 7)
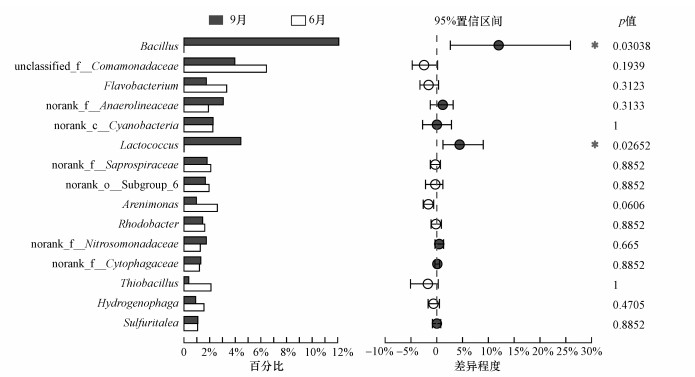 |
| 图 7 6月与9月组间差异显著性检验 Fig. 7Examined significant differences between the sample groups of June and September |
引黄带来的硫杆菌属在间歇期的各样本中均没有被检测到, 而厌氧绳菌属和亚硝化单胞菌属仍存在.FR01~FR03属水平丰度排名前15的物种的样本间差异显著性检验结果表明, 9月各样本中厌氧绳菌属的丰度较6月有所增加, 且在FR04处成为优势菌.亚硝化单胞菌属在FR02处增加, 在FR03处减少.此外, 间歇期从FR01~FR03黄杆菌和黄色单胞菌(Arenimonas)两种条件致病菌的丰度显著减少.噬氢菌属、Lutelibacter和噬胞菌属在FR01、FR02中的丰度较引黄期显著减少.引黄对汇入口附近上游FR02断面造成的影响有所消退.
聚类结果表明, 9月FR01样本单独为一簇(图 8), 芽孢杆菌在其中的丰度达到了近40%, 使其微生物群落结构明显区别于其他样本.温度通过影响微生物的酶活性从而影响其生长发育(房昀昊等, 2018), 温度超过4 ℃人工湿地微生物的种类和数量随温度增加而增加(梁威等, 2002).9月FR01的水温是各样点中最低的(12.7 ℃), 且明显低于6月(19.7 ℃), 明显的温度变化可能引起河流沉积物微生物群落结构的季节性变化.聚类结果中两个采样时段的样品整体上分开, 然而引黄时段6月份的样品没有聚成较近的一簇, 表明引入的黄河水造成受水河段沉积物中微生物群落的空间演替显著.9月其余样本聚为一簇, 说明经过汾河水体一段时间的自我调节与恢复, 汇入口与其上下游的微生物群落结构已恢复至较为相似的水平.总体上, 引黄调水对受水河段河流沉积物微生物群落的影响显著, 同时季节性变化也造成不受引黄影响的河段沉积物微生物群落的差异.6月引黄口上游的两个样点FR02与FR01为一簇, 而在9月间歇期汇入口FR03与上游的FR02为一簇.这种变化表明, 虽然引黄明显改变了沉积物微生物群落组成和结构, 但当引黄停止后微生物群落可以得到较好的恢复, 引黄的影响逐渐被减弱乃至消除.
图 8(Fig. 8)
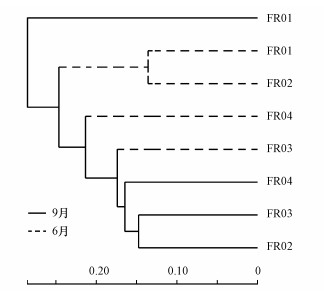 |
| 图 8 6月与9月样本层级聚类树 Fig. 8Hierarchical clustering tree of samples on June and September |
4 讨论(Discussion)4.1 引黄影响沉积物微生物群落的作用因子细菌功能类群的种类和数量与水质特征、营养物质水平及其转化直接相关(Henriques et al., 2006; Laque et al., 2010;张旭, 2016).在被污染的河段可检测出能分解复杂有机物的微生物(Casals, 2016).引黄期受水河段离子含量大幅增加, 水环境剧烈变化.Alpha多样性评估显示, 自引黄口FR03开始, Ace指数、Chao指数和Sobs指数急剧上升, FR03处Shannon指数值最高, Simpson指数值最低, 表明其微生物数量较上游大幅度增加, 多样性水平达到最高.对湖泊细菌的研究也表明, 在极度贫营养条件下, 水体中细菌种类相对较少, 随着营养水平的逐渐升高, 细菌由于营养物质等生存条件的改变, 多样性会增加, 但当营养水平达到超富营养或接近超富营养时, 水体中细菌群落多样性表现为减少的趋势(刘乐冕等, 2012).属水平的物种组成亦表明引黄时FR03处的微生物种类最丰富, 且相对缺乏绝对优势物种(图 5).当外界条件发生较大改变时, 有可能引起部分功能微生物的不适应而衰亡, 而新的绝对优势种群尚未形成(刘君寒等, 2011).这种演替是微生物群落在适应外界环境条件变化过程中的表现.
物种与各环境因子的相关性如图 9所示, 沉积物环境因子包括河流沉积物pH值、土壤有机质(SOM)、全氮(TN)、碱解氮(AN)、全磷(TP)、速效磷(OP)、全钾(TK)、速效钾(AK)、颗粒累积分布为90%的粒径(d(0.9))和体积平均粒径(MVD), 水环境因子包括电导率(EC)、矿化度(TDS)、温度(T)和主要离子(NO3-、SO42-、Cl-、Na+、K+、Mg2+).
图 9(Fig. 9)
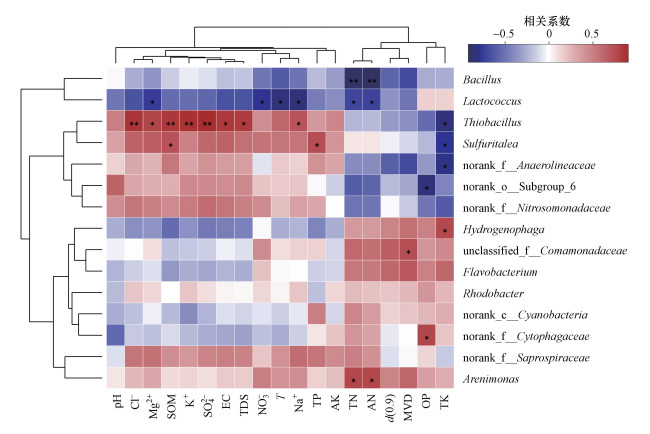 |
| 图 9 物种与环境因子相关性热图(相关系数大小以不同颜色表示, *表示0.01 < p≤0.05, **表示0.001 < p≤0.01) Fig. 9The correlation between species and environmental factors on heatmap (The relative coefficients are expressed in different colors, * represents 0.01 < p≤0.05, ** represents 0.001 < p≤0.01) |
丛毛单胞菌是引黄期FR01~FR03处的优势菌及间歇期FR02和FR03处的亚优势菌, 对多种有机和无机污染物具有较好的降解作用(赵燕等, 2012), 在环境治理中可用于废水处理和污染土壤的修复.丛毛单胞菌隶属于变形菌门, 普遍分布于两个时期的各样本中且均达到一定的丰度, 因而表现出对引黄水注入和季节变化的响应较弱, 不容易受到影响, 在环境中较为稳定.6月FR03处的亚优势菌黄杆菌是有机化能菌, 可降解有机物, 在氧化有机物的同时降低硝酸盐的含量(裘钱玲琳等, 2015).黄河水汇入后, 细菌种类、多样性水平和总体数量增加, 而单个菌种的数量相对下降.黄杆菌与沉积物各环境因子均未达到显著相关(图 9), 反映了其在多变环境下的易生存特性, 故该菌在引黄汇入口下游河段FR03处丰度虽有下降, 却演替为亚优势菌群.
引黄带来的新物种硫杆菌属于专性化能自养菌, 通过氧化各种还原态的含硫化合物来获得能量(布坎南等, 1986), 可为植物提供硫素营养, 但同时增加了水体污染风险(郭丽芸等, 2011).引黄期FR03与FR04处硫杆菌丰度较大, 水体SO42-浓度也大幅上升, 二者呈显著正相关(r=0.905).硫杆菌利用无机硫化合物作为能量来源、无机碳化合物作为碳源进行生长(谭文勃等, 2017), 有研究显示, 在受 到全氟辛酸(PFOA)污染的河流沉积物中可检测到硫杆菌的大幅增加(Sun et al., 2016).硫杆菌属与沉积物中有机质(SOM)、全钾(TK)含量分别达到显著正相关(r=0.838)和显著负相关(r=-0.833), 随着黄河水汇入后沉积物中有机质含量的增加和全钾含量的减少, 硫杆菌数量不断增加, 表现出明显的相互推动作用.除此之外, 该菌受水体和沉积物环境中多种因素的影响且达到显著正相关水平(图 9), 随着黄河水汇入后SO42-、Cl-、Na+等离子浓度的大幅升高和沉积物环境的改变, 硫杆菌出现并大量繁殖, 参与环境中新的硫循环与碳循环, 极易受到引黄的影响.
引黄间歇期黄河水的影响逐渐消退, 河水水质明显好转.各采样点细菌数量变化趋势与6月一致, 表现为FR01汾河源头菌群数较少, 向下游逐渐增多, FR04比FR03略有下降.河流是天然的生态系统, 污染物一旦进入水体就开始了自净过程(江玉梅等, 2016).在引黄间歇期, 沉积物微生物群落与其生境所构成的生态系统的演替不断进行, 表现为9月与6月微生物群落结构发生明显改变.
间歇期FR01~FR03处的优势菌全部转变为芽孢杆菌, 占据绝对优势地位.芽孢杆菌可抑制有害病菌增长, 改善水质环境.乳球菌在环境中与芽孢杆菌有协同效应, 能使芽孢杆菌改善水质的作用更加显著(明晶, 2006), 这表明引黄间歇期水质恢复带来沉积物环境改变.
芽孢杆菌与乳球菌聚为最相近的一簇(图 8), 与沉积物中氮含量呈显著负相关, 其中, 芽孢杆菌与全氮(r=-0.898)、碱解氮(r=-0.922)含量显著相关.9月各样点沉积物中全氮(TN)和碱解氮(AN)含量从FR01至下游持续增加, 因而芽孢杆菌和乳球菌的丰度也保持同比例下降.二者属于汾河原生菌落, 与水体矿物质含量及沉积物中各养分含量大都呈负相关(图 9), 黄河水汇入带来水体和沉积物环境改变, 使得上述两菌种丰度急剧变化.说明间歇期FR03处微生物多样性水平和细菌总数都较上游大幅增加, 表明引黄的影响仍然存在.然而芽孢杆菌和乳球菌在丰度下降的同时在样本中所占比例大幅减小.
4.2 支流汇入对汾河水体和沉积物微生物群落结构的影响支流汇入对河流沉积物微生物群落结构可能产生明显的影响(Cébron et al., 2005), 支流水体和沉积物中均含有比干流更多的微生物种类(Lu et al., 2016).FR03到FR04之间有多条支流汇入引黄河段, 该河段区域分布有多个小型煤矿, 使得支流中SO42-和Fe的含量较高, 最大值分别为240 mg · L-1和227 μg · L-1, 同时溶解氧含量稍有降低.支流汇入后(FR04)相比于引黄入口(FR03)多样性指数值略有下降, 但微生物结构有明显差异.
间歇期支流汇入后使芽孢杆菌退化, 丧失绝对优势地位, 而蓝藻大量繁殖成为优势种.芽孢杆菌具有抑制蓝藻生长、直接或间接地抑制有害病菌生长、改善水质环境的作用(Henriques et al., 2006).蓝藻是光能原核生物, 细胞分解后释放大量细胞内含物于水中, 导致水体EC上升(包先明等, 2015).这可能是FR04处EC值高于上游3个干流采样点的原因.FR04处的亚优势菌为厌氧绳菌, 该菌在产甲烷生物系统中具有降解碳水化合物和其他细胞材料的重要作用, 在少氧或缺氧的环境中能较好的生存(刘君寒等, 2011).
虽然支流流量远小于引黄期干流流量, 但支流对引黄受水河段沉积物微生物群落的影响不仅体现在间歇期.引黄期FR04的优势菌从上游的丛毛单胞菌属变为黄河水带来的新增物种硫杆菌属, 其比例由FR03处的不到2%上升至FR04处的7%.来自矿区的支流水体有较多含硫物质, 汇入干流后为硫杆菌提供了能量来源, 导致硫杆菌在FR04处的大量繁殖而占据优势.硫杆菌数量的大幅增加也导致了其他菌类的减少(Sun et al., 2016).黄河水引入带来的厌氧绳菌属在支流汇入后大量繁殖成为FR04的亚优势菌, 相关性Heatmap图显示, 硫杆菌属与厌氧绳菌属聚为一簇, 二者与沉积物中各环境因子的关系十分相似(图 9).此外, 亚硝化单胞菌属保持了相当的丰度.
引黄期和间歇期FR04样本的微生物多样性水平相当, 但微生物物种组成有明显变化.其中, 引黄期FR04样本的微生物群落结构更加复杂, 这可能是同时受到引黄和支流汇入等因素影响下微生物群落对外界环境改变作出响应的结果.
5 结论(Conclusions)1) 引黄调水导致汇入口下游亚优势菌发生演替, 亚优势菌逐渐从蓝细菌门的Tychonema和蓝藻转变为黄杆菌, 噬氢菌、暖绳菌、Luteolibacter、假单胞菌属逐渐消失.引黄带来的新菌群硫杆菌属、厌氧绳菌属和亚硝化单胞菌属逐渐适应环境, 并通过微生物上溯扩张使临近的上游河段沉积物微生物群落改变.
2) 引黄间歇期受水河段沉积物微生物群落逐渐恢复, 沉积物中的优势菌群转化为芽孢杆菌, 乳球菌的丰度相应增加, 硫杆菌属消失, 黄杆菌、黄色单胞菌等有害菌属丰度下降.
3) 跨流域引黄调水使汾河受水河段沉积物微生物群落多样性大幅增加, 但相对缺乏绝对优势物种, 微生物群落处于对外界环境变化的适应过程中.丛毛单胞菌在汾河受水河段沉积物环境中较为稳定, 而硫杆菌、芽孢杆菌和乳球菌容易受到引黄的影响.其主要环境推动因素为水体矿物质含量及沉积物有机质、全氮、碱解氮和全钾含量.
4) 间歇期多条支流汇入可能使芽孢杆菌丧失绝对优势地位, 而蓝藻大量繁殖成为优势种.引黄期支流汇入点下游的硫杆菌属和厌氧绳菌属分别成为优势菌和亚优势菌.
参考文献
| Baniulyte D, Favila E, Kelly J J. 2009. Shifts in microbial community composition following surface application of Dredged River sediments[J]. Microbial Ecology, 57(1): 160–169.DOI:10.1007/s00248-008-9410-y |
| 包先明, 顾东祥, 吴婷婷, 等. 2015. 藻华聚集的环境效应:对漂浮植物水葫芦光合作用的影响[J]. 环境科学, 2015, 36(6): 2070–2076. |
| Brito E M S, De la Cruz Barrón M, Caretta C A, et al. 2015. Impact of hydrocarbons, PCBs and heavy metals on bacterial communities in Lerma River, Salamanca, Mexico:Investigation of hydrocarbon degradation potential[J]. Science of The Total Environment, 521-522: 1–10.DOI:10.1016/j.scitotenv.2015.02.098 |
| 布坎南R E, 吉本斯N E. 1986. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社. |
| Casals A F.2016.Function and structure of river sediment biofilms and their role in dissolved organic matter utilization[D].Girona: Universitat de Girona |
| Cébron A, Garnier J. 2005. Nitrobacter and Nitrospira genera as representatives of nitrite-oxidizing bacteria:Detection, quantification and growth along the lower Seine River (France)[J]. Water Research, 39(20): 4979–4992.DOI:10.1016/j.watres.2005.10.006 |
| 邸琰茗, 王广煊, 黄兴如, 等. 2017. 再生水补水对河道底泥细菌群落组成与功能的影响[J]. 环境科学, 2017, 38(2): 743–751. |
| 房昀昊, 彭剑峰, 宋永会, 等. 2018. 高通量测序法表征潜流人工湿地中不同植物根际细菌群落特征[J]. 环境科学学报, 2018, 38(3): 911–918. |
| Francis C A, Beman J M, Kuypers M M. 2007. New processes and players in the nitrogen cycle:the microbial ecology of anaerobic and archaeal ammonia oxidation[J]. The ISME Journal, 1(1): 19–27.DOI:10.1038/ismej.2007.8 |
| Gibbons S M, Jones E, Bearquiver A, et al. 2014. Human and environmental impacts on river sediment microbial communities[J]. PLoS ONE, 9(5): e97435.DOI:10.1371/journal.pone.0097435 |
| 郭丽芸, 时飞, 杨柳燕. 2011. 反硝化菌功能基因及其分子生态学研究进展[J]. 微生物学通报, 2011, 38(4): 583–590. |
| Haller L, Tonolla M, Zopfi J, et al. 2011. Composition of bacterial and archaeal communities in freshwater sediments with different contamination levels (Lake Geneva, Switzerland)[J]. Water Research, 45(3): 1213–1228.DOI:10.1016/j.watres.2010.11.018 |
| Henriques I S, Alves A, Tac?o M, et al. 2006. Seasonal and spatial variability of free-living bacterial community composition along an estuarine gradient (Ria de Aveiro, Portugal)[J]. Estuarine, Coastal and Shelf Science, 68(1-2): 139–148.DOI:10.1016/j.ecss.2006.01.015 |
| 洪璇, 张永雨, 陈仲巍, 等. 2017. 九龙江河口区微生物多样性及群落结构的时空分布[J]. 应用海洋学学报, 2017, 36(2): 167–176.DOI:10.3969/J.ISSN.2095-4972.2017.02.003 |
| 江玉梅, 张晨, 黄小兰, 等. 2016. 重金属污染对鄱阳湖底泥微生物群落结构的影响[J]. 中国环境科学, 2016, 36(11): 3475–3486.DOI:10.3969/j.issn.1000-6923.2016.11.034 |
| Laque T, Farjalla V F, Rosado A S, et al. 2010. Spatiotemporal variation of bacterial community composition and possible controlling factors in tropical shallow lagoons[J]. Microbial Ecology, 59(4): 819–829. |
| 梁威, 吴振斌, 周巧红, 等. 2002. 构建湿地基质微生物与净化效果及相关分析[J]. 中国环境科学, 2002, 22(3): 282–285.DOI:10.3321/j.issn:1000-6923.2002.03.021 |
| 刘驰, 李家宝, 芮俊鹏, 等. 2015. 16S rRNA基因在微生物生态学中的应用[J]. 生态学报, 2015, 35(9): 2769–2788. |
| 刘君寒, 胡光荣, 李福利, 等. 2011. 厌氧消化系统微生物菌群的研究进展[J]. 工业水处理, 2011, 31(10): 10–14. |
| 刘乐冕, 杨军, 余小青, 等. 2012. 厦门后溪流域沿城乡梯度浮游细菌多样性及其与环境因子的关系[J]. 应用与环境生物学报, 2012(4): 591–598. |
| 刘睿, 吴巍, 周孝德, 等. 2017. 渭河浮游细菌群落结构特征及其关键驱动因子[J]. 环境科学学报, 2017, 37(3): 934–944. |
| 路娜, 胡维平, 邓建才, 等. 2010. 引江济太对太湖水体碱性磷酸酶动力学参数的影响[J]. 水科学进展, 2010(3): 413–420. |
| 罗昊, 周雪欣. 2017. 跨流域调水工程的生态影响识别及评价指标体系研究[J]. 环境科学与管理, 2017(6): 190–194.DOI:10.3969/j.issn.1673-1212.2017.06.042 |
| Lu S, Sun Y, Zhao X, et al. 2016. Sequencing insights into microbial communities in the water and sediments of Fenghe River, China[J]. Archives of Environmental Contamination and Toxicology, 71(1): 122–132. |
| 明晶. 2006. 芽孢杆菌在改良水体环境中的作用[J]. 科学养鱼, 2006(4): 76. |
| Oelgeschlager E, Rother M. 2008. Carbon monoxide-dependent energy metabolism in anaerobic bacteria and archaea[J]. Archives of Microbiology, 190(3): 257–269.DOI:10.1007/s00203-008-0382-6 |
| 裘钱玲琳, 徐如卫, 朱建林, 等. 2015. 凡纳滨对虾土塘养殖与循环养殖系统细菌群落结构比较研究[J]. 生物学杂志, 2015, 32(6): 45–49.DOI:10.3969/j.issn.2095-1736.2015.06.045 |
| Rinke C, Schwientek P, Sczyrba A, et al. 2013. Insights into the phylogeny and coding potential of microbial dark matter[J]. Nature, 499(7459): 431–437.DOI:10.1038/nature12352 |
| 盛夏, 张红, 苏超. 2013. 基于BP神经网络的汾河水质评价[J]. 山西大学学报, 2013, 36(2): 301–307. |
| Sun Y, Wang T, Peng X, et al. 2016. Bacterial community compositions in sediment polluted by perfluoroalkyl acids (PFAAs) using Illumina high-throughput sequencing[J]. Environmental Science and Pollution Research, 23(11): 10556–10565.DOI:10.1007/s11356-016-6055-0 |
| Sun Z, Li G, Wang C, et al. 2015. Community dynamics of prokaryotic and eukaryotic microbes in an estuary reservoir[J]. Scientific Reports, 4(1).DOI:10.1038/srep06966 |
| 谭文勃, 马晓丹, 黄聪, 等. 2017. 1株异养反硝化硫细菌的分离鉴定及代谢特性[J]. 环境科学, 2017, 38(2): 809–814. |
| Van Rossum T, Peabody M A, Uyaguari-Diaz M I, et al. 2015. Year-long metagenomic study of river microbiomes across land use and water quality[J]. Frontiers in Microbiology, 6: 1405. |
| 王鹏.2005.深海沉积物微生物多样性及其与环境相互关系的研究[D].青岛: 中国海洋大学.122http://cdmd.cnki.com.cn/Article/CDMD-10423-2005140375.htm |
| 邢德峰, 任南琪. 2006. 应用DGGE研究微生物群落时的常见问题分析[J]. 微生物学报, 2006, 46(2): 331–335.DOI:10.3321/j.issn:0001-6209.2006.02.034 |
| 姚清晨, 解静芳. 2008. 引黄入晋前后汾河水库水质变化情况及趋势[J]. 太原城市职业技术学院学报, 2008(3): 148–149.DOI:10.3969/j.issn.1673-0046.2008.03.085 |
| 袁瑞强, 张文新, 王鹏, 等. 2018. 引黄调水对汾河受水区水环境的影响[J]. 自然资源学报, 2018(8): 1416–1426. |
| 张旭.2016.淡水水体底泥微生物群落特征及微生物指标评价研究[D].上海: 上海大学.99http://cdmd.cnki.com.cn/Article/CDMD-10280-1016745848.htm |
| 赵燕, 薛林贵, 李琳, 等. 2012. 丛毛单胞菌在环境污染物降解方面的研究进展[J]. 微生物学通报, 2012, 39(10): 1471–1478. |
| 赵媛莉, 张倩倩, 刘新华, 等. 2017. 三峡大坝对香溪河底栖微生物群落结构和多样性的影响[J]. 水生态学杂志, 2017, 38(3): 45–50. |
| 周潮晖, 张庆强, 杜乔乔, 等. 2016. 引滦入津工程黎河河道表层沉积物重金属形态及风险分析[J]. 水资源与水工程学报, 2016(2): 103–107. |
| Zwart G, Crump B C, Agterveld M P K, et al. 2002. Typical freshwater bacteria:an analysis of available 16S rRNA gene sequences from plankton of lakes and rivers[J]. Aquaitic Microbial Ecology, 28: 141–155.DOI:10.3354/ame028141 |
