 , 全向春
, 全向春
 , 李婉琳, 裴元生, 王颖, 殷立峰
, 李婉琳, 裴元生, 王颖, 殷立峰北京师范大学环境学院, 水环境模拟国家重点实验室, 北京 100875
收稿日期: 2019-02-20; 修回日期: 2019-04-16; 录用日期: 2019-04-16
基金项目: 国家自然科学基金(No.51678055)
作者简介: 孙越(1993-), 女, E-mail:201621180078@mail.bnu.edu.cn
通讯作者(责任作者): 全向春, E-mail:xchquan@bnu.edu.cn
摘要: 微生物反向电渗析(Microbial reverse-electrodialysis electrolysis cell,MREC)是一种通过微生物产生的电能与浓淡水盐差能耦合形成的一种新型的生物电化学技术.本文对MREC阴极回收H2O2的运行条件与影响因素及同步产能效应进行了研究.结果表明,浓淡水流速及浓度比是影响H2O2产生的关键因素.在浓淡水流速为2 mL·min-1、浓/淡水比为100时,MREC可以获得最大H2O2产量711.4 mg·L-1,产H2O2速率达到最大33.65 mg·L-1·h-1,阴极回收率为19.77%.同时,对应的产电性能达到1.25 W·m-2.MREC反应器能够在无需施加外界能源的情况下获得较高的H2O2产量,为H2O2绿色生产提供了一条新思路.
关键词:微生物反向电渗析反应器生物电化学H2O2
Microbial reverse-electrodialysis electrolysis cell for effective production of hydrogen peroxide
SUN Yue
 , QUAN Xiangchun
, QUAN Xiangchun
 , LI Wanlin, PEI Yuansheng, WANG Ying, YIN Lifeng
, LI Wanlin, PEI Yuansheng, WANG Ying, YIN Lifeng State Key Laboratory of Water Environment Simulation, School of Environment, Beijing Normal University, Beijing 100875
Received 20 February 2019; received in revised from 16 April 2019; accepted 16 April 2019
Abstract: Microbial reverse-electrodialysis electrolysis cell (MREC) is a new type of bioelectrochemical technology which is developed by coupling electrical energy generated by microorganisms with salinity-gradient energy between seawater and freshwater. In this study, a MREC was established aiming to produce H2O2 in the cathode chamber. The effects of operating conditions and influencing factors on H2O2 generation and power generation were investigated. The results show that the flow rate of seawater and freshwater and the salinity gradient were the key factors influencing the production of H2O2. The maximum H2O2 production, 711.4 mg·L-1, was obtained when the flow rate of Seawater and Freshwater was 2 mL·min-1 and the concentration of Freshwater was 0.35 g·L-1. Under this condition, the H2O2 production rate also reached a maximum value of 33.65 mg·L-1·h-1, and the cathode recovery rate was 19.77%. Correspondingly, the power density reached 1.25 W·m-2. The MREC reactor can obtain a high H2O2 production rate without applying external energy, which provides a new route for green production of H2O2.
Keywords: Microbial reverse-electrodialysis electrolysis cellbioelectrochemical systemH2O2
1 引言(Introduction)H2O2作为一种高效氧化剂广泛应用于环境污染治理领域(Xu et al., 2013; Yi, 2015; Sim et al., 2015; Li et al., 2017).利用生物电化学系统(bioelectrochemical system, BES)生产H2O2, 是近年来发展起来的一种低能耗污水处理与资源回收技术(Rozendal et al., 2009; Fu et al., 2010; Zhang et al., 2015; Dong et al., 2018).利用微生物燃料电池(Microbial Fuel Cells, MFC)反应器, 在阴极有氧的条件下, 阳极微生物产电可以被阴极电极利用从而还原H+.H+在接收电子后可能发生四电子反应从而产生水(式(1)), 或发生二电子反应从而产生过氧化氢(式(2))(Fu et al., 2010; Feng, 2010; Yi, 2015).用BES反应器产H2O2存在以下两个问题:(1)如果不施加外压, 由于MFC反应器自身产电性能有限、电流较小, H2O2产量较小; (2)施加外压可提高H2O2产量, 但增加能耗.
 | (1) |
 | (2) |
MREC反应器同样可以用来产生H2O2(Li et al., 2017).与传统外加电压的BES系统不同, MREC通过RED膜堆施加的电压提高其产电性能及H2O2产量.因此, 有必要深入探究RED膜堆运行操作条件对MREC反应器产电及产H2O2的影响, 本文重点探讨了浓淡水流速和浓度差对系统产H2O2及产电的影响.
2 材料和方法(Materials and methods)2.1 阴极气体扩散电极制备方法阴极采用气体扩散电极, 其包含扩散层、催化层和基层, 主要制备方法如下所述.将钛网在丙酮溶液中浸泡12 h, 取出后去离子水冲洗3次, 烘干后作为基层; 扩散层以80 mg·cm-2的炭黑负载量称取炭黑, 溶于乙醇随后以(炭黑:PTFE=1:1)的质量比加入PTFE, 超声分散, 均匀搅拌后放入水浴锅中80 ℃加热至糊状, 用锟压机将扩散层与钛网压合; 催化层以60 mg·cm-2的炭黑和20 mg·cm-2的导电石墨粉负载量称取炭黑和导电石墨粉, 同样溶于乙醇随后以(碳材料:PTFE=2:1)的质量比加入PTFE, 再次超声, 均匀搅拌后加入水浴锅中80 ℃加热至糊状, 同样用锟压机将催化层与钛网压合.扩散层和催化层与基层钛网压合完成之后, 放入马弗炉中在350 ℃条件下烧结30 min, 即可制备出所需产H2O2的气体扩散电极.
2.2 MREC反应器的构型和运行MREC反应器的构型如图 1所示, 包含阳极室、阴极室、RED膜堆部分、浓水进水口、淡水进水口、浓水出水口、淡水出水口等部分.阳极室容积30 mL, 阴极室18 mL.RED膜堆采用阳离子交换膜和阴离子交换膜(山东天维膜技术有限公司)交替排列的形式, 膜对数量为5, 离子交换膜的排列方式如图 1a所示.离子交换膜之间用浇筑的隔板(山东天维膜技术有限公司)进行分隔, 隔板厚度为0.5 mm, 隔板之间放置0.33 mm厚的隔网.阳极室中放置颗粒碳, 阴极室中放置气体扩散电极(制备方法如图 1所示).
图 1(Fig. 1)
 |
| 图 1 MREC反应器原理图(CEM:阳离子交换膜, AEM:阴离子交换膜; Seawater:海水/浓水; Freshwater:淡水) Fig. 1Schematic of the MREC reactor (CEM: cation exchange membrane; AEM: anion exchange membrane; Seawater: seawater/high concentration solution; Freshwater: freshwater/low concentration solution) |
在运行之初, 将MREC反应器的RED膜堆取出, 将阳极室直接与阴极室组合成微生物燃料电池, 并连接1000 Ω电阻, 向阳极室中接种厌氧污泥, 并加入培养液进行产电微生物的挂膜.培养液的组成包括:CH3COONa, 1 g·L-1; Na2HPO4, 18 g·L-1; KH2PO4, 9 g·L-1; NH4Cl, 0.1 g·L-1; NaCl, 0.5 g·L-1; MgSO4·7H2O, 0.1 g·L-1; CaCl2·7H2O, 0.015 g·L-1.阴极室中加入50 mmol·L-1的PBS作为阴极液.当输出电压均稳定在约0.4 V时, 挂膜完成.
然后将RED膜堆组装到阳极室和阴极室之间, 形成MREC反应器.反应器阳极室和阴极室中均放置参比电极(饱和甘汞电极)用于测定膜堆电压和阴、阳极电势.此时反应器阳极液配方仍为上述配方液配方, 而阴极液则采用0.1 mol·L-1的Na2SO4溶液.然后考察了不同浓度的NaCl溶液作为浓水和淡水对产电及产H2O2特性影响.在控制流速为2 mL·min-1、浓水NaCl浓度为35 g·L-1不变的条件下, 探究了0、0.35和0.7 g·L-1 3种不同淡水浓度, 即∞、100、50 3种不同的浓/淡水比对MREC反应器的产电及产H2O2性能的影响.然后控制浓水为35 g·L-1的NaCl溶液、淡水为0.35 g·L-1的NaCl溶液, 探究了0.5、1、2、4 mL·min-14种浓淡水流速对MREC反应器的产电及产H2O2性能的影响.运行过程中, MREC反应器外接10 Ω电阻(ZX21型, 旋转式电阻箱), 浓水进水和淡水进水通过蠕动泵(BT00-100M, 保定兰格恒流泵有限公司)打入MREC反应器的膜堆中并控制进水流速.在没有特殊说明的情况下, 浓淡水进水流速均控制在2 mL·min-1.
电阻两端外加电压表用于测定体系中的电流, 阴极同样外加电压表用于测定阴极电位.实验过程中, 每隔一段时间便从反应器的阴极室中取出0.5 mL样品于10 mL离心管中用于测定H2O2浓度.H2O2浓度测定方法见2.3.取样同时记录阴极电位和体系中的电流.
2.3 测定方法及计算本实验中利用偏钒酸铵分光光度法在λ=450 nm处测定溶液中的H2O2浓度.具体方法如下:以0.28 mol·L-1的硫酸溶液为溶剂配置0.06 mol·L-1的偏钒酸铵检测液; 取阴极样品0.5 mL加入0.5 mL偏钒酸铵检测液, 再加4 mL去离子水定容至总体积5 mL; 显色10 min后在450 nm波长下用紫外分光光度计(HACH DR6000)测定吸光度, 进而得出对应的H2O2浓度.
反应器在开路状态下放置2 h, 之后测定的反应器两端电压为其开路电压; 采用极化曲线斜率法测定反应器的内阻, 同时计算反应器的功率密度.
浓淡水进水及出水(取反应器稳定运行时的100 mL出水)电导率由电导率仪进行测定.
产H2O2速率的计算:
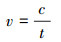 | (3) |
阴极回收率即电流效率, 即反应器所产电量中参加阴极室中产H2O2所用电量的比例(Luo et al., 2015a).其计算公式为:
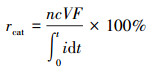 | (4) |
3 结果与讨论(Results and discussion)3.1 浓淡水流速对MREC反应器产H2O2影响MREC反应器中间RED膜堆需要盐差能驱动, 不同浓淡水流速对MREC反应器产H2O2的影响如图 2a所示.MREC阴极室内H2O2产量随着运行时间的延长逐渐增加, 达到峰值后开始下降, 说明阴极内存在H2O2产生和分解两个过程(Qiang et al., 2002; Xia et al., 2015).当流速在0.5~2 mL·min-1范围内, H2O2的量随着流速的增加而增加, 2 mL·min-1时达到最大值711.5 mg·L-1, 当流速继续增加到4 mL·min-1, H2O2产量并没有继续增加反而降低为480.3 mg·L-1.
图 2(Fig. 2)
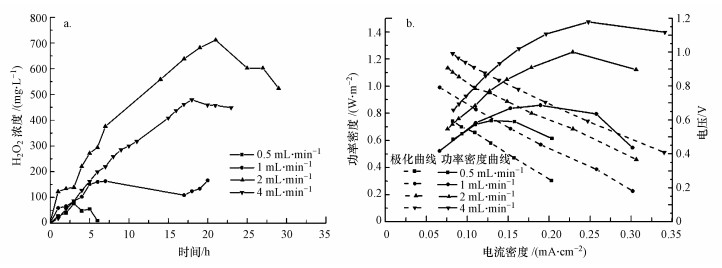 |
| 图 2 不同浓淡水流速下MREC反应器产的H2O2量(a)及该条件下对应的极化曲线和功率密度曲线(b) Fig. 2The concentration of H2O2 produced by MREC reactor under different Seawater and Freshwater flow rates (a) and the corresponding polarization curves and power density curves under these conditions(b) |
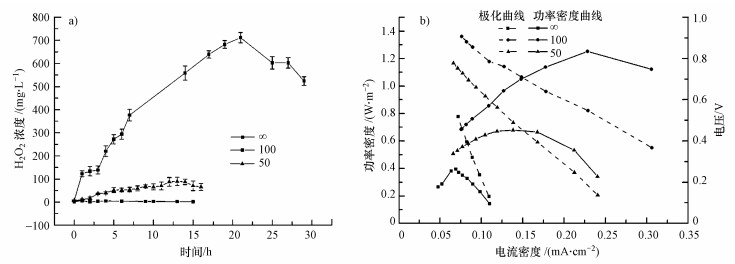
不同浓淡水流速下MREC反应器的功率密度曲线和极化曲线如图 2b所示.可以看出, 最大功率密度随着浓淡水流速的增加而增加, 在0.5、1、2、4 mL·min-1 4种流速下, MREC反应器的最大功率密度分别为0.60、0.86、1.25和1.47 W·m-2.该功率密度与文献报道的利用碳酸氢铵作为浓淡水、利用碳材料做气体扩散电极的MREC反应器获得的功率密度(0.86 W·m-2)可比(罗希, 2015).由极化曲线计算得到的内阻分别为238、211、193和187 Ω.可见, 浓淡水流速的增加可以降低系统内阻, 分析可能是因为流速的增加降低了膜堆内部膜与溶液界面处的浓差极化, 减小边界层的传质阻力, 并使发生离子交换的浓水和淡水更替加快, 盐溶液浓度梯度差随着流道延伸下降程度减少(Kim et al., 2011b, Ramon et al., 2011).
不同流速下MREC输出电流及阴极电位变化见图 3.输出电流随运行时间延长逐渐降低.当浓淡水流速为0.5和1 mL·min-1时, 系统产生的电流比较小, 分别为3.25~1.34 mA和4.25~1.32 mA, 阴极电位则为(-0.29±0.02)和(-0.37±0.02) V.当流速增加到2 mL·min-1, 系统输出电流显著增加, 为8.56~1.80 mA, 阴极电位也最低, 为(-0.46±0.02) V.当流速继续增大到4 mL·min-1时, 输出电流略有降低, 为7.75~1.56 mA, 而阴极电位则略有升高, 为(-0.34±0.03) V.而流速为1 mL·min-1时, 运行开始(0 h)时其阴极电位更负则可能是由于系统运行初期不稳定所致(Liu et al., 2014; Song et al., 2016).
图 3(Fig. 3)
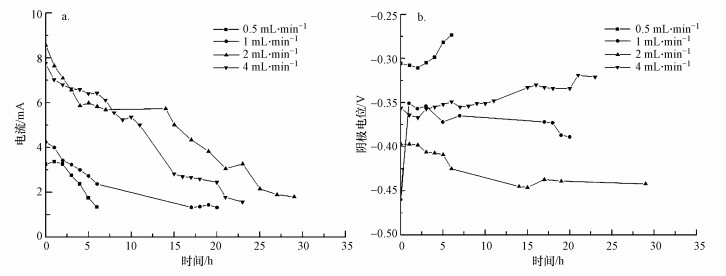 |
| 图 3 不同浓淡水流速下MREC反应器产H2O2时所对应的电流(a)和阴极电位(b) Fig. 3The current (a) and cathode potential(b) of the MREC reactor under different Seawater and Freshwater flow rates |
综合以上分析, 当流速为2 mL·min-1时, MREC获得最大H2O2产量, 主要是因为该条件下系统具有高输出电流与更负的阴极电位, 有利于有关H2O2的产生(Modin et al., 2012; Modin et al., 2013; Sim et al., 2015; Li et al., 2017).本研究中MREC反应器最大H2O2的量(711.5 mg·L-1)与Li等(2017)等所述的MREC反应器最高H2O2产量(778 ± 11) mg·L-1相当.而不施加外压的单纯的MFC系统能够产生的H2O2产量比较有限, 一般为79~450 mg·L-1(Fu et al., 2010; Chen et al., 2014; Sim et al., 2015; Asghar et al., 2017; Dong et al., 2018).可见, 通过膜堆产生的电压施加到微生物燃料电池中, 提高了系统的H2O2产量.
不同浓淡水流速下, MREC反应器的阴极回收率和产H2O2速率如图 4所示.在流速为2 mL·min-1时, 产H2O2速率最大, 达到33.65 mg·L-1·h-1, 此时的阴极回收率为19.77%, 该H2O2产生速率高于文献相关研究中报道的利用MFC产H2O2的速率.如Dong等(2018)利用MFC产H2O2, 其速率为13.7 mg·L-1·h-1(Dong et al., 2018), 而Lei等利用MFC反应器在外加20 Ω电阻条件下产H2O2速率为6.577 mg·L-1·h-1(Lei et al., 2010).本研究中, MREC反应器当流速增加到4 mL·min-1时, 虽然系统获得的功率密度最大, 但产H2O2速率有所降低, 为26.68 mg·L-1·h-1, 而阴极回收率也降低到4.73%, 分析可能是该条件下阴极电位及阴极液的变化促进更多电子与氧发生四电子还原反应生成H2O而不是H2O2.
图 4(Fig. 4)
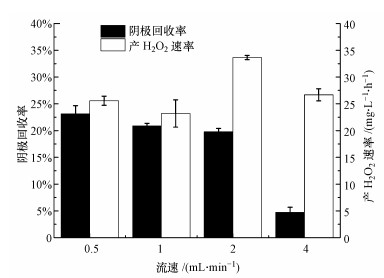 |
| 图 4 不同浓淡水流速下MREC反应器的阴极回收率和产H2O2速率 Fig. 4The cathodic recovery and H2O2 production rate of MREC reactor under different Seawater and Freshwater flow rates |
3.2 不同浓/淡水比对MREC反应器产H2O2的影响通过溶液盐差驱动RED系统时, 浓水与淡水的浓度差会影响系统电化学性能(Dlugolecki et al., 2008).本实验浓水浓度设定为海水, 采用35 g·L-1 NaCl溶液, 淡水分别采用纯水以及0.35 g·L-1和0.7 g·L-1NaCl溶液, 从而得到∞、100、50 3种不同的浓/淡水比.不同淡水浓度下MREC反应器产H2O2的量如图 5a所示.可以看出, 浓/淡水比会直接影响最大H2O2产量.当浓/淡水比为100时, MREC反应器获得最高H2O2产量, 达到711.5 mg·L-1.当浓/淡水比为50时, H2O2产量为89.4 mg·L-1, 相比最大产量下降了87.46%.当纯水作为淡水(浓/淡水比为∞)时, H2O2产量最低, 仅为5.2 mg·L-1.
图 5(Fig. 5)
 |
| 图 5 不同浓/淡水比下MREC反应器产的H2O2量(a)及该条件下对应的极化曲线和功率密度曲线(b) Fig. 5The concentration of H2O2 produced by MREC reactor under different salinity gradient(a) and the corresponding polarization curves and power density curves under these conditions(b) |
不同浓/淡水比下MREC反应器的功率密度曲线和极化曲线如图 5b所示.当浓淡水比为100时, MREC反应器获得的最大功率密度值最大, 为1.14 W·m-2; 当浓淡水比降低为50时, 最大功率密度降低到0.68 W·m-2.以纯水为淡水, 系统产生的功率密度最低, 仅为0.40 W·m-2.由极化曲线计算内阻发现, 纯水作为淡水溶液时, MREC反应器总内阻最大, 为896 Ω, 因为纯水的电导率小, 其通过膜堆时电阻较大.以盐溶液作为淡水, 控制浓/淡水比为100和50时, 系统内阻相比纯水显著降低, 分别为193 Ω和300 Ω, 此时的开路电压分别为1.32 V和1.29 V.
MREC反应器在上述产H2O2过程中对应的电流和阴极电位如图 6所示.由图可知, MREC反应器的电流随着时间的增加而逐渐降低(图 6a), 可见, 随着反应的进行, 电流逐渐降低(Kim et al., 2011; Logan et al., 2012).MREC反应器平均电流在浓/淡水比为100时最高, 从8.56 mA逐渐降低为1.80 mA.而浓/淡水比为50时稍低, 从7.39 mA逐渐降低为2.56 mA.纯水作为淡水时, 由于电流较小((1.59±0.26) V), 导致其H2O2产量较低.该条件下, 阴极电位为-0.29 V.当浓/淡水比为100时, 反应器阴极电位维持在-0.43 V左右.而当浓/淡水比降低至50时, 反应器阴极电位从-0.442 V降低至-0.355 V.H2O2产量往往与阴极电流密度成正比(Li et al., 2017).综合分析, 浓/淡水比为100的条件下, MREC反应器功率密度最大, 阴极电流最大, 氧化还原电位最低, 使得该条件下H2O2产量也最大.
图 6(Fig. 6)
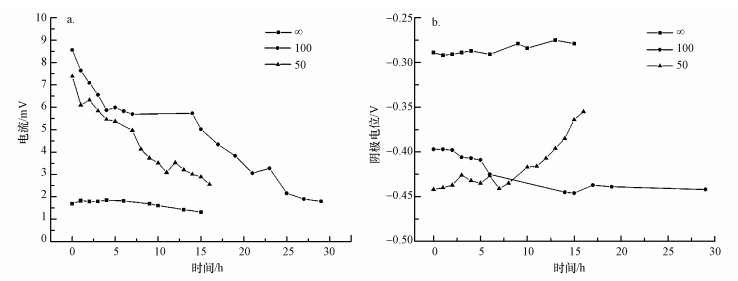 |
| 图 6 不同浓/淡水比下MREC反应器的产H2O2时所对应的电流(a)和阴极电位(b) Fig. 6The current (a) andcathode potential (b) of the MREC reactor under different salinity gradient |
不同浓/淡水比下, MREC反应器的阴极回收率和产H2O2速率如图 7所示.由图可知, 最大阴极回收率出现在浓/淡水比为100时, 为19.77%.当浓/淡水比为50时, 阴极回收率为0.53%.此外, MREC反应器在浓/淡水比为100时, 产H2O2速率最高达到33.65 mg·L-1·h-1, 当浓/淡水比降低50时, 最高产H2O2速率也下降了82%, 为6.35 mg·L-1·h-1.纯水为淡水时, 产H2O2速率仅为3.35 mg·L-1·h-1.由上述结果可知, 在浓/淡水比为100时, MREC反应器产H2O2量最多, 产H2O2速率最大, 阴极回收率最高.因此, MREC反应器的最佳浓/淡水比为100.
图 7(Fig. 7)
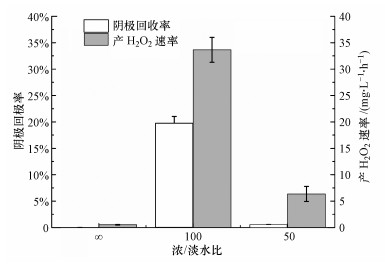 |
| 图 7 不同浓/淡水比下MREC反应器的阴极回收率和产H2O2速率 Fig. 7The cathodic recovery and H2O2 production rate of MREC reactor under different salinity gradient |
除了膜堆的浓/淡水比及流速外, MREC反应器的阴极构造形式、基底材料及催化剂等因素也会影响到氧气在电极表面传输及还原生成H2O2的效率.本研究采用了气体扩散电极作为阴极, 空气中氧气通过扩散层均匀溶解在水中, 并在催化剂作用下发生还原反应.这种气体扩散形式无需主动供氧, 靠溶液与空气氧分压不同, 实现氧的溶解扩散传输.所制备的阴极气体扩散电极参考了文献已经报道的具有优异H2O2产生特性的电极(Luo et al., 2015b), 因此在本文不再作为重点讨论.
4 结论(Conclusions)1) 利用MREC反应器可以得到最大711.5 mg·L-1的H2O2产量, 最大产H2O2速率为33.65 mg·L-1·h-1, 该条件下的最大功率密度为1.25 W·m-2.
2) MREC反应器在浓淡水流速为2 mL·min-1的条件下, 达到最大的H2O2产量和产H2O2速率, 为产H2O2时的最优浓淡水流速.
3) MREC反应器在浓/淡水比为100的条件下, 达到最大的H2O2产量、阴极回收率和产H2O2速率, 为最优的浓/淡水比.
参考文献
| Asghar A, Salihoudin A, Raman A A A, et al. 2017. Cathode modification to enhance the performance of in-situ fenton oxidation in microbial fuel cells[J]. Environmental Progress & Sustainable Energy, 36(2): 382–393. |
| Brillas E, Sires I, Oturan M A. 2009. Electro-Fenton Process and Related Electrochemical Technologies Based on Fenton's Reaction Chemistry[J]. Chemical Reviews, 109: 6570–6631.DOI:10.1021/cr900136g |
| Chen J Y, Li N, Zhao L. 2014. Three-dimensional electrode microbial fuel cell for hydrogen peroxide synthesis coupled to wastewater treatment[J]. Journal of Power Sources, 254: 316–322.DOI:10.1016/j.jpowsour.2013.12.114 |
| 邓会宁, 何云飞, 胡柏松, 等. 2017. 反电渗析法盐差能发电用离子交换膜研究进展[J]. 化工进展, 2017, 36(1): 224–231. |
| D?ugo?ecki P, Gambier A, Nijmeijer K, et al. 2009. Practical potential of reverse electrodialysis as process for sustainable energy generation[J]. Environmental Science & Technology, 43(17): 6888–6894. |
| D?ugo?ecki P, Nymeijera K, Metz S, et al. 2008. Current status of ion exchange membranes for power generation from salinity gradients[J]. Journal of Membrane Science, 319: 214–222.DOI:10.1016/j.memsci.2008.03.037 |
| Dong H, Liu X W, Xu T, et al. 2018. Hydrogen peroxide generation in microbial fuel cells using graphene-based air-cathodes[J]. Bioresource Technology, 247: 684–689.DOI:10.1016/j.biortech.2017.09.158 |
| Feng C H, Li F B, Mai H J, et al. 2010. Bio-electro-Fenton process driven by microbial fuel cell for wastewater treatment[J]. Environmental Science & Technology, 44(5): 1875–1880. |
| Fu L, You S J, Yang F L, et al. 2010. Synthesis of hydrogen peroxide in microbial fuel cell[J]. Journal of Chemical Technology & Biotechnology, 85(5): 715–719. |
| 姜成春, 张佳发, 李继. 2006. 电化学原位产生H2O2的影响因素分析及数学建模[J]. 环境科学学报, 2006, 26(9): 1504–1509.DOI:10.3321/j.issn:0253-2468.2006.09.016 |
| Kim Y, Logan B E. 2011a. Hydrogen production from inexhaustible supplies of fresh and salt water using microbial reverse-electrodialysis electrolysis cells[J]. Process of the National Academic of Science of the United States of America, 108(39): 16176–16181.DOI:10.1073/pnas.1106335108 |
| Kim Y, Logan B E. 2011b. Microbial reverse electrodialysis cells for synergistically enhanced power production[J]. Environmental Science & Technology, 45(13): 5834–5839. |
| Li X H, Angelidaki I, Zhang Y F. 2017. Salinity-gradient energy driven microbial electrosynthesis of hydrogen peroxide[J]. Journal of Power Sources, 341: 357–365.DOI:10.1016/j.jpowsour.2016.12.030 |
| Liu J, Geise G M, Luo X, et al. 2014. Patterned ion exchange membranes for improved power production in microbial reverse-electrodialysis cells[J]. Journal of Power Sources, 271: 437–443.DOI:10.1016/j.jpowsour.2014.08.026 |
| Luo H J, Li C L, Wu C Q, et al. 2015a. Electrochemical degradation of phenol by in situ electro-generated and electro-activated hydrogen peroxide using an improved gas diffusion cathode[J]. Electrochimica Acta, 186: 486–493.DOI:10.1016/j.electacta.2015.10.194 |
| Luo H J, Li C L, Wu C Q, et al. 2015b. In situ electrosynthesis of hydrogen peroxide with an improved gas diffusion cathode by rolling carbon black and PTFE[J]. Royal Science of Chemistry, 5(80): 65227–65235. |
| Luo X, Cao X X, Mo Y H, et al. 2012. Power generation by coupling reverse electrodialysis and ammonium bicarbonate:Implication for recovery of waste heat[J]. Electrochemistry Communications, 19: 25–28.DOI:10.1016/j.elecom.2012.03.004 |
| 罗希. 2015.基于碳酸氢铵反向电渗析的污水生物产电及有价物质生产[D].北京: 清华大学. 75-76 |
| Modin O, Fukushi K. 2012. Development and testing of bioelectrochemical reactors converting wastewater organics into hydrogen peroxide[J]. Water Science & Technology, 66(4): 831–846. |
| Modina O, Fukushib K. 2013. Production of high concentrations of H2O2 in a bioelectrochemical reactor fed with real municipal wastewater[J]. Environmental Technology, 34(19): 2737–2742.DOI:10.1080/09593330.2013.788041 |
| Nam J Y, Cusick R D, Kim Y, et al. 2012. Hydrogen generation in microbial reverse-electrodialysis electrolysis cells using a heat-regenerated salt solution[J]. Environmental Science & Technology, 46(9): 5240–5246. |
| Qiang Z M, Chang J H, Huang C P. 2002. Electrochemical generation of hydrogen peroxide from dissolved oxygen in acidic solutions[J]. Water Research, 36(1): 85–94.DOI:10.1016/S0043-1354(01)00235-4 |
| Rozendal R A, Leone E, Keller J, et al. 2009. Efficient hydrogen peroxide generation from organic matter in a bioelectrochemical system[J]. Electrochemistry Communications, 11(9): 1752–1755.DOI:10.1016/j.elecom.2009.07.008 |
| Sim J Y, An J Y, Elbeshbishy E, et al. 2015. Characterization and optimization of cathodic conditions for H2O2 synthesis in microbial electrochemical cells[J]. Bioresource Technology, 195: 31–36.DOI:10.1016/j.biortech.2015.06.076 |
| Song Y H, Hidayat S, Kim H K, et al. 2016. Hydrogen production in microbial reverse-electrodialysis electrolysis cells using a substrate without buffer solution[J]. Bioresource Technology, 210: 56–60.DOI:10.1016/j.biortech.2016.02.021 |
| Vermaas D A, Saakes M, Nijmeijer K. 2011. Doubled power density from salinity gradients at reduced intermembrane distance[J]. Environmental Science & Technology, 45(16): 7089–7095. |
| Xia G S, Lu Y H, Xu H B. 2015. An energy-saving production of hydrogen peroxide via oxygen reduction for electro-Fenton using electrochemically modified polyacrylonitrile-based carbon fiber brush cathode[J]. Separation and Purification Technology, 156: 553–560.DOI:10.1016/j.seppur.2015.10.048 |
| Xu N, Zhang Y Y, Tao H C, et al. 2013. Bio-electro-Fenton system for enhanced estrogens degradation[J]. Bioresoure Technology, 138: 136–140.DOI:10.1016/j.biortech.2013.03.157 |
| Yi Y H, Wang L, Li G, et al. 2015. A review on research progress in the direct synthesis of hydrogen peroxide from hydrogen and oxygen:noble-metal catalytic method, fuel-cell method and plasma method[J]. Royal Society of Chemistry, 6(6): 1593–1610. |
| Zhang Y F, Wang Y, Angelidaki I. 2015. Alternate switching between microbial fuel cell and microbial electrolysis cell operation as a new method to control H2O2 level in Bioelectro-Fenton system[J]. Journal of Power Sources, 291: 108–116.DOI:10.1016/j.jpowsour.2015.05.020 |
