 , 包海艺, 袁佳敏, 汤明亮, 杨雪莹, 胡辉
, 包海艺, 袁佳敏, 汤明亮, 杨雪莹, 胡辉

华中科技大学环境科学与工程学院, 武汉 430074
收稿日期: 2019-07-28; 修回日期: 2019-10-14; 录用日期: 2019-10-14
基金项目: 华中科技大学重点基金(No.2172015ZDTD063)
作者简介: 郭雨桐(1998-), 女, E-mail:gytss501@qq.com
通讯作者(责任作者): 胡辉, E-mail:hqh08@sina.com
摘要:以三乙烯四胺(TETA)为阳离子前驱体、氟硼酸(HBF4)为阴离子前驱体制备多胺基离子液体[TETAH]+[BF4]-,并与助溶剂乙二醇(EG)按一定计量比组成[TETAH]+[BF4]--EG混合体系.实验考察了离子液体的浓度、吸收温度和气体流量等对该混合体系吸收CO2性能的影响.结果表明,当[TETAH]+[BF4]-的浓度为20%,吸收温度为15℃,气体流量为200 mL·min-1时,该混合体系对CO2的吸收容量达到1.50 mol·mol-1(以每mol离子液体吸收的CO2量(mol)计,下同);离子液体的浓度、CO2流量和温度均会影响该混合体系达到吸收平衡的时间.同时,该混合体系对CO2的吸收容量均高于[TETAH]+[BF4]-和EG单独吸收CO2的容量,这表明离子液体[TETAH]+[BF4]-与助溶剂EG之间存在某种协同作用.另外,该混合体系具有良好的再生性能,在80℃的条件下经过5次吸收-解吸循环实验后的吸收摩尔分率为1.00 mol·mol-1,性能下降仅为33.3%.
关键词:离子液体助溶剂混合体系吸收再生CO2
Experimental study on CO2 absorption by ionic liquid[TETAH]+[BF4]--ethylene glycol mixed solvent
GUO Yutong
 , BAO Haiyi, YUAN Jiamin, TANG Mingliang, YANG Xueying, HU Hui
, BAO Haiyi, YUAN Jiamin, TANG Mingliang, YANG Xueying, HU Hui

School of Environmental Science & Engineering, Huazhong University of Science and Technology, Wuhan 430074
Received 28 July 2019; received in revised from 14 October 2019; accepted 14 October 2019
Abstract: CO2 capture is seen as an effective method to control CO2 emission and has received extensive attention. Polyamine-based ionic liquid[TETAH]+[BF4]- can be synthesized and mixed with ethylene glycol (EG) to form a mixed solvent to capture CO2. In this study, we conducted experiments to study the influence of ionic liquid concentration, absorption temperature and gas flow on the capacity of such mixed solvent to absorb CO2. The results indicated that ionic liquid concentration, absorption temperature and gas flow had clear impacts on the speed of reaching the equilibrium of CO2 absorption. The maximum absorption rate of the mixed solvent was achieved at a level of 1.50 mol·mol-1 when the ionic liquid concentration was 20%, the absorption temperature was 15℃ and the gas flow was 200 mL·min-1. The CO2 absorption capacity of the mixed solvent was found greater than that of either[TETAH]+[BF4]- or EG, indicating potential synergetic mechanisms between[TETAH]+[BF4]- and EG on improving the absorption capacity. Moreover, the mixed solvent had decent capability to maintain the absorption capacity at high temperature levels. After five times of absorption-desorption experiments at 80℃, the maximum absorption capacity only reduced by 33.3%.
Keywords: ionic liquidsolventmixed solventabsorptionregenerationCO2
1 引言(Introduction)离子液体是绿色溶剂的代表之一, 研究发现, 许多离子液体具有可吸收CO2的性能, 但同时都存在一些不足.以咪唑类为主的常规离子液体在常温常压下对CO2的吸收量较小, 不利于工程实际应用;聚合物离子液体和负载型离子液体在吸收CO2的过程中, 黏度会随着吸附量的增加而变大, 不利于CO2传质.胺基功能型离子液体与常规离子液体相比, 不仅具有熔点低、热稳定性高和结构可调等特性, 而且具有更高的CO2吸收性能, 因而成为捕集CO2的重要研究对象(于荣等, 2009;夏裴文等, 2019).研究显示, 胺基功能化离子液体吸收CO2是通过胺基—NH2与CO2反应生成—NH2+COO-(Xu et al., 2011), 因此, 理论上, 离子液体所含胺基越多, 其捕集CO2的量越大.杨旗等(2016)的研究表明, 阴离子相同的三乙烯四胺离子液体捕集CO2的量明显高于二乙烯三胺离子液体捕集CO2的量.然而, 胺基数越多离子液体粘度越大, 其吸收CO2的传质推动力下降, 进而会影响离子液体的CO2吸收容量和达到吸收平衡所需要的时间(代成娜等, 2015).为了降低多胺基离子液体的黏度, 许多研究者采用将离子液体添加到助溶剂中的方法.例如, 张慧等(2016)的实验结果表明, 胺基离子液体[NH2e-mim]Br、[NH2p-bmim]Br、[NH2e-mim]BF4、[NH2p-bmim]BF4在纯溶剂状态下的CO2吸收容量为0.2~0.3 mol · mol-1, 在水溶液状态下为0.4~0.5 mol · mol-1.胡辉等(2014)构成的[TETAH]+[BF4]--H2O混合体系在含水率为40%时, 其对CO2的吸收容量由纯离子液体时的0.96 mol · mol-1提高到2.04 mol · mol-1.
由于水的比热容和蒸发潜热大, 离子液体-H2O混合体系吸收CO2后的再生能耗偏大, 为此, 研究者选择比热容较小的溶剂代替水.陈阳等(2017)的研究表明, 离子液体-聚乙二醇混合体系中的聚乙二醇不仅作为助溶剂, 而且还参与离子液体吸收CO2的过程, 从而提高了离子液体对CO2的吸收容量.王占丽等(2013)将离子液体[N2222][Ala]、[N2222][Ser]和甲基二乙醇胺(MDEA)混合, 发现离子液体浓度为10%时, 混合体系的CO2吸收量增加了8.63%.Saleem等(2017)配制了30%MDEA+30%PZ(哌嗪)+10%[bmim][AC]+30%水的混合体系, 发现该混合体系的CO2吸收容量达到1.84 mol · mol-1, 比MDEA水溶液增加了0.72 mol · mol-1;同时, 选择有机溶剂替代水还能提高混合体系的再生性能.Liu等(2019)用聚乙二醇(PEG200)替代混合体系[Cho][Gly]/H2O中的部分溶剂水配制成了含30%PEG200的[Cho][Gly]/H2O/PEG200混合体系, 该研究表明, 混合体系[Cho][Gly]/H2O/PEG200的再生性能显著优于[Cho][Gly]/H2O混合体系.然而, Hussen等(2010)实验表明, 离子液体含水率的增加会导致其CO2吸收容量降低, 这表明离子液体与助溶剂之间需要一个适当的比例.
本研究在合成离子液体[TETAH]+[BF4]-并与乙二醇(EG)构成[TETAH]+[BF4]--EG混合体系的基础上, 开展不同离子液体浓度、温度和气体流量等条件下, [TETAH]+[BF4]--EG混合体系吸收CO2性能及再生性能的实验研究.
2 实验部分(Experimental)2.1 离子液体的合成与纯化本文采用一步合成法(Hu et al., 2014), 即取一定量的三乙烯四胺(TETA)至烧瓶中, 用无水乙醇稀释至60%, 在15 ℃水浴条件下强烈搅拌;然后称取相同质量的氟硼酸(HBF4), 用无水乙醇稀释至60%, 加入到滴液漏斗中, 控制滴液滴入烧瓶的速度;滴定结束后继续在水浴中搅拌12 h, 待反应完全后用乙醚萃取;最后在70 ℃下采用N2吹扫和减压蒸馏相结合的方法进行纯化, 得到目标离子液体[TETAH]+[BF4]-.实验所使用的试剂包括氟硼酸(HBF4, 分析纯)、三乙烯四胺(TETA)、无水乙醇、乙醚(分析纯)、乙二醇(EG, 分析纯).
2.2 混合体系吸收性能评价方法2.2.1 实验装置及实验方法本文采用如图 1所示的实验装置(Hu et al., 2014), 开展混合体系[TETAH]+[BF4]--EG吸收CO2的性能评价.该实验装置由气体传输系统、CO2吸收系统与尾气吸收排放系统三部分组成.
图 1(Fig. 1)
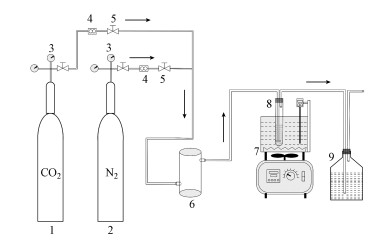 |
| 图 1 混合体系吸收CO2实验装置(1.CO2气罐, 2.N2气罐, 3.减压阀, 4.转子流量计, 5.阀门, 6.缓冲室, 7.恒温水浴锅, 8.吸收管, 9.尾气吸收瓶) Fig. 1Experiment equipment of CO2 absorption by ionic liquid |
按照表 1的实验条件, 开展[TETAH]+[BF4]--EG混合体系吸收CO2性能的实验研究.实验前采用粘度计(上海加内特机电设备有限公司, NDJ-5S)测量[TETAH]+[BF4]-和EG的粘度.实验时先按设计实验条件把水浴温度调至实验温度, 配置一定浓度的离子液体-EG混合体系, 并把混合体系装入吸收管内, 在万分之一的电子天平(德国赛多利斯公司, TE124S)上称重记录, 然后把吸收管置于水浴中, 通入N2(99.99% N2)来检查整个气路装置的气密性, 排除气体输送系统和吸收装置内的空气, 30 min之后停止通入N2并开始通入CO2进行吸收实验.每吸收5 min后取出吸收管, 用吸水滤纸擦干后称重记录.称重后将吸收管放回气路中继续进行吸收实验并循环上述步骤, 待前后两次质量不变时, 表明离子液体[TETAH]+[BF4]--EG混合体系对CO2的吸收达到饱和.期间气路中持续通入CO2, 待实验结束后关闭.
表 1(Table 1)
| 表 1 [TETAH]+[BF4]--EG混合体系吸收CO2的实验条件 Table 1 Experimental conditions of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent | ||||||||||||||||||||||||
表 1 [TETAH]+[BF4]--EG混合体系吸收CO2的实验条件 Table 1 Experimental conditions of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent
| ||||||||||||||||||||||||
2.2.2 评价指标采用重量法来测量离子液体的CO2吸收能力, 评价指标为CO2吸收摩尔分率x(式(1)).x值越大, 表明离子液体对CO2的吸收容量越大.
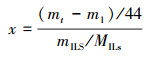 | (1) |
2.3 混合体系的循环再生在离子液体[TETAH]+[BF4]-的浓度为20%, 吸收温度为15 ℃, 气体流量为200 mL · min-1的条件下进行吸收实验, 吸收饱和后, 在80 ℃水浴条件下用流量为200 mL · min-1的N2吹扫, 将CO2从离子液体中脱附出来, 再次进行吸收实验, 依次循环, 进行5次吸收-解吸循环实验, 考察[TETAH]+[BF4]--EG混合体系的循环再生性能.
3 结果与讨论(Results and discussion)3.1 离子液体[TETAH]+[BF4]-和助溶剂乙二醇吸收CO2的基本特性分别在实验1、实验2条件下开展了助溶剂乙二醇EG和离子液体[TETAH]+[BF4]-吸收CO2的实验研究, 结果如图 2所示.从图 2可知, 随着时间的推移, EG吸收CO2的容量呈缓慢增长趋势, 大约在120 min时达到了吸收平衡, 此时EG的吸收容量为0.021 mol · mol-1;同理, 随着时间的推移, [TETAH]+[BF4]-吸收CO2的容量则呈快速增长趋势, 大约在190 min时, 离子液体[TETAH]+[BF4]-对CO2的吸收达到平衡, 此时[TETAH]+[BF4]-对CO2的吸收容量为0.13 mol · mol-1.由此可见, 纯EG和[TETAH]+[BF4]-对CO2的吸收容量均很小, 尤其是助溶剂EG.另外, 从EG和[TETAH]+[BF4]-吸收CO2达到平衡的时间看, EG所需的时间比[TETAH]+[BF4]-短得多, 其原因是25 ℃时纯离子液体的黏度(12861 mPa · s)约是乙二醇(363 mPa · s)的10倍, 导致离子液体吸收CO2的传质推动力比EG小.
图 2(Fig. 2)
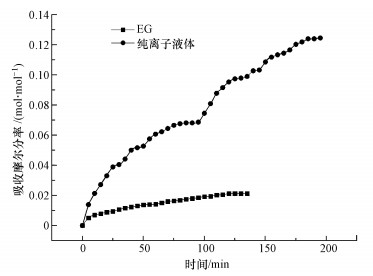 |
| 图 2 实验1、实验2条件下EG和[TETAH]+[BF4]-的CO2吸收容量随时间的变化曲线 Fig. 2Curve of CO2 absorption capacity of EG and [TETAH]+[BF4]- with time under Expt.1 and Expt.2 conditions |
3.2 离子液体[TETAH]+[BF4]-浓度对混合体系吸收CO2的影响图 3是在实验3条件下, [TETAH]+[BF4]-浓度对混合体系[TETAH]+[BF4]--EG吸收CO2性能的影响, 图中a~e处分别表示离子液体达到吸收平衡所需的时间.由图 3可知, 随着混合体系中[TETAH]+[BF4]-浓度的增加, 混合体系[TETAH]+[BF4]--EG吸收CO2的容量呈减少趋势, 从[TETAH]+[BF4]-浓度为20%时的1.13 mol · mol-1下降到60%时的0.84 mol · mol-1, 下降幅度达到25.7%.另外, 随着吸收时间的延长, 不管哪一种浓度的离子液体, 其对CO2的吸收容量均呈快速上升的趋势, 尤其在开始吸收的60 min期间.然而, 从图 3还可知, 离子液体的浓度不同, 混合体系达到吸收平衡的时间也存在差异.这表明离子液体的浓度不仅影响混合体系吸收CO2的容量, 还影响其吸收CO2的速率和达到吸收平衡的时间.
图 3(Fig. 3)
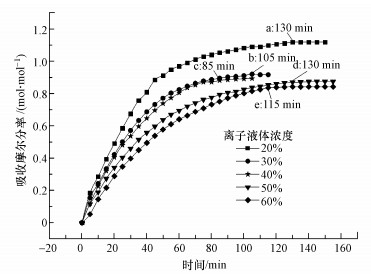 |
| 图 3 实验3条件下[TETAH]+[BF4]--EG混合体系吸收CO2的吸收曲线 Fig. 3Absorption curve of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent under Expt.3 condition |
结合图 2所示的[TETAH]+[BF4]-和EG单独对CO2的吸收容量可知, 一定浓度的[TETAH]+[BF4]-与EG混合后, 均显著提高了其对CO2的吸收容量, 而且达到吸收平衡的时间与纯离子液体相比均缩短, 即助溶剂改善了离子液体的CO2吸收性能.这种现象暗示离子液体与助溶剂之间存在某种协同作用, 这种协同作用大大提高了[TETAH]+[BF4]--EG混合体系对CO2的吸收容量.
3.3 气体流量对混合体系吸收CO2性能的影响压力是影响溶剂吸收气体容量的因素之一, 为此, 本文开展了实验4条件下混合体系[TETAH]+[BF4]--EG对CO2吸收性能的影响, 结果如图 4所示.从图 4可知, 随着气体流量的增加, 混合体系[TETAH]+[BF4]--EG吸收CO2的吸收容量呈上升趋势, 当气体流量从50 mL · min-1增加到200 mL · min-1时, 混合体系对CO2的吸收容量从0.97 mol · mol-1上升到1.13 mol · mol-1.这表明在一定的气体流量范围内, 增加气体流量有利于CO2的吸收, 其原因是吸收容器体积一定时, 气体流量的增大增加了吸收容器内CO2的分压, 增大了CO2在气液两相间的传质推动力, 从而提高了混合体系的吸收容量和吸收速率.
图 4(Fig. 4)
 |
| 图 4 实验4条件下[TETAH]+[BF4]--EG混合体系吸收CO2的吸收曲线 Fig. 4Absorption curve of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent under Expt.4 condition |
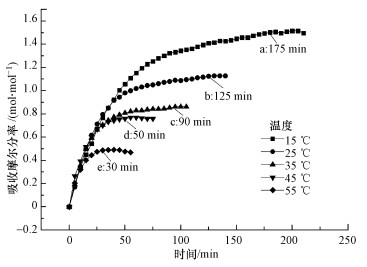
3.4 温度对混合体系吸收CO2性能的影响由于温度是影响气体在吸收溶剂中溶解度的关键因素之一, 为此开展了实验5条件下, 吸收温度对混合体系[TETAH]+[BF4]--EG吸收CO2性能影响的实验研究, 结果如图 5所示.由图 5可知, 随着吸收温度的升高, 混合体系[TETAH]+[BF4]--EG吸收CO2的容量呈快速下降趋势, 当吸收温度为15 ℃时, 该混合体系的吸收容量为1.50 mol · mol-1;当吸收温度为55 ℃时, 混合体系的吸收容量仅为0.49 mol · mol-1.由此可见, 当吸收温度从15 ℃升高到55 ℃时, 该混合体系的吸收容量从1.50 mol · mol-1下降到0.49 mol · mol-1, 下降幅度达到67.3%.这表明温度越低越有利于提高该混合体系对CO2的吸收容量, 其原因是CO2与含胺基离子液体间的反应为酸碱中和反应, 该反应过程放热, 因此, 降低温度有利于反应的进行.
图 5(Fig. 5)
 |
| 图 5 实验5条件下[TETAH]+[BF4]--EG混合体系吸收CO2的吸收曲线 Fig. 5Absorption curve of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent under Expt.5 condition |
此外, 从图 5还可以看出, 随着温度的增加, 混合体系达到吸收饱和所需的时间越短, 这是由于升高温度增加了反应活化分子数, 使有效碰撞增加, 反应速率加快, 因此, 混合体系达到吸收平衡的时间也明显缩短.
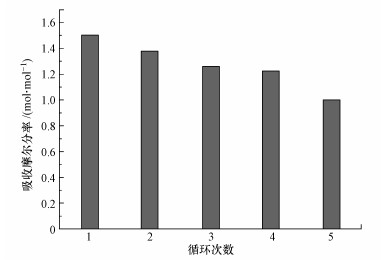
3.5 混合体系的再生性能为了考察[TETAH]+[BF4]--EG混合体系解吸再生之后的吸收能力, 对该离子吸收液进行了5次吸收-解吸循环实验, 实验结果如图 6所示.由图 6可以看出, 混合体系在第一次吸收时吸收效果最好, 其吸收摩尔分率为1.50 mol · mol-1, 混合体系的吸收性能随着再生次数的增加而下降.吸收性能下降的原因可能是:解吸过程中造成了离子液体的损失, 使离子液体总体含量减小;其次, 混合体系中的CO2未能完全解吸出来, 导致吸收率降低.混合体系经过5次吸收-解吸循环实验后的吸收摩尔分率为1.00 mol · mol-1, 性能下降仅为33.3%, 且再生温度低, 仅为80 ℃, 说明其再生性能良好.另外, 乙二醇在80 ℃下的比热容仅为2.786 kJ · kg-1 · K-1, 相比于水的4.2 kJ · kg-1 · K-1较低, 且不像水一样有蒸发潜热, 由此可说明乙二醇作助溶剂的混合体系再生能耗低, 具有优越性.
图 6(Fig. 6)
 |
| 图 6 实验6条件下[TETAH]+[BF4]--EG混合体系再生后吸收CO2性能 Fig. 6Histogram of CO2 absorption after regeneration of [TETAH]+[BF4]--EG mixed solvent under Expt.6 condition |
4 结论(Conclusions)通过开展混合体系[TETAH]+[BF4]--EG在不同条件下吸收CO2性能的实验研究, 发现该混合体系对CO2具有良好的吸收性能.当离子液体[TETAH]+[BF4]-的浓度为20%, 吸收温度为15 ℃, 气体流量为200 mL · min-1时, 该混合体系的吸收容量可达1.50 mol · mol-1, 远高于[TETAH]+[BF4]-和EG单独吸收CO2的容量.同时, 离子液体的浓度、CO2气体流量和吸收温度均影响该混合体系达到吸收平衡的时间与CO2吸收容量.在一定范围内, 降低温度、增大气体流量、降低离子液体浓度均能提高混合体系的CO2吸收容量, 但降低温度会增加其达到吸收平衡所需的时间.因此, 在实际应用中可通过控制该混合体系的吸收条件来控制其CO2吸收容量和吸收所需时间, 使混合体系吸收CO2在最经济的状态下进行.
另外, 该混合体系再生性能良好, 在80 ℃的条件下经过5次吸收-解吸循环实验后的吸收摩尔分率为1.00 mol · mol-1.由此可见, 乙二醇是一种优良的助溶剂, 它既可以提高离子液体对CO2的吸收容量, 又可以使形成的混合体系[TETAH]+[BF4]--EG在低能耗条件下拥有良好的再生性能.因此, 混合体系[TETAH]+[BF4]--EG具有很好的工业应用潜力.
参考文献
| Chen Y, Hu H. 2017. Carbon dioxide capture by diethylenetriamine hydrobromide in nonaqueous solvents and phase-change formation[J]. Energy&Fuels, 31(5): 5363-5375. |
| 代成娜, 项银, 雷志刚. 2015. 规整填料塔中离子液体吸收CO2的传质与流体力学性能[J]. 化工学报, (8): 2953-2961. |
| Hui H, Fang L, Qi X, et al. 2014. Research on influencing factors and mechanism of CO2 absorption by poly-amino-based ionic liquids[J]. International Journal of Greenhouse Gas Control, 31: 33-40. DOI:10.1016/j.ijggc.2014.09.021 |
| Husson P, Pison L, Jacquemin J, et al. 2010. Influence of water on the carbon dioxide absorption by 1-ethyl-3-methylimidazoliumbis (trifluoromethylsulfonyl) amide[J]. Fluid Phase Equilib, 294: 98-104. DOI:10.1016/j.fluid.2010.02.021 |
| Liu S D, Li H, Chen Y F, et al. 2019. Improved CO2 separation performance of aqueous choline-glycine solution by partially replacing water with polyethylene glycol[J]. Fluid Phase Equilibria, 495: 12-20. DOI:10.1016/j.fluid.2019.05.006 |
| Saleem N K, Sintayehu M H, Zakaria M, et al. 2017. Thermophysical properties of concentrated aqueous solution of N-methyldiethanolamine (MDEA), piperazine (PZ), and ionic liquids hybrid solvent for CO2 capture[J]. Journal of Molecular Liquids, 3(229): 221-229. |
| 王占丽, 徐凡, 邢小林, 等. 2013. 功能化离子液体-MDEA复配体系吸收CO2[J]. 化工进展, 32(2): 394-399. |
| Xu Z M, Zhang Z F, Hua J, et al. 2011. Carbon dioxide capture by a dual amino ionic liquid with amino-functionalized imidazolium cation and taurine anion[J]. International Journal of Greenhouse Gas Control, 5: 628-633. DOI:10.1016/j.ijggc.2011.05.014 |
| 夏裴文, 丁保宏, 张鹏军, 等. 2019. 离子液体及其吸收机理的研究进展[J]. 应用化工, 48(6): 1469-1473. DOI:10.3969/j.issn.1671-3206.2019.06.048 |
| 杨旗, 胡辉, 夏琪, 等. 2016. γ-Al2O3负载型多胺基离子液体对CO2的吸附特性[J]. 应用化工, 45(1): 1-6. |
| 于荣, 宋宝华. 2009. 二氧化碳捕集技术发展动态研究[J]. 中国环保业, (10): 27-30. |
| 张慧, 张红梅, 沈锦优, 等. 2016. 胺基功能型离子液体吸收CO2的性能[J]. 化工学报, (12): 5057-5065. |
