 , 李炫莹, 范书伶, 王柔荑, 张珩琳, 曲媛媛
, 李炫莹, 范书伶, 王柔荑, 张珩琳, 曲媛媛

工业生态与环境工程教育部重点实验室, 大连理工大学环境学院, 大连 116024
收稿日期: 2019-08-04; 修回日期: 2019-09-07; 录用日期: 2019-09-07
基金项目: 哈尔滨工业大学城市水资源与水环境国家重点实验室开放课题(No.QAK201943)
作者简介: 卢治宇(1999—), 男, E-mail:huoxingyu@mail.dlut.edu.cn
通讯作者(责任作者): 曲媛媛(1976—), 女, 教授, 博士生导师, 主要研究方向:芳香化合物的微生物转化及降解. E-mail:qyy@dlut.edu.cn
摘要:生物法合成纳米金是一种环境友好且经济高效的合成途径,受到广泛关注.普遍认为微生物合成纳米金是通过胞外分泌生物大分子而实现的一种自发脱毒过程.同时,相关研究表明低浓度的重金属离子对菌株胞外酶的活性会产生一定的影响,进而会对菌株合成纳米金的能力产生影响.基于此,本研究选择一株前期筛选得到的真菌Trichoderma sp.WL-Go,探究不同金属离子诱导菌株对其合成的纳米金特性的影响.结果表明,经Co2+、Al3+、Zn2+、Sn2+、Ni2+等金属离子诱导后,菌株WL-Go合成纳米金的能力均有所提升,而Pb2+、Cu2+、Fe3+与对照组相比,其合成的纳米金浓度及转化率都无明显变化.此外,Co2+诱导菌株合成的纳米金呈现肉眼可见的团簇状,发生明显的团聚现象.本实验还考察了生物合成纳米金对4-硝基苯酚还原的催化特性,结果表明,Sn2+和Pb2+的诱导使菌株WL-Go合成的纳米金催化速率得到明显提升,而其他金属离子均有所抑制.最后选取革兰氏阳性菌Arthrobacter sp.W1和革兰氏阴性菌Escherichia coli BL21(DE3)验证了不同金属离子诱导后合成的纳米金均具有良好的生物相容性.综上,本研究为对于拓宽纳米金的工业化应用前景有着重要意义.
关键词:纳米金生物合成Trichoderma sp.催化特性生物相容性
The biosynthesis of gold nanoparticles by Trichoderma sp. WL-Go induced by different metal ions
LU Zhiyu
 , LI Xuanying, FAN Shuling, WANG Rouyi, ZHANG Henglin, QU Yuanyuan
, LI Xuanying, FAN Shuling, WANG Rouyi, ZHANG Henglin, QU Yuanyuan

Key Laboratory of Industrial Ecology and Environmental Engineering(Ministry of Education), School of Environmental Science and Technology, Dalian University of Technology, Dalian 116024
Received 4 August 2019; received in revised from 7 September 2019; accepted 7 September 2019
Abstract: Biosynthesis of gold nanoparticles has been considered to be an environmentally friendly, economical and efficient synthetic route, which has attracted increasing attentions in recent years. It is generally believed that the synthesis of AuNPs by microorganisms is a spontaneous detoxification process through some biological macromolecules. Previous studies have shown that some heavy metal ions could affect the extracellular enzyme activity of the microorganism and its ability to synthesize AuNPs. Therefore, in this study, we chose the fungus Trichoderma sp. WL-Go to explore the effects of different metal ions on the AuNPs synthesis. The results show that Co2+, Al3+, Zn2+, Sn2+ and Ni2+ could promote the synthesis of AuNPs, while there were no significant changes in the concentration and transformation of AuNPs synthesized by Pb2+, Cu2+ and Fe3+-induced strains. In addition, AuNPs synthesized by Co2+-induced strain exhibited obvious agglomeration. Result also shows that the catalytic properties of AuNPs synthesized by strains WL-Go induced with Sn2+ and Pb2+ were improved. Finally, Gram-positive bacteria Arthrobacter sp. W1 and Gram-negative bacteria Escherichia coli BL21 (DE3) were selected, and further proved that the AuNPs synthesized by different metal ions induced WL-Go strains exhibited good biocompatibility. Overall, this study provides new insights into the potential industrial application of AuNPs.
Keywords: gold nanoparticlesbiosynthesisTrichoderma sp.catalytic characteristicsbiocompatibility
1 引言(Introduction)纳米金(AuNPs), 由于其特殊的结构和表面性能及良好的稳定性, 具有量子尺寸效应、小尺寸效应、表面效应及宏观量子隧道效应等特点(Lee et al., 2010).合成纳米金的方法有物理法、化学法和生物法等.其中物理法能耗高, 所需仪器复杂(Narayanan et al., 2010).化学法则会使用有毒的化学还原剂, 不符合当下绿色化学的理念(Sathish et al., 2011).与这两种方法相比, 生物法合成纳米金具有产率高、分散性好, 且合成过程中无需添加还原剂和封端剂等特点, 受到了广泛关注(Suresh et al., 2010).
真菌是生物法合成过程中常用的生物资源(Das et al., 2012).真菌能够分泌大量的蛋白酶、还原酶及次级代谢产物;耐受金离子的毒性, 合成的纳米金颗粒分散性好, 适合于工业化应用(厉舒祯等, 2016).但目前可合成纳米金的真菌资源仍相对匮乏, 且对纳米金合成速率、形貌特征、粒径大小等特征的调控仍具有不确定性, 限制了生物纳米金的工业化应用.微生物合成纳米金的过程被认为是一种面对重金属压力时的脱毒机制, 且已经有研究表明, 低浓度重金属如Cd2+、Cu2+、Al3+、Pb2+、Zn2+等会使微生物胞外酶活性有所增加(Kredics et al., 2001).而通常这些胞外酶参与了纳米金合成的关键步骤, 因此探究金属离子的诱导对于纳米金的合成调控, 对于拓宽纳米金的工业化应用前景有着重要意义.
本实验室前期筛选得到一株木霉菌Trichoderma sp. WL-Go, 相关研究已证明其具有优良的纳米金合成能力(沈文丽, 2018).本研究在此基础上, 选取不同金属离子对菌株WL-Go进行诱导, 利用诱导后的菌株合成纳米金颗粒.在本实验中考察不同金属离子诱导后菌株合成纳米金的浓度、形貌以及粒径大小.并选择4-硝基苯酚(4-NP)为目标底物考察不同金属离子诱导后合成的纳米金的催化速率, 并对其生物相容性进行探讨, 为生物合成纳米金的工业化应用提供理论依据.
2 材料与方法(Materials and methods)2.1 实验材料2.1.1 菌株木霉菌Trichoderma sp. WL-Go是本实验室前期从反应器污泥中分离得到的, 由中国微生物菌种保藏管理委员会普通微生物中心保存, 保藏号为CGMCC 10456.GenBank数据库也收录其26S rRNA基因序列(500 bp), 收录号为KP676894 (Qu et al., 2017).革兰氏阴性菌E. coli BL21 (DE3)与革兰氏阳性菌Arthrobacter sp. W1均为实验室储存用菌.
2.1.2 主要实验试剂与仪器本实验所涉及到的主要试剂如下:4-NP, 分析纯, 天津市科密欧化学试剂有限公司;氯金酸(HAuCl4·3H2O), 分析纯, 大连美仑生物技术有限公司;其他试剂均为分析纯及以上纯度.
本实验所使用的主要仪器有:JY92-IIN型超声波细胞破碎仪;Tecnai G220 S-Twin型透射电子显微镜(TEM, 美国);Optima 2000DV型电感耦合等离子发射光谱仪(ICP-OES, 美国);Avanti J-30型高速低温冷冻离心机.
2.2 实验方法2.2.1 菌株培养Trichoderma sp. WL-Go采用改良马丁培养基培养, 配方为:KH2PO4 1.0 g·L-1, MgSO4·7H2O 0.5 g·L-1, (NH4)2SO4 1.0 g·L-1, 葡萄糖5.0 g·L-1.接菌量5% (v/v).改良马丁培养基在115 ℃的条件下灭菌15 min后使用.
菌株E. coli BL21 (DE3)、菌株Arthrobacter sp. W1采用LB培养基, 配方为:蛋白胨10.0 g·L-1, 酵母浸粉5.0 g·L-1和NaCl 10.0 g·L-1, pH 7.0.在液体培养基中加入2%琼脂粉配制固体培养基.LB培养基在121 ℃的条件下灭菌20 min后使用.
2.2.2 不同金属离子诱导对菌株WL-Go合成纳米金影响考察不同金属离子诱导对菌株WL-Go合成纳米金的影响.向菌液中加入预先配制的金属离子的母液(Cu2+、Co2+、Pb2+、Fe3+、Al3+、Sn2+、Ni2+、Zn2+, 浓度均为10 mmol·L-1)并调节金属离子终浓度为0.1 mmol·L-1;培养菌株至稳定期后过滤, 用超纯水清洗菌体3次后重悬, 调节菌液终浓度为100 g·L-1;向该体系加入一定体积的氯金酸溶液使其终浓度为1 mmol·L-1, 在150 r·min-1、30 ℃的避光摇床中培养大约7 d时间.
2.2.3 纳米金的分离及表征将培养后的菌丝-纳米金混合物超声破碎30 min;在3000 r·min-1的条件下离心5 min, 取上清液, 即得到生物合成纳米金;随即利用透射电子显微镜观察在400目铜网上分离得到的纳米金的粒径及形貌;利用电感耦合等离子发射光谱仪对合成的纳米金的浓度进行表征.
2.2.4 不同金属离子诱导合成纳米金催化特性研究以4-NP为目标底物, 探究经过不同金属离子诱导后的菌株WL-Go合成的纳米金的催化活性.将400 μL硼氢化钠(NaBH4, 50 mmol·L-1)溶液和100 μL 4-NP (2 mmol·L-1)混合后, 加入10 μL合成的纳米金溶液, 用超纯水定容至2 mL.全过程利用UV-vis分光光度计监测并在400 nm波长处进行定点扫描.
2.2.5 不同金属离子诱导下的合成纳米金的生物相容性探讨利用革兰氏阴性菌E. coli BL21 (DE3)和革兰氏阳性菌Arthrobacter sp. W1考察不同金属离子诱导合成的纳米金的生物相容性.采用LB固体培养基, 吸取200 μL处于对数生长期末期的菌液进行平板涂布.将灭菌后的滤纸片放置在涂有菌液的平板上, 并分别滴加各组纳米金(所加纳米金浓度如表 1所示), 观察平板相应位置上是否出现抑菌圈.
表 1(Table 1)
| 表 1 不同金属离子诱导WL-Go合成纳米金的浓度和转化率 Table 1 The concentration and transformation rate of AuNPs using strain WL-Go by different metal ions-induced | ||||||||||||||||||||||||||||||
表 1 不同金属离子诱导WL-Go合成纳米金的浓度和转化率 Table 1 The concentration and transformation rate of AuNPs using strain WL-Go by different metal ions-induced
| ||||||||||||||||||||||||||||||
3 结果与讨论(Results and discussion)3.1 不同金属离子诱导菌株WL-Go合成纳米金的浓度由表 1可知, 菌株WL-Go经过经过Al3+、Fe3+、Ni2+、Co2+、Cu2+、Zn2+、Sn2+以及Pb2+等金属离子诱导后依旧具备合成纳米金的能力.且经Co2+、Al3+、Zn2+、Sn2+、Ni2+等金属离子诱导后, 菌株WL-Go合成纳米金的能力均有所提升.推测在此过程中, 菌株WL-Go中与重金属抗性相关的基因将上调表达, 合成相应的生物还原蛋白和酶以抵抗重金属毒性.但并不是所有金属离子诱导均对菌株WL-Go合成纳米金起积极促进作用, 例如Pb2+、Cu2+、Fe3+与对照组相比, 其合成的纳米金浓度及转化率都变化不大.
3.2 不同金属离子诱导菌株WL-Go合成纳米金的形貌及粒径分析通过TEM探究菌株WL-Go在经过不同金属离子诱导后合成纳米金的形貌尺寸特征变化(图 1).经过不同金属离子诱导后, 菌株WL-Go合成的纳米金多为伪球形和球形, 与对照组相比并无特殊的变化.而Co2+诱导菌株合成的纳米金呈现肉眼可见的团簇状, 发生明显的团聚现象.目前, 对于Co2+的诱导对真菌分泌蛋白量的多少与合成纳米粒子稳定性的关系尚未见报道, 但大量文献已证实附着在生物纳米颗粒表面的生物大分子物质作为纳米粒子合成的稳定剂或封端剂对纳米粒子的稳定性起着重要作用(Sanghi et al., 2009; Paul et al., 2016).因此结合本实验相关现象推测这是由于菌株经Co2+诱导后分泌的类似稳定剂、封端剂等生物活性物质有所减少, 降低了生物合成纳米金的分散性.
图 1(Fig. 1)
 |
| 图 1 金属离子诱导菌株WL-Go合成的纳米金TEM图 Fig. 1TEM diagrams of AuNPs synthesized by strain WL-Go induced with metal ions |
从TEM图中随机选取250粒纳米金, 利用粒径分析软件Nano Measure 1.2对金属离子诱导合成的纳米金进行粒径分析(图 2), 可见菌株WL-Go合成纳米金的平均粒径相比对照组均有一定增长.有研究报道, 微生物合成纳米金可能是微生物一种自发的脱毒机制, 当其面临重金属离子胁迫时, 通过分泌还原性物质及相关的酶, 将对微生物有毒害作用的Au3+还原为无毒的Au0 (Haiss et al., 2007).通过UV-vis和TEM粒径分析可知, 尽管Co2+、Fe3+、Ni2+、Sn2+及Cu2+等重金属离子诱导可促使菌株WL-Go合成更多数量的纳米金, 但合成的纳米金粒径也变大.推测重金属离子的诱导虽然增强了菌株WL-Go还原Au3+的能力, 但分泌的封端剂可能减少, 进而导致合成的纳米金粒径有所增加.
图 2(Fig. 2)
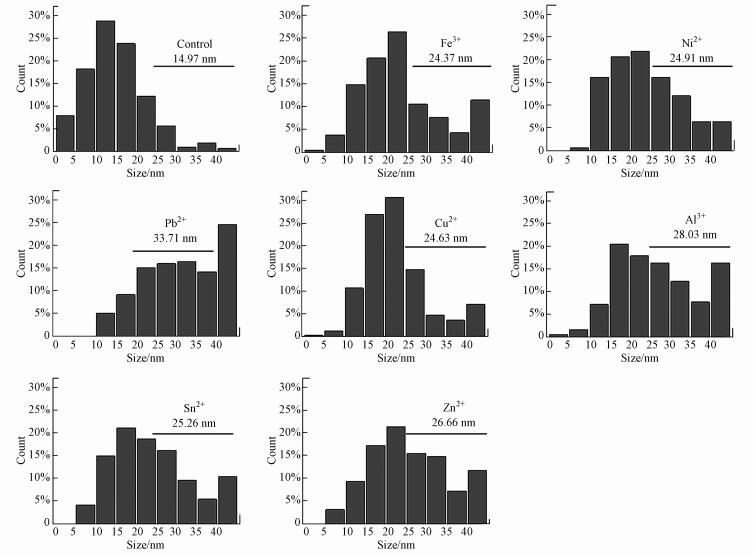 |
| 图 2 金属离子诱导菌株WL-Go合成纳米金的粒径分析 (数字为各组平均粒径) Fig. 2Particle size of AuNPs synthesized by metal ions-induced strain WL-Go |
3.3 不同金属离子诱导对菌株WL-Go合成纳米金催化特性的影响以4-NP为目标底物, 通过其与NaBH4的氧化还原反应, 探究不同金属离子诱导合成的纳米金的催化能力.各组实验结果如图 3a所示.因为反应体系中4-NP的浓度远远小于NaBH4, 因此可认为该反应在动力学上近似为一级反应.经过动力学拟合, 计算得到各组的催化速率常数, 汇总到表 2.由计算结果可知不同金属离子诱导合成后的纳米金的催化特性以及催化速率变化趋势均不相同.其中经过Pb2+和Sn2+诱导合成的纳米金催化速率明显加快;而经过Cu2+、Co2+、Zn2+的诱导, 菌株WL-Go合成纳米金的催化速率相比于对照组却有所下降.
图 3(Fig. 3)
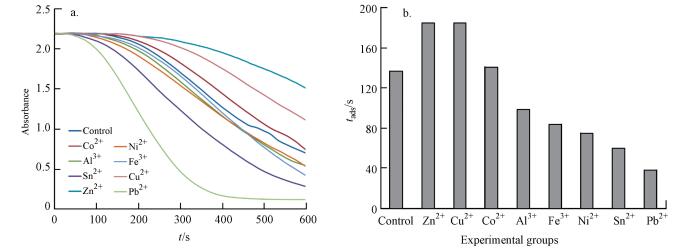 |
| 图 3 金属离子诱导菌株WL-Go合成纳米金催化还原4-NP (a.纳米金催化还原4-NP曲线;b.纳米金吸附4-NP的时间tads) Fig. 3Reduction of 4-nitrophenol catalyzed by AuNPs synthesized by strains WL-Go induced with metal ions (a. Reduction curves of 4-nitrophenol catalyzed by AuNPs; b. Time variation of 4-NP adsorbed by AuNPs) |
表 2(Table 2)
| 表 2 金属离子诱导WL-Go合成纳米金催化还原4-NP的催化速率常数 Table 2 Catalytic reduction rate of 4-nitrophenol using strain WL-Go by different metal ions-induced | ||||||||||||||||||||
表 2 金属离子诱导WL-Go合成纳米金催化还原4-NP的催化速率常数 Table 2 Catalytic reduction rate of 4-nitrophenol using strain WL-Go by different metal ions-induced
| ||||||||||||||||||||
Kaur等发现在实验中随着球形金共催化剂负载尺寸的减小以及表面体积比(S/V)的增大, TiO2的光催化活性得到了显著提高.导致这个现象产生的原因为不同尺寸的纳米金颗粒与TiO2相互作用在不同程度上诱导光激发电荷转移过程, 导致光催化活性的差异(Kaur et al., 2012).因此在球形纳米颗粒中, 粒径越小, 比表面积越大, 越利于其反应的进行, 催化能力也越强.除此之外, 纳米金的表面性质也是影响催化速率的一个重要因素.尤其在生物法合成过程中, 因为合成纳米金的表面常附着有难以完全分离的生物质, 纳米金的最终催化能力可能因此受到较大影响.相关研究表明随着真菌提取物浓度的增加, 合成的纳米金浓度也增大, 但附着在其表面的生物大分子数量也有所增加, 使其光催化活性降低(Gautam et al., 2013).Das等在研究霉菌合成纳米金的过程中, 认为在催化反应中, 反应物总会先吸附在纳米金表面, 其吸附时间(记作tads)会作为催化反应的一个阶段影响催化反应的总速率(Das et al., 2012).以99%的初始吸光度为临界条件, 将不同金属离子诱导合成的纳米金催化反应的吸附时间绘制为柱状图 3b.不难发现, 经Pb2+诱导合成的纳米金吸附时间最短, 推测是因为其表面结构可能更适合反应物的吸附.
3.4 不同金属离子诱导对菌株WL-Go合成纳米金的生物相容性为验证金属离子诱导的菌株WL-Go合成的纳米金的生物相容性, 本实验选取革兰氏阴性菌E. coli BL21 (DE3)和革兰氏阳性菌Arthrobacter sp. W1进行实验.通过在琼脂培养基中的圆纸片上滴加定量的纳米金, 观测在圆纸片周围是否产生抑菌圈, 探究合成的纳米金的生物相容性效果.实验结果表明, 在滴加的纳米金的圆片周围未发现明显的抑菌圈(图 4), 说明经过不同金属离子诱导后的菌株WL-Go合成的纳米金具有较好的生物相容性.此外有相关报道显示, 纳米材料由于其极小的尺寸, 对微生物存在一定的毒性:如纳米银对细菌存在毒害作用;在污水处理领域, 许多含有碳基官能团的纳米材料对生物的生长造成不良影响(Sankar et al., 2013;沈文丽等, 2015).本实验合成的纳米金相对一些具有毒性的纳米材料, 能够在生物光热反应、药物传递、抗癌治疗等医学领域拥有更好的应用前景.
图 4(Fig. 4)
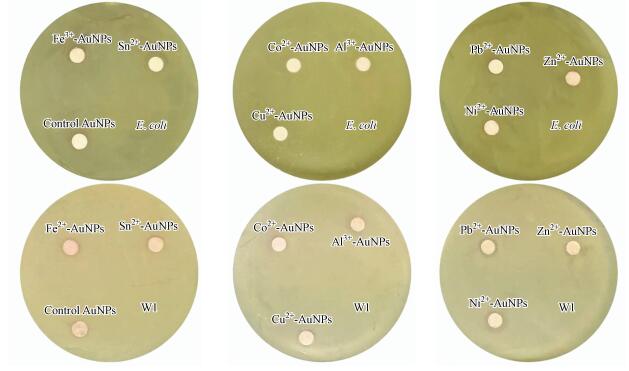 |
| 图 4 金属离子诱导菌株WL-Go合成纳米金的生物相容性 Fig. 4Biocompatibility of AuNPs synthesized by strain WL-Go induced with metal ions |
4 结论(Conclusions)1) 菌株WL-Go在不同金属离子诱导后仍具有合成纳米金的能力, 且合成的纳米金形貌发生了一定的变化.其中, 经Co2+、Al3+、Zn2+、Sn2+、Ni2+等金属离子诱导后, 菌株WL-Go合成纳米金的能力均有所提升, 而Pb2+、Cu2+、Fe3+与对照组相比, 其合成的纳米金浓度及转化率都变化不大.其中Co2+诱导后菌株合成的纳米金有明显的团聚现象.
2) 考察金属离子诱导菌株WL-Go合成纳米金的催化特性, 结果表明, 不同金属离子对生物合成纳米金催化还原4-NP的能力产生影响.结果表明, Pb2+和Sn2+诱导菌株WL-Go合成的纳米金催化速率得到显著提升, 特别是Pb2+诱导合成的纳米金吸附时间最短, 催化速率最快.
3) 抗菌实验表明, 不同金属离子诱导菌株WL-Go合成的纳米金对革兰氏阴性菌E. coli BL21 (DE3)和革兰氏阳性菌Arthrobacter sp. W1均无明显的抗菌活性, 具有良好的生物相容性.
参考文献
| Ahmad A, Senapati S, Khan M I, et al. 2003. Extracellular biosynthesis of monodisperse gold nanoparticles by a novel extremophilic actinomycete, Thermomonospora sp.[J]. Langmuir, 19(8): 3550-3553. DOI:10.1021/la026772l |
| Das S K, Liang J, Schmidt M, et al. 2012. Biomineralization mechanism of gold by zygomycete fungi Rhizopous oryzae[J]. ACS Nano, 6(7): 6165-6173. DOI:10.1021/nn301502s |
| Du L W, Xian L, Feng J X. 2011. Rapid extra-/intracellular biosynthesis of gold nanoparticles by the fungus Penicillium sp.[J]. Journal of Nanoparticle Research, 13(3): 921-930. DOI:10.1007/s11051-010-0165-2 |
| Gautam K, Naika P, Manjari M. 2013. Green synthesis of Au/TiO2 for effective dye degradation in aqueous system[J]. Chemical Engineering Journal, 9: 492-497. |
| Gericke M, Pinches A. 2006. Biological synthesis of metal nanoparticles[J]. Hydrometallurgy, 83(1/4): 132-140. |
| Haiss W, Thanh N T K, Aveyard J, et al. 2007. Determination of size and concentration of gold nanoparticles from UV-Vis spectra[J]. Analytical Chemistry, 79(11): 4215-4221. DOI:10.1021/ac0702084 |
| Kaur R, Pal B. 2012. Size and shape dependent attachments of Au nanostructures to TiO2 for optimum reactivity of Au-TiO2 photocatalysis[J]. Journal of Molecular Catalysis A:Chemical, 355: 39-43. DOI:10.1016/j.molcata.2011.11.022 |
| Kredics L, Antal Z, Manczinger L, et al. 2001. Breeding of mycoparasitic Trichoderma strains for heavy metal resistance[J]. Letters in Applied Microbiology, 33(2): 112-116. DOI:10.1046/j.1472-765x.2001.00963.x |
| Lee Y, Miguel A G, Natalie A F H. 2010. Synthetic tuning of the catalytic properties of Au-Fe3O4 nanoparticles[J]. Angewandte Chemie, 7(7): 1271-1274. |
| Li C, Xu D, Zhao M, et al. 2014. Production optimization, purification, and characterization of a novel acid protease from a fusant by Aspergillus oryzae and Aspergillus niger[J]. European Food Research & Technology, 238(6): 905-917. |
| 厉舒祯, 沈文丽, 刘洋荧, 等. 2016. 真菌介导的纳米金合成及其应用研究进展[J]. 环境科学与技术, 39(9): 82-87. |
| Mishra A N, Bhadauria S, Gaur M S, et al. 2010. Extracellular microbial synthesis of gold nanoparticles using fungus Hormoconis resinae[J]. Journal of Metals, 62(11): 45-48. |
| Narayanan K B, Sakthivel N. 2010. Biological synthesis of metal nanoparticles by microbes[J]. Advances in Colloid and Interface Science, 156(1/2): 1-13. |
| Paul B, Bhuyan B, Purkayastha D D, et al. 2016. Photocatalytic and antibacterial activities of gold and silver nanoparticles synthesized using biomass of Parkia roxburghii leaf[J]. Journal of Photochemistry and Photobiology B:Biology, 154: 1-7. DOI:10.1016/j.jphotobiol.2015.11.004 |
| Qu Y Y, Shen W L, Pei X F, et al. 2017. Biosynthesis of gold nanoparticles by Trichoderma sp. WL-Go for azo dyes decolorization[J]. Journal of Environmental Sciences, 6: 79-86. |
| Sanghi R, Verma P. 2009. Biomimetic synthesis and characterisation of protein capped silver nanoparticles[J]. Bioresource Technology, 100(1): 501-504. DOI:10.1016/j.biortech.2008.05.048 |
| Sankar R, Karthik A, Prabu A, et al. 2013. Origanum vulgare mediated biosynthesis of silver nanoparticles for its antibacterial and anticancer activity[J]. Colloids and Surfaces B:Biointerfaces, 108: 80-84. DOI:10.1016/j.colsurfb.2013.02.033 |
| Sathish K, Arumugam P, et al. 2011. Synthesis of gold nanoparticles:an ecofriendly approach using Hansenula anomala[J]. ACS Applied Materials & Interfaces, 3(5): 1418-1425. |
| 沈文丽. 2018.不同真菌合成纳米金的特性及其调控[D].大连: 大连理工大学 |
| 沈文丽, 马桥, 李会杰, 等. 2015. 纳米材料对污水处理厂的生态效应研究进展[J]. 环境科学与技术, 38(7): 98-102. |
| Song J Y, Jang H K, Kim B S. 2009. Biological synthesis of gold nanoparticles using Magnolia kobus and Diopyros kaki leaf extracts[J]. Process Biochemistry, 44(10): 1133-1138. DOI:10.1016/j.procbio.2009.06.005 |
| Suresh A K, Pelletier D A, Wang W, et al. 2011. Biofabrication of discrete spherical gold nanoparticles using the metal-reducing bacterium Shewanella oneidensis[J]. Acta Biomaterialia, 7(5): 2148-2152. DOI:10.1016/j.actbio.2011.01.023 |
