全文HTML
--> --> --> 苯酚是众多化工反应的中间体,是分布最广的酚类挥发性有机物之一,因其具有长效性、生物累积性和强致癌性,被列入优先控制污染物[1-2]。利用微生物降解苯酚二次污染小[3],已逐渐成为处理含酚废水的主要方法。目前已发现多种苯酚降解菌,如假单胞菌(Pseudomonas adaceae)[4-5]、芽孢杆菌(Bacillus)[6-7]、不动杆菌(Acinetobacter)[8-9]、葡萄球菌(Staphylococcus)[10]、酵母菌(Yeast)[11-12]、红球菌(Rhodococcus)[13-14],然而这些降解菌大部分仅适于低浓度含酚废水降解,高浓度下因微生物生长受抑制导致降解能力下降。近年来也有高浓度苯酚降解菌的研究报道。周江亚等[15]筛选出假丝酵母菌,以1.5×108 cfu·mL?1接菌量降解 1.03 g·L?1苯酚,48 h降解率达99.1%;丁杰等[16]筛选出假丝酵母菌,以1%(体积比)接菌量,30 h可完全降解1 500 mg·L?1苯酚;魏炜等[17]筛选出酵母菌,以6%(体积比)接菌量降解1 500 mg·L?1苯酚,24 h降解率达86.44%。微生物燃料电池(microbial fuel cell, MFC)利用附着在阳极表面的产电菌氧化分解有机物产生电子,在降解污染物同时还达到产电效果[18-19]。陈柳柳等[20]以葡萄糖和苯酚为双底物构建MFC,当苯酚贡献COD为200 mg·L?1时,苯酚降解率为99.9%,库仑效率为7.2%。汪家权等[21]以MFC降解400 mg·L?1苯酚,35 ℃下降解率达88%,输出电压280 mV,功率密度达30 mW·m?2。产电微生物作为MFC核心也受到广泛关注,已报道的产电菌多达数十种,其中研究较多的有希瓦式菌(Shewanella)[22-24],假单胞菌(Pseudomonas adaceae)[25]等,但有关真菌的报道较少。殷赟等[26]在2010年首次发现酒精酵母菌(Saccharomyces cerevisiae)可用于MFC产电,2015年LEE等[27]发现假丝酵母菌(Candida)接种MFC可产生200~250 mV的电压。产电微生物消耗分解有机碳源是MFC运行的基础[19],以苯酚为唯一碳源筛选具有高效降解性的产电菌株将为苯酚废水处理与能源节约提供新思路。
本研究以上海海滨污水处理厂进样区污泥为底物构建MFC,从阳极生物膜上分离驯化一株可降解高浓度苯酚的产电菌ZY07,经鉴定后分析其生长特性及最适降酚条件,并对其产电性做初步探讨,以期为MFC处理高浓度苯酚废水提供参考。
1.1. 培养基及缓冲液
液体富集培养基:5 g·L?1牛肉膏、10 g·L?1蛋白胨、10 g·L?1 NaCl、500 mg·L?1苯酚、25 mmol·L?1柠檬酸铁,调节pH为7.2。筛选驯化苯酚培养基:0.2 g·L?1 NaCl、0.2 g·L?1 CaCl2、0.5 g·L?1 kH2PO4、0.5 g·L?1 K2HPO4、0.2 g·L?1 MgSO4、1 g·L?1 NH4NO3、苯酚(按实验所需加入),调节pH为7.2。分离纯化固体苯酚培养基为液体培养基中加入18 g·L?1琼脂粉。阳极缓冲液:1 000 mg·L?1苯酚、2.5 g·L?1 NaH2PO4、4 g·L?1 Na2HPO4、0.3 g·L?1 NH4Cl、0.5 g·L?1 Na2SO4、0.15 g·L?1 KCl。阴极缓冲液:50 mmol·L?1铁氰化钾、8 g·L?1 NaCl、0.2 g·L?1 KCl、1.44 g·L?1 NaH2PO4、0.24 g·L?1 K2HPO4。1.2. 产电微生物的富集
采用双室微生物燃料电池,阳极室接种污泥样品并加入500 mg·L?1苯酚,阴极室加入阴极缓冲液,待电池电压稳定时取出阳极室碳毡,用接种环刮取生物膜,重悬于无菌水。以4%接种量接种于液体富集培养基,30 ℃下培养24 h后稀释涂布于固体培养基,30 ℃下培养48 h,挑选形态和颜色差异明显的单菌落分别接种至富集培养基,培养3~5代得到若干纯菌株。1.3. 苯酚降解菌的驯化与筛选
将初步筛选后的纯菌株接种至富集培养基,培养至对数生长期取适量菌液离心,收集菌体重悬于生理盐水,接种于500 mg·L?1苯酚培养基,30 ℃、160 r·min?1下培养24 h,取0.1 mL菌液涂布于固体苯酚培养基培养24 h后观察固体平板,若有菌落生成,则以300 mg·L?1浓度梯度逐步提高培养基苯酚浓度继续驯化,若无菌落生成,则结束该菌株培养。经驯化筛选得优势纯菌株ZY07。1.4. 菌株的鉴定
菌液经稀释后涂布于固体苯酚培养基,30 ℃下培养48 h观察其菌落特征。采用扫描电镜观察其单一菌体表面形态。采用上游引物ITS1:TCCGTAGGTGAACCTGCGG和下游引物ITS4:TCCTCCGCTTATTGATATGC进行PCR扩增,由上海生工生物工程股份有限公司进行18S rRNA测序,测序结果提交至Gen bank中进行同源性序列比对,利用Mega软件构建系统发育树。1.5. 菌株降解苯酚特性
1)菌株生长曲线和苯酚降解曲线。取3%(所占苯酚培养基体积比,1%接菌量对应菌落总数为3×108 cfu·mL?1,干菌量为56.43 mg)对数生长期菌液以5 000 r·min?1速率离心,所得菌体重悬于生理盐水并接种于500 mg·L?1苯酚培养基,30 ℃、160 r·min?1下培养24 h,间隔2 h取样。2)最适苯酚降解条件及COD去除比较。取对数生长期菌液接种于苯酚培养基,160 r·min?1下培养进行单因素实验,初始苯酚质量浓度为100、300、500、800、1 100、1 400、1 700、2 000 mg·L?1;pH为3、4、5、6、7、8、9、10、11;温度为20、25、30、35、37、40 ℃;接菌量为1%、2%、3%、4%、5%、6%、7%、8%、9%、10%。另以500 mg·L?1苯酚作为研究对象,30 ℃、160 r·min?1下培养24 h,6 h间隔取样,比较苯酚降解率和COD去除率。以上实验均在摇瓶中进行,设置3组平行和3个无菌对照。
1.6. 菌株产电特性
1)菌株循环伏安分析。将菌株与碳毡在富集培养基中培养,用电化学工作站定期进行循环伏安扫描,通过氧化还原峰表征电化学活性。以负载对数生长期菌株的碳毡为工作电极,铂电极为对电极,Ag/AgCl电极为参比电极,扫描速率为100 mV·s?1,扫描电压为?0.8~0.8 V。2) MFC的菌株接种与运行。双室微生物燃料电池反应器阴阳极室均为100 mL,电极材料为碳毡。将菌液与阳极缓冲液按一定比例混合加入阳极室,阴极室加入阴极缓冲液,30 ℃下运行记录MFC电压变化。调节外接电阻阻值测量对应的输出电压,绘制极化曲线和功率密度曲线。
3)阳极碳毡扫描电镜。将稳定运行的MFC阳极碳毡取出,用叔丁醇和戊二醛法制备扫描电镜样品[28],用扫描电子显微镜在5.00 kV的加速电压下进行表面形态观察。
1.7. 分析测定方法
1)采用紫外分光光度法在600 nm波长处测定菌液吸光度(OD600)表示菌体生物量;用4-氨基安替比林直接分光光度法测定苯酚质量浓度[29];取4 mL菌液离心后弃掉上清液,加入4 mL无酚水超声萃取10 min,离心取上清液测定吸附苯酚质量浓度[30]。苯酚表观去除率、吸附率、被氧化损失率和降解率根据式(1)~式(4)计算。式中:η为表观去除率;C0为初始苯酚质量浓度,mg·L?1;C为反应后表观苯酚质量浓度,mg·L?1;α为吸附率;Cα为菌体萃取液中苯酚质量浓度,mg·L?1;Vm、Vn分别为萃取剂、取样体积,mL;β为被氧化损失率;Ct为氧化后苯酚质量浓度,mg·L?1;δ为微生物降解率。
2) MFC输出电压用数据采集器采集,电阻箱调节阻值。电流密度和功率密度根据式(5)和式(6)计算。
式中:I为电流密度,A·m?2;P为功率密度,mW·m?2;U为测量电压,V;R为外接电阻阻值,Ω;A为电极面积,m2。
2.1. 菌株的分离鉴定
筛选所得菌株ZY07的菌落形态如图1(a)所示。可见,菌落呈卵圆或椭圆状,边缘整齐,不透明乳白色。由扫描电镜图1(b)可见,菌体呈不透明椭圆状,颜色较为均一,且菌体之间相互黏接,可明显看到液泡存在。对菌株ZY07的18S rRNA片段进行PCR扩增,测序后将序列提交至Gen bank,序列号为(MZ373278)。序列进行同源性比对,选取模式菌株序列构建系统发育树如图2所示,可见,菌株ZY07与热带假丝酵母菌(Candida tropicalis)汇聚于同一分支中,且序列同源性高达100%。因此,菌株ZY07属于假丝酵母菌属(Candida)的热带假丝酵母菌(Candida tropicalis)。
2.2. 生物学特性
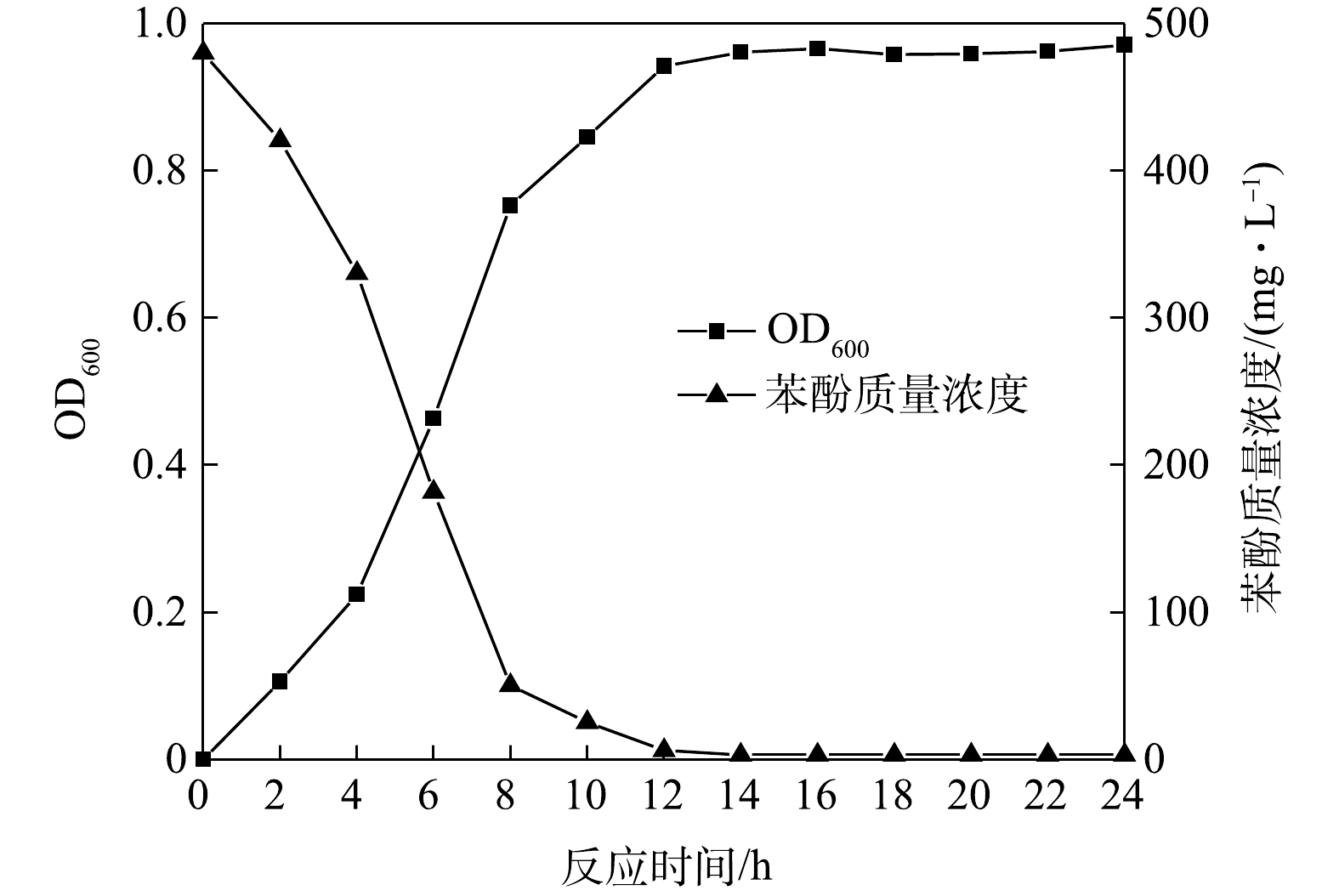
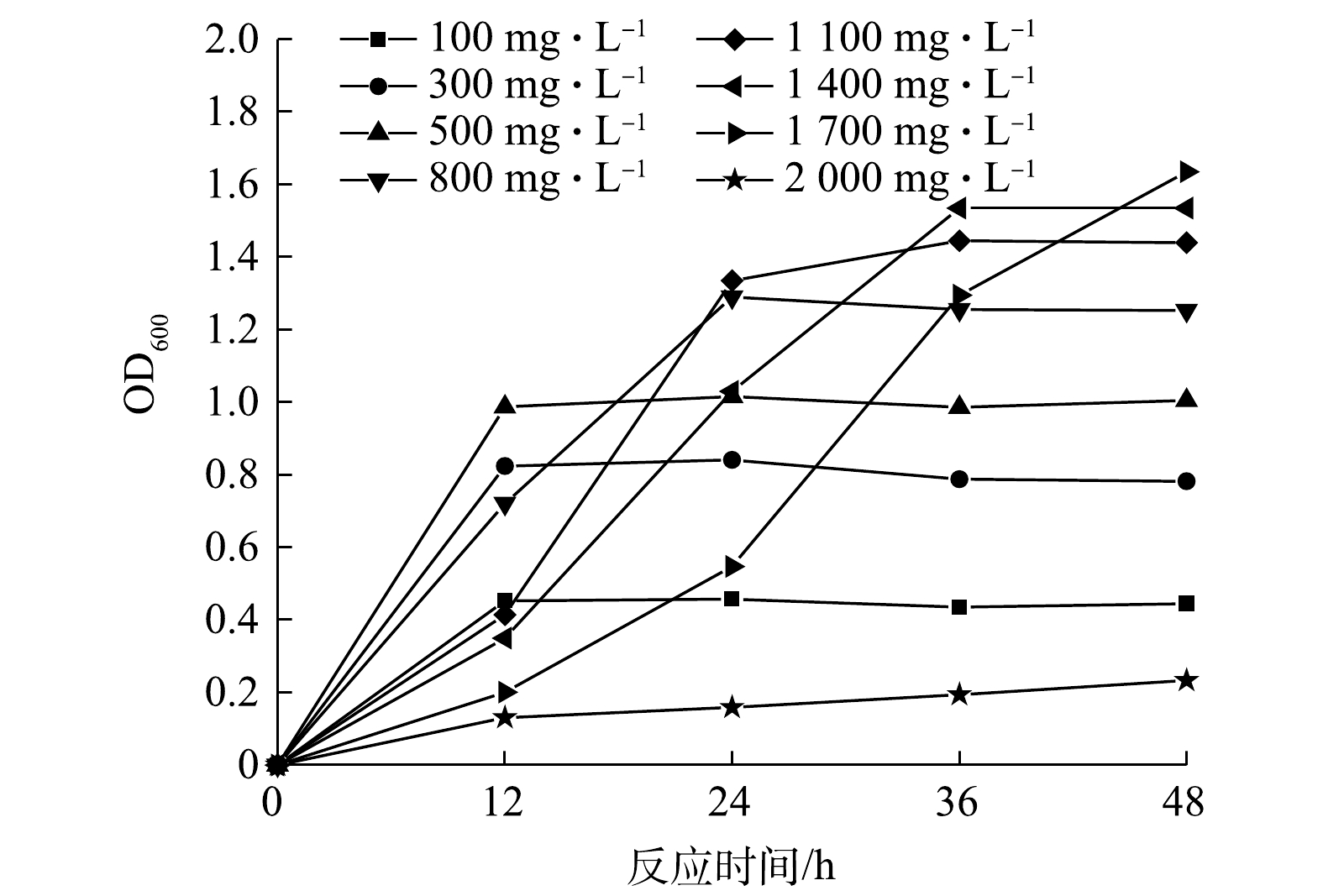
1)生长曲线和苯酚降解曲线。菌株ZY07的生长曲线和苯酚降解曲线如图3所示。对数生长期是研究菌株生物学特性的最佳时期。可见,ZY07约12 h结束对数生长期,期间内生长迅速且12 h后仍保持良好的生物量。当ZY07处于对数生长期时苯酚质量浓度迅速降低,仅12 h降解率达95.5%,说明菌株ZY07具备降解高浓度苯酚的潜力。2)初始浓度的影响。不同初始浓度下苯酚降解菌ZY07生物量变化如图4所示。在0~12 h,不同浓度苯酚对菌株产生显著影响。作为唯一碳源,苯酚质量浓度为300 mg·L?1和500 mg·L?1时对微生物生长起促进作用,生物量随苯酚浓度增加而增加,此时ZY07可以充分利用低浓度苯酚碳源获取营养[31]。但苯酚质量浓度低至100 mg·L?1时,因无法满足微生物需求导致生物量增长较小[32]。当苯酚质量浓度为800~2 000 mg·L?1时,ZY07生长受到抑制,2 000 mg·L?1时生长最缓,仅增长13%。苯酚质量浓度越高,毒害作用越强,微生物生长代谢越缓慢[33]。值得注意的是,ZY07并未因为苯酚浓度升高而停止生长,只是延长了缓慢生长期,当苯酚质量浓度为800~1 700 mg·L?1时,生长曲线大致呈S形,即使在1 700 mg·L?1时,ZY07也可在24~36 h内达到对数生长期。
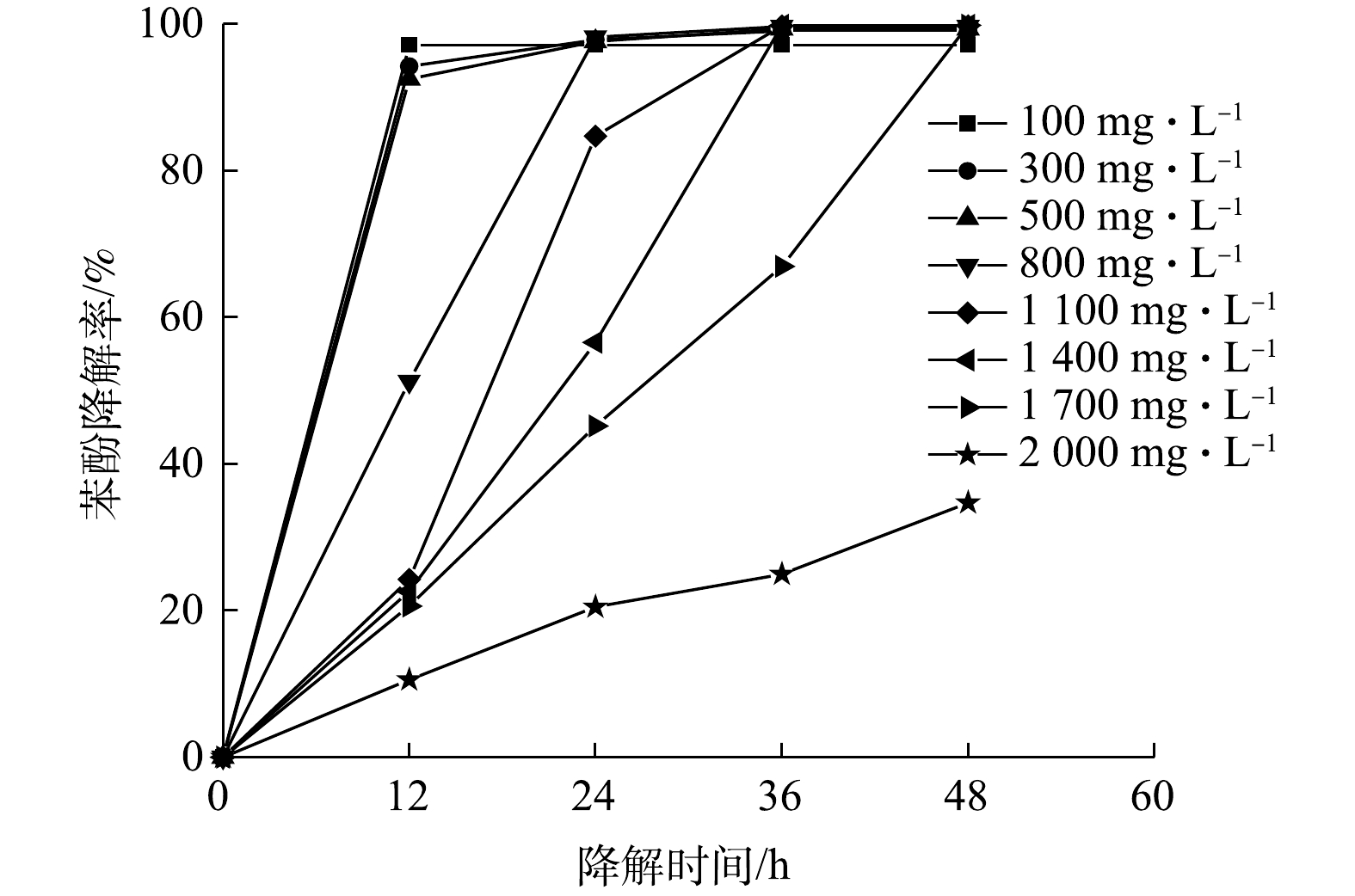
初始浓度对苯酚降解的影响如图5所示。可见,100、300和500 mg·L?1苯酚在12 h降解趋于完全,800 mg·L?1苯酚降解率约为50%,而1 100、1 400和1 700 mg·L?1苯酚降解率仅20%左右。对比图4和图5,100~1 700 mg·L?1时ZY07的生长和降解曲线变化呈一致趋势,降解率快速上升阶段与对数生长期相对应,且ZY07生长至稳定期时苯酚也达到最大程度降解。以上结果均说明,ZY07具有良好的耐酚性和降解高浓度苯酚特性。
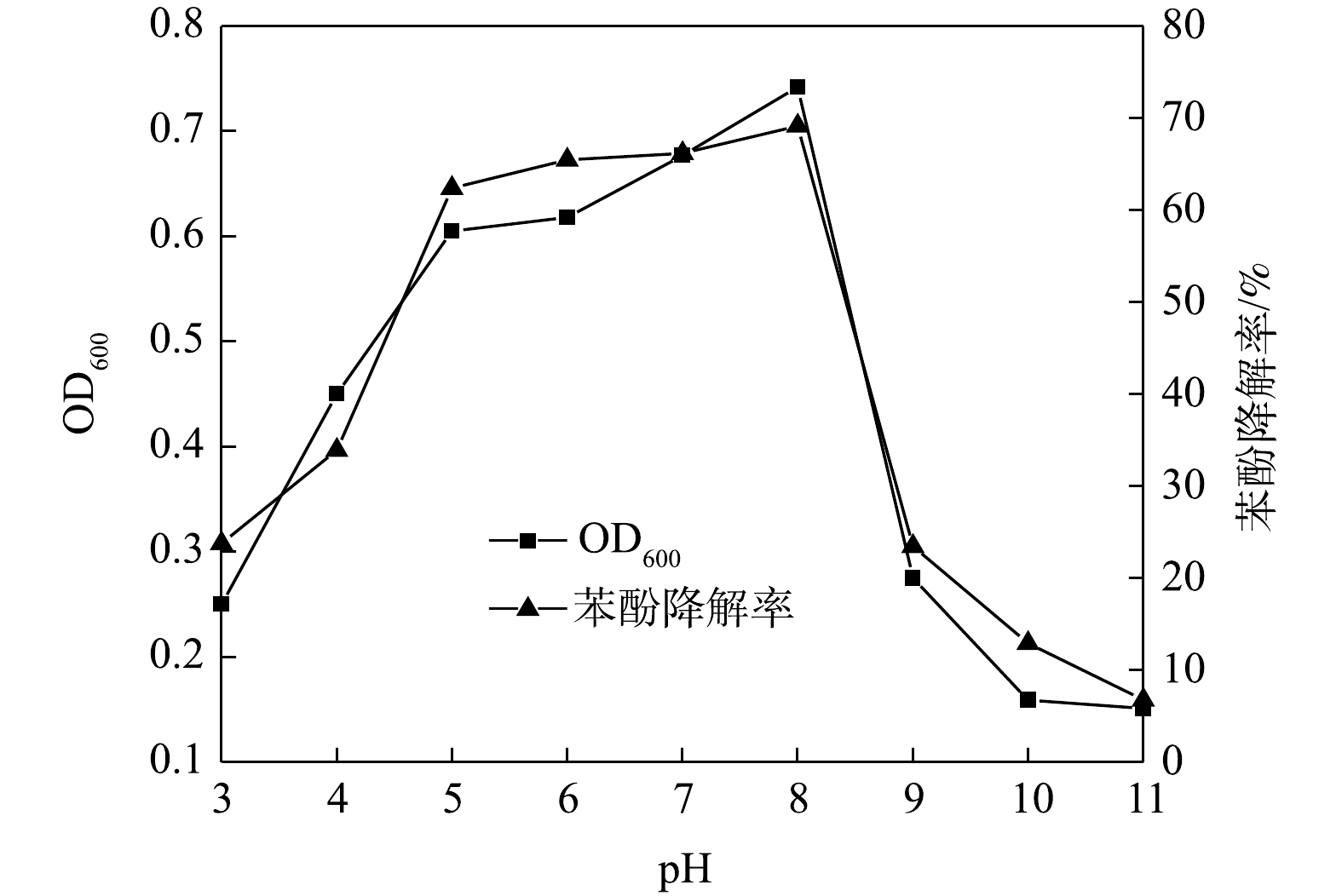
3) pH的影响。酸碱环境变化可影响微生物新陈代谢和生长状况[34]。如图6所示,随着pH的升高,ZY07生物量及苯酚降解率均呈现先上升后下降的趋势。pH的变化可影响微生物胞外酶活性,进而影响微生物生长及其对污染物的降解[35-36]。中性环境下ZY07的生物量和苯酚降解率显著提升,当pH为8时,培养9 h后ZY07生物量达到最高,苯酚降解率达69.1%。随着pH的进一步增大,ZY07生物量和苯酚降解率显著降低。当pH为11时,苯酚降解率仅6.8%。此外,还发现反应后菌液最终pH均有所降低,这是由于微生物降解苯酚过程中生成如羟基黏酸、酮基己二酸、酮基戊酸等有机酸的中间产物[37]。
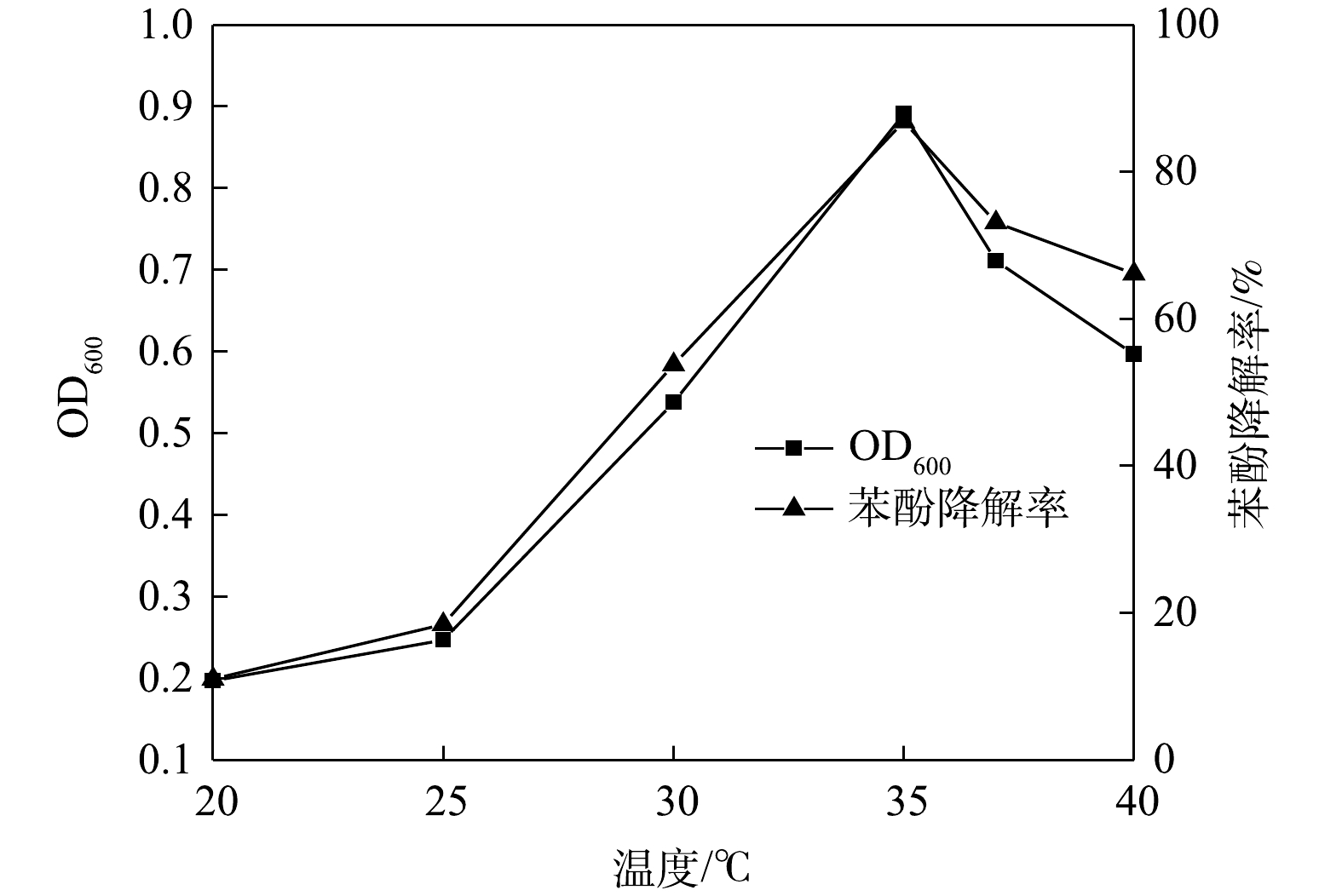
4)温度的影响。温度是影响微生物酶学性质的重要因素。由图7可见,不同温度下ZY07生物量与苯酚降解率的变化趋势较为一致;培养9 h后,35 ℃下ZY07的生物量和降解率均达到最大,苯酚降解率86.9%。20 ℃下ZY07生长最为缓慢,降解率仅11%,温度过低时微生物产酶活性受到抑制[38]。随着温度的提高,ZY07生物量和苯酚降解率不断上升。但当温度大于35 ℃时,生物量和降解率均明显降低,这是因为高温影响微生物酶活和酶促反应,从而影响有机物代谢[39]。
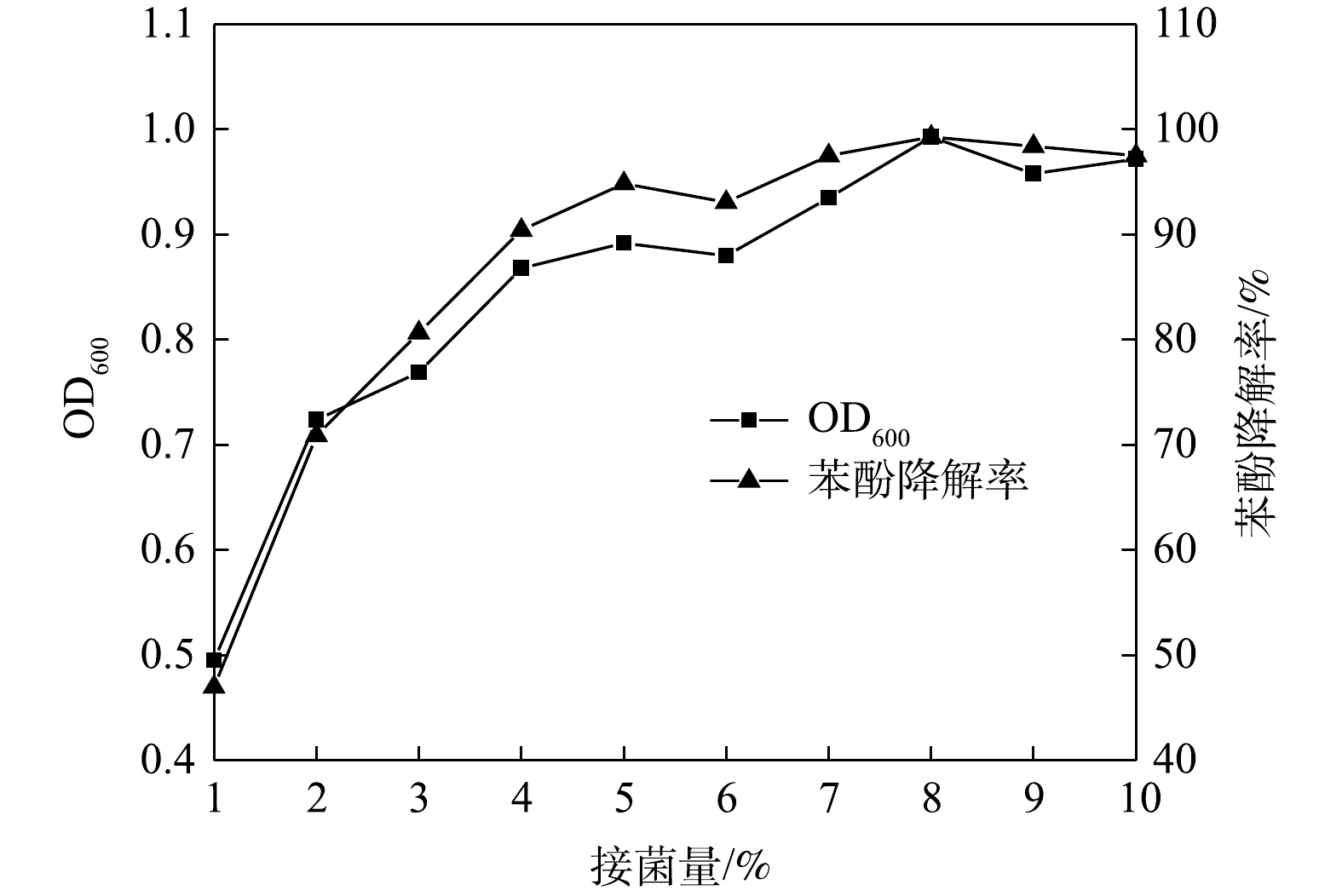
5)接菌量的影响。不同接菌量对ZY07的影响如图8所示。可见,生物量和降解率整体变化均呈上升趋势。当接菌量为2%~8%时,ZY07生物量持续增长,且以8%接菌量培养9 h后,苯酚降解率可达99.3%,故8%为ZY07降解苯酚的最适接菌量。接菌量继续增大时生物量和降解率略微降低,这可能是由于:当碳源量一定时,微生物之间竞争作用使其生长受到抑制[37]。
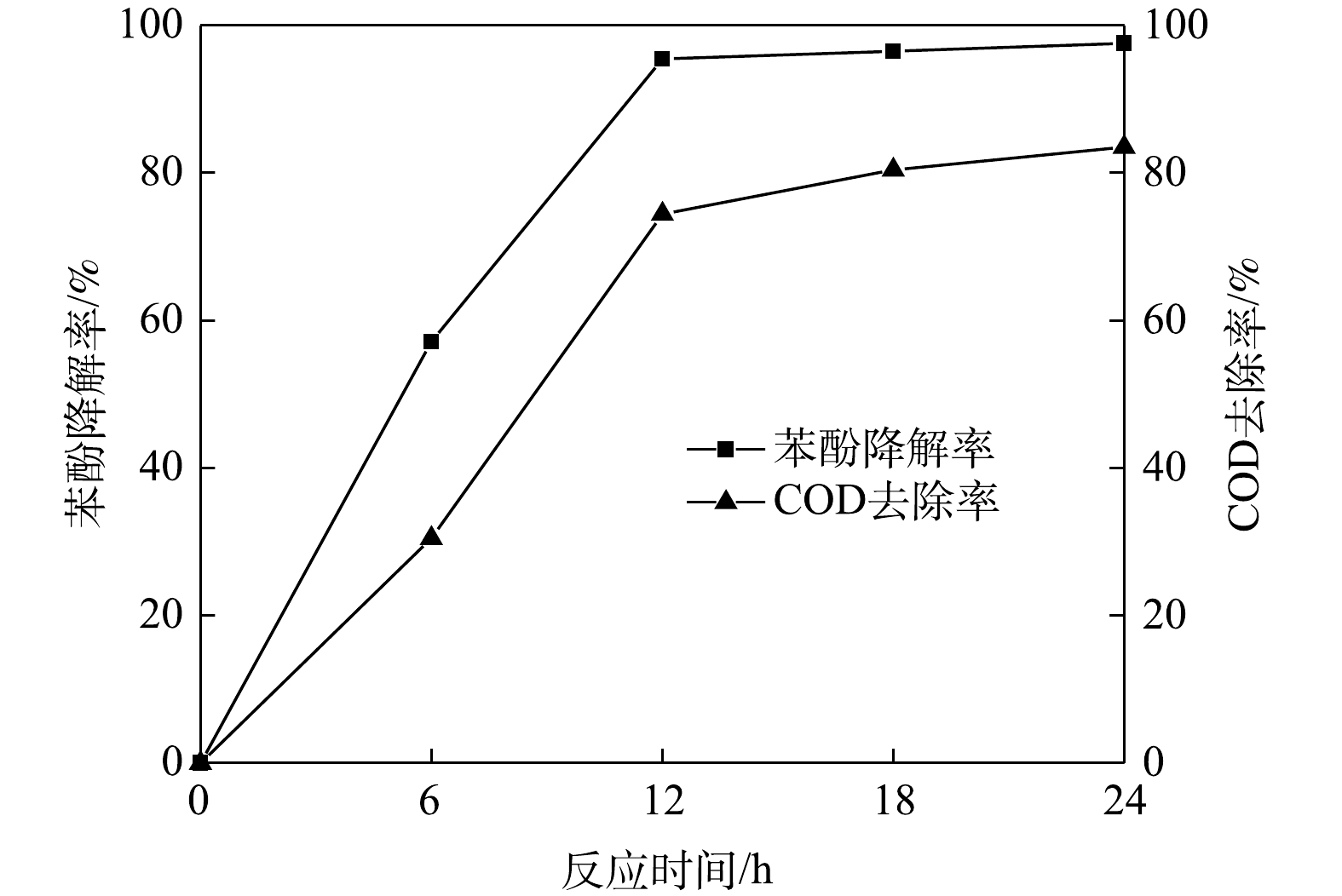
6)苯酚降解率和COD去除率对比结果如图9所示。可见,COD去除率小于苯酚降解率。培养12 h后,苯酚几乎降解完全,COD 去除率仅为74.5%;继续培养至24 h,苯酚降解率变化不大,COD 去除率仍不断上升,这说明苯酚降解完全时COD仍未完全去除。在降解过程中,有机酸等中间产物的存在使得COD去除率低于苯酚降解率[37]。
2.3. 产电特性
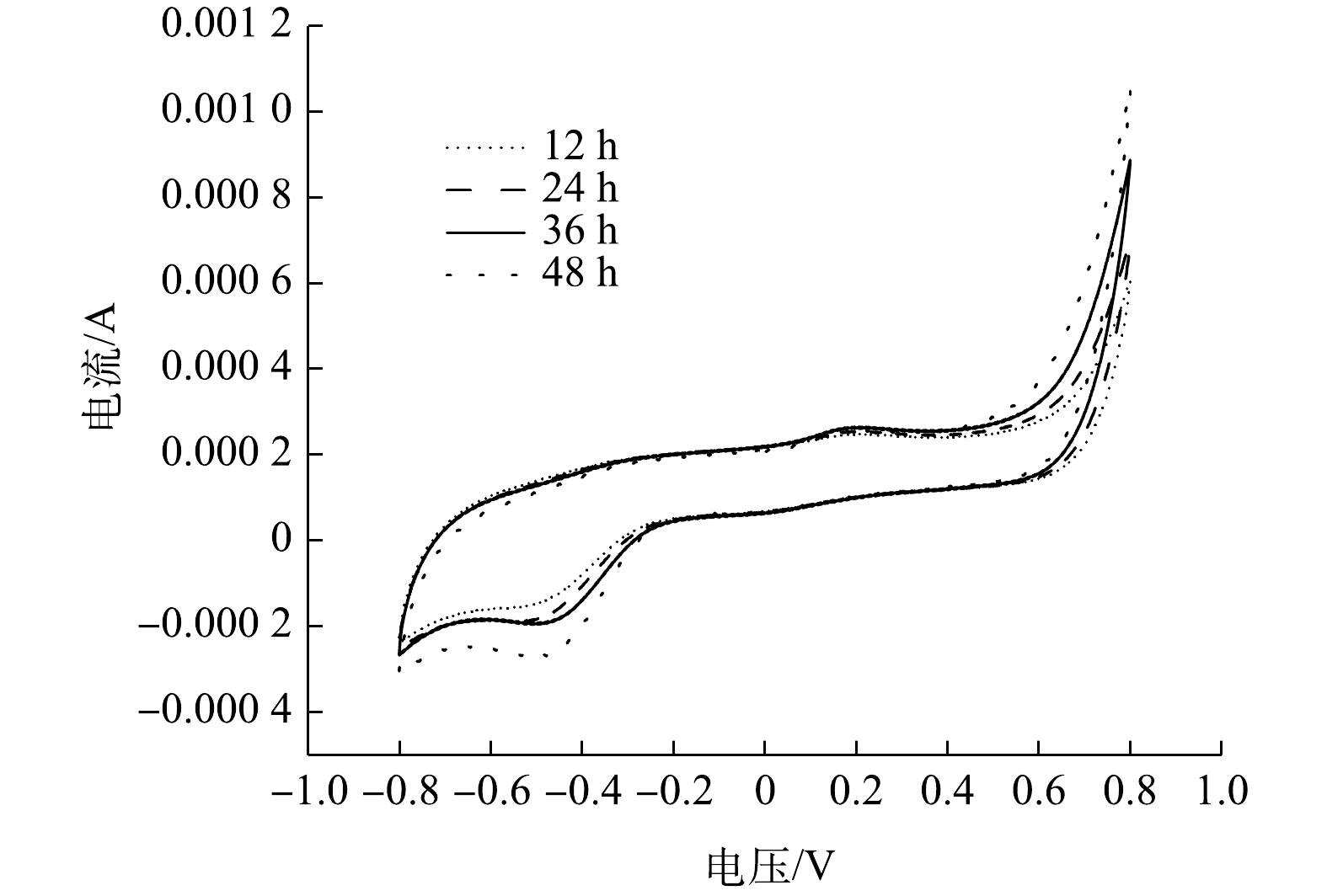
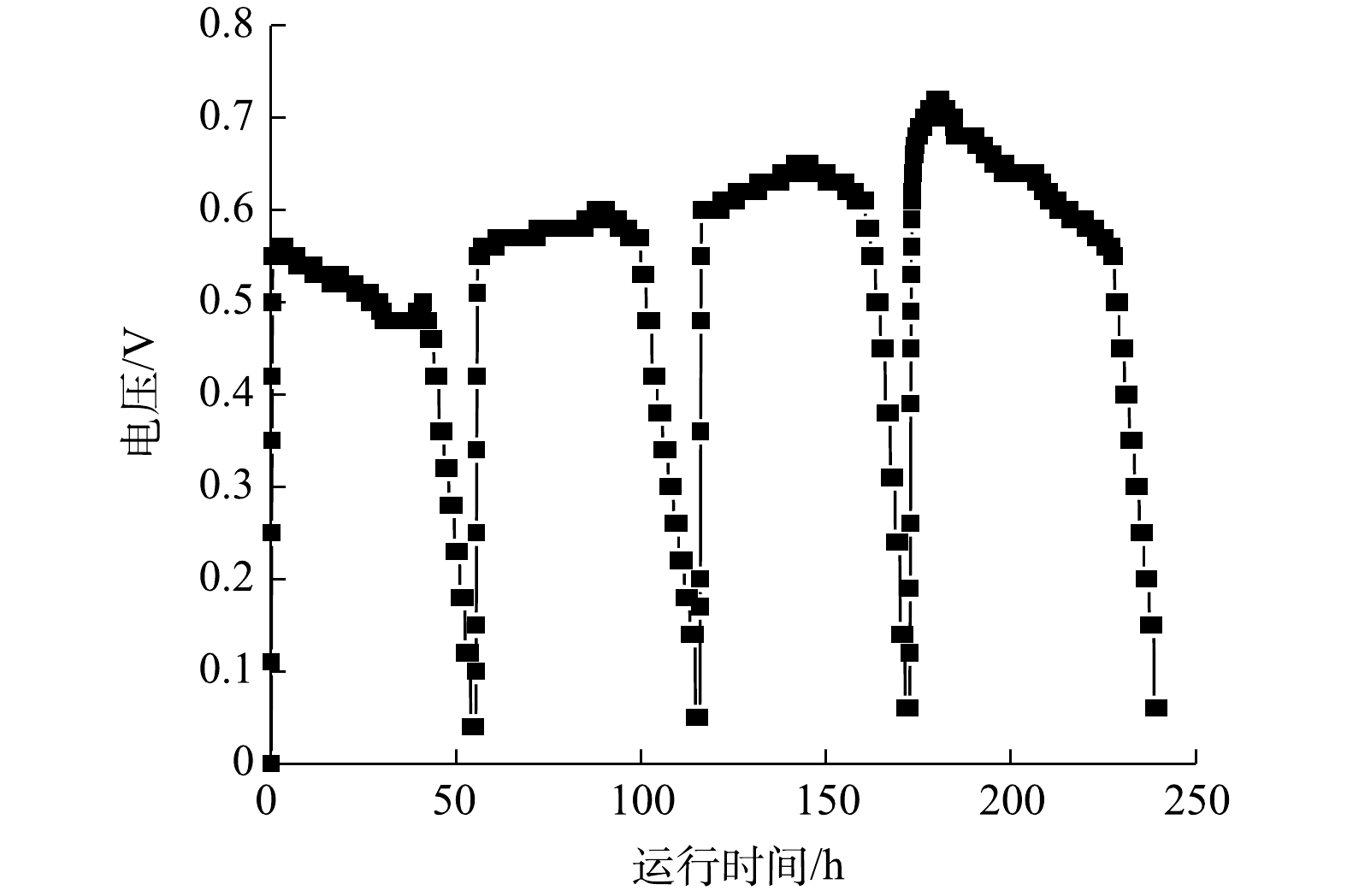
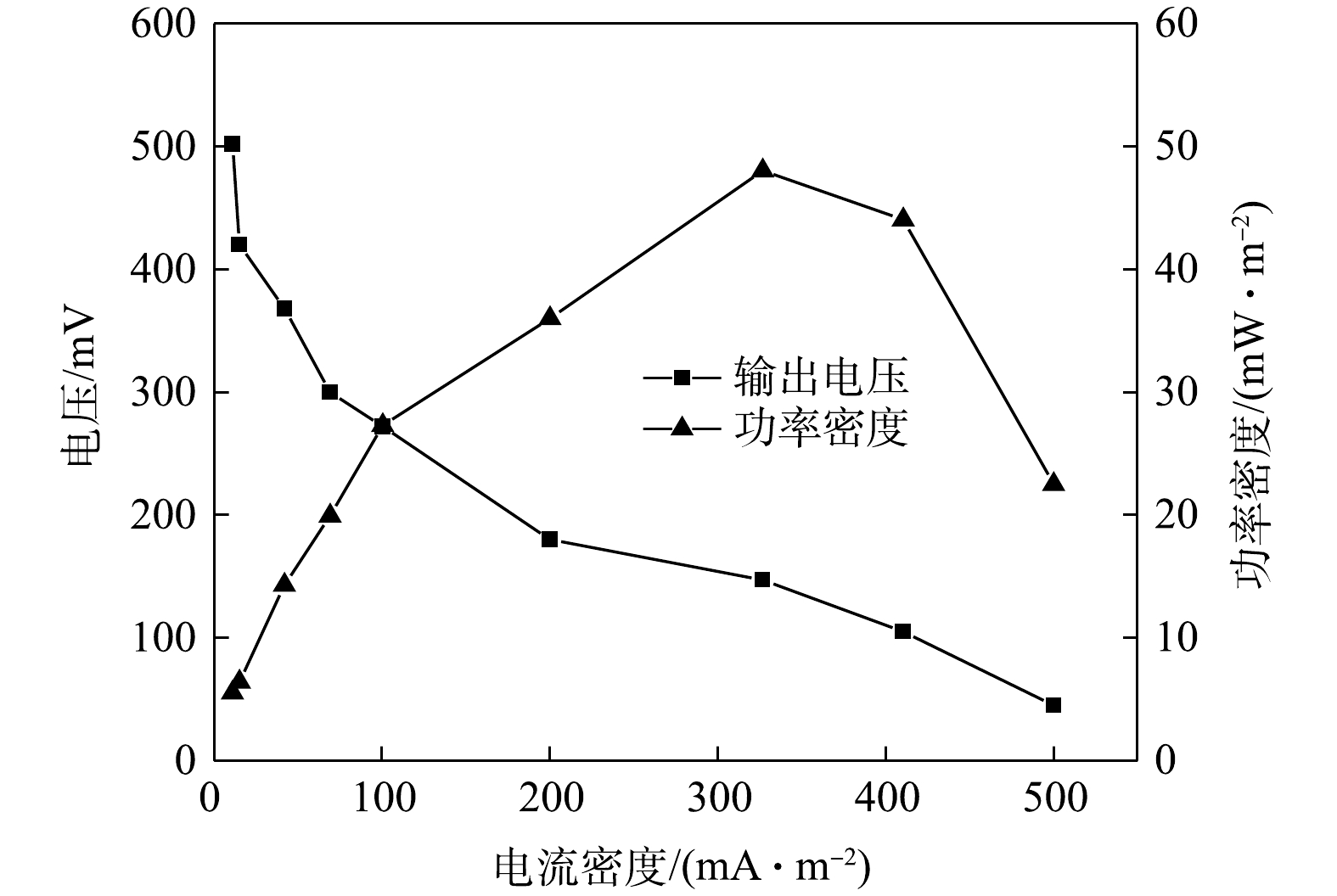
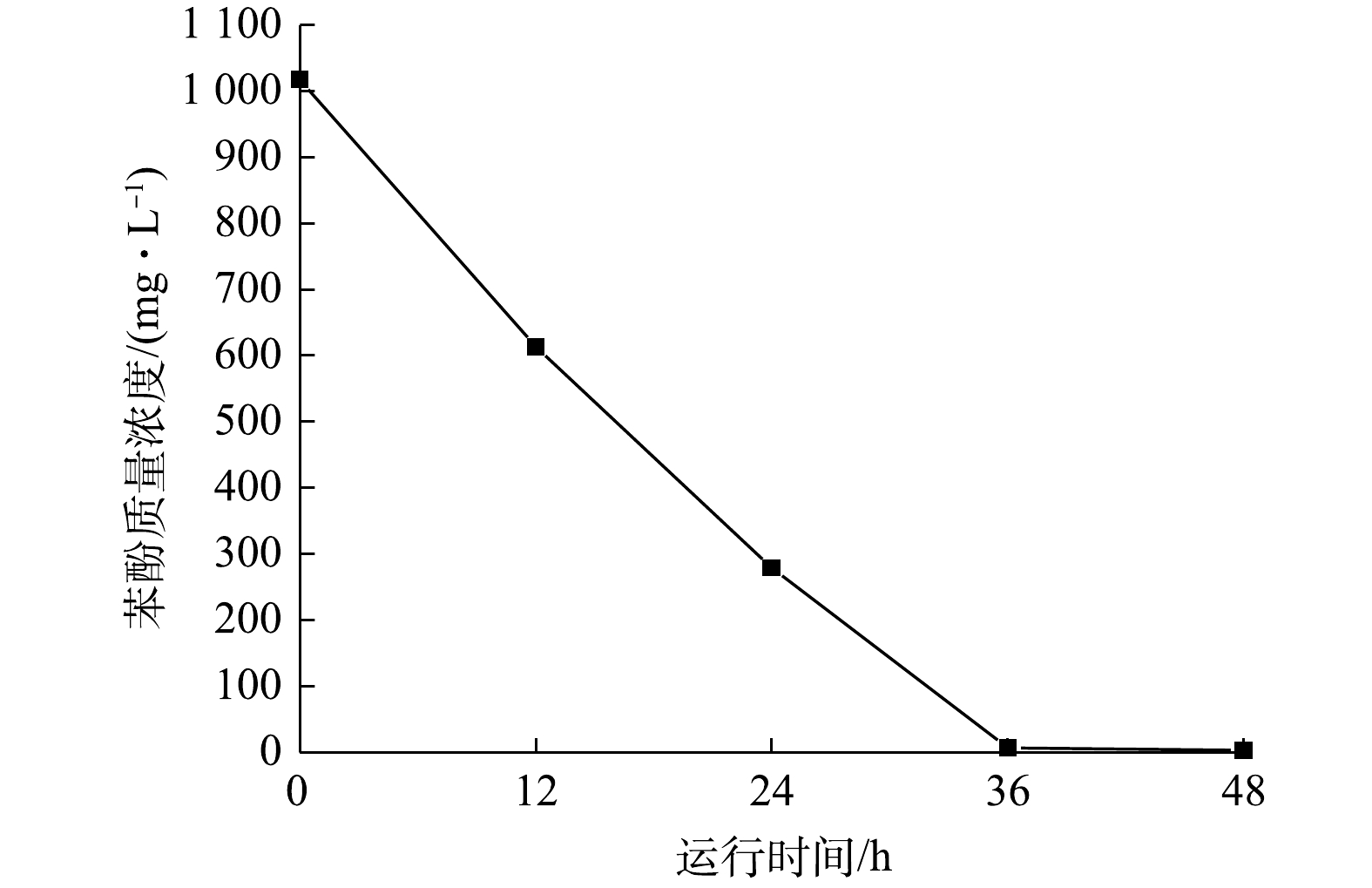
1)循环伏安分析。ZY07的电化学活性可通过循环伏安分析表征,图10为不同生长时期ZY07的循环伏安曲线。可见,CV曲线氧化峰为0.15~0.25 V,还原峰为?0.4~?0.6 V。峰值随培养时间的增加而增加,氧化还原活性不断增强。有研究表明,假丝酵母菌通过好氧呼吸代谢降解苯酚[40],并通过生物膜与材料接触直接传递电子[41],随着时间的增加,生物膜逐渐发育成熟,电子转移效率随之提高。2) MFC产电分析。以1 000 mg·L?1苯酚为唯一碳源接种ZY07构建MFC,其产电状况如图11所示。可见,阳极缓冲液加入后电压快速上升,随着苯酚不断消耗,电压缓慢下降。周期结束更换阳极缓冲液后,峰值电压较前一周期均有所增加,运行至第4周期时最大可产生0.72 V开路电压。在MFC稳定输出阶段绘制极化曲线和功率密度曲线,如图12所示,当外接电阻为500 Ω时,功率密度最大达到48.02 mW·m?2。姜允斌等[42]筛选出土壤产电菌最大输出功率为44.42 mW·m?2,并认为MFC产电能力的关键在于阳极电子传递方式,纳米导线传递能使产电菌在阳极表面形成多层生物膜,产电性能较优。此外,电极材料、面积及装置构造等因素也会影响产电能力。MFC系统阳极苯酚降解结果如图13所示。可见,产电同时苯酚不断消耗,1 000 mg·L?1苯酚在MFC运行36 h后几乎降解完全。以上结果均说明,以苯酚为碳源接种ZY07的MFC具有良好的降酚和产电特性。
3)阳极碳毡扫描电镜分析。生物膜的形成分为黏附、起始、成熟、分散4个阶段。对不同运行阶段ZY07所构建MFC的阳极碳毡进行生物膜扫描电镜观察,结果如图14所示。由图14(a)可以看出,碳毡内部呈长条状相互交错,该结构有利于微生物在其表面负载形成生物膜。如图14(b)所示,6 h后在碳毡表面仅观察到少量零散无规则菌体,此时生物膜处于黏附阶段,菌体呈个体分布,在黏附过程中,生物膜极容易受到破坏而回到游离状态[43]。如图14(c)所示,24 h后单个菌体开始相互连接形成微菌落,菌丝不断增殖,入侵材料表面并逐渐成为生物膜的基底层。碳毡表面出现菌体掉落的痕迹,进一步说明菌丝的黏性与入侵性提升了生物膜的抗压性[44]。如图14(d)所示,在生物膜发育至72 h时,碳毡表面出现类似连接体的基质,这是假丝酵母菌产生的胞外基质包裹覆盖菌体,菌落相互融合形成成熟的生物膜[45]。
通过阳极生物膜扫描电镜分析可初步推断ZY07电子传递机制。产电微生物电子转移机制主要有直接电子转移和间接电子转移2种,其中直接电子转移又可以分为生物膜接触传递如希瓦式菌(Shewanella)[46]和纳米导线接触传递如地杆菌(Geobacteraceae)[47],而铜绿假单胞菌(Pseudomonas aeruginosa)则是典型的借助自身产生绿脓素作为电子介体进行的间接电子传递[48]。有研究[41, 49]表明,假丝酵母菌可通过生物膜直接接触的方式转移电子,ZY07在碳毡表面形成成熟的生物膜,属于生物膜接触式直接电子传递,但其具体的电子转移方式还有待进一步探究。
2) ZY07在12 h内达到对数生长期,温度为35 ℃、接菌量为8%、pH为8是ZY07生长及降解苯酚的最适条件,48 h基本能完全降解1 700 mg·L?1的苯酚,ZY07对浓度高达2 000 mg·L?1的苯酚具有耐受性。
3) ZY07所构建MFC可产生最大输出电压0.72 V,最大功率密度48.02 mW·m?2。据循环伏安曲线和扫描电镜结果推测,ZY07的电子传递机制为生物膜接触式直接传递。
参考文献


 下载:
下载: 

 点击查看大图
点击查看大图