全文HTML
--> --> --> 提高人工快速渗滤(constructed rapid infiltration,CRI)系统的脱氮除磷性能是确保该工艺高效处理城镇生活污水的关键[1-2]。在诸多研究中,强化CRI系统中基于亚硝化的全程自养脱氮(completely autotrophic nitrogen removal over nitrite,CANON)作用被认为是提高该工艺脱氮效果的重要途径,此技术随之用于城镇生活污水处理[3]。截至目前,有****相继开展了常温和低

作为另一种备受关注的生物脱氮除磷新技术,反硝化除磷(denitrifying phosphorus removal,DPR)工艺可消耗有机碳源,并可发挥“一碳两用”的功能,使除磷和反硝化在缺氧环境下同时完成[9]。有研究结果初步证实,反硝化除磷耦合ANAMMOX作用的生物同步脱氮除磷工艺具备高效处理市政污水的潜力[10-11],如能在CRI系统中实现CANON作用与DPR作用的耦合,则CANON型CRI工艺的上述缺陷便有可能得到弥补。
本研究尝试构建了基于同步短程硝化、ANAMMOX、反硝化和反硝化除磷(simultaneous partial nitrification,ANAMMOX,denitrification and denitrifying phosphorus removal,SNADPR)作用的复合式人工快速渗滤(hybrid constructed rapid infiltration,H-CRI)系统,考察和探究了该系统的运行效能及微生物特性,而后对其中氮磷元素的归趋进行了解析。期望通过此研究,可探寻有效措施以弥补CANON型CRI工艺在处理城镇生活污水时的缺陷,提高其脱氮除磷性能及其稳定性,进而推动新型生物同步脱氮除磷工艺的研发及应用。
1.1. 实验装置
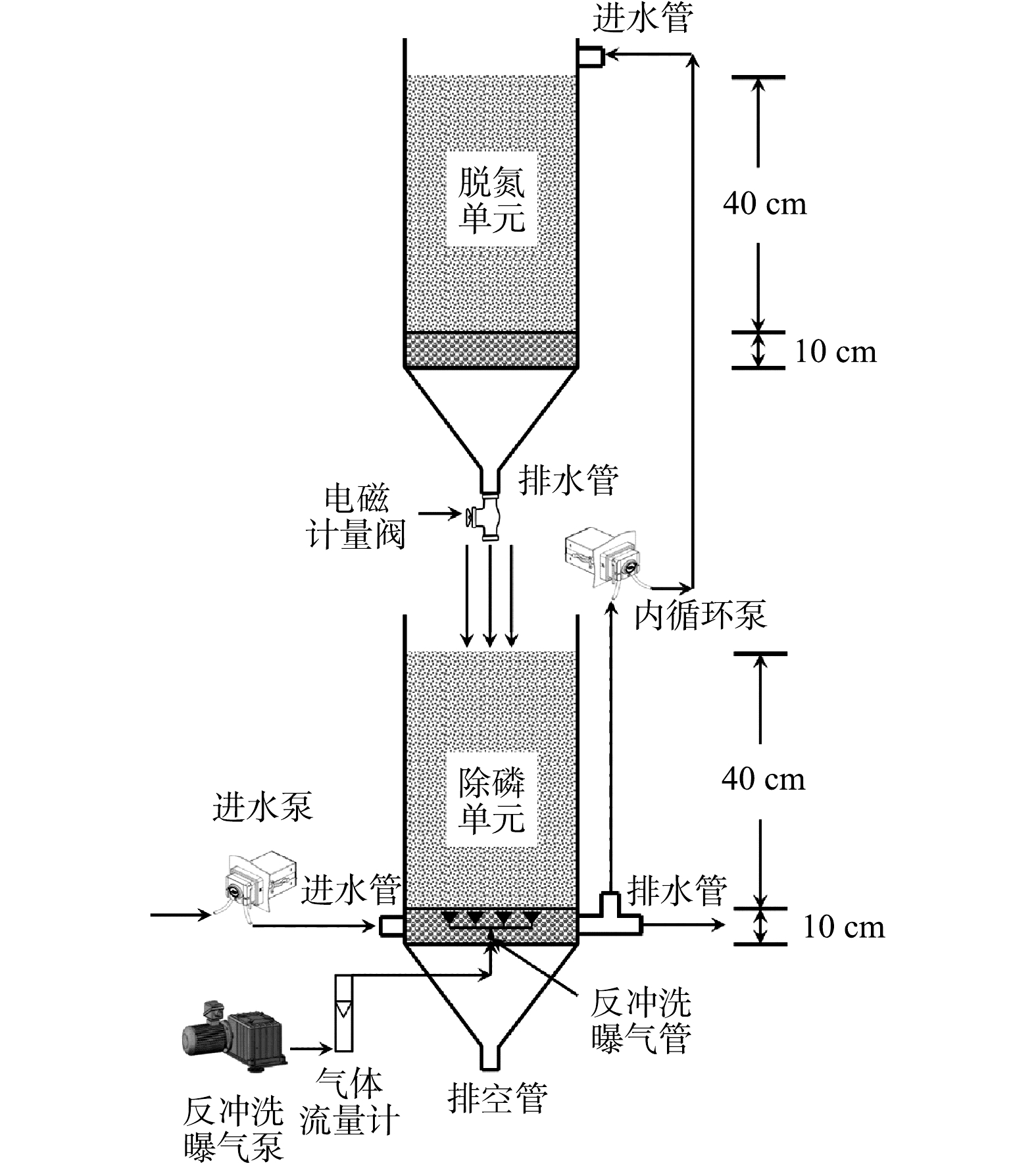
SNADPR型H-CRI装置构型见图1。前期实验分别构建了CANON型CRI系统和DPR型CRI系统[12-13]。其中:CANON型CRI系统由PVC管制成,表面积约314 cm2(φ=20 cm),其填料层厚度为50 cm且孔隙率约为37%:底部为5 cm厚砾石承托层,粒径为1~3 cm;上部为45 cm厚沸石层,粒径为5~10 mm。装置顶部和底部分别设有进水管和出水管,出水管附有计量阀控制装置的排水速率(vd)。前期研究中,当vd为0.5 L·min?1时,系统中的CANON作用得以强化,其TN和



SNADPR型H-CRI系统由CANON型CRI装置(标记为脱氮单元)和DPR型CRI装置(标记为除磷单元)耦合而成(图1),即两单元上下堆叠,并设置3台泵控制其运行。其中,1台为进水泵,与除磷单元的进水管相连;1台为内循环泵,分别与除磷单元的排水管和脱氮单元的进水管相连,可将前者出水泵入后者;1台为反冲洗曝气泵,与除磷单元的反冲洗曝气管相连。此外,本研究另设置1套CANON型CRI系统作为对照组,用于和SNADPR型H-CRI系统进行对比。
1.2. 运行方式
考虑到好氧氨氧化菌(AOB)、厌氧氨氧化菌(AnAOB)、反硝化菌和反硝化聚磷菌(DPAOs)等功能微生物各自的生理生化特性,需对SNADPR型H-CRI系统进行空间或时间上的分割与交替,才能确保上述功能微生物的高效协同。为此,将该系统按照内循环潮汐流模式连续运行150个周期(图2),每个周期时长为12 h。运行方式为:将5 L进水泵入除磷单元中,使其进入释磷反应期,期间脱氮单元处于闲置期;随后,内循环泵将污水自除磷单元泵入脱氮单元中,使后者进入脱氮反应期,期间除磷单元处于中间闲置期;待脱氮单元的脱氮反应期结束后,此单元中的污水通过排水管以0.5 L·min?1的排水速率跌入除磷单元中,则除磷单元进入吸磷反应期,而脱氮单元则进入二次闲置期;最后,除磷单元将处理后的污水排出系统。按照时间顺序,上述典型周期内除磷单元的运行过程依次标记为进水期(时长为15 min)、释磷反应期(时长为150 min)、中间排水期(时长为15 min)、中间闲置期(时长为270 min)、中间进水期(时长为15 min)、吸磷反应期(时长为240 min)和排水期(时长为15 min)7个阶段;脱氮单元的运行过程依次为闲置期(时长为165 min)、进水期(时长为15 min)、脱氮反应期(时长为270 min)、排水期(时长为15 min)和二次闲置期(时长为255 min)5个阶段。H-CRI系统的污水处理量为10 L·d?1,水力负荷(HLR)为0.18 m3·(m2·d)?1。对照组在实验阶段以潮汐流模式亦连续运行了150个周期,每个周期时长为12 h,包括进水期(时长为15 min)、淹水期(时长为270 min)、排水期(时长为15 min,vd=0.5 L·min?1)和闲置期(时长为420 min)4个阶段。该系统的污水处理量为10 L·d?1,HLR为0.32 m3·(m2·d)?1。
1.3. 反冲洗操作
每周对H-CRI系统中的除磷单元进行反冲洗,以去除其中老化的生物膜,维持DPAOs活性并确保填料层的孔隙率。采用气-水联合反冲洗方式对此单元进行反冲洗:先对其单独气洗4 min,而后气-水联合反冲洗5 min,最后漂洗9 min。此过程中水洗和气洗的强度分别为6 L·(m2·s)?1和12 L·(m2·s)?1。清洗液和脱落的生物膜通过该单元的排空管进行收集。1.4. 进水水质
实验用水为安徽农业大学园区内生活污水,将其初沉后的上清液作为2组装置进水,其耗氧有机物(以COD计)、TN、


1.5. 分析方法
1)水样采集及分析方法。每天采集装置进出水水样;当各系统稳定运行时,在其典型周期内实时采集填料层中的水样。水样中COD、TN、


2)填料样品采集。在实验阶段末采集2组实验装置中的填料样品,样品编号分别标记S1(取自对照组)、S2(取自H-CRI系统的脱氮单元)和S3(取自H-CRI系统的除磷单元)。
3)脱氮除磷性能测定。对于S1和S2,其亚硝酸化活性(PPNA)、硝酸化活性(PNA)、反硝化活性(PDA)、短程反硝化活性(PBDA)及厌氧氨氧化比活性(SAA)分别参照文献[15-16]中方法进行测定;对于S3,其生物膜中PHA、PHB、PHV、PH2MV和糖原(Gly)含量的测定参照文献[17],DPAOs占PAOs比例(即DPAOs/PAOs)的测定参照文献[18]。填料样品中全氮和全磷含量的测定方法均参照文献[19]。
4)基于16S rDNA的Illumina平台高通量测序。获取上述填料样品表面的生物膜,而后将其送至上海美吉生物科技医药公司进行高通量分析测序。测序分析后,根据Barcode序列区分各个样本的数据,进行嵌合体过滤,得到可用于后续分析的有效数据,即Clean reads。为了研究样品的物种组成多样性,对所有样品的Clean reads进行聚类,以97%的一致性(identity)将序列聚类成OTUs (operational taxonomic units),然后对OTUs的代表序列进行物种注释。
1.6. 数据处理
采用SPSS 22.0对试验数据进行统计分析;采用one-way ANOVA进行方差分析;采用Origin 2018作图,图中相关数据为平均值±标准差;文中污染物去除(转化)率(量)、累积率(量)等的计算方法均参照文献[20];实验装置中氮磷去除途径的解析方法参考文献[21]。2.1. 运行性能
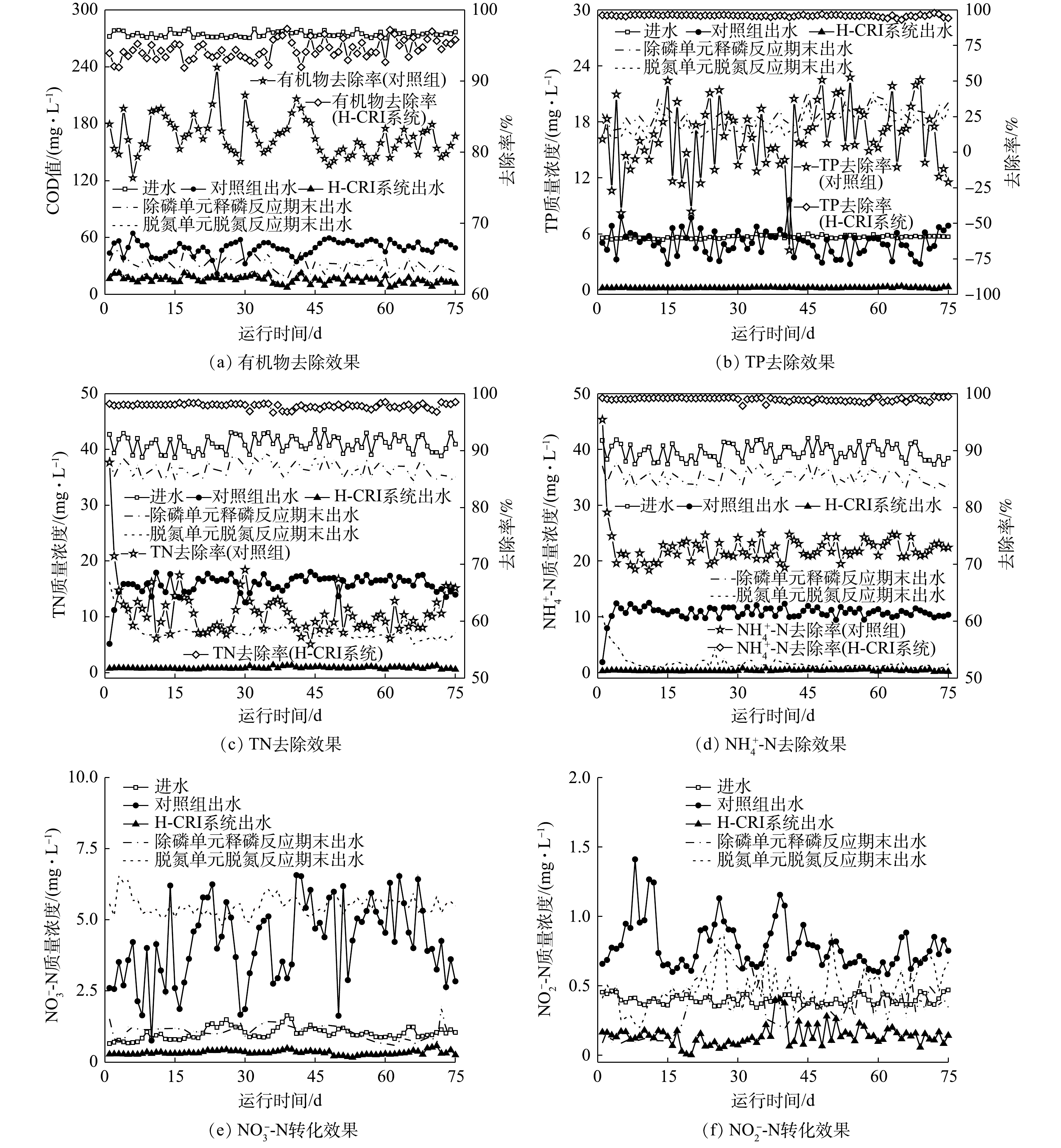
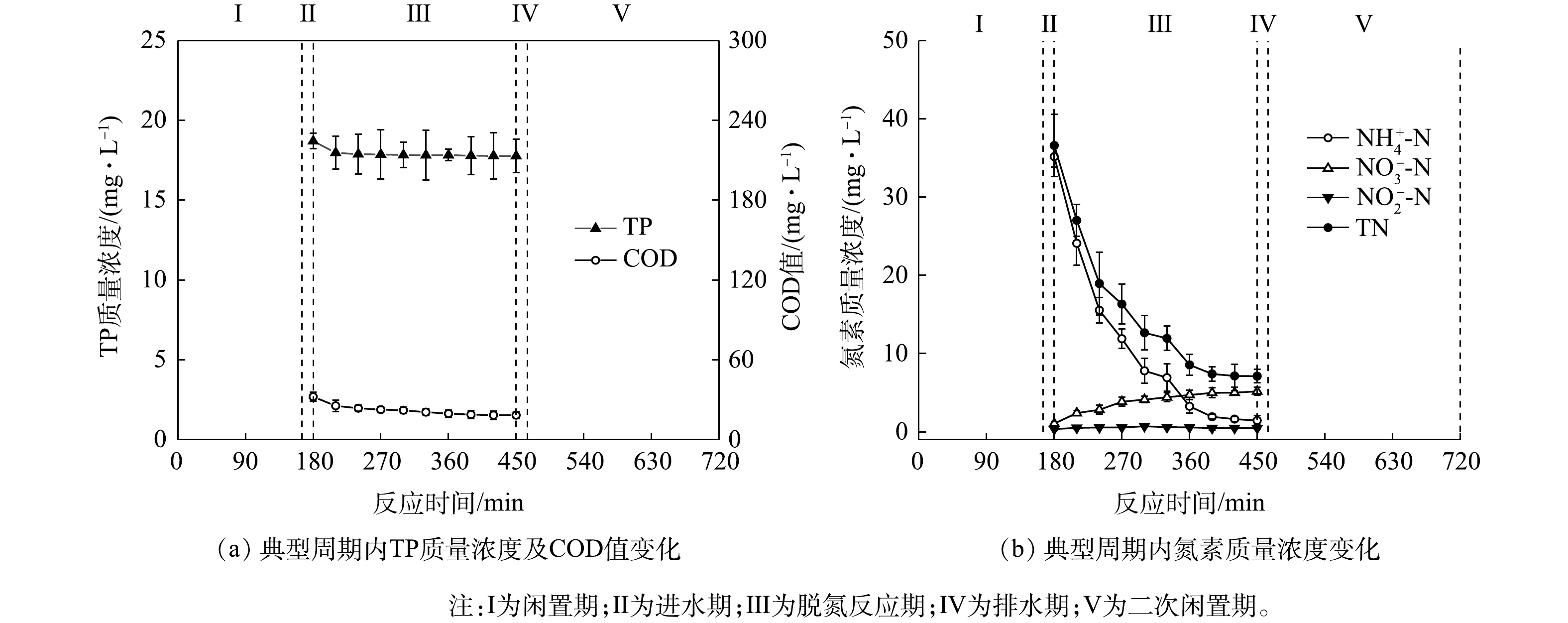
由图3可知,作为前期已成功启动的CANON型CRI系统,对照组具有良好的有机物去除性能[η≈(82.10±0.12)%],其出水的COD值<50 mg·L?1。有研究[4]表明,由于生物膜结构及其内部微环境的复杂性,某些CANON工艺中仍存在相当数量的异养型微生物,其可获得高效的有机物去除效果。然而,进水中的有机物却使对照组的脱氮性能出现下降,其TN和
在稳定运行期间,SNADPR型H-CRI系统对进水中有机物、TN、





































上述结果表明,相较于对照组,H-CRI系统具备更佳的有机物及氮磷去除性能,可实现对生活污水的高效处理。对于该耦合装置,内循环潮汐流运行模式的设置可使其中的脱氮单元和除磷单元高效协作,且2单元中CANON作用和DPR作用的强度及稳定性均可得到充分保障。
2.2. 微生物群落组成
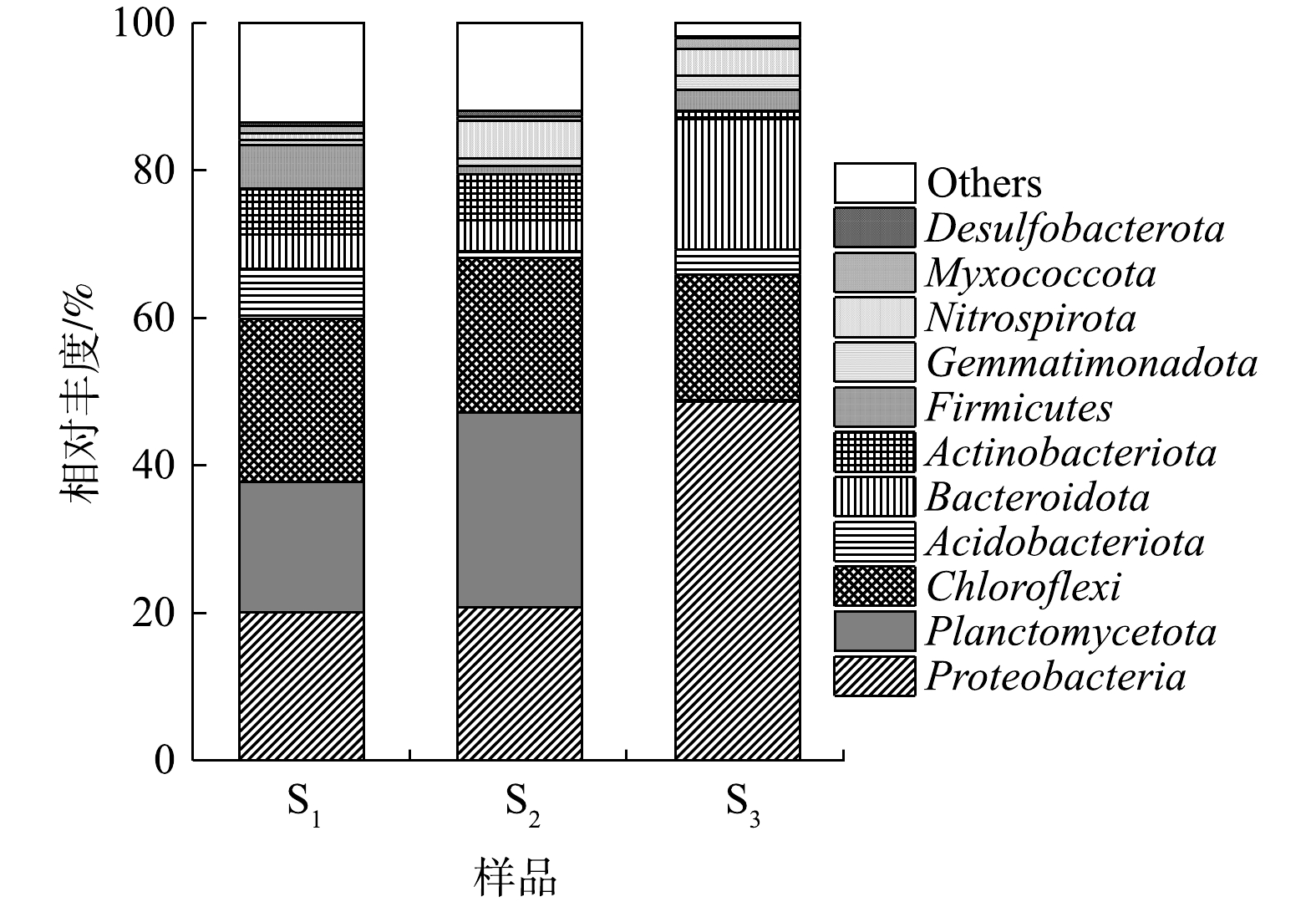
由图6可知,变形菌门(Proteobacteria)、浮霉菌门(Planctomycetota)和绿弯菌门(Chloroflexi)是S1和S2中相对丰度较高的3个菌门。其中,Proteobacteria在2组样本中的占比均>20%;Planctomycetota在S1中的相对丰度为17.66%,但其在S2中的含量却可达26.40%;此外,S1中硝化螺旋菌门(Nitrospirota)的相对丰度较S2(5.16%)显著下降至0.85%,但其中酸杆菌门(Acidobacteriota)的含量却增至6.72%,高于S2(0.91%)。有研究者指出,多数AOB(如Nitrosococcus、Nitrosomonas等)属Proteobacteria;AnAOB共包括5个属9个菌种,均属于Planctomycetota;亚硝酸盐氧化菌(NOB)属于Nitrospirota;反硝化菌则主要存在于Proteobacteria;另外,Acidobacteriota中的部分功能菌也具备还原
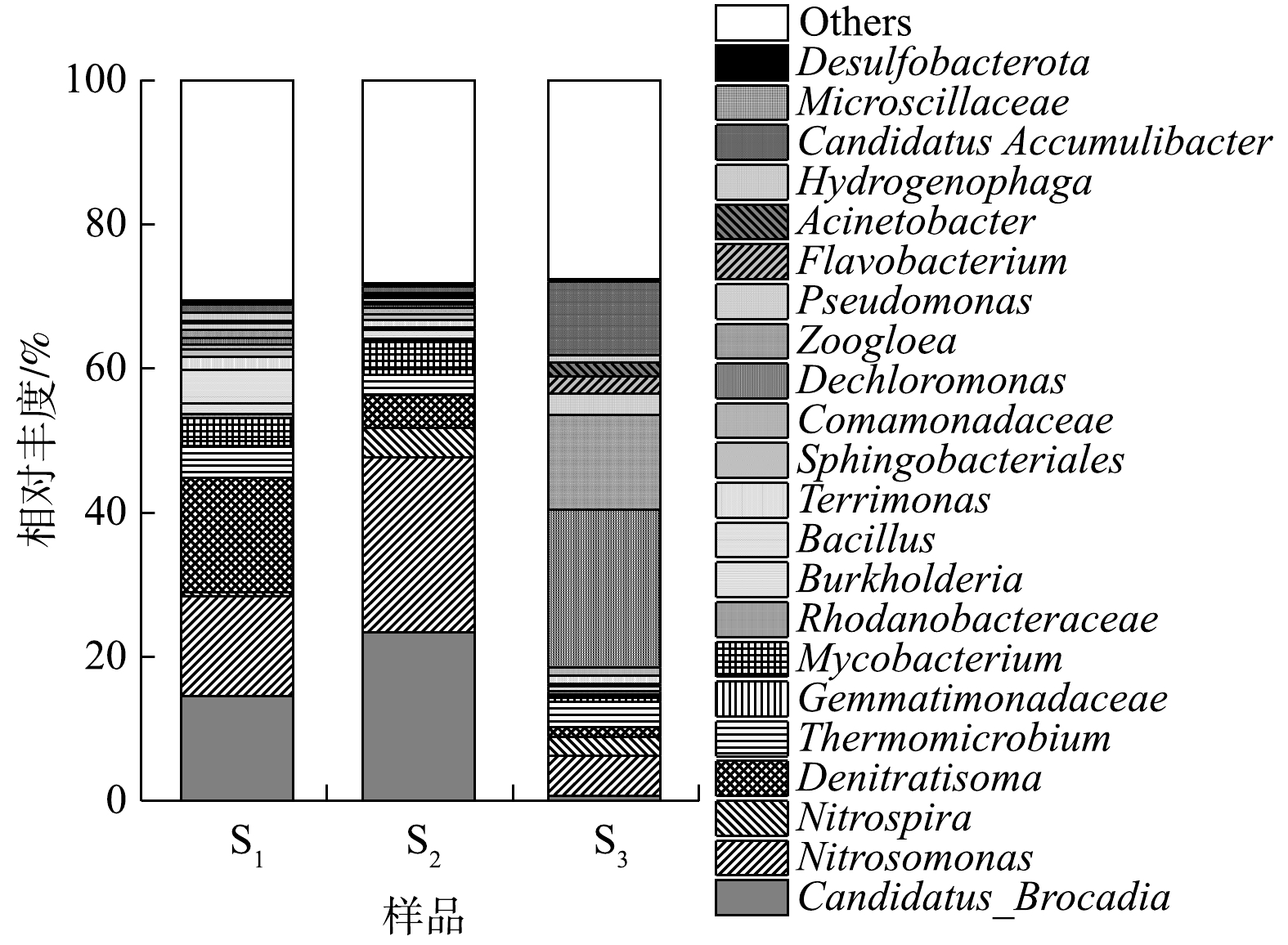
由图7可知,S1和S2中的优势菌属均包括Candidatus Brocadia和Nitrosomonas,2种菌属与CANON反应相关[24]。其中,Candidatus Brocadia是上述样本中检出的唯一AnAOB,此结果与HU等[26]和GONZALEZ等[27]的研究结论相符。Nitrosomonas是各样本中唯一检出的AOB,相较于Nitrospira与Nitrospina,该菌属被证实更易在CANON系统中生长[28]。与图6相呼应,Candidatus Brocadia和Nitrosomonas在S1中的相对丰度(14.56%和13.80%)低于S2(23.38%和24.25%);硝化螺旋菌属(Nitrospira)在S1中的含量也明显低于S2。然而,属红环菌科(Rhodocyclaceae)的反硝化菌属——Denitratisoma此时却是S1中的优势菌属,其相对丰度可达15.89%,这表明,对照组的反硝化性能较H-CRI系统的脱氮单元有所增强。上述结果进一步证实:对照组和H-CRI系统的脱氮单元中均存在CANON反应体系;对照组由于受到进水中较高浓度有机物的影响,导致其中的异养菌(包括反硝化菌)滋生,随之影响了AOB与AnAOB的丰度及活性,进而影响了CANON作用的强度。而对于H-CRI系统的脱氮单元,由于除磷单元与之耦合后可缓解有机物对其微生物群落结构的冲击,则脱氮单元中CANON作用的强度及稳定性得到保障。S3中的第1大优势菌属为Dechloromonas(21.83%)。在侧流EBPR工艺中,Dechloromonas是常见的优势微生物,其具备缺氧吸磷的能力[29]。此结果表明H-CRI系统的除磷单元具备较理想的反硝化除磷性能。Zoogloea(13.11%)是S3中的第2大优势菌属,其能够合成胞内碳源进行内源反硝化作用[30],此样品中较高丰度的Zoogloea预示着H-CRI系统的除磷单元还具有一定的内源反硝化性能。值得注意的是,S3中还存在一定含量的Candidatus Accumulibacter (10.23%)和Pseudomonas (3.01%),此2种微生物均可进行反硝化除磷作用[31-32],则两者均对除磷单元的反硝化除磷效果有促进作用。有研究表明,除了

2.3. 功能微生物活性
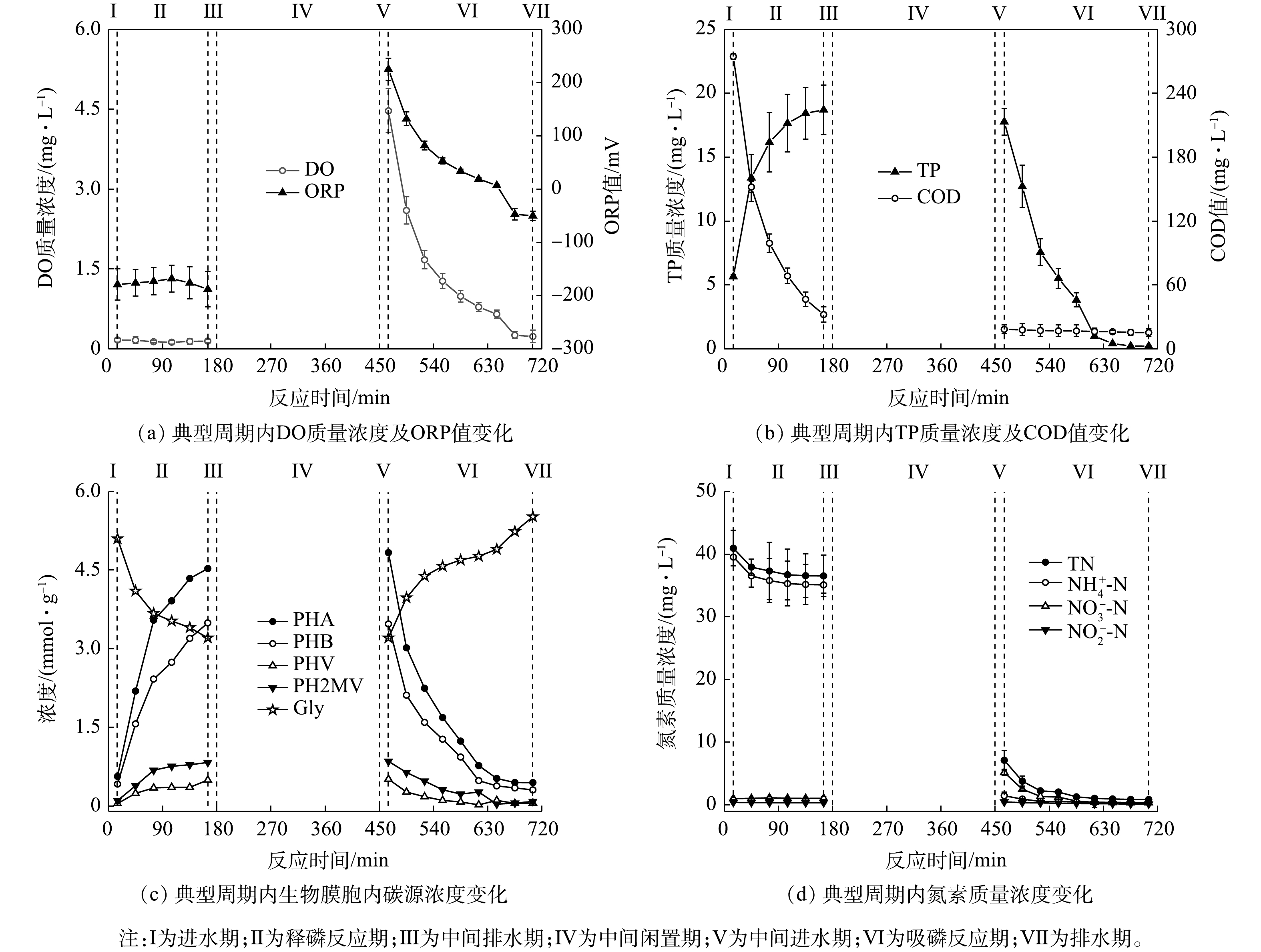
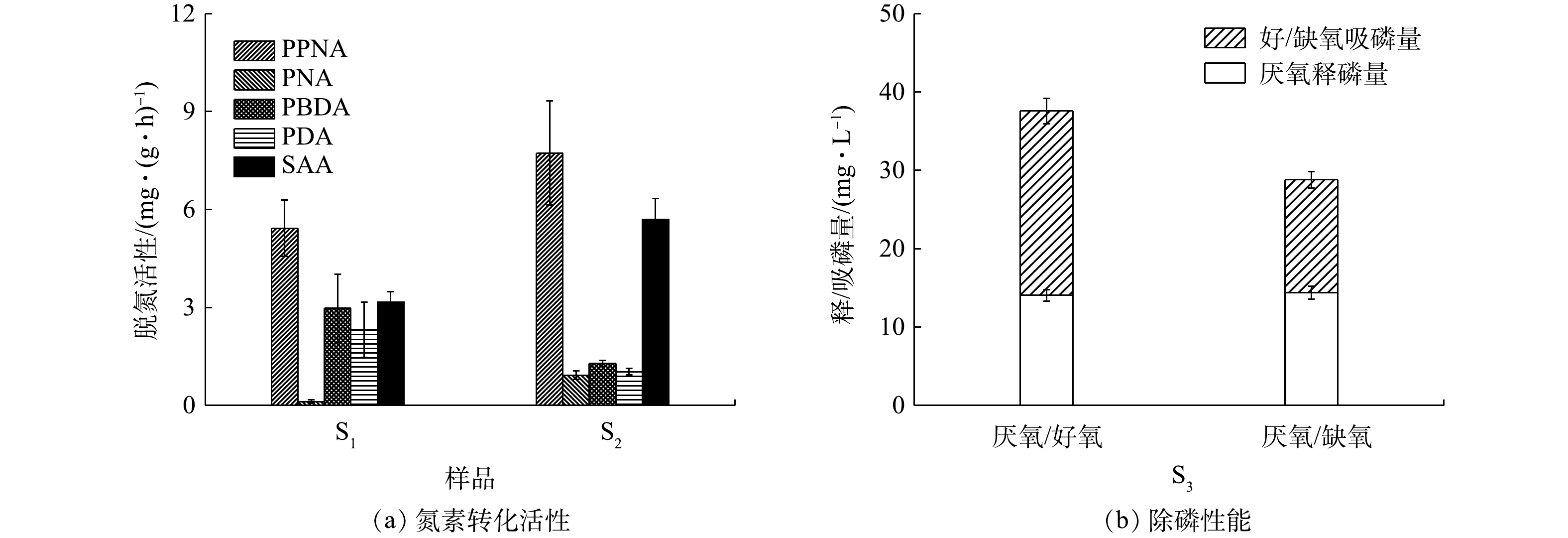
由图8可知,对照组的PPNA和SAA分别为(5.43±0.86) mg·(g·h)?1和(3.16±0.32) mg·(g·h)?1,而其PBDA和PDA则分别为(2.98±1.04) mg·(g·h)?1和(2.32±0.85) mg·(g·h)?1。与同类型研究[4]相比,此系统中CANON作用的强度偏低,但其反硝化性能却有较大幅度的提升。相较于对照组,H-CRI系统中脱氮单元的PPNA和SAA分别增至(7.73±1.60) mg·(g·h)?1和(5.70±0.64) mg·(g·h)?1,但该单元的PBDA和PDA有所下降,分别稳定在(1.29±0.08) mg·(g·h)?1和(1.03±0.10) mg·(g·h)?1。据此判断,脱氮单元中的CANON作用此时具备较高的强度,其反硝化性能也得到一定程度的强化。进水C/N会影响CANON系统中各功能微生物之间的竞争和协同关系[24]:当进水中有机物浓度适量时,各类脱氮功能微生物可共存并互相促进,即系统中的AOB和AnAOB协作完成CANON反应,反硝化菌则以有机碳源为电子供体,将体系中剩余的

上述结果表明,与对照组相比,内循环潮汐流运行模式下的H-CRI系统凭借其2个子单元的高效耦合分别为AOB、AnAOB、异养反硝化菌和PAOs(包括DPAOs)提供了其各自适宜的生态位,确保了此4类功能微生物对底物的合理竞争,进而实现了对生活污水的高效处理。其中:除磷单元中富集的PAOs(包括DPAOs)可在释磷反应期内利用有机物合成胞内碳源,因而削弱乃至消除了有机物对脱氮单元运行性能的影响,确保了其中CANON作用的稳定;除磷单元中的PAOs在吸磷反应期通过消耗内碳源实现了对脱氮单元出水中TP的超量吸收;脱氮单元出水中的

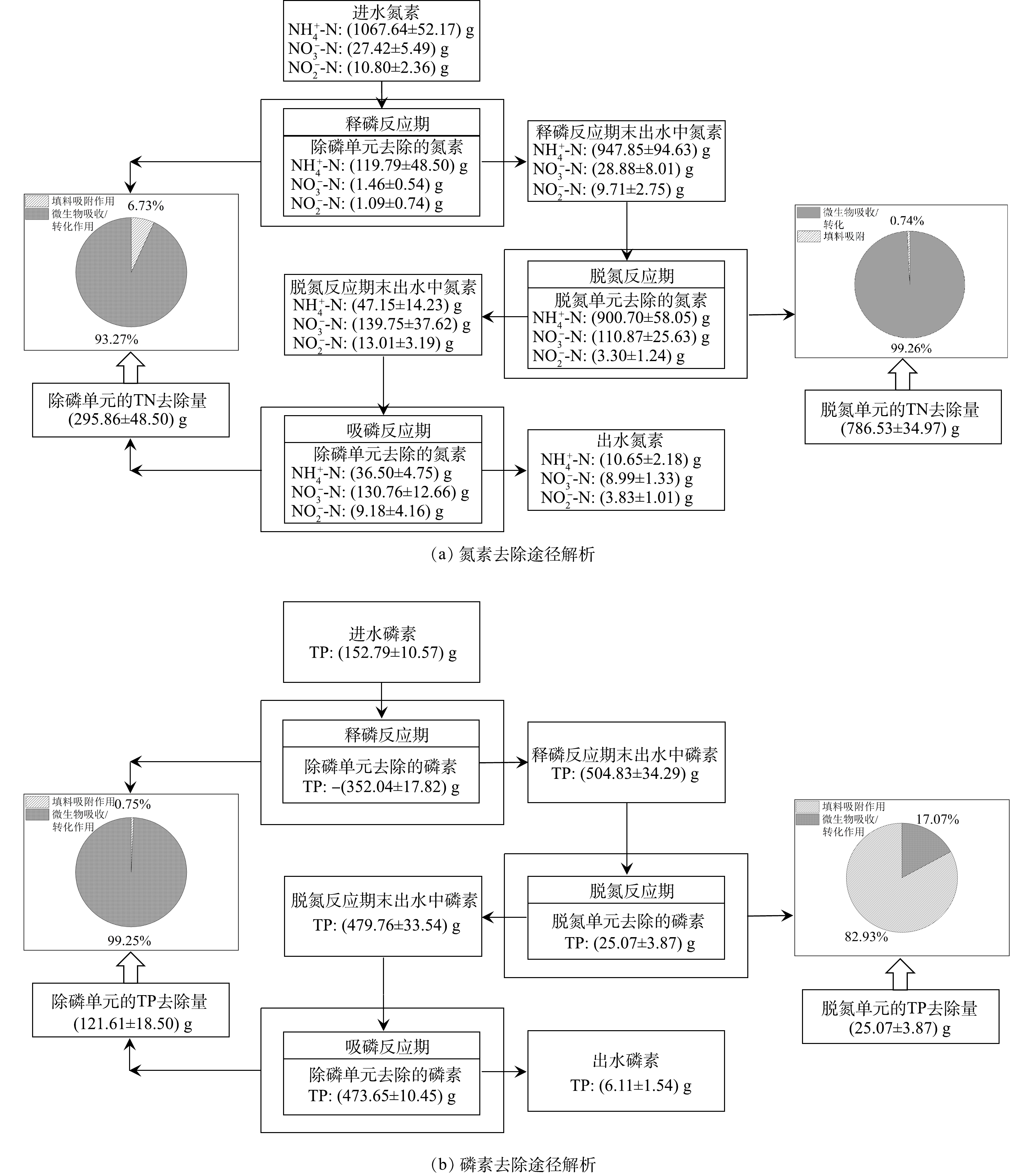
2.4. 氮磷去除途径解析
由图9可知,H-CRI系统在实验阶段的TN去除量为(1 082.39±27.82) g。其中,除磷单元的











综上所述,内循环潮汐流运行模式可将DPR型CRI装置与CANON型CRI装置成功耦合为SNADPR型H-CRI系统,此工艺在处理生活污水时可摆脱低

2)当HLR为0.18 m3·(m2·d)?1时,SNADPR型H-CRI系统可实现对生活污水中有机物及氮磷的高效同步去除,其对有机物、TN、

3)脱氮单元中的CANON作用是SANDPR型H-CRI系统脱氮的主要途径,而系统中磷素的去除主要依赖于除磷单元中PAOs的过量吸磷作用,两者去除的氮磷量分别占H-CRI系统脱氮除磷总量的(72.13±6.12)%和(82.29±5.58)%。
参考文献



 下载:
下载: 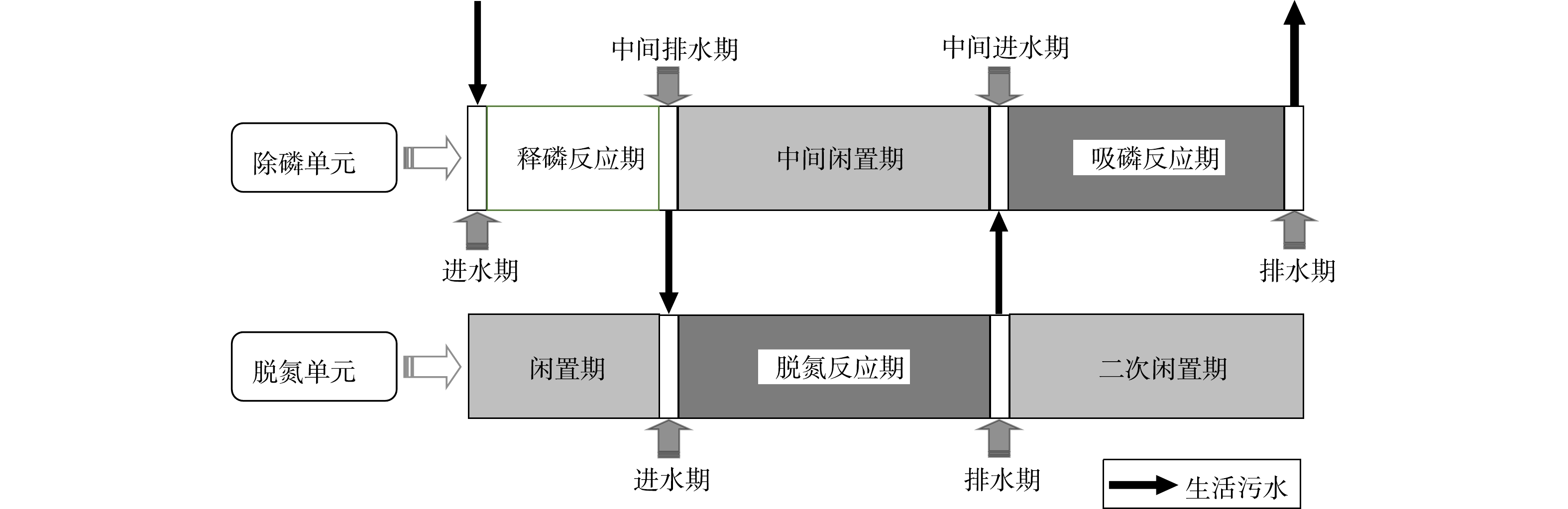
 点击查看大图
点击查看大图