全文HTML
--> --> --> 抗生素作为一种抗菌类药物被广泛应用于治疗和预防疾病、促进动物生长以及作物种植和保护等领域[1-2]。至2013年,我国抗生素的使用量已突破16×104 t,其中48%为人类摄入,剩余的用于畜禽等动物[1]。然而,生物体所摄取抗生素的30%~90%不会被代谢,而是会从体内排出,最后进入环境中,从而对生态系统和人类健康造成威胁[3-4]。同时,抗生素残留在环境中还会诱导抗生素耐药细菌和抗生素抗性基因(antibiotics resistance genes, ARGs)的产生[5]。然而,传统的污水处理厂一般没有针对抗生素的处理工艺,抗生素与抗性基因在废水和污泥中被频繁检测出来[6],导致大量抗生素未经处理进入环境中。有研究[7]表明,人工湿地(constructed wetland, CW)在抗生素和ARGs的处理中具有巨大的潜力。但是,CW易堵塞、占地面积大、受外部条件影响大等缺点,影响了其对污染物的去除性能[8]。微生物燃料电池型人工湿地系统(microbial fuel cell integrated with constructed wetland, CW-MFC)作为一种新型废水处理技术,其可将微生物燃料电池(microbial fuel cell, MFC)嵌入到人工湿地中,实现废水处理的同时产生电能[9]。典型的MFC需要一个厌氧阳极区和好氧阴极区来提供氧化还原梯度,以促进电子和质子从厌氧区到好氧区的转移。而CW底部为厌氧区,顶部为有氧区,因而形成了天然的氧化还原梯度。两者在结构上的相似性,提供了将两者进行结合的可能性。二者的耦合可更好得提高污染物的去除效率。有研究[10-12]表明,CW-MFC对N、P等常规污染物以及偶氮染料、硝基苯、药品及个人护理品等难降解有机物都有良好的去除性能。
目前,关于CW-MFC对抗生素废水的处理效果及相关机理的研究还较少。杨可昀等[13]利用CW-MFC处理含四环素和磺胺甲恶唑的废水,证实了CW-MFC相较于传统CW可以更有效的去除废水中的抗生素,但没有明确其去除机理。因此,构建高效的微生物燃料电池型人工湿地并研究其对抗生素废水处理的效果及机制已成为当前废水处理中的研究热点之一。
生物炭作为吸附剂广泛地应用于污水处理,其不仅容易获取而且对污染物有良好的吸附效果[14]。有研究[15]表明,利用生物炭作吸附剂可有效吸附去除水中的抗生素。YUAN等[16]发现,生物炭作为基质填充到人工湿地,可以提高湿地对污染物的去除效果,因为生物炭不但可以吸附更多的污染物,同时发达的孔隙结构,较大的比表面积可以为微生物提供附着场所,有利于微生物生长。基于此,本研究建造了以生物炭作为电极基质的CW-MFC系统,开展不同电路运行模式下处理含喹诺酮类抗生素盐酸环丙沙星(ciprofloxacin hydrochloride, CIPH)和磺胺类抗生素磺胺甲恶唑(sulfamethoxazole, SMX)废水的研究,通过系统运行,研究了不同电路运行模式下CW-MFC对抗生素的去除效果、抗生素废水中常规污染物的去除效果以及基质微生物对不同运行模式的响应。
1.1. 实验装置的构建
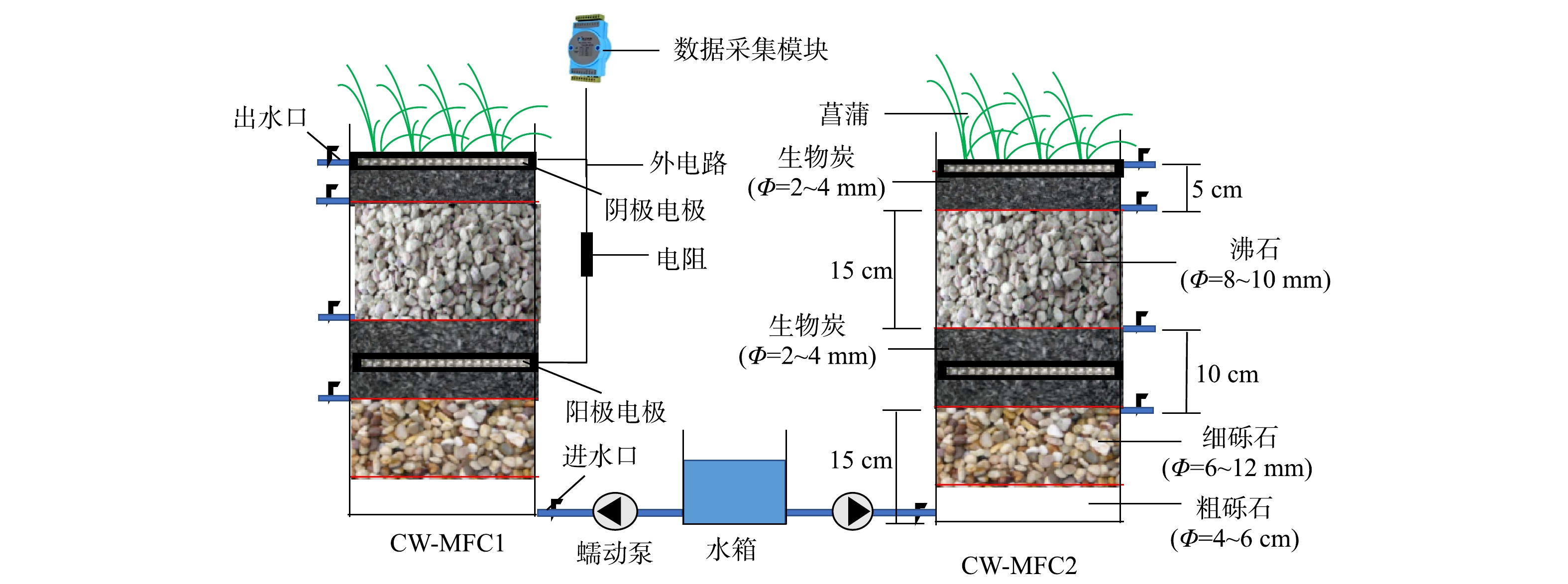
本实验在济南大学水利与环境学院温室中进行,温度保持在(25±3) ℃,模拟构建了2个CW-MFC装置模型。如图1所示,闭路运行的CW-MFC1与开路运行的CW-MFC2的圆柱型池体由有机玻璃制成,内径20 cm,高50 cm。由下向上依次填充底层基质粗砾石5 cm,细砾石10 cm、阳极层基质生物炭10 cm、中间层基质沸石15 cm、阴极层基质生物炭5 cm。在阳极层中部与阴极层顶部铺设附着在不锈钢网上的碳纤维毡以增强电子的转移。在空气阴极层种植4颗菖蒲。其中CW-MFC1阴极与阳极之间使用绝缘铜线相连接,中间连接1 000 Ω电阻形成闭合回路。CW-MFC2阴极与阳极之间不进行连接,开路模式运行,本质上是传统人工湿地。使用黑色遮光布对装置与水箱进行遮光处理防止藻类的产生和抗生素的光解。1.2. 系统的接种与运行
受试废水是人工制备的合成废水,由160 mg·L?1葡萄糖、160 mg·L?1乙酸钠、89 mg·L?1 NH4Cl、16 mg·L?1 KNO3、10 mg·L?1 KH2PO4、10 mg·L?1 CaCl2和5 mg·L?1 MgSO4组成。在实验装置构建完成后,使用活性污泥对阳极进行接种,活性污泥取自济南光大水务二厂;之后进入培养期,合成废水使用蠕动泵从底部进水口连续泵入2个实验装置,流量为1.190 mL·min?1,2个实验装置的水力停留时间(hydraulic retention time, HRT)为3 d。在30 d后,装置内形成稳定的生物膜,出水水质稳定,CW-MFC1输出端电压稳定。系统达到稳定后,在合成废水中加入目标抗生素磺胺甲恶唑(SMX)与盐酸环丙沙星(CIPH)各2 mg·L?1,该系统运行90 d。1.3. 采样与指标测定方法
1)常规水质指标的测定。每3 d从装置顶部出水口采集系统出水,同时获取进水样品。在水样采集当天,分别按照以下标准方法测定出水水质指标。

2)抗生素检测方法。每6 d从装置顶部出水口采集系统出水,检测抗生素(CIPH和SMX)的浓度。进出水样品使用0.22 μm滤膜过滤后采用高效液相色谱和紫外检测器(DAD)测定SMX和CIPH的质量浓度。采用C18反相柱(4.6 mm×250 mm;5 μm),2种抗生素的注射量均为20 μL,流动相流速为1 mL·min?1。CIPH流动相为0.025 mol·L?1磷酸∶乙腈=75∶25,用三乙胺溶液调节磷酸溶液pH至(3.0±0.1),荧光检测波长为278 nm。SMX流动相为水∶乙腈=1∶1,荧光检测波长为272 nm。
3)微生物群落分析。装置运行结束后,采集装置阳极层(A)与阴极层(C)基质,探究开路和闭路运行模式下阴极与阳极微生物群落多样性和组成。采集的基质送到杭州LC-Bio科技有限公司。使用E.Z.N.A.?Soil DNA Kit土壤试剂盒进行DNA的提取。针对16SrRNA基因V3~V4高变区,选择正向引物341F(5'-CCTACGGGNGGCWGCAG-3')和反向引物805R(5'-GACTACHVGGGTATCTAATCC-3')作为扩增引物。在Illumina Novaseq平台上按照制造商的操作指南进行测序。使用Vsearch (2.3.4版本)筛选高质量的嵌合序列,利用DADA2进行解调,得到特征表和特征序列。通过QIIME2软件获取观测物种、Chao1、Shannon和Simpson指数。
1.4. 数据处理与分析
采用Excel 2019进行数据的平均值和标准偏差计算,采用SPSS 26进行统计差异与相关性分析,使用Origin 2018软件绘制图形,使用Canoco 5进行冗余分析(RDA)。2.1. 不同运行模式下CW-MFC对常规污染物的去除性能
表1所示为CW-MFC1(闭路)和CW-MFC2(开路)运行期间的进出水污染物平均质量浓度与平均去除率。CW-MFC1和CW-MFC2对







有研究表明,闭路运行模式可以加快电化学细菌在电极上的富集与生长[17],而电化学活性细菌对CW-MFC中硝化和反硝化过程会有促进作用[18]。在本研究中,闭路运行的CW-MFC中电化学细菌和氨氧化细菌具有更高的丰度,可使硝化作用得到增强,这可能是其中


































































































运行期间开闭路2种运行模式下CW-MFC出水中










































































































2.2. 不同运行模式下CW-MFC对抗生素的去除性能
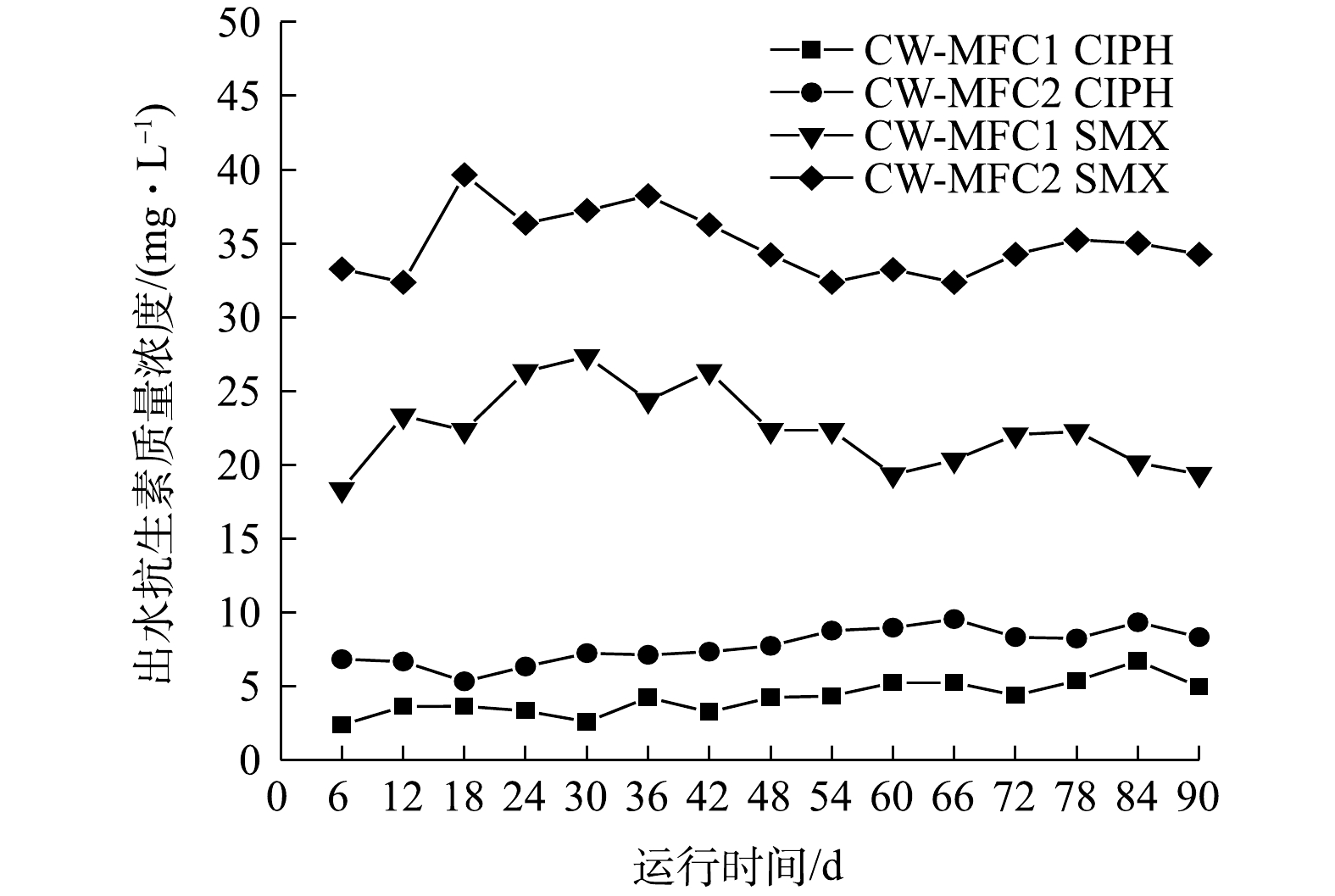
图3为运行期间开闭路2种运行模式下CW-MFC出水中目标抗生素质量浓度的变化。CW-MFC1和CW-MFC2中CIPH的平均出水质量浓度分别为4.23 μg·L?1与7.73 μg·L?1,平均去除率为99.79%与99.61%,SMX的平均出水质量浓度分别为22.43 μg·L?1与34.96 μg·L?1,平均去除率为98.89%和98.25%。上述结果表明,闭路运行的CW-MFC与开路运行的CW-MFC对CIPH和SMX都有较好的去除效果,闭路运行的CW-MFC对CIPH和SMX的出水质量浓度显著低于开路运行的CW-MFC(P<0.05),同时,2个系统中CIPH的去除效果显著好于SMX的去除效果(P<0.05)。CW-MFC主要通过基质吸附,微生物降解和植物吸收等方式去除废水中的抗生素[23]。水解与光解也是去除抗生素的途径,CIPH容易发生光解,SMX易发生水解[24-25]。本研究装置的池体使用黑色遮光布覆盖,以此降低CIPH的光解作用。本研究中,装置内pH保持在7左右,此时水解作用十分有限[25]。因此,本实验不考虑抗生素的光解与水解作用。在CW-MFC系统中,阳极微生物会分解葡萄糖以及一些难降解有机物产生电子,而闭路运行模式的CW-MFC阳极产生的电子通过外电路到达阴极,为阴极提供了更多的末端电子受体,从而可提高阴极还原速率。因此,闭路运行模式可能具有更高的阳极微生物活性,从而提高了污染物的利用率,可促进抗生素的微生物降解[26]。同时,YANG等[27]的研究表明,电吸附过程可以增强基质对抗生素的吸附能力,闭路运行模式的CW-MFC中有弱电流的存在,这可能是其具有更好去除抗生素效率的原因之一。有研究[28]表明,喹诺酮类抗生素的去除主要靠基质的吸附作用,而磺胺类抗生素的去除则是以微生物作用为主。这可能是2种抗生素出水质量浓度差异较大的原因。LIU等[29]的研究表明,CW对喹诺酮类抗生素的去除效果要远高于磺胺类抗生素,这与本研究得到的结果一致。
2.3. 不同运行模式下CW-MFC的微生物群落响应
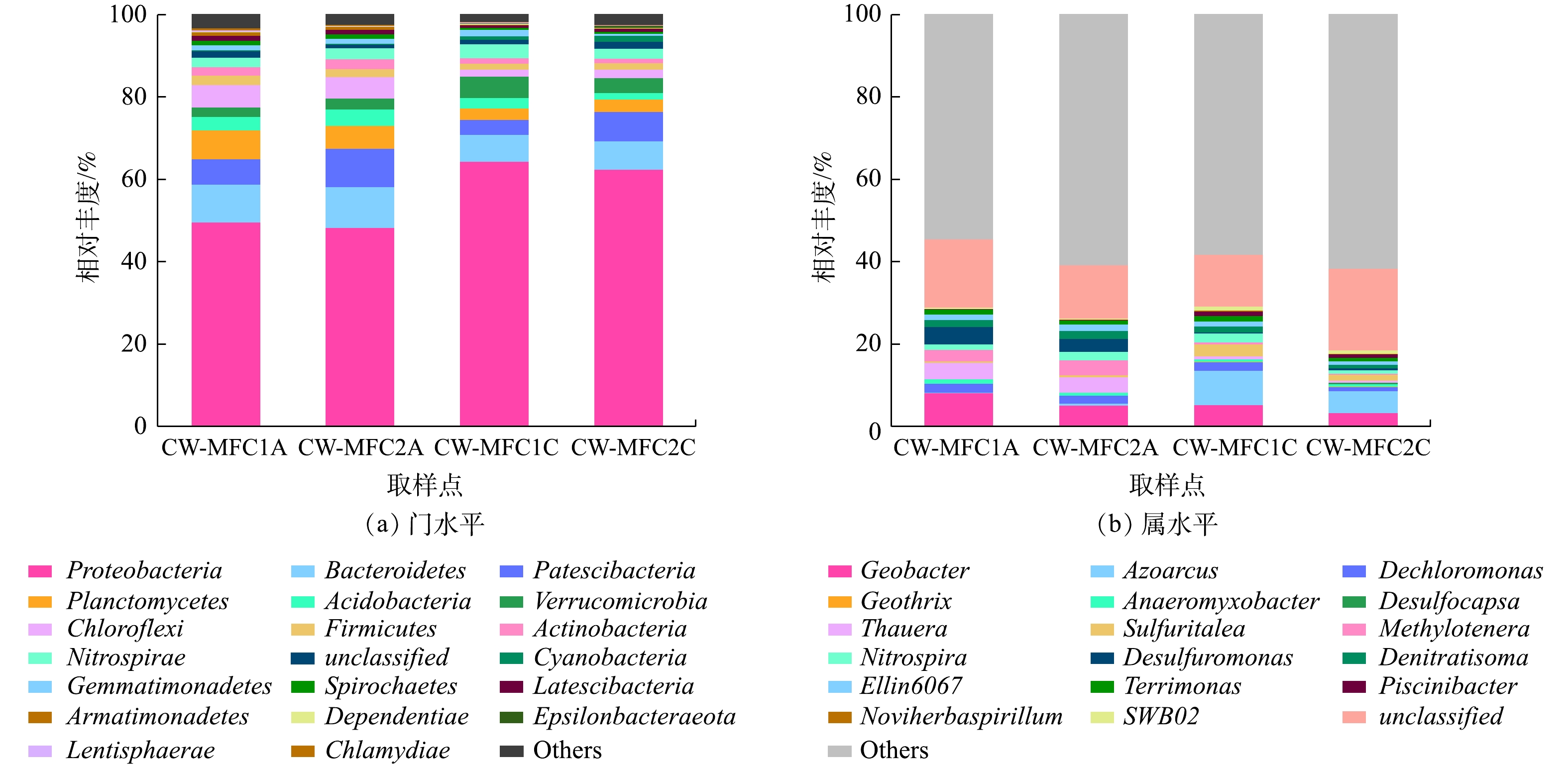
表2为利用Illumina Novaseq测序得到的Alpha多样性数据。闭路运行的CW-MFC阳极微生物的丰富度(Chao1)与多样性(Shannon、Simpson)显著高于开路运行的CW-MFC(P<0.05)。在闭路运行的CW-MFC装置中,阳极微生物的丰富度和多样性显著高于阴极微生物(P<0.05)。而在开路运行的CW-MFC装置中则相反,阳极微生物的丰富度和多样性略微低于阴极微生物。以上结果表明,不同运行模式显著改变了微生物的丰富度和多样性。闭路运行的CW-MFC由于电流刺激促进了微生物在阳极的富集与生长,这与闭路运行模式的CW-MFC对污染物有更好的去除性能相一致。微生物降解是主要的污染物去除途径,因此,更高的微生物丰度会带来更好的处理性能。图4(a)所示为CW-MFCs中细菌门水平相对丰度最高的20个门。在2个CW-MFC阳极中,变形菌门(Proteobacteria)是主要的优势菌门之一,具有最高的相对丰度,分别为49.71%和48.38%,其次是拟杆菌门(Bacteroidetes)、Patescibacteria、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)。在2个CW-MFC阴极中,变形菌门(Proteobacteria)同样是主要的优势菌门,且具有更高的相对丰度,分别为62.56%和64.43%,其次是拟杆菌门(Bacteroidetes),Patescibacteria,疣微菌门(Verrucomicrobia)和硝化螺旋菌门(Nitrospirae)。这些广泛存在于自然界中的菌门,在污染物的去除方面扮演着重要的角色。Proteobacteria可以有效降解污水中营养物质与一些有机污染物,同时在生物电的生产中起着重要的作用[30]。在本研究中,闭路运行的CW-MFC阳极和阴极Proteobacteria的相对丰度略高于开路运行的CW-MFC,但差异不显著(P>0.05),但2个装置阴极Proteobacteria的相对丰度显著大于阳极(P<0.05)。Bacteroidetes与Chloroflexi作产电菌,在2个装置阳极的相对丰度均高于阴极。在2个装置的阳极,闭路运行的CW-MFC中Patescibacteria的相对丰度低于开路运行的CW-MFC,但Planctomycetes的相对丰度高于开路运行的CW-MFC。属于Planctomycetes的厌氧氨氧化细菌类群可以在厌氧环境下,以









选取相对丰度最高的30个属,将其中未分类的归为一类,得到图4(b)。可以看出,开闭路运行模式对细菌属水平上的结构有明显的影响。在2个装置阳极,主要的菌属为地杆菌属(Geobater)、陶厄氏菌属(Thauera)、甲基娇养杆菌属(Methylotenera)、脱氯单胞菌属(Dechloromonas)、脱硫单胞菌属(Desulfuromonas)、Nitrospira、Ellin6067等菌属。Geobater是CW-MFCs装置阳极相对丰度最高的属,这是一种典型的电化学活性细菌,属于产电菌中的优势菌属[33]。闭路运行模式下CW-MFC的Geobater相对丰度的显著高于开路运行模式,而闭路运行时电子可以通过外电路到达阴极产生电流,二者结果一致。Thauera具有反硝化能力,作为一种反硝化功能菌,其在2个装置阳极的相对丰度为4.00%和3.68%,远大于其在2个装置阴极0.81%和0.48%的相对丰度,由此可知,阳极厌氧区域确实为进行反硝化作用的主要场所。Ellin6067是一种亚硝化菌属,Nitrospira是常见的硝化细菌,二者参与硝化作用,其在2个装置的阴极与阳极均有发现,但Nitrospira在闭路运行模式的CW-MFC阴极丰度最高。由此说明,在装置阳极与阴极均有硝化作用发生,但装置阴极发生的硝化作用更强,而装置阳极发生硝化作用的原因可能是由于进水中含有一定的溶解氧。Desulfuromonas在参与硫的转化中同样会产生电子,高丰度的Desulfuromonas可能会使SMX中的S=O化学键断裂,从而提高抗生素去除率[34]。因此,闭路运行模式下CW-MFC更高的产电性能和抗生素去除效率可能与其更高的Desulfuromonas相对丰度有关。2个装置的阴极的主要菌属为地杆菌属(Geobater)、固氮弧菌属(Azoarcus)、Sulfuritalea、Nitrospira等菌属。Azoarcus是CW-MFCs系统阴极相对丰度最高的菌属,这是一种广泛存在于自然界中的兼性厌氧菌,是参与污水中的

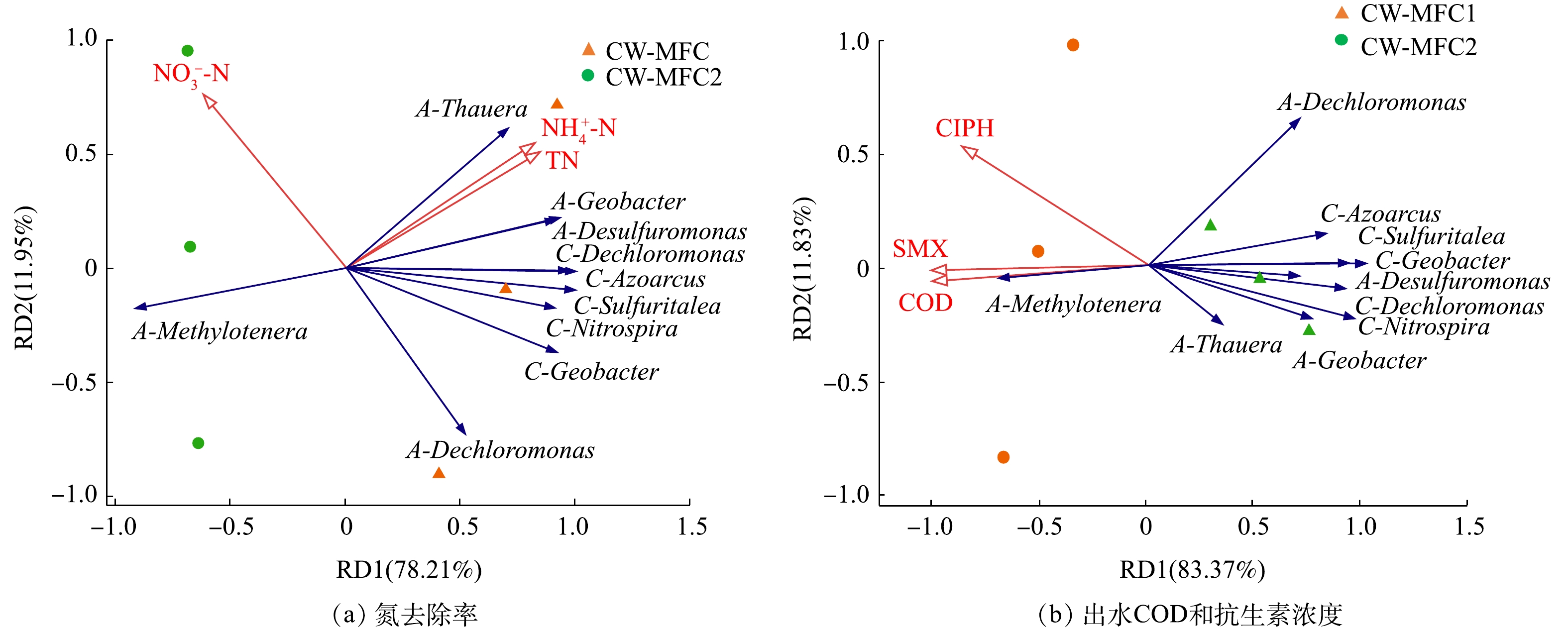
2.4. 不同运行模式下微生物群落与污染物去除之间的关系
分别选取阳极与阴极已归类的相对丰度前5的细菌属和









































2)闭路运行与开路运行的CW-MFC系统均能够有效去除污水中的抗生素,去除率大于99%。闭路运行的CW-MFC去除效果更好。
3)闭路运行模式会提高微生物丰富度与多样性,同时会对微生物群落结构产生影响,从而影响废水中污染物的去除能力。
参考文献





 下载:
下载: 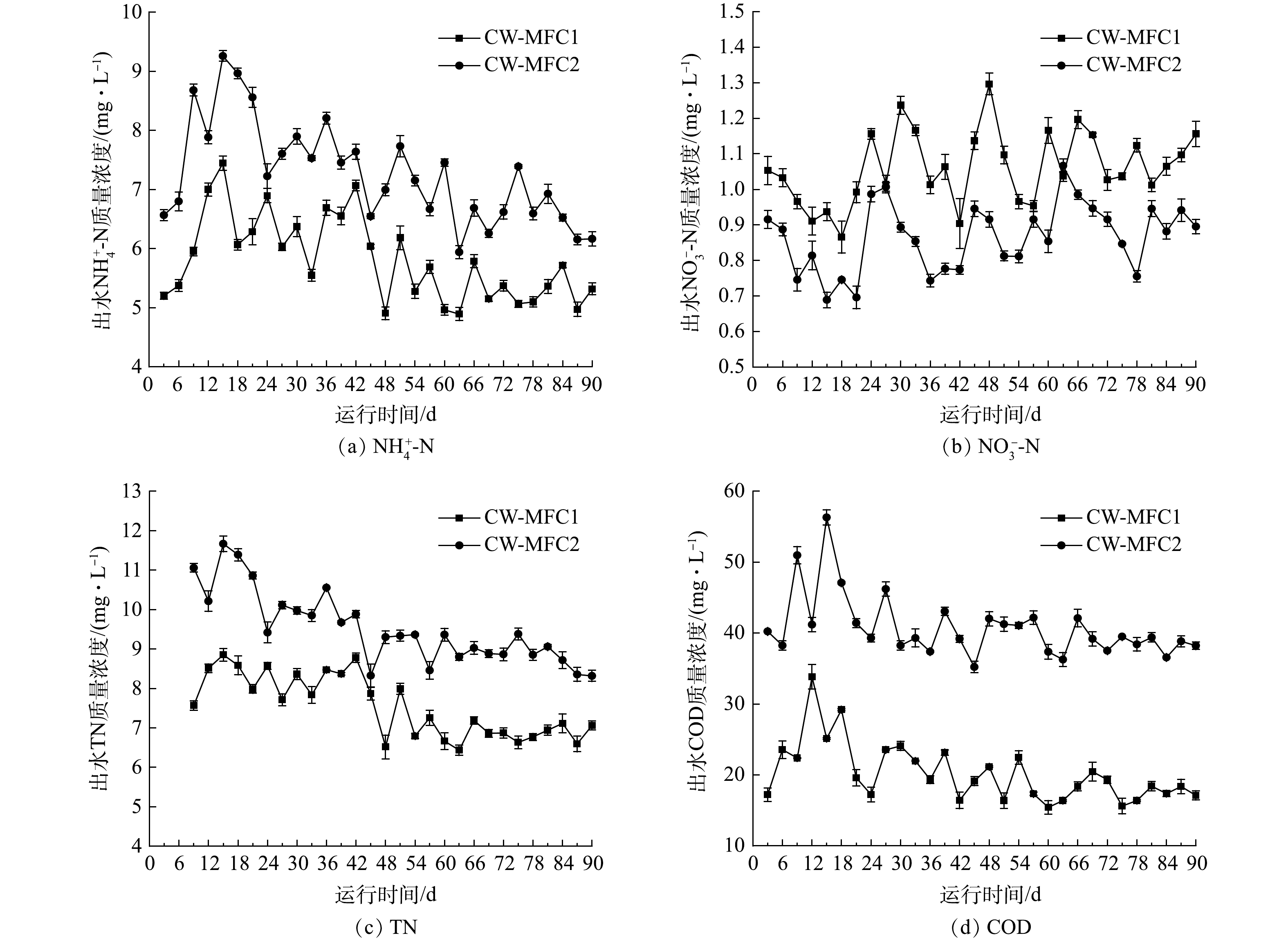










 点击查看大图
点击查看大图