全文HTML
--> --> --> 厌氧氨氧化工艺氮去除负荷高、无需外加有机碳源、污泥产量低、运行成本低,但因厌氧氨氧化菌生长速度慢、倍增时间长,且对环境条件变化较为敏感,使得厌氧氨氧化工艺启动耗时较长,这极大地限制了厌氧氨氧化技术的工程应用[1]。Dokhaven污水厂的厌氧氨氧化(anaerobic ammonia oxidation,ANAMMOX)工艺耗时3.5 a成功启动[2]。因此,厌氧氨氧化菌(anaerobic ammonia oxidizing bacteria,AnAOB)的高效富集、ANAMMOX工艺的快速启动及稳定运行引起研究者的广泛关注。ANAMMOX工艺的快速启动与接种污泥性质、反应器类型密切相关[3]。不同类型的好氧、厌氧污泥均可用于ANAMMOX工艺启动。好氧污泥虽菌群丰富,但其所含厌氧菌属较少,启动期会相应较长;厌氧反硝化污泥中含有的反硝化菌与AnAOB同属厌氧菌,可省去好氧转向厌氧环境时的污泥适应阶段,完成AnAOB的富集,可缩短工艺启动市场,但其沉降性能较差,启动过程中易出现污泥流失[4];而经厌氧消化后的剩余污泥具有良好沉降性能,且来源广泛、易于获取,污泥碳氮比含量低、高氨氮适应性强、厌氧菌含量高且与AnAOB的代谢基质相近,较适合作为ANAMMOX工艺启动的接种污泥。反应器类型直接影响污泥固体停留时间(solid retention time,SRT)、水流上升流速等,进而影响AnAOB富集、工艺启动速度、工艺运行稳定性等;序批式反应器(sequencing batch reactor,SBR)、序批式生物膜反应器(sequencing batch biofilm reactor,SBBR)、膜生物反应器(membrane bioreactor,MBR)、生物滤池均可成功启动ANAMMOX工艺[5-7]。上流式厌氧污泥床(upflow anaerobic sludge blanket,UASB)反应器作为第2代厌氧反应器的杰出代表,具有较好的污泥持留能力和基质传质效果,可为AnAOB的生长提供良好的环境,其在ANAMMOX工艺运行中的优势已逐步显现。WANG等[8]将厌氧氨氧化颗粒污泥接种于UASB反应器(22 L),经过178 d启动及稳定运行,氮容积负荷(nitrogen loading rate,NLR)和氮去除负荷(nitrogen removal rate,NRR)可高达8.25 kg ·(m3·d)?1(以N计)和6.93 kg·(m3·d)?1(以N计)。
因此,本研究以厌氧消化污泥为接种污泥,以UASB反应器为反应装置启动ANAMMMOX工艺,研究了ANAMMOX-UASB反应器启动过程的生物特性,考察了ANAMMOX- UASB启动运行过程中的污泥表观形态、脱氢酶及胞外聚合物的变化,分析了启动过程中胞外聚合物结构、组成的特征,解析了功能菌群动态演替规律,以期探明ANAMMOX-UASB启动过程中的生物特性,为厌氧氨氧化工艺的快速启动与工程应用提供参考。
1.1. 实验装置
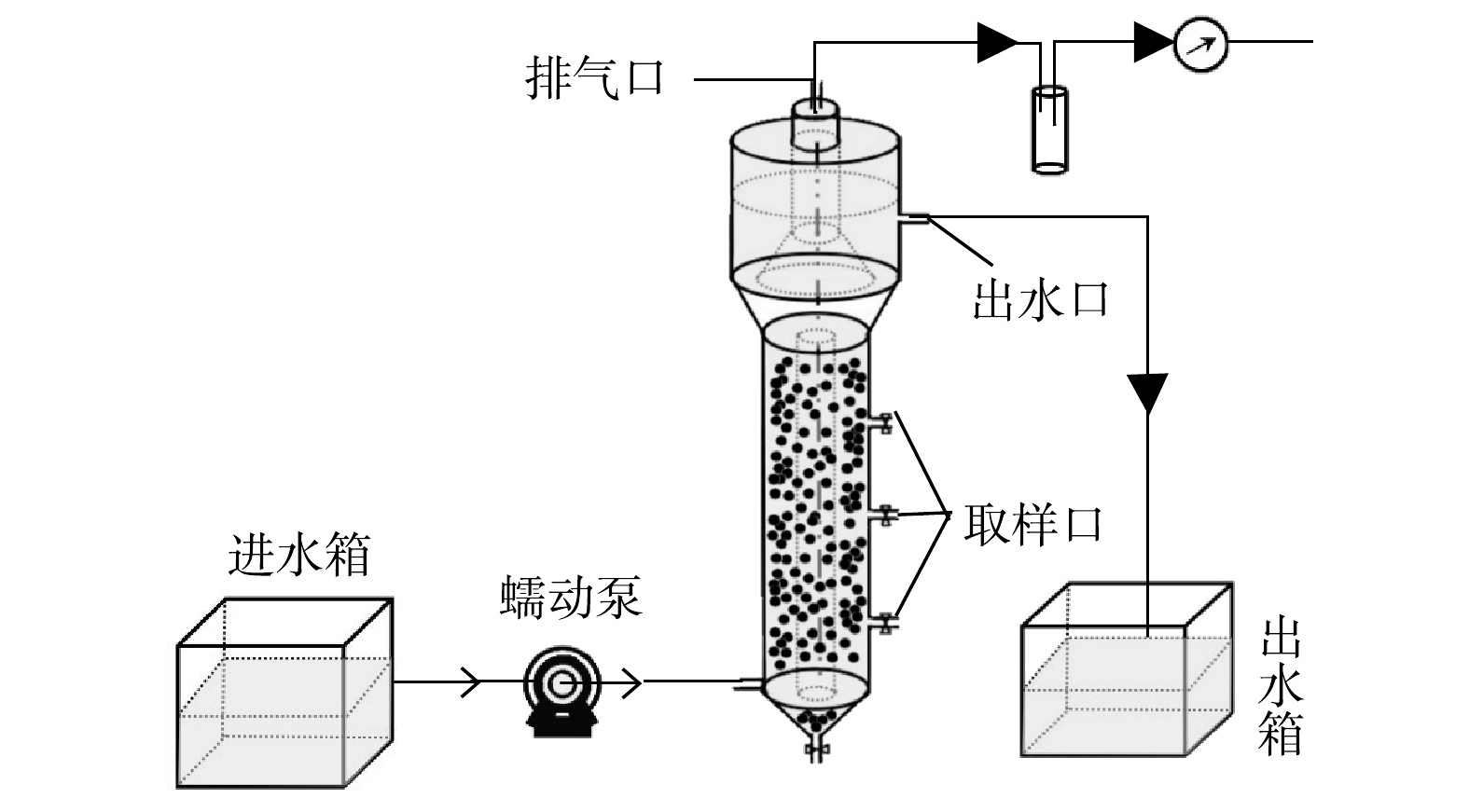
所采用的实验装置如图1所示,UASB反应器呈圆柱结构,由有机玻璃制成,总容积为3.5 L,有效容积为1.4 L,其中反应区内径6 cm,高度50 cm。模拟废水由蠕动泵从UASB反应器底部连续泵入,从下至上依次经反应区、沉淀区后,最后经出水口排出;产生的气体经顶部排气孔排出。反应区部分采用黑布包裹以避免光照对AnAOB产生的不利影响。反应器工作温度为(35±1) ℃。1.2. 接种污泥
实验中所用接种污泥取自青岛市某污水处理厂厌氧消化罐,污泥形态呈黑褐色絮状。混合液悬浮固体质量浓度(mixed liquid suspended solids,MLSS)约为47.39 g·L?1,混合液挥发性悬浮固体质量浓度(mixed liquor volatile suspended solids,MLVSS)约为22.77 g·L?1,MLVSS/MLSS为0.48。接种污泥量为1.2 L。1.3. 实验废水
实验废水采用人工模拟废水,

1.4. 分析测定方法



三维荧光光谱(three-dimensional excitation-emission matrix fluorescence spectroscopy,3D-EEM)采用荧光光度计(F-4 600, Hitachi, Japan)测定样品中LB-EPS和TB-EPS的三维荧光光谱[14]。激发波长(Ex)和发射波长(Em)分别为200~450 nm和240~550 nm,扫描间隔为5 nm,扫描速度采用1 200 nm·min?1。用超纯水作为空白样品校正水的拉曼散射。实验数据采用Origin绘图分析。
聚合酶链式反应(polymerase chain reaction,PCR)及高通量测序:采用Power Soil DNA Isolation Kit按照操作步骤提取样品中DNA,使用1%(质量分数)的琼脂糖凝胶电泳检测DNA浓度和质量。采用细菌16S rRNA基因V3+V4扩增区域,引物为341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC),对DNA进行PCR扩增,扩增体系及扩增条件按彭广生等[15]方法进行。PCR扩增产物使用OMEGA胶回收纯化试剂盒纯化后4 ℃保存。样本交由北京诺禾致源生物信息科技有限公司进行DNA提取和测序。利用Illumina HiSeq高通量测序技术在HiSeq 2500系统进行测序。
2.1. 污泥表观形态
ANAMMOX-UASB反应器接种污泥为絮状黑褐色厌氧消化污泥(图2(a))。随着启动运行,污泥内有机物不断消耗、异养菌逐渐死亡,导致反应器污泥层高度逐渐下降。第53天,絮状污泥颜色逐渐转变为黄褐色,且部分区域污泥呈现团聚体状。自第100天起,反应器内出现小颗粒状污泥,且部分已呈现浅红色(图2(b)),结合此过程反应器脱氮性能可断定厌氧氨氧化反应已明显显现。此时,反应器内的污泥与郑平等[17]报导的厌氧氨氧化颗粒污泥形状一致,说明絮状污泥逐渐颗粒化,厌氧氨氧化污泥初步形成。颗粒污泥呈现红色是由于厌氧氨氧化菌体内含有丰富的细胞色素c,污泥发红程度可以反映厌氧氨氧化菌的富集程度,可以作为肉眼判断厌氧氨氧化活性的依据[18]。随着ANAMMOX-UASB反应器继续运行,絮状污泥颗粒化进一步加强,至第250天时,反应器内以不规则状的红色颗粒污泥和褐色絮状污泥为主(图2(c)),此时NRR维持在2 kg·(m3·d)?1左右,厌氧氨氧化菌已成功富集。2.2. 脱氢酶(DHA)活性
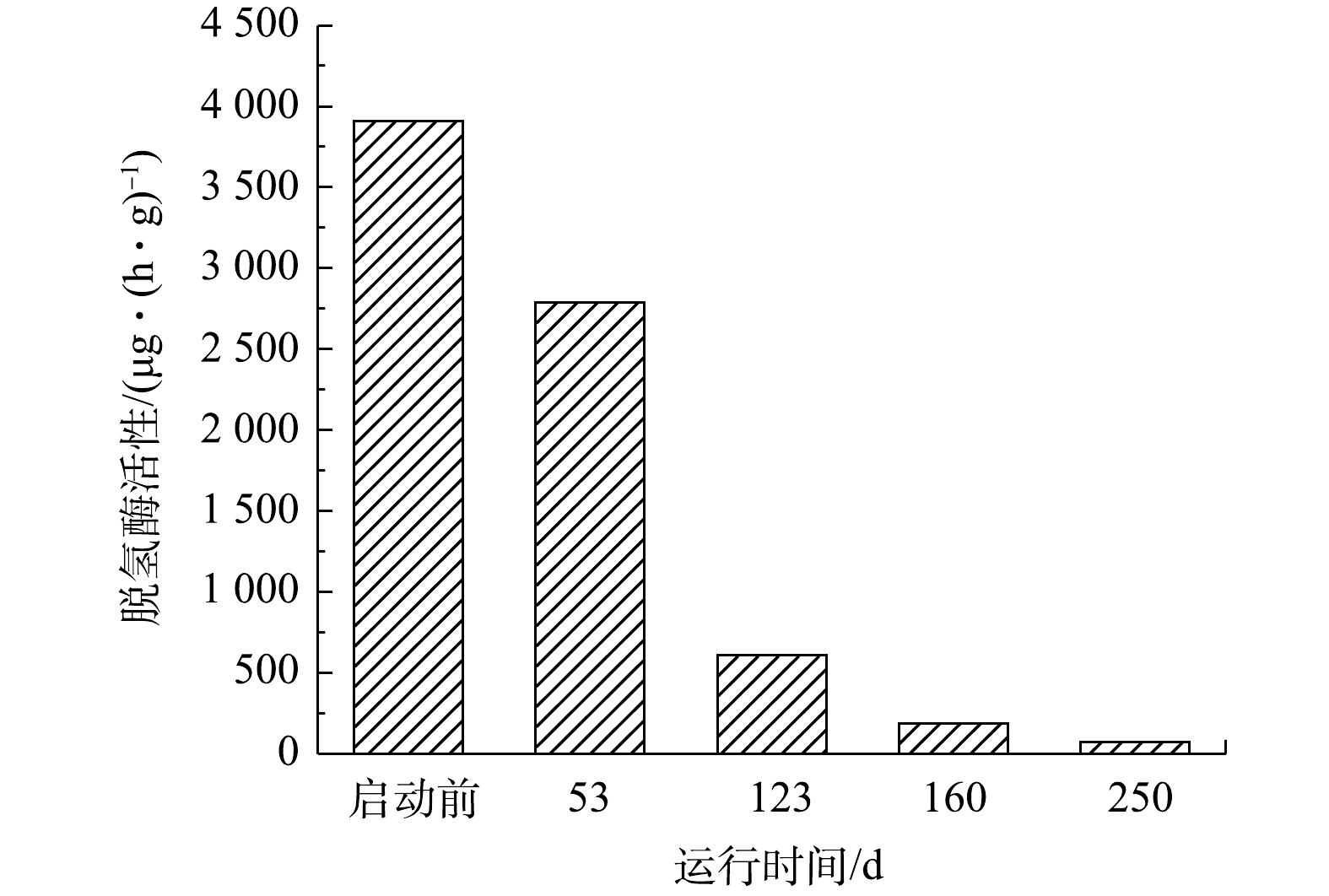
脱氢酶主要参与微生物降解有机物的过程[10],也可以参与某些细胞的合成。一氧化碳脱氢酶是乙酰辅酶A途径的关键酶。尽管厌氧氨氧化菌不以有机物为碳源,但仍有脱氢酶活性。ANAMMOX-UASB反应器启动过程中脱氢酶活性变化,可以反映出厌氧氨氧化工艺启动过程中污泥中异养菌的消长情况,结果见图3。由图3可知,因接种污泥为厌氧消化污泥,其异养微生物丰度较高,脱氢酶活性为3 909.51 μg·(h·g)?1(以TF计)。在第53天,污泥的脱氢酶活性降低至2 788.809 μg·(h·g)?1,这主要是由内源有机物量降低,异养微生物逐步衰亡、自溶等造成。随着启动过程的继续(53~250 d),厌氧氨氧化菌丰度逐步增加,异养菌含量进一步降低,脱氢酶活性大幅度降低,最终降至72.13 μg·(h·g)?1。LIN等[19]利用厌氧氨氧化污泥作为接种污泥启动厌氧氨氧化工艺时,启动前脱氢酶活性为684 μg·(h·g)?1,成功启动后脱氢酶活性降为252 μg·(h·g)?1。KIM等[20]的研究表明,异养菌脱氢酶参与了有机化合物的同化和异化反应,自养菌的脱氢酶主要参与有机化合物的同化,异养菌的脱氢酶活性远高于自养菌脱氢酶。在厌氧氨氧化工艺启动中,因进水基质无有机物,污泥中异养菌大量裂解死亡,导致脱氢酶活性大幅下降;厌氧氨氧化菌虽然不利用有机物进行分解代谢,但仍以CO2作为无机碳源,通过乙酰辅酶A途径合成自身细胞物质,故工艺在成功启动后仍具有一定的脱氢酶活性。2.3. 胞外聚合物(EPS)
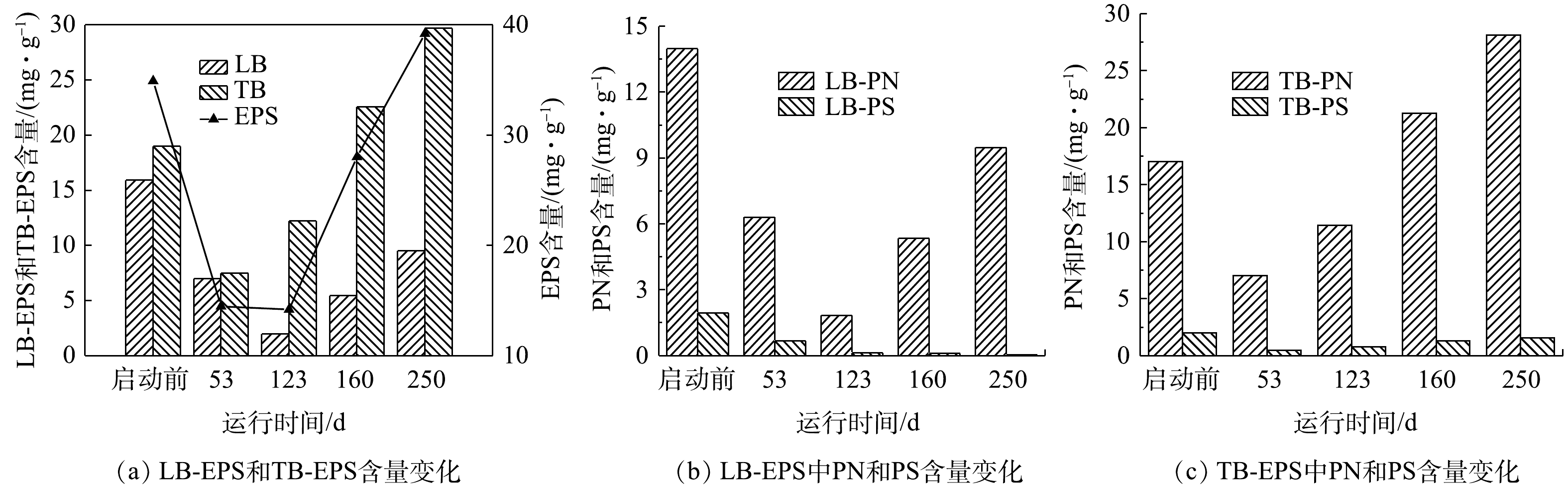
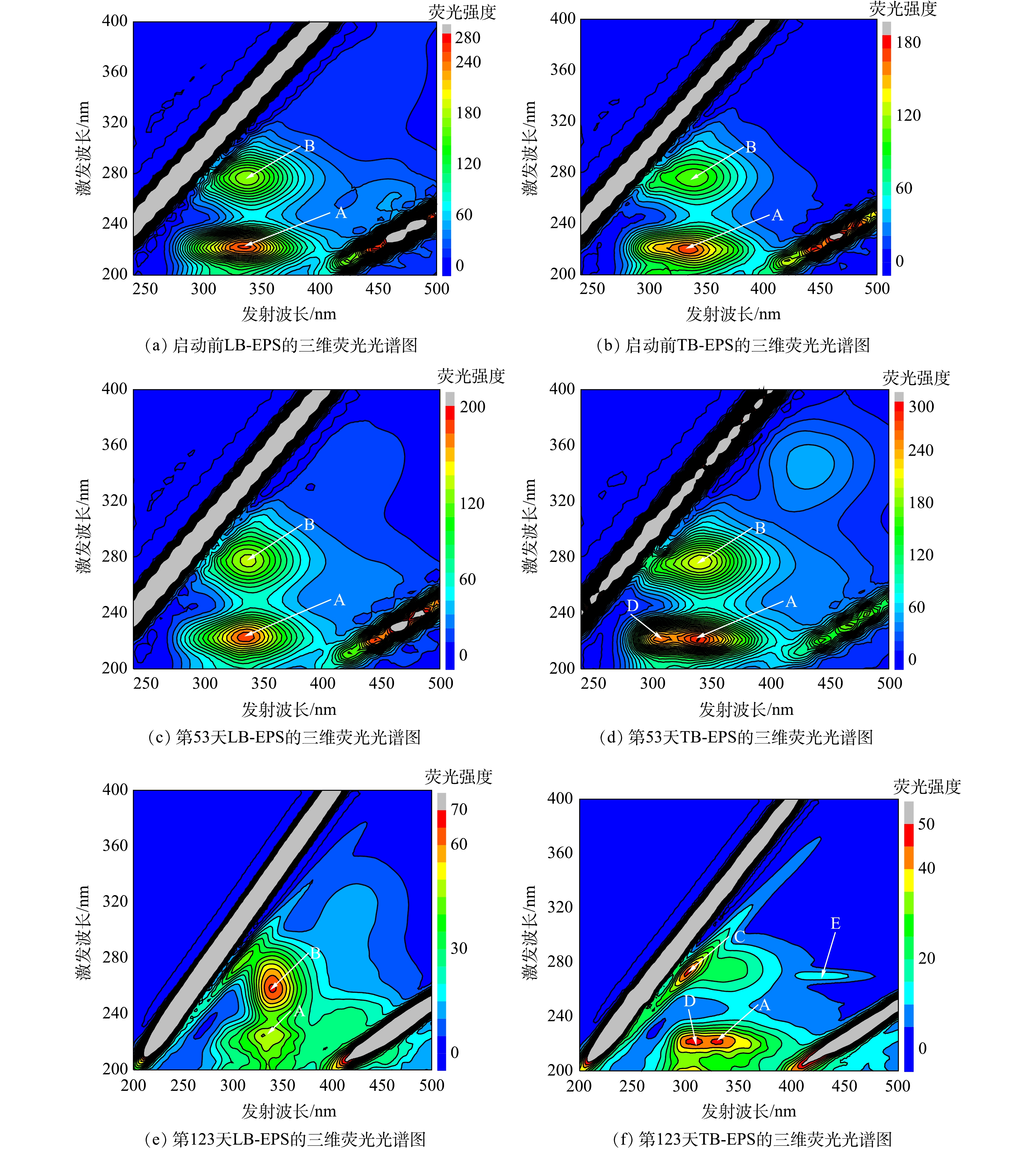
1) EPS含量。EPS是厌氧氨氧化污泥的重要组成部分,厌氧氨氧化细菌会嵌入到由细胞和EPS组成的聚集体中[21]。EPS具有流动性的双层结构,是由松散附着的外层(LB)和紧密黏附的内层(TB)组成,EPS的主要成分是蛋白质(PN)和多糖(PS)[22]。ANAMMOX-UASB反应器启动过程中EPS含量及组成见图4。由图4可知,第0~53天,EPS含量快速降低,由初期的34.91 mg·g?1(以VSS计)(0 d)下降为14.48 mg·g?1(53 d),PN/PS由7.88(0 d)升至11.58(53 d);EPS中TB/LB由1.19变为1.07。第53~123天,EPS含量略降至14.19 mg·g?1,PN/PS由11.58升至14.25;EPS中TB/LB为6.21。第123~160天,EPS含量逐渐上升至28.02 mg·g?1,PN/PS进一步升至18.59;EPS中TB/LB为4.15。第160~250天,EPS含量继续升至39.21 mg·g?1,PN/PS升至23.20;EPS中TB/LB变为3.12。EPS中PN含量变化大,PS含量变化相对较小,且在启动过程中PN/PS持续上升。启动过程中EPS均以TB-EPS为主;LB-EPS中LB-PN/LB平均值93.8%,TB-EPS中TB-PN/TB平均值为93.1%,各分层EPS中均以PN为主,表明EPS中蛋白质在ANAMMOX-UASB启动过程中起关键作用,这与GUO等[23]报道的研究结果一致。大量的PN产生可能来源于细胞死亡后的释放、细胞的分泌以及EPS中含有大量胞外酶所致。PN是疏水性基团,PS是亲水性基团,MA等[24]的研究表明,EPS中PN的含量与污泥的絮凝和沉降能力成正相关,较高的PN含量可以增强微生物聚集体的凝聚性。DONG等[25]的研究表明,PN中带正电荷的氨基可以中和羧基的负电荷,从而加剧污泥的絮凝。CHEN等[21]发现,PN/PS越大,污泥的沉降性能越好。在ANAMMOX-UASB启动过程中,PN/PS由启动前的7.88增至23.20,与絮状污泥逐渐颗粒化及其沉降性能逐渐增强的变化趋势一致。2) EPS组分的荧光特性。污泥EPS中含有大量荧光特性的物质,可利用三维荧光分光光度法分析EPS组成特征。启动过程中第0、53、123天的LB-EPS和TB-EPS三维荧光光谱如图5所示。由图5可知,ANAMMOX-UASB在启动过程中共观察到5个荧光峰(A~E)。其中,荧光峰A(220~225 nm/330~340 nm)为芳香族蛋白类物质;荧光峰B(260~275 nm/335~340 nm)为色氨酸蛋白类物质;荧光峰C(270~275 nm/300~305 nm)与酪氨酸蛋白类物质有关;荧光峰D(220 nm/310~320 nm)与简单芳环蛋白类物质有关,荧光峰E(270 nm/425 nm)为富里酸类物质[26]。
荧光峰A、B在污泥启动过程的LB-EPS和TB-EPS中均存在,说明在启动过程中的EPS均以蛋白质为主;虽然LB-EPS和TB-EPS所处位置不同,但其组分和结构基本相同。在LB-EPS中仅存在荧光峰A和B,无其他荧光峰,且启动过程中LB-EPS的结构与组成并未发生较大变化。在第53天时TB-EPS中,除存在荧光峰A和B,还出现荧光峰D,说明此阶段有简单芳环蛋白类物质产生;第123天时,出现荧光峰C和E,荧光峰B消失,说明部分色氨酸蛋白类物质转化为酪氨酸蛋白类物质[27]。三维荧光结果表明,在ANAMMOX-UASB启动过程中污泥EPS中的TB-EPS的结构和组成均会发生变化。
ANAMMOX-UASB启动过程中LB-EPS和TB-EPS中各峰光谱参数见表2。由表2可知,荧光峰会向更长的波长移动(称为红移),或向更短的波长移动(称为蓝移)。在LB-EPS中,第123天荧光峰A沿Ex方向蓝移5 nm,沿Em方向红移5 nm;荧光峰B沿Ex方向蓝移15 nm,沿Em方向红移5 nm。在TB-EPS中,第53天时荧光峰A沿Em方向红移10 nm,但至第123天时沿Em方向蓝移10 nm,与启动前相同;荧光峰B沿Em方向红移5 nm。上述研究结果表明,波长移动与EPS中各成分的结构变化密切相关,其中波长红移与含羰基取代基、羟基、烷氧基、氨基和羧基含量增加相关联,而波长蓝移则与芳香酯基减少,芳香环数下降,共轭键数的降低和羰基、羟基和氨基的减少直接相关。荧光峰波长及峰强度的变化说明ANAMMOX-UASB启动过程中污泥EPS中的组分、结构均发生变化。
2.4. 微生物群落
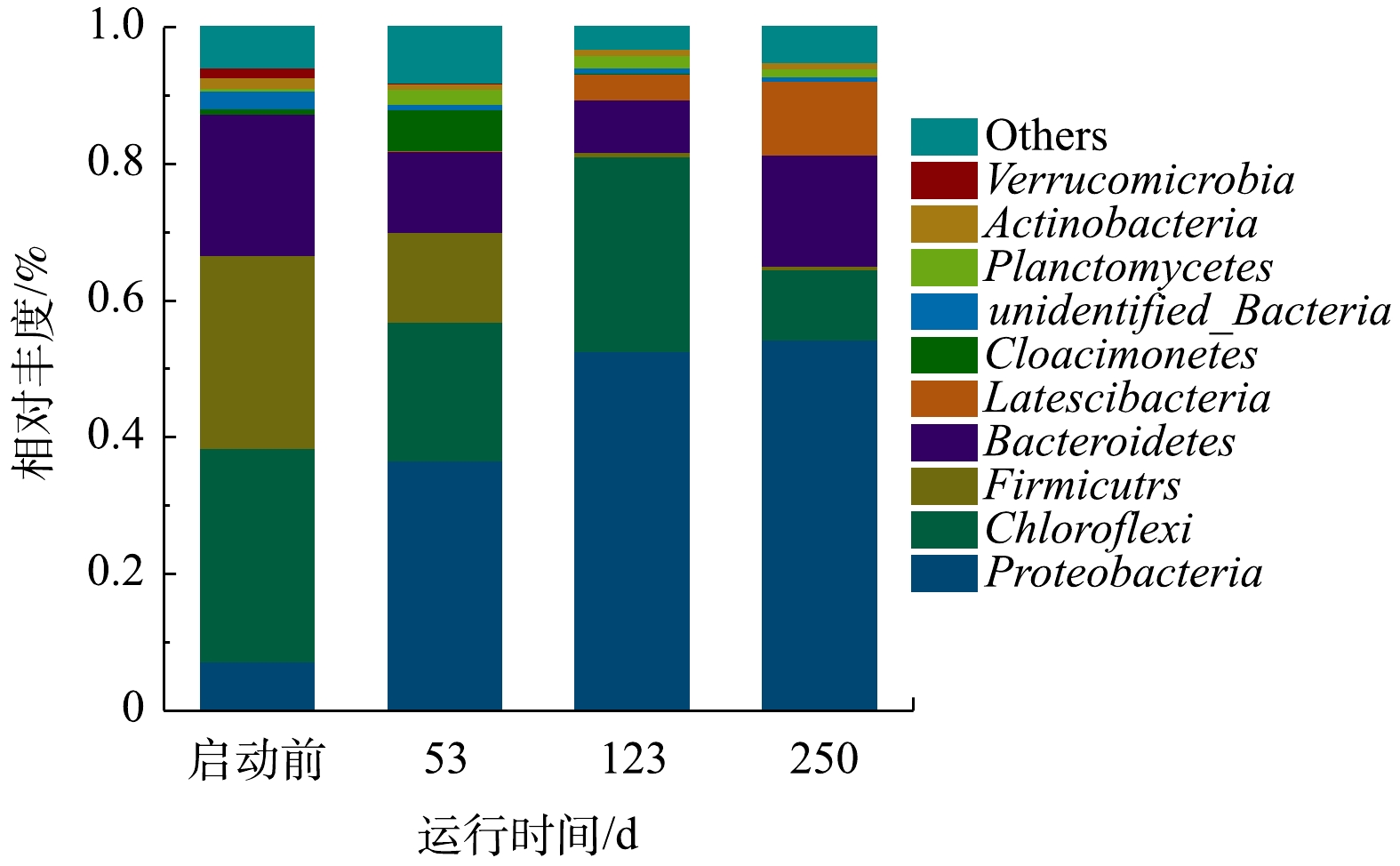
1)微生物多样性和丰富度分析。ANAMMOX-UASB启动过程中的微生物多样性和丰富度如表3所示。由表3可知,所有样品的覆盖率均大于99%。这表明样品数据涵盖的物种充足,微生物群落丰富度和多样性结果具有较高的可靠性和真实性[28]。ACE和Chao1指数可以表征物种的丰富度,其值越大,所含物种越丰富。Shannon指数常用来评价生物群落组成复杂程度,其值越大,表明群落复杂程度越高[29]。Simpson指数更倾向于反应群落的均匀性,其值越大,表示优势菌群占总体生物菌群比例越大[30]。由表3可知,接种污泥的Chao1和ACE指数分别为594.16和583.74,第53天的Chao1和ACE指数分别上升至最大值,为695.08和682.31。这表明此时的群落中所含物种最丰富,结合启动中出水指标可得,此时反硝化菌、氨化菌、厌氧氨氧化菌共存。第250天分别下降到351.00和312.34,表明工艺启动成功后,微生物以自养厌氧氨氧化菌为主,群落丰富度有所下降。接种污泥的Shannon指数为5.19,第53天上升至最大值为6.06,表明此时群落复杂度最大;第250天降低至4.43,其原因是反应器成功启动后,厌氧氨氧化菌的丰度不断升高,其他微生物的丰度逐渐降低,导致微生物群落复杂度有所下降。接种污泥的Simpson指数为0.92,第53天上升至最大值0.96,表明此时反应器内优势菌群所占的比例也最大;第250天下降为0.87,较接种污泥略有降低,表明反应器启动成功后,优势菌群所占的比例有所下降。2)微生物门水平物种丰度分析。将微生物在门水平上丰度前10的物种绘制成物种相对丰度柱形累加图(图6)。主要为变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、Latescibacteria菌门、Cloacimonetes菌门、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)。其中浮霉菌门和变形菌门为脱氮功能菌。变形菌门在各个样品中占最大比例,在启动过程中丰度逐渐上升,由7.22%上升到54.40%。曹雁等[31]利用上流式厌氧过滤床(upflow blanket filter,UBF)反应器启动厌氧氨氧化工艺,启动成功后变形菌门增加了12%。杨开亮等[32]利用SBR接种活性污泥启动厌氧氨氧化工艺时,变形菌门在启动过程中丰度逐渐下降。上述研究结果不同,可能与反应器类型、接种污泥类型、运行参数及环境条件等不同有关。沈耀良等[33]在厌氧折流板(anaerobic baffled reactor,ABR)反应器中发现各隔室中变形菌门为主要菌种,其在脱氮方面占有重要地位。绿弯菌门是厌氧氨氧化系统中常见的伴生菌门,接种污泥的丰度为31.23%,第53天下降为20.32%,第123天反应器启动成功时丰度上升为28.52%。CHEN等[34]研究发现,绿弯菌门是兼性厌氧菌,在厌氧氨氧化污泥中起到支撑和骨架作用,可作为形成小颗粒污泥的框架粒子,也可作为颗粒污泥的载体,从而有利于厌氧氨氧化颗粒污泥的形成。MIAO等[35]的研究表明,厚壁菌门对反硝化有重要作用,厚壁菌门丰度由28.27%下降为5.55%,说明ANAMMOX-UASB启动过程中异养反硝化菌因环境条件改变大量裂解死亡。浮霉菌门为主要的自养脱氮功能菌群,厌氧氨氧化菌归属此菌门;接种污泥浮霉菌门丰度仅为0.34%,第123天启动成功时其丰度增至1.89%,表明反应器内富集了一定量的厌氧氨氧化菌。其他研究者也发现,厌氧氨氧化工艺启动过程中变形菌门丰度始终高于浮霉菌门丰度。如朱彤等[36]发现,在厌氧氨氧化反应器启动成功后,虽然变形菌门丰度有所下降,但仍高于浮霉菌门。
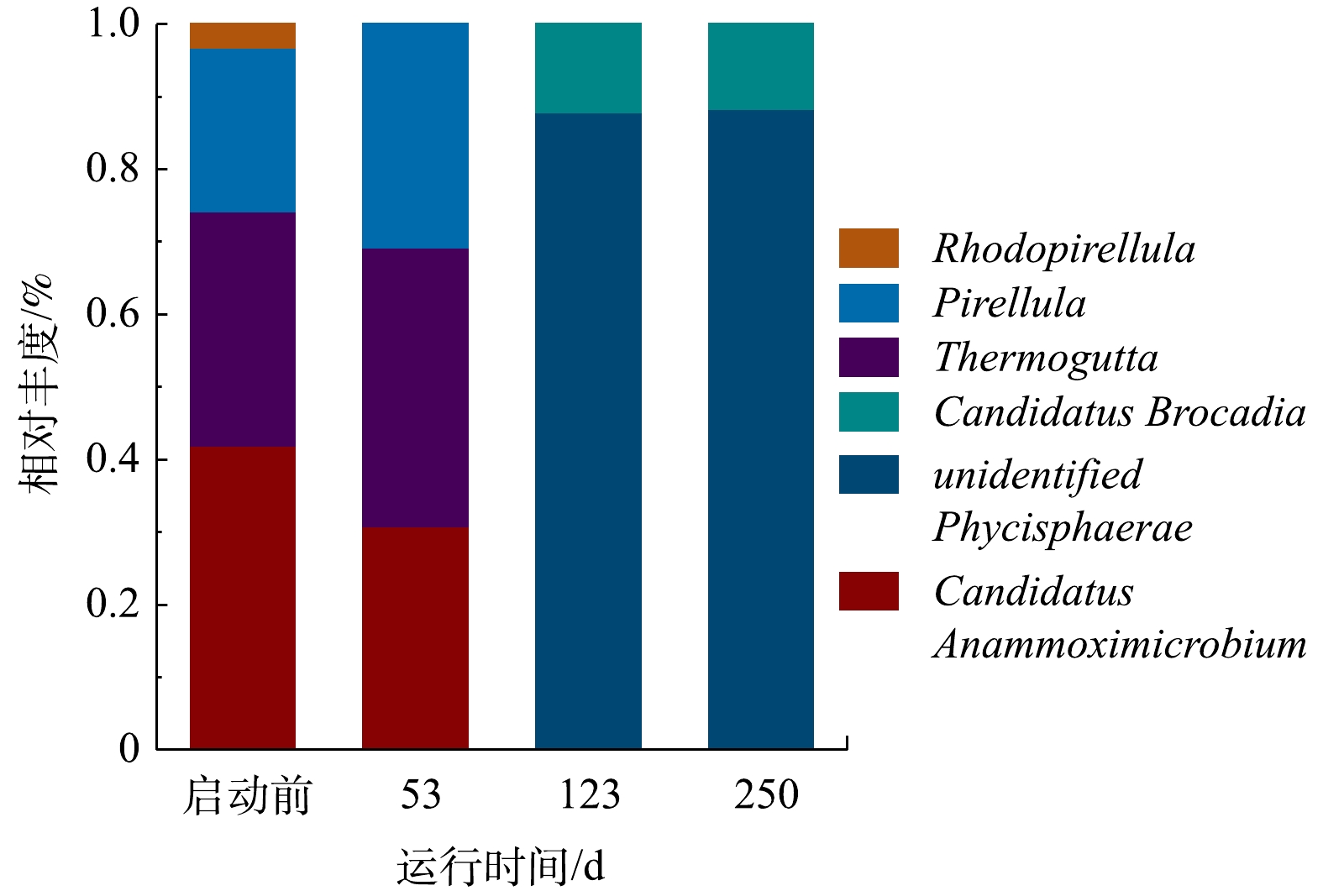
3)微生物属水平物种丰度分析。由于厌氧氨氧化菌属于浮霉菌门,因此,对浮霉菌门进行属水平的分析(图7)。浮霉菌门有unidentified_Phycisphaerae、Candidatus_Anammoximicrobium、Candidatus_Brocadia、Thermogutta、Pirellula和Rhodopirellula。在已知的6种厌氧氨氧化菌属中,启动过程中存在2种厌氧氨氧化菌属,分别为Candidatus Anammoximicrobium和Candidatus Brocadia。接种污泥中Candidatus Anammoximicrobium的丰度为40.94%,第53天下降到30.77%,第123天下降为0。杨瑞丽等[29]进行厌氧氨氧化工艺启动时,观察到Candidatus Anammoximicrobium丰度随NLR增大而逐渐降低,第172天下降到0,其可能的原因是Candidatus Anammoximicrobium生长速率较慢、亚硝酸盐亲和力较低以及对水质变化的抵抗力较弱。第123天,Candidatus Brocadia是反应器内唯一的厌氧氨氧化菌,其丰度为12.15%,第250天,下降到11.63%。曹雁等[31]利用UBF反应器培养厌氧氨氧化细菌时,Candidatus Brocadia的丰度由0.01%增加到1.00%。VAN DER STAR等[37]发现Candidatus Brocadia适合存在于高含氮浓度废水中。本实验中,进水氨氮质量浓度由50 mg·L?1提高到300 mg·L?1,属于高含氮废水,更适合Candidatus Brocadia生长,故Candidatus Brocadia启动过程中可得到有效富集,成为优势菌属。有研究[38]表明,由于生存环境的不同,厌氧氨氧化菌的群落结构存在差异,在稳定的生长环境中,通常只有1个属种的厌氧氨氧化菌占优势,这与本研究结果类似。
2)在ANAMMOX-UASB启动过程中,Chao1、ACE、Shannon和Simpson指数均呈现先升后降的趋势,启动过程中污泥的优势菌门为变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)。浮霉菌门中Candidatus Anammoximicrobium丰度逐渐降低直至消失,而Candidatus Brocadia丰度最终增至12.15%。
参考文献

 下载:
下载: 















 点击查看大图
点击查看大图