全文HTML
--> --> -->本文将介绍STED的基本原理及系统的主要组成部分, 重点介绍近年来STED技术各方面性能提升的实现方式以及STED与其他技术相结合的情况.
2.1.STED显微技术的基本原理
传统光学显微技术即使在很大程度上消除了像差和提高了放大倍率, 但其分辨率始终无法实现突破, 主要是受到光学系统衍射效应的限制, 即一个理想的物点在经过光学系统成像后, 在成像面上形成具有一定尺寸的衍射斑. 观测物可以被视为由多个物点组成, 在像面上则会形成多个衍射光斑, 当衍射光斑之间的距离近到一定程度时就无法区分开, 称为衍射极限. 在荧光显微镜中, 被衍射光斑照射的区域发出荧光, 形成一个荧光光斑. STED技术针对荧光光斑受衍射影响而扩大的情况, 对光束进行空域上的调制, 有效地压缩了光斑的点扩散函数(point spread function, PSF), 实现超分辨成像. 具体原理是: 利用两束激光来进行显微成像, 其中一束为激发光, 用于激发荧光分子; 另一束是中心强度为零的中空形圆环状STED光(也称为损耗光), 其与激发光共轴且波长与荧光分子发射波长匹配. 激发光使基态能级S0上的电子跃迁到激发态能级S1, 在没有外界干扰的情况下这些激发态的电子将会以自发辐射荧光的形式回落到基态, 如果处在激发态的电子在环形STED光照射下将会发生受激辐射效应, 导致STED光照射区域产生光子的波长有别于自发辐射区域的光子波长, 相较于自发辐射区域, STED光照射区域分子处于暗态, 视为不发荧光(如图1(a)). 由于两束光重叠区域产生受激辐射, 只有中心区域发出荧光, 因此减小了激发光斑的有效面积, 即减小了PSF, 实现了空间分辨率的提高(如图1(b)). STED系统的横向空间分辨率, 可用公式表示为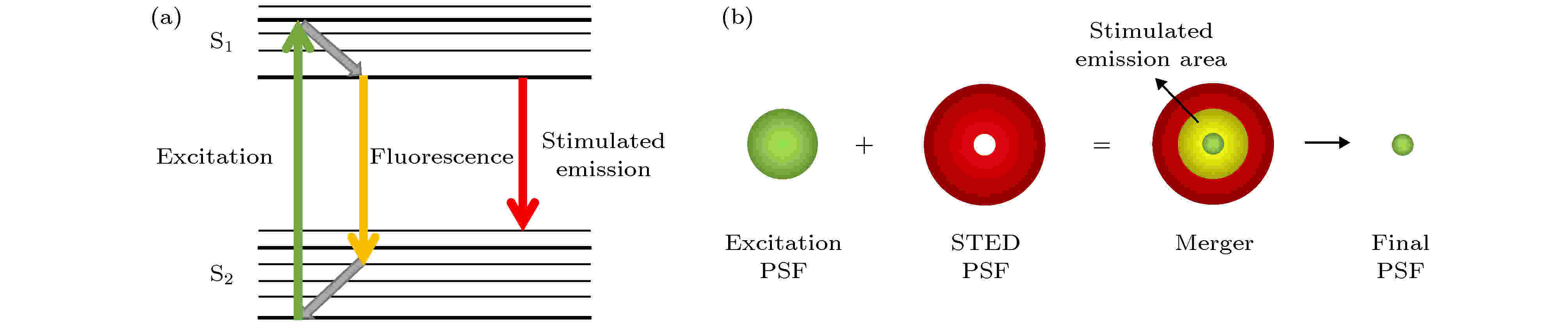 图 1 STED的原理图 (a)能级辐射示意图; (b)光束重合示意图
图 1 STED的原理图 (a)能级辐射示意图; (b)光束重合示意图Figure1. The concept of STED: (a)The concept of stimulated emission; (b)the overlapping of beams.
2
2.2.STED系统的基本组成
典型的点扫描式STED系统一般由光源(图2红色虚线框)、光束耦合单元(图2绿色虚线框)、扫描单元(图2橙色虚线框)与成像单元(图2蓝色虚线框)等四个部分组成.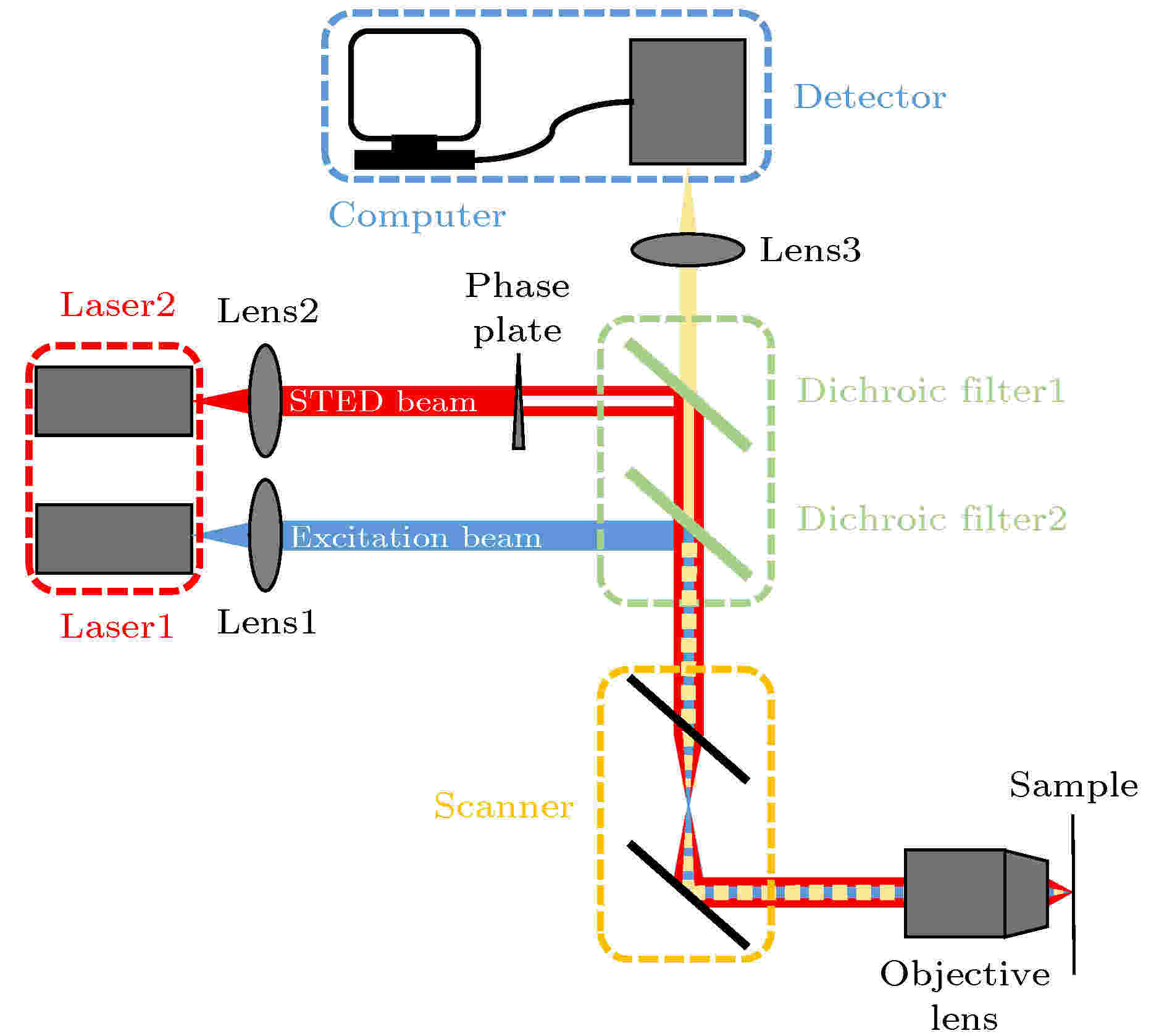 图 2 STED系统图
图 2 STED系统图Figure2. The setup of STED system.
一般的单色STED超分辨成像系统需要两个单波长输出的激光器作为光源, 第一个激光器产生激发光束, 其波长处于荧光分子激发谱的波峰附近. 第二个激光器产生STED光束, 其波长处于荧光分子发射谱的拖尾附近, 避免对荧光分子产生二次激发. 此外, 脉冲光在时间上具有可分离性, 为了保证激发光与STED光到达样品时的先后顺序, 激发光与STED光一般都是脉冲光. 在光源的强度上, 为了保证一定的擦除效果以获得高的分辨率, STED系统中的STED光强度一般为10—103 mW量级.
要实现对PSF的调制, 关键是需要对STED光进行调制, 并保证激发光束与STED光束高度重合. 一般使用涡旋相位板(vortex phase plate, VPP)或空间光调制器(spatial light modulator, SLM)来对STED光的波前进行调制以产生环形光, 其中心强度趋近于零的区域必须小于激发光的光斑大小. 利用二向色镜对STED光与激发光的反射率和透射率的不同来实现激发光与STED光的重合, 不仅要实现横截面上两个光斑的重合, 也要保证在Z轴上高度重合. 此外, 二向色镜还需要对样品返回的荧光有透射作用.
激发光与STED光重合之后, 通过扫描单元如扫描振镜, 实现光斑在样品上的扫描, 从而实现二维面阵成像. 在点扫描STED成像系统中, 扫描单元的扫描速度直接决定了系统的成像速度.
3.1.STED系统光源部分的改进
为了实现更高的空间分辨率, STED系统通常需要具有很高功率的STED光, 因此, 在早期的STED系统中, 激发光多为皮秒激光器, 而STED光通常是对具有很高功率的飞秒激光器进行展宽而得到的高能宽脉冲激光, 所达到的最高分辨率为2.4 nm[2]. 虽然用飞秒激光器作为STED光能够获得超高的分辨率, 但是飞秒激光器成本高, 难以普及. 对于早期的STED系统, 最常用的光源是脉冲宽度80 ps的激发光与脉冲宽度200 fs的STED光. 其中, STED光需要进行约1000倍的脉冲展宽. 此外, 还需要将激发光与STED光进行时间同步, 确保STED光脉冲在样品已经被激发到激发态但是还没有发生自发辐射的这个时间段到达样品, 这使得脉冲型STED系统较为复杂. 脉冲光在带来更高峰值功率的同时, 也更容易对生物活体样品造成损伤.2007年, Willig等[3]发现可以利用连续光(continuous wave, CW)进行STED成像. 若CW激发光以Kexc的速率进行激发时, 认为S1被电子填充的概率为N1:


3
3.1.1.使用超连续脉冲激光器作为光源
2008年Wildanger等报道了一种基于光子晶体光纤的超连续谱STED显微镜[4], 这种STED显微镜使用单一的超连续谱激光器作为光源, 利用偏振分束器(polarization beam splitter, PBS)得到了用于激发和损耗的两束光. 对于激发光, 使用干涉滤波片(interference filter, EF)分离出所需要的激发波长. 对于STED光, 使用布儒斯特棱镜构建的波长选择器(wavelength selector, WS)来筛选波长. 该波长选择器的出口设置了一个位置与宽度可变的狭缝, 通过改变狭缝的位置与宽度可以选择STED光的中心波长与光谱宽度, 以输出所需STED光(图3).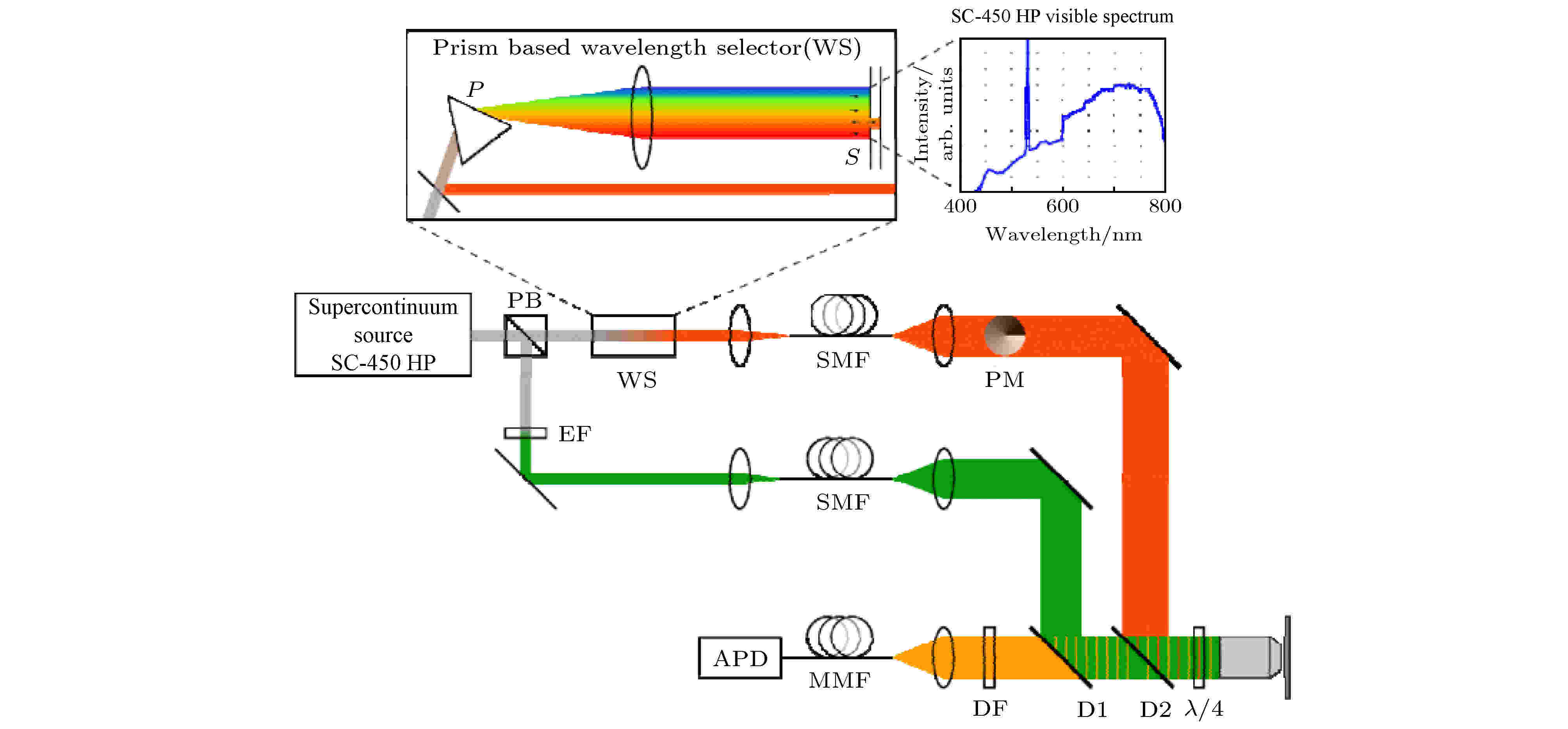 图 3 基于超连续谱光源的STED系统[4]
图 3 基于超连续谱光源的STED系统[4]Figure3. STED system based on supercontinuum laser source[4].
该系统在保证超分辨效果的前提下, 简化了光源, 降低了STED系统的成本, 同时提高了STED光的可调谐性. 理论上, 该系统通过移动狭缝位置可以实现多色成像, 然而实际操作上受到双色镜透过率的限制, 实现多色成像的难度较大.
3
3.1.2.使用多色受激拉曼散射光作为光源
优化系统光源是改进STED系统的重点方向之一, 使用连续光作为STED的光源, 不仅可降低系统成本, 而且使多色成像成为可能. Rankin等[5]在2008年尝试了使用多色受激拉曼散射(stimulated Raman scattering, SRS)光源作为STED系统的STED光(图4(a)).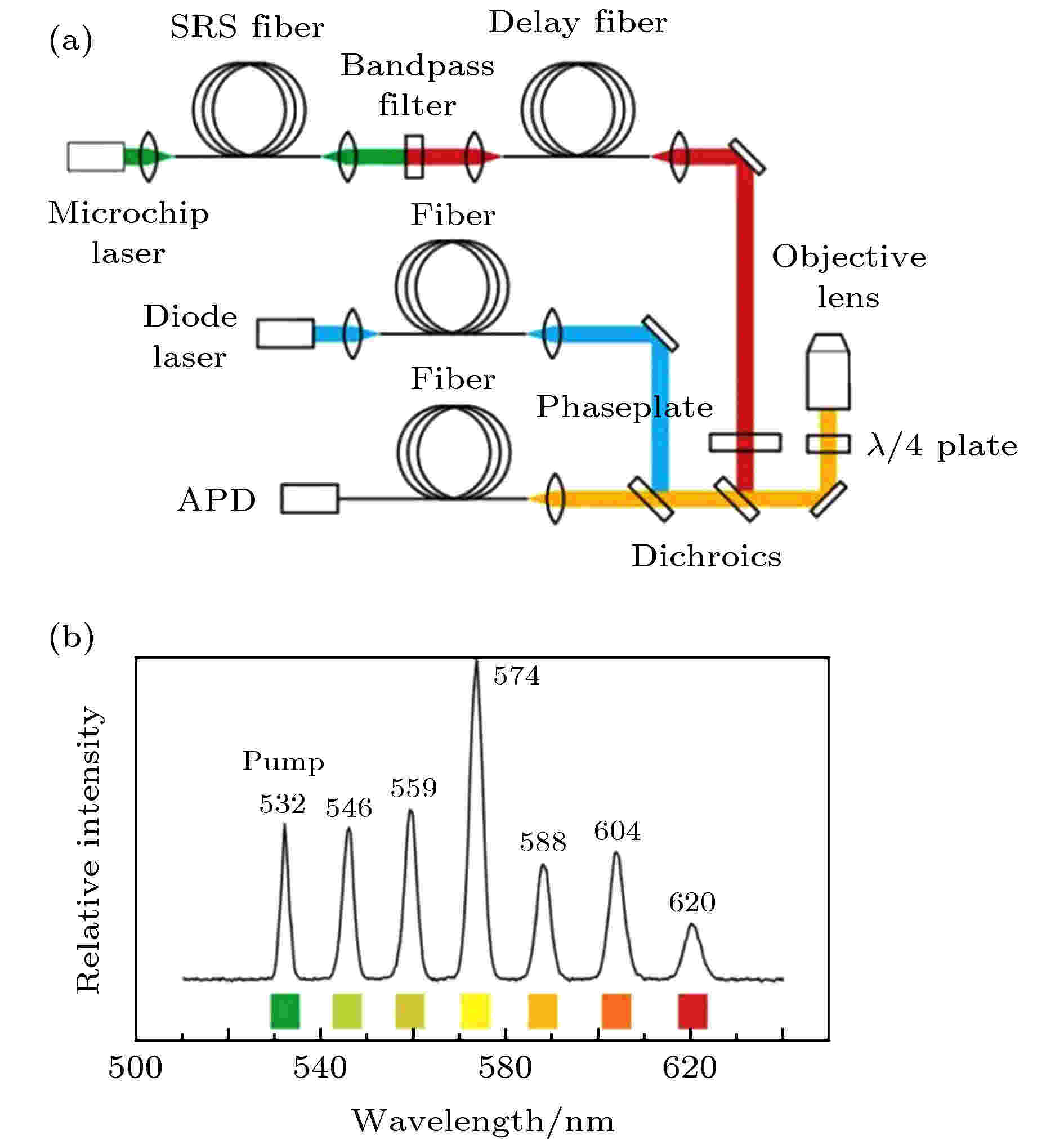 图 4 基于受激拉曼散射光源的STED系统示意图[5] (a)基于受激拉曼散射光源的多色STED系统; (b)激光器在光纤中的SRS输出光谱
图 4 基于受激拉曼散射光源的STED系统示意图[5] (a)基于受激拉曼散射光源的多色STED系统; (b)激光器在光纤中的SRS输出光谱Figure4. Simplified schematic of a STED system with a stimulated Raman-scattering light source[5]: (a) Multicolor STED system with stimulated Raman-scattering laser source; (b) output spectrum from the SRS fiber.
受激拉曼散射效应是指当入射到工作介质(如石英光纤)的激光足够强时, 会在光纤中产生具有较高强度的拉曼散射光(频率在激发光频率到分子简正振动频率范围内), 当入射光强度超越一定阈值时, 对应的散射光也足以成为单独的辐射光源, 从而激发另一频率范围的拉曼散射光. 如此反复, 便能产生一系列频率的拉曼散射光. 该系统中, 利用脉冲长度为1 ns, 光谱带宽为0.3 nm的532 nm的激光作为初始光源, 通过SRS光纤发生受激拉曼散射效应, 产生了一系列波长的散射光(图4(b)), 利用带通滤波器可选择出合适波长的STED光进行超分辨成像. 使用受激拉曼散射光作为STED光, 具有系统紧凑和STED光波长可选的特点, 是多色STED超分辨成像的基础, 但是该系统的主要缺点是需要功率较高的脉冲光源, 对光源的要求仍然较高, 对于活体成像也有一定的限制.
3
3.1.3.使用高斯-拉盖尔矢量光束作为STED光源
环形STED光的产生, 对实现STED超分辨成像非常重要. 传统的STED系统一般是采用VPP或SLM进行波前调制产生环形光, T?r?k等[6]报道了利用高斯-拉盖尔(Gauss-Laguerre)矢量光束作为环形STED光, 在不同深度的焦面上均能保证较好的零强度.传统的高斯环形光在没有畸变的条件下能够在聚焦位置产生较好的零强度(图5点划线), 然而当聚焦深度增加且出现像差时, 其能量分布将发生移动, 并且聚焦位置的强度不再为零(图5实线). 相反地, 高斯-拉盖尔环形光则可以不受像差畸变的影响, 在光轴上保持稳定的零强度(图5虚线), 能够保证STED光束在不同焦面深度的受激辐射效率.
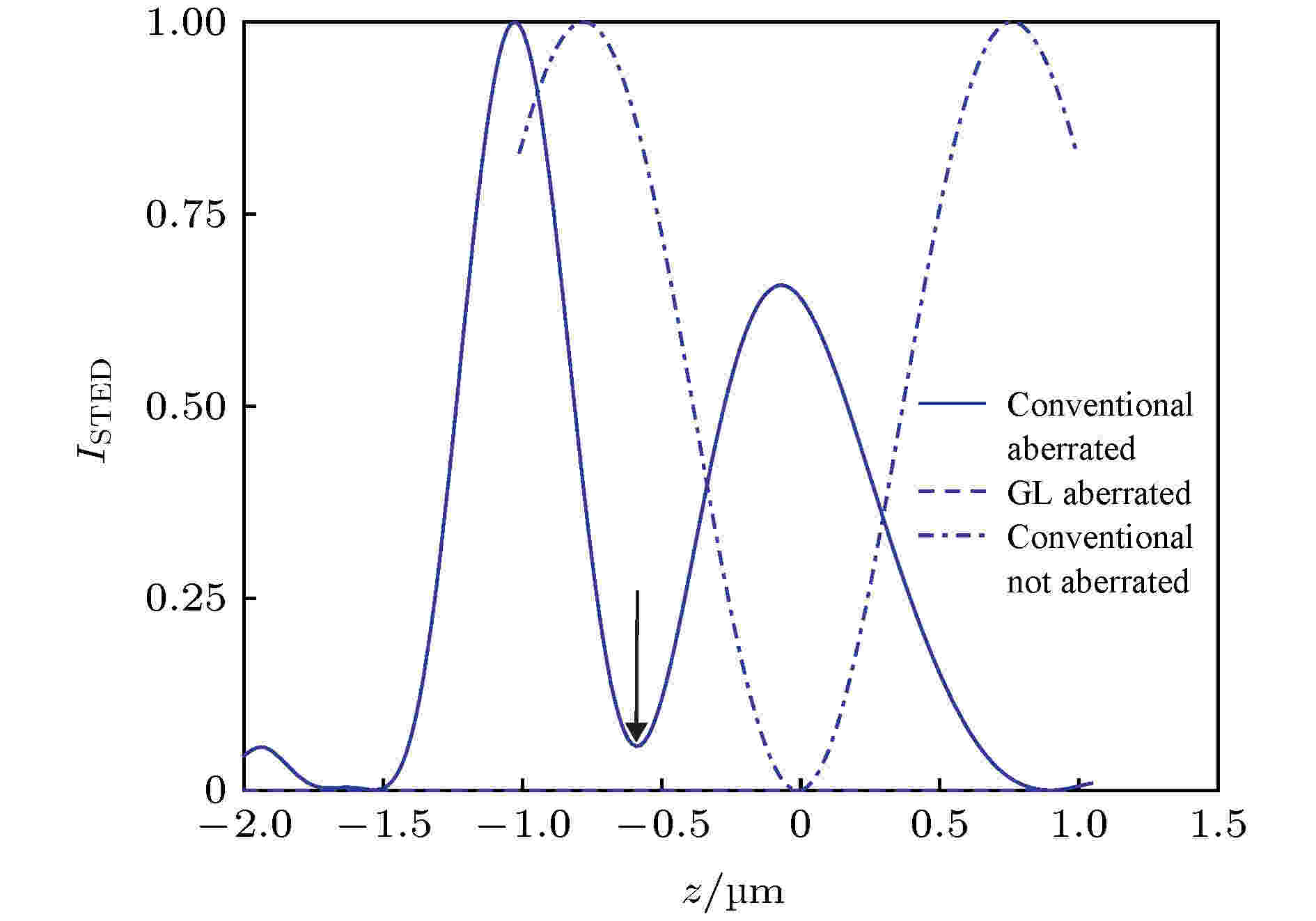 图 5 TED光强度的分布曲线[6]
图 5 TED光强度的分布曲线[6]Figure5. The intensity distributions of depletion beam[6].
3
3.1.4.使用贝塞尔光作为STED光源
使用高斯光形成的STED光进行STED成像, 由于球面像差、散射畸变和损耗等因素, 当焦点从样品表面移到样品深处时, 通常无法保持一致的分辨率. 2016年北京大学Yu等[7]利用贝塞尔光束(Bessel-beam)无畸变的特性, 将环形贝塞尔光束作为STED光进行STED成像(GB-STED), 在固体琼脂糖样品和类脑组织灰质中分别达到了155 μm (图6左) 和100 μm (图6右)深度的超分辨成像.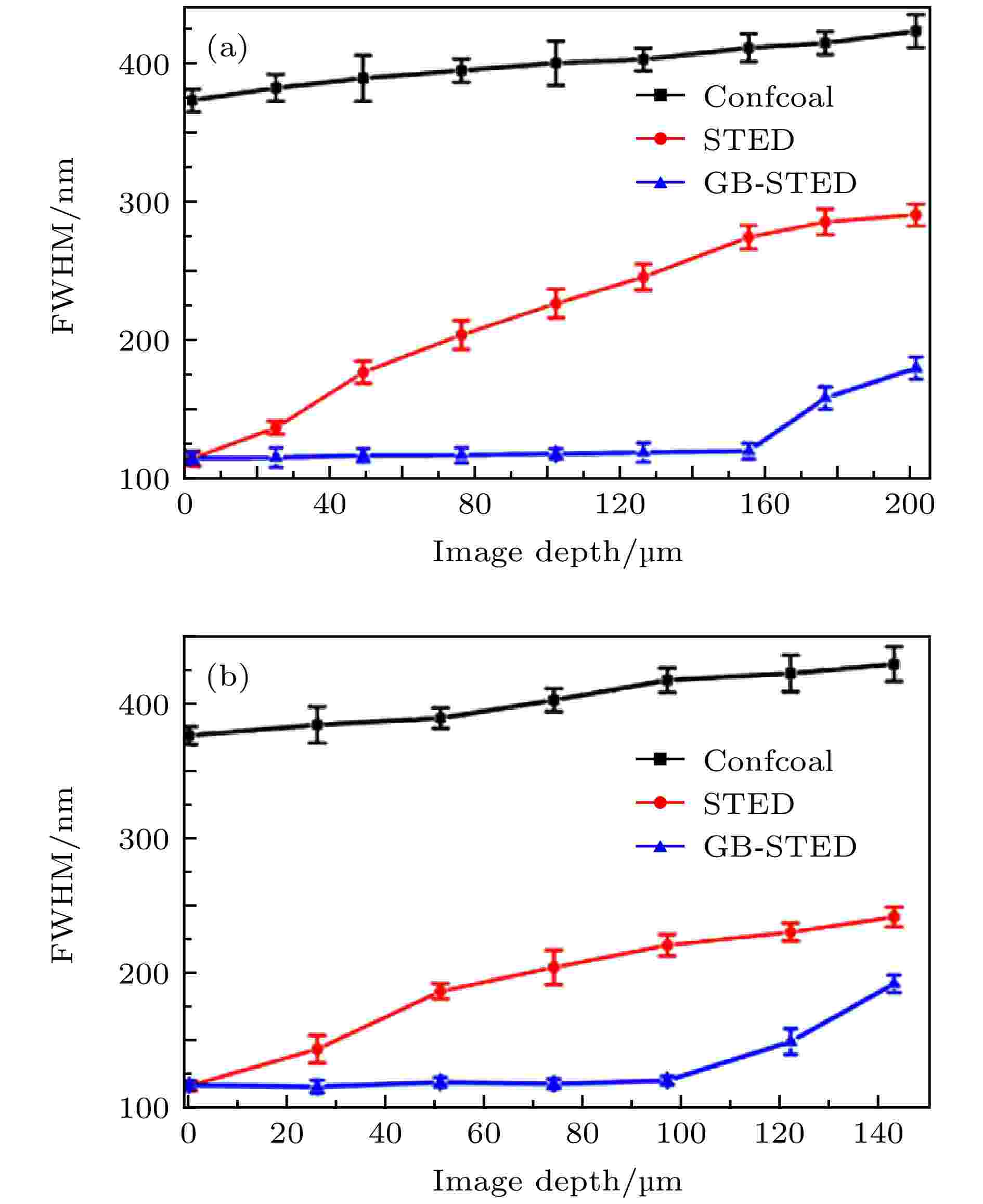 图 6 共聚焦、传统STED与贝塞尔STED成像的分辨率随成像深度的变化曲线[7] (a) 40 nm荧光珠在固体琼脂糖样品不同深度成像的分辨率; (b) 40 nm荧光珠在类脑组织灰质不同深度成像的分辨率
图 6 共聚焦、传统STED与贝塞尔STED成像的分辨率随成像深度的变化曲线[7] (a) 40 nm荧光珠在固体琼脂糖样品不同深度成像的分辨率; (b) 40 nm荧光珠在类脑组织灰质不同深度成像的分辨率Figure6. Imaging curves of Confocal、traditional STED and Bessel-STED[7]: (a) Resolution of 40 nm fluorescent beads at different depths of solid agarose samples; (b) resolution of 40 nm fluorescent beads at different depths of like-gray matter in brain tissue.
由于贝塞尔光束在不同成像深度上能保持高的空间分辨率, Zhang等[8]在其深度成像的基础上, 将点扫描改为线扫描, 搭建了贝塞尔STED光片成像系统, 有效地提升了STED系统的成像速度, 降低了光损伤. 在系统实现上, 将零级贝塞尔光作为系统的激发光(图7(a)), 比二阶贝塞尔光效率更高的一阶贝塞尔光作为STED光(图7(c)), 通过高阶贝塞尔光束来耗尽贝塞尔激发光周围的自发辐射, 可以将光片的厚度减小到衍射极限. 与传统的点扫描STED显微镜相比, 线扫描贝塞尔光束STED(BB-STED)显微镜具有更快的成像速度, 能够对大体积样品实现快速成像. 此外, 由于BB-STED使用平面照明光限制样品的薄层, 从而显著减少了焦平面上方和下方的光漂白和光损伤.
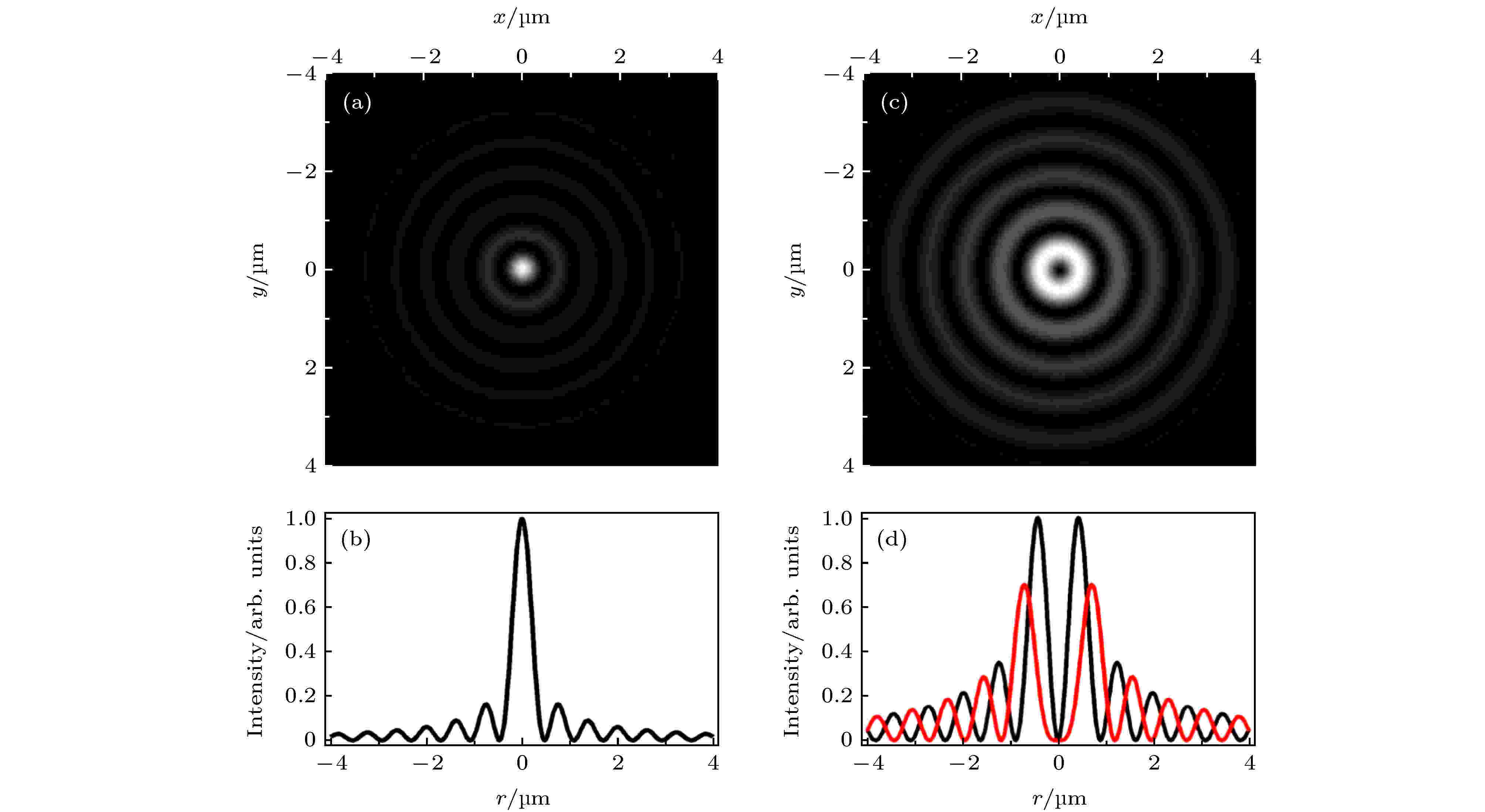 图 7 零阶贝塞尔激发光与高阶贝塞尔STED光[8] (a)零阶贝塞尔激发光在XY平面的光强分布; (b)零阶贝塞尔激发光的光强曲线; (c)一阶贝塞尔STED光在XY平面的光强分布; (d)一阶(黑色)与二阶(红色)贝塞尔STED光的光强曲线
图 7 零阶贝塞尔激发光与高阶贝塞尔STED光[8] (a)零阶贝塞尔激发光在XY平面的光强分布; (b)零阶贝塞尔激发光的光强曲线; (c)一阶贝塞尔STED光在XY平面的光强分布; (d)一阶(黑色)与二阶(红色)贝塞尔STED光的光强曲线Figure7. The zero-order Bessel beam for excitation and the higher-order Bessel beam for depletion[8]: (a) The intensity distribution of zero-order Bessel excitation beam in the XY plane.; (b) the intensity curve of zero-order Bessel excitation beam; (c) the intensity distribution of first-order Bessel depletion beam in the XY plane; (d) the intensity curve of first-order (black) and second-order (red)Bessel depletion beam.
与高斯光束相比, 贝塞尔光束的光斑会不可避免地出现旁瓣, 使用相消干涉的方法来使边带最小化可以在一定程度上减少贝塞尔光束的旁瓣强度.
2
3.2.STED系统的光束校准
STED系统利用STED光来抑制激发光外围区域的荧光发射, 前提是需要对光路进行精密准确的校准, 使STED光与激发光完全重合, 这对于系统操作提出了非常高的要求. 在传统STED系统中, 光束重合的精确度决定了STED系统的成像质量, 因此要想获得高质量的STED图像, 必须保证两束光的高度重合.3
3.2.1.自适应光学自动校准
常规的STED系统一般利用电荷耦合器(charge coupled device, CCD)等探测器成像对光束进行粗略的调节, 然后再使用金纳米颗粒的散射成像进行细微调节, 直至两束光的PSF完全对准. 这种光束重合的调节方式, 一方面需要进行手动调节, 另一方面需要切换反射成像模式, 不仅操作繁琐, 而且反射和荧光成像模式之间的不匹配也可能引起其他问题. 针对这一问题, Gould等[9]提出了使用自适应光学实现光束自动对准的方法, 可以实现4.3 ± 2.3 nm的对准精度. 具体地, 通过在STED光束的路径中放置空间光调制器(SLM), 在SLM上输入STED相位掩模产生环形光束, 并施加在X和Y方向上的已知倾斜量来获取STED图像. 对获取的STED图像的图像亮度和清晰度进行分析计算, 当STED光焦点的零强度位置对准激发光焦点的中心时, STED图像最亮, 且清晰度最高; 当STED光束与激发光束重叠不好时, 得到的STED图像与重叠比较好的STED图像对比, 图像的亮度和清晰度都会降低. 利用亮度与清晰度两个指标, 能够对光束的对准效果提供可靠的判断标准.利用自适应光学, 可以对荧光样品进行程序对准操作来代替手动调节(图8(a)—图8(f)), 从而极大简化STED光与激发光的对准.
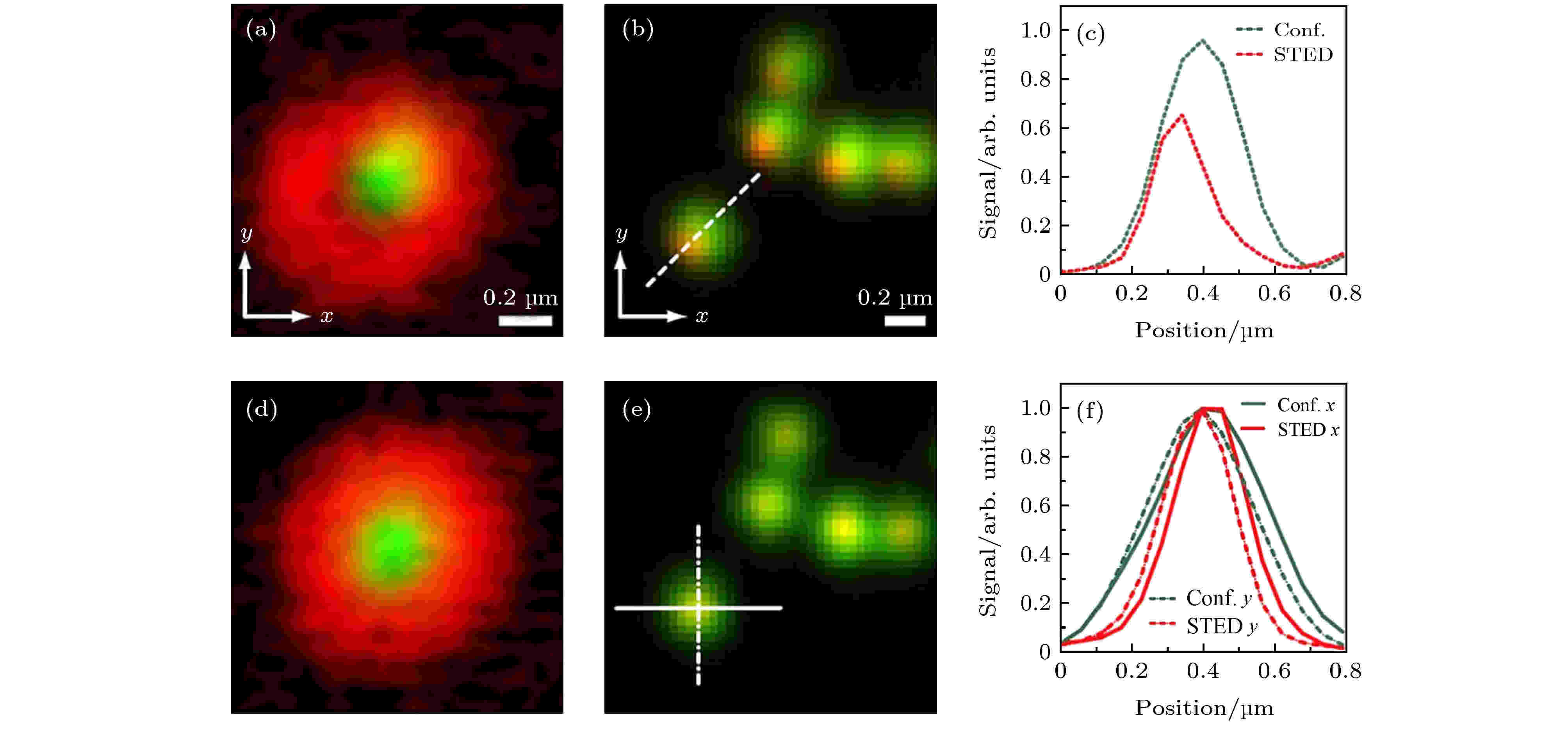 图 8 STED光束与激发光束的对准结果[9] (a)激发光与STED光未对准时的金纳米颗粒图像; (b) (a)中激发光与STED光未对准时所得到的荧光珠的共聚焦(绿色)与STED(红色)图像的合并; (c)沿图(b)中所示虚线的信号强度曲线: 共聚焦(绿色)和STED(红色); (d)激发光与STED光对准情况下的金纳米颗粒图像; (e) (d)中激发光与STED光对准时所得到的荧光珠的共聚焦(绿色)与STED(红色)图像的合并; (f)沿图(e)中所示直线和点划线的信号强度曲线: 共聚焦(绿色)和STED(红色)
图 8 STED光束与激发光束的对准结果[9] (a)激发光与STED光未对准时的金纳米颗粒图像; (b) (a)中激发光与STED光未对准时所得到的荧光珠的共聚焦(绿色)与STED(红色)图像的合并; (c)沿图(b)中所示虚线的信号强度曲线: 共聚焦(绿色)和STED(红色); (d)激发光与STED光对准情况下的金纳米颗粒图像; (e) (d)中激发光与STED光对准时所得到的荧光珠的共聚焦(绿色)与STED(红色)图像的合并; (f)沿图(e)中所示直线和点划线的信号强度曲线: 共聚焦(绿色)和STED(红色)Figure8. Alignment results of depletion and excitation beams[9]: (a) Merged result of the excitation focus (green) and a poorly aligned depletion focus(red) using gold nanoparticles; (b) merged result of corresponding confocal (green) and STED(red) images of fluorescent beads imaged with the focus shown in (a); (c) line profiles across the dotted line in (b): confocal (green) and STED (red); (d) merged image of the excitation focus (green) and a well aligned depletion focus (red); (e) merged result of corresponding confocal (green) and STED (red) images of fluorescent beads imaged with the focus shown in (d); (f) line profiles across the solid and dashed lines in (e): confocal (green) and STED (red).
3
3.2.2.双折射装置实现光束校准
Reuss等[10]提出了利用双折射装置进行光束对准的方法, 称为easy-STED, 提高了光束的稳定性和操作的简易性. 常规的VPP不能在同一位置对不同波长的光束进行有效区分, 利用双折射晶体作为光束整形装置, 当激发光与STED光通过该整形装置后, 只有STED光的波前被调制成为中空环形分布, 而激发光则不受影响. 具体来说, 该光束整形装置的中心部分是具有四个快轴方向的组合波片, 该组合波片由一个较大的波片切割成四个部分并以一定的快轴方向夹角重新黏合到共同的基底上得到(如图9(a)左侧). 不同的快轴方向对光束偏振产生不同的效果, 因而产生方位角偏振光束. 以波长532 nm的激发光及对应647 nm的STED光为例, 相应波片对激发光产生的延迟约是3 λ, 对STED光产生的延迟是2.5 λ. 因此, STED光会产生一个半波延迟, 导致偏振面旋转, 而激发光则不受影响. 另外, 结合消色差半波片, 可以实现针对STED光束的环形聚焦, 而激发光则聚焦成标准的衍射光斑. 图 9 双折射光束整形示意图[10] (a) easy-STED双折射光束整形装置示意图; (b)光斑重合效果
图 9 双折射光束整形示意图[10] (a) easy-STED双折射光束整形装置示意图; (b)光斑重合效果Figure9. Schematic of birefringent beam shaping[10]: (a) Schematic of an easy-STED microscope using a birefringent beam shaping device; (b) merged image of the excitation beam and a depletion beam.
图9(a)右侧表示在光束整形装置不同阶段和周期的两个代表点处激发光束和STED光束的偏振状态. 由于分段波片的波长性质, 两个光束会受到不同的影响. 首先, 两个线偏振光束由消色差四分之一波片(quarter-wave plate, QWP)变为圆偏振光. 然后, 通过分段波片对STED光束选择性地旋转偏振. 最后, 二分之一波片选择性地反转两个光束的水平偏振分量, 反转激发光束的圆偏振并将STED光束转换成环形光. 对于激发光, 则形成正常聚焦的光斑. 由于组合波片是四个波片拼合而成的, 形成的环形光束不是完全规则的圆形环, 如图9(b)所示.
3
3.2.3.简易的空间光调制器校准
与easy-STED类似, 2018年G?rlitz等[11]研究人员提出将激发光与STED光耦合到光纤中进行重合, 然后利用SLM对激发光和STED光分别进行光束整合, 称为easySLM-STED, 进一步简化了光束重合的复杂度, 提高了光束重合的稳定性. 如图10所示, 利用SLM相位调制只能作用于一个线性偏振的特性, 结合偏振方向正交的激发光与STED光, 再利用QWP旋转偏振的特性, 就可以对重合的激发光与STED光分别进行独立的调制, 使得只有STED光被调制为环形光.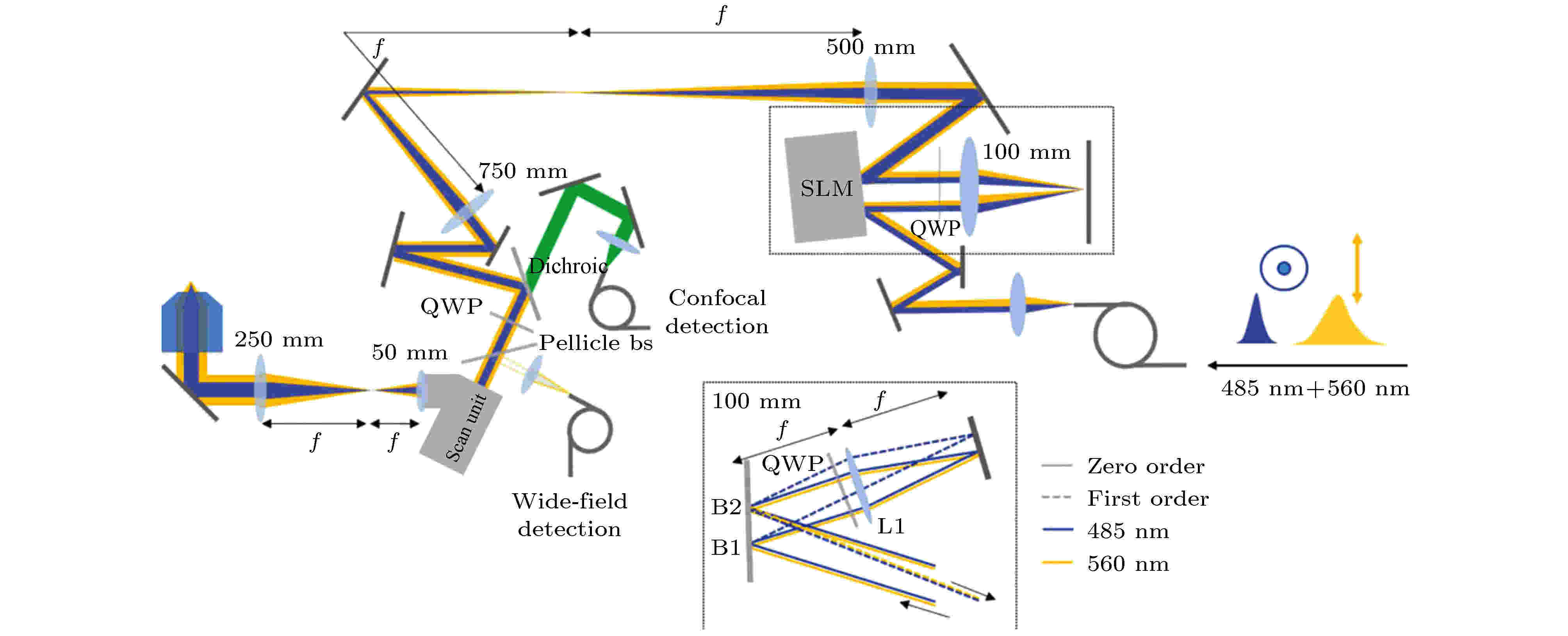 图 10 asySLM-STED系统示意图[11]
图 10 asySLM-STED系统示意图[11]Figure10. Schematic diagram of easySLM-STED system[11]
尽管能在空间上实现对准, 但是STED光束具有轨道角动量, 因此, STED系统的性能通常容易受到热变化和振动的影响, 稳定性较差, 使用Q-plate可以解决这个问题[12].
2
3.3.STED系统的扫描单元
荧光成像, 包括STED成像的质量在很大程度上取决于信号的强度, 在一定阈值内荧光信号的强度与激发光强呈正相关, 超过一定阈值后光吸收将趋于饱和并永久性地破坏荧光分子的激发态, 发生光漂白. 光漂白是STED系统成像质量提高的一个重要的限制条件, 减少光漂白的一个有效途径是提高扫描速度, 从而减少光斑在样品上的停留时间. 由于STED是基于点扫描成像的, 所以扫描速度对于光漂白有着直接的影响. 目前显微镜常用的扫描装置有扫描振镜和声光偏转器. 扫描振镜主要是利用伺服电机控制镜片摆动来达到扫描的效果. 这种光束扫描不需要移动样品, 仅靠镜片的摆动就可以达到每秒上千行的逐行扫描, 共振振镜扫描更是可以达到每秒上万行的扫描速度, 振镜是STED系统使用最广泛的扫描装置[13]. 声光偏转器是基于声光效应, 通过控制施加在声光晶体两端超声波的频率来改变光束角度的一种扫描装置, 有部分STED系统使用声光偏转器进行扫描[14]. 与机械式偏转的扫描振镜相比, 声光偏转器在扫描速度上有一定的差距, 但却具有无振动的优势, 也有较好的稳定性.3
3.3.1.大视场共振扫描STED
提高STED系统的扫描速度和扫描角度, 对样品进行大视场快速扫描, 能在有效减少光漂白的同时得到高分辨率的图像. 目前主要通过快速共振扫描器件来实现大视场快速扫描, 减少曝光时间和光漂白. 但是, 提升扫描速度及扫描视场之后, 还必须具备相应的快速光子计数系统, 否则快速共振扫描得到的光子信息无法被及时捕获, 也无法提升图像的采集速率.加州大学Wu等[15,16]针对这种限制构建了一个基于高速光子计数图像采集系统的共振扫描CW-STED显微镜, 具有超快的读出速率, 优异的计数线性度, 可实现在线时间门控检测. 利用现场可编程门阵列(fieldprogrammable gate array, FPGA)实时记录每个光子脉冲, 读出速率最高可达450 MHz, 搭配8 KHz的扫描振镜, 与共振扫描时间选通CW-STED显微镜相结合, 可以在较大视场(50 μm × 50 μm)下获得具有较小光漂白的高分辨率图像.
3
3.3.2.并行扫描STED
与提高扫描速度的方法不同, 并行扫描[17,18]STED通过提高每次扫描的效率, 来增大扫描视场, 减少光漂白. Wagner等[17]提出了使用多波长全息术[19]来生成激发和STED光图案: 设计一个由两个平面组成的全息图, 其中一个平面编码生成激发图案, 另一个平面编码生成擦除图案, 然后将全息图编程到SLM上. 通过选择投影全息图的位置和两个图像平面之间的距离, 可以确保激发光束和STED光束图案在一个平面上对齐. 使用这种方法, 可以同时将激发光束和STED光束分成N个光束对(图11(a), N = 8), 使视场增加N倍, 极大地提高了扫描效率. 图 11 并行扫描STED示意图[17,18] (a)扩展STED光束对的结果; (b)多点扫描STED光路示意图
图 11 并行扫描STED示意图[17,18] (a)扩展STED光束对的结果; (b)多点扫描STED光路示意图Figure11. Schematic diagram of parallel scanning STED[17,18]: (a) Results of extended STED beam pairs; (b) optical path of the multi-point scanning STED.
然而, 这种并行扫描的缺点是, 使用相同的全息图来产生激发光以及STED光图案, 意味着只有一半的功率用于成像, 能量利用率较低. Bingen等[18]提出了另外一种产生多光束的方法, 将非偏振的激发光与STED光耦合进光纤, 利用渥拉斯顿棱镜(图11(b)中的W1与W2)将光束分为四个偏振的子光束. 经过扫描电镜后, 使用双折射装置(详见3.2.2)对所有子光束进行处理. 样品发出的荧光被收集后聚焦到金字塔棱镜上, 金字塔棱镜将四个焦点的荧光分开并分别聚焦在四个探测器上. 这种方法可以根据激光能量以及实际需求, 分出更多的子光束来提升扫描速度, 但是这种提高扫描效率的方法也极大地增加了系统的成本和操作的复杂性.
2
3.4.STED系统的成像单元
STED系统的成像单元包括接收信号的探测器以及对信号的处理. 对STED系统探测器得到的信号进行处理, 可进一步提高成像的空间分辨率. 由于STED光对所激发荧光的损耗, 使探测器接收到的有效荧光信号变得很弱, 因此必须使用高灵敏度的弱信号探测器, 如光电倍增管(photomultiplier tube, PMT)、雪崩光电二极管(avalanche photo diode, APD)或单光子雪崩光电二极管[20] (single-photon avalanche photo diode, SPAD)、多像素光子计数器[21] (multi-pixel photon counter, MPPC)和混合探测器等. 得益于二次发射倍增系统, 光电倍增管具有较大的探测范围以及较快的响应速度, 但是其在可见光范围的量子效率偏低, 所以对于微弱荧光信号的探测能力较差. 雪崩光电二极管基于二极管的雪崩倍增效应, 具有极高的量子效率, 但是其动态响应范围不如光电倍增管. 多像素光子计数器则是在雪崩光电二极管的基础上, 将APD以像素的方式集成到1 mm2的基底上, 进一步提升了弱光探测能力. 混合光探测器则是结合了PMT与APD的优点, 不仅具有高的量子效率, 较大的动态范围, 低的背景噪声和快速的时间响应, 而且还具有较大的探测范围, 是目前STED商用系统最常用的探测器. 探测器接收到荧光信号之后, 需要利用数据采集卡(data acquisition card, DAQ)来对荧光信号进行收集和处理.另外, STED系统通常还会配置一个并行探测系统, 如CCD或互补金属氧化物半导体(complementary metal oxide semiconductor, CMOS)等对光路进行重合和校准.
2
3.5.STED成像系统
最常见的STED成像系统一般为单光子激发、单色STED系统, 这种系统由一个激发光和一个STED光组成, 下面将介绍近年来在单色STED系统基础上发展起来的其他STED成像系统.3
3.5.1.双光子激发STED系统
与单光子激发相比, 双光子激发(two-photon excitation, TPE)具有多个优点: 1)双光子激发使用近红外波长的激光作为光源, 对样品的穿透深度比短波长的光更深; 2)长波长的近红外光对细胞毒性较低; 3)双光子只在物镜的焦点处激发, 因此双光子显微不需要共焦针孔, 提高了荧光的检测效率; 4)双光子激发只在焦平面上有光漂白, 适合用来观察厚样本和活细胞, 或用来进行定点光漂白实验[22,23].将TPE和STED结合(图12), 使用1060 nm的脉冲激发光源对荧光团进行双光子激发, 使用676 nm的连续光作为STED光, 充分发挥了TPE和STED的优势[24].
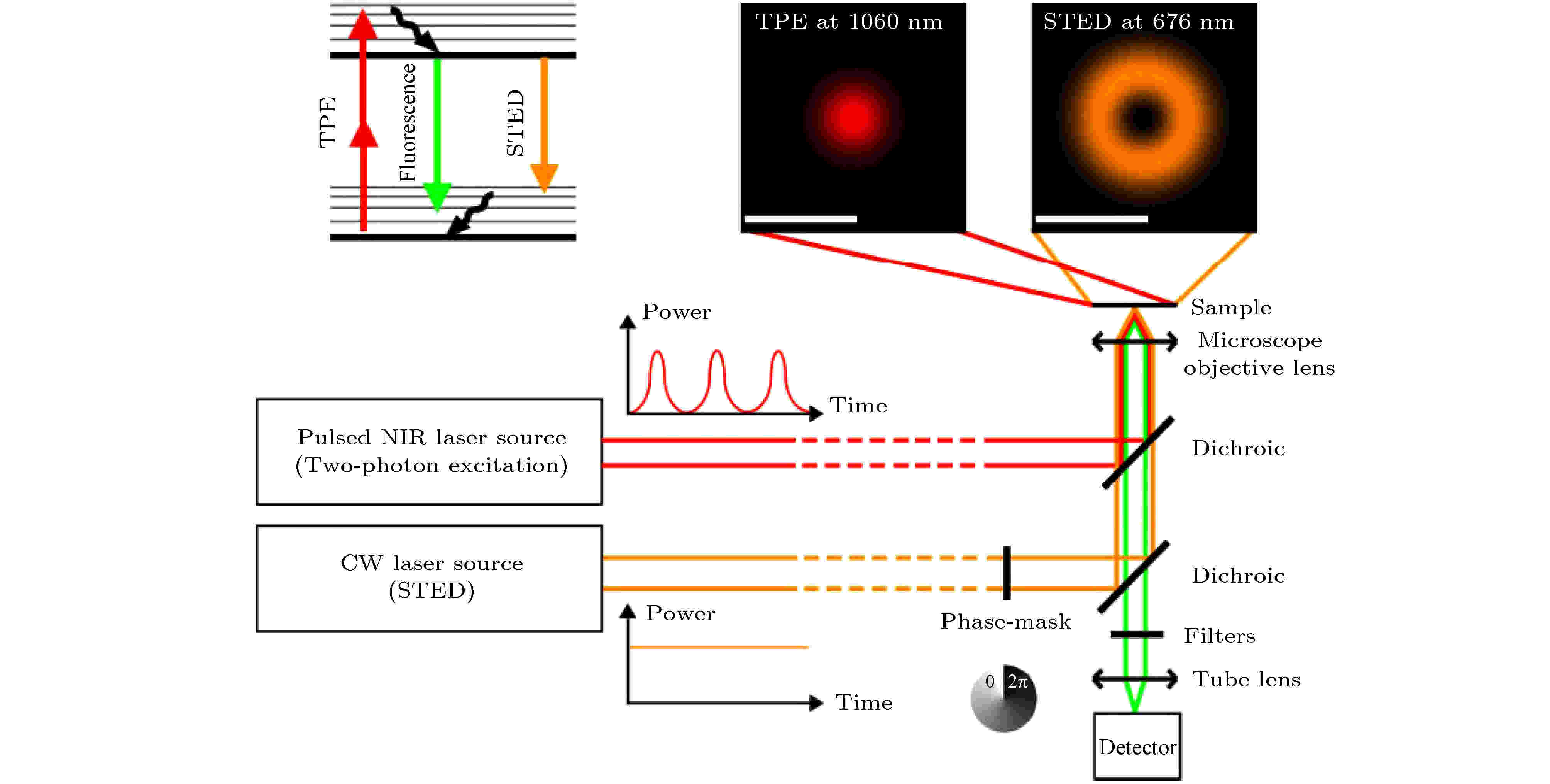 图 12 双光子STED系统示意图[24]
图 12 双光子STED系统示意图[24]Figure12. Schematic diagram of two-photon STED system[24].
Bianchini等[25]报道了基于单个光源的双光子STED成像方案(SW2PE-STED), 该系统利用770 nm的飞秒激光同时实现了激发与受激辐射. 需要注意的是, 双光子激发光与STED光的脉冲宽度必须相差大约三个数量级, 并且强度必须相差两个数量级以上. 因此, 需要通过PBS实现对单色光源的能量分配, 并对STED光束的脉冲宽度进行扩展(图13). 该系统能够在2PE成像的基础上将空间分辨率提升4—5倍. 目前该系统方案仅对于ATTO647 N这种常见的荧光染料进行了验证, 其他种类的荧光染料尚未得到验证.
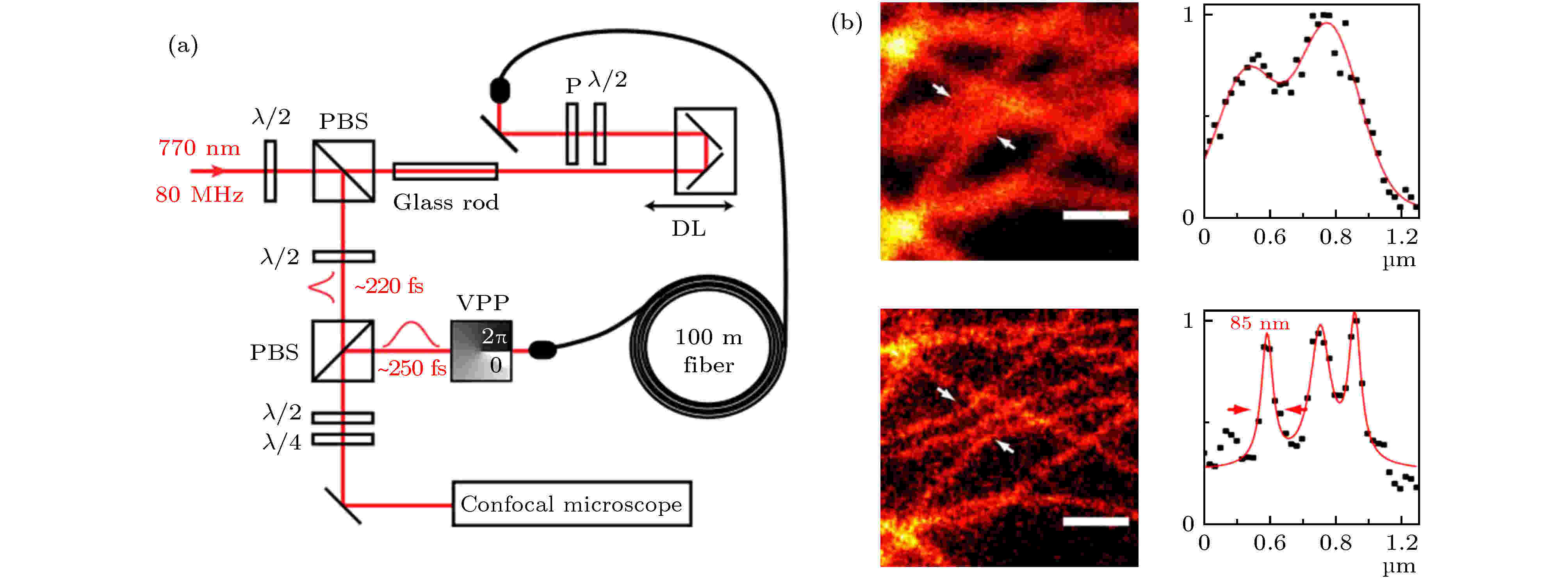 图 13 双光子STED系统及成像结果[25] (a) SW2PE-STED系统示意图; (b) 2PE与2PE-STED成像对比
图 13 双光子STED系统及成像结果[25] (a) SW2PE-STED系统示意图; (b) 2PE与2PE-STED成像对比Figure13. Schematic of two-photon STED and imaging results[25]: (a) Schematic of SW2PE-STED system; (b) 2PE and 2PE-STED imaging.
3
3.5.2.双色STED系统
生物样品的结构和功能非常丰富, 对多种结构同时成像的需求日益迫切, 通过增加一路激发光与一路STED光, 可以实现双色STED成像系统. 最早的双色STED系统利用四个单波长的激光器来实现双色STED成像[26], 这种方法虽然直接有效, 但是系统复杂, 成本很高.对于激发波长相近的两种荧光染料, 可以考虑使用同一个波长的STED光进行擦除. 2013年, G?ttfert等针对ATTO594和KK114两种染料, 搭建了一套简易的双色STED系统[27]. 分别用595和640 nm两个通道的激发光进行激发, 并使用20 MHz, 脉冲带宽1.2 ns的775 nm脉冲光对两个通道同时擦除. 由于两种染料的发射波长分别为620和670 nm, 因此利用双色镜可以很容易地将荧光信号分离到两个通道进行探测. 这种双色STED系统不仅结构简单, 而且具有较好的共定位效果, 但是在染料类型的选择上仍受到限制.
相比于在系统中采用四个或者三个激光器来实现双色STED成像, 通过选取同一激发波长, 不同发射波长, 且可用同一个STED光进行擦除的两种染料如黄色荧光蛋白(yellow fluorescent protein, YFP)和绿色荧光蛋白(green fluorescent protein, GFP), 利用荧光发射波长的不同, 使用双色镜把两路荧光信号区分开, 从而达到只用一个激发光和一个STED光, 实现双色成像的目的[28]. T?nnesen等[28]在2011年提出的这种双色STED成像方法(图14(a))利用了两种具有不同发射波长的染料(图14(b)), 该方法大大简化了双色STED系统的复杂性, 实现了横向分辨率为80 nm的双色活体突触成像. 但是, 这种方法只对特殊的染料有作用, 所以其应用受到很大限制.
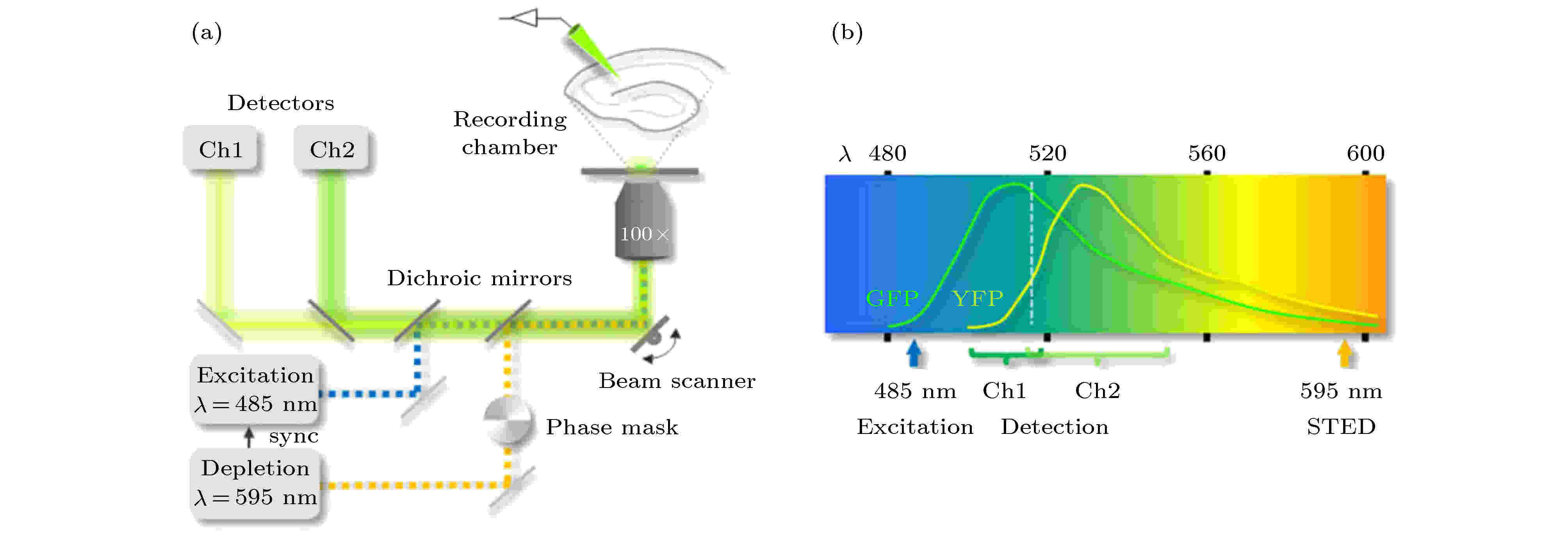 图 14 双光源双色STED系统示意图[28] (a)双光源双色STED系统示意图; (b) YFP与GFP的荧光发射光谱
图 14 双光源双色STED系统示意图[28] (a)双光源双色STED系统示意图; (b) YFP与GFP的荧光发射光谱Figure14. Schematic diagram of two laser source dual-color STED system[28]: (a) Dual-color STED system with two laser sources; (b) emission spectra of GFP and YFP.
3
3.5.3.多寿命多色STED系统
Bückers等[29]于2011年提出了一种四光源多寿命多色STED成像方法. 与双光源双色STED系统类似, 这种方法使用具有几乎相同的吸收和发射光谱但荧光寿命不同的两种荧光染料, 用共同的激发光和STED光来对两种荧光染料进行STED成像, 并通过它们荧光寿命的不同来进行信号的分离. 第三个通道则用另外的激发光与STED光进行成像, 通过荧光发射波长来进行区分. 由于第一、第二通道不需要第二个STED光, 寿命分离对漂移不敏感, 因此比较适合共定位分析. 这种基于寿命分离的方法虽然使多色系统得到简化, 但却同样在荧光染料上受到限制.3
3.5.4.三维STED成像
随着生物医学的不断发展, 对样品的三维观察越发重要. 目前实现3D-STED超分辨成像的方法主要有波前非相干调节、4π法以及结构光照明法.通过图15所示的0/π(左下PM1)和0—2 π螺旋相位板(左下PM2)对两束光进行空间调制时, 可以产生横向及纵向的中空环形光束. 将所产生的两束非相干光重合, 可以得到三维中空的STED光, 在横向及纵向压缩激发光斑的有效点扩散函数(PSF). 利用三维光斑在样品上进行三维扫描, 就可以通过后期重构得到样品的三维STED图像[30]. 这种实现3D-STED成像的方法比较简单, 但缺点是横向与轴向分辨率通常相差50 nm以上, 3D成像质量较差.
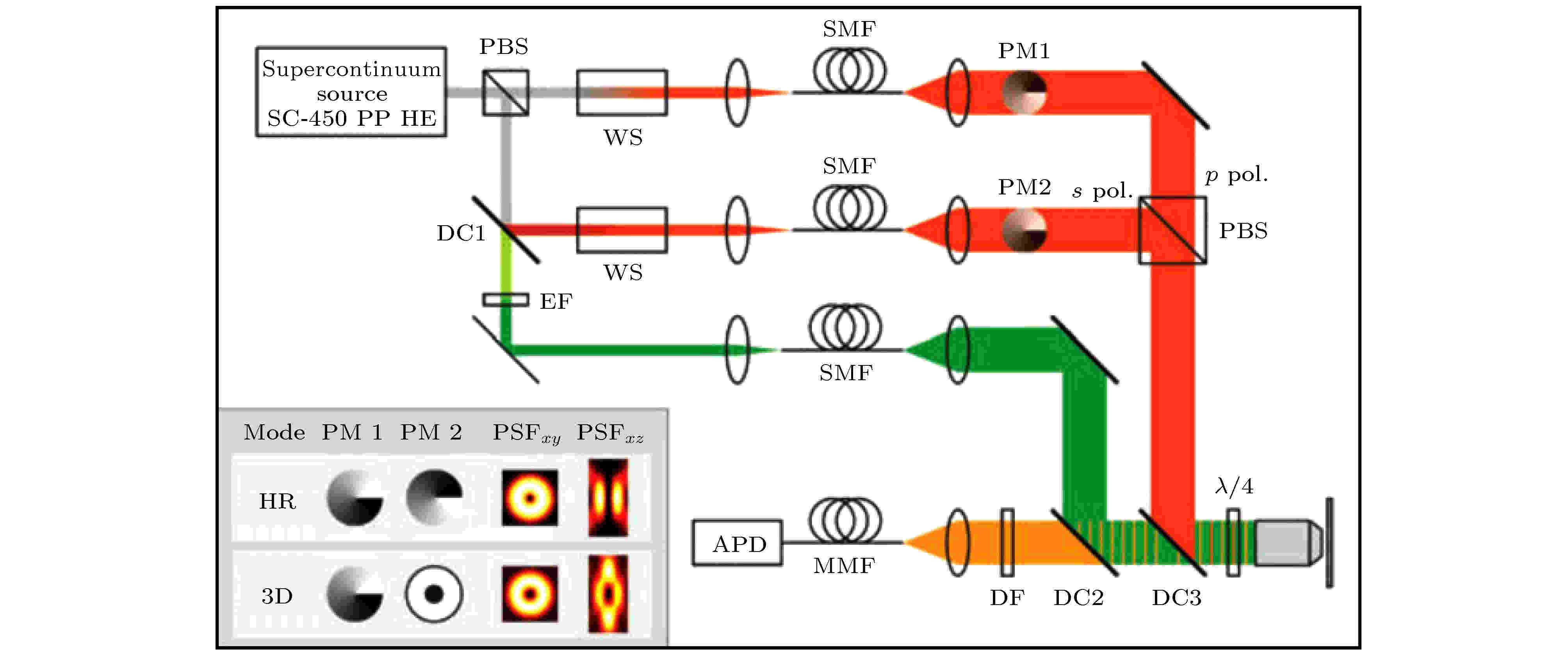 图 15 基于非相干波前调制的3D-STED成像系统示意图[30]. 插图: 用于实现横向超分辨(HR)或3D超分辨率(3D)的相位板及对应的STED PSF
图 15 基于非相干波前调制的3D-STED成像系统示意图[30]. 插图: 用于实现横向超分辨(HR)或3D超分辨率(3D)的相位板及对应的STED PSFFigure15. Schematic diagram of 3D-STED system with non-coherent wavefront modulation[30]. Inset: combinations of phase plates and resulting STED PSFs used to achieve either ultimate lateral resolution (HR) or 3D superresolution.
除了以上对两束STED光的波前进行调制外, 第二种方法是基于4π显微镜实现三维超分辨成像. 4π显微镜是通过增加物镜的接收角(等效于增加物镜NA)来使空间立体角达到4π, 从而大幅度减小PSF, 提高轴向分辨率[31]. 利用4π方法实现3D-STED超分辨成像, 需要在样品两端放置两个相同的物镜, 在样品两端同时照明并接收荧光信号, 系统中的两束STED光只有一束通过相位板调制成环形光. 通过调节两束STED光以相同或相差180°的偏振方向分别从两个物镜入射, 在样品上发生相长干涉(横向环形斑)或相消干涉(纵向环形斑), 两种光斑通过光强非相干叠加就可以产生三维的空心球形光斑, 从而实现3D-STED成像(图16)[32]. 利用这种方法, 可以成倍地提升光学系统的轴向分辨率, 将轴向分辨率从500 nm提升到约40 nm, 在三维成像上有明显的优势. 但是, 4π方法需要用到两个物镜, 而且对光路的对准要求非常严苛, 使其应用受到了很大的限制. 2016年北京大学Yang等[33]通过在样品后方放置一面介质反射镜来使入射光与反射光在样品焦面发生干涉, 能够在一定程度上降低系统的复杂性.
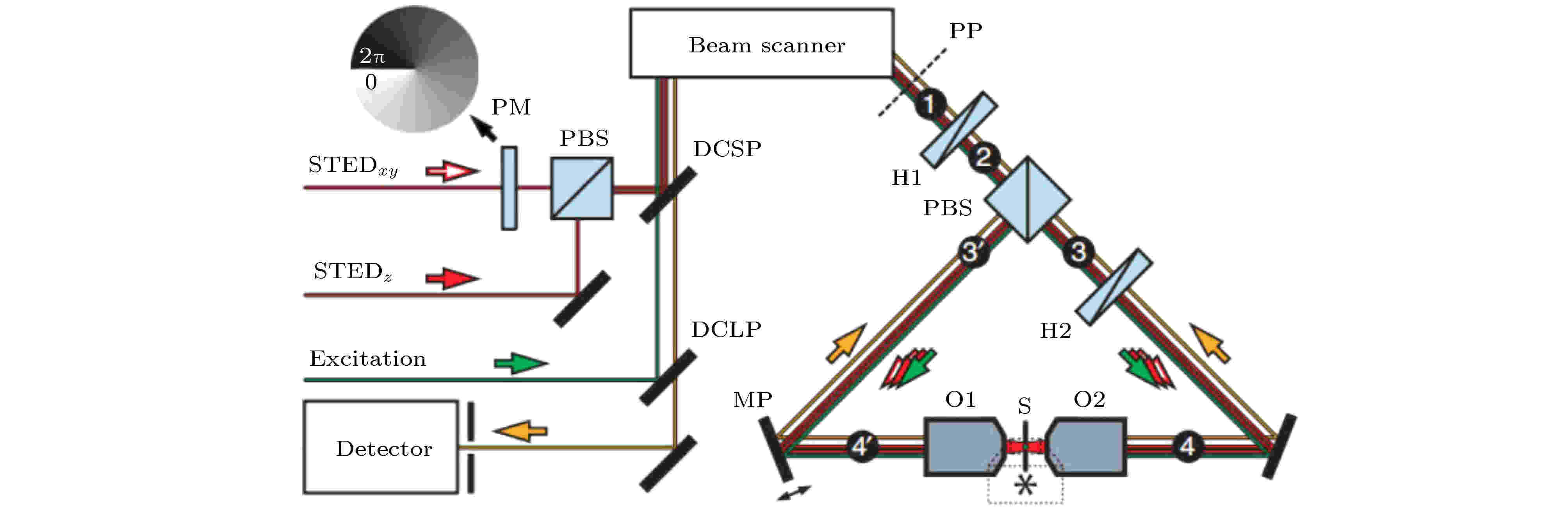 图 16 利用4π法实现3D-STED成像的系统示意图[32]
图 16 利用4π法实现3D-STED成像的系统示意图[32]Figure16. Schematic diagram of 4π3D-STED system[32].
Gustafsson等[34,35]和Xue等[36]提出使用结构光照明可以实现三维成像. 具体方法是, 利用线性相位光栅产生–1, 0, +1三级衍射光, 衍射光经过物镜聚焦后在样品的焦平面处发生干涉, 并产生具有横向和轴向结构的强度分布(图17(a)).
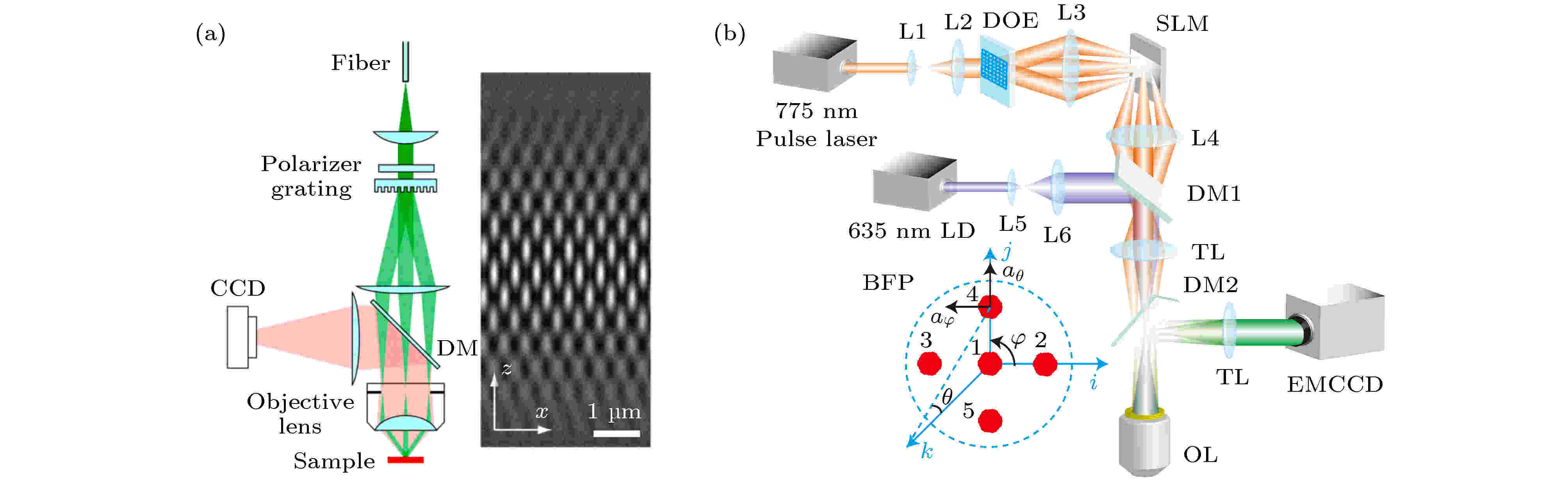 图 17 基于结构光照明的系统图[35,36] (a)结构光照明系统图及空间强度分布; (b)结构光照明3D-STED系统示意图
图 17 基于结构光照明的系统图[35,36] (a)结构光照明系统图及空间强度分布; (b)结构光照明3D-STED系统示意图Figure17. Structured illumination system[35,36]: (a) Simplified diagram of the structured illumination apparatus and spatial intensity distribution; (b) structured illumination 3D-STED system.
利用这种结构光照明的原理, Xue和So[36]进一步利用衍射光学元件(diffractive optical elements, DOE)将衍射光扩展到五束(图17(b)), 搭建了基于结构光的3D-STED系统. 在DOE的傅里叶面, 每个光束的相位由SLM调制, 可以使图像平面中的干涉图案发生位移. 改变中心光束和周边光束之间的相对强度可以改变干涉图案的对比度. 利用五束衍射光干涉来产生3D网格, 能够获得对称的径向超分辨成像. 此外, Xue等[37]在2011年也提出了对径向偏振光或切向偏振光进行相位调制, 实现相干与非相干叠加的方法来产生三维空心光斑.
2
4.1.时间门控STED技术
荧光分子被激光激发, 吸收能量跃迁到激发态, 再从激发态自发辐射荧光回到基态, 这个过程称为自发辐射. 在自发辐射荧光的过程中, 荧光强度降低到初始强度的1/e时所需要的时间, 称为荧光寿命, 常用τfl表示. 也可以理解为荧光寿命是荧光分子被激发后回到基态之前在激发态平均停留的时间. 前文提到, 荧光衰减率Kfl = 1/τfl, 相反地, τfl也可以由Kfl表示:(6)式表明, 由于受激辐射的存在, 使得荧光分子的荧光寿命变短, 这为利用寿命信息提高系统分辨率提供了可能.
STED成像时, 激发光照射的区域产生了荧光寿命较长的光子, 而激发光与STED光重叠的区域由于发生了受激辐射效应, 所以该区域所发射荧光的寿命会明显减少. 时间门控STED技术[41,42]利用不同区域荧光寿命不同的特性, 在激发光照射到样品一定时间Tg后才开始收集光子, 过滤掉短寿命的光子, 只接收来自激发中心的长寿命光子, 能够有效提升STED系统的空间分辨率(图18(a)). 利用时间门控来进行筛选, 需要将光源与探测单元进行时间同步调节, 并且搭配可以快速开启和关闭的光子探测器(如SPAD).
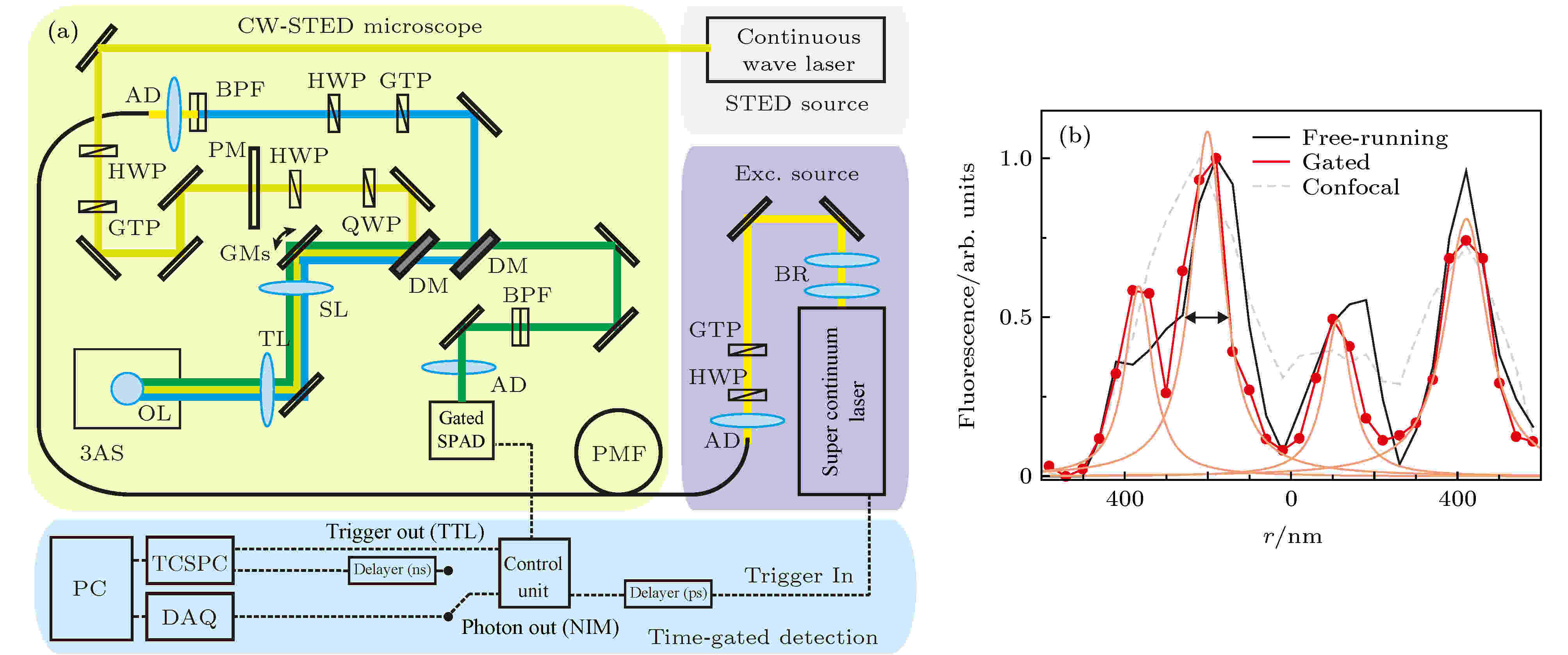 图 18 时间门控STED[41] (a)快速时间门控STED系统示意图; (b)共聚焦、STED与gate-STED分辨率结果
图 18 时间门控STED[41] (a)快速时间门控STED系统示意图; (b)共聚焦、STED与gate-STED分辨率结果Figure18. Time-gated STED[41]: (a) Schematic of fast-gated STED system; (b) comparison of spatial resolution for confocal, STED and gate-STED resolution.
理论上通过延迟门控SPAD的开启时间能够持续提升系统的空间分辨率. 然而, 由于STED系统的STED光通常无法实现中心的绝对零强度, 所以即使是处于激发光中心的光子也有可能受到STED光的影响而缩短寿命, 延迟门控SPAD的开启时间在滤除受激辐射区域光子的同时也会滤除一部分自发辐射区域的光子, 使接收到的长寿命的光子数减少. 因此, 延迟门控SPAD开启时间在提升分辨率的同时也会使系统的信噪比(signal-noise ratio, SNR)降低, 需要根据系统的实际情况来调节门控的开启时间. 此外, 可通过多图像反卷积来减少时间门控STED系统对SNR的影响[43]. Diaspro等[41]选择在激发光到达样品2 ns后开启时间门, 时间门长度为7 ns, 可以排除反斯托克斯光, 最终在50 mW的STED光功率下实现75 nm的分辨率, 而Giuseppe等[42]则在250 mW的功率下实现35 nm的分辨率.
2
4.2.离线门控STED技术
使用时间门控来控制探测器接收信号的时间, 虽然能够在一定程度上提升STED成像的分辨率, 然而对于不同的系统和实验对象, 在分辨率和峰值信噪比(peak signal-to-noise ratios, PSNR)上, Tg的选择则没有一个明确的标准.浙江大学Wang等[44]提出了离线时间选通来实现时间门控STED的方法, 将STED系统的分辨率从75 nm提高到38 nm, 同时降低了所需STED光的功率(图19). 这种方法采用时间相关单光子计数(time-correlated single-photon counting, TCSPC)技术, 记录所有激发脉冲和相应的荧光光子之间的时间间隔并统计为直方图. 这种离线时间门控方法允许实验人员在后期自由选择合适的时间门, 以保证获得分辨率与PSNR之间最佳的平衡.
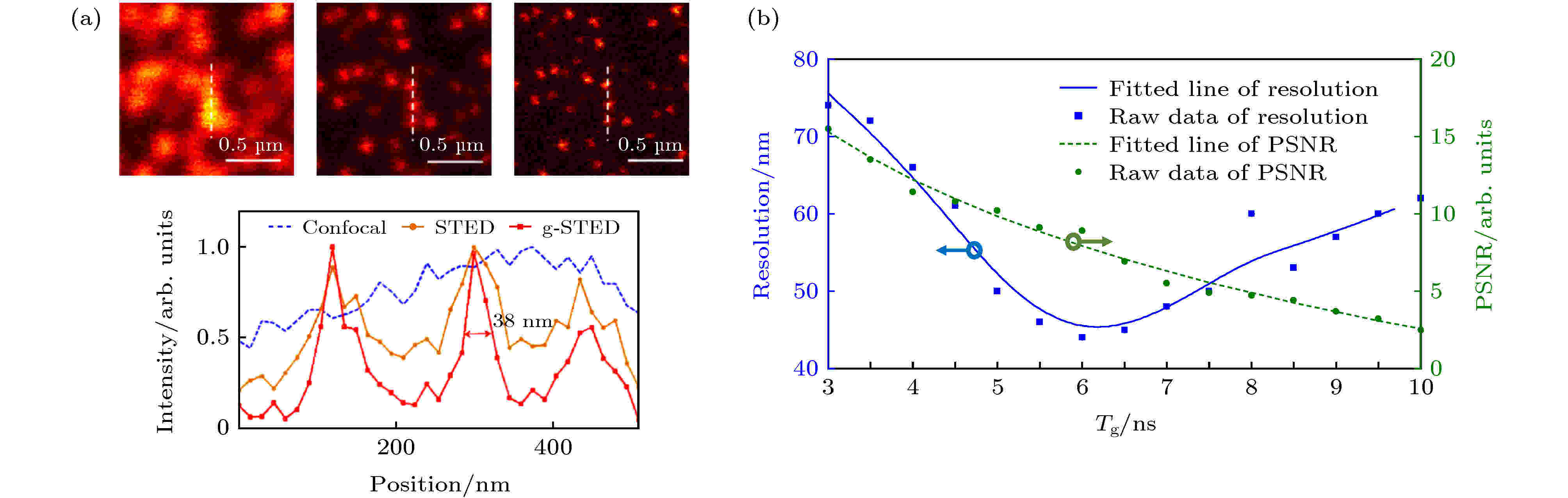 图 19 离线时间门控STED[44] (a)共聚焦、STED与off-line gated-STED分辨率结果; (b) Tg、分辨率与PSNR关系曲线
图 19 离线时间门控STED[44] (a)共聚焦、STED与off-line gated-STED分辨率结果; (b) Tg、分辨率与PSNR关系曲线Figure19. Off-line gated-STED[44]: (a) Spatial resolutions of confocal, STED and off-line gated-STED; (b)the relationship between Tg, resolution and PSNR.
2
4.3.STED-FLIM相图分析技术
时间门控STED方法通过选择性接受长寿命的光子来排除STED光区域的光子, 虽然能一定程度提升系统的空间分辨率, 但同时也会排除掉许多激发光中心区域的光子, 丢失了部分信息. 将所有光子的寿命信息记录下来, 采用相图分析法进行分离, 能在更大程度上利用所采集到的光子信息. 2018年Wang等[45]在STED系统上加入了脉冲同步单元和TCSPC数据采集卡, 将STED系统与荧光寿命成像(fluorescence lifetime imaging, FLIM)技术相结合, 建立了STED-FLIM系统. 对STED-FLIM系统所采集的图像进行相图(phasor plot)分析, 实现了在低功率下的STED超分辨成像(图20), 利用这种STED-FLIM的相位图分析法, 在不增加STED光能量的前提下成功地将不同寿命的光子进行分离, 分辨率从150 nm提高到80 nm.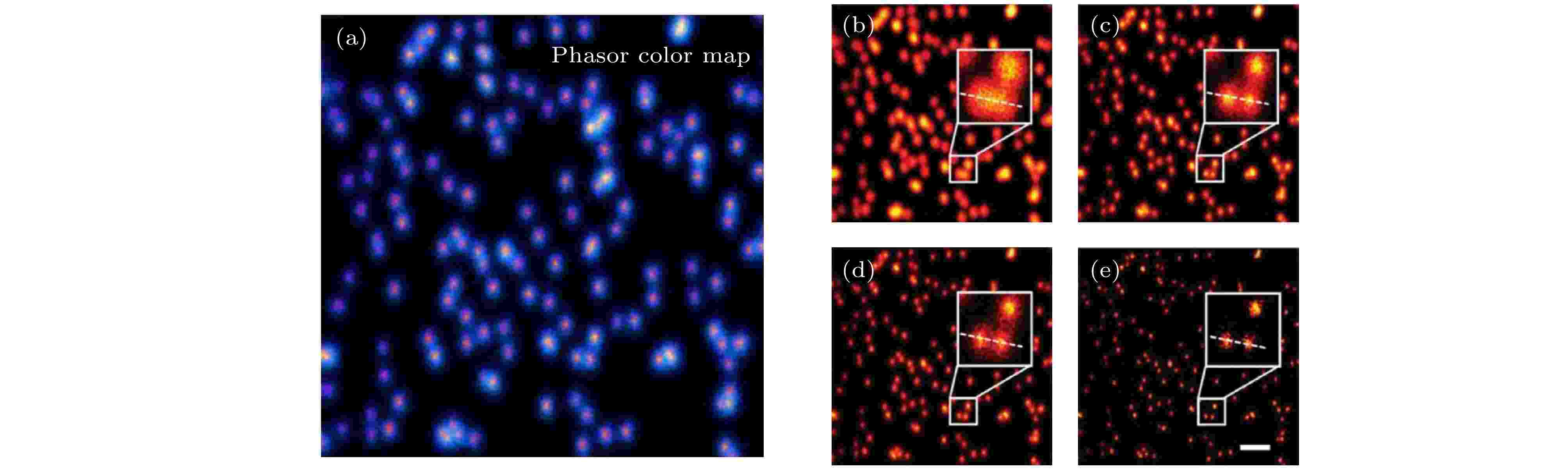 图 20 STED-FLIM成像及相图分析结果[45] (a)彩色相位图; (b)荧光珠的共聚焦图像; (c)荧光珠的STED图像(10 mW); (d)时间门STED图像; (e)相图分析后的图像
图 20 STED-FLIM成像及相图分析结果[45] (a)彩色相位图; (b)荧光珠的共聚焦图像; (c)荧光珠的STED图像(10 mW); (d)时间门STED图像; (e)相图分析后的图像Figure20. STED-FLIM and Phasor-plot analysis[45]: (a) Phasor color map of the STED-FLIM image; (b) Confocal, (c) STED·(10 mW), (d) time gate STED and (e) Phasor-plot images of fluorescent beads.
2
4.4.pSTED-SPLIT技术
在不提高STED光功率的前提下, 光子数分离是基于相量分析法[46]的一种有效提高STED系统空间分辨率的方法. 对于相位图中寿命变化与有效荧光光子之间的关系, 目前还没有统一的标准. Tortarolo等[47]提出了区域分割法(图21(a))与pSTED-SPLIT方法(图21(b)), 提高了系统的空间分辨率, 同时降低了光漂白.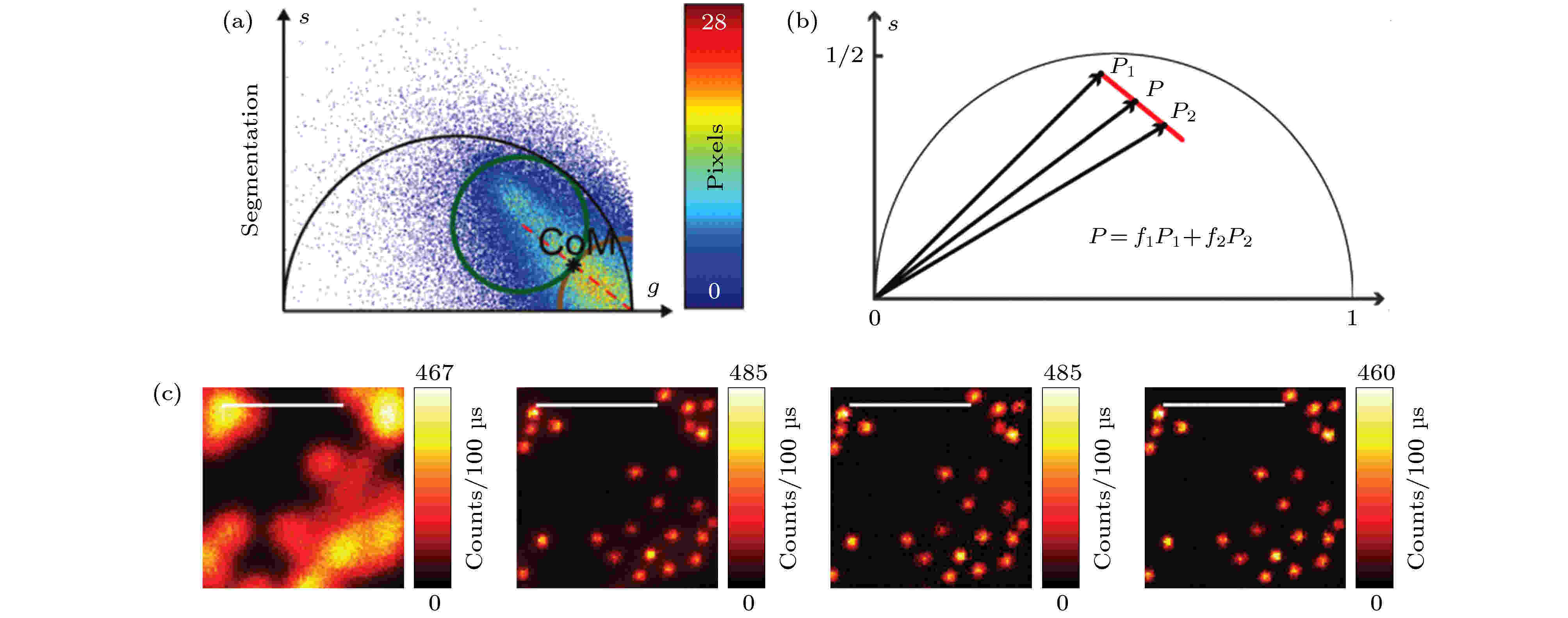 图 21 区域分割法与pSTED-SPLIT方法所得到的荧光珠的成像结果[47] (a)区域分割法示意图; (b) pSTED-SPLIT方法示意图; (c)从左到右依次为荧光珠的共聚焦、常规STED、区域分割法STED和pSTED-SPLIT的成像结果
图 21 区域分割法与pSTED-SPLIT方法所得到的荧光珠的成像结果[47] (a)区域分割法示意图; (b) pSTED-SPLIT方法示意图; (c)从左到右依次为荧光珠的共聚焦、常规STED、区域分割法STED和pSTED-SPLIT的成像结果Figure21. Imaging results of fluorescent beads using segmentation and pSTED-SPLIT methods[47]: (a) Schematic diagram of segmentation method; (b) schematic diagram of pSTED-SPLIT method; (c) from left to right: Confocal, conventional STED, segmentation STED, and pSTED-SPLIT imaging results of fluorescence beads.
2
4.5.利用量子点作为荧光探针实现STED超分辨成像
在STED成像中, 使用量子点作为探针可以提高探针的抗漂白和光稳定性. 2017年北京大学Liu等[48]首次利用上转换纳米粒子(upconversion nanoparticle, UCNP)实现了STED超分辨成像, 通过在UCNP上掺杂高浓度的铥离子(Tm3+), 用980 nm波长激发UCNP可以很容易地在其中间亚稳态3H4能级上建立粒子数反转, 使用808 nm激光照射, 匹配3H4 → 3H6跃迁的上转换带, 可以触发放大的受激辐射以释放3H4中间能级, 从而可以抑制上转换路径(图22). 利用上转换发光, 用980 nm激光激发荧光, 808 nm激光作为STED光可以有效提高受激辐射效率, 降低STED光强度, 减少对生物样品的光损伤. 利用这种方法, 可以将STED光饱和强度降低两个数量级(0.19 mW/cm2), 实现横向28 nm的分辨率(图22(b)). 几乎同时, 华南师范大学Zhan等[49]利用UCNP在生物样品上实现了STED超分辨成像.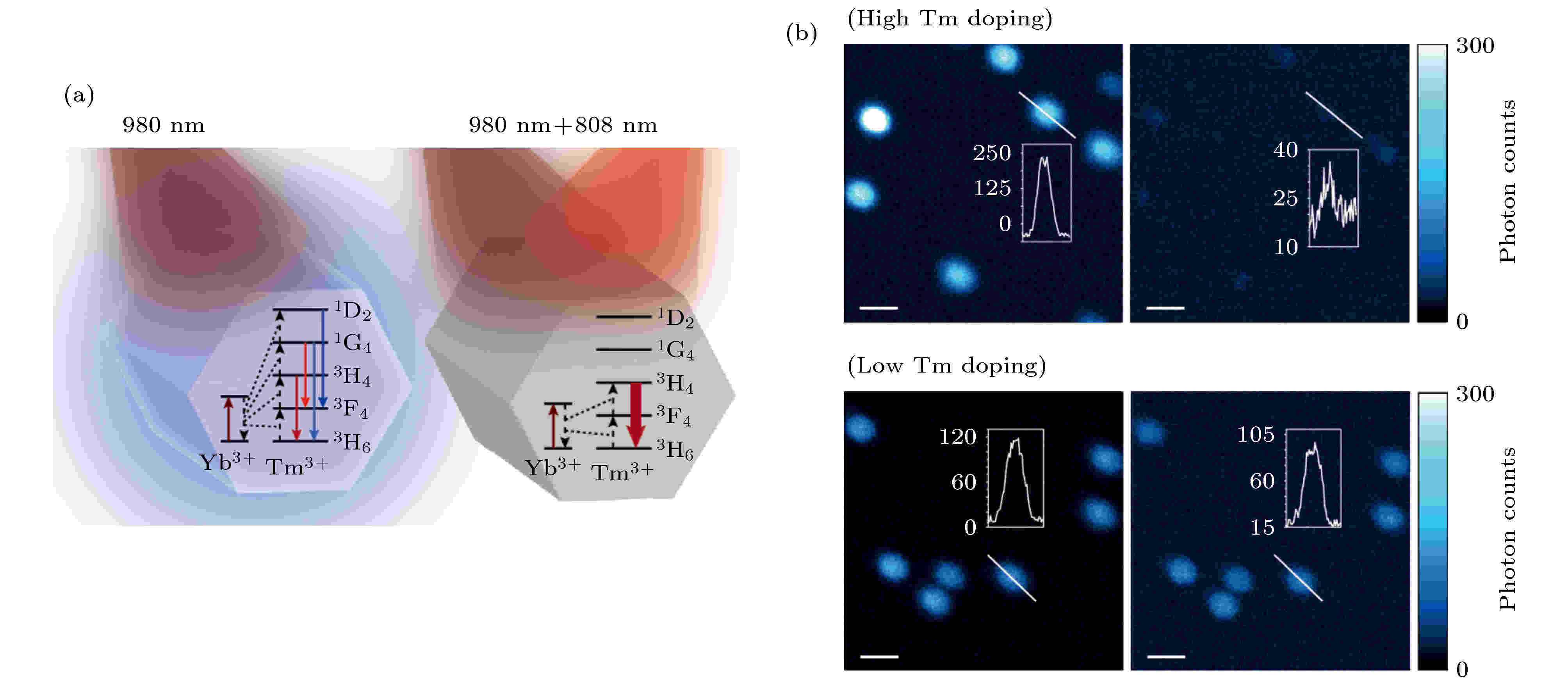 图 22 上转换示意图及利用上转换纳米颗粒的成像结果[48] (a)上转换能级关系图; (b)上转换纳米颗粒成像结果
图 22 上转换示意图及利用上转换纳米颗粒的成像结果[48] (a)上转换能级关系图; (b)上转换纳米颗粒成像结果Figure22. Schematic diagram of upconversion and imaging results[48]: (a) Diagram of energy levels of upconversion nanoparticles; (b) imaging results of UCNPs.
除了UCNP外, 还有很多其他量子点可以作为STED探针. 2017年浙江大学Li等[50]首次利用AIE纳米颗粒实现了STED超分辨成像; 2018年Ye等[51]首次利用钙钛矿量子点作为STED探针实现了20.6 nm的超高分辨率; 2019年Li等[52]利用对生物体无害的碳点作为STED探针, 实现了细胞内超分辨成像; 2020年, Liang等[53]利用靶向性较好的有机硅量子点作为探针, 实现了活体STED超分辨成像.
2
4.6.荧光发射差分超分辨成像
2013年浙江大学Kuang等[54]提出了一种与STED思想类似的可在低功率下实现超分辨成像的荧光发射差分(fluorescence emission difference, FED)法. 即利用同一波长的两束激发光对样品激发, 其中一束为常规的高斯光斑, 另一束为经过相位板调制波前的环形光斑. 高斯激发光斑(图23(a))在探测器上的最终PSFc为高斯激发光斑与小孔PSF卷积的结果(图23(c)), 此时得到的是共聚焦图像; 环形激发光斑(图23(b))在探测器上的最终PSFn为环形激发光斑与小孔PSF卷积的结果(图23(d)), 此时得到的是负共聚焦图像.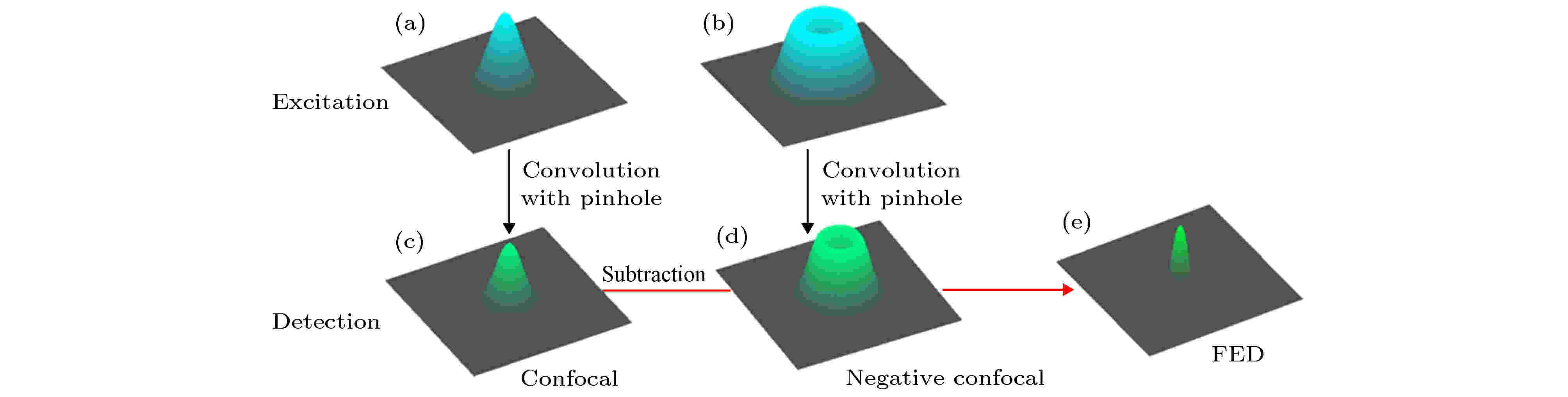 图 23 FED成像原理[53]
图 23 FED成像原理[53]Figure23. Illustration of FED theory[53].
用共聚焦图像减去负共聚焦图像就可以得到超分辨的FED图像, 最终的PFSFED为
FED方法可以避开STED需要高强度STED光的劣势, 仅在激发光功率水平, 就能够实现对相距105 nm的荧光珠的超分辨成像. 在荧光饱和的情况下, 通过调整减法因子r, 可以获得高质量的超分辨图像.
2
4.7.数字增强型STED超分辨成像
受FED超分辨成像方法的启发, 最近我们课题组, 开发了一种新型STED图像处理方法, 即数字增强型STED(DE-STED), 该方法可大大降低STED光所需功率, 使活细胞长时间超分辨成像成为可能[55]. 图24为DE-STED的基本原理, 用共聚焦强度图减去STED强度图, 即可得到STED光由于受激辐射效应擦除掉的光子强度图(图24(c)中的Donut图), 由于受激辐射效率在低STED光功率情况下是很低的, 用STED强度图减去N倍的Donut图, 即可实现重叠区域的受激辐射效率100%(理想STED成像是STED光与激发光重叠区域的受激辐射效率为100%), 在传统的STED超分辨成像中需要非常高的STED光才可以实现100%的受激辐射效率. 因此, DE-STED可以在较低的STED光功率下实现非常高的分辨率.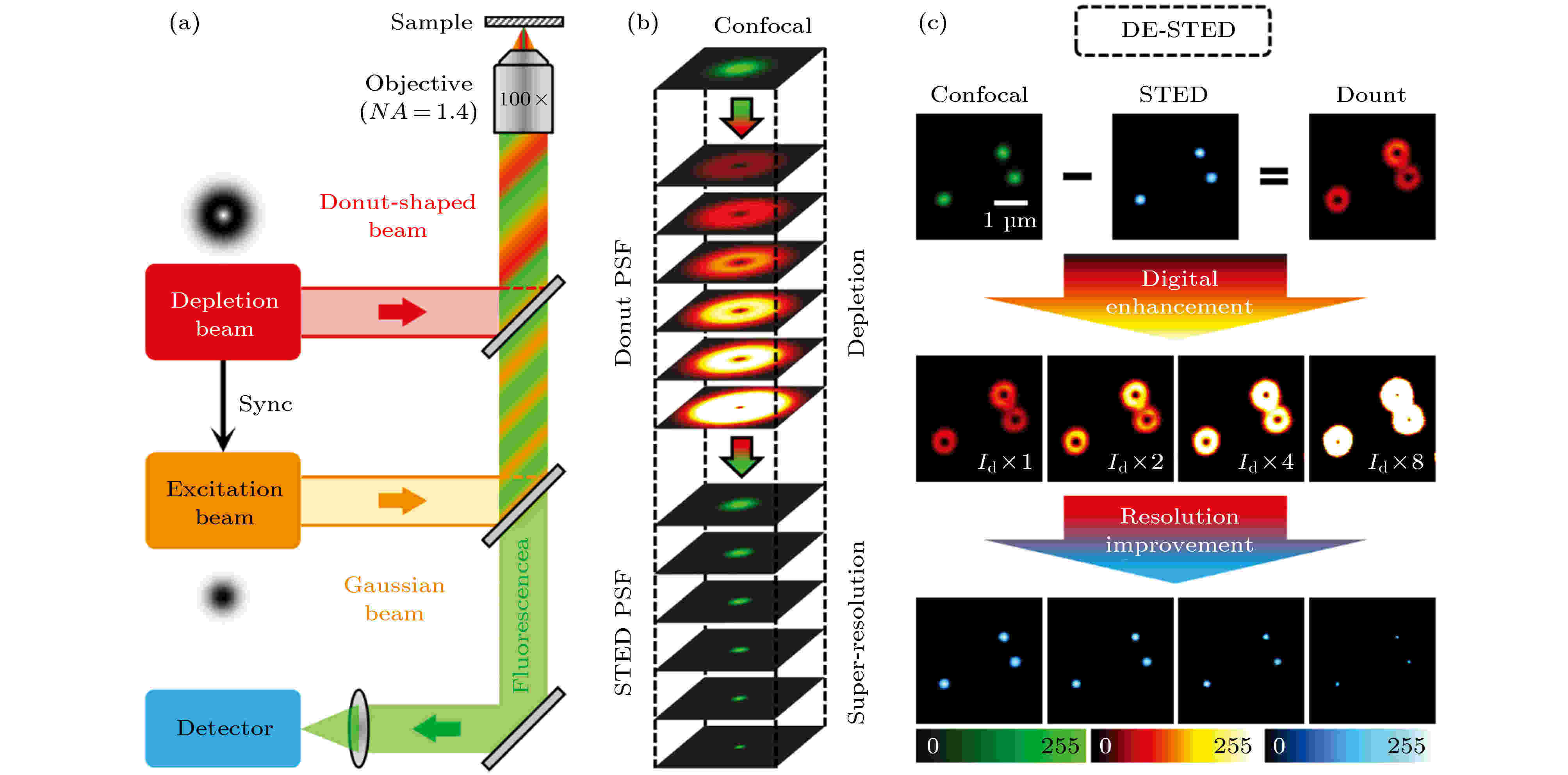 图 24 DE-STED原理图[55]
图 24 DE-STED原理图[55]Figure24. Schematic principle of DE-STED[55].
2
4.8.基于自适应光学的STED超分辨成像
在进行深层生物样品STED超分辨成像时, 常会由于样品内部的折射率分布不均匀引入严重的像差, 导致STED成像效果较差, 即便是很强的STED光都很难实现超分辨成像. 最有效的解决办法是引入自适应光像差校正技术, 常用的像差校正算法为泽尼克多项式[39]. 2017年Yan等[38]首次将相干自适应光学(coherent optical adaptive techniques, COAT)技术引入STED, 极大地提高了STED的成像深度以及样品成像的空间分辨率. 2019年, Wang等[40]发展了基于遗传算法的STED(GA-STED)成像技术, 提高了成像速度和精度, 实现了快速实时像差校正的STED成像. 引入自适应光学技术后和之前相比, 在保持相同分辨率的情况下, 有效地降低了STED光能量.2
5.1.STED与FCS的结合
荧光相关光谱(fluorescence correlation spectroscopy, FCS)技术是一种能够通过检测荧光强度的变化来获取溶液的浓度、粒子扩散系数等信息的单分子水平检测技术, 对于探究活细胞内的生物过程具有重要的意义[56-58]. Lanzanò等[58]最早于2005年提出将STED与FCS相结合. 2011年Gould等[59]为了在宏观分子尺度上对细胞膜的结构和功能进行成像和光谱分析, 将全内反射荧光(total internal reflection fluorescence, TIRF)显微与STED结合进行荧光光谱分析图25. 一方面, 由于TIRF可以减小测量体积的轴向范围, 另一方面, STED又能提升系统的成像能力, 所以将TRIF与STED结合可以克服STED系统受到离焦信号影响及全内发射显微系统分辨力低的缺点. TIRF-STED-FCS系统的关键是要调节激发光与STED光的偏振态, 确保激发光为切向偏振态, STED光为圆偏振态, 以获得激发焦点的偏振和STED焦点之间的最佳匹配[60]. 图 25 TIRF-STED-FCS系统示意图[59]
图 25 TIRF-STED-FCS系统示意图[59]Figure25. Schematic of TIRF-STED-FCS system[59].
2014年Honigmann等[61]把扫描STED技术与FCS相结合(scanning STED-FCS, sSTED-FCS), 能够利用STED技术提供的超高空间分辨率和FCS技术带来的快速时间分辨对细胞内分子的纳米级活动进行检测(图26), 对于解决真核质膜中脂质与蛋白质之间的相互作用具有重要意义.
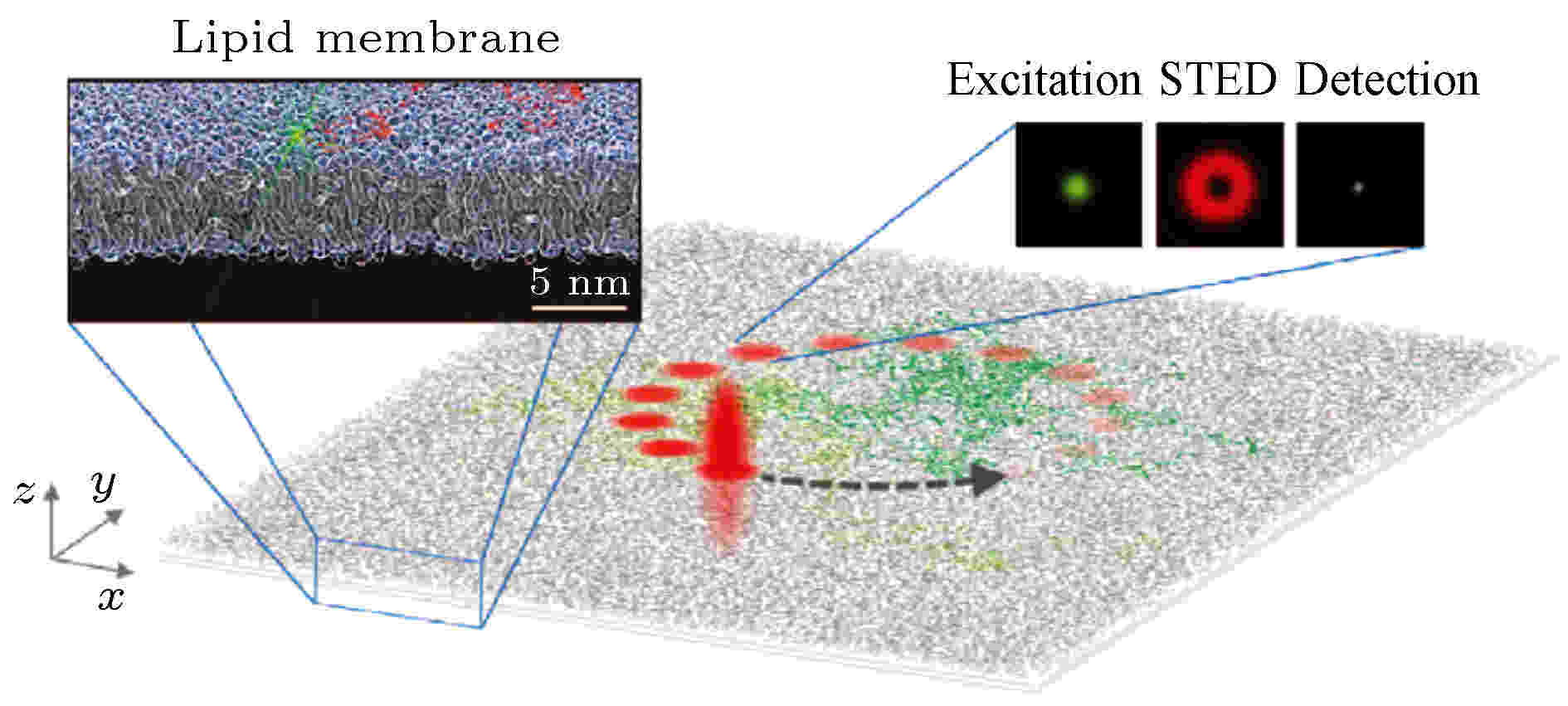 图 26 脂膜上sSTED-FCS的成像结果[61]
图 26 脂膜上sSTED-FCS的成像结果[61]Figure26. sSTED-FCS results of the lipid membrane[61].
2
5.2.STED与细胞膨胀技术的结合
膨胀显微[62] (expansion microscopy, ExM)通过在样品内直接合成可溶胀的聚电解质凝胶网络, 然后在水中透析样品, 可以使样品发生各向同性的膨胀, 相当于物理上将样品结构进行扩大(约4.5倍), 从而可以用普通显微镜观察到小于衍射极限的结构. 原则上膨胀显微技术可以和现有的超分辨成像技术进行结合, 然而由于成像体积的增大要求深度的聚焦, 且单分子定位显微等技术需要的特殊缓冲液可能会干扰凝胶的扩增, 而STED基于共聚焦原理, 对样品的深度成像相对简单, 而且无需任何特殊缓冲液, 所以将ExM与STED相结合是比较合理的方案. 将ExM与STED相结合形成ExSTED, 在样品膨胀四倍后进行STED成像, 能够实现2 D成像的有效空间分辨率小于10 nm, 3D成像的有效空间分辨率小于50—70 nm[63].2
5.3.STED与扫描离子电导显微镜的结合
扫描离子电导显微镜(scanning ion-conductance microscope, SICM)是扫描电镜中少数可以对活细胞进行成像的显微镜, 通过对样品表面电解质的局部离子电流进行采样, 可以获得样品的表面轮廓[64]. 早在2002年就已实现了将SICM和Confocal的结合[65], 因此, 理论上将SICM与STED结合是可行的. Hagemann等[66]对同一样品进行了SICM与STED成像, 两种成像结果将微管蛋白网络的变化与细胞形状和细胞形貌的变化联系起来, 对于研究细胞膜粗糙度、细胞形状和高度与细胞肌动蛋白结构之间的联系有重要意义.2
5.4.STED与PALM/STROM的结合
MINFLUX方法是2018年提出的一种结合了光束波前调制与单分子定位[67,68]的新的超分辨成像技术, 实现了约1.5 nm的单分子定位精度[69,70]. 具体来说, MINFLUX技术通过相位掩模版对激光波前进行调制, 使光束在物镜处产生环形激发光. 与STED技术不同的是, 该环形光束是用来激发而不是抑制荧光的产生. 然后, 与单分子定位显微技术, 如光激活定位显微 (photo-activated localization microscopy, PALM)或随机光学重构显微(stochastic optical reconstruction microscopy, STROM)技术类似, 通过控制随机地开启或关闭单个分子, 当目标分子位于光斑的圆环上时, 分子将发射荧光; 当目标分子位于光斑的圆环中心即暗点时则不会发射荧光. 通过探测目标分子发出的光子, 控制光束偏转器使目标分子始终位于环形光的中心. 利用这种方法, 就可以精确地定位出光子的位置. MINFLUX显微方法与STED相比, 避免了光学元器件对于光斑的影响, 通过光子状态来实现超分辨成像. 与PALM/STROM方法相比, 分子定位不再依赖于分子自身的荧光光子, 而是利用环形激发光束提供大量的光子来实现定位. 这样一来, 可以提高对光子的利用率, 能够对分子进行快速追踪, 同时也提高了定位精度.此外, STED与其他技术如X射线扫描衍射[71]、原子力显微镜[72,73](atomic force microscope, AFM)等相结合, 可以提升成像性能, 对于探究生物样品内不同结构间的联系具有重要的意义.
目前STED最主要的问题依然是STED光功率过高. 因此, 未来STED技术发展的一个重要方向是在保证STED成像速度和空间分辨率优势的前提下, 进一步降低STED光的功率, 实现低光照功率STED超分辨成像; 同时, 发展低毒性甚至无毒性、靶向性好和光稳定性强的荧光探针. 此外, 光毒性与成像深度和光波长都有着密切关系, 因此未来应倾向于用红外光及其相应的探针而非可见光来进行活细胞成像.
总的来说, STED技术发展非常迅速, 前面所提到的一些问题都在逐渐被解决, STED超分辨成像未来有着巨大的发展潜力与空间.
