第一联系人:
Online:2019-01-20

摘要
关键词:
Abstract
Keywords:
PDF (292KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
荆玉栋, 周骏翔. 人类高赖氨酸血症源于线粒体稳态破坏[J]. 遗传, 2019, 41(1): 85-87 doi:

周骏翔 博士
氨基酸代谢紊乱是一类遗传性代谢病,绝大多数属于常染色体隐性遗传病。高赖氨酸血症即是其中一种比较罕见的氨基酸代谢病,分I型和II型。I型患者血液中赖氨酸浓度偏高,但是症状不明显。II型患者血液中除赖氨酸浓度升高外,酵母氨酸浓度也会增高,患者会表现出严重的神经损伤和发育迟缓,多数患者在成年之前死亡。目前的研究对人体内的赖氨酸主要降解途径——酵母氨酸途径已经比较清楚:双功能酶α-氨基半醛合酶(α-aminoadipic semialdehyde synthase, AASS)是该途径主要的催化酶,N端是赖氨酸-酮戊二酸还原酶(lysine ketalutarate reductase, LKR)结构域,C端是酵母氨酸脱氢酶(saccharopine dehydrogenase, SDH)结构域,线粒体内的赖氨酸在LKR活性催化下与酮戊二酸结合,形成酵母氨酸,然后在SDH活性催化下分解成谷氨酸和氨基己二酸半醛,最后经过一系列生化反应变成乙酰辅酶A进入三羧酸循环。高赖氨酸血症的致病基因也已经明确,即赖氨酸降解途径的关键酶AASS。I型主要是LKR部分发生了突变,II型主要是SDH部分发生了突变。但是,关于赖氨酸和酵母氨酸浓度升高与患者症状的关联机制并不明确。截至目前II型高赖氨酸血症在临床上尚无有效的治疗方法,只能给病人食用不含赖氨酸的食物。
细胞是生命活动的基本结构和功能单位,细胞的生理活动需要能量维持,而生命体的能量主要以三磷酸腺苷(ATP)为载体,而线粒体就是动物细胞合成ATP的主要场所。另外线粒体还是代谢的重要场所,三羧酸循环、脂肪酸的β-氧化、血红素的合成以及某些氨基酸的代谢等都在线粒体内进行。所以线粒体是一类非常重要的细胞器,也是细胞内最丰富的细胞器之一,通常占细胞质容积的20%~25%,其数目和形态处于动态变化中。线粒体的形状变化很大,有球状、棒状、分枝状等,低倍镜下呈网状或线状。线粒体的分裂和融合对线粒体的形状以及维持线粒体稳态至关重要,该过程涉及还会许多调控蛋白的参与。目前研究发现,发动蛋白(dynamin)家族控制着线粒体分裂和融合的动态变化过程。第一个线粒体发动蛋白Mgm1在酵母中被发现,定位于线粒体内膜,介导线粒体内膜的融合。其在人类中的同源蛋白为OPA1,在线虫的同源蛋白是EAT-3。介导线粒体外膜融合的蛋白首先在果蝇中被发现,被命名为fuzzy onions,后来在果蝇中又发现了一个控制外膜融合的蛋白Marf,而人类中的同源蛋白分别是MFN1和MFN2。但是酵母或线虫中只发现了一个同源蛋白Fzo1p或FZO-1。Dnm1是最先在酵母中被发现的控制线粒体分裂的动力蛋白,其在线虫和哺乳动物的同源蛋白分别是DRP-1和DRP1。
为寻找新的调控线粒体稳态的因子,来自云南大学杨崇林教授和中国科学院遗传与发育生物学研究所郭伟翔研究员领导的研究团队联合以秀丽线虫为模式材料,构建了一个yqIs157株系,用绿色荧光蛋白标记线虫表皮细胞内的线粒体,从而在荧光显微镜下观察线粒体的形态。
研究团队通过EMS诱变进行了正向遗传学筛选,获得了一些线粒体形态发生改变的突变体株系。其中一类是具有球状增大线粒体的突变体,被命名为yq170和yq211 (图1)。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1aass-1基因的两个功能缺失突变体yq170中表皮细胞内的线粒体异常增大
右侧为透射电镜图。
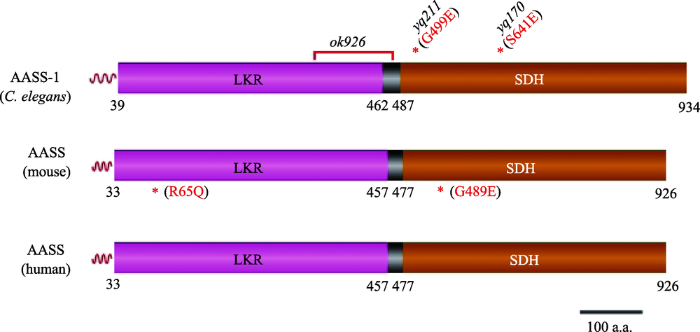
进一步研究发现,两个突变体影响的是同一个基因,该基因编码的蛋白质与人类α-氨基半醛合酶同源,所以将该基因命名为aass-1。yq170和yq211两个突变体中aass-1基因发生了功能缺失突变,而且突变位点都在C端的酵母氨酸脱氢酶(SDH)结构域(图2)。以从国际线虫遗传中心(Caenorhabditis Genetics Center, CGC)获得的LKR功能受到影响的线虫株系aass-1 (ok926)作为对照,该突变体由于基因缺失突变导致AASS-1蛋白中的LKR和SDH功能缺失。用荧光蛋白标记其线粒体发现,aass-1 (ok926)表皮细胞中的线粒体并不增大。说明只有在SDH功能受损而LKR功能正常的情况下才会造成线粒体球状增大的表型。
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2线虫AASS-1蛋白与人类AASS蛋白之间的比对
波浪线表示线粒体定位信号(MTS)。线虫AASS-1蛋白中的缺失突变和点突变的位置分别由红线和星号(*)指示。
通过液相色谱-质谱联用仪(LC-MS)检测发现,aass-1 (yq170)和aass-1 (yq211)突变体的酵母氨酸浓度大概是野生型N2的100倍,赖氨酸浓度是N2的3~4倍。aass-1 (ok926)突变体赖氨酸浓度是N2的5倍,但酵母氨酸浓度比野生型还低。荧光素发光实验显示,相对于野生型线虫N2,aass-1 (yq170)和aass-1 (yq211)突变体表皮细胞中的ATP含量显著降低,表明线粒体合成ATP的功能受到影响。而aass-1 (ok926)突变体表皮细胞中的ATP含量基本不变。
为验证突变体表皮细胞中线粒体增大是由于SDH突变导致的,以及人类AASS蛋白和线虫AASS-1蛋白功能类似,将人类AASS蛋白的LKR 结构域和SDH结构域分别在线虫中表达,结果发现LKR不能回复突变体线粒体增大的表型,而SDH结构域却可以将增大的线粒体回复到野生型的丝状或棒状。
秀丽线虫在进化上和结构上毕竟距离人类比较远,研究团队又通过构建高赖氨酸血症的小鼠模型做进一步验证。Aass (R65Q)纯合突变体小鼠的突变位点在LKR结构域,该突变位点就是人I型高赖氨酸血症的突变位点,Aass (G489E)纯合突变体小鼠的突变位点在SDH结构域,模拟II型高赖氨酸血症,该突变位点是aass-1 (yq211)线虫突变体的突变位点。
LC-MS检测发现,Aass (R65Q)突变体小鼠血浆中的酵母氨酸浓度比野生型小鼠更低,而Aass (G489E)突变体小鼠的酵母氨酸浓度是野生型小鼠的100倍以上,这一结果与人类II型高赖氨酸血症一致。线粒体的氧消耗量是其功能的重要指标,利用seahorse细胞能量代谢分析仪,对小鼠肝脏细胞的氧消耗量进行了检测,发现Aass (G489E)突变体小鼠的氧消耗量低于野生型小鼠。
II型高赖氨酸血症会使得病人发育迟缓和过早死亡,而I型高赖氨酸血症大部分病人的症状并不明显。而在Aass (G489E)突变体小鼠模型中,线粒体内酵母氨酸氧化缺陷会造成肝脏内线粒体的损伤,并使肝脏重量增加,从而导致小鼠生长迟缓和过早死亡。
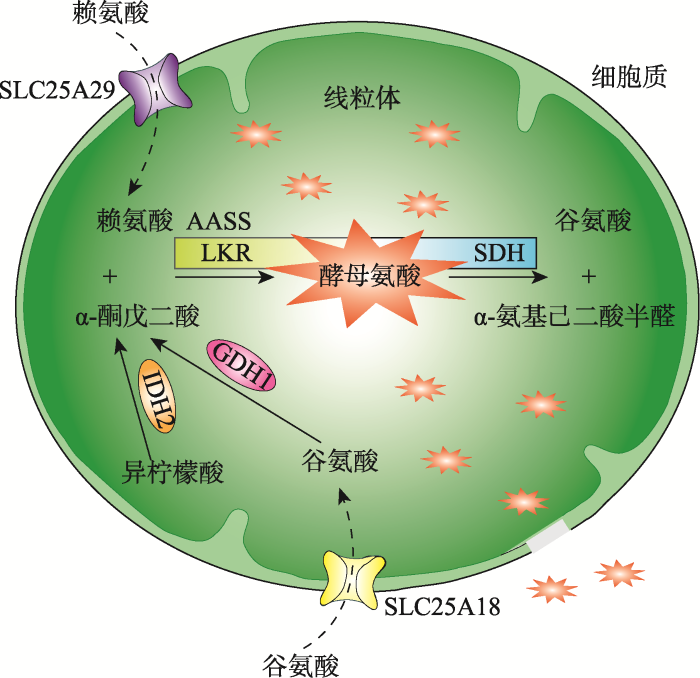
为探索II型高赖氨酸血症的治疗策略,利用线虫aass-1 (yq170)突变体进行了抑制筛选,获得突变体并克隆了相应基因。研究发现抑制LRK、抑制向线粒体的赖氨酸或谷氨酸运输、抑制线粒体谷氨酸脱氢酶或异柠檬酸脱氢酶均可以抑制aass-1 (yq170)突变体中酵母氨酸的产生,从而使线粒体恢复正常。这就为II型高赖氨酸血症的治疗提供了重要的理论依据和治疗思路(图3)。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3赖氨酸代谢相关通路以及酵母氨酸累积造成线粒体损伤的机制示意图
我们通过秀丽线虫和小鼠模型的研究,发现由于赖氨酸代谢产物酵母氨酸累积,使线粒体增大,破坏了线粒体稳态,影响了线粒体的功能,从而影响了个体的发育。这就在细胞水平阐明了人类高赖氨酸血症发病机理,并为下一步的治疗指明了方向。高赖氨酸血症发病机理的揭示,很好的体现了利用经典模式生物秀丽线虫进行基础研究的重要性。通过研究维持线粒体稳态的机制,最终阐明了一种氨基酸代谢缺陷病的发病机制。
