李艳敏, 蒋卉, 符真珠, 张晶, 袁欣, 王慧娟, 高杰, 董晓宇, 王利民, 张和臣
, * 河南省农业科学院园艺研究所, 郑州 450002
Callus Induction and Somatic Embryogenesis in Anther Culture of Paeonia lactiflora Yanmin Li, Hui Jiang, Zhenzhu Fu, Jing Zhang, Xin Yuan, Huijuan Wang, Jie Gao, Xiaoyu Dong, Limin Wang, Hechen Zhang
, * Horticultural Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China
通讯作者: *E-mail:
zhc5128@126.com 责任编辑: 朱亚娜
收稿日期: 2020-12-1
接受日期: 2021-05-27
基金资助: 河南省农业科学院自主创新项目 (2021ZC20 )河南省科技攻关计划 (192102110148 )河南省农业科学院科技创新创意项目 (2020CX13 )河南省农业科学院优秀青年基金 (2020YQ17 )
Corresponding authors: *E-mail:
zhc5128@126.com Received: 2020-12-1
Accepted: 2021-05-27
摘要 以芍药(
Paeonia lactiflora )品种粉玉奴花药为外植体, 研究不同浓度2,4-D对愈伤组织诱导、体胚发生及植株再生的影响, 采用组织细胞学方法观察愈伤组织以及体细胞胚发育过程, 采用根尖染色体法鉴定再生植株倍性。结果表明, 芍药花药愈伤组织诱导的最适培养基为MS+1 mg·L
-1 2,4-D+1 mg·L
-1 NAA+0.1 mg·L
-1 KT+30 g·L
-1 蔗糖+6.5 g·L
-1 琼脂, 愈伤组织诱导率为14.7%。转入体细胞胚诱导培养基上, 历经球形胚、心形胚、鱼雷胚和子叶胚阶段, 体胚诱导率为52.1%; 在成苗培养基中能够长出真叶并得到完整植株, 成苗率为47.1%。经根尖染色体法鉴定出单倍体和二倍体植株。该研究初步建立了通过体细胞胚间接发生途径实现植株再生的培养体系, 可为芍药属其它品种的花药培养提供借鉴, 获得的再生植株是芍药遗传学研究和育种工作的重要材料。
关键词: 芍药 ;
花药培养 ;
愈伤组织 ;
体细胞胚 ;
再生植株 Abstract The anthers of
Paeonia lactiflora cv. ‘Fenyunu’ were used as explants to study the effects of different concentrations of 2,4-D on callus induction, somatic embryogenesis and plant regeneration. The cell composition of callus and the development process of somatic embryos were observed with cytohistological method, and the ploidy of regenerated plants was identified using root tip squash method. The results showed that the suitable medium for callus induction of
P. lactiflora anther was MS+1 mg·L
-1 2,4-D+1 mg·L
-1 NAA+0.1 mg·L
-1 KT+30 g·L
-1 sucrose+6.5 g·L
-1 agar, and the callus induction rate was 14.7%. The callus was transferred to somatic embryo induction medium and underwent stages of spherical embryo, heart-shaped embryo, torpedo embryo and cotyledon embryo, and the somatic embryo induction rate was 52.1%. Genuine leaves germinated in seedling medium and complete plants were obtained, and the seedling rate was 47.1%. Haploid and diploid plants were identified using root tip squash method. The study preliminarily established a culture system to implement plant regeneration through somatic embryogenesis, which also provided reference protocol for anther culture of other varieties of
Paeonia . Regenerated plants are important materials for genetic research and haploid breeding of
P. lactiflora .
Keywords: Paeonia lactiflora ;
anther culture ;
callus ;
somatic embryos ;
regenerated plants PDF (2527KB) 元数据 多维度评价 相关文章 导出 EndNote |
Ris |
Bibtex 收藏本文 引用本文 李艳敏, 蒋卉, 符真珠, 张晶, 袁欣, 王慧娟, 高杰, 董晓宇, 王利民, 张和臣 . 芍药花药愈伤组织诱导及体细胞胚发生. 植物学报, 2021,
56 (4): 443-450 doi:10.11983/CBB20195
Li Yanmin, Jiang Hui, Fu Zhenzhu, Zhang Jing, Yuan Xin, Wang Huijuan, Gao Jie, Dong Xiaoyu, Wang Limin, Zhang Hechen .
Callus Induction and Somatic Embryogenesis in Anther Culture of Paeonia lactiflora .
Chinese Bulletin of Botany , 2021,
56 (4): 443-450 doi:10.11983/CBB20195
芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”。芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 )。近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 )。然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 )。采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 )。单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 )。目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 )。其中, 花药培养是获得单倍体的一种重要方式。
目前, 植物花药培养的报道较多, 而观赏植物花药培养报道却较少。芍药属植物花药培养始于20世纪70年代(
Sunderland et al., 1975 ), 但多数研究仍停留在愈伤组织诱导阶段, 均未获得完整植株(
文书生等, 2018 )。研究表明, 牡丹花粉培养诱导得到的花粉胚可分化出根, 但无法分化出芽(Robers and Sunderland, 1977)。国内以紫斑牡丹(
P. suffruticosa var.
papaveracea )(
陈怡平, 2001 )的雄蕊为外植体诱导愈伤组织未能成功;
朱向涛等(2010a ,
2010b) 研究了牡丹花蕾大小、激素和低温预处理时间对花药诱导愈伤组织的影响, 认为单核中期的花粉是诱导愈伤组织的最佳材料。目前, 关于芍药花药培养的研究报道很少。本研究以花药数量较多的芍药品种粉玉奴为材料, 开展花药愈伤组织诱导及体胚发生和植株再生研究, 初步建立了芍药花药培养与植株再生技术体系, 以期为芍药属其它品种的花药培养提供技术借鉴, 同时也为芍药单倍体育种工作奠定基础。
1 植物材料 2019年4月15日上午10:00在洛阳农林科学院资源圃采集芍药(
Paeonia lactiflora Pall.)粉玉奴花蕾, 花蕾橫径1.8-2.1 cm、纵径1.6-1.9 cm, 以顶部微露红为宜。
2 培养基成分与培养条件 2.1 外植体处理及消毒 将采下的花蕾放于冰盒带回实验室, 进行灭菌处理。灭菌方法为: 剥去萼片, 用流水冲洗5分钟; 然后在超净工作台上, 用0.1% HgCl
2 灭菌12分钟; 最后用无菌水冲洗3遍, 备用。
2.2 花药愈伤组织诱导 先用无菌镊子剥去花瓣, 然后夹住花丝取下花药, 接种至愈伤组织诱导培养基上。诱导愈伤组织的基本培养基为MS培养基, 添加2,4-D (浓度分别为1、1.5和2 mg·L
-1 ), 以及1 mg·L
-1 NAA, 0.1 mg·L
-1 KT, 30 g∙L
-1 蔗糖, 6.5 g∙L
-1 琼脂, pH5.8。每皿接种25-30枚花药, 每个处理接种1-2皿, 重复3次。置于(23±2)°C的培养室, 黑暗条件下培养5-7天, 再在6.25 μmol·m
-2 ·s
-1 光照下继续培养约100天, 记录愈伤组织的颜色和状态, 并统计愈伤组织诱导率((诱导出愈伤组织的花药数/各处理接种的花药总数)× 100%)。
2.3 体胚诱导及成苗培养 将愈伤组织转接到体胚诱导培养基上继代培养。体胚诱导培养基为MS+1 mg·L
-1 KT+1.0 g·L
-1 椰子粉+ 30 g·L
-1 蔗糖+6.5 g·L
-1 琼脂, pH5.8。统计体细胞胚诱导率((诱导出体胚的愈伤组织数量/接入的愈伤组织总数)×100%)。挑选发育成熟的体细胞胚转接到成苗培养基进行成苗培养, 成苗标准为体胚长出1-2片真叶。成苗培养基为WPM+1.0 mg·L
-1 6-BA+ 0.2 mg·L
-1 IAA+1.0 mg·L
-1 GA
3 +30 g·L
-1 蔗糖+ 6.5 g·L
-1 琼脂, pH5.8。在培养温度为(23±2)°C, 光照强度为25 μmol·m
-2 ·s
-1 , 光周期为12小时光照/12小时黑暗的培养室内培养4-5周, 统计成苗数量, 计算成苗率((成苗数量/接入的体胚总数)×100%)。
以上试验均采用单因素完全随机设计, 所得数据用DPSv6.55软件进行统计分析, 采用Microsoft Excel 2003软件作图。
2.4 愈伤组织及体胚发育的组织细胞学观察 将不同类型的愈伤组织分装, 用38%福尔马林:冰乙酸:70%乙醇=5:5:90 (v/v/v)的FAA固定液固定48小时后进行石蜡包埋, 石蜡切片厚度为10 μm。用1%番红- 0.5%固绿染色法染色, 封片后使用Nikon ECLIPSE E100显微镜观察, 用ISH数码显微摄像系统拍照, 后期不同发育阶段的体细胞胚及成苗使用数码相机拍照。
2.5 再生植株根尖细胞染色体观察 采用
李懋学和陈定慧(1980) 的方法进行芍药根尖细胞染色制片观察。取再生植株的根尖, 先用对氯二苯饱和水溶液在室温下处理2-3小时, 然后用蒸馏水冲洗2-3次, 再用卡诺固定液固定24小时。用0.1 mol∙L
-1 HCl在60°C水浴锅中解离8分钟, 然后用卡宝品红染色, 最后在Nikon ECLIPSE E100显微镜下观察, 并用ISH数码显微摄像系统拍照。
3 结果与讨论 3.1 2,4-D浓度对花药愈伤组织诱导的影响 将花药均匀接种在诱导培养基上。接种7天后, 花药逐渐变为浅褐色; 接种16天后, 花药顶端膨大, 或者中间部位开裂, 有少许颗粒物质形成, 前期愈伤组织生长缓慢; 接种30天后, 花药基本全部变为褐色, 可以观察到愈伤组织从花药一端或者开裂的花药中长出, 此后愈伤组织逐渐长大, 将花药包裹在内。本研究表明, 不同诱导培养基中花药的愈伤组织诱导率有所不同(
表1 )。在愈伤组织诱导培养基中添加不同浓度的2,4-D, 随着2,4-D浓度的增加诱导率呈现先增加后下降趋势。当2,4-D浓度为1.5 mg·L
-1 时诱导率最高(16.7%), 其次为2,4-D浓度为2.0 mg·L
-1 , 愈伤组织诱导率为14.8%; 2,4-D浓度为1.0 mg·L
-1 时愈伤组织诱导率为14.7%, 但3个处理之间差异不显著, 仅愈伤组织的颜色不同。当2,4-D浓度较低(1-1.5 mg·L
-1 )时, 愈伤组织均为浅褐色疏松状态, 当2,4-D浓度增至2 mg·L
-1 时, 愈伤组织为褐色疏松状态。
Table 1 表1 表1 2,4-D浓度对花药愈伤组织诱导的影响(平均值±标准差)
Table 1
Effects of 2,4-D concentration on anther callus induction (means±SD) Medium 2,4-D -1 ) NAA -1 ) KT -1 ) Callus induction rate (%) Callus M1 1 1 0.1 14.7±3.64 a Light brown, loose M2 1.5 1 0.1 16.7±2.33 a Light brown, loose M3 2 1 0.1 14. 8±3.70 a Brown, loose
同列不同小写字母表示差异显著(P <0.05)。KT: 激动素; NAA: α-萘乙酸 Different lowercase letters in the same column indicate significant differences at P <0.05. KT: Kinetin; NAA: α-naphthalene acetic acid 新窗口打开 |
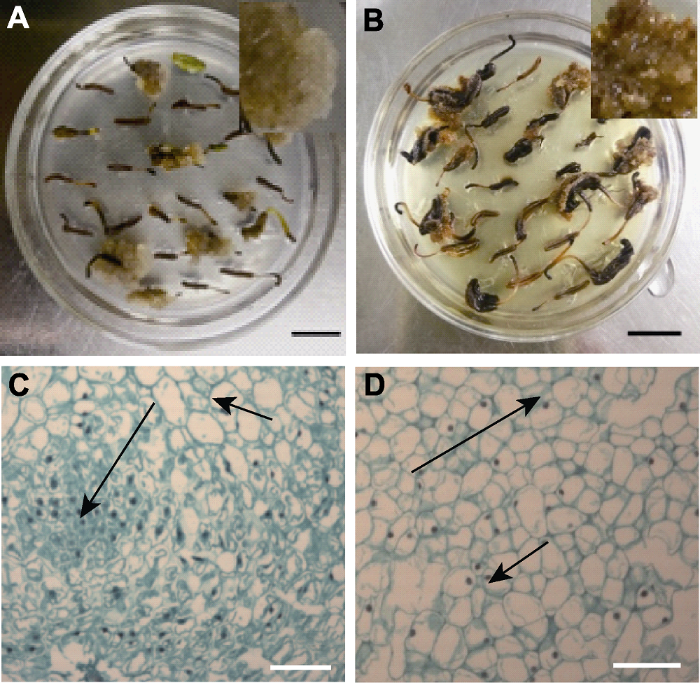
下载CSV 3.2 不同类型愈伤组织的细胞学观察 在花药愈伤组织诱导中, 获得的愈伤组织颜色存在差异, 主要包括浅褐色疏松愈伤组织(I型) (
图1A )和褐色疏松愈伤组织(II型) (
图1B ) 2种类型。将其转入体细胞胚诱导培养基培养一段时间后, I型和II型愈伤组织表面或内部均出现光滑的球状物。分别对其进行细胞学观察, 结果显示, 组成愈伤组织的细胞有2类, 一类是细胞大、液泡大、核小、颜色较浅、排列疏松的非胚性细胞(a型), 另一类是细胞小、液泡小、核大、颜色较深、排列紧密的胚性细胞(b型)。I型愈伤组织内部有大量的胚性细胞, 形成分裂中心, 外围是非胚性细胞(
图1C ); II型愈伤组织多数由非胚性细胞组成, 有个别胚性细胞分布在愈伤组织内部(
图1D )。
图1 新窗口打开 |
下载原图ZIP |
生成PPT 图1芍药花药愈伤组织的类型 (A) 浅褐色疏松愈伤组织(I型); (B) 褐色疏松愈伤组织(II型); (C) I型愈伤组织的显微结构; (D) II型愈伤组织的显微结构。 短箭头示非胚性细胞(a型), 长箭头示胚性细胞(b型)。(A), (B) Bars=1 cm; (C), (D) Bars=100 μm
Figure 1Types of Paeonia lactiflora anther callus (A) Light brown loose callus (type I); (B) Brown loose callus (type II); (C) The microstructure of type I; (D) The microstructure of type II. Short arrows refer to non-embryonic cells (type a) and long arrows refer to embryonic cells (type b); (A), (B) Bars=1 cm; (C), (D) Bars=100 μm
3.3 体细胞胚发育及植株再生 将愈伤组织分别转接到体细胞胚诱导培养基上培养40天左右。大约15天后, 愈伤组织增殖变大, 表面或者内部分化出淡黄色的芽状体和白色的短根, 可在解剖镜下观察到球形胚和心形胚(
图2A , B)。将愈伤组织转接到新鲜的诱导培养基上继续培养, 可以相继观察到鱼雷胚(
图2C )、子叶胚(
图2D )和具有胚根和胚芽的成熟胚(
图2E ), 这一发育过程与合子胚发生途径一致。将发育成熟的体胚转接到成苗培养基上培养, 子叶转绿, 真叶长出, 形成具有根和茎叶的完整植株(
图2F )。
图2 新窗口打开 |
下载原图ZIP |
生成PPT 图2芍药花药体细胞胚发育过程 (A) 球形胚; (B) 心形胚; (C) 鱼雷胚; (D) 子叶胚; (E) 成熟胚; (F) 再生植株; (G) 发育不同步的体胚; (H) 胚根伸长; (I) 胚芽萌发; (J) 子叶畸形胚; (A)-(D) Bars=2 mm; (E)-(J) Bars=1 cm
Figure 2Anther somatic embryo development process of Paeonia lactiflora (A) Spherical embryo; (B) Heart-shaped embryo; (C) Torpedo embryo; (D) Cotyledon embryo; (E) Mature embryo; (F) Regenerating plants; (G) Somatic embryos with unsynchronized development; (H) Radicle elongation; (I) Germ germination; (J) Malformed cotyledon embryo; (A)-(D) Bars=2 mm; (E)-(J) Bars=1 cm
芍药花药体细胞胚的发育具有不同步性, 即在同一块胚性愈伤组织中, 会有不同发育时期的体细胞胚同时存在(
图2G )。有的愈伤组织先发育形成根, 将其转入成苗培养基后, 在另一端会长出绿色芽点, 但是很难继续长出真叶(
图2H )。此外, 还发现子叶胚下胚轴不生长的现象, 将其转入成苗培养基, 可以正常长出真叶, 但未形成根系(
图2I )。将芍药的成熟胚转入空白培养基上, 可见根系生长, 但无真叶长出, 转入仅添加细胞分裂素和生长素的培养基后子叶会变大变粗,亦无真叶长出, 只有在培养基中添加GA
3 后, 才有真叶长出, 形成正常发育的完整植株。部分体细胞胚发育畸形, 如子叶畸形(
图2J )。畸形体胚转入成苗培养基后, 少数能形成正常植株。
统计不同来源愈伤组织的体胚诱导率和成苗率(
图3 ), 结果表明, 从M1培养基中获得的愈伤组织体胚诱导率和成苗率均最高(分别为52.1%和47.1%); 其次是来源于M2培养基的愈伤组织(体胚诱导率为35.4%, 成苗率为36.6%); 来源于M3培养基的愈伤组织体胚诱导率为23.3%, 成苗率为13.3%。综上, 芍药花药愈伤组织诱导最适培养基为M1, 即MS+ 1 mg·L
-1 2,4-D+1 mg·L
-1 NAA+0.1 mg·L
-1 KT+30 g·L
-1 蔗糖+6.5 g·L
-1 琼脂。
图3 新窗口打开 |
下载原图ZIP |
生成PPT 图3芍药不同来源愈伤组织的体胚诱导率及成苗率 不同小写字母表示在
P <0.05水平差异显著。
Figure 3Somatic embryo induction rate and seedling rate of Paeonia lactiflora calli from different sources Different lowercase letters indicate significant differences at
P <0.05 level.
3.4 再生植株的根尖细胞染色体观察 芍药品种粉玉奴为二倍体植物, 染色体数目为2
n = 2
x =10 (
张建军等, 2020 )。对12株花药再生植株进行根尖细胞染色体观察, 在根尖细胞分裂相的8株花药再生植株中, 有3株植株的根尖分别观察到6、6和7个细胞中期分裂相, 均有5条染色体(
图4A ), 为单倍体植株; 有4株植株的根尖分别观察到6、8、12和7个细胞中期分裂相, 均有10条染色体(
图4B ), 为二倍体植株; 1株植株仅观察到3个细胞中期分裂相, 分别有7条、8条和8条染色体(
图4C ), 为非整倍体植株。此外, 还观察到在根尖细胞有丝分裂后期, 存在染色体不对称分裂现象(
图4D )。未观察到分裂期细胞的植株有4株。
图4 新窗口打开 |
下载原图ZIP |
生成PPT 图4芍药再生植株根尖细胞染色体观察 (A) 单倍体; (B) 二倍体; (C) 非整倍体; (D) 染色体不对称分裂。Bars=2 μm
Figure 4Chromosome observation of root tip cells from plant regeneration of Paeonia lactiflora (A) Haploid; (B) Diploid; (C) Aneuploid; (D) Asymmetric chromosome division. Bars=2 μm
3.5 单倍体与二倍体再生植株形态对比 将获得的单倍体和二倍体再生植株在相同条件下继代培养3个周期后, 观察其生长状况(
图5 ), 并统计每株苗的根系和叶片生长指标, 分别计算单倍体和二倍体再生植株各项指标的平均值。结果表明, 单倍体植株叶片数量介于2-5片, 平均3.3片; 叶柄粗, 平均长2.93 cm; 平均根数11条, 平均根长6.33 cm, 3株再生植株基部均分化出新芽。二倍体植株叶片数量介于2-6片, 平均4.25片; 叶柄细, 平均长5.75 cm, 平均根数2条; 平均根长8.67 cm, 仅有1株基部分化出新芽。
图5 新窗口打开 |
下载原图ZIP |
生成PPT 图5芍药单倍体与二倍体再生植株对比 (A) 单倍体植株; (B) 二倍体植株。Bar=10 mm
Figure 5Comparison of haploid and diploid plants of Paeonia lactiflora (A) Haploid plants; (B) Diploid plants. Bar=10 mm
3.6 讨论 植物细胞离体培养形态发生包括2种途径, 即体细胞胚发生途径和器官发生途径(
李杉等, 2001 )。体细胞胚发生途径又分为直接途径和间接途径, 体细胞直接诱导形成体细胞胚然后形成再生植株的途径为直接途径, 这种情况多发生在合子胚的胚性细胞继续分裂及萌发中; 间接途径需要先诱导愈伤组织, 然后再诱导产生体细胞胚进行植株再生(
魏冬霞等, 2018 )。本研究中, 芍药花药是经过愈伤组织诱导体细胞胚再生的间接途径, 因此, 获得胚性愈伤组织是进行体细胞胚诱导再生的关键。不同物种诱导获得的胚性愈伤组织其颜色形态也不相同。香樟(
Cinnamomum camphora )胚性愈伤组织为白色, 表面散布淡黄色颗粒, 非胚性愈伤组织多为灰色、白色或深黄色(
荆茹月等, 2020 ); 唐菖蒲(
Gladiolus hybridus )中的黄白色致密愈伤组织为胚性愈伤组织, 浅黄色偏白疏松愈伤组织为非胚性愈伤组织(
吴健等, 2012 )。采用芍药茎段诱导出的淡黄色致密型、白色透明型、淡黄色松散型和淡黄色水润型4类愈伤组织中, 淡黄色水润型愈伤组织为胚性愈伤组织, 可发育到心形胚阶段(
魏冬霞等, 2018 )。通过组织细胞学观察, 发现胚性愈伤组织的细胞存在共性, 即细胞体积小, 细胞质浓、细胞核大, 液泡较少或无液泡, 具有旺盛的分裂能力。在本研究中, 我们获得了两类芍药花药愈伤组织, 即浅褐色和褐色疏松愈伤组织。经组织细胞学观察, 发现浅褐色疏松愈伤组织内部存在胚性细胞团, 具有较高的分裂活性, 可以诱导体细胞胚; 褐色愈伤组织多数由非胚性细胞组成, 在体胚诱导培养基上也能分化形成体细胞胚, 表明非胚性细胞在适宜的培养条件下可向胚性细胞转化, 这与菠萝(
Ananas comosus )愈伤组织体细胞胚起源过程相似。将菠萝的非胚性愈伤组织转入体胚诱导培养基后, 愈伤组织中会先出现一些胚性细胞, 然后单个胚性细胞分裂形成原胚(
何业华等, 2010 )。
植物体细胞胚胎的发育过程与合子胚的发育过程相似, 历经球形胚、心形胚、鱼雷胚、子叶胚到成熟胚。自然条件下, 芍药属植物(牡丹和芍药)的种子具有较特殊的休眠特性, 即下胚轴休眠和上胚轴休眠双重休眠(
郑相穆等, 1995 ;
金飚等, 2006 ;
张捷等, 2018 )。
郑相穆等(1995) 发现凤丹(
P. ostii )种子萌发需要经过严格有序的后熟、长根和长芽3个阶段, 种子采收后要经过40天的生理后熟过程, 胚才分化完成; 在25°C条件下, 胚根生长, 为暖温长根阶段; 在5°C条件下, 胚芽生长, 为低温春化长芽阶段。上胚轴休眠需要低温或者赤霉素处理才能打破。在芍药体细胞胚胎发育过程中, 也存在胚根和胚芽发育不同步现象, 即花药胚胎发育到子叶胚后, 继续在培养室中培养, 胚根伸长, 但是胚芽无变化, 只有放入培养箱进行4-8°C低温处理或者在培养基中添加GA
3 后, 胚芽才会长出真叶。培养基中只添加细胞分裂素和生长素, 子叶会增粗, 但未长出真叶。说明芍药体细胞胚中胚芽处于休眠状态, 打破其休眠与打破种子上胚轴休眠需要的条件一致。这与
周秀梅等(2009) 的研究结果一致, 即牡丹体胚存在上胚轴休眠现象, 在3-5°C条件下, 2个月后形成芽。在芍药花药体细胞胚的发育过程中, 多数体细胞胚遵循胚根先萌发胚芽后萌发的生长顺序, 但是也有少数体胚的胚根未萌发, 转入成苗培养基后, 胚芽萌发长出真叶, 这与种子胚的萌发有所不同。在打破芍药种子休眠的过程中发现, 只有先打破下胚轴休眠再打破上胚轴休眠, 种子才能萌发(
张捷等, 2018 )。这可能是由于在离体培养条件下, 外源激素的存在使芍药体细胞胚在胚根未生长的条件下胚芽能够继续生长。
植物花药离体培养存在愈伤组织诱导分化难的问题。愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件。2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力。牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a )。也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 )。本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加。研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响。随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似。百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 )。花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在。单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 )。红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 )。百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 )。本研究获得的芍药花药植株同样存在倍性复杂的情况。对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性。
本研究筛选到芍药花药愈伤组织诱导的最适培养基为MS+1 mg·L
-1 2,4-D+1 mg·L
-1 NAA+0.1 mg·L
-1 KT+30 g·L
-1 蔗糖+6.5 g·L
-1 琼脂, 获得的愈伤组织能够诱导体细胞胚发生, 得到单倍体植株, 初步建立了芍药花药培养及植株再生技术体系, 可为芍药属其它品种的花药培养提供技术借鉴。获得的再生植株是遗传学研究和育种工作的重要材料。
[1] 卜华虎 , 任志强 , 王晓清 , 肖建红 (2017 ). 植物单倍体育种研究进展山西农业科学 45, 2032 -2037 . [本文引用: 1] [2] 陈怡平 , 丁兰 , 赵敏桂 (2001 ). 用紫斑牡丹不同外植体诱导愈伤组织的研究西北师范大学学报(自然科学版) 37(3 ), 66 -69 . [本文引用: 1] [3] 成仿云 , 陈德忠 (1998 ). 紫斑牡丹新品种选育及牡丹品种分类研究北京林业大学学报 20(2 ), 27 -32 . [本文引用: 1] [4] 褚云霞 , 陈龙清 , 黄燕文 , 张永春 (2001 ). 百合的花药培养研究园艺学报 32, 472 -474 . [本文引用: 2] [5] 崔凯荣 , 邢更生 , 周功克 , 刘新民 , 王亚馥 (2000 ). 植物激素对体细胞胚胎发生的诱导与调节遗传 22, 349 -354 . [本文引用: 1] [6] 冯大领 , 李伟 , 张洁 , 李鹏涛 , 李明 , 赵书岗 , 史宝胜 , 彭伟秀 (2009 ). 黄山栾树体细胞胚的发生和组织学观察植物生理学通讯 45, 855 -858 . [本文引用: 1] [7] 何业华 , 方少秋 , 马均 , 胡中沂 , 卢敏 , 彭兵 (2010 ). 菠萝愈伤组织中体细胞胚起源过程的组织细胞学观察园艺学报 37, 689 -696 . [本文引用: 1] [8] 金飚 , 丁玲 , 何小弟 , 贾妮 , 李娜 , 向其柏 (2006 ). 芍药种子露地播种和低温贮藏过程中内源激素含量的变化南京林业大学学报(自然科学版) 30, 45 -48 . [本文引用: 1] [9] 荆茹月 , 霍坤 , 李志辉 (2020 ). 香樟胚性与非胚性愈伤组织间的差异研究中南林业科技大学学报 40(10 ), 70 -78 . [本文引用: 1] [10] 李懋学 , 陈定慧 (1980 ). 栽培芍药染色体的Giemsa C-带及体细胞染色体联合的观察遗传学报 7, 271 -275 . [本文引用: 1] [11] 李杉 , 邢更妹 , 崔凯荣 , 王亚馥 (2001 ). 植物体细胞胚发生中ATP酶活性时空分布动态与内源激素的变化植物学通报 18, 308 -317 . [本文引用: 1] [12] 李允菲 , 孙宇涵 , 李云 (2016 ). 植物单倍体育种及其在林木育种中的应用世界林业研究 26, 41 -46 . [本文引用: 2] [13] 卢洁 , 徐金光 , 杲承荣 , 窦霄 , 于华冰 , 姜楠南 (2017 ). 芍药切花优良品种筛选山东林业科技 47(3 ), 13 -17 . [本文引用: 1] [14] 田丹青 , 葛亚英 , 潘晓韵 , 金亮 , 周媛 , 朱强 , 万晓 (2020 ). 红掌花药培养及单倍体植株的鉴定分子植物育种 18, 7149 -7154 . [本文引用: 1] [15] 魏冬霞 , 张滕 , 郑严仪 , 于晓南 (2018 ). 芍药愈伤组织中体细胞胚发育过程的组织细胞学观察植物研究 38, 56 -63 . [本文引用: 2] [16] 文书生 , 何绒绒 , 郑佳康 , 田如男 (2018 ). 牡丹组织培养技术研究进展林业科学 54(10 ), 143 -155 . [本文引用: 1] [17] 吴健 , 王鸿昌 , 罗弦 , 钟雄辉 , 高明伟 , 吴泽 , 义鸣放 (2012 ). 唐菖蒲体细胞胚起源、发育的形态与组织细胞学观察园艺学报 39, 2413 -2420 . [本文引用: 1] [18] 苑庆磊 (2011 ). 中国芍药花文化研究硕士论文. 北京: 北京林业大学 . pp. 7 -11 . [本文引用: 1] [19] 张建军 , 陈莉祺 , 李建光 , 孙苗 , 范永明 , 于晓南 (2020 ). 芍药根茎解剖结构特征及生长轮分析北京林业大学学报 42(5 ), 124 -134 . [本文引用: 1] [20] 张捷 , 谢军 , 孙辑凯 , 沙伟 (2018 ). 芍药播种繁殖中种子破眠技术的研究进展分子植物育种 16, 4380 -4386 . [本文引用: 2] [21] 张文婷 , 何燕红 , 舒宁 , 邢景景 , 刘宝骏 , 包满珠 , 刘国锋 (2019 ). 金黄花滇百合植株再生与离体快繁技术体系的建立植物学报 54, 773 -778 . DOI:
10.11983/CBB18256 [本文引用: 1] 以金黄花滇百合(Lilium bakerianum var. aureum)的鳞片为外植体, 探讨不同部位外植体和不同配比的植物生长调节剂对愈伤组织诱导和植株再生的影响。研究结果表明, 鳞片诱导愈伤组织和不定芽的最适培养基为MS+1.0 mg∙L <sup>-1</sup>6-BA+0.1 mg∙L <sup>-1</sup>NAA+30 g∙L <sup>-1</sup>蔗糖; 不定芽增殖的最适培养基为MS+0.5 mg∙L <sup>-1</sup>6-BA+0.1 mg∙L <sup>-1</sup>NAA+30 g∙L <sup>-1</sup>蔗糖; 不定芽诱导小鳞茎的最适培养基为MS+1.0 mg∙L <sup>-1</sup>NAA+30 g∙L <sup>-1</sup>蔗糖; 小鳞茎膨大生根的最适培养基为1/2MS+0.01 mg∙L <sup>-1</sup>NAA+60 g∙L <sup>-1</sup>蔗糖。该研究为金黄花滇百合种质资源保护和快速繁殖提供了技术支撑。
[22] 郑相穆 , 周阮宝 , 谷丽萍 , 茆敦俊 , 周嘉槐 (1995 ). 凤丹种子的休眠和萌发特性植物生理学通讯 31, 260 -262 . [本文引用: 2] [23] 周秀梅 , 成仿云 , 钟原 , 齐力旺 (2009 ). 紫斑牡丹‘书生捧墨’的体胚诱导与发生北京林业大学学报 31, 151 -154 . [本文引用: 1] [24] 朱向涛 , 王雁 , 彭镇华 , 律春燕 (2010 a). 牡丹花药诱导愈伤组织东北林业大学学报 38, 34 -36 . [本文引用: 2] [25] 朱向涛 , 王雁 , 彭镇华 , 律春燕 , 郑宝强 , 高云瑞 (2010 b). 牡丹花蕾大小对花药组培诱导率的影响湖南农业科学 (11 ), 102 -104 . [本文引用: 1] [26] Buchheim JAT Burkhart LF Meyer MM Jr 1994 ). Effect of exogenous gibberellic acid, abscisic acid, and benzylaminopurine on epicotyl dormancy of cultured herbaceous peony embryosPlant Cell Tissue Organ Cult 35 -43 . DOI:
10.1007/BF00048313 URL [本文引用: 1] [27] Roberts M Sunderland N 1977 ). Pollen culture in Paeonia John Innes Annu Rep 60 -61 . [28] Sunderland N Dunwell JM Robert M 1975 ). Anther culture in the genus Paeonia John Innes Annu Rep 57 -60 . [本文引用: 1] [29] von Arnold S Sabala I Bozhkov P Dyachok J Filonova L 2002 ). Developmental pathways of somatic embryogenesisPlant Cell Tissue Organ Cult 233 -249 . DOI:
10.1023/A:1015673200621 URL [本文引用: 1] [30] Yang Y Sun M Li SS Chen QH da Silva JAT Wang AJ Yu XN Wang LS 2020 ). Germplasm resources and genetic breeding of Paeonia : a systematic reviewHortic Res 107 . DOI:
10.1038/s41438-020-0332-2 URL [本文引用: 1] 植物单倍体育种研究进展
1
2017
... 芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”.芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 ).近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 ).然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 ).采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 ).单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 ).目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 ).其中, 花药培养是获得单倍体的一种重要方式. ...
用紫斑牡丹不同外植体诱导愈伤组织的研究
1
2001
... 目前, 植物花药培养的报道较多, 而观赏植物花药培养报道却较少.芍药属植物花药培养始于20世纪70年代(
Sunderland et al., 1975 ), 但多数研究仍停留在愈伤组织诱导阶段, 均未获得完整植株(
文书生等, 2018 ).研究表明, 牡丹花粉培养诱导得到的花粉胚可分化出根, 但无法分化出芽(Robers and Sunderland, 1977).国内以紫斑牡丹(
P. suffruticosa var.
papaveracea )(
陈怡平, 2001 )的雄蕊为外植体诱导愈伤组织未能成功;
朱向涛等(2010a ,
2010b) 研究了牡丹花蕾大小、激素和低温预处理时间对花药诱导愈伤组织的影响, 认为单核中期的花粉是诱导愈伤组织的最佳材料.目前, 关于芍药花药培养的研究报道很少.本研究以花药数量较多的芍药品种粉玉奴为材料, 开展花药愈伤组织诱导及体胚发生和植株再生研究, 初步建立了芍药花药培养与植株再生技术体系, 以期为芍药属其它品种的花药培养提供技术借鉴, 同时也为芍药单倍体育种工作奠定基础. ...
紫斑牡丹新品种选育及牡丹品种分类研究
1
1998
... 芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”.芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 ).近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 ).然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 ).采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 ).单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 ).目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 ).其中, 花药培养是获得单倍体的一种重要方式. ...
百合的花药培养研究
2
2001
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
... ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
植物激素对体细胞胚胎发生的诱导与调节
1
2000
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
黄山栾树体细胞胚的发生和组织学观察
1
2009
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
菠萝愈伤组织中体细胞胚起源过程的组织细胞学观察
1
2010
... 植物细胞离体培养形态发生包括2种途径, 即体细胞胚发生途径和器官发生途径(
李杉等, 2001 ).体细胞胚发生途径又分为直接途径和间接途径, 体细胞直接诱导形成体细胞胚然后形成再生植株的途径为直接途径, 这种情况多发生在合子胚的胚性细胞继续分裂及萌发中; 间接途径需要先诱导愈伤组织, 然后再诱导产生体细胞胚进行植株再生(
魏冬霞等, 2018 ).本研究中, 芍药花药是经过愈伤组织诱导体细胞胚再生的间接途径, 因此, 获得胚性愈伤组织是进行体细胞胚诱导再生的关键.不同物种诱导获得的胚性愈伤组织其颜色形态也不相同.香樟(
Cinnamomum camphora )胚性愈伤组织为白色, 表面散布淡黄色颗粒, 非胚性愈伤组织多为灰色、白色或深黄色(
荆茹月等, 2020 ); 唐菖蒲(
Gladiolus hybridus )中的黄白色致密愈伤组织为胚性愈伤组织, 浅黄色偏白疏松愈伤组织为非胚性愈伤组织(
吴健等, 2012 ).采用芍药茎段诱导出的淡黄色致密型、白色透明型、淡黄色松散型和淡黄色水润型4类愈伤组织中, 淡黄色水润型愈伤组织为胚性愈伤组织, 可发育到心形胚阶段(
魏冬霞等, 2018 ).通过组织细胞学观察, 发现胚性愈伤组织的细胞存在共性, 即细胞体积小, 细胞质浓、细胞核大, 液泡较少或无液泡, 具有旺盛的分裂能力.在本研究中, 我们获得了两类芍药花药愈伤组织, 即浅褐色和褐色疏松愈伤组织.经组织细胞学观察, 发现浅褐色疏松愈伤组织内部存在胚性细胞团, 具有较高的分裂活性, 可以诱导体细胞胚; 褐色愈伤组织多数由非胚性细胞组成, 在体胚诱导培养基上也能分化形成体细胞胚, 表明非胚性细胞在适宜的培养条件下可向胚性细胞转化, 这与菠萝(
Ananas comosus )愈伤组织体细胞胚起源过程相似.将菠萝的非胚性愈伤组织转入体胚诱导培养基后, 愈伤组织中会先出现一些胚性细胞, 然后单个胚性细胞分裂形成原胚(
何业华等, 2010 ). ...
芍药种子露地播种和低温贮藏过程中内源激素含量的变化
1
2006
... 植物体细胞胚胎的发育过程与合子胚的发育过程相似, 历经球形胚、心形胚、鱼雷胚、子叶胚到成熟胚.自然条件下, 芍药属植物(牡丹和芍药)的种子具有较特殊的休眠特性, 即下胚轴休眠和上胚轴休眠双重休眠(
郑相穆等, 1995 ;
金飚等, 2006 ;
张捷等, 2018 ).
郑相穆等(1995) 发现凤丹(
P. ostii )种子萌发需要经过严格有序的后熟、长根和长芽3个阶段, 种子采收后要经过40天的生理后熟过程, 胚才分化完成; 在25°C条件下, 胚根生长, 为暖温长根阶段; 在5°C条件下, 胚芽生长, 为低温春化长芽阶段.上胚轴休眠需要低温或者赤霉素处理才能打破.在芍药体细胞胚胎发育过程中, 也存在胚根和胚芽发育不同步现象, 即花药胚胎发育到子叶胚后, 继续在培养室中培养, 胚根伸长, 但是胚芽无变化, 只有放入培养箱进行4-8°C低温处理或者在培养基中添加GA
3 后, 胚芽才会长出真叶.培养基中只添加细胞分裂素和生长素, 子叶会增粗, 但未长出真叶.说明芍药体细胞胚中胚芽处于休眠状态, 打破其休眠与打破种子上胚轴休眠需要的条件一致.这与
周秀梅等(2009) 的研究结果一致, 即牡丹体胚存在上胚轴休眠现象, 在3-5°C条件下, 2个月后形成芽.在芍药花药体细胞胚的发育过程中, 多数体细胞胚遵循胚根先萌发胚芽后萌发的生长顺序, 但是也有少数体胚的胚根未萌发, 转入成苗培养基后, 胚芽萌发长出真叶, 这与种子胚的萌发有所不同.在打破芍药种子休眠的过程中发现, 只有先打破下胚轴休眠再打破上胚轴休眠, 种子才能萌发(
张捷等, 2018 ).这可能是由于在离体培养条件下, 外源激素的存在使芍药体细胞胚在胚根未生长的条件下胚芽能够继续生长. ...
香樟胚性与非胚性愈伤组织间的差异研究
1
2020
... 植物细胞离体培养形态发生包括2种途径, 即体细胞胚发生途径和器官发生途径(
李杉等, 2001 ).体细胞胚发生途径又分为直接途径和间接途径, 体细胞直接诱导形成体细胞胚然后形成再生植株的途径为直接途径, 这种情况多发生在合子胚的胚性细胞继续分裂及萌发中; 间接途径需要先诱导愈伤组织, 然后再诱导产生体细胞胚进行植株再生(
魏冬霞等, 2018 ).本研究中, 芍药花药是经过愈伤组织诱导体细胞胚再生的间接途径, 因此, 获得胚性愈伤组织是进行体细胞胚诱导再生的关键.不同物种诱导获得的胚性愈伤组织其颜色形态也不相同.香樟(
Cinnamomum camphora )胚性愈伤组织为白色, 表面散布淡黄色颗粒, 非胚性愈伤组织多为灰色、白色或深黄色(
荆茹月等, 2020 ); 唐菖蒲(
Gladiolus hybridus )中的黄白色致密愈伤组织为胚性愈伤组织, 浅黄色偏白疏松愈伤组织为非胚性愈伤组织(
吴健等, 2012 ).采用芍药茎段诱导出的淡黄色致密型、白色透明型、淡黄色松散型和淡黄色水润型4类愈伤组织中, 淡黄色水润型愈伤组织为胚性愈伤组织, 可发育到心形胚阶段(
魏冬霞等, 2018 ).通过组织细胞学观察, 发现胚性愈伤组织的细胞存在共性, 即细胞体积小, 细胞质浓、细胞核大, 液泡较少或无液泡, 具有旺盛的分裂能力.在本研究中, 我们获得了两类芍药花药愈伤组织, 即浅褐色和褐色疏松愈伤组织.经组织细胞学观察, 发现浅褐色疏松愈伤组织内部存在胚性细胞团, 具有较高的分裂活性, 可以诱导体细胞胚; 褐色愈伤组织多数由非胚性细胞组成, 在体胚诱导培养基上也能分化形成体细胞胚, 表明非胚性细胞在适宜的培养条件下可向胚性细胞转化, 这与菠萝(
Ananas comosus )愈伤组织体细胞胚起源过程相似.将菠萝的非胚性愈伤组织转入体胚诱导培养基后, 愈伤组织中会先出现一些胚性细胞, 然后单个胚性细胞分裂形成原胚(
何业华等, 2010 ). ...
栽培芍药染色体的Giemsa C-带及体细胞染色体联合的观察
1
1980
... 采用
李懋学和陈定慧(1980) 的方法进行芍药根尖细胞染色制片观察.取再生植株的根尖, 先用对氯二苯饱和水溶液在室温下处理2-3小时, 然后用蒸馏水冲洗2-3次, 再用卡诺固定液固定24小时.用0.1 mol∙L
-1 HCl在60°C水浴锅中解离8分钟, 然后用卡宝品红染色, 最后在Nikon ECLIPSE E100显微镜下观察, 并用ISH数码显微摄像系统拍照. ...
植物体细胞胚发生中ATP酶活性时空分布动态与内源激素的变化
1
2001
... 植物细胞离体培养形态发生包括2种途径, 即体细胞胚发生途径和器官发生途径(
李杉等, 2001 ).体细胞胚发生途径又分为直接途径和间接途径, 体细胞直接诱导形成体细胞胚然后形成再生植株的途径为直接途径, 这种情况多发生在合子胚的胚性细胞继续分裂及萌发中; 间接途径需要先诱导愈伤组织, 然后再诱导产生体细胞胚进行植株再生(
魏冬霞等, 2018 ).本研究中, 芍药花药是经过愈伤组织诱导体细胞胚再生的间接途径, 因此, 获得胚性愈伤组织是进行体细胞胚诱导再生的关键.不同物种诱导获得的胚性愈伤组织其颜色形态也不相同.香樟(
Cinnamomum camphora )胚性愈伤组织为白色, 表面散布淡黄色颗粒, 非胚性愈伤组织多为灰色、白色或深黄色(
荆茹月等, 2020 ); 唐菖蒲(
Gladiolus hybridus )中的黄白色致密愈伤组织为胚性愈伤组织, 浅黄色偏白疏松愈伤组织为非胚性愈伤组织(
吴健等, 2012 ).采用芍药茎段诱导出的淡黄色致密型、白色透明型、淡黄色松散型和淡黄色水润型4类愈伤组织中, 淡黄色水润型愈伤组织为胚性愈伤组织, 可发育到心形胚阶段(
魏冬霞等, 2018 ).通过组织细胞学观察, 发现胚性愈伤组织的细胞存在共性, 即细胞体积小, 细胞质浓、细胞核大, 液泡较少或无液泡, 具有旺盛的分裂能力.在本研究中, 我们获得了两类芍药花药愈伤组织, 即浅褐色和褐色疏松愈伤组织.经组织细胞学观察, 发现浅褐色疏松愈伤组织内部存在胚性细胞团, 具有较高的分裂活性, 可以诱导体细胞胚; 褐色愈伤组织多数由非胚性细胞组成, 在体胚诱导培养基上也能分化形成体细胞胚, 表明非胚性细胞在适宜的培养条件下可向胚性细胞转化, 这与菠萝(
Ananas comosus )愈伤组织体细胞胚起源过程相似.将菠萝的非胚性愈伤组织转入体胚诱导培养基后, 愈伤组织中会先出现一些胚性细胞, 然后单个胚性细胞分裂形成原胚(
何业华等, 2010 ). ...
植物单倍体育种及其在林木育种中的应用
2
2016
... 芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”.芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 ).近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 ).然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 ).采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 ).单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 ).目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 ).其中, 花药培养是获得单倍体的一种重要方式. ...
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
芍药切花优良品种筛选
1
2017
... 芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”.芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 ).近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 ).然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 ).采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 ).单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 ).目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 ).其中, 花药培养是获得单倍体的一种重要方式. ...
红掌花药培养及单倍体植株的鉴定
1
2020
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
芍药愈伤组织中体细胞胚发育过程的组织细胞学观察
2
2018
... 植物细胞离体培养形态发生包括2种途径, 即体细胞胚发生途径和器官发生途径(
李杉等, 2001 ).体细胞胚发生途径又分为直接途径和间接途径, 体细胞直接诱导形成体细胞胚然后形成再生植株的途径为直接途径, 这种情况多发生在合子胚的胚性细胞继续分裂及萌发中; 间接途径需要先诱导愈伤组织, 然后再诱导产生体细胞胚进行植株再生(
魏冬霞等, 2018 ).本研究中, 芍药花药是经过愈伤组织诱导体细胞胚再生的间接途径, 因此, 获得胚性愈伤组织是进行体细胞胚诱导再生的关键.不同物种诱导获得的胚性愈伤组织其颜色形态也不相同.香樟(
Cinnamomum camphora )胚性愈伤组织为白色, 表面散布淡黄色颗粒, 非胚性愈伤组织多为灰色、白色或深黄色(
荆茹月等, 2020 ); 唐菖蒲(
Gladiolus hybridus )中的黄白色致密愈伤组织为胚性愈伤组织, 浅黄色偏白疏松愈伤组织为非胚性愈伤组织(
吴健等, 2012 ).采用芍药茎段诱导出的淡黄色致密型、白色透明型、淡黄色松散型和淡黄色水润型4类愈伤组织中, 淡黄色水润型愈伤组织为胚性愈伤组织, 可发育到心形胚阶段(
魏冬霞等, 2018 ).通过组织细胞学观察, 发现胚性愈伤组织的细胞存在共性, 即细胞体积小, 细胞质浓、细胞核大, 液泡较少或无液泡, 具有旺盛的分裂能力.在本研究中, 我们获得了两类芍药花药愈伤组织, 即浅褐色和褐色疏松愈伤组织.经组织细胞学观察, 发现浅褐色疏松愈伤组织内部存在胚性细胞团, 具有较高的分裂活性, 可以诱导体细胞胚; 褐色愈伤组织多数由非胚性细胞组成, 在体胚诱导培养基上也能分化形成体细胞胚, 表明非胚性细胞在适宜的培养条件下可向胚性细胞转化, 这与菠萝(
Ananas comosus )愈伤组织体细胞胚起源过程相似.将菠萝的非胚性愈伤组织转入体胚诱导培养基后, 愈伤组织中会先出现一些胚性细胞, 然后单个胚性细胞分裂形成原胚(
何业华等, 2010 ). ...
... ).采用芍药茎段诱导出的淡黄色致密型、白色透明型、淡黄色松散型和淡黄色水润型4类愈伤组织中, 淡黄色水润型愈伤组织为胚性愈伤组织, 可发育到心形胚阶段(
魏冬霞等, 2018 ).通过组织细胞学观察, 发现胚性愈伤组织的细胞存在共性, 即细胞体积小, 细胞质浓、细胞核大, 液泡较少或无液泡, 具有旺盛的分裂能力.在本研究中, 我们获得了两类芍药花药愈伤组织, 即浅褐色和褐色疏松愈伤组织.经组织细胞学观察, 发现浅褐色疏松愈伤组织内部存在胚性细胞团, 具有较高的分裂活性, 可以诱导体细胞胚; 褐色愈伤组织多数由非胚性细胞组成, 在体胚诱导培养基上也能分化形成体细胞胚, 表明非胚性细胞在适宜的培养条件下可向胚性细胞转化, 这与菠萝(
Ananas comosus )愈伤组织体细胞胚起源过程相似.将菠萝的非胚性愈伤组织转入体胚诱导培养基后, 愈伤组织中会先出现一些胚性细胞, 然后单个胚性细胞分裂形成原胚(
何业华等, 2010 ). ...
牡丹组织培养技术研究进展
1
2018
... 目前, 植物花药培养的报道较多, 而观赏植物花药培养报道却较少.芍药属植物花药培养始于20世纪70年代(
Sunderland et al., 1975 ), 但多数研究仍停留在愈伤组织诱导阶段, 均未获得完整植株(
文书生等, 2018 ).研究表明, 牡丹花粉培养诱导得到的花粉胚可分化出根, 但无法分化出芽(Robers and Sunderland, 1977).国内以紫斑牡丹(
P. suffruticosa var.
papaveracea )(
陈怡平, 2001 )的雄蕊为外植体诱导愈伤组织未能成功;
朱向涛等(2010a ,
2010b) 研究了牡丹花蕾大小、激素和低温预处理时间对花药诱导愈伤组织的影响, 认为单核中期的花粉是诱导愈伤组织的最佳材料.目前, 关于芍药花药培养的研究报道很少.本研究以花药数量较多的芍药品种粉玉奴为材料, 开展花药愈伤组织诱导及体胚发生和植株再生研究, 初步建立了芍药花药培养与植株再生技术体系, 以期为芍药属其它品种的花药培养提供技术借鉴, 同时也为芍药单倍体育种工作奠定基础. ...
唐菖蒲体细胞胚起源、发育的形态与组织细胞学观察
1
2012
... 植物细胞离体培养形态发生包括2种途径, 即体细胞胚发生途径和器官发生途径(
李杉等, 2001 ).体细胞胚发生途径又分为直接途径和间接途径, 体细胞直接诱导形成体细胞胚然后形成再生植株的途径为直接途径, 这种情况多发生在合子胚的胚性细胞继续分裂及萌发中; 间接途径需要先诱导愈伤组织, 然后再诱导产生体细胞胚进行植株再生(
魏冬霞等, 2018 ).本研究中, 芍药花药是经过愈伤组织诱导体细胞胚再生的间接途径, 因此, 获得胚性愈伤组织是进行体细胞胚诱导再生的关键.不同物种诱导获得的胚性愈伤组织其颜色形态也不相同.香樟(
Cinnamomum camphora )胚性愈伤组织为白色, 表面散布淡黄色颗粒, 非胚性愈伤组织多为灰色、白色或深黄色(
荆茹月等, 2020 ); 唐菖蒲(
Gladiolus hybridus )中的黄白色致密愈伤组织为胚性愈伤组织, 浅黄色偏白疏松愈伤组织为非胚性愈伤组织(
吴健等, 2012 ).采用芍药茎段诱导出的淡黄色致密型、白色透明型、淡黄色松散型和淡黄色水润型4类愈伤组织中, 淡黄色水润型愈伤组织为胚性愈伤组织, 可发育到心形胚阶段(
魏冬霞等, 2018 ).通过组织细胞学观察, 发现胚性愈伤组织的细胞存在共性, 即细胞体积小, 细胞质浓、细胞核大, 液泡较少或无液泡, 具有旺盛的分裂能力.在本研究中, 我们获得了两类芍药花药愈伤组织, 即浅褐色和褐色疏松愈伤组织.经组织细胞学观察, 发现浅褐色疏松愈伤组织内部存在胚性细胞团, 具有较高的分裂活性, 可以诱导体细胞胚; 褐色愈伤组织多数由非胚性细胞组成, 在体胚诱导培养基上也能分化形成体细胞胚, 表明非胚性细胞在适宜的培养条件下可向胚性细胞转化, 这与菠萝(
Ananas comosus )愈伤组织体细胞胚起源过程相似.将菠萝的非胚性愈伤组织转入体胚诱导培养基后, 愈伤组织中会先出现一些胚性细胞, 然后单个胚性细胞分裂形成原胚(
何业华等, 2010 ). ...
中国芍药花文化研究
1
2011
... 芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”.芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 ).近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 ).然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 ).采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 ).单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 ).目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 ).其中, 花药培养是获得单倍体的一种重要方式. ...
芍药根茎解剖结构特征及生长轮分析
1
2020
... 芍药品种粉玉奴为二倍体植物, 染色体数目为2
n = 2
x =10 (
张建军等, 2020 ).对12株花药再生植株进行根尖细胞染色体观察, 在根尖细胞分裂相的8株花药再生植株中, 有3株植株的根尖分别观察到6、6和7个细胞中期分裂相, 均有5条染色体(
图4A ), 为单倍体植株; 有4株植株的根尖分别观察到6、8、12和7个细胞中期分裂相, 均有10条染色体(
图4B ), 为二倍体植株; 1株植株仅观察到3个细胞中期分裂相, 分别有7条、8条和8条染色体(
图4C ), 为非整倍体植株.此外, 还观察到在根尖细胞有丝分裂后期, 存在染色体不对称分裂现象(
图4D ).未观察到分裂期细胞的植株有4株. ...
芍药播种繁殖中种子破眠技术的研究进展
2
2018
... 植物体细胞胚胎的发育过程与合子胚的发育过程相似, 历经球形胚、心形胚、鱼雷胚、子叶胚到成熟胚.自然条件下, 芍药属植物(牡丹和芍药)的种子具有较特殊的休眠特性, 即下胚轴休眠和上胚轴休眠双重休眠(
郑相穆等, 1995 ;
金飚等, 2006 ;
张捷等, 2018 ).
郑相穆等(1995) 发现凤丹(
P. ostii )种子萌发需要经过严格有序的后熟、长根和长芽3个阶段, 种子采收后要经过40天的生理后熟过程, 胚才分化完成; 在25°C条件下, 胚根生长, 为暖温长根阶段; 在5°C条件下, 胚芽生长, 为低温春化长芽阶段.上胚轴休眠需要低温或者赤霉素处理才能打破.在芍药体细胞胚胎发育过程中, 也存在胚根和胚芽发育不同步现象, 即花药胚胎发育到子叶胚后, 继续在培养室中培养, 胚根伸长, 但是胚芽无变化, 只有放入培养箱进行4-8°C低温处理或者在培养基中添加GA
3 后, 胚芽才会长出真叶.培养基中只添加细胞分裂素和生长素, 子叶会增粗, 但未长出真叶.说明芍药体细胞胚中胚芽处于休眠状态, 打破其休眠与打破种子上胚轴休眠需要的条件一致.这与
周秀梅等(2009) 的研究结果一致, 即牡丹体胚存在上胚轴休眠现象, 在3-5°C条件下, 2个月后形成芽.在芍药花药体细胞胚的发育过程中, 多数体细胞胚遵循胚根先萌发胚芽后萌发的生长顺序, 但是也有少数体胚的胚根未萌发, 转入成苗培养基后, 胚芽萌发长出真叶, 这与种子胚的萌发有所不同.在打破芍药种子休眠的过程中发现, 只有先打破下胚轴休眠再打破上胚轴休眠, 种子才能萌发(
张捷等, 2018 ).这可能是由于在离体培养条件下, 外源激素的存在使芍药体细胞胚在胚根未生长的条件下胚芽能够继续生长. ...
... 的研究结果一致, 即牡丹体胚存在上胚轴休眠现象, 在3-5°C条件下, 2个月后形成芽.在芍药花药体细胞胚的发育过程中, 多数体细胞胚遵循胚根先萌发胚芽后萌发的生长顺序, 但是也有少数体胚的胚根未萌发, 转入成苗培养基后, 胚芽萌发长出真叶, 这与种子胚的萌发有所不同.在打破芍药种子休眠的过程中发现, 只有先打破下胚轴休眠再打破上胚轴休眠, 种子才能萌发(
张捷等, 2018 ).这可能是由于在离体培养条件下, 外源激素的存在使芍药体细胞胚在胚根未生长的条件下胚芽能够继续生长. ...
金黄花滇百合植株再生与离体快繁技术体系的建立
1
2019
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
凤丹种子的休眠和萌发特性
2
1995
... 植物体细胞胚胎的发育过程与合子胚的发育过程相似, 历经球形胚、心形胚、鱼雷胚、子叶胚到成熟胚.自然条件下, 芍药属植物(牡丹和芍药)的种子具有较特殊的休眠特性, 即下胚轴休眠和上胚轴休眠双重休眠(
郑相穆等, 1995 ;
金飚等, 2006 ;
张捷等, 2018 ).
郑相穆等(1995) 发现凤丹(
P. ostii )种子萌发需要经过严格有序的后熟、长根和长芽3个阶段, 种子采收后要经过40天的生理后熟过程, 胚才分化完成; 在25°C条件下, 胚根生长, 为暖温长根阶段; 在5°C条件下, 胚芽生长, 为低温春化长芽阶段.上胚轴休眠需要低温或者赤霉素处理才能打破.在芍药体细胞胚胎发育过程中, 也存在胚根和胚芽发育不同步现象, 即花药胚胎发育到子叶胚后, 继续在培养室中培养, 胚根伸长, 但是胚芽无变化, 只有放入培养箱进行4-8°C低温处理或者在培养基中添加GA
3 后, 胚芽才会长出真叶.培养基中只添加细胞分裂素和生长素, 子叶会增粗, 但未长出真叶.说明芍药体细胞胚中胚芽处于休眠状态, 打破其休眠与打破种子上胚轴休眠需要的条件一致.这与
周秀梅等(2009) 的研究结果一致, 即牡丹体胚存在上胚轴休眠现象, 在3-5°C条件下, 2个月后形成芽.在芍药花药体细胞胚的发育过程中, 多数体细胞胚遵循胚根先萌发胚芽后萌发的生长顺序, 但是也有少数体胚的胚根未萌发, 转入成苗培养基后, 胚芽萌发长出真叶, 这与种子胚的萌发有所不同.在打破芍药种子休眠的过程中发现, 只有先打破下胚轴休眠再打破上胚轴休眠, 种子才能萌发(
张捷等, 2018 ).这可能是由于在离体培养条件下, 外源激素的存在使芍药体细胞胚在胚根未生长的条件下胚芽能够继续生长. ...
... ).
郑相穆等(1995) 发现凤丹(
P. ostii )种子萌发需要经过严格有序的后熟、长根和长芽3个阶段, 种子采收后要经过40天的生理后熟过程, 胚才分化完成; 在25°C条件下, 胚根生长, 为暖温长根阶段; 在5°C条件下, 胚芽生长, 为低温春化长芽阶段.上胚轴休眠需要低温或者赤霉素处理才能打破.在芍药体细胞胚胎发育过程中, 也存在胚根和胚芽发育不同步现象, 即花药胚胎发育到子叶胚后, 继续在培养室中培养, 胚根伸长, 但是胚芽无变化, 只有放入培养箱进行4-8°C低温处理或者在培养基中添加GA
3 后, 胚芽才会长出真叶.培养基中只添加细胞分裂素和生长素, 子叶会增粗, 但未长出真叶.说明芍药体细胞胚中胚芽处于休眠状态, 打破其休眠与打破种子上胚轴休眠需要的条件一致.这与
周秀梅等(2009) 的研究结果一致, 即牡丹体胚存在上胚轴休眠现象, 在3-5°C条件下, 2个月后形成芽.在芍药花药体细胞胚的发育过程中, 多数体细胞胚遵循胚根先萌发胚芽后萌发的生长顺序, 但是也有少数体胚的胚根未萌发, 转入成苗培养基后, 胚芽萌发长出真叶, 这与种子胚的萌发有所不同.在打破芍药种子休眠的过程中发现, 只有先打破下胚轴休眠再打破上胚轴休眠, 种子才能萌发(
张捷等, 2018 ).这可能是由于在离体培养条件下, 外源激素的存在使芍药体细胞胚在胚根未生长的条件下胚芽能够继续生长. ...
紫斑牡丹‘书生捧墨’的体胚诱导与发生
1
2009
... 植物体细胞胚胎的发育过程与合子胚的发育过程相似, 历经球形胚、心形胚、鱼雷胚、子叶胚到成熟胚.自然条件下, 芍药属植物(牡丹和芍药)的种子具有较特殊的休眠特性, 即下胚轴休眠和上胚轴休眠双重休眠(
郑相穆等, 1995 ;
金飚等, 2006 ;
张捷等, 2018 ).
郑相穆等(1995) 发现凤丹(
P. ostii )种子萌发需要经过严格有序的后熟、长根和长芽3个阶段, 种子采收后要经过40天的生理后熟过程, 胚才分化完成; 在25°C条件下, 胚根生长, 为暖温长根阶段; 在5°C条件下, 胚芽生长, 为低温春化长芽阶段.上胚轴休眠需要低温或者赤霉素处理才能打破.在芍药体细胞胚胎发育过程中, 也存在胚根和胚芽发育不同步现象, 即花药胚胎发育到子叶胚后, 继续在培养室中培养, 胚根伸长, 但是胚芽无变化, 只有放入培养箱进行4-8°C低温处理或者在培养基中添加GA
3 后, 胚芽才会长出真叶.培养基中只添加细胞分裂素和生长素, 子叶会增粗, 但未长出真叶.说明芍药体细胞胚中胚芽处于休眠状态, 打破其休眠与打破种子上胚轴休眠需要的条件一致.这与
周秀梅等(2009) 的研究结果一致, 即牡丹体胚存在上胚轴休眠现象, 在3-5°C条件下, 2个月后形成芽.在芍药花药体细胞胚的发育过程中, 多数体细胞胚遵循胚根先萌发胚芽后萌发的生长顺序, 但是也有少数体胚的胚根未萌发, 转入成苗培养基后, 胚芽萌发长出真叶, 这与种子胚的萌发有所不同.在打破芍药种子休眠的过程中发现, 只有先打破下胚轴休眠再打破上胚轴休眠, 种子才能萌发(
张捷等, 2018 ).这可能是由于在离体培养条件下, 外源激素的存在使芍药体细胞胚在胚根未生长的条件下胚芽能够继续生长. ...
牡丹花药诱导愈伤组织
2
2010
... 目前, 植物花药培养的报道较多, 而观赏植物花药培养报道却较少.芍药属植物花药培养始于20世纪70年代(
Sunderland et al., 1975 ), 但多数研究仍停留在愈伤组织诱导阶段, 均未获得完整植株(
文书生等, 2018 ).研究表明, 牡丹花粉培养诱导得到的花粉胚可分化出根, 但无法分化出芽(Robers and Sunderland, 1977).国内以紫斑牡丹(
P. suffruticosa var.
papaveracea )(
陈怡平, 2001 )的雄蕊为外植体诱导愈伤组织未能成功;
朱向涛等(2010a ,
2010b) 研究了牡丹花蕾大小、激素和低温预处理时间对花药诱导愈伤组织的影响, 认为单核中期的花粉是诱导愈伤组织的最佳材料.目前, 关于芍药花药培养的研究报道很少.本研究以花药数量较多的芍药品种粉玉奴为材料, 开展花药愈伤组织诱导及体胚发生和植株再生研究, 初步建立了芍药花药培养与植株再生技术体系, 以期为芍药属其它品种的花药培养提供技术借鉴, 同时也为芍药单倍体育种工作奠定基础. ...
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
牡丹花蕾大小对花药组培诱导率的影响
1
2010
... 目前, 植物花药培养的报道较多, 而观赏植物花药培养报道却较少.芍药属植物花药培养始于20世纪70年代(
Sunderland et al., 1975 ), 但多数研究仍停留在愈伤组织诱导阶段, 均未获得完整植株(
文书生等, 2018 ).研究表明, 牡丹花粉培养诱导得到的花粉胚可分化出根, 但无法分化出芽(Robers and Sunderland, 1977).国内以紫斑牡丹(
P. suffruticosa var.
papaveracea )(
陈怡平, 2001 )的雄蕊为外植体诱导愈伤组织未能成功;
朱向涛等(2010a ,
2010b) 研究了牡丹花蕾大小、激素和低温预处理时间对花药诱导愈伤组织的影响, 认为单核中期的花粉是诱导愈伤组织的最佳材料.目前, 关于芍药花药培养的研究报道很少.本研究以花药数量较多的芍药品种粉玉奴为材料, 开展花药愈伤组织诱导及体胚发生和植株再生研究, 初步建立了芍药花药培养与植株再生技术体系, 以期为芍药属其它品种的花药培养提供技术借鉴, 同时也为芍药单倍体育种工作奠定基础. ...
Effect of exogenous gibberellic acid, abscisic acid, and benzylaminopurine on epicotyl dormancy of cultured herbaceous peony embryos
1
1994
... 芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”.芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 ).近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 ).然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 ).采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 ).单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 ).目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 ).其中, 花药培养是获得单倍体的一种重要方式. ...
Pollen culture in
Paeonia 0
1977
Anther culture in the genus
Paeonia 1
1975
... 目前, 植物花药培养的报道较多, 而观赏植物花药培养报道却较少.芍药属植物花药培养始于20世纪70年代(
Sunderland et al., 1975 ), 但多数研究仍停留在愈伤组织诱导阶段, 均未获得完整植株(
文书生等, 2018 ).研究表明, 牡丹花粉培养诱导得到的花粉胚可分化出根, 但无法分化出芽(Robers and Sunderland, 1977).国内以紫斑牡丹(
P. suffruticosa var.
papaveracea )(
陈怡平, 2001 )的雄蕊为外植体诱导愈伤组织未能成功;
朱向涛等(2010a ,
2010b) 研究了牡丹花蕾大小、激素和低温预处理时间对花药诱导愈伤组织的影响, 认为单核中期的花粉是诱导愈伤组织的最佳材料.目前, 关于芍药花药培养的研究报道很少.本研究以花药数量较多的芍药品种粉玉奴为材料, 开展花药愈伤组织诱导及体胚发生和植株再生研究, 初步建立了芍药花药培养与植株再生技术体系, 以期为芍药属其它品种的花药培养提供技术借鉴, 同时也为芍药单倍体育种工作奠定基础. ...
Developmental pathways of somatic embryogenesis
1
2002
... 植物花药离体培养存在愈伤组织诱导分化难的问题.愈伤组织培养初期, 一定浓度的生长素类物质是诱导脱分化、愈伤组织生长及胚性细胞形成的必要条件.2,4-D是诱导胚性愈伤组织的重要激素(
崔凯荣等, 2000 ;
张文婷等, 2019 ), 但其也是导致遗传和表观遗传变异的原因之一(
von Arnold et al., 2002 ); 同时, 2,4-D还会影响愈伤组织的分化能力.牡丹花药愈伤组织的诱导频率随着2,4-D质量浓度的增加而升高, 但是产生的愈伤组织分化能力却显著降低(
朱向涛等, 2010a ).也有研究表明, 2,4-D在体胚诱导中的作用具有阶段性, 即在诱导胚性愈伤组织阶段均须添加, 而在胚性愈伤组织向体细胞胚和成熟植株发育时, 不需要添加2,4-D (
冯大领等, 2009 ).本研究中, 仅在愈伤组织诱导阶段添加不同浓度的2,4-D, 在体胚诱导及成苗培养基中均未添加.研究发现, 2,4-D不仅影响花药愈伤组织诱导率, 同时对愈伤组织的体胚及成苗诱导也有影响.随着2,4-D浓度的增加, 体胚诱导率和成苗率均降低, 这与百合(
Lilium brownii var.
viridulum )花药培养相似.百合花药愈伤组织的分化能力受诱导培养基中2,4-D浓度的影响, 2,4-D浓度升高导致愈伤组织的分化能力降低(
褚云霞等, 2001 ).花药离体培养时, 花药壁、药隔和花丝等体细胞愈伤组织和花粉愈伤组织可能同时存在.单倍体愈伤组织在植株再生过程中染色体自发加倍, 从而发育成双单倍体植株, 因此花药植株存在倍性混乱、多倍体植株来源不明等问题(
李允菲等, 2016 ).红掌(
Anthurium andraeanum )花药培养获得再生植株后, 采用流式细胞仪检测13株再生植株的倍性, 结果表明, 其中单倍体植株8株, 二倍体植株5株(
田丹青等, 2020 ).百合花粉植株经根尖压片观察, 发现单倍体约占25%, 二倍体约占75% (
褚云霞等, 2001 ).本研究获得的芍药花药植株同样存在倍性复杂的情况.对再生植株进行根尖细胞染色体鉴定, 发现12株植株中, 有3株是单倍体, 说明其来源于花粉细胞; 二倍体有4株, 其来源可能是体细胞转化, 也可能是花药异常减数分裂直接形成的二倍体花粉, 或者愈伤组织细胞分裂过程中染色体自然加倍, 需要采用SSR标记分析确定再生植株的纯合性. ...
Germplasm resources and genetic breeding of
Paeonia : a systematic review
1
2020
... 芍药(
Paeonia lactiflora )是芍药科(Paeoniaceae) 芍药属(
Paeonia )多年生宿根草本植物, 与同属的牡丹(
P. suffruticosa )并称为“花王”和“花相”.芍药在我国有3 000多年的栽培历史, 其名最早来源于《诗经》, “维士与女, 伊其相谑, 赠之以芍药”, 自古以来就被视为情花用于男女互赠(
苑庆磊, 2011 ).近年来, 芍药作为一类新型切花越来越受欢迎, 形成了包括中国、荷兰、北美和新西兰在内的几个主要切花生产区(
Yang et al., 2020 ).然而, 我国芍药切花产业还处于起步阶段, 切花专用型自主品种较少, 对外依赖程度较高, 已经成为制约我国芍药产业发展的主要问题(
卢洁等, 2017 ).采用传统育种方法培育芍药新品种需要10年以上(
Buchheim et al., 1994 ;
成仿云和陈德忠, 1998 ).单倍体育种是一种缩短育种周期的重要方法, 通常杂交育种需要5-6代才能获得稳定的品系, 而单倍体育种只需2-3年; 同时, 由于单倍体植株只有1套染色体组, 不存在基因显隐性关系, 很多优良隐性性状能够得以表现, 因此可丰富育种材料的性状选择, 也是开展遗传学、基因学和生理学研究的理想材料(
李允菲等, 2016 ).目前, 获得单倍体的方法主要有2种, 一是自然条件下发生的孤雌生殖; 二是植物单倍体组织离体培养, 包括雄配子体(花粉和花药)离体培养和未受精的雌核(未受精的子房和胚珠等)离体培养(
卜华虎等, 2017 ).其中, 花药培养是获得单倍体的一种重要方式. ...
 ,*河南省农业科学院园艺研究所, 郑州 450002
,*河南省农业科学院园艺研究所, 郑州 450002 ,*Horticultural Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China
,*Horticultural Research Institute, Henan Academy of Agricultural Sciences, Zhengzhou 450002, China

 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT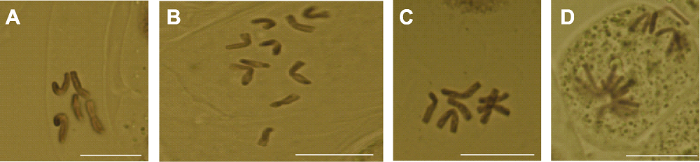 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT
