 ,1,*
,1,*The Establishment and Optimization of a Regeneration System for Marigold (Tagetes erecta)
Yaqin Wang1,2, Ludan Wei1, Wenjing Wang1, Baojun Liu1, Chunling Zhang1, Junwei Zhang1, Yanhong He ,1,*
,1,*通讯作者: *E-mail:hyh2010@mail.hzau.edu.cn
责任编辑: 孙冬花
收稿日期:2020-04-16接受日期:2020-08-26网络出版日期:2020-11-01
| 基金资助: |
Corresponding authors: *E-mail:hyh2010@mail.hzau.edu.cn
Received:2020-04-16Accepted:2020-08-26Online:2020-11-01

摘要
以40个不同基因型万寿菊(Tagetes erecta)叶片为外植体, 在相同条件下诱导不定芽分化, 获得最佳再生基因型; 然后分析不同激素组合、外植体切口方式、固化剂及蔗糖对万寿菊再生和玻璃化影响; 最后对不同类型的伸长培养基进行探索。结果表明, 最佳再生基因型为里程碑·黄色; 最佳再生培养基为MS+0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA+8 g·L?1琼脂+40 g·L?1蔗糖, 再生率达70%, 玻璃化率降低至16%; 最适再生的小叶部位为全小叶; 最适伸长培养基为MS+8 g·L?1琼脂+30 g·L?1蔗糖, 伸长率达91.3%。该研究建立了高效稳定的万寿菊再生体系, 解决了万寿菊再生过程中严重的玻璃化问题, 可为万寿菊的遗传改良和基因功能研究奠定基础。
关键词:
Abstract
In this study, marigold (Tagetes erecta) leaves of 40 different genotypes were used as explants to induce adventitious buds formation to select the best regenerating genotype. In addition, main factors impacting the selected genotype’s regeneration and vitrification were analyzed, including hormone combinations, the way of explant incision, curing agent and sucrose, etc. Finally, different types of elongation medium were explored. The best regenerated genotype was marigold Milestone·Yellow. The best regeneration medium was MS media supplied with 0.2 mg·L?1 TDZ, 0.5 mg·L?1 IBA, 8 g·L?1 agar, and 40 g·L?1 sucrose, in which the regeneration rate was 70% and the vitrification rate was reduced to 16%. Whole leaflet was the most suitable explant among different leaflet segments; the best performing elongation medium was MS media supplied with 8 g·L?1 agar and 30 g·L?1 sucrose, and the elongation rate was 91.3%. This study establishes an efficient and stable regeneration system of marigold, and solved the serious vitrification problem commonly found during regeneration. It laid a foundation for marigold genetic improvement and gene function research.
Keywords:
PDF (1624KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
王亚琴, 韦陆丹, 王文静, 刘宝骏, 张春玲, 张俊卫, 何燕红. 万寿菊再生体系的建立及优化. 植物学报, 2020, 55(6): 749-759 doi:10.11983/CBB20062
Wang Yaqin, Wei Ludan, Wang Wenjing, Liu Baojun, Zhang Chunling, Zhang Junwei, He Yanhong.
万寿菊(Tagetes erecta)为菊科(Asteraceae)万寿菊属一年生草本植物。其花色艳丽, 花期长, 园林应用广泛, 观赏品种丰富。万寿菊花瓣富含叶黄素, 具有重要的观赏和经济价值(Vasudevan et al., 1997; Bosma et al., 2003)。目前, 万寿菊最主要的育种方法仍是杂交优势育种, 而基因工程可定向改良万寿菊性状, 弥补传统方法的不足, 极大地缩短育种周期。但建立一个高效稳定的再生体系是实现遗传改良的前提(侯文胜等, 2002)。万寿菊属于再生较困难的植物, 其再生效率在很大程度上受基因型、外植体类型和激素组合的影响。目前的研究则多集中在植物激素和外植体类型等方面。
前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (Bespalhok and Hattori, 1998; Espinoza et al., 2017; Kumar et al., 2018)。而直接诱导不定芽的再生效率显著提高。例如, Vanegas等(2002)发现, 叶片在3 mg·L?1 IAA+3 mg·L?1 6-BA的MS培养基上, 再生率达69.4%; Gupta和Rahman (2015)研究发现, 1.5 mg·L?1 6-BA与5.0 mg·L?1 GA3的激素组合最适于下胚轴再生, 再生率为66.6%; Nuoendagula等(2017)发现, 万寿菊叶片在含有3 mg·L?1 IAA+3-5 mg·L?1 6-BA的培养基上, 再生率介于70%-75%之间; 赵子刚等(2010)以色素万寿菊叶片为外植体, 发现其在含有3 mg·L?1 IAA+3 mg·L?1 6-BA+30 g·L?1蔗糖+6 g·L?1植物凝胶的MS培养基上的不定芽分化率达97.5%, 并且玻璃化现象出现较晚。
研究表明, 由于多数万寿菊的基因型不明, 所用激素组合也局限在6-BA+IAA、6-BA+NAA和6-BA+ GA3三种, 尤其是高浓度6-BA的使用会影响遗传转化效率(Nuoendagula et al., 2017)。此外, 万寿菊再生不定芽的玻璃化问题, 目前也未有很好的处理方法。为解决万寿菊再生难、基因型不明确、6-BA使用浓度高和再生芽玻璃化严重等问题, 我们以40个不同基因型的万寿菊叶片为外植体, 筛选再生效果最好的基因型, 并探索了不同激素组合、外植体切口方式、固化剂和蔗糖对万寿菊再生的影响, 成功优化了万寿菊再生体系, 可为其遗传改良奠定基础。
1 植物材料
实验室培育的万寿菊(Tagetes erecta L.)自交系及商业购买的F1杂交种, 共计40个基因型(表1)。Table 1
表1
表1不同万寿菊基因型的再生效率(平均值±标准差)
Table 1
| No. | Genotype | Phenotype | Regeneration rate (%) | Source | Regeneration type | ||
|---|---|---|---|---|---|---|---|
| 1 | Perfect·Golden | Short-height plant, yellow-oran- ge color, double petal | 54.21±12.11 a | Chunhe Gardening (F1) | Easy | ||
| 2 | Milestone·Yellow | Short-height plant, yellow color, double petal | 51.44±8.29 ab | Sainuo Gardening (F1) | Easy | ||
| 3 | Proud·Orange-yellow | Short-height plant, yellow-oran- ge color, double petal | 41.47±6.12 abc | Dannuo Gardening (F1) | Moderate | ||
| 4 | Chrysanthemum marigold·Orange | Short-height plant, orange color, double petal | 36.23±11.95 abcd | Huaxianzi Gardening (F1) | Moderate | ||
| 5 | Xunlei·Yellow | Short-height plant, yellow color, double petal | 33.48±13.73 abcde | Chunhe Gardening (F1) | Moderate | ||
| 6 | Galore·Yellow | Medium-height plant, yellow co- lor, double petal | 31.95±18.22 abcdef | Hongyue Gardening (F1) | Moderate | ||
| 7 | Proud·Golden | Short-height plant, yellow-oran- ge color, double petal | 30.50±10.33 abcdef | Dannuo Gardening (F1) | Moderate | ||
| 8 | Double marigold· Light beige | Medium-height plant, yellow color, double petal | 22.01±14.56 bcdefg | Jinqiu Gardening (F1) | Difficult | ||
| 9 | DC | Short-height plant, orange color, double petal | 21.33±13.66 cdefgh | Self breeding (inbred line) * | Difficult | ||
| 10 | Youyi·Yellow | Short-height plant, yellow color, double petal | 18.00±1.83 cdefgh | Chunhe Gardening (F1) | Difficult | ||
| 11 | Miracle·Yellow | Short-height plant, yellow color, double petal | 13.29±9.62 cdefghi | Huaxianzi Gardening (F1) | Difficult | ||
| 12 | Old Inka·Orange | Medium-height plant, orange co- lor, double petal | 13.24±10.50 defghij | Hongyue Gardening (F1) | Difficult | ||
| 13 | Liberty·Yellow | Short-height plant, yellow color, double petal | 12.95±8.82 defghij | Huaxianzi Gardening (F1) | Difficult | ||
| 14 | 6210 | Medium-height plant, yellow-oran- ge color, double petal | 10.00±11.08 fghij | Self breeding (inbred line) * | Difficult | ||
| 15 | F8 | Medium-height plant, orange co- lor, simple petal | 9.33±5.96 efghij | Self breeding (inbred line) * | Difficult | ||
| No. | Genotype | Phenotype | Regeneration rate (%) | Source | Regeneration type | ||
| 16 | Fengsheng·Orange | Short-height plant, yellow-orange color, double petal | 7.11±7.70 ghij | Shijie seed (F1) | Difficult | ||
| 17 | AJ | Short-height plant, yellow-orange color, double petal | 7.02±13.41 ghij | Self breeding (inbred line) * | Difficult | ||
| 18 | Inka·Orange-yellow | Short-height plant, yellow-orange color, double petal | 5.11±7.87 ghij | Chunhe Gardening (F1) | Difficult | ||
| 19 | S3 | Medium-height plant, yellow color, simple petal | 4.92±2.75 ghij | Self breeding (inbred line) * | Difficult | ||
| 20 | S12 | Short-height plant, yellow color, simple petal | 4.67±10.43 hij | Self breeding (inbred line) * | Difficult | ||
| 21 | S5 | Short-height plant, yellow-orange color, simple petal | 4.67±5.06 ghij | Self breeding (inbred line) * | Difficult | ||
| 22 | SW2 | Medium-height plant, yellow color, double petal | 4.67±10.43 hij | Self breeding (inbred line) * | Difficult | ||
| 23 | Hawaii | Medium-height plant, yellow-oran- ge color, double petal | 4.22±5.87 ghij | Thailand (F1) | Difficult | ||
| 24 | 6170 | Medium-height plant, yellow-oran- ge color, double petal | 2.89±1.62 ghij | Self breeding (inbred line) * | Difficult | ||
| 25 | Jindun·Yellow | Short-height plant, yellow color, double petal | 2.71±4.36 hij | Sainuo Gardening (F1) | Difficult | ||
| 26 | GFR | Medium-height plant, orange color, double petal | 1.92±1.75 hij | Self breeding (inbred line) * | Difficult | ||
| 27 | DH | Short-height plant, yellow color, double petal | 1.33±1.83 ij | Self breeding (inbred line) * | Difficult | ||
| 28 | Vanilla | Medium-height plant, yellow-w- hite color, double petal | 0.91±2.03 ij | Thailand (F1) | Unable | ||
| 29 | Double Chrysanthe- mum marigold·Orange | Short-height plant, yellow-oran- ge color, double petal | 0.71±1.60 ij | Jinqiu Gardening (F1) | Unable | ||
| 30 | 6155 | Medium-height plant, yellow color, double petal | 0.00±0.00 j | Self breeding (inbred line) * | Unable | ||
| 31 | 9905 | Medium-height plant, yellow-oran- ge color, double petal | 0.00±0.00 j | Self breeding (inbred line) * | Unable | ||
| 32 | Antigua·Orange | Short-height plant, yellow-orange color, double petal | 0.00±0.00 j | Huaxianzi Gardening (F1) | Unable | ||
| 33 | Discovery·Orange | Short-height plant, orange color, double petal | 0.00±0.00 j | Sainuo Gardening (F1) | Unable | ||
| 34 | Double cut flower marigold·Lemon | Tall-height plant, yellow color, double petal | 0.00±0.00 j | Jinqiu Gardening (F1) | Unable | ||
| 35 | Double marigold·Golden | Medium-height plant, yellow color, double petal | 0.00±0.00 j | Jinqiu Gardening (F1) | Unable | ||
| 36 | Marigold·Deep orange | Tall-height plant, orange color, double petal | 0.00±0.00 j | Jinqiu Gardening (F1) | Unable | ||
| 37 | MB | Short-height plant, yellow color, double petal | 0.00±0.00 j | Self breeding (inbred line) * | Unable | ||
| 38 | New Fengsheng·Yellow | Short-height plant, yellow color, double petal | 0.00±0.00 j | Sainuo Gardening (F1) | Unable | ||
| 39 | S13 | Medium-height plant, yellow color, double petal | 0.00±0.00 j | Self breeding (inbred line) * | Unable | ||
| 40 | Yingtai·Golden | Medium-height plant, yellow color, double petal | 0.00±0.00 j | Shijie seed (F1) | Unable | ||
新窗口打开|下载CSV
2 培养基成分与培养条件
2.1 种子消毒及无菌苗培养
选取饱满的成熟种子, 用无菌水浸泡10分钟, 0.1%氯化汞溶液洗涤90秒, 无菌水洗涤3次, 每次10分钟。将消毒的种子接种在MS+8 g·L?1琼脂+30 g·L?1蔗糖的培养基上发芽(Gupta and Rahman, 2015), 培养6周。温度为(25±2)°C, 光照强度为800-1 000 μmol· m-2·s?1, 光周期为14小时光照/10小时黑暗。2.2 基因型筛选
培养基为: MS+5.0 mg·L?1 6-BA+3.0 mg·L?1 IAA+ 3 g·L?1植物凝胶+30 g·L?1蔗糖(Nuoendagula et al., 2017)。切取40个万寿菊基因型生长约6周的实生苗顶部2-3对复叶的小叶片, 正面向上接种于培养基上, 每组重复5皿, 每皿约25个外植体, 实验重复2次。培养条件同2.1节。4周后统计外植体再生率。2.3 激素组合优化
切取里程碑·黄色生长约6周的实生苗顶部2-3对真叶的小叶片, 正面向上接种于下列不同激素组合的MS培养基上, 每个处理重复4皿, 每皿10个外植体, 实验重复2次。培养基均添加3 g·L?1植物凝胶和30 g·L?1蔗糖, pH 5.8-6.0。培养条件同2.1节。4周后统计再生率。6-BA和IAA组合(表2): 固定6-BA浓度为3.0 mg·L?1, IAA浓度分别为1.0、1.5、1.8、2.0、2.5以及3.0 mg·L?1, 共6个处理。
Table 2
表2
表26-BA和IAA对万寿菊里程碑·黄色叶片再生的影响
Table 2
| No. | 6-BA (mg?L-1) | IAA (mg?L-1) | Regeneration rate (%) |
|---|---|---|---|
| 1 | 3 | 1.0 | 37.50±15.00 b |
| 2 | 3 | 1.5 | 40.00±14.14 b |
| 3 | 3 | 1.8 | 35.00±5.77 b |
| 4 | 3 | 2.0 | 52.50±5.00 ab |
| 5 | 3 | 2.5 | 47.50±17.08 ab |
| 6 | 3 | 3.0 | 65.00±12.91 a |
新窗口打开|下载CSV
ZT和IAA组合(表3): ZT浓度分别为0.3、0.6和1.8 mg·L?1, IAA浓度分别为0.5、1.0和2.0 mg·L?1, 共9个处理。
Table 3
表3
表3ZT和IAA对万寿菊里程碑·黄色叶片再生的影响
Table 3
| No. | ZT (mg?L-1) | IAA (mg?L-1) | Regeneration rate (%) |
|---|---|---|---|
| 1 | 0.3 | 0.5 | 37.50±9.57 bc |
| 2 | 0.3 | 1.0 | 35.00±10.00 bc |
| 3 | 0.3 | 2.0 | 22.50±12.58 c |
| 4 | 0.6 | 0.5 | 67.50±9.57 a |
| 5 | 0.6 | 1.0 | 40.00±8.16 bc |
| 6 | 0.6 | 2.0 | 55.00±10.00 ab |
| 7 | 1.8 | 0.5 | 52.50±15.00 ab |
| 8 | 1.8 | 1.0 | 55.00±19.15 ab |
| 9 | 1.8 | 2.0 | 27.50±22.17 c |
新窗口打开|下载CSV
TDZ+IBA组合1 (表4): TDZ浓度分别为0.5、1.0和1.5 mg·L?1, IBA浓度分别为0.3、0.5和1.0 mg·L?1, 共9个处理。
Table 4
表4
表4TDZ和IBA对万寿菊里程碑·黄色叶片再生的影响
Table 4
| No. | TDZ (mg?L-1) | IBA (mg?L-1) | Regeneration rate (%) |
|---|---|---|---|
| 1 | 0.5 | 0.3 | 62.50±12.58 ab |
| 2 | 0.5 | 0.5 | 55.00±17.32 ab |
| 3 | 0.5 | 1.0 | 67.50±15.00 a |
| 4 | 1.0 | 0.3 | 40.00±14.14 bcd |
| 5 | 1.0 | 0.5 | 57.50±20.62 ab |
| 6 | 1.0 | 1.0 | 47.50±9.57 abcd |
| 7 | 1.5 | 0.3 | 32.50±12.58 cd |
| 8 | 1.5 | 0.5 | 52.50±9.57 abc |
| 9 | 1.5 | 1.0 | 27.50±9.57 d |
新窗口打开|下载CSV
TDZ+IBA组合2 (表5): 在TDZ+IBA组合1的基础上, TDZ浓度分别设置为0.1、0.2、0.3和0.4 mg·L?1, IBA浓度分别为0.25和0.5 mg·L?1, 共8个处理。
Table 5
表5
表5TDZ和IBA对万寿菊里程碑·黄色叶片再生的影响
Table 5
| No. | TDZ (mg?L-1) | IBA (mg?L-1) | Regeneration rate (%) |
|---|---|---|---|
| 1 | 0.1 | 0.25 | 22.50±15.00 c |
| 2 | 0.1 | 0.50 | 40.00±8.16 ab |
| 3 | 0.2 | 0.25 | 35.00±12.91 ab |
| 4 | 0.2 | 0.50 | 62.50±12.58 a |
| 5 | 0.3 | 0.25 | 35.00±12.91 ab |
| 6 | 0.3 | 0.50 | 47.50±12.58 ab |
| 7 | 0.4 | 0.25 | 35.00±12.91 ab |
| 8 | 0.4 | 0.50 | 32.50±17.08 ab |
新窗口打开|下载CSV
2.4 小叶部位对万寿菊再生的影响
培养基为: MS+0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA+3 g·L?1植物凝胶+30 g·L?1蔗糖。选取里程碑·黄色生长约6周的实生苗顶部2-3对真叶的小叶片, 从中间横切, 获得基部和上部小叶, 并以全小叶为对照, 正面向上接种于培养基, 每组重复3皿, 每皿15个外植体, 实验重复3次。培养条件同2.1节。4周后统计再生率。2.5 固化剂对万寿菊再生的影响
切取里程碑·黄色生长约6周的实生苗顶部2-3对真叶的小叶片, 正面向上接种于7种添加不同浓度固化剂的培养基上, 植物凝胶和琼脂浓度分别为3、4.5、6 g·L?1及7、8、9、10 g·L?1, 培养基均添加0.2 mg·L?1 TDZ、0.5 mg·L?1 IBA和30 g·L?1蔗糖, pH5.8-6.0。每组重复4皿, 每皿10个外植体, 实验重复3次。培养条件同2.1节。4周后统计再生率和玻璃化率。2.6 蔗糖对万寿菊再生的影响
切取里程碑·黄色生长约6周的实生苗顶部2-3对真叶的小叶片, 正面向上接种于4种添加不同浓度蔗糖(20、30、40和50 g·L?1)的培养基上, 培养基均添加0.2 mg·L?1 TDZ、0.5 mg·L?1 IBA和8 g·L?1琼脂, pH 5.8-6.0。每组重复4皿, 每皿10个外植体, 实验重复3次。培养条件同2.1节。4周后统计再生率和玻璃化率。2.7 不定芽伸长
切下再生的不定芽, 转入6种伸长培养基, 即MS1? MS6 (表7)。MS1: 无激素的MS培养基; MS2: MS+ 0.1 mg·L?1 TDZ (15天后改为0.01 mg·L?1 TDZ); MS3: MS+0.3 mg·L?1 6-BA+1.0 mg·L?1 NAA; MS4: MS+0.6 mg·L?1 6-BA+1.0 mg·L?1 NAA; MS5: MS+ 0.9 mg·L?1 6-BA+1.0 mg·L?1 NAA; MS6: MS+0.2 mg·L?1 6-BA+0.6 mg·L?1 NAA, 培养基中均添加8 g·L?1琼脂和30 g·L?1蔗糖。15天继代1次, 30天后统计不定芽伸长率, 并转入MS1培养基生根培养; 15天后统计再生苗生根情况, 并对健壮的生根苗炼苗移栽。Table 7
表7
表7不同培养基对万寿菊不定芽伸长的影响
Table 7
| Code | Treatment | Explant No. | Elongation rate (%) | Status |
|---|---|---|---|---|
| MS1 | No hormone | 46 | 91.30 | Strong; elongate 4-5 cm |
| MS2 | 0.1 mg·L?1 TDZ; chang to 0.01 mg·L?1 TDZ after 15 days | 60 | 65.00 | Healthy; elongate 3-4 cm |
| MS3 | 0.3 mg·L?1 6-BA+1.0 mg·L?1 NAA | 53 | 30.19 | Weak; elongate 0-2 cm |
| MS4 | 0.6 mg·L?1 6-BA+1.0 mg·L?1 NAA | 55 | 18.18 | Weak; elongate 0-1 cm |
| MS5 | 0.9 mg·L?1 6-BA+1.0 mg·L?1 NAA | 57 | 12.28 | Weak; elongate 0-1 cm |
| MS6 | 0.2 mg·L?1 6-BA+0.6 mg·L?1 NAA | 45 | 33.33 | Weak; elongate 0-2 cm |
新窗口打开|下载CSV
2.8 数据分析
采用Microsoft Excel 2010软件进行数据整理, 采用SAS 9.2软件进行方差分析, 应用Tukey或Duncan’s新复极差法进行多重比较。百分数经反正弦转换(即把原始数据X转换成$\text{sin-}{{\text{1}}^{\sqrt{x}}}$), 再进行方差分析。叶片再生率=(产生不定芽的外植体个数/外植体总个数)×100%;
不定芽玻璃化率=(玻璃化的不定芽个数/不定芽总个数)×100%;
伸长率=(伸长≥2 cm的外植体个数/接种外植体总个数)×100%;
生根率=(生根的外植体个数/接种外植体总个数)×100%。
3 结果与讨论
3.1 不同基因型的再生效率
小叶片外植体培养1周后, 伤口部位膨大并产生愈伤组织; 2周后, 叶片愈伤组织已完全形成, 不定芽开始分化, 且小叶片接触培养基一端向上翻卷。第2-4周为不定芽快速形成阶段, 4周后不定芽数量趋于稳定。根据再生结果, 万寿菊基因型可分为易再生(≥50%)、中等再生(30%-50%)、难再生(1%-30%)和不能再生(0-1%) 4种类型, 再生效果如图1A-D所示。由表1可知, 叶片再生效率最高的2个基因型为完美·金黄色(54.21%)和里程碑·黄色(51.44%)。二者再生率无明显差异, 但后者较前者再生更加稳定, 且重复性最佳。因此选择里程碑·黄色为最佳基因型, 并用作后续的再生体系建立和优化研究。此外, Tukey方差分析及多重比较结果显示, 基因型对万寿菊再生的影响极显著(P<0.001), 不同基因型再生差异明显, 甚至有部分基因型无法通过叶片再生(如安提瓜·桔色)。虽然40个基因型的再生率有明显差异, 但均显示不定芽严重玻璃化。图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1万寿菊的叶片再生过程
(A) 易再生基因型: 里程碑·黄色; (B) 中等再生基因型: 自豪·橙黄改良; (C) 难再生基因型: 奇迹·黄色; (D) 不能再生基因型: 安提瓜·桔色; (E) 生长在MS+3 mg·L?1 6-BA+3 mg·L?1 IAA+3 g·L?1植物凝胶+30 g·L?1蔗糖培养基的里程碑·黄色叶片; (F) 生长在MS+0.3 mg·L?1 ZT+2.0 mg·L?1 IAA+3 g·L?1植物凝胶+30 g·L?1蔗糖培养基的里程碑·黄色叶片; (G) 生长在MS+0.6 mg·L?1 ZT+0.5 mg·L?1 IAA+3 g·L?1植物凝胶+30 g·L?1蔗糖培养基的里程碑·黄色叶片; (H) 生长在MS+0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA+3 g·L?1植物凝胶+30 g·L?1蔗糖培养基的里程碑·黄色叶片; (I) 生长在MS+0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA+8 g·L?1琼脂+30 g·L?1蔗糖培养基的里程碑·黄色叶片; (J) 生长在MS+0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA+8 g·L?1琼脂+40 g·L?1蔗糖培养基的里程碑·黄色叶片; (K) 在MS1培养基上生根伸长的再生苗; (L) 移栽成活的再生植株。(A)-(K) Bars=1 cm; (L) Bar=2 cm
Figure 1Leaves regenerations process of marigold
(A) An easy regeneration genotype: Milestone·Yellow; (B) A moderate regeneration genotype: Proud·Orange-yellow; (C) A difficult regeneration genotype: Miracle·Yellow; (D) An unregenerable genotype: Antigua·Orange; (E) The leaves of Milestone·Yellow on the MS medium supplied with 3 mg·L?1 6-BA, 3 mg·L?1 IAA, 3 g·L?1 phytagel, and 30 g·L?1 sucrose; (F) The leaves of Milestone·Yellow on the MS medium supplied with 0.3 mg·L?1 ZT, 2.0 mg·L?1 IAA, 3 g·L?1 phytagel, and 30 g·L?1 sucrose; (G) The leaves of Milestone·Yellow on the MS medium supplied with 0.6 mg·L?1 ZT, 0.5 mg·L?1 IAA, 3 g·L?1 phytagel, and 30 g·L?1 sucrose; (H) The leaves of Milestone·Yellow on the MS medium supplied with 0.2 mg·L?1 TDZ, 0.5 mg·L?1 IBA, 3 g·L?1 phytagel, and 30 g·L?1 sucrose; (I) The leaves of Milestone·Yellow on the MS medium supplied with 0.2 mg·L?1 TDZ, 0.5 mg·L?1 IBA, 8 g·L?1 agar, and 30 g·L?1 sucrose; (J) The leaves of Milestone·Yellow on the MS medium supplied with 0.2 mg·L?1 TDZ, 0.5 mg·L?1 IBA, 8 g·L?1 agar, and 40 g·L?1 sucrose; (K) Regenerated shoot extension and rooting culture on MS1 medium; (L) A living regenerating transplanted plants. (A)-(K) Bars=1 cm; (L) Bar=2 cm
3.2 不同激素组合对万寿菊再生的影响
3.2.1 6-BA和IAA对万寿菊再生的影响由于初始再生培养基中细胞分裂素类物质(6-BA)浓度(5 mg·L?1)过高, 会加重再生芽玻璃化(Kataeva et al., 1991; 陈兵先等, 2011)并影响遗传转化效率(Nuoendagula et al., 2017)。因此, 将6-BA浓度降为3 mg·L?1, 组合不同浓度的IAA。由表2可知, 随着IAA浓度的增加, 叶片的再生率显著提高, 其中3 mg·L?1 6-BA+3 mg·L?1 IAA组合里程碑·黄色叶片的再生率达65%, 再生效率显著提高, 但芽较小, 且玻璃化严重(图1E)。
3.2.2 ZT和IAA对万寿菊再生的影响
由表3可知, 不同浓度的ZT和IAA组合对里程碑·黄色叶片再生有显著影响。当ZT浓度为0.3 mg·L?1时, 外植体大量生根, 再生率低于40% (图1F)。当ZT浓度为0.6和1.8 mg·L?1时, 再生率显著提高, 其中0.6 mg· L?1 ZT+0.5 mg·L?1 IAA为最佳组合, 再生率达67.5%。该组合虽然玻璃化现象依旧严重, 且外植体少数生根, 但产生的不定芽大, 且正常芽较多, 畸形芽少(图1G)。
3.2.3 TDZ和IBA对万寿菊再生的影响
由表4和表5可知, 不同浓度的TDZ和IBA组合对里程碑·黄色叶片再生有显著影响。表4显示, 随着TDZ浓度的增加, 再生率从约60%逐渐降低到约30%, 且高浓度TDZ更易导致不定芽玻璃化, 而不同浓度IBA对万寿菊再生率的影响不显著。为减轻玻璃化和提高再生率, 将TDZ浓度降低。由表5可知, 添加0.5 mg·L?1 IBA再生率普遍高于0.25 mg·L?1 IBA, 且当固定IBA浓度为0.5 mg·L?1时, 随着TDZ浓度的增大, 叶片再生率呈先增加后降低的趋势, 0.2 mg·L?1 TDZ为最佳浓度。0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA为最佳组合, 再生率达62.5%。相比0.6 mg·L?1 ZT+0.5 mg·L?1 IAA组合, 该组合不定芽大, 健壮, 生根较少(图1H)。
3.3 小叶部位对万寿菊再生的影响
由表6可知, 全小叶和基部小叶的再生率无明显差异, 分别为66.67%和63.49%, 显著高于上部小叶的再生率(29.84%)。芽的分化均在形态学的下端, 即全小叶、基部小叶和上部小叶的不定芽生长位置都在基部切口端, 综合考虑, 以全小叶作为外植体。Table 6
表6
表6小叶部位对万寿菊叶片再生的影响
Table 6
| Leaflet segment | Regeneration rate (%) | Status |
|---|---|---|
| Whole leaflet | 66.67±11.55 a | Callus and buds differentiated at the incision |
| Basal segment | 63.49±8.64 a | Callus were differentiated at both end incisions, but only adventitious buds were differentiated in basal wound |
| Top segment | 29.84±11.75 b | Callus and buds differentiated at the incision |
新窗口打开|下载CSV
3.4 固化剂对叶片再生和玻璃化的影响
由图2A, B可知, 不同类型及浓度的固化剂对万寿菊叶片再生率影响不明显, 但对不定芽玻璃化有显著影响。植物凝胶和琼脂浓度越低, 玻璃化现象越严重, 但植物凝胶更易导致不定芽玻璃化。当琼脂浓度为8 g·L?1时, 万寿菊再生率最高, 达65%, 同时不定芽玻璃化率降低至41.55%。且不定芽的状态好, 畸形少, 再生稳定(图1I)。图2
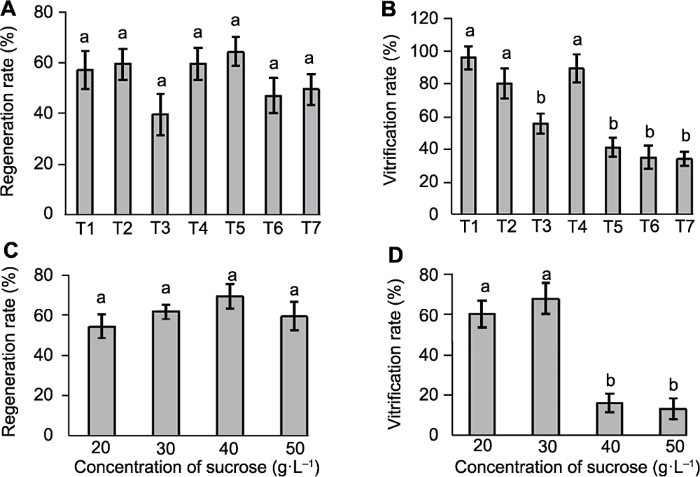 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2不同固化剂和蔗糖对万寿菊里程碑·黄色叶片再生率和玻璃化率的影响
(A), (B) 不同固化剂类型及浓度(T1: 3 g·L?1植物凝胶; T2: 4.5 g·L?1植物凝胶; T3: 6 g·L?1植物凝胶; T4: 7 g·L?1琼脂; T5: 8 g·L?1琼脂; T6: 9 g·L?1琼脂; T7: 10 g·L?1琼脂); (C), (D) 不同蔗糖浓度。不同小写字母表示在P<0.05水平差异显著。
Figure 2Effects of different curing agents and sucrose on the leaf regeneration and vitrification of marigold Milestone·Yellow
(A), (B) Different types and concentrations of curing agent (T1: 3 g·L?1 phytagel; T2: 4.5 g·L?1 phytagel; T3: 6 g·L?1 phytagel; T4: 7 g·L?1 agar; T5: 8 g·L?1 agar; T6: 9 g·L?1 agar; T7: 10 g·L?1 agar); (C), (D) Different sucrose concentrations. Different lowercase letters indicate significant differences at P<0.05 level.
3.5 蔗糖对叶片再生和玻璃化的影响
图2C, D显示, 不同浓度蔗糖对万寿菊再生率无明显影响, 但不同处理之间的不定芽玻璃化率有显著差异。随着蔗糖浓度的增加, 再生率呈现先上升后下降趋势, 在40 g·L?1时达到最大(70%)。而玻璃化率则随着蔗糖浓度的增大而逐渐降低, 40 g·L?1蔗糖时不定芽玻璃化率降低至16.07%, 并且芽大而健壮(图1J)。3.6 不定芽伸长生根
由表7可知, 培养基中添加不同的激素对不定芽伸长有明显的抑制作用。不添加任何激素的MS1培养基中, 伸长的不定芽健壮, 叶色深绿, 可长至4-5 cm高(图1K)。将伸长至4-5 cm的壮苗移至不添加任何激素的MS1培养基进行生根, 生根率近100%。将生根2周的再生苗进行炼苗移栽, 极易成活, 植株健壮, 且能正常开花(图1L)。3.7 讨论
再生体系的建立对植物快速繁殖、遗传转化和种质资源保护具有重要意义。同种植物不同品种的再生能力有很大差异(姜福星等, 2018)。齐迎春等(2005)将5份不同品系的孔雀草(Tagetes patula)叶片接种在MS+ 1.5 mg·L?1 NAA+1.0 mg·L?1 BA培养基上, 发现它们的不定芽分化率有显著差异, 21614品系最高为85%。张志扬等(2007)以亚麻(Linum usitatissimum) 8个品种的下胚轴为外植体进行植株再生研究, 发现白花的不定芽诱导率远大于其它品种, 达98.5%。我们对万寿菊40个基因型叶片的再生研究也表明, 不同基因型万寿菊的再生能力差异显著。此外, 万寿菊自交系的再生率普遍很低, 可能是由于万寿菊多代自交引起生活力衰退, 同时导致叶片的再生能力下降。植物生长调节剂已广泛应用于植物栽培和组织培养中。目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(刘莉等, 2004; Pal, 2019)。6-BA、ZT和TDZ是常用的3种细胞分裂素类物质, 可促进细胞分化, 诱导不定芽和胚状体形成。其中, 6-BA在植物体内的移动性差, 生理作用部位具局限性; ZT是一种天然的细胞分裂素, 活性强, 副作用小, 可被植物自身代谢, 但价格昂贵, 且易导致组培外植体生根; TDZ具有微量高效的特点, 但高浓度的TDZ也易导致组培苗玻璃化和生长异常。前人的报道中, 万寿菊再生的激素组合大多为6-BA+IAA (Vanegas et al., 2002; 赵子刚, 2010; Nuoendagula et al., 2017; 赵鹏雪, 2018)、6-BA+NAA (Vanegas et al., 2002; 赵子刚, 2010; Kumar et al., 2018)和6-BA+GA3 (赵子刚, 2010; Gupta and Rahman, 2015)三种。本研究探索了3类不同激素组合(6-BA+IAA、ZT+IAA和TDZ+IBA)对万寿菊再生的影响, 发现3 mg·L?1 IAA+3 mg·L?1 6-BA为6-BA+IAA激素组合的最佳浓度, 与Vanegas等(2002)、赵子刚等(2010)和Nuoendagula等(2017)所得结论一致, 但与赵鹏雪(2018)的结论(2 mg·L?1 IAA+3 mg·L?1 6-BA)不同, 说明相同物种的不同基因型对植物生长调节剂的需求以及反应度有差异。本研究表明, 与3 mg·L?1 IAA+3 mg·L?1 6-BA相比, 0.6 mg·L?1 ZT+0.5 mg·L?1 IAA组合培养基培养的万寿菊再生效果更好, 不定芽大且健壮, 但较易长根(对后期遗传转化不利), 这与ZT的特性有关。0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA组合则在提高再生率的基础上, 成功改善了不定芽小而弱的状态, 使其更容易成苗, 不易出根, 是理想的激素组合。
相同外植体不同部位的再生能力不同。前人的研究(张德双等, 2000; 姜福星等, 2018)表明, 叶片再生多来自切口及其附近的薄壁细胞分化, 植物叶片的某些有机营养成分含量从叶尖到叶基逐渐增加, 可能是叶片不同部位再生能力存在差异的原因之一。君迁子(Diospyros lotus)叶片基部的再生能力最强, 其再生率和平均不定芽数均显著高于顶部等其它部位(谢启鑫等, 2008)。Kumar等(2019)发现, 万寿菊小叶基部段的再生率和平均芽数均高于小叶尖端, 与本研究结果一致。本研究表明, 万寿菊叶片外植体的全小叶再生效果最佳, 与下部小叶无差异, 比上部小叶的再生率高, 可能是由于下部小叶靠近叶基, 富含更多的内源激素, 利于叶片再生。
很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (张红和王万新, 2008)、菊花(Dendranthema morifolium) (孙庆春等, 2009)、非洲冰草(Mesemb-ryanthemum crystallinum) (陈思等, 2016)以及甜杨(Populous suaveolens) (赵鑫闻和梁德军, 2017)。取材部位及外植体大小、光照、温度、封口材料、培养基类型和植物激素等因素均会影响玻璃化现象(陈兵先等, 2011)。其中, 外源细胞分裂素浓度与玻璃化率呈正相关(黄烈健和王鸿, 2016)。前人已有关于万寿菊实生苗和快繁组培苗玻璃化方面的研究(李娜等, 2013; 吴丽芳等, 2020)。我们在建立万寿菊再生体系过程中, 除降低细胞分裂素浓度之外, 还探索了固化剂类型和浓度及蔗糖浓度对万寿菊再生的影响, 证明8 g·L?1琼脂和40 g·L?1蔗糖组合最佳, 而赵子刚等(2010)对色素万寿菊再生的研究结果显示, 6 g·L?1植物凝胶对其再生最为有利, 这与本研究有差异。适宜浓度的固化剂和蔗糖可促进再生并减少不定芽玻璃化发生。但琼脂或植物凝胶用量过多, 会造成培养基太硬, 影响养分吸收, 对再生不利; 蔗糖浓度太高会导致培养基渗透压过高, 也不利于万寿菊叶片再生。
分化的不定芽进一步壮苗培养后, 才可进行后续的生根移栽。本研究发现, 将万寿菊叶片再生获得的不定芽移至不添加激素的MS培养基, 芽伸长和根发育最佳, 添加激素对不定芽伸长有抑制作用, 与Vanegas等(2002)及Gupta和Rahman (2015)的研究结果一致。万寿菊不定芽经再生阶段体内积累了大量外源激素, 故伸长阶段应减少外源激素的供应, 以达到生物体内激素的平衡与稳定。
本研究从40个万寿菊基因型中筛选出再生效率高的基因型, 并通过研究不同条件对万寿菊再生的影响, 成功建立并优化了万寿菊里程碑·黄色叶片离体再生体系。最佳培养基为MS+0.2 mg·L?1 TDZ+0.5 mg·L?1 IBA+8 g·L?1琼脂+40 g·L?1蔗糖, 光下培养4周, 叶片再生率从51%提高至70%, 玻璃化率从96%降低至16%, 获得的不定芽更易成苗, 该研究为万寿菊遗传转化奠定了基础。
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 2]
[本文引用: 1]
URL [本文引用: 1]

生物技术的发展为植物遗传改良开辟了一条新途径 ,论述了转基因技术在植物遗传改良中的应用及其与传统育种方法的关系。
URL [本文引用: 1]

2浓度、湿度,以促进外植体光自养微繁殖生长;二者均着眼于降低组培成本,简化组培程序,有望使组培技术得到革新。本文对林木组织培养研究进展进行综述,为今后开展林木植物组织培养技术的研究提供重要参考。]]>
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]

将孔雀草品种T. patula'Little Hero Golden'的叶片、子叶和下胚轴接种于4种含有不同浓度IAA、NAA和BA的MS培养基上,比较不同外植体的再生植株的能力。结果表明,叶片再生植株能力较子叶和下胚轴强。随后,进一步将其叶片接种于9种添加不同浓度NAA和BA的MS培养基上,分化结果显示,在MS+NAA 1.5 mg·L-1+BA 1.0 mg·L-1的培养基上植株再生率最高,达75%。5份材料的叶片分别接种在该培养基上,再生率均达70%以上,其中T. patula21614的再生率达85%。所有再生植株均能成苗并表现出正常的形态特征。从而建立了适合于5种基因型孔雀草的离体高效再生体系。
URL [本文引用: 1]

以菊花组培苗为试材,对菊花玻璃化苗和正常苗的生理特性进行比较.测定了组织含水量、叶绿素、可溶性糖、蔗糖、可溶性蛋白5个指标.玻璃化苗的组织含水量、可溶性糖含量高于正常苗,叶绿素a、叶绿素b、蔗糖、可溶性蛋白含量明显低于正常苗.说明玻璃化苗与正常苗在光合能力、蛋白质合成和糖代谢方面显著不同.
[本文引用: 1]
URL [本文引用: 1]

【目的】建立君迁子叶片离体再生体系,为转基因操作奠定基础。【方法】以君迁子幼叶为外植体,研究适合其再生植株的叶片部位、放置方式、基础培养基、植物生长调节剂以及暗培养时间等条件。【结果】叶片基部上表面朝下接种于1/2MS+ ZT 5.0 mg•L-1+IBA 0.01 mg•L-1的培养基,先期暗培养5周后转移至正常光照下培养效果最好,愈伤组织形成率、不定芽再生率和外植体平均不定芽数分别为100.0%、85.3%和2.8±0.6个。再生芽接种于不含植物生长调节剂的1/2MS培养基上,30 d时生根率达100%,平均根数和平均根长分别达5.4条和3.7 cm。再生植株炼苗后移栽,30 d时成活率达98.5%。【结论】成功地建立了君迁子叶片的离体再生体系。
DOI:10.3321/j.issn:1000-7091.2000.03.021URL [本文引用: 1]

通过池栽试验,研究了冬小麦的需硫规律。结果表明:供硫充足的小麦,植株硫的累积呈一单峰曲线,在拔节至抽穗期吸收量最高。而全硫含量在返青起身期有一个高峰,之后随着小麦的生长而逐渐降低。供硫不足时,小麦硫的吸收量显著降低,在拔节至抽穗期吸收量很低,而在其前后出现2个高峰。小麦吸收到体内的硫达到一定浓度后,即使增加土壤硫的供给,植株硫的吸收过程也不会增强。如果土壤缺氮,即使供硫充足,植株也会缺硫。硫在小麦各器官的分配随生育期变化,供硫充足的小麦叶片的硫浓度保持最高,但叶片中硫的分配比例只在抽穗前最高,成熟过程中叶片中有部分硫运出。抽穗后茎的累积量迅速上升,分配比例最高。
URL [本文引用: 1]

玻璃化是香石竹组织培养中的一大障碍,试验研究了BA、琼脂、蔗糖、活性炭等因素对香石竹组培苗玻璃化的影响,结果表明:降低细胞分裂素的浓度,提高琼脂的用量,培养基中加入0.5g/L活性炭对克服香石竹组培苗玻璃化有明显的效果;增加蔗糖的用量对香石竹玻璃化的防止没有明显的作用;香石竹组织培养中能有效防止玻璃化的适宜培养基为MS+BA 0.5mg/L+NAA 0.01mg/L+蔗糖30g/L+琼脂8g/L+活性炭0.5g/L.
[本文引用: 1]
[本文引用: 2]
[本文引用: 1]
URL [本文引用: 5]

以色素万寿菊叶片为外植体,探讨了不同的植物生长调节剂组合、AgNO3、凝胶剂及不同的继代培养基对叶片器官发生的影响。结果表明:6-BA 3.0 mg · L-1 + IAA 3.0 mg · L-1 + 蔗糖30.0 g · L-1 + 植物凝胶6.0 g · L-1的MS培养基适宜不定芽的分化,不定芽分化率达97.5%,将分化13 d的叶片外植体转接到组织培养瓶中,30 d后56.7%的不定芽可发育成高约5 cm的植株,再生植株在MS培养基上生根率为100%,移栽成活率达100%。
DOI:10.1007/s002990050500URLPMID:30736559 [本文引用: 1]

Embryogenic callus and somatic embryos were induced from cotyledonary explants of African marigold (Tagetes erecta L.). Cotyledons were first cultured on MS medium supplemented with 2.0 mg l(-1) 2,4-D and 0.2 mg l(-1) kinetin. After 5 weeks, calli were transferred to MS medium supplemented with 0.02 mg l(-1) thidiazuron where compact embryogenic callus developed. Friable embryogenic callus developed when the compact embryogenic callus was transferred to medium containing 2,4-D and subcultured every 2 weeks. Friable embryogenic callus has been maintained for more than 2 years without losing the capacity to generate embryos. Embryo development was obtained when friable embryogenic callus was transferred to MS medium supplemented with 3 mg l(-1) ABA and 60 g l(-1) sucrose. The addition of 10-30 mM L-glutamine improved embryo development.
DOI:10.2135/cropsci2003.2118URL [本文引用: 1]
DOI:10.5511/plantbiotechnology.17.1120aURL [本文引用: 1]
DOI:10.1007/s00709-014-0740-yURLPMID:25504508 [本文引用: 4]

Tagetes erecta, L. an asteraceous plant of industrial and medicinal value, contains important compounds like pyrethrins, thiophenes and lutein, possessing immense potential for insecticidal, nematicidal and nutraceutical activities. Considering the importance and demand for these natural compounds, genetic manipulation of this crop for better productivity of secondary metabolites holds great significance. A rapid and reproducible direct regeneration and genetic transformation system is the prerequisite for genetic manipulation of any crop. This paper elucidates the establishment of an efficient direct regeneration and transformation protocol of T. erecta using Agrobacterium tumefaciens. Investigation of the effects of different types of explants (Hypocotyls, cotyledonary leaves, rachis and leaf sections) and different BAP and GA3 combinations on the regeneration frequency of T. erecta suggested that the best regeneration frequency (66 %) with an average of 5.08 +/- 0.09 shoot buds/explant was observed from hypocotyl explants cultured on media containing 1.5 mg/l BAP and 5 mg/l GA3. The transformation protocol was established using A. tumefaciens strain LBA4404, containing the binary vector pBI121, along with the gusA reporter gene with intron under the transcriptional control of the Cauliflower Mosaic Virus (CaMV) 35S promoter and the neomycin phosphotransferase II (nptII) gene as a kanamycin-resistant plant-selectable marker. Various parameters like optimization of kanamycin concentration (200 mg/l) for selection, standardization of cocultivation time (45 min) and acetosyringone concentration (150 muM) for obtaining higher transformation frequency were established using hypocotyl explants. The selected putative transgenic shoots were subsequently rooted on the Murashige and Skoog medium and transferred to the green house successfully. The plants were characterised by analysing the gus expression, amplification of 600 bp npt II fragment and Southern blot hybridization using the PCR-amplified gusA fragment as probe. The standardised protocol established during the study will open new vistas for genetic manipulation and introduction of desired genes for genetic improvement of T. erecta.
DOI:10.1007/BF00041283URL [本文引用: 1]
[本文引用: 2]
[本文引用: 1]
DOI:10.5511/plantbiotechnology.17.0530aURL [本文引用: 6]
[本文引用: 1]
DOI:10.1023/A:1015610011374URL [本文引用: 5]
DOI:10.1016/S0960-8524(97)00101-6URL [本文引用: 1]
植物组织培养试管苗玻璃化现象研究进展
2
2011
... 由于初始再生培养基中细胞分裂素类物质(6-BA)浓度(5 mg·L?1)过高, 会加重再生芽玻璃化(
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
非洲冰草快速繁殖及试管苗玻璃化的影响因子
1
2016
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
利用转基因技术进行植物遗传改良
1
2002
... 万寿菊(Tagetes erecta)为菊科(Asteraceae)万寿菊属一年生草本植物.其花色艳丽, 花期长, 园林应用广泛, 观赏品种丰富.万寿菊花瓣富含叶黄素, 具有重要的观赏和经济价值(
林木植物组织培养及存在问题的研究进展
1
2016
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
植物叶片再生的探究
2
2018
... 再生体系的建立对植物快速繁殖、遗传转化和种质资源保护具有重要意义.同种植物不同品种的再生能力有很大差异(
... 相同外植体不同部位的再生能力不同.前人的研究(
色素万寿菊试管苗玻璃化现象及防止研究
1
2013
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
不同植物生长调节剂对莴苣愈伤组织的诱导与植株再生的影响
1
2004
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
不同基因型孔雀草高效植株再生体系的建立
1
2005
... 再生体系的建立对植物快速繁殖、遗传转化和种质资源保护具有重要意义.同种植物不同品种的再生能力有很大差异(
菊花玻璃化苗与正常苗的生理特性比较
1
2009
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
色素万寿菊试管苗玻璃化控制的研究
1
2020
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
君迁子叶片培养再生植株的研究
1
2008
... 相同外植体不同部位的再生能力不同.前人的研究(
几种主要营养成分在大白菜不同叶片及部位中的分布规律
1
2000
... 相同外植体不同部位的再生能力不同.前人的研究(
香石竹组培中的玻璃化现象及防止
1
2008
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
亚麻组织培养高频不定芽诱导体系
1
2007
... 再生体系的建立对植物快速繁殖、遗传转化和种质资源保护具有重要意义.同种植物不同品种的再生能力有很大差异(
万寿菊类胡萝卜素合成途径关键基因PSY和CCS的克隆及其再生体系的建立
2
2018
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
... 所得结论一致, 但与
甜杨离体再生中玻璃化苗的发生与预防
1
2017
... 很多植物在组织培养过程中会产生玻璃化现象, 如香石竹(Dianthus cargophyllus) (
色素万寿菊叶片再生体系的建立及优化
5
2010
... 前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
... ;
... (
... 、
Friable embryogenic callus and somatic embryo formation from cotyledon explants of African marigold (Tagetes erecta L.).
1
1998
... 前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (
Optimizing marigold ( Tagetes erecta L.) petal and pigment yield
1
2003
... 万寿菊(Tagetes erecta)为菊科(Asteraceae)万寿菊属一年生草本植物.其花色艳丽, 花期长, 园林应用广泛, 观赏品种丰富.万寿菊花瓣富含叶黄素, 具有重要的观赏和经济价值(
Somatic embryogenesis from leaf explants of Tagetes erecta L
1
2017
... 前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (
An efficient plant regeneration and Agrobacterium-mediated genetic transformation of Tagetes erecta
4
2015
... 前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (
... 选取饱满的成熟种子, 用无菌水浸泡10分钟, 0.1%氯化汞溶液洗涤90秒, 无菌水洗涤3次, 每次10分钟.将消毒的种子接种在MS+8 g·L?1琼脂+30 g·L?1蔗糖的培养基上发芽(
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
... 分化的不定芽进一步壮苗培养后, 才可进行后续的生根移栽.本研究发现, 将万寿菊叶片再生获得的不定芽移至不添加激素的MS培养基, 芽伸长和根发育最佳, 添加激素对不定芽伸长有抑制作用,
Effect of applied and internal hormones on vitrification and apical necrosis of different plants cultured in vitro
1
1991
... 由于初始再生培养基中细胞分裂素类物质(6-BA)浓度(5 mg·L?1)过高, 会加重再生芽玻璃化(
Influence of growth regulators on callus induction and plant regeneration from anthers of Tagetes spp
2
2018
... 前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
Influence of genotypes, growth regulators and basal media on direct differentiation of shoot buds from leaf segments of marigold ( Tagetes spp.)
1
2019
... 相同外植体不同部位的再生能力不同.前人的研究(
In vitro regeneration and Agrobacterium-mediated transformation of male-sterile marigold (Tagetes erecta L.)
6
2017
... 前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (
... 研究表明, 由于多数万寿菊的基因型不明, 所用激素组合也局限在6-BA+IAA、6-BA+NAA和6-BA+ GA3三种, 尤其是高浓度6-BA的使用会影响遗传转化效率(
... 培养基为: MS+5.0 mg·L?1 6-BA+3.0 mg·L?1 IAA+ 3 g·L?1植物凝胶+30 g·L?1蔗糖(
... 由于初始再生培养基中细胞分裂素类物质(6-BA)浓度(5 mg·L?1)过高, 会加重再生芽玻璃化(
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
... 和
Role of plant growth regulators in floriculture: an overview
1
2019
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
Plant regeneration via organogenesis in marigold
5
2002
... 前人通过间接诱导体胚途径获得的万寿菊再生效率较低(<10%) (
... 植物生长调节剂已广泛应用于植物栽培和组织培养中.目前, 已有很多关于不同浓度激素组合对植物再生影响的报道, 一般将细胞分裂素和生长素按一定比例组合, 才可有效实现愈伤组织、不定芽或根的诱导(
... )、6-BA+NAA (
... 6-BA为6-BA+IAA激素组合的最佳浓度, 与
... 分化的不定芽进一步壮苗培养后, 才可进行后续的生根移栽.本研究发现, 将万寿菊叶片再生获得的不定芽移至不添加激素的MS培养基, 芽伸长和根发育最佳, 添加激素对不定芽伸长有抑制作用,
Tagetes: a multipurpose plant
1
1997
... 万寿菊(Tagetes erecta)为菊科(Asteraceae)万寿菊属一年生草本植物.其花色艳丽, 花期长, 园林应用广泛, 观赏品种丰富.万寿菊花瓣富含叶黄素, 具有重要的观赏和经济价值(
