 ,1,2,*
,1,2,*Methods for Identification and Resistance Evaluation of Barley Slow Rusting to Leaf Rust
Mingzhe Che1, Yajun Wang3, Chuangxin Ma1,2, Xiaoquan Qi ,1,2,*
,1,2,*通讯作者: E-mail:xqi@ibcas.ac.cn
责任编辑: 朱亚娜
收稿日期:2020-05-8接受日期:2020-07-21网络出版日期:2020-09-01
| 基金资助: |
Corresponding authors: E-mail:xqi@ibcas.ac.cn
Received:2020-05-8Accepted:2020-07-21Online:2020-09-01

摘要
成功的病原菌接种和准确的病情调查是大麦(Hordeum vulgare)抗病研究的基础。该文总结了大麦抗叶锈病慢锈性鉴定实验中几种常用的喷雾和涂抹接种方法, 以及主要的抗性评价指标, 并对操作过程中的一些注意事项进行了说明。
关键词:
Abstract
Successful pathogen inoculation and following accurate rating are the basis of barley disease resistance studies. Here, we summarized selected barley leaf rust inoculation methods including spraying and smearing, and two evaluation indexes which are widely used in barley slow rusting evaluation. Key issues worthy affecting the assays were also discussed.
Keywords:
PDF (3075KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
车明哲, 王亚军, 马创新, 漆小泉. 大麦抗叶锈病慢锈性鉴定技术及抗性评价方法. 植物学报, 2020, 55(5): 573-576 doi:10.11983/CBB20074
Che Mingzhe, Wang Yajun, Ma Chuangxin, Qi Xiaoquan.

大麦(Hordeum vulgare)叶锈病是由大麦叶锈菌(Puccinia hordei)引起的一种真菌病害, 被认为是当前栽培大麦最重要的病害(Clifford, 1985; Park et al., 2015)。筛选并培育具有持久抗病性的品种是控制锈病危害的重要策略。与R基因控制的质量抗性不同, 慢锈性(slow rusting)是指在苗期及适于病害发生的环境条件下, 寄主植物与病原物相互作用表现感病反应, 但在田间病害发展速度相对较慢(Niks, 1986; Parlevliet, 2002)。抗性品种的慢锈性由于一般没有小种专化性以及抗性持久等特点逐渐受到育种家的重视(Niks et al., 2015)。通常情况下, 具有成株抗性(adult plant resistance, APR)的品种在生理上表现出侵染率低、产孢量少及孢子堆小的慢锈性特点, 在小麦(Triticum aestivum)和大麦中均被认为是一种重要的持久抗源。目前, 小麦抗锈病的鉴定技术和抗性评价方法已非常完善, 早在2007年我国农业部就已颁布NY/T 1443-2007《小麦抗病虫性评价技术规范》系列标准(中华人民共和国农业部, 2007)。其中第1-3部分分别为小麦抗条锈病、叶锈病和秆锈病评价技术规范, 详细且明确地介绍了病原物接种体制备、田间接种、病情调查及抗性评价标准等。与小麦抗锈病研究方法相比, 大麦抗锈病研究相对较少, 多借鉴小麦抗病研究体系进行相应实验操作。田间诊断时, 通常根据“条锈成行叶锈乱, 秆锈是个大红斑”加以区别。鉴于不同锈病的致病机理略有不同, 结合多年实践, 本文总结了一套操作简单、条件稳定且准确规范的大麦抗叶锈病慢锈性鉴定技术和抗性评价方法。该方法以大麦旗叶或苗期为接种对象, 采用喷雾或涂抹方法接种, 以相对潜伏期和侵染频率作为抗性评价标准。
1 实验材料
繁菌苗和感病对照大麦(Hordeum vulgare L.)品种均为L94。待鉴定大麦材料包括Vada、Vada-rphq4、L94- Rphq4、L94-Rphq2、182Q20和Golden Promise。大麦叶锈菌菌种为Puccinia hordei 1.2.1 (Wang et al., 2019)。接种塔(自制)为一种铝制的圆柱形构造, 将待测植物放置在塔底, 使叶片固定在水平位置, 接种物从靠近塔顶部的一根金属管通过机动吹灰机吹入塔内, 然后自然沉落在植物上(如3.2节所述) (Niks et al., 2011)。2 试剂
吐温20, Soltrol, 滑石粉, 石松粉(lycopodium) (Sigma), 营养土, 蛭石, 泥炭土。3 实验程序
3.1 大麦叶锈菌的繁殖和保存
(1) 育苗 选用直径为10 cm、高度为10 cm的花盆, 以营养土:蛭石:泥炭土为1:1:1的体积配比装土。每盆播种20-25粒已提前2-3天萌发露白的健康饱满感病品种L94种子, 覆土1 cm。将花盆置于盛水的育苗盘内, 使水从花盆底部缓慢吸收至土体表面完全湿润, 移出, 置于22°C温室内培养6-8天, 待用。(2) 菌种繁殖 菌种繁殖分为初繁和扩繁。
初繁: 待繁菌苗L94第1叶片全部展开后, 在叶面喷0.1%的吐温20水溶液。从-80°C冰箱中取出保存菌种的离心管, 在38°C温水中水浴7-10分钟后置于4°C冰箱过夜, 然后再次38°C水浴7分钟。将叶锈菌夏孢子与滑石粉按1:10的比例进行稀释, 待叶面吐温20水溶液晾干后, 用毛刷蘸取孢子粉均匀地涂抹在叶片正面, 再用清水喷雾, 待叶面形成水雾后随即放入保湿桶中, 盖上塑料薄膜, 置于12-18°C黑暗保湿18-24小时(图1A)。
图1
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1大麦繁菌苗保湿效果图(A)和接种后14天产孢效果图(B)
Figure 1Representative images of barley plants just after spray inoculation and moisture treatment (A) and plants 14 days later when unediniospores became apparent (B)
扩繁: 将新鲜孢子与滑石粉按1:20的比例进行稀释, 其它步骤同初繁。
(3) 潜育发病 取出接种苗, 置于温度为22°C、光周期为16小时光照/8小时黑暗的温室内培养。待叶片显斑时(约为接种6-7天), 剪去心叶。接种后约12-14天, 叶面可见明显的孢子堆(图1B)。
(4) 菌种收集 轻轻抖动发病叶片, 使菌种散落到玻璃纸上, 移去麦苗, 轻敲玻璃纸, 将新鲜菌种集中。
(5) 菌种保藏 若菌种在5-6天内使用, 可将菌种均匀散落于玻璃纸或称量纸上, 然后放入盛有变色硅胶的干燥器内待用。若长期保藏, 首先将菌种均匀散落于玻璃纸或称量纸上, 放入盛有变色硅胶的干燥器内干燥过夜, 然后少量多管地转移至离心管中, 封口膜封管, 置于-80°C冰箱中保存。
3.2 苗期抗性鉴定
(1) 育苗及接种 取37?cm ×?39 cm的方盆, 装满并压平营养土。将大约40粒大麦种子分别播种于方盆的两侧, 浇水后置于光周期为16小时光照/8小时黑暗、温度为20°C的温室培养间中培养10天。接种前, 剪掉大麦幼苗的第2片叶, 将第1片叶用半截回形针(用钳子将完整的回形针剪去一半)固定于土壤表面, 叶片正面朝上(图2A)。将固定好的植物放到接种塔底部的托盘上, 打开旋转开关, 植物会随托盘以40秒1圈的速度旋转。用分析天平称取1 mg大麦叶锈菌1.2.1的新鲜孢子与100 mg的lycopodium混匀, 然后用喷粉器将混有孢子的粉末从接种塔顶部完全喷到接种塔中, 等待10分钟, 使粉末均匀地散落在植物叶片表面。打开接种塔, 将植物放置于接种间, 打开加湿器, 使整个接种间充满水蒸气。10小时后, 将植物从接种间取出, 取出半截回形针, 并将植物放回温室培养间, 等待发病然后统计表型(图2B)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2大麦苗期抗性鉴定育苗示意图(A)及接种塔(B)
Figure 2Images displaying barley seedlings in the process of inoculation preparation (A) and the settling tower instrument for inoculation (B)
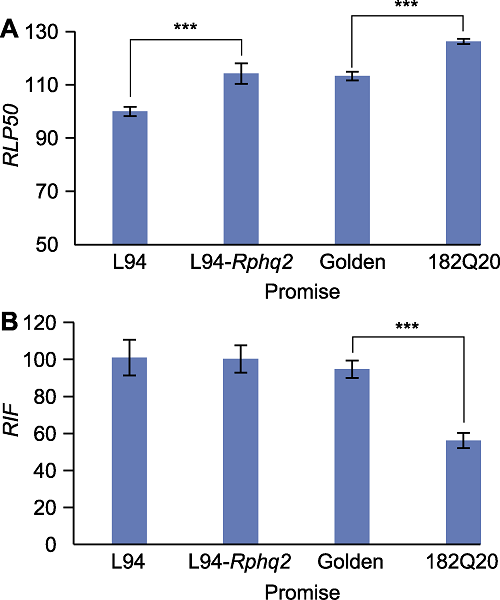
(2) 病情调查 大麦苗期叶锈病病情一般用侵染频率(infection frequency, IF)、相对侵染频率(relative infection frequency, RIF)、潜伏期(latency period 50, LP50)和相对潜伏期(relative latency period, RLP50) 进行定量评估(图3A, B)。
图3
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3不同大麦品种叶锈菌侵染统计结果
(A) 相对潜伏期(RLP50); (B) 相对侵染频率(RIF)。***P<0.001
Figure 3Statistical results of leaf rust inoculation in different barley cultivars
(A) Measurements of the relative latency period (RLP50); (B) Measurements of the relative infection frequency (RIF). ***P<0.001
侵染频率为1 cm2面积内夏孢子堆的个数, 计算公式为:
$侵染频率(IF)=\frac{夏孢子堆个数}{叶片长度\times 叶片宽度}$
相对侵染频率为不同实验材料相对于同一对照材料的相对值, 计算公式为:
$相对侵染频率(RIF)=\frac{实验材料侵染频率}{对照材料侵染频率}\times 100$
潜伏期为50%的夏孢子堆长出所用的小时数(Wang et al., 2019)。待叶片表面长出明显褪绿斑时, 根据褪绿斑密度, 用记号笔标注1-5 cm包含有大约50个褪绿斑的叶段。从第1个夏孢子堆长出开始, 每间隔12到24小时统计标注的叶段内夏孢子堆个数, 一直到夏孢子堆数目不再增加为止(主孢子堆周围后来长出的次生孢子堆不在统计范围之内)。计算50%的孢子堆长出所需要的小时数即为其潜伏期。相对潜伏期为不同实验材料的潜伏期相对于同一对照材料的潜伏期的相对值, 计算公式为:
$相对潜伏期(RLP50)=\frac{实验材料潜伏期}{对照材料潜伏期} \times 100$
3.3 成株抗性鉴定
(1) 育苗 若鉴定材料少, 可选用直径为25 cm、高度为30 cm的花盆, 以营养土:蛭石:泥炭土为1:1:1的体积配比装土。每盆播种2粒健康饱满感病品种L94或鉴定材料的种子, 覆土1 cm。将花盆置于盛水的育苗盘内, 使水从花盆底部缓慢吸收至土体表面完全湿润后移出, 置于22°C温室内培养至旗叶展开, 待用。若采用塑料大棚鉴定苗圃进行抗性鉴定, 可采用开畦条播、等行距配置方式。行长1 m, 行间距15- 20 cm, 每份材料播种1行, 每行均匀播种20粒, 每10行鉴定材料播种1行感病对照材料L94, 同时苗圃四周各播种1行感病对照材料作为保护行(图4A)。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4大棚鉴定苗圃(A)和发病大麦叶片(B)
(B) Bar=1 cm
Figure 4A nursery in a greenhouse (A) and infected barley leaves (B)
(B) Bar=1 cm
(2) 接种 待旗叶展开, 选择无风天的傍晚进行接种。若待鉴定材料较少, 可采用涂抹法。在叶面喷0.1%的吐温20水溶液, 将新鲜孢子与滑石粉按1:80的比例进行稀释, 待叶面吐温20水溶液晾干后, 用毛刷蘸取孢子粉均匀地涂抹在叶片正面, 用清水喷雾, 使叶面形成水膜, 盖好大棚的塑料薄膜, 保湿过夜。若待鉴定材料较多, 可采用喷雾法, 按1 g孢子:1 L水(将所选生理小种的夏孢子粉用少量0.1%的吐温20水溶液调成糊状), 或1 g孢子:1.5 L Soltrol的比例稀释成夏孢子悬浮液。用手持式喷雾器将孢子悬浮液均匀喷洒在大麦叶片表面, 盖好大棚的塑料薄膜, 保湿过夜。
(3) 病情调查 大麦抗叶锈病病情调查采用潜伏期和侵染频率作为病情调查指标(图4B)。潜伏期和侵染频率统计方法同3.2节。为了使不同年份不同区组试验之间具有可比性, 通常采用相对潜伏期(RLP50)作为统一指标, 即选取一参考材料(如感病对照或分离感病材料)进行相对值的计算, 计算方法同3.2节。
4 注意事项
(1) 繁菌苗在产孢期间需注意土壤水分, 不要过于干旱, 可控制育苗盘有水保湿, 同时也不要存水过多。(2) 成株接种时尽可能选取叶龄一致的分蘖进行接种, 以降低不同材料间苗龄的差异。
(3) 喷雾器的选择, 需使得孢子悬浮液或清水喷出形成雾状, 而不是大粒水珠。
(责任编辑: 朱亚娜)
参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
http://www.moa.gov.cn/nybgb/2007/dshiq/201806/t20180614_6152043.htm.
URL [本文引用: 1]
[本文引用: 1]
DOI:10.1016/S0048-4059(86)80073-XURL [本文引用: 1]
[本文引用: 1]
DOI:10.1146/annurev-phyto-080614-115928URLPMID:26047563 [本文引用: 1]

Quantitative resistance (QR) refers to a resistance that is phenotypically incomplete and is based on the joined effect of several genes, each contributing quantitatively to the level of plant defense. Often, QR remains durably effective, which is the primary driver behind the interest in it. The various terms that are used to refer to QR, such as field resistance, adult plant resistance, and basal resistance, reflect the many properties attributed to it. In this article, we discuss aspects connected to those attributions, in particular the hypothesis that much of the QR to biotrophic filamentous pathogens is basal resistance, i.e., poor suppression of PAMP-triggered defense by effectors. We discuss what role effectors play in suppressing defense or improving access to nutrients. Based on the functions of the few plant proteins identified as involved in QR, vesicle trafficking and protein/metabolite transportation are likely to be common physiological processes relevant to QR.
DOI:10.1146/annurev-phyto-080614-120324URLPMID:26047566 [本文引用: 1]

Leaf rust of barley is caused by the macrocyclic, heteroecious rust pathogen Puccinia hordei, with aecia reported from selected species of the genera Ornithogalum, Leopoldia, and Dipcadi, and uredinia and telia occurring on Hordeum vulgare, H. vulgare ssp. spontaneum, Hordeum bulbosum, and Hordeum murinum, on which distinct parasitic specialization occurs. Although Puccinia hordei is sporadic in its occurrence, it is probably the most common and widely distributed rust disease of barley. Leaf rust has increased in importance in recent decades in temperate barley-growing regions, presumably because of more intensive agricultural practices. Although total crop loss does not occur, under epidemic conditions yield reductions of up to 62% have been reported in susceptible varieties. Leaf rust is primarily controlled by the use of resistant cultivars, and, to date, 21 seedling resistance genes and two adult plant resistance (APR) genes have been identified. Virulence has been detected for most seedling resistance genes but is unknown for the APR genes Rph20 and Rph23. Other potentially new sources of APR have been reported, and additivity has been described for some of these resistances. Approaches to achieving durable resistance to leaf rust in barley are discussed.
DOI:10.1023/A:1015601731446URL [本文引用: 1]
DOI:10.1038/s41477-019-0545-2URL [本文引用: 2]
NY/T 1443-2007小麦抗病虫性评价技术规范
1
2007
... 大麦(Hordeum vulgare)叶锈病是由大麦叶锈菌(Puccinia hordei)引起的一种真菌病害, 被认为是当前栽培大麦最重要的病害(
1
1985
... 大麦(Hordeum vulgare)叶锈病是由大麦叶锈菌(Puccinia hordei)引起的一种真菌病害, 被认为是当前栽培大麦最重要的病害(
Failure of haustorial development as a factor in slow growth and development of Puccinia hordei in partially resistant barley seedlings
1
1986
... 大麦(Hordeum vulgare)叶锈病是由大麦叶锈菌(Puccinia hordei)引起的一种真菌病害, 被认为是当前栽培大麦最重要的病害(
Breeding Crops with Resistance to Diseases and Pests.
1
2011
... 繁菌苗和感病对照大麦(Hordeum vulgare L.)品种均为L94.待鉴定大麦材料包括Vada、Vada-rphq4、L94- Rphq4、L94-Rphq2、182Q20和Golden Promise.大麦叶锈菌菌种为Puccinia hordei 1.2.1 (
Quantitative resistance to biotrophic filamentous plant pathogens: concepts, misconceptions, and mechanisms
1
2015
... 大麦(Hordeum vulgare)叶锈病是由大麦叶锈菌(Puccinia hordei)引起的一种真菌病害, 被认为是当前栽培大麦最重要的病害(
Leaf rust of cultivated barley: pathology and control
1
2015
... 大麦(Hordeum vulgare)叶锈病是由大麦叶锈菌(Puccinia hordei)引起的一种真菌病害, 被认为是当前栽培大麦最重要的病害(
Durability of resistance against fungal, bacterial and viral pathogens; present situation
1
2002
... 大麦(Hordeum vulgare)叶锈病是由大麦叶锈菌(Puccinia hordei)引起的一种真菌病害, 被认为是当前栽培大麦最重要的病害(
Orthologous receptor kinases quantitatively affect the host status of barley to leaf rust fungi
2
2019
... 繁菌苗和感病对照大麦(Hordeum vulgare L.)品种均为L94.待鉴定大麦材料包括Vada、Vada-rphq4、L94- Rphq4、L94-Rphq2、182Q20和Golden Promise.大麦叶锈菌菌种为Puccinia hordei 1.2.1 (
... 潜伏期为50%的夏孢子堆长出所用的小时数(
