马路 ,
方媛 ,
肖飒清 ,
周纯 ,
金哲伦 ,
叶雯澜 ,
饶玉春 * , 浙江师范大学化学与生命科学学院, 金华 321004
Ma Lu ,
Fang Yuan ,
Xiao Saqing ,
Zhou Chun ,
Jin Zhelun ,
Ye Wenlan ,
Rao Yuchun * , College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China 引用本文 马路 ,
方媛 ,
肖飒清 ,
周纯 ,
金哲伦 ,
叶雯澜 ,
饶玉春 . 水稻条斑病抗性QTL的挖掘及相关基因的表达. 植物学报, 2018, 53(4): 468-476
贡献者
* 通讯作者。E-mail: ryc@zjnu.cn 基金资助
国家转基因重大科技专项(No.2016ZX08009003003-008)、浙江省自然科学基金(No.LY16C130001)、浙江省育才工程(No.2017YCGC008)和浙江省大学生科技创新活动计划(新苗计划) ;
接受日期:2017-12-18接受日期:2018-02-22网络出版日期:2018-07-1
-->Copyright
2018《植物学报》编辑部
Contributors
* Author for correspondence. E-mail: ryc@zjnu.cn History
Received :
Accepted :
Online :
摘要: 条斑病是水稻(Oryza sativa )中的常见病害, 已经对我国粮食的高产稳产造成严重威胁。以典型籼稻台中本地1号与粳稻春江06的杂交F1 代花药培养双单倍体群体(DH)为材料, 用Xoc BLS256进行人工接菌, 对双亲及群体各株系的病斑长度进行测量和量化分析; 同时利用该群体业已构建的加密遗传图谱对病斑表型数据进行QTL作图分析。结果在水稻第2、4、5和8号染色体上共检测到4个效应值能区分开的QTL。对2号与5号染色体上2个较大的QTL区间内抗条斑病相关基因进行了表达分析, 结果表明这些基因在处理前后出现了不同程度的表达差异, 暗示这些基因可能是响应春江06与台中本地1号条斑病抗性差异的目标基因。研究结果为进一步克隆水稻条斑病抗性QTL奠定了重要基础。 关键词 :
条斑病 ;
QTL分析 ;
抗性 ;
水稻 Abstract :
Bacterial leaf streak (BLS) is a common disease in rice and a serious threat to the high and stable production of China’s grain. We used a pair of typical indica TN1 and japonica CJ06 double haploid (DH) rice and inoculated them with Xoc BLS256, then measured and quantified the length of diseased plaques of parents and next generations. We used the molecular linkage map of this population for quantitative trait loci (QTL) mapping analysis. We found 4 QTLs that were able to distinguish the effect values located on chromosomes 2, 4, 5 and 8. We analyzed the expression of genes resistant to BLS in two large QTL intervals on chromosomes 2 and 5 and found that these genes had different degrees of expression before and after treatment. These genes might be the target genes responding to the difference in resistance to BLS of TN1 and CJ06. The results of this study lay a solid foundation for further cloning QTL for resistance to rice BLS. Key words :
bacterial leaf streak ;
QTL analysis ;
resistance ;
rice 水稻(
Oryza sativa ), 禾本科稻属, 一年生单子叶植物, 是世界主要粮食作物之一, 全世界将近一半人口都以之为主食, 其对民生的重要性不言而喻。细菌性条斑病(
Xanthomonas oryzae pv.
oryzicola )是水稻常见病害。1918年, 在菲律宾发现该病, 目前在东南亚各国和亚洲中部稻区都有发生。1953年, 该病在我国珠江三角洲发生, 之后在南方水稻产区区域性和间歇性暴发成灾。近年来, 水稻条斑病在长江流域杂交晚稻上亦有大面积发生, 已成为华南和中南稻区的主要细菌病害(
张荣胜等, 2014 ), 严重时可造成40%-60%产量损失, 已经成为制约我国水稻优质高产的重要障碍(
徐建龙等, 1996 ;
Niñoliu et al., 2006 )。
水稻条斑病症状十分明显。田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落。随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 )。而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 )。引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 )。
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜。在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 )。我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 )。植物病原菌对寄主植物的侵染主要依靠各种致病相关因子。已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 )。
自1960年以来, 在抗细菌性条斑病遗传研究方面, 国内外****采用不同的材料和菌株, 得出的结论不尽相同。有****尝试分析抗源BJ1的抗性, 初步认为其抗性受3对独立隐性基因控制(
徐建龙等, 1997 )。Dular和IR36对细菌性条斑病的抗性由1对主效基因控制(
张红生等, 1996 )。
何月秋等(1994) 和
李任华等(1998) 分别对几个杂交水稻恢复系和不育系配组了不同的杂交组合, 并对各个世代抗细菌性条斑病的遗传规律进行了研究, 结果表明杂交稻的抗性取决于恢复系, 抗病恢复系对细菌性条斑病的抗性由1-2对主效基因控制, 抗病对感病为显性。
贺文爱等(2010) 发现DY3、DY17和DY20的抗性由2对隐性抗性基因控制; DY16的抗性由1对隐性抗性基因控制。而
Khush (1977) 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 )。
越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状。
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体。之后, 对水稻条斑病抗性QTL的研究越来越多。
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间。
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb。
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb。
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内。虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离。随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要。我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点。
1 材料与方法1.1 实验材料
1.1.1 亲本及DH群体 利用籼稻(
Oryza sativa L. subsp.
indica )品种台中本地1号(TN1)为母本、粳稻品种春江06 (CJ06)为父本, 对F
1 代花药离体培养, 再经秋水仙素处理, 共获得纯合稳定的二倍体(DH系) 120个株系, 组成DH群体。
1.1.2 水稻条斑病病原菌菌株 水稻条斑病菌BLS256由康奈尔大学Adam Joseph Bogdanove教授提供。
1.2 实验方法
1.2.1 水稻种子的萌发与培养 分别取亲本与各株系的种子50粒, 表面消毒后, 置于水中浸种2天, 期间换水1次。后在37°C培养箱浸种催芽48小时(用毛巾包裹以确保种子湿度), 挑选露白一致的种子进行播种。1个月后, 选择长势一致的水稻亲本及各株系秧苗各20株进行移栽。期间进行常规田间管理。
1.2.2 条斑病菌接种双亲及后代株系 取4°C保存的菌株, 在NA培养基平板上划线培养48小时。挑取平板上的单菌落接种到200 mL的NB培养基上, 于28°C恒温摇床中以每分钟180转振荡培养24小时, 所得菌液用于接菌。在苗期采用针刺法接种条斑病菌。每株选取2-3片生长完全且健康的新叶进行接种, 每叶设2个针刺点。
1.2.3 确定双亲及后代株系的抗性差异 每2天观察接菌的叶片病斑发生情况。接菌2周后每株系选择接菌后无损害(虫害及除条斑病以外的其它病害或机械损伤)叶片, 每叶选取最长病斑测量病斑长度。
1.2.4 QTL定位分析 利用实验室前期构建的分子标记连锁图谱, 对条斑病接菌后的病斑长度数据进行数量性状座位(QTL)区间作图。同时, 计算QTL对条斑病抗性的贡献率和加性效应。QTL的命名遵循
McCouch等(1997) 的原则。
1.2.5 基因表达定量分析 取接种条斑病菌1周和未处理的两亲本叶片, 叶片总RNA的提取按照试剂盒RNeasy Plant Mini Kit (QIAGEN, Cat No.74904)说明书进行; 按照逆转录试剂盒ReverTra Ace® qPCR RT Kit (TOYOBO, Cat No.FSQ-101)说明书反转录成cDNA。根据QTL定位结果, 在第2和5号染色体的区间内, 选取与条斑病抗性相关的基因进行表型分析。利用实时荧光定量PCR (qRT-PCR)方法, 分析各基因在两亲本处理前和处理后的表达差异情况。以
OsActin 作为内参基因, 每个反应做3个平行复孔, 采用2
-ΔΔCt 方法进行相对定量分析。重复3次独立反应。qRT-PCR反应体系: 总体积20 μL, cDNA模板2 μL, SYBR qPCR Mix (TOYOBO) 10 μL, 正反引物(10 μmol∙L
-1 )各0.8 μL, 加ddH
2 O补足至20 μL。qRT-PCR扩增程序: 95°C30秒; 95°C5秒, 55°C10秒, 72°C15秒, 40个循环。所需引物序列见
表1 。采用7500实时PCR体系(Applied Biosystems, Life Technologies), 用Excel和SPSS19.0软件对实验数据进行统计分析, 采用
t 检验比较不同数据间的差异显著性。不同处理组与对照组的基因表达量采用Duncan多重比较法进行差异显著性分析。
表1 Table 1 表1 表1 实时荧光定量PCR的引物序列
Table 1 Primer sequences of quantitative real-time fluorescent PCR
Marker Forward primer (5′-3′) Reverse primer (5′-3′) OsActin1 TGGCATCTCTCAGCACATTCC TGCACAATGGATGGGTCAGA LOC_Os02g10580 GGAGAGAGGCATCGTCAGTC GCCGGAGGAGTAACCAAACA LOC_Os02g11760 GACGGTCTTCCTGCGTACAA CGAGCTCCGCAAATCCATTG LOC_Os02g16250 GTACGGACAGAAGCCCATCAA CACCCCTTCGAGCTACTGC LOC_Os02g16540 GTACGGACAGAAGCCCATCAA CACCCCTTCGAGCTACTGC LOC_Os02g17190 CTGGAGCAACATCTGGCGAA TATGGGCAACCTGAAGGAGG LOC_Os02g18000 CGGGACATTGGAACCCTTCA CAATGCGTCGTGTGATGGTC LOC_Os02g18510 CCCTATGCTTCGACGGGTTT GAGACCCACCAGTTTGTCGT LOC_Os05g44400 TGTGCGAGCCGTATGAACAA AAGGTCTCCTCGCCCATGTA
表1
实时荧光定量PCR的引物序列
Table 1
Primer sequences of quantitative real-time fluorescent PCR
2 结果与讨论2.1 双亲对条斑病的抗性表现接种2周后, 双亲叶片条斑型症状稳定且明显。随机选取长势一致且无损害(条斑病除外)的叶片, 测量病斑长度, 量化表型。结果表明, TN1叶片病斑平均长度为7.60 cm; CJ06叶片病斑平均长度为3.71 cm, 比TN1病斑平均长度短51.15% (
图1 )。双亲病斑平均长度差异明显, 存在条斑病感抗差异。
图1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_1.png <b>图1</b> 水稻双亲对条斑病的抗性差异<br/><b>Figure 1</b> Resistance differences between two parents on bacterial leaf streak in rice Figure 1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_1.png <b>图1</b> 水稻双亲对条斑病的抗性差异<br/><b>Figure 1</b> Resistance differences between two parents on bacterial leaf streak in rice 在新窗口打开 下载 下载原图ZIP 生成PPT 图1
水稻双亲对条斑病的抗性差异
Figure 1
Resistance differences between two parents on bacterial leaf streak in rice
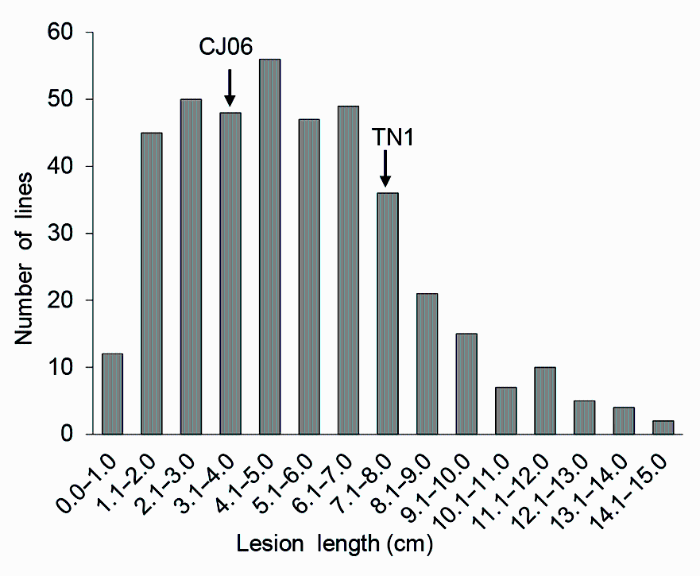
2.2 DH群体抗条斑病的考察接种2周后, 以相同方法测量并统计DH群体叶片病斑长度, 进行抗性量化, 从而系统地考察DH群体的条斑病抗性。统计结果显示, DH群体平均病斑长度为5.02 cm, 介于TN1与CJ06之间, 接种后120个DH株系病斑长度表现为连续正态分布(
图2 ), 且有一定数量的超亲个体存在, 适合QTL区间作图。
图2 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_2.png <b>图2</b> 水稻二倍体(DH)群体对条斑病的抗性分布<br/><b>Figure 2</b> Resistance distribution of double haploid (DH) population to bacterial leaf streak in rice Figure 2 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_2.png <b>图2</b> 水稻二倍体(DH)群体对条斑病的抗性分布<br/><b>Figure 2</b> Resistance distribution of double haploid (DH) population to bacterial leaf streak in rice 在新窗口打开 下载 下载原图ZIP 生成PPT 图2
水稻二倍体(DH)群体对条斑病的抗性分布
Figure 2
Resistance distribution of double haploid (DH) population to bacterial leaf streak in rice
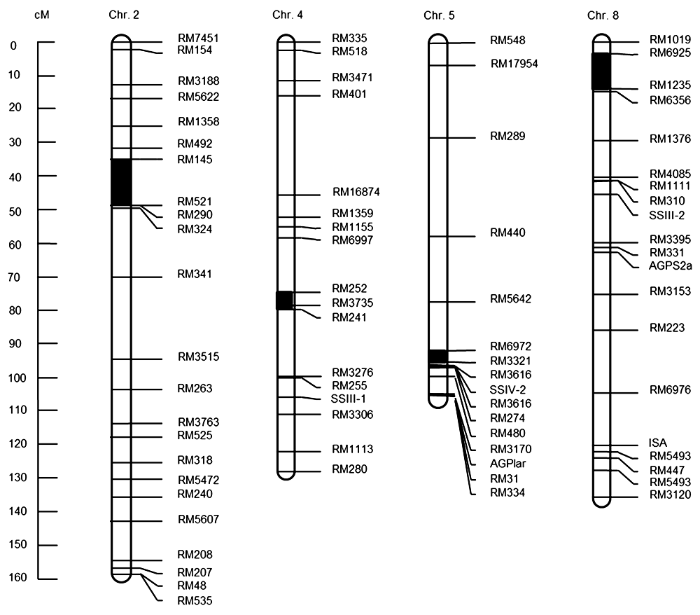
2.3 QTL定位分析利用已构建完成的分子连锁图谱, 我们对接种条斑病菌的DH群体病斑长度数据进行了QTL检测。我们在4个位点检测到效应值能区分开的对应的QTL, 分别分布于水稻第2、4、5和8号染色体上(
表2 ;
图3 )。在第2号染色体RM145-RM521区间内定位到1个包含12个QTLs的簇, 其中贡献率最大的QTL贡献率达19.315 7%。另有1个贡献率较高的QTL位于第5号染色体RM6972-RM3321标记区间内, 其贡献率达18.567 6%。这说明2个QTL区间与抗条斑病调控具有一定的关联。另外, 与抗条斑病相关的QTL分别位于第4号染色体RM252-RM3735标记区间内和第8号染色体RM6925-RM1235标记区间内。
表2 Table 2 表2 表2 水稻二倍体(DH)群体中抗条斑病的QTL区间统计
Table 2 QTL interval statistics of resistance to bacterial leaf streak in rice double haploid (DH) population
Chromosome No. QTL position (cM) Marker interval LOD score Variation explained (%) Additive effect Dominant 2 41.5 RM145-RM521 3.1272 19.2549 -0.1729 2.6315 4 80 RM252-RM241 2.3362 10.1937 -0.3362 1.3523 5 106.6 RM6972-RM3321 2.4984 18.0963 0.18 -1.5646 8 11.5 RM6925-RM1235 2.5792 14.6327 -0.4059 -2.0904
表2
水稻二倍体(DH)群体中抗条斑病的QTL区间统计
Table 2
QTL interval statistics of resistance to bacterial leaf streak in rice double haploid (DH) population
图3 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_3.png <b>图3</b> 水稻二倍体(DH)群体中抗条斑病的QTLs定位<br/><b>Figure 3</b> Location of QTLs for resistance to bacterial leaf streak in rice double haploid (DH) population Figure 3 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_3.png <b>图3</b> 水稻二倍体(DH)群体中抗条斑病的QTLs定位<br/><b>Figure 3</b> Location of QTLs for resistance to bacterial leaf streak in rice double haploid (DH) population 在新窗口打开 下载 下载原图ZIP 生成PPT 图3
水稻二倍体(DH)群体中抗条斑病的QTLs定位
Figure 3
Location of QTLs for resistance to bacterial leaf streak in rice double haploid (DH) population
位于第5号染色体上的2个位点加性效应为正值, 分别为0.094 6和0.18, 表明增强抗性的等位基因来自感病亲本TN1; 其余位点均为负值, 表明增强抗性的等位基因来自抗病亲本CJ06。
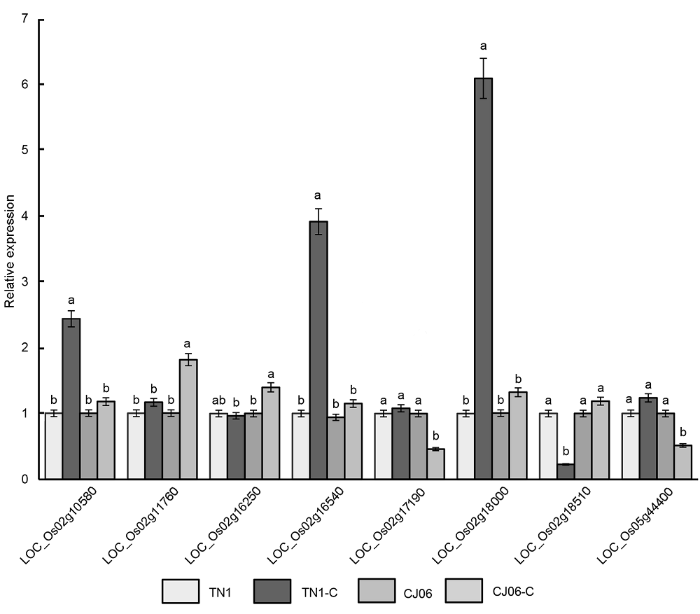
2.4 抗条斑病相关基因的表达分析我们通过水稻基因组注释网站(http://rice.plantbio- logy.msu.edu)对第2和5号染色体上2个贡献率较大的QTLs所在的区间进行候选基因表达分析, 并对可能的基因进行了初步的总结。这些基因包括结构域蛋白、转录因子及抗性蛋白基因等(
表3 )。我们进一步通过实时荧光定量PCR选择性地对这些基因在条斑病菌接种前后的表达进行了对比, 结果(
图4 )显示, 基因
LOC_Os02g11760 、
LOC_Os02g16250 和
LOC_ Os02g18510 在CJ06接菌处理后显著上调表达; 而基因
LOC_Os02g16250 和
LOC_Os02g18510 在接菌处理后下调表达。基因
LOC_Os02g10580 、
LOC_ Os02g18000 和
LOC_Os02g16540 则在TN1接菌处理后显著上调表达, 而CJ06在处理前和处理后上调表达程度不明显。这3个基因在2个品种中表达程度的显著差异说明它们参与调控细菌性条斑病的抗性分子遗传应答。基因
LOC_Os02g17190 和
LOC_Os05- g44400 在CJ06接菌处理后下调表达。
表3 Table 3 表3 表3 检测到的QTL区间内的候选基因
Table 3 Candidate gene in the detected QTL interval
Gene ID Putative function Gene ID Putative function LOC_Os02g10370 hrpN-interacting protein from Malus LOC_Os02g17150 OsSub18-putative subtilisin homologue LOC_Os02g11760 Pleiotropic drug resistance protein LOC_Os02g17190 MYB family transcription factor LOC_Os02g13890 FYVE zinc finger domain containing protein LOC_Os02g17990 Leucine rich repeat family protein LOC_Os02g15160 OsFBX40-F-box domain containing protein LOC_Os02g18000 Disease resistance protein RGA2 LOC_Os02g15280 VQ domain containing protein LOC_Os02g18140 NBS type disease resistance protein LOC_Os02g15594 Protein phosphatase 2C LOC_Os02g18410 Salt stress root protein RS1 LOC_Os02g15870 Molybdenu cofactor biosynthesis protein 1 LOC_Os02g18510 Stripe rust resistance protein Yr10 LOC_Os02g16070 Lr1 disease resistance protein LOC_Os05g43820 Ras-related protein LOC_Os02g16540 WRKY transcription factor LOC_Os05g44550 Zinc finger family protein LOC_Os02g16680 BZIP transcription factor LOC_Os05g44770 Receptor-like protein kinase 5 precursor
表3
检测到的QTL区间内的候选基因
Table 3
Candidate gene in the detected QTL interval
图4 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_4.png <b>图4</b> 抗条斑病相关基因的表达<br/>TN1-C和CJ06-C代表接种过细菌性条斑病病菌。不同小写字母表示差异显著(<i>P</i><0.05)。<br/><b>Figure 4</b> Expression of genes resistant to bacterial leaf streak<br/>TN1-C and CJ06-C represent after inoculated bacterial leaf streak. Different lowercase letters indicate significant differences (<i>P</i><0.05). Figure 4 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-468/img_4.png <b>图4</b> 抗条斑病相关基因的表达<br/>TN1-C和CJ06-C代表接种过细菌性条斑病病菌。不同小写字母表示差异显著(<i>P</i><0.05)。<br/><b>Figure 4</b> Expression of genes resistant to bacterial leaf streak<br/>TN1-C and CJ06-C represent after inoculated bacterial leaf streak. Different lowercase letters indicate significant differences (<i>P</i><0.05). 在新窗口打开 下载 下载原图ZIP 生成PPT 图4
抗条斑病相关基因的表达
TN1-C和CJ06-C代表接种过细菌性条斑病病菌。不同小写字母表示差异显著(
P <0.05)。
Figure 4
Expression of genes resistant to bacterial leaf streak
TN1-C and CJ06-C represent after inoculated bacterial leaf streak. Different lowercase letters indicate significant differences (
P <0.05).
2.5 讨论表达性状易受多种因素的影响, 同一性状的QTL在实验材料、环境及处理时间不同的情况下检测结果也会存在一定的偏差。
郑景生等(2005) 利用籼稻品种明恢86与佳辐占为亲本构建F
2 群体, 应用SSR标记检测到水稻条斑病抗性QTL (标记区间为RM279-RM- 154)。本研究在第2号染色体上定位的效应最大的位点(标记区间RM145-RM521)与
郑景生等(2005) 的定位结果位于相同的染色体区域, 且距离相近, 仅相差几个遗传图距。
陈粟(2002) 利用H359/Acc8558组建RI群体, 通过分离体分组混合分析法检测到条斑病抗性QTL位于第2号染色体的C235A-Xpsr371标记区间, 与本研究结果存在重叠区间。由此可以推断, RM145-RM521之间确实存在1个控制水稻条斑病抗性的主效QTL。
在本研究中, 第5号染色体上条斑病抗性相关的QTL位于RM145-RM521标记区间内。
陈志伟等(2006) 和
韩庆典(2008) 运用抗病近等基因系H359- BLSRSA与轮回感病亲本H359杂交建立了1个较大的F
2 分离群体, 通过选择极端抗病表型个体, 然后验证其F
2:3 抗性的方法, 将位于第5号染色体上对表型变异贡献率最大的QTL定位于RM153-RM159区间。
李丰涛(2010) 则以H359与H359-BLSR5A杂交并自交形成的次级分离群体为材料, 利用CSSL精细定位水稻条斑病抗性QTL
qBLSR5A , 最终将目标定位在RM5816-RM122之间, 物理距离仅为52.7 kb, 该结果与
韩庆典(2008) 的定位结果相吻合。而本研究检测到的抗条斑病QTL与前人的研究区间不重叠, 且物理距离差距较大, 可能是1个全新的QTL。
陈志伟等(2005) 以籼稻品种Acc8558和籼稻品种H359的近基因系H359R为研究对象, 检测到第8号染色体RM506- RM25区间存在抗条斑病QTL。本研究在第8号染色 体上检测到的抗条斑病标记位点(标记区间RM6925-RM1235)与之存在重叠。对第4号染色体上抗条斑病QTL定位的报道不多, 我们继
吴为人等(1998) 的报道后, 又一次用不同的材料在第4号染色体上定位到了抗条斑病区间。
对比近年来的研究结果, 我们发现本研究得到的抗条斑病QTL区间附近存在有关水稻其它耐胁迫的重要性状的QTL(
表4 )。以往文献报道成功定位的QTL, 进一步证实了本研究得到的QTL的价值。
表4 Table 4 表4 表4 候选区域内已报道的抗性QTL
Table 4 Resistant QTL reported in the candidate region
Traits Chr. No. Materials Marker interval LOD score Reference Blast resistance 2 Double haploid population of ZYQ8/ JX17 CT87-G1234 5.11 Xu et al., 2004 Grain density 2 F3 population derived from the cross RM12729-RM324 3.33 Han et al., 2017 Spike grain number 2 F3 population derived from the cross RM12729-RM324 4.74 Han et al., 2017 Bacterial blight resistance 4 Lemont/Teqing cross introgression lines (ILs) RM119-RM252 3.56 Zhou et al., 2012
表4
候选区域内已报道的抗性QTL
Table 4
Resistant QTL reported in the candidate region
根据水稻基因组数据库(http://rice.plantbiology. msu.edu/)的信息,
LOC_Os02g16540 属于WRKY转录因子家族基因;
LOC_Os02g17190 属于MYB转录因子家族基因;
LOC_Os02g18510 属于抗条锈病基因;
LOC_Os02g16250 编码NBS-LRR抗性蛋白;
LOC_Os05g44400 编码GATA锌指结构域蛋白;
LOC_Os02g10580 编码含NB-ARC结构域的抗性蛋白;
LOC_Os02g11760 编码多效耐药蛋白;
LOC_ Os02g18000 编码RGA2抗性蛋白(
表3 )。
水稻WRKY转录因子直接或间接调控抗逆、氧化损伤及衰老等相关基因的表达, 在水稻的非生物胁迫反应中发挥重要作用(
陈思雀等, 2017 ;
张凡等, 2018 )。研究表明, 水稻转录因子OsWRKY45的表达下调可降低水杨酸(SA)对真菌和细菌病原体抗性的诱导, 而其过表达对2种病原体都具有强烈的抗性, 表明其对SA诱导的抗病性具有重要作用(
Nakayama et al., 2013 )。敲除
WRKY22 的转基因水稻对稻瘟病菌的感病性增强, 而过表达
WRKY22 基因则可增强水稻的抗病性, 说明
WRKY22 是水稻抗稻瘟病正调控因子(
Cheng and Wang, 2014 )。包含NB-ARC保守结构域的NBS-LRR类蛋白质在植物体的超敏反应中发挥重要作用。
赵婷婷(2012) 发现含NB-ARC保守结构域的
OsPDRH9N 基因超量表达转基因植株对
Xoc 的侵染更具敏感性。
定量分析结果表明, 接菌处理后WRKY转录因子基因
LOC_Os02g16540 、RGA2抗性蛋白基因
LOC_Os02g18000 和NB-ARC抗性蛋白基因
LOC_ Os02g10580 在2个不同抗性的亲本中都出现了上调表达。抗条锈病基因
LOC_Os02g18510 在2种不同抗性亲本中却表现出相反的表达模式, 即在感病亲本TN1接菌处理后发生了较为显著的下调表达。而多效耐药蛋白基因
LOC_Os02g11760 则在抗病亲本CJ06接菌处理后显著上调表达。因此, 我们推测这5个基因极有可能参与水稻条斑病抗性调控。但是WRKY转录因子基因、RGA2抗性蛋白基因、NB-ARC抗性蛋白基因、抗条锈病基因和多效耐药蛋白基因在调控条斑病抗性的功能中发挥何种作用还需要进一步验证。
The authors have declared that no competing interests exist. 参考文献 文献选项 原文顺序 文献年度倒序 文中引用次数倒序 被引期刊影响因子 [1] 曹金良 , 陈志伟 , 林德塨 , 吴为人 , 谢小芳 (2014 ). 通过构建单染色体片段代换系验证水稻细菌性条斑病抗性QTL qBlsr3d . 分子植物育种 12, 416 -420 .[2] 陈思雀 , 翁群清 , 曹红瑞 , 孙立新 (2017 ). WRKY转录因子在生物和非生物胁迫中的功能和调控机理的研究进展. 农业生物技术学报 25, 668 -682 .[3] 陈粟 (2002 ). 利用SSR标记定位水稻细条病抗性QTL. 硕士论文 . 福州: 福建农林大学. pp. 1 .[4] 陈志伟 , 景艳军 , 李小辉 , 周元昌 , 刁志娟 , 李生平 , 吴为人 (2006 ). 水稻细条病抗性QTL qBlsr5a 的验证和更精确定位. 福建农林大学学报(自然科学版) 35, 619 -622 .[5] 陈志伟 , 吴为人 , 景艳军 , 周元昌 (2005 ). 利用近等基因系验证水稻细菌性条斑病抗性QTL. 福建农林大学学报(自然科学版) 34, 273 -277 .[6] 郭威 (2011 ). 水稻条斑病菌致病相关基因的鉴定与功能研究. 博士论文 . 南京: 南京农业大学. pp. 1 .[7] 韩保林 , 顾朝剑 , 张洪凯 , 廖泳祥 , 彭永彬 , 张红宇 , 徐培洲 , 陈晓琼 , 吴先军 (2017 ). 水稻穗部性状的QTL定位及上位性分析. 分子植物育种 15, 2218 -2227 .[8] 韩庆典 (2008 ). 水稻细菌性条斑病抗性QTL qBlsr5a 的精细定位及候选基因的表达分析. 博士论文 . 福州: 福建农林大学. pp. 1 .[9] 贺文爱 , 黄大辉 , 刘驰 , 岑贞陆 , 张月雄 , 马增风 , 陈英之 , 卢双楠 , 刘开勇 , 武波 , 李容柏 (2010 ). 普通野生稻抗源对细菌性条斑病的抗性遗传分析. 植物病理学报 40, 180 -185 .[10] 何月秋 , 文艳华 , 黄瑞荣 , 曾小萍 (1994 ). 杂交水稻对细菌性条斑病抗性遗传研究. 江西农业大学学报 16, 62 -65 .[11] 黄大辉 , 秦钢 , 马增凤 , 刘驰 , 罗同平 , 张月雄 , 岑贞陆 (2016 ). 水稻抗细菌性条斑病主效基因BLS1 位点的分子标记及其应用. 中国专利, CN106011287A . 2016-10-12.[12] 李丰涛 (2010 ). 利用CSSL精细定位水稻细菌性条斑病抗性QTL qBLSR5A . 硕士论文 . 福州: 福建农林大学. pp. 1 -57 .[13] 李任华 , 徐才国 , 何予卿 , 袁隆平 , 王象坤 (1998 ). 水稻亲本遗传分化程度与籼粳杂种优势的关系. 作物学报 24, 564 -576 .[14] 刘姮 , 李雪琴 (2011 ). 水稻细菌性条斑病的研究概述. 湖北植保 (5 ), 51 -54 .[15] 王公金 , 朱献玳 , 诸葛龙 , 谢关林 (1993 ). 应用液相酶联法研究水稻细菌性条斑病菌感染途径及在植株内的分布. 江苏农业学报 9(2 ), 51 -52 .[16] 温志杰 (2013 ). 水稻细菌性条斑病菌的相关研究. 大众科技 15(167 ), 130 -131, 134 .[17] 吴为人 , 唐定中 , 李维明 , 卢浩然 , Worland AJ 1998 ). 水稻细菌性条斑病抗性基因定位. 高技术通讯 8(7 ), 47 -50 .[18] 徐吉臣 , 王久林 , 凌忠专 , 朱立煌 (2004 ). 利用QTL定位分析水稻的稻瘟病抗性基因. 科学通报 49, 245 -251 .[19] 徐建龙 , 林贻滋 , 翁锦屏 , 赵新立 (1996 ). 水稻白叶枯病抗性基因的聚合及其遗传效应. 遗传学报 23, 129 -134 .[20] 徐建龙 , 王汉荣 , 林贻滋 , 奚永安 (1997 ). 水稻细菌性条斑病和白叶枯病抗性遗传研究. 遗传学报 24, 330 -335 .[21] 张凡 , 尹俊龙 , 郭瑛琪 , 岳艳玲 (2018 ). WRKY转录因子的研究进展. 生物技术通报 34(1 ), 40 -48 .[22] 张红生 , 陆志强 , 朱立宏 (1996 ). 四个籼稻品种对细菌性条斑病的抗性遗传研究. 中国水稻科学 10, 193 -196 .[23] 张荣胜 (2012 ). 水稻细菌性条斑病菌遗传多样性研究与生防菌剂研发. 博士论文 . 南京: 南京农业大学. pp. 1 -2 .[24] 张荣胜 , 陈志谊 , 刘永锋 (2014 ). 水稻细菌性条斑病研究进展. 江苏农业学报 30, 901 -908 .[25] 赵婷婷 (2012 ). 具有NB-ARC结构域的OsPDRH9N蛋白质功能鉴定及其在逆境响应中的表达分析. 硕士论文 . 厦门: 厦门大学. pp. 2 .[26] 郑景生 , 李义珍 , 方宣钧 (2005 ). 水稻第2染色体上细菌性条斑病抗性QTL的检测. 中国农业科学 38, 1923 -1925 .[27] Cheng HT Wang SP 2014 ). WRKY-type transcription factors: a significant factor in rice-pathogen interactions.Sci Sin 44, 784 -793 .[28] Khan MSK Saeed M Iqbal J 2016 ). Quantitative trait locus mapping for salt tolerance at maturity stage in indica rice using replicated F2 population.Braz J Bot 39, 641 -650 .[29] Khush GS 1977 ). The Genetic Basis of Epidemics in Agriculture (Day Red) . New York: Academy of Sciences. pp. 296 -308 .[30] McCouch SR Cho YG Yano M Paul E Blinstrub M Morishima H Kinoshita T 1997 ). Report on QTL nomenclature.Rice Genet Newsl 14, 11 -13 .[31] Nakayama A Fukushima S Goto S Matsushita A Shimono M Sugano S Jiang CJ Akagi A Yamazaki M Inoue H Takatsuji H 2013 ). Genome-wide identification of WRKY45-regulated genes that mediate benzothiadiazole-induced defense responses in rice.BMC Plant Biol 13, 150 .[32] Niño-Liu DO Ronald PC Bogdanove AJ 2006 ). Xanthomonas oryzae pathovars: model pathogens of a model crop. Mol Plant Pathol 303 -324 .[33] Swings J van den Vanden M Vauterin L Hoste B Gillis M Mew TW Kersters K 1990 ). Reclassification of the causal agents of bacterial blight (Xanthomonas campestris pv. oryzae ) and bacterial leaf streak(Xanthomonas cam- pestris pv. oryzicola ) of rice AS pathovars of Xanthomonas oryzae (ex Ishiyama 1922) sp. nov., nom. rev. Int J Syst Baeteriol 309 -311 .[34] Tang D Wu W Li W Lu H Worland AJ 2000 ). Mapping of QTLs conferring resistance to bacterial leaf streak in rice.Theor Appl Genet 101, 286 -291 .[35] Yuan GQ Chen YY Li FJ Zhou RJ Li QQ Lin W Huang LH 2017 ). Isolation of an antibacterial substance from Mahonia fortunei and its biological activity against Xanthomonas oryzae pv. oryzicola . J Phytopathol 289 -296 .[36] Zhou YL Xie XW Xu MR Zang JP Zhu LH Xu JL Li ZK 2012 ). Genetic overlap in the quantitative resistance of rice at the seedling and adult stages to Xanthomonas ory- zae pv. oryzae . J Plant Biol 102 -113 .
通过构建单染色体片段代换系验证水稻细菌性条斑病抗性QTL
qBlsr3d 1
2014
... 越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状.
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体.之后, 对水稻条斑病抗性QTL的研究越来越多.
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间.
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb.
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb.
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内.虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离.随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要.我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点. ...
WRKY转录因子在生物和非生物胁迫中的功能和调控机理的研究进展
1
2017
... 水稻WRKY转录因子直接或间接调控抗逆、氧化损伤及衰老等相关基因的表达, 在水稻的非生物胁迫反应中发挥重要作用(
陈思雀等, 2017 ;
张凡等, 2018 ).研究表明, 水稻转录因子OsWRKY45的表达下调可降低水杨酸(SA)对真菌和细菌病原体抗性的诱导, 而其过表达对2种病原体都具有强烈的抗性, 表明其对SA诱导的抗病性具有重要作用(
Nakayama et al., 2013 ).敲除
WRKY22 的转基因水稻对稻瘟病菌的感病性增强, 而过表达
WRKY22 基因则可增强水稻的抗病性, 说明
WRKY22 是水稻抗稻瘟病正调控因子(
Cheng and Wang, 2014 ).包含NB-ARC保守结构域的NBS-LRR类蛋白质在植物体的超敏反应中发挥重要作用.
赵婷婷(2012) 发现含NB-ARC保守结构域的
OsPDRH9N 基因超量表达转基因植株对
Xoc 的侵染更具敏感性. ...
1
2002
... 表达性状易受多种因素的影响, 同一性状的QTL在实验材料、环境及处理时间不同的情况下检测结果也会存在一定的偏差.
郑景生等(2005) 利用籼稻品种明恢86与佳辐占为亲本构建F
2 群体, 应用SSR标记检测到水稻条斑病抗性QTL (标记区间为RM279-RM- 154).本研究在第2号染色体上定位的效应最大的位点(标记区间RM145-RM521)与
郑景生等(2005) 的定位结果位于相同的染色体区域, 且距离相近, 仅相差几个遗传图距.
陈粟(2002) 利用H359/Acc8558组建RI群体, 通过分离体分组混合分析法检测到条斑病抗性QTL位于第2号染色体的C235A-Xpsr371标记区间, 与本研究结果存在重叠区间.由此可以推断, RM145-RM521之间确实存在1个控制水稻条斑病抗性的主效QTL. ...
水稻细条病抗性QTL
qBlsr5a 的验证和更精确定位
1
2006
... 在本研究中, 第5号染色体上条斑病抗性相关的QTL位于RM145-RM521标记区间内.
陈志伟等(2006) 和
韩庆典(2008) 运用抗病近等基因系H359- BLSRSA与轮回感病亲本H359杂交建立了1个较大的F
2 分离群体, 通过选择极端抗病表型个体, 然后验证其F
2:3 抗性的方法, 将位于第5号染色体上对表型变异贡献率最大的QTL定位于RM153-RM159区间.
李丰涛(2010) 则以H359与H359-BLSR5A杂交并自交形成的次级分离群体为材料, 利用CSSL精细定位水稻条斑病抗性QTL
qBLSR5A , 最终将目标定位在RM5816-RM122之间, 物理距离仅为52.7 kb, 该结果与
韩庆典(2008) 的定位结果相吻合.而本研究检测到的抗条斑病QTL与前人的研究区间不重叠, 且物理距离差距较大, 可能是1个全新的QTL.
陈志伟等(2005) 以籼稻品种Acc8558和籼稻品种H359的近基因系H359R为研究对象, 检测到第8号染色体RM506- RM25区间存在抗条斑病QTL.本研究在第8号染色 体上检测到的抗条斑病标记位点(标记区间RM6925-RM1235)与之存在重叠.对第4号染色体上抗条斑病QTL定位的报道不多, 我们继
吴为人等(1998) 的报道后, 又一次用不同的材料在第4号染色体上定位到了抗条斑病区间. ...
利用近等基因系验证水稻细菌性条斑病抗性QTL
1
2005
... 在本研究中, 第5号染色体上条斑病抗性相关的QTL位于RM145-RM521标记区间内.
陈志伟等(2006) 和
韩庆典(2008) 运用抗病近等基因系H359- BLSRSA与轮回感病亲本H359杂交建立了1个较大的F
2 分离群体, 通过选择极端抗病表型个体, 然后验证其F
2:3 抗性的方法, 将位于第5号染色体上对表型变异贡献率最大的QTL定位于RM153-RM159区间.
李丰涛(2010) 则以H359与H359-BLSR5A杂交并自交形成的次级分离群体为材料, 利用CSSL精细定位水稻条斑病抗性QTL
qBLSR5A , 最终将目标定位在RM5816-RM122之间, 物理距离仅为52.7 kb, 该结果与
韩庆典(2008) 的定位结果相吻合.而本研究检测到的抗条斑病QTL与前人的研究区间不重叠, 且物理距离差距较大, 可能是1个全新的QTL.
陈志伟等(2005) 以籼稻品种Acc8558和籼稻品种H359的近基因系H359R为研究对象, 检测到第8号染色体RM506- RM25区间存在抗条斑病QTL.本研究在第8号染色 体上检测到的抗条斑病标记位点(标记区间RM6925-RM1235)与之存在重叠.对第4号染色体上抗条斑病QTL定位的报道不多, 我们继
吴为人等(1998) 的报道后, 又一次用不同的材料在第4号染色体上定位到了抗条斑病区间. ...
1
2011
... 水稻条斑病症状十分明显.田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落.随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 ).而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 ).引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 ).
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜.在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 ).我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 ).植物病原菌对寄主植物的侵染主要依靠各种致病相关因子.已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 ). ...
水稻穗部性状的QTL定位及上位性分析
0
2017
2
2008
... 在本研究中, 第5号染色体上条斑病抗性相关的QTL位于RM145-RM521标记区间内.
陈志伟等(2006) 和
韩庆典(2008) 运用抗病近等基因系H359- BLSRSA与轮回感病亲本H359杂交建立了1个较大的F
2 分离群体, 通过选择极端抗病表型个体, 然后验证其F
2:3 抗性的方法, 将位于第5号染色体上对表型变异贡献率最大的QTL定位于RM153-RM159区间.
李丰涛(2010) 则以H359与H359-BLSR5A杂交并自交形成的次级分离群体为材料, 利用CSSL精细定位水稻条斑病抗性QTL
qBLSR5A , 最终将目标定位在RM5816-RM122之间, 物理距离仅为52.7 kb, 该结果与
韩庆典(2008) 的定位结果相吻合.而本研究检测到的抗条斑病QTL与前人的研究区间不重叠, 且物理距离差距较大, 可能是1个全新的QTL.
陈志伟等(2005) 以籼稻品种Acc8558和籼稻品种H359的近基因系H359R为研究对象, 检测到第8号染色体RM506- RM25区间存在抗条斑病QTL.本研究在第8号染色 体上检测到的抗条斑病标记位点(标记区间RM6925-RM1235)与之存在重叠.对第4号染色体上抗条斑病QTL定位的报道不多, 我们继
吴为人等(1998) 的报道后, 又一次用不同的材料在第4号染色体上定位到了抗条斑病区间. ...
... , 最终将目标定位在RM5816-RM122之间, 物理距离仅为52.7 kb, 该结果与
韩庆典(2008) 的定位结果相吻合.而本研究检测到的抗条斑病QTL与前人的研究区间不重叠, 且物理距离差距较大, 可能是1个全新的QTL.
陈志伟等(2005) 以籼稻品种Acc8558和籼稻品种H359的近基因系H359R为研究对象, 检测到第8号染色体RM506- RM25区间存在抗条斑病QTL.本研究在第8号染色 体上检测到的抗条斑病标记位点(标记区间RM6925-RM1235)与之存在重叠.对第4号染色体上抗条斑病QTL定位的报道不多, 我们继
吴为人等(1998) 的报道后, 又一次用不同的材料在第4号染色体上定位到了抗条斑病区间. ...
普通野生稻抗源对细菌性条斑病的抗性遗传分析
2
2010
... 自1960年以来, 在抗细菌性条斑病遗传研究方面, 国内外****采用不同的材料和菌株, 得出的结论不尽相同.有****尝试分析抗源BJ1的抗性, 初步认为其抗性受3对独立隐性基因控制(
徐建龙等, 1997 ).Dular和IR36对细菌性条斑病的抗性由1对主效基因控制(
张红生等, 1996 ).
何月秋等(1994) 和
李任华等(1998) 分别对几个杂交水稻恢复系和不育系配组了不同的杂交组合, 并对各个世代抗细菌性条斑病的遗传规律进行了研究, 结果表明杂交稻的抗性取决于恢复系, 抗病恢复系对细菌性条斑病的抗性由1-2对主效基因控制, 抗病对感病为显性.
贺文爱等(2010) 发现DY3、DY17和DY20的抗性由2对隐性抗性基因控制; DY16的抗性由1对隐性抗性基因控制.而
Khush (1977) 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 ). ...
... 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 ). ...
杂交水稻对细菌性条斑病抗性遗传研究
1
1994
... 自1960年以来, 在抗细菌性条斑病遗传研究方面, 国内外****采用不同的材料和菌株, 得出的结论不尽相同.有****尝试分析抗源BJ1的抗性, 初步认为其抗性受3对独立隐性基因控制(
徐建龙等, 1997 ).Dular和IR36对细菌性条斑病的抗性由1对主效基因控制(
张红生等, 1996 ).
何月秋等(1994) 和
李任华等(1998) 分别对几个杂交水稻恢复系和不育系配组了不同的杂交组合, 并对各个世代抗细菌性条斑病的遗传规律进行了研究, 结果表明杂交稻的抗性取决于恢复系, 抗病恢复系对细菌性条斑病的抗性由1-2对主效基因控制, 抗病对感病为显性.
贺文爱等(2010) 发现DY3、DY17和DY20的抗性由2对隐性抗性基因控制; DY16的抗性由1对隐性抗性基因控制.而
Khush (1977) 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 ). ...
水稻抗细菌性条斑病主效基因
BLS1 位点的分子标记及其应用
1
2016
... 越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状.
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体.之后, 对水稻条斑病抗性QTL的研究越来越多.
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间.
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb.
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb.
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内.虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离.随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要.我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点. ...
2
2010
... 越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状.
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体.之后, 对水稻条斑病抗性QTL的研究越来越多.
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间.
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb.
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb.
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内.虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离.随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要.我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点. ...
... 在本研究中, 第5号染色体上条斑病抗性相关的QTL位于RM145-RM521标记区间内.
陈志伟等(2006) 和
韩庆典(2008) 运用抗病近等基因系H359- BLSRSA与轮回感病亲本H359杂交建立了1个较大的F
2 分离群体, 通过选择极端抗病表型个体, 然后验证其F
2:3 抗性的方法, 将位于第5号染色体上对表型变异贡献率最大的QTL定位于RM153-RM159区间.
李丰涛(2010) 则以H359与H359-BLSR5A杂交并自交形成的次级分离群体为材料, 利用CSSL精细定位水稻条斑病抗性QTL
qBLSR5A , 最终将目标定位在RM5816-RM122之间, 物理距离仅为52.7 kb, 该结果与
韩庆典(2008) 的定位结果相吻合.而本研究检测到的抗条斑病QTL与前人的研究区间不重叠, 且物理距离差距较大, 可能是1个全新的QTL.
陈志伟等(2005) 以籼稻品种Acc8558和籼稻品种H359的近基因系H359R为研究对象, 检测到第8号染色体RM506- RM25区间存在抗条斑病QTL.本研究在第8号染色 体上检测到的抗条斑病标记位点(标记区间RM6925-RM1235)与之存在重叠.对第4号染色体上抗条斑病QTL定位的报道不多, 我们继
吴为人等(1998) 的报道后, 又一次用不同的材料在第4号染色体上定位到了抗条斑病区间. ...
水稻亲本遗传分化程度与籼粳杂种优势的关系
1
1998
... 自1960年以来, 在抗细菌性条斑病遗传研究方面, 国内外****采用不同的材料和菌株, 得出的结论不尽相同.有****尝试分析抗源BJ1的抗性, 初步认为其抗性受3对独立隐性基因控制(
徐建龙等, 1997 ).Dular和IR36对细菌性条斑病的抗性由1对主效基因控制(
张红生等, 1996 ).
何月秋等(1994) 和
李任华等(1998) 分别对几个杂交水稻恢复系和不育系配组了不同的杂交组合, 并对各个世代抗细菌性条斑病的遗传规律进行了研究, 结果表明杂交稻的抗性取决于恢复系, 抗病恢复系对细菌性条斑病的抗性由1-2对主效基因控制, 抗病对感病为显性.
贺文爱等(2010) 发现DY3、DY17和DY20的抗性由2对隐性抗性基因控制; DY16的抗性由1对隐性抗性基因控制.而
Khush (1977) 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 ). ...
水稻细菌性条斑病的研究概述
1
2011
... 水稻条斑病症状十分明显.田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落.随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 ).而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 ).引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 ).
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜.在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 ).我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 ).植物病原菌对寄主植物的侵染主要依靠各种致病相关因子.已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 ). ...
应用液相酶联法研究水稻细菌性条斑病菌感染途径及在植株内的分布
1
1993
... 水稻条斑病症状十分明显.田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落.随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 ).而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 ).引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 ).
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜.在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 ).我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 ).植物病原菌对寄主植物的侵染主要依靠各种致病相关因子.已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 ). ...
水稻细菌性条斑病菌的相关研究
1
2013
... 水稻条斑病症状十分明显.田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落.随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 ).而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 ).引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 ).
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜.在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 ).我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 ).植物病原菌对寄主植物的侵染主要依靠各种致病相关因子.已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 ). ...
水稻细菌性条斑病抗性基因定位
2
1998
... 越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状.
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体.之后, 对水稻条斑病抗性QTL的研究越来越多.
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间.
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb.
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb.
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内.虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离.随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要.我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点. ...
... 在本研究中, 第5号染色体上条斑病抗性相关的QTL位于RM145-RM521标记区间内.
陈志伟等(2006) 和
韩庆典(2008) 运用抗病近等基因系H359- BLSRSA与轮回感病亲本H359杂交建立了1个较大的F
2 分离群体, 通过选择极端抗病表型个体, 然后验证其F
2:3 抗性的方法, 将位于第5号染色体上对表型变异贡献率最大的QTL定位于RM153-RM159区间.
李丰涛(2010) 则以H359与H359-BLSR5A杂交并自交形成的次级分离群体为材料, 利用CSSL精细定位水稻条斑病抗性QTL
qBLSR5A , 最终将目标定位在RM5816-RM122之间, 物理距离仅为52.7 kb, 该结果与
韩庆典(2008) 的定位结果相吻合.而本研究检测到的抗条斑病QTL与前人的研究区间不重叠, 且物理距离差距较大, 可能是1个全新的QTL.
陈志伟等(2005) 以籼稻品种Acc8558和籼稻品种H359的近基因系H359R为研究对象, 检测到第8号染色体RM506- RM25区间存在抗条斑病QTL.本研究在第8号染色 体上检测到的抗条斑病标记位点(标记区间RM6925-RM1235)与之存在重叠.对第4号染色体上抗条斑病QTL定位的报道不多, 我们继
吴为人等(1998) 的报道后, 又一次用不同的材料在第4号染色体上定位到了抗条斑病区间. ...
利用QTL定位分析水稻的稻瘟病抗性基因
0
2004
水稻白叶枯病抗性基因的聚合及其遗传效应
1
1996
... 水稻(
Oryza sativa ), 禾本科稻属, 一年生单子叶植物, 是世界主要粮食作物之一, 全世界将近一半人口都以之为主食, 其对民生的重要性不言而喻.细菌性条斑病(
Xanthomonas oryzae pv.
oryzicola )是水稻常见病害.1918年, 在菲律宾发现该病, 目前在东南亚各国和亚洲中部稻区都有发生.1953年, 该病在我国珠江三角洲发生, 之后在南方水稻产区区域性和间歇性暴发成灾.近年来, 水稻条斑病在长江流域杂交晚稻上亦有大面积发生, 已成为华南和中南稻区的主要细菌病害(
张荣胜等, 2014 ), 严重时可造成40%-60%产量损失, 已经成为制约我国水稻优质高产的重要障碍(
徐建龙等, 1996 ;
Niñoliu et al., 2006 ). ...
水稻细菌性条斑病和白叶枯病抗性遗传研究
1
1997
... 自1960年以来, 在抗细菌性条斑病遗传研究方面, 国内外****采用不同的材料和菌株, 得出的结论不尽相同.有****尝试分析抗源BJ1的抗性, 初步认为其抗性受3对独立隐性基因控制(
徐建龙等, 1997 ).Dular和IR36对细菌性条斑病的抗性由1对主效基因控制(
张红生等, 1996 ).
何月秋等(1994) 和
李任华等(1998) 分别对几个杂交水稻恢复系和不育系配组了不同的杂交组合, 并对各个世代抗细菌性条斑病的遗传规律进行了研究, 结果表明杂交稻的抗性取决于恢复系, 抗病恢复系对细菌性条斑病的抗性由1-2对主效基因控制, 抗病对感病为显性.
贺文爱等(2010) 发现DY3、DY17和DY20的抗性由2对隐性抗性基因控制; DY16的抗性由1对隐性抗性基因控制.而
Khush (1977) 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 ). ...
WRKY转录因子的研究进展
1
2018
... 水稻WRKY转录因子直接或间接调控抗逆、氧化损伤及衰老等相关基因的表达, 在水稻的非生物胁迫反应中发挥重要作用(
陈思雀等, 2017 ;
张凡等, 2018 ).研究表明, 水稻转录因子OsWRKY45的表达下调可降低水杨酸(SA)对真菌和细菌病原体抗性的诱导, 而其过表达对2种病原体都具有强烈的抗性, 表明其对SA诱导的抗病性具有重要作用(
Nakayama et al., 2013 ).敲除
WRKY22 的转基因水稻对稻瘟病菌的感病性增强, 而过表达
WRKY22 基因则可增强水稻的抗病性, 说明
WRKY22 是水稻抗稻瘟病正调控因子(
Cheng and Wang, 2014 ).包含NB-ARC保守结构域的NBS-LRR类蛋白质在植物体的超敏反应中发挥重要作用.
赵婷婷(2012) 发现含NB-ARC保守结构域的
OsPDRH9N 基因超量表达转基因植株对
Xoc 的侵染更具敏感性. ...
四个籼稻品种对细菌性条斑病的抗性遗传研究
1
1996
... 自1960年以来, 在抗细菌性条斑病遗传研究方面, 国内外****采用不同的材料和菌株, 得出的结论不尽相同.有****尝试分析抗源BJ1的抗性, 初步认为其抗性受3对独立隐性基因控制(
徐建龙等, 1997 ).Dular和IR36对细菌性条斑病的抗性由1对主效基因控制(
张红生等, 1996 ).
何月秋等(1994) 和
李任华等(1998) 分别对几个杂交水稻恢复系和不育系配组了不同的杂交组合, 并对各个世代抗细菌性条斑病的遗传规律进行了研究, 结果表明杂交稻的抗性取决于恢复系, 抗病恢复系对细菌性条斑病的抗性由1-2对主效基因控制, 抗病对感病为显性.
贺文爱等(2010) 发现DY3、DY17和DY20的抗性由2对隐性抗性基因控制; DY16的抗性由1对隐性抗性基因控制.而
Khush (1977) 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 ). ...
1
2012
... 水稻条斑病症状十分明显.田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落.随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 ).而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 ).引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 ).
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜.在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 ).我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 ).植物病原菌对寄主植物的侵染主要依靠各种致病相关因子.已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 ). ...
水稻细菌性条斑病研究进展
2
2014
... 水稻(
Oryza sativa ), 禾本科稻属, 一年生单子叶植物, 是世界主要粮食作物之一, 全世界将近一半人口都以之为主食, 其对民生的重要性不言而喻.细菌性条斑病(
Xanthomonas oryzae pv.
oryzicola )是水稻常见病害.1918年, 在菲律宾发现该病, 目前在东南亚各国和亚洲中部稻区都有发生.1953年, 该病在我国珠江三角洲发生, 之后在南方水稻产区区域性和间歇性暴发成灾.近年来, 水稻条斑病在长江流域杂交晚稻上亦有大面积发生, 已成为华南和中南稻区的主要细菌病害(
张荣胜等, 2014 ), 严重时可造成40%-60%产量损失, 已经成为制约我国水稻优质高产的重要障碍(
徐建龙等, 1996 ;
Niñoliu et al., 2006 ). ...
... 水稻条斑病症状十分明显.田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落.随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 ).而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 ).引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 ).
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜.在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 ).我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 ).植物病原菌对寄主植物的侵染主要依靠各种致病相关因子.已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 ). ...
1
2012
... 水稻WRKY转录因子直接或间接调控抗逆、氧化损伤及衰老等相关基因的表达, 在水稻的非生物胁迫反应中发挥重要作用(
陈思雀等, 2017 ;
张凡等, 2018 ).研究表明, 水稻转录因子OsWRKY45的表达下调可降低水杨酸(SA)对真菌和细菌病原体抗性的诱导, 而其过表达对2种病原体都具有强烈的抗性, 表明其对SA诱导的抗病性具有重要作用(
Nakayama et al., 2013 ).敲除
WRKY22 的转基因水稻对稻瘟病菌的感病性增强, 而过表达
WRKY22 基因则可增强水稻的抗病性, 说明
WRKY22 是水稻抗稻瘟病正调控因子(
Cheng and Wang, 2014 ).包含NB-ARC保守结构域的NBS-LRR类蛋白质在植物体的超敏反应中发挥重要作用.
赵婷婷(2012) 发现含NB-ARC保守结构域的
OsPDRH9N 基因超量表达转基因植株对
Xoc 的侵染更具敏感性. ...
水稻第2染色体上细菌性条斑病抗性QTL的检测
3
2005
... 越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状.
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体.之后, 对水稻条斑病抗性QTL的研究越来越多.
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间.
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb.
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb.
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内.虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离.随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要.我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点. ...
... 表达性状易受多种因素的影响, 同一性状的QTL在实验材料、环境及处理时间不同的情况下检测结果也会存在一定的偏差.
郑景生等(2005) 利用籼稻品种明恢86与佳辐占为亲本构建F
2 群体, 应用SSR标记检测到水稻条斑病抗性QTL (标记区间为RM279-RM- 154).本研究在第2号染色体上定位的效应最大的位点(标记区间RM145-RM521)与
郑景生等(2005) 的定位结果位于相同的染色体区域, 且距离相近, 仅相差几个遗传图距.
陈粟(2002) 利用H359/Acc8558组建RI群体, 通过分离体分组混合分析法检测到条斑病抗性QTL位于第2号染色体的C235A-Xpsr371标记区间, 与本研究结果存在重叠区间.由此可以推断, RM145-RM521之间确实存在1个控制水稻条斑病抗性的主效QTL. ...
... 群体, 应用SSR标记检测到水稻条斑病抗性QTL (标记区间为RM279-RM- 154).本研究在第2号染色体上定位的效应最大的位点(标记区间RM145-RM521)与
郑景生等(2005) 的定位结果位于相同的染色体区域, 且距离相近, 仅相差几个遗传图距.
陈粟(2002) 利用H359/Acc8558组建RI群体, 通过分离体分组混合分析法检测到条斑病抗性QTL位于第2号染色体的C235A-Xpsr371标记区间, 与本研究结果存在重叠区间.由此可以推断, RM145-RM521之间确实存在1个控制水稻条斑病抗性的主效QTL. ...
1
2014
... 水稻WRKY转录因子直接或间接调控抗逆、氧化损伤及衰老等相关基因的表达, 在水稻的非生物胁迫反应中发挥重要作用(
陈思雀等, 2017 ;
张凡等, 2018 ).研究表明, 水稻转录因子OsWRKY45的表达下调可降低水杨酸(SA)对真菌和细菌病原体抗性的诱导, 而其过表达对2种病原体都具有强烈的抗性, 表明其对SA诱导的抗病性具有重要作用(
Nakayama et al., 2013 ).敲除
WRKY22 的转基因水稻对稻瘟病菌的感病性增强, 而过表达
WRKY22 基因则可增强水稻的抗病性, 说明
WRKY22 是水稻抗稻瘟病正调控因子(
Cheng and Wang, 2014 ).包含NB-ARC保守结构域的NBS-LRR类蛋白质在植物体的超敏反应中发挥重要作用.
赵婷婷(2012) 发现含NB-ARC保守结构域的
OsPDRH9N 基因超量表达转基因植株对
Xoc 的侵染更具敏感性. ...
0
2016
1
1977
... 自1960年以来, 在抗细菌性条斑病遗传研究方面, 国内外****采用不同的材料和菌株, 得出的结论不尽相同.有****尝试分析抗源BJ1的抗性, 初步认为其抗性受3对独立隐性基因控制(
徐建龙等, 1997 ).Dular和IR36对细菌性条斑病的抗性由1对主效基因控制(
张红生等, 1996 ).
何月秋等(1994) 和
李任华等(1998) 分别对几个杂交水稻恢复系和不育系配组了不同的杂交组合, 并对各个世代抗细菌性条斑病的遗传规律进行了研究, 结果表明杂交稻的抗性取决于恢复系, 抗病恢复系对细菌性条斑病的抗性由1-2对主效基因控制, 抗病对感病为显性.
贺文爱等(2010) 发现DY3、DY17和DY20的抗性由2对隐性抗性基因控制; DY16的抗性由1对隐性抗性基因控制.而
Khush (1977) 等不少****认为水稻对细菌性条斑病的抗性与细胞质无关, 属多基因控制的数量性状, 符合简单的加性模型, 基因的效应为积加作用, 具有较高的广义和狭义遗传力(
贺文爱等, 2010 ). ...
1
1997
... 利用实验室前期构建的分子标记连锁图谱, 对条斑病接菌后的病斑长度数据进行数量性状座位(QTL)区间作图.同时, 计算QTL对条斑病抗性的贡献率和加性效应.QTL的命名遵循
McCouch等(1997) 的原则. ...
1
2013
... 水稻WRKY转录因子直接或间接调控抗逆、氧化损伤及衰老等相关基因的表达, 在水稻的非生物胁迫反应中发挥重要作用(
陈思雀等, 2017 ;
张凡等, 2018 ).研究表明, 水稻转录因子OsWRKY45的表达下调可降低水杨酸(SA)对真菌和细菌病原体抗性的诱导, 而其过表达对2种病原体都具有强烈的抗性, 表明其对SA诱导的抗病性具有重要作用(
Nakayama et al., 2013 ).敲除
WRKY22 的转基因水稻对稻瘟病菌的感病性增强, 而过表达
WRKY22 基因则可增强水稻的抗病性, 说明
WRKY22 是水稻抗稻瘟病正调控因子(
Cheng and Wang, 2014 ).包含NB-ARC保守结构域的NBS-LRR类蛋白质在植物体的超敏反应中发挥重要作用.
赵婷婷(2012) 发现含NB-ARC保守结构域的
OsPDRH9N 基因超量表达转基因植株对
Xoc 的侵染更具敏感性. ...
1
2006
... 水稻(
Oryza sativa ), 禾本科稻属, 一年生单子叶植物, 是世界主要粮食作物之一, 全世界将近一半人口都以之为主食, 其对民生的重要性不言而喻.细菌性条斑病(
Xanthomonas oryzae pv.
oryzicola )是水稻常见病害.1918年, 在菲律宾发现该病, 目前在东南亚各国和亚洲中部稻区都有发生.1953年, 该病在我国珠江三角洲发生, 之后在南方水稻产区区域性和间歇性暴发成灾.近年来, 水稻条斑病在长江流域杂交晚稻上亦有大面积发生, 已成为华南和中南稻区的主要细菌病害(
张荣胜等, 2014 ), 严重时可造成40%-60%产量损失, 已经成为制约我国水稻优质高产的重要障碍(
徐建龙等, 1996 ;
Niñoliu et al., 2006 ). ...
1
1990
... 水稻条斑病症状十分明显.田间发病时, 感病品种上的病斑纵向扩展快, 长达4-6 cm, 病斑两端菌脓很多, 呈鱼籽状, 干燥后呈琥珀状附于病叶表面而不易脱落.随后病斑不断扩展, 整叶变为红褐色、不规则黄褐色至枯白, 与白叶枯病症状类似, 但对着光看可见许多半透明条斑, 在水稻孕穗期症状尤为明显(
郭威, 2011 ;
张荣胜, 2012 ).而抗病品种病斑较短, 长度不到1 cm, 且病斑少, 菌脓也少(
张荣胜等, 2014 ).引起水稻条斑病的病原是黄单胞菌属稻黄单胞菌(
Xanthomonas oryzae )的变种
X. oryzae pv.
oryzicola (
Xoc ) (
Swings et al., 1990 ).
Xoc 呈杆状, 单生, 少数成对但不成链, 单极鞭, 革兰氏染色阴性, 不形成芽孢和荚膜.在肉汁胨琼脂培养基上该菌落呈黄色, 圆形, 边缘整齐, 黏稠, 对青霉素、葡萄糖反应钝感, 最适生长温度为25-28°C, 致死温度为51°C (
刘姮和李雪琴, 2011 ).我国水稻细菌性条斑病菌出现明显的遗传分化, 遗传多样性较高, 而菌株的致病类群与其DNA的遗传变异间相关性很小, 类群分类与地理位置显著相关, 与致病型分化相关性不显著(
王公金等, 1993 ).植物病原菌对寄主植物的侵染主要依靠各种致病相关因子.已知的条斑病致病因子主要有胞外多糖、脂多糖、胞外酶、植物毒素和III型效应物, 其在植物致病的过程中起着至关重要的作用, 可以调节植物寄主防御系统和基因的转录(
温志杰, 2013 ). ...
1
2000
... 越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状.
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体.之后, 对水稻条斑病抗性QTL的研究越来越多.
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间.
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb.
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb.
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内.虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离.随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要.我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点. ...
1
2017
... 越来越多的证据表明, 条斑病抗性属于多基因控制的数量性状.
吴为人等(1998) 和
Tang等(2000) 从高感品种H359和高抗品种Acc8558的重组自交系群体中检测出11个QTLs, 分别定位在第1、2、3、4、5、7、8和11号染色体.之后, 对水稻条斑病抗性QTL的研究越来越多.
郑景生等(2005) 以明恢86和佳辐占为亲本构建了F
2 群体, 在第2号染色体上检测到1个与条斑病抗性有关的QTL, 将其定位于RM279-RM- 154之间.
李丰涛(2010) 以Acc8558和H359为亲本育成的近等基因系H359-BLSR5a与H359杂交, 建立了1个大的F
2 群体, 将QTL
qBlsr5a 定位在RM5816与RM122之间, 物理距离为52.7 kb.
曹金良等(2014) 利用相同亲本构建的近等基因系H359R, 证实了
qBlsr3d 的存在, 并将其定位在3DSSR3-3DSSR12之间, 物理长度约为1 250 kb.
黄大辉等(2016) 以抗条斑病普通野生稻(
O. rufipogon ) DP3为供体, 感条斑病籼稻品种93-11为受体, 获得定位分离群体近等基因系F
2 , 将
BLS1 定位在RM19400与RM510之间的21 kb物理范围内.虽然上述研究取得了一定进展, 但由于所限定的区间过大, 部分位点贡献率不高, 因而离水稻生产实践应用还有距离.随着水稻条斑病发病愈发严重, 且有恶化的趋势(
Yuan et al., 2017 ), 每年造成水稻大量减产, 研发和培育抗条斑病品种显得尤为重要.我们在前人研究的基础上, 以典型籼粳交(春江06/台中本地1号)双单倍体(DH)群体为材料, 对水稻条斑病抗性QTL进行重新检测, 以期为培育抗条斑病水稻品种提供新的抗性位点. ...
0
2012