张红艳 1 ,
罗杰 2 , * , 1 华中农业大学园艺林学学院, 武汉 4300702 华中农业大学生命科学技术学院, 武汉 430070Zhang Hongyan 1 ,
Luo Jie 2 , * , 1 College of Horticulture and Forestry Sciences, Huazhong Agricultural University, Wuhan 430070, China2 College of Life Science and Technology, Huazhong Agricultural University, Wuhan 430070, China引用本文 张红艳 ,
罗杰 . 中国科学家完成博落回全基因组测序并解析苄基异奎宁类生物碱途径. 植物学报, 2018, 53(3): 289-292
贡献者
* 通讯作者。E-mail: jie.luo@mail.hzau.edu.cn 接受日期:2017-01-25接受日期:2018-03-21网络出版日期:2018-05-20
-->Copyright
2018《植物学报》编辑部
Contributors
* Author for correspondence. E-mail: jie.luo@mail.hzau.edu.cn History
Received :
Accepted :
Online :
摘要: 博落回(Macleaya cordata )是罂粟属的一种传统中药, 因其富含具有抗菌功能的血根碱(SAN)和白屈菜红碱(CHE), 可以作为牲畜抗菌生长促进剂的安全来源植物。中国科学家以博落回为材料, 利用从头测序手段测定了首个罂粟属植物全基因组序列。研究人员通过组织特异性代谢谱及表达谱分析鉴定了博落回中16个参与血根碱和白屈菜红碱合成的候选基因, 并结合同源克隆及饲喂实验对其中的14个基因进行了体外功能验证。上述研究为进一步探索博落回中血根碱等苄基异奎宁类生物碱(BIAs)合成、调控及后续合成奠定了基础, 也为解析罂粟属其它植物的代谢途径提供了有力工具。 关键词 :
博落回 ;
血根碱 ;
白屈菜红碱 ;
从头测序 Abstract :
Macleaya cordata is a traditional Chinese medicinal plant species from the Papaveraceae family and is considered a safe resource of antimicrobial feed additive for livestock for its production of antimicrobial-active constituents such as sanguinarine (SAN) and chelerythrine (CHE). Chinese scientists reported the de novo whole-genome sequencing of M. cordata , the first to be sequenced from the Papaveraceae family. They then used the tissue-specific transcriptome and metabolic profiling data to identify 16 candidate genes involved in the biosynthesis of SAN and CHE. Homologous cloning and substrate-feeding experiments were then applied to verify the biochemical functions of the 14 candidates. This research set up the foundation for further improvement of the biosynthesis, regulation and biosynthetic chemistry of benzylisoquinoline alkaloids and also provides a powerful tool for the dissection of metabolic pathway(s) in other species from the Papaveraceae family.Key words :
Macleaya cordata ;
sanguinarine ;
chelerythrine ;
de novo sequencing 畜牧和医疗领域的抗生素滥用给公共健康带来了一系列潜在威胁。为此, 欧盟自2006年起禁止将抗生素生长促进剂用于饲料添加剂。血根碱(sanguina- rine, SAN)和白屈菜红碱(chelerythrine, CHE)等同时具有抗菌及生长促进功能的天然生长促进剂受到广泛关注, 并被70多个国家批准使用(
Ikezawa et al., 2009 )。血根草是目前市场上血根碱和白屈菜红碱的主要来源植物。但是由于过度开发, 血根草资源受到威胁, 因此寻找替代来源刻不容缓。博落回(
Mac- leaya cordata )是一种多年生草本植物, 作为一种传统的抗菌中草药(
Kosina et al., 2010 ), 其使用记载可追溯到唐代的《本草拾遗》。博落回富含血根碱、白屈菜红碱、原阿片碱和别隐品碱等, 但不合成吗啡和可待因等成瘾类苄基异奎宁类生物碱(benzylisoqu- inoline alkaloids, BIAs), 因此是替代血根草用于血根碱商业化生产的理想来源, 并已被欧洲食品安全局(European Food Safety Authority)批准使用(
Vienna et al., 2007 )。但是, 博落回目前还是一种野生植物, 未被广泛栽培和研究。湖南农业大学园艺与风景学院曾建国研究组和熊兴耀教授与中国农业科学院蔬菜花卉研究所黄三文研究员、尚轶博士合作完成了博落回全基因组测序, 并对其血根碱和白屈菜红碱的合成进行了深入解析(
Liu et al., 2017 ) (
图1 )。
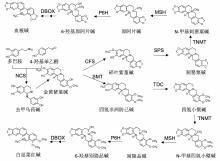
图1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-3-289/img_1.jpg <b>图1</b> 血根碱和白屈菜红碱的合成途径<br/>NCS: 去甲乌药碱合成酶; CFS: 碎叶碱合成酶; SPS: 刺罂粟碱合成酶; SMT: 金黄紫堇碱-9-<i>O</i>-甲基转移酶; TDC: 氢化小檗碱合成酶; TNMT: 氢化小檗碱-顺式-N-甲基转移酶; MSH: N-甲基人血草碱-14羟化酶; P6H: 阿原片碱-6-羟化酶; DBOX: 二氢苯并啡啶氧化酶<br/><b>Figure 1</b> Biosynthesis of sanguinarine and chelerythrine <br/>NCS: Norcoclaurine synthase; CFS: Cytochrome P450; SPS: Stylopine synthase; SMT: (S)-scoulerine-9-<i>O</i>-methyltransferase; TDC: (S)-canadine synthase; TNMT: Tetrahydroprotoberberine <i>cis</i>-N-methyltransferase; MSH: (S)-<i>cis</i>-N-methylstylopine 14- hydroxylase; P6H: Protopine-6-hydroxylase; DBOX: Dihydrobenzophenanthridine oxidase Figure 1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-3-289/img_1.jpg <b>图1</b> 血根碱和白屈菜红碱的合成途径<br/>NCS: 去甲乌药碱合成酶; CFS: 碎叶碱合成酶; SPS: 刺罂粟碱合成酶; SMT: 金黄紫堇碱-9-<i>O</i>-甲基转移酶; TDC: 氢化小檗碱合成酶; TNMT: 氢化小檗碱-顺式-N-甲基转移酶; MSH: N-甲基人血草碱-14羟化酶; P6H: 阿原片碱-6-羟化酶; DBOX: 二氢苯并啡啶氧化酶<br/><b>Figure 1</b> Biosynthesis of sanguinarine and chelerythrine <br/>NCS: Norcoclaurine synthase; CFS: Cytochrome P450; SPS: Stylopine synthase; SMT: (S)-scoulerine-9-<i>O</i>-methyltransferase; TDC: (S)-canadine synthase; TNMT: Tetrahydroprotoberberine <i>cis</i>-N-methyltransferase; MSH: (S)-<i>cis</i>-N-methylstylopine 14- hydroxylase; P6H: Protopine-6-hydroxylase; DBOX: Dihydrobenzophenanthridine oxidase 新窗口打开 Download Download zip Download PPT 图1 血根碱和白屈菜红碱的合成途径
NCS: 去甲乌药碱合成酶; CFS: 碎叶碱合成酶; SPS: 刺罂粟碱合成酶; SMT: 金黄紫堇碱-9-
O -甲基转移酶; TDC: 氢化小檗碱合成酶; TNMT: 氢化小檗碱-顺式-N-甲基转移酶; MSH: N-甲基人血草碱-14羟化酶; P6H: 阿原片碱-6-羟化酶; DBOX: 二氢苯并啡啶氧化酶
Figure 1
Biosynthesis of sanguinarine and chelerythrine
NCS: Norcoclaurine synthase; CFS: Cytochrome P450; SPS: Stylopine synthase; SMT: (S)-scoulerine-9-
O -methyltransferase; TDC: (S)-canadine synthase; TNMT: Tetrahydroprotoberberine
cis -N-methyltransferase; MSH: (S)-
cis -N-methylstylopine 14- hydroxylase; P6H: Protopine-6-hydroxylase; DBOX: Dihydrobenzophenanthridine oxidase
血根碱和白屈菜红碱的合成起始于2种酪氨酸衍生物(多巴胺和4-羟基苯乙醛), 经去甲乌药碱合成酶(NCS)的催化缩合生成去甲乌药碱(norcoclaurine) (
Beaudoin and Facchini, 2014 ), 然后经过几个甲基化和羟基化步骤生成金黄紫堇碱(scoulerine) (
Dang and Facchini, 2012 )。金黄紫堇碱进一步由碎叶碱合成酶(CFS)和刺罂粟碱合成酶(SPS)催化生成刺罂粟碱(stylopine)。金黄紫堇碱由金黄紫堇碱-9-
O -甲基转移酶(SMT)催化生成四氢非洲防己碱(tetrahydroco- lumbamine), 然后经由氢化小檗碱合成酶(TDC)催化生成四氢小檗碱(canadine) (
Díaz Chávez et al., 2011 )。刺罂粟碱和氢化小檗碱再由相同的4个酶(氢化小檗碱-顺式-N-甲基转移酶(TNMT)、N-甲基人血草碱-14羟化酶(MSH)、阿原片碱-6-羟化酶(P6H)和二氢苯并啡啶氧化酶(DBOX))分别催化形成血根碱和白屈菜红碱(
Takemura et al., 2013 )。
科学家首先利用
13 C
6 (苯环)标记的酪氨酸饲喂进行同位素示踪, 发现博落回中存在完整的血根碱和白屈菜红碱合成途径; 并首次在植物中检测到N-甲基金黄紫堇碱和N-甲基碎叶紫堇碱(仅在酵母体外合成血根碱和白屈菜红碱时产生的中间产物)。
科学家进一步检测了血根碱和白屈菜红碱及其中间产物在博落回不同组织中的分布。虽然博落回原阿片碱和别隐品碱等中间产物主要在除茎以外的各个组织中有较高积累, 但是在根部的含量最高, 而血根碱和白屈菜红碱几乎只在蒴果中积累, 提示有相关合成酶在蒴果中特异表达或存在相应的转运子。
为了系统研究博落回中的血根碱和白屈菜红碱的合成途径, 研究人员对博落回(二倍体, 2n=20)进行了全基因组从头测序。利用HiSeq 2000对6个基因组文库(插入片段大小为180 bp-10 kb)进行长度为100 bp的配对末端测序, 共获得256.5 Gb数据(覆盖度466.43倍基因组)。19-kmer分析提示博落回基因组大小为540.5 Mb, 杂合度为0.92%。基因组拼接后scaffolds长度为378 Mb, contig和scaffolds N50分别为25与308 kb。转座元件占全部拼接基因组的43.5%, 其中66.5%为长末端重复型反转录转座子(long terminal repeat (LTR) retrotransposons), 约70%的LTRs具有种属特异性。全基因组复制(whole genome duplication, WGD)是陆生植物的一个普遍现象, 其中几乎所有真双子叶植物都存在古六倍体化(
Vanne- ste et al., 2014 )。博落回与另一种基底真双子叶植物荷花(
Nelumbo nucifera )类似(
Ming et al., 2013 ), 不存在古六倍体化, 提示基底真双子叶植物可能均未发生古六倍体化。
科学家利用RNA测序及cDNA克隆对已报道的14个已知血根碱和白屈菜红碱合成基因的直系同源基因进行克隆, 在博落回中共获得39个可能参与血根碱和白屈菜红碱合成的候选基因。由于血根碱和白屈菜红碱不在茎中积累, 从博落回不同组织转录组测序结果中去掉在茎中高量表达的候选基因, 进一步将参与血根碱和白屈菜红碱生物合成的候选基因数量缩减至16个。将上述候选基因在酵母中异源表达, 结合底物饲喂, 验证了其中14个候选基因的生化功能, 包括催化
N -甲基金黄紫堇碱和
N -甲基碎叶紫堇碱合成的McTNMT/McCNMT。有趣的是, 目前尚未在博落回中克隆到参与吗啡以及可待因合成的番荔枝碱差向异构酶(reticuline epimerase)基因(
Winzer et al., 2015 ), 这与博落回不积累上述成瘾性麻醉剂的研究结果一致。
传统植物药在药用植物中的种属特异性积累为深入研究其代谢途径带来了困难。随着测序技术的快速发展, 全基因组序列测定已成为药用植物等非模式生物代谢途径解析的基础和强有力工具。例如, 对首个药用植物灵芝(
Ganoderma lucidum )的全基因组序列的测定, 就为大量鉴定三萜等次生代谢物合成及调控基因奠定了基础(
Chen et al., 2012 ) 。而上述研究测定了首个罂粟科(Papaveraceae)植物基因组, 并利用同位素示踪、代谢谱分析及同源克隆等方法解析了博落回血根碱和白屈菜红碱的合成途径, 为进一步研究其调控与转运机制提供了有利条件。
The authors have declared that no competing interests exist. 参考文献 文献选项 原文顺序 文献年度倒序 文中引用次数倒序 被引期刊影响因子 [1] Beaudoin GAW Facchini PJ 2014 ). Benzylisoquinoline alkaloid biosynthesis in opium poppy.Planta 240, 19 -32 .[2] Chen SL Xu J Liu C Zhu YJ Nelson DR Zhou SG Li CF Wang LZ Guo X Sun YZ Luo HM Li Y Song JY Henrissat B Levasseur A Qian J Li JQ Luo X Shi LC He L Xiang L Xu XL Niu YY Li QS Han MV Yan HX Zhang J Chen HM Lv AP Wang Z Liu MZ Schwartz DC Sun C 2012 ). Genome sequence of the model medicinal mushroom Ganoderma lucidum . Nat Commun 3, 913 .[3] Dang TT Facchini PJ 2012 ). Characterization of three O -methyltransferases involved in noscapine biosynthesis in opium poppy. Plant Physiol 159, 618 -631 .[4] Díaz Chávez ML Rolf M Gesell A Kutchan TM 2011 ). Characterization of two methylenedioxy bridge-forming cy- tochrome P450-dependent enzymes of alkaloid formation in the Mexican prickly poppy Argemone mexicana . Arch Biochem Biophys 507, 186 -193 .[5] Ikezawa N Iwasa K Sato F 2009 ). CYP719A subfamily of cytochrome P450 oxygenases and isoquinoline alkaloid biosynthesis in Eschscholzia californica . Plant Cell Rep 28, 123 -133 .[6] Kosina P Gregorova J Gruz J Vacek J Kolar M Vogel [7] M , Roos W Naumann K Simanek V Ulrichova J 2010 ). Phytochemical and antimicrobial characterization of Macleaya cordata herb. Fitoterapia 81, 1006 -1012 .[8] Liu XB Liu YS Huang P Ma YS Qing ZX Tang Q Cao HF Cheng P Zheng YJ Yuan ZJ Zhou Y Liu JF Tang ZS Zhuo YX Zhang YC Yu LL Huang JL Yang P Peng Q Zhang JB Jiang WK Zhang ZH Lin K Ro DK Chen XY Xiong XY Shang Y Huang SW Zeng JG 2017 ). The genome of medicinal plant Macleaya cordata provides new insights into benzylisoquinoline alkaloids metabolism. Mol Plant 10, 975 -989 .[9] Ming R VanBuren R Liu Y Yang M Han Y Li LT Zhang Q Kim MJ Schatz MC Campbell M Li J Bowers JE Tang H Lyons E Ferguson AA Narzisi G Nelson DR Blaby-Haas CE Gschwend AR Jiao Y Der JP Zeng F Han J Min XJ Hudson KA Singh R Grennan AK Karpowicz SJ Watling JR Ito K Robinson SA Hudson ME Yu Q Mockler TC Carroll A Zheng Y Sunkar R Jia R Chen N Arro J Wai CM Wafula E Spence A Han Y Xu L Zhang J Peery R Haus MJ Xiong W Walsh JA Wu J Wang ML Zhu YJ Paull RE Britt AB Du C Downie SR Schuler MA Michael TP Long SP Ort DR Schopf JW Gang DR Jiang N Yandell M dePamphilis CW Merchant SS Paterson AH Buchanan BB Li S Shen-Miller J 2013 ). Genome of the long-living sacred lotus ( Nelumbo nucifera Gaertn.). Genome Biol 14, R41 .[10] Takemura T Ikezawa N Iwasa K Sato F 2013 ). Molecular cloning and characterization of a cytochrome P450 in san- guinarine biosynthesis from Eschscholzia californica cells. Phytochemistry 91, 100 -108 .[11] Vanneste K Baele G Maere S Van de Peer Y 2014 ). Analysis of 41 plant genomes supports a wave of successful genome duplications in association with the Cretaceous-Paleogene boundary.Genome Res 24, 1334 -1347 .[12] Vienna CF Graz RB Hohenheim RC Milano DT Trieste AT Wien K-ZE 2007 ). Study on the assessment of plants/ herbs, plant/herb extracts and their naturally or synthetically produced components as ‘additives’ for use in animal production.EFSA Supporting Publications 4, 070828 .[13] Winzer T Kern M King AJ Larson TR Teodor RI Donninger SL Li Y Dowle AA Cartwright J Bates R Ashford D Thomas J Walker C Bowser TA Graham IA 2015 ). Morphinan biosynthesis in opium poppy requires a P450-oxidoreductase fusion protein.Science 349, 309 -312 .
1
2014
... 血根碱和白屈菜红碱的合成起始于2种酪氨酸衍生物(多巴胺和4-羟基苯乙醛), 经去甲乌药碱合成酶(NCS)的催化缩合生成去甲乌药碱(norcoclaurine) (
Beaudoin and Facchini, 2014 ), 然后经过几个甲基化和羟基化步骤生成金黄紫堇碱(scoulerine) (
Dang and Facchini, 2012 ).金黄紫堇碱进一步由碎叶碱合成酶(CFS)和刺罂粟碱合成酶(SPS)催化生成刺罂粟碱(stylopine).金黄紫堇碱由金黄紫堇碱-9-
O -甲基转移酶(SMT)催化生成四氢非洲防己碱(tetrahydroco- lumbamine), 然后经由氢化小檗碱合成酶(TDC)催化生成四氢小檗碱(canadine) (
Díaz Chávez et al., 2011 ).刺罂粟碱和氢化小檗碱再由相同的4个酶(氢化小檗碱-顺式-N-甲基转移酶(TNMT)、N-甲基人血草碱-14羟化酶(MSH)、阿原片碱-6-羟化酶(P6H)和二氢苯并啡啶氧化酶(DBOX))分别催化形成血根碱和白屈菜红碱(
Takemura et al., 2013 ). ...
1
2012
... 传统植物药在药用植物中的种属特异性积累为深入研究其代谢途径带来了困难.随着测序技术的快速发展, 全基因组序列测定已成为药用植物等非模式生物代谢途径解析的基础和强有力工具.例如, 对首个药用植物灵芝(
Ganoderma lucidum )的全基因组序列的测定, 就为大量鉴定三萜等次生代谢物合成及调控基因奠定了基础(
Chen et al., 2012 ) .而上述研究测定了首个罂粟科(Papaveraceae)植物基因组, 并利用同位素示踪、代谢谱分析及同源克隆等方法解析了博落回血根碱和白屈菜红碱的合成途径, 为进一步研究其调控与转运机制提供了有利条件. ...
1
2012
... 血根碱和白屈菜红碱的合成起始于2种酪氨酸衍生物(多巴胺和4-羟基苯乙醛), 经去甲乌药碱合成酶(NCS)的催化缩合生成去甲乌药碱(norcoclaurine) (
Beaudoin and Facchini, 2014 ), 然后经过几个甲基化和羟基化步骤生成金黄紫堇碱(scoulerine) (
Dang and Facchini, 2012 ).金黄紫堇碱进一步由碎叶碱合成酶(CFS)和刺罂粟碱合成酶(SPS)催化生成刺罂粟碱(stylopine).金黄紫堇碱由金黄紫堇碱-9-
O -甲基转移酶(SMT)催化生成四氢非洲防己碱(tetrahydroco- lumbamine), 然后经由氢化小檗碱合成酶(TDC)催化生成四氢小檗碱(canadine) (
Díaz Chávez et al., 2011 ).刺罂粟碱和氢化小檗碱再由相同的4个酶(氢化小檗碱-顺式-N-甲基转移酶(TNMT)、N-甲基人血草碱-14羟化酶(MSH)、阿原片碱-6-羟化酶(P6H)和二氢苯并啡啶氧化酶(DBOX))分别催化形成血根碱和白屈菜红碱(
Takemura et al., 2013 ). ...
1
2011
... 血根碱和白屈菜红碱的合成起始于2种酪氨酸衍生物(多巴胺和4-羟基苯乙醛), 经去甲乌药碱合成酶(NCS)的催化缩合生成去甲乌药碱(norcoclaurine) (
Beaudoin and Facchini, 2014 ), 然后经过几个甲基化和羟基化步骤生成金黄紫堇碱(scoulerine) (
Dang and Facchini, 2012 ).金黄紫堇碱进一步由碎叶碱合成酶(CFS)和刺罂粟碱合成酶(SPS)催化生成刺罂粟碱(stylopine).金黄紫堇碱由金黄紫堇碱-9-
O -甲基转移酶(SMT)催化生成四氢非洲防己碱(tetrahydroco- lumbamine), 然后经由氢化小檗碱合成酶(TDC)催化生成四氢小檗碱(canadine) (
Díaz Chávez et al., 2011 ).刺罂粟碱和氢化小檗碱再由相同的4个酶(氢化小檗碱-顺式-N-甲基转移酶(TNMT)、N-甲基人血草碱-14羟化酶(MSH)、阿原片碱-6-羟化酶(P6H)和二氢苯并啡啶氧化酶(DBOX))分别催化形成血根碱和白屈菜红碱(
Takemura et al., 2013 ). ...
1
2009
... 畜牧和医疗领域的抗生素滥用给公共健康带来了一系列潜在威胁.为此, 欧盟自2006年起禁止将抗生素生长促进剂用于饲料添加剂.血根碱(sanguina- rine, SAN)和白屈菜红碱(chelerythrine, CHE)等同时具有抗菌及生长促进功能的天然生长促进剂受到广泛关注, 并被70多个国家批准使用(
Ikezawa et al., 2009 ).血根草是目前市场上血根碱和白屈菜红碱的主要来源植物.但是由于过度开发, 血根草资源受到威胁, 因此寻找替代来源刻不容缓.博落回(
Mac- leaya cordata )是一种多年生草本植物, 作为一种传统的抗菌中草药(
Kosina et al., 2010 ), 其使用记载可追溯到唐代的《本草拾遗》.博落回富含血根碱、白屈菜红碱、原阿片碱和别隐品碱等, 但不合成吗啡和可待因等成瘾类苄基异奎宁类生物碱(benzylisoqu- inoline alkaloids, BIAs), 因此是替代血根草用于血根碱商业化生产的理想来源, 并已被欧洲食品安全局(European Food Safety Authority)批准使用(
Vienna et al., 2007 ).但是, 博落回目前还是一种野生植物, 未被广泛栽培和研究.湖南农业大学园艺与风景学院曾建国研究组和熊兴耀教授与中国农业科学院蔬菜花卉研究所黄三文研究员、尚轶博士合作完成了博落回全基因组测序, 并对其血根碱和白屈菜红碱的合成进行了深入解析(
Liu et al., 2017 ) (
图1 ). ...
1
... 畜牧和医疗领域的抗生素滥用给公共健康带来了一系列潜在威胁.为此, 欧盟自2006年起禁止将抗生素生长促进剂用于饲料添加剂.血根碱(sanguina- rine, SAN)和白屈菜红碱(chelerythrine, CHE)等同时具有抗菌及生长促进功能的天然生长促进剂受到广泛关注, 并被70多个国家批准使用(
Ikezawa et al., 2009 ).血根草是目前市场上血根碱和白屈菜红碱的主要来源植物.但是由于过度开发, 血根草资源受到威胁, 因此寻找替代来源刻不容缓.博落回(
Mac- leaya cordata )是一种多年生草本植物, 作为一种传统的抗菌中草药(
Kosina et al., 2010 ), 其使用记载可追溯到唐代的《本草拾遗》.博落回富含血根碱、白屈菜红碱、原阿片碱和别隐品碱等, 但不合成吗啡和可待因等成瘾类苄基异奎宁类生物碱(benzylisoqu- inoline alkaloids, BIAs), 因此是替代血根草用于血根碱商业化生产的理想来源, 并已被欧洲食品安全局(European Food Safety Authority)批准使用(
Vienna et al., 2007 ).但是, 博落回目前还是一种野生植物, 未被广泛栽培和研究.湖南农业大学园艺与风景学院曾建国研究组和熊兴耀教授与中国农业科学院蔬菜花卉研究所黄三文研究员、尚轶博士合作完成了博落回全基因组测序, 并对其血根碱和白屈菜红碱的合成进行了深入解析(
Liu et al., 2017 ) (
图1 ). ...
0
2010
1
2017
... 畜牧和医疗领域的抗生素滥用给公共健康带来了一系列潜在威胁.为此, 欧盟自2006年起禁止将抗生素生长促进剂用于饲料添加剂.血根碱(sanguina- rine, SAN)和白屈菜红碱(chelerythrine, CHE)等同时具有抗菌及生长促进功能的天然生长促进剂受到广泛关注, 并被70多个国家批准使用(
Ikezawa et al., 2009 ).血根草是目前市场上血根碱和白屈菜红碱的主要来源植物.但是由于过度开发, 血根草资源受到威胁, 因此寻找替代来源刻不容缓.博落回(
Mac- leaya cordata )是一种多年生草本植物, 作为一种传统的抗菌中草药(
Kosina et al., 2010 ), 其使用记载可追溯到唐代的《本草拾遗》.博落回富含血根碱、白屈菜红碱、原阿片碱和别隐品碱等, 但不合成吗啡和可待因等成瘾类苄基异奎宁类生物碱(benzylisoqu- inoline alkaloids, BIAs), 因此是替代血根草用于血根碱商业化生产的理想来源, 并已被欧洲食品安全局(European Food Safety Authority)批准使用(
Vienna et al., 2007 ).但是, 博落回目前还是一种野生植物, 未被广泛栽培和研究.湖南农业大学园艺与风景学院曾建国研究组和熊兴耀教授与中国农业科学院蔬菜花卉研究所黄三文研究员、尚轶博士合作完成了博落回全基因组测序, 并对其血根碱和白屈菜红碱的合成进行了深入解析(
Liu et al., 2017 ) (
图1 ). ...
1
2013
... 为了系统研究博落回中的血根碱和白屈菜红碱的合成途径, 研究人员对博落回(二倍体, 2n=20)进行了全基因组从头测序.利用HiSeq 2000对6个基因组文库(插入片段大小为180 bp-10 kb)进行长度为100 bp的配对末端测序, 共获得256.5 Gb数据(覆盖度466.43倍基因组).19-kmer分析提示博落回基因组大小为540.5 Mb, 杂合度为0.92%.基因组拼接后scaffolds长度为378 Mb, contig和scaffolds N50分别为25与308 kb.转座元件占全部拼接基因组的43.5%, 其中66.5%为长末端重复型反转录转座子(long terminal repeat (LTR) retrotransposons), 约70%的LTRs具有种属特异性.全基因组复制(whole genome duplication, WGD)是陆生植物的一个普遍现象, 其中几乎所有真双子叶植物都存在古六倍体化(
Vanne- ste et al., 2014 ).博落回与另一种基底真双子叶植物荷花(
Nelumbo nucifera )类似(
Ming et al., 2013 ), 不存在古六倍体化, 提示基底真双子叶植物可能均未发生古六倍体化. ...
1
2013
... 血根碱和白屈菜红碱的合成起始于2种酪氨酸衍生物(多巴胺和4-羟基苯乙醛), 经去甲乌药碱合成酶(NCS)的催化缩合生成去甲乌药碱(norcoclaurine) (
Beaudoin and Facchini, 2014 ), 然后经过几个甲基化和羟基化步骤生成金黄紫堇碱(scoulerine) (
Dang and Facchini, 2012 ).金黄紫堇碱进一步由碎叶碱合成酶(CFS)和刺罂粟碱合成酶(SPS)催化生成刺罂粟碱(stylopine).金黄紫堇碱由金黄紫堇碱-9-
O -甲基转移酶(SMT)催化生成四氢非洲防己碱(tetrahydroco- lumbamine), 然后经由氢化小檗碱合成酶(TDC)催化生成四氢小檗碱(canadine) (
Díaz Chávez et al., 2011 ).刺罂粟碱和氢化小檗碱再由相同的4个酶(氢化小檗碱-顺式-N-甲基转移酶(TNMT)、N-甲基人血草碱-14羟化酶(MSH)、阿原片碱-6-羟化酶(P6H)和二氢苯并啡啶氧化酶(DBOX))分别催化形成血根碱和白屈菜红碱(
Takemura et al., 2013 ). ...
1
2014
... 为了系统研究博落回中的血根碱和白屈菜红碱的合成途径, 研究人员对博落回(二倍体, 2n=20)进行了全基因组从头测序.利用HiSeq 2000对6个基因组文库(插入片段大小为180 bp-10 kb)进行长度为100 bp的配对末端测序, 共获得256.5 Gb数据(覆盖度466.43倍基因组).19-kmer分析提示博落回基因组大小为540.5 Mb, 杂合度为0.92%.基因组拼接后scaffolds长度为378 Mb, contig和scaffolds N50分别为25与308 kb.转座元件占全部拼接基因组的43.5%, 其中66.5%为长末端重复型反转录转座子(long terminal repeat (LTR) retrotransposons), 约70%的LTRs具有种属特异性.全基因组复制(whole genome duplication, WGD)是陆生植物的一个普遍现象, 其中几乎所有真双子叶植物都存在古六倍体化(
Vanne- ste et al., 2014 ).博落回与另一种基底真双子叶植物荷花(
Nelumbo nucifera )类似(
Ming et al., 2013 ), 不存在古六倍体化, 提示基底真双子叶植物可能均未发生古六倍体化. ...
1
2007
... 畜牧和医疗领域的抗生素滥用给公共健康带来了一系列潜在威胁.为此, 欧盟自2006年起禁止将抗生素生长促进剂用于饲料添加剂.血根碱(sanguina- rine, SAN)和白屈菜红碱(chelerythrine, CHE)等同时具有抗菌及生长促进功能的天然生长促进剂受到广泛关注, 并被70多个国家批准使用(
Ikezawa et al., 2009 ).血根草是目前市场上血根碱和白屈菜红碱的主要来源植物.但是由于过度开发, 血根草资源受到威胁, 因此寻找替代来源刻不容缓.博落回(
Mac- leaya cordata )是一种多年生草本植物, 作为一种传统的抗菌中草药(
Kosina et al., 2010 ), 其使用记载可追溯到唐代的《本草拾遗》.博落回富含血根碱、白屈菜红碱、原阿片碱和别隐品碱等, 但不合成吗啡和可待因等成瘾类苄基异奎宁类生物碱(benzylisoqu- inoline alkaloids, BIAs), 因此是替代血根草用于血根碱商业化生产的理想来源, 并已被欧洲食品安全局(European Food Safety Authority)批准使用(
Vienna et al., 2007 ).但是, 博落回目前还是一种野生植物, 未被广泛栽培和研究.湖南农业大学园艺与风景学院曾建国研究组和熊兴耀教授与中国农业科学院蔬菜花卉研究所黄三文研究员、尚轶博士合作完成了博落回全基因组测序, 并对其血根碱和白屈菜红碱的合成进行了深入解析(
Liu et al., 2017 ) (
图1 ). ...
1
2015
... 科学家利用RNA测序及cDNA克隆对已报道的14个已知血根碱和白屈菜红碱合成基因的直系同源基因进行克隆, 在博落回中共获得39个可能参与血根碱和白屈菜红碱合成的候选基因.由于血根碱和白屈菜红碱不在茎中积累, 从博落回不同组织转录组测序结果中去掉在茎中高量表达的候选基因, 进一步将参与血根碱和白屈菜红碱生物合成的候选基因数量缩减至16个.将上述候选基因在酵母中异源表达, 结合底物饲喂, 验证了其中14个候选基因的生化功能, 包括催化
N -甲基金黄紫堇碱和
N -甲基碎叶紫堇碱合成的McTNMT/McCNMT.有趣的是, 目前尚未在博落回中克隆到参与吗啡以及可待因合成的番荔枝碱差向异构酶(reticuline epimerase)基因(
Winzer et al., 2015 ), 这与博落回不积累上述成瘾性麻醉剂的研究结果一致. ...