艾文琴 1 ,
姜瀚原 1 ,
李欣欣 2 ,
廖红 2 , * , 1 华南农业大学资源环境学院, 广州 5106422 福建农林大学根系生物学研究中心, 福州 350002Ai Wenqin 1 ,
Jiang Hanyuan 1 ,
Li Xinxin 2 ,
Liao Hong 2 , * , 1 College of Resources and Environment, South China Agricultural University, Guangzhou 510642, China2 Root Biology Center, Fujian Agriculture and Forestry University, Fuzhou 350002, China引用本文 艾文琴 ,
姜瀚原 ,
李欣欣 ,
廖红 . 一种高效研究大豆根瘤共生固氮的营养液栽培体系. 植物学报, 2018, 53(4): 519-527
贡献者
* 通讯作者。E-mail: hliao@fafu.edu.cn 基金资助
国家自然科学基金(No.31601814) ;
接受日期:2018-01-9接受日期:2018-02-12网络出版日期:2018-07-1
-->Copyright
2018《植物学报》编辑部
Contributors
* Author for correspondence. E-mail: hliao@fafu.edu.cn History
Received :
Accepted :
Online :
摘要: 为建立一种既可高效结瘤固氮, 又具有一定产量的大豆(Glycine max )营养液栽培系统, 设计并进行了2个试验。首先在不同供氮条件下, 研究了接种根瘤菌对大豆的结瘤状况、固氮能力、生物量及产量的影响。结果表明, 供氮过高或过低, 均影响大豆生长、产量形成及根瘤固氮; 并且植物生长所需的最适供氮水平远高于生物固氮所需的最适供氮水平。此外, 大豆生物固氮活性最高的时期在生殖期第一期(R1期)之前。由此推断, 大豆R1期前, 供应较低的氮, 有利于根瘤形成及固氮; 而从R1期起, 应提高供氮水平, 以促进植物生长及产量的形成。在此基础上开展第2个试验, 对供氮条件进行了优化处理(即R1期前低氮供应、R1期开始中氮供应)。结果表明, 与持续供应高氮相比, 优化供氮处理不仅可获得较多固氮酶活性较高的大根瘤, 还能保持较好的生长、获得更高的百粒重及维持80%左右的产量。研究结果不仅可为高效研究大豆根瘤共生固氮提供营养液配方, 还可为大豆高产高效栽培提供试验依据。 关键词 :
大豆 ;
根瘤 ;
生物固氮 ;
营养液 ;
产量 Abstract :
To establish a nutrient solution system for soybean cultivation with effective nodulation and relatively high yield, we first evaluated the effect of nitrogen (N) content and rhizobia inoculation on soybean growth, yield and biological nitrogen fixation (BNF). Too high or too low N supply affected soybean growth, yield and N2 fixation capacity. Also, the required optimal N level was much higher for plant growth than that of BNF. Furthermore, the highest nitrogenase activity in soybean occurred before the first stage of reproduction (R1 stage). Thus, the enzyme activity could facilitate nodule formation and N2 fixation with a lower N supply before the R1 stage and a higher N supply afterward to promote plant growth and yield in soybean. A second experiment was conducted to optimize N supply (i.e., low N supply before R1 and medium N supply at the beginning of R1). As compared with continuously supplied high N, the optimal scheme promoted BNF with more and larger nodules with higher nitrogenase activity and also maintained a good growth performance with higher 100 grain weight and about sustained 80% of soybean yield. These results provide a reference for nutrient receipt for soybean BNF study as well as soybean production for high yield and nutrient efficiency. Key words :
soybean ;
nodule ;
biological nitrogen fixation ;
nutrient solution ;
yield 大豆(
Glycine max )富含蛋白质、脂肪、维生素及微量元素等, 营养价值高, 享有“豆中之王”、“绿色乳牛”等美誉, 是我国重要的粮油经济作物。中国栽培大豆已有五千多年的历史, 是世界上最早种植和驯化大豆的国家。我国大豆生产量曾长期居于世界首位。然而近年来, 虽然大豆的种植范围已由温带扩展到热带地区(
李艳和盖钧镒, 2017 ), 但我国大豆生产依旧停滞不前, 供不应求, 需要大量进口才能满足市场对大豆日益增长的需求。仅在2016年, 我国进口大豆就超过8×10
7 t万吨, 占当年大豆总消费量的80%以上(
罗进和曹智, 2017 )。因此, 加强大豆基础研究, 提高大豆产量, 对保障我国食品安全具有重要意义。
大豆是典型的生物固氮作物, 能与根瘤菌形成特殊的共生固氮器官——根瘤, 将空气中的分子态氮(N
2 )转化为NH
3 (
Brewin, 1991 )。根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(
李欣欣等, 2016 )。接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术。据报道, 巴西大豆增产主要依靠生物固氮(
Alves et al., 2003 ;
Hungria et al., 2005 )。不施化学氮肥, 接种根瘤菌平均增产127 kg·hm
-2 (
Hungria et al., 2006 )。在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(
Alam et al., 2015 )。在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(
Qin et al., 2012 )。可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一。
然而, 施氮过高或过低, 均不利于豆科作物结瘤固氮, 进而造成作物减产(
陈文新和陈文峰, 2004 ;
彭玉新, 2009 ;
邸伟等, 2010 )。
Gan等(2004) 研究不同供氮浓度对大豆结瘤性状的影响, 发现氮浓度高于10 mmol·L
-1 时, 无论供氮形式是硝态氮、铵态氮还是硝酸铵, 均显著降低大豆根瘤数、根瘤重以及总固氮量。
Daimon等(1999) 利用
15 N标记硝酸盐, 发现氮浓度高于14 mmol·L
-1 时, 花生(
Arachis hypogaea )的根瘤数、根瘤重量及固氮酶活性最低, 并且花生产量不随供氮浓度的增加而增加。而
Saito等(2014) 的研究结果表明, 在低氮(5 mmol·L
-1 )条件下, 大豆根生长及结瘤受到抑制。因此, 需要针对不同豆科作物及不同的土壤环境, 确定适量的施氮水平, 确保豆科作物既能高效固氮, 又能高产。由于田间试验影响因素太多, 不仅耗费大量的人力物力, 而且研究结果还可能存在重复性不好等问题。因此, 有必要建立一套高效且能够模拟田间供氮及接种条件的研究体系。
本实验室前期筛选出多种大豆慢生根瘤菌菌株。其中, BXYD3具有宿主广适性、固氮效率高及竞争力强等特点(
程凤娴等, 2008 )。目前, BXYD3作为侵染大豆根系的高效固氮菌株, 已被应用于根瘤固氮生理与分子机制等方面的研究(
Qin et al., 2011 ,
2012 ;
Li et al., 2015 )。本研究以磷高效大豆基因型HN66及测序品种Williams 82为材料, 通过在不同氮浓度下接种高效根瘤菌株系BXYD3, 研究不同施氮水平对大豆结瘤及产量的影响, 以期建立一套既能高效固氮、又能获得较高籽粒产量的营养液栽培体系。
1 材料与方法1.1 材料供试大豆(
Glycine max (L.) Merr.)为养分高效大豆基因型HN66和测序品种Williams 82。供试根瘤菌为高效固氮根瘤菌菌株BXYD3。
1.2 营养液组成根瘤菌YMA培养液成分包括: 10 g·L
-1 甘露醇, 0.2 g·L
-1 MgSO
4 ·7H
2 O, 0.1 g·L
-1 NaCl, 3 g·L
-1 酵母粉, 0.25 g·L
-1 K
2 HPO
4 ·3H
2 O, 0.25 g·L
-1 KH
2 PO
4 。大豆营养液配制参照Li等(2015)的方法, HN66和Williams 82接种根瘤菌后进行营养液栽培。营养液具体配方为: 283.38 mg·L
-1 Ca(NO
3 )
2 ·4H
2 O, 151.65 mg·L
-1 KNO
3 , 123.24 mg·L
-1 MgSO
4 ·7H
2 O, 52.28 mg·L
-1 K
2 SO
4 , 39.72 mg·L
-1 (NH
4 )
2 SO
4 , 34.02 mg·L
-1 KH
2 PO
4 , 32.02 mg·L
-1 NH
4 NO
3 , 14.68 mg·L
-1 EDTA-Fe, 8.5 mg·L
-1 NaB
4 O
7 ·10H
2 O, 5.08 mg·L
-1 MgCl
2 ·6H
2 O, 0.44 mg·L
-1 ZnSO
4 ·7H
2 O, 0.256 mg·L
-1 MnSO
4 ·H
2 O, 0.2 mg·L
-1 (NH
4 )
6 Mo
7 O
24 ·4H
2 O, 0.125 mg·L
-1 Cu SO
4 ·5H
2 O。
1.3 试验方法
1.3.1 根瘤菌培养 挑取根瘤菌单克隆至含有5 mL YMA的50 mL离心管中, 摇菌, 3-5天后将其转移至含400 mL YMA的三角瓶中培养至对数生长期, 离心收集菌液, 利用上述大豆低氮或无氮营养液重悬配置成根瘤菌接种液。
1.3.2 试验设计 本研究共包括两部分试验。
(1) 不同氮处理。供试大豆材料为养分高效大豆基因型HN66。本试验包括供氮水平和接种根瘤菌2个因素。5个氮水平包括: N1 (300 μmol·L
-1 )、N2 (900 μmol·L
-1 )、N3 (2 400 μmol·L
-1 )、N4 (4 800 μmol·L
-1 )和N5 (7 200 μmol·L
-1 ); 每个氮水平设接种(+R)和不接根瘤菌(-R) 2个处理; 共10个处理, 每处理4次生物学重复。为了消除不同氮形态的影响, 各氮处理的硝铵比均固定为4.3:1。本试验在大豆生长至V4期(四节期)和R1期(始花期)时, 收获地下部根瘤进行根瘤数、根瘤重及固氮酶活性的测定, R1期收获地上部及其根系进行生物量的测定, 在植株生长至R8期(完熟期)进行产量统计。
(2) 优化氮处理。供试大豆材料为测序品种Willi- ams 82。本研究设3个处理, 分别为: +R (接种后的大豆在530 μmol·L
-1 低氮下生长至R1期, 再移到2 500 μmol·L
-1 中氮营养液生长至成熟)以及LN-R (530 μmol·L
-1 低氮不接种处理12天, 再移到2 500 μmol·L
-1 中氮营养液生长至成熟)和HN-R (不接种处理12天, 再移到5 300 μmol·L
-1 高氮营养液生长至成熟) 2个对照处理; 每处理4次重复。大豆植株生长至V4期和R3 (始荚期)期时统计根瘤性状; 植株生长至V4、R1、R3、R4 (盛荚期)和R5 (始粒期)期时收集根瘤测定固氮酶活性; 植株生长至R8期时统计产量。收获时, 用2 mm筛子对大豆根瘤进行分级, 其中直径≥2 mm的为大根瘤, 直径<2 mm的为小根瘤。
1.3.3 试验步骤 将籽粒饱满的大豆种子在石英砂中萌发7天后, 挑选生长均匀的大豆幼苗移至不同处理的营养液中。需要接种根瘤菌的大豆幼苗, 在移入营养液前, 将根系浸入根瘤菌接种液中1.5小时, 再移至不同营养液中培养。大豆生长至V4期和R3期时, 收获根瘤进行统计分析; V4、R1、R3、R4和R5期分别收集根瘤进行固氮酶活性测定; R8成熟期进行产量统计分析。生长过程中每天监测营养液pH值, 并用KOH或H
2 SO
4 将营养液pH值保持在5.8左右。营养液保持良好的通气状况, 每隔30分钟通气1次, 每周更换1次营养液。每处理收获2个单株用于生理指标测定, 收获4个单株用于产量指标测定。
1.3.4 固氮酶活性测定 参照
胡浩南等(2017) 的方法, 取适量根瘤于10 mL青霉素瓶中, 并用封口膜封紧瓶盖, 再用1 mL针筒抽出1 mL气体并同时注入等体积的乙炔气体, 室温下反应2小时后, 加入0.5 mol·L
-1 NaOH终止反应。用1 mL针筒吸取0.3 mL反应气体注入GC-2014气相色谱分析仪测定生成乙烯的量。利用1%乙烯稀释成1.78×10
-3 mol·L
-1 、3.56×10
-3 mol·L
-1 、7.12×10
-3 mol·L
-1 、1.424×10
-2 mol·L
-1 、2.136×10
-2 mol·L
-1 、2.848×10
-2 mol·L
-1 和3.56×10
-2 mol·L
-1 浓度梯度, 用于制作乙烯标准曲线。以μmol (C
2 H
4 )·g
-1 (FW)·h
-1 表示固氮酶活性大小, 计算公式如下:
固氮酶活性μmol (C
2 H
4 )·g
-1 (FW)·h
-1 =
C ×(
V1 -
V2 )/(M×
FW ×H) ×10
9 。
式中,
C 为标准曲线上对应的乙烯浓度(g·L
-1 );
V1 为瓶子的体积(L);
V2 为装样品所占用的体积(L); M为乙烯分子量;
FW 为样品鲜重(g); H为加入乙炔后培养的时间(h)。
1.3.5 数据处理 应用Microsoft Excel 2010进行数据统计分析, 采用SigmaPlot软件作图。利用SPSS 16.0统计软件进行差异显著性分析。
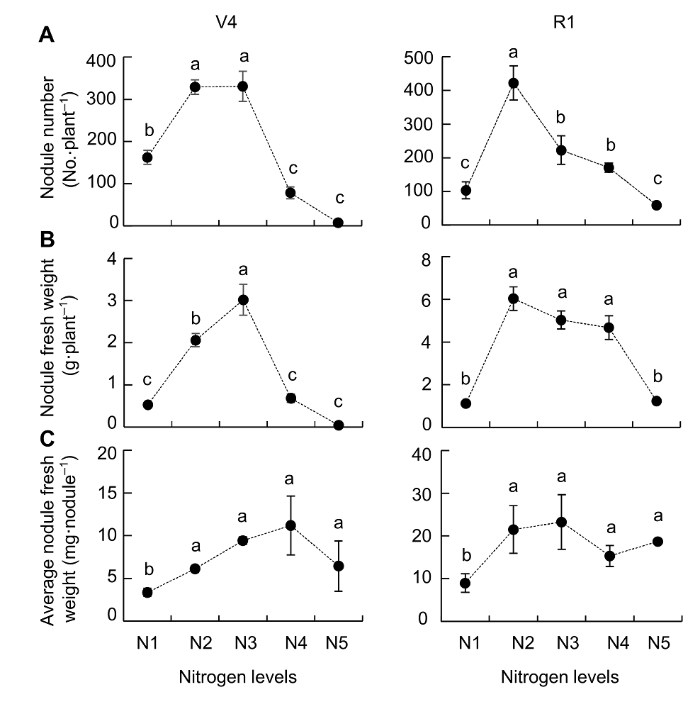
2 结果与讨论2.1 供氮水平对大豆根瘤生长及固氮能力的影响如
图1A 所示, 供氮水平显著影响大豆结瘤, 供氮过多或过少均限制大豆结瘤数及根瘤发育。在V4期, N2和N3处理大豆结瘤最多; 而在R1期, 除N2根瘤数显著较高外, 其余氮处理条件下的根瘤数目均较低, 表明根瘤生长前期对外界供氮较为敏感, 低氮更有利于根瘤的形成。
图1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_1.png <b>图1</b> 供氮水平对大豆根瘤结瘤性状的影响<br/>(A) 根瘤数; (B) 根瘤鲜重; (C) 平均根瘤鲜重。V4和R1分别为大豆不同生长时期。N1-N5分别代表300 μmol·L<sup>-1</sup>、900 μmol·L<sup>-1</sup>、2 400 μmol·L<sup>-1</sup>、4 800 μmol·L<sup>-1</sup>和7 200 μmol·L<sup>-1</sup>氮素水平。不同小写字母代表不同供氮水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 1</b> Effects of nitrogen supply on soybean nodulation<br/>(A) Nodule number; (B) Nodules fresh weight; (C) Average nodules fresh weight. V4 and R1 represent different growth stages of soybean. N1-N5 indicate 300 μmol·L<sup>-1</sup>, 900 μmol·L<sup>-1</sup>, 2 400 μmol·L<sup>-1</sup>, 4 800 μmol·L<sup>-1</sup> and 7 200 μmol·L<sup>-1 </sup>nitrogen level, respectively. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). Figure 1 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_1.png <b>图1</b> 供氮水平对大豆根瘤结瘤性状的影响<br/>(A) 根瘤数; (B) 根瘤鲜重; (C) 平均根瘤鲜重。V4和R1分别为大豆不同生长时期。N1-N5分别代表300 μmol·L<sup>-1</sup>、900 μmol·L<sup>-1</sup>、2 400 μmol·L<sup>-1</sup>、4 800 μmol·L<sup>-1</sup>和7 200 μmol·L<sup>-1</sup>氮素水平。不同小写字母代表不同供氮水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 1</b> Effects of nitrogen supply on soybean nodulation<br/>(A) Nodule number; (B) Nodules fresh weight; (C) Average nodules fresh weight. V4 and R1 represent different growth stages of soybean. N1-N5 indicate 300 μmol·L<sup>-1</sup>, 900 μmol·L<sup>-1</sup>, 2 400 μmol·L<sup>-1</sup>, 4 800 μmol·L<sup>-1</sup> and 7 200 μmol·L<sup>-1 </sup>nitrogen level, respectively. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). 在新窗口打开 下载 下载原图ZIP 生成PPT 图1
供氮水平对大豆根瘤结瘤性状的影响
(A) 根瘤数; (B) 根瘤鲜重; (C) 平均根瘤鲜重。V4和R1分别为大豆不同生长时期。N1-N5分别代表300 μmol·L
-1 、900 μmol·L
-1 、2 400 μmol·L
-1 、4 800 μmol·L
-1 和7 200 μmol·L
-1 氮素水平。不同小写字母代表不同供氮水平间差异显著(
P <0.05)。
Figure 1
Effects of nitrogen supply on soybean nodulation
(A) Nodule number; (B) Nodules fresh weight; (C) Average nodules fresh weight. V4 and R1 represent different growth stages of soybean. N1-N5 indicate 300 μmol·L
-1 , 900 μmol·L
-1 , 2 400 μmol·L
-1 , 4 800 μmol·L
-1 and 7 200 μmol·L
-1 nitrogen level, respectively. Different lowercase letters indicate significant differences among different N supply levels (
P <0.05).
供氮水平对根瘤鲜重也有极显著的影响。供氮过多或过少均降低根瘤鲜重和根瘤数量, 但具体影响程度存在差异。如
图1B 所示, 在V4期, N3处理下根瘤鲜重最大; R1期, 除N1和N5处理下的根瘤鲜重显著较低外, 其余3个氮处理差异均不显著。平均根瘤鲜重在一定程度上能反映根瘤大小。供氮水平对根瘤大小也有影响, 但影响程度低于对根瘤数和根瘤鲜重的影响。在V4期和R1期, 除了N1分别与N2-N5处理之间, 平均根瘤鲜重存在显著差异外, 其余4个氮处理(N2- N5)之间差异均不显著(
图1C )。上述结果表明, 中浓度供氮更有利于根瘤的发育。
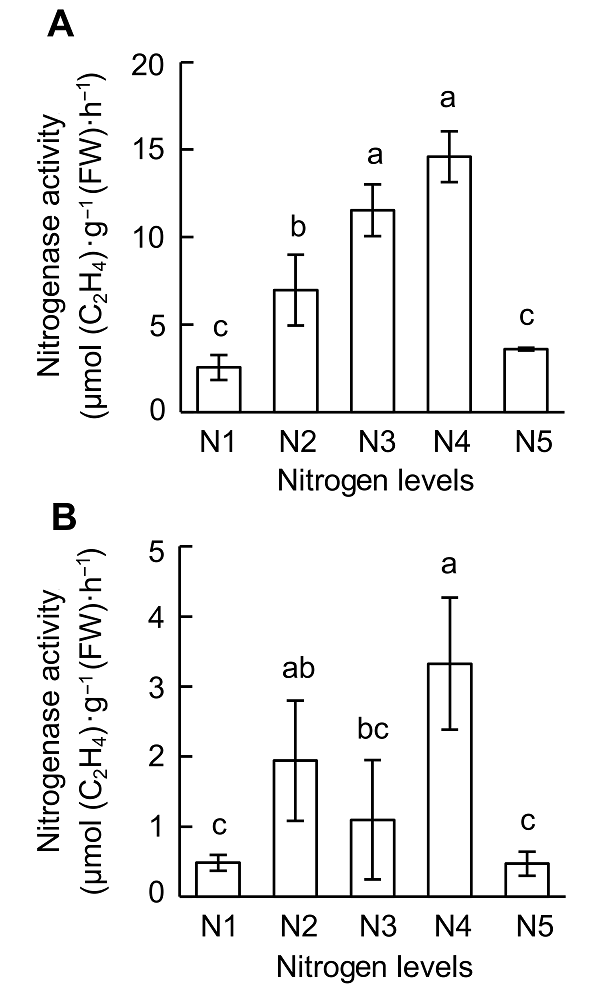
供氮水平对大豆根瘤固氮能力也具有显著的影响(
图2 )。在V4期, 供氮浓度为2 400 μmol·L
-1 (N3)和4 800 μmol·L
-1 (N4)时固氮酶活性最大(
图2 A); 在R1期, 900-4 800 μmol·L
-1 (N2-N4)氮处理下固氮酶活性最大(
图2 B)。并且在R1期, 根瘤固氮酶活性较V4期下降极显著, 表明R1期的根瘤已经开始衰老, 此时的根瘤固氮酶活性对外源氮供应的敏感性下降。
图2 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_2.png <b>图2</b> 供氮水平对大豆不同时期根瘤固氮酶活性的影响<br/>(A) V4期; (B) R1期。N1-N5同<xref ref-type="fig" rid="F1-1674-3466-53-4-519">图1</xref>。不同小写字母代表不同氮供应水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 2</b> Effects of nitrogen supply on nitrogenase activity at different growth stages of soybean<br/>(A) V4 stage; (B) R1 stage. N1-N5 see <xref ref-type="fig" rid="F1-1674-3466-53-4-519">Figure 1</xref>. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). Figure 2 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_2.png <b>图2</b> 供氮水平对大豆不同时期根瘤固氮酶活性的影响<br/>(A) V4期; (B) R1期。N1-N5同<xref ref-type="fig" rid="F1-1674-3466-53-4-519">图1</xref>。不同小写字母代表不同氮供应水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 2</b> Effects of nitrogen supply on nitrogenase activity at different growth stages of soybean<br/>(A) V4 stage; (B) R1 stage. N1-N5 see <xref ref-type="fig" rid="F1-1674-3466-53-4-519">Figure 1</xref>. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). 在新窗口打开 下载 下载原图ZIP 生成PPT 图2
供氮水平对大豆不同时期根瘤固氮酶活性的影响
(A) V4期; (B) R1期。N1-N5同
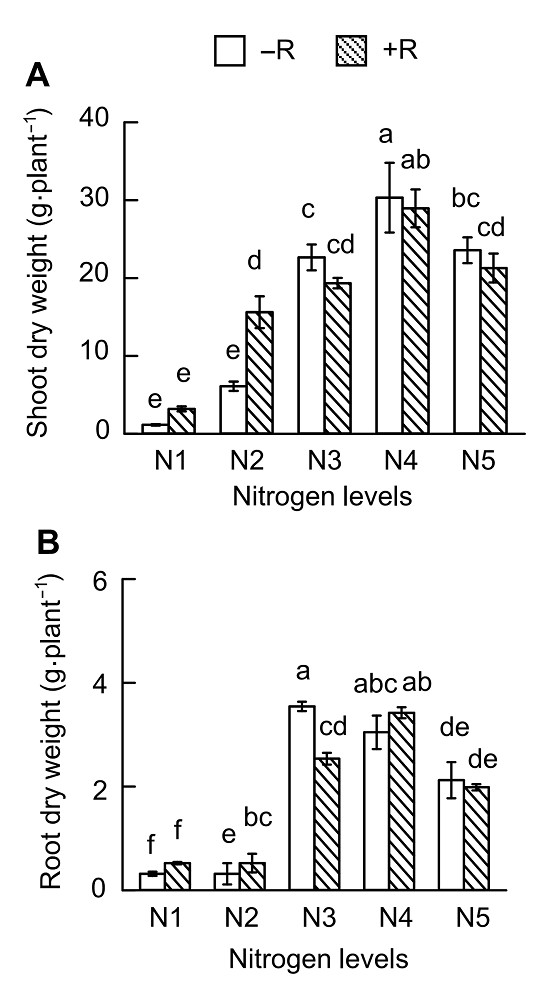
图1。不同小写字母代表不同氮供应水平间差异显著(P <0.05)。Figure 1. Different lowercase letters indicate significant differences among different N supply levels (P <0.05).表1 ); 并且在不同供氮水平下, 接种根瘤菌对大豆生长的影响存在差异, 表现出显著的交互作用(表1 )。无论接种与否, 地上部和根部干重均随着供氮水平的升高而增加, 到N4后下降。地上部干重在N4处理最高, 而根部干重在N3和N4最高。此外, 在低氮(N1和N2)条件下, 接种根瘤菌显著促进大豆地上部及根系的生长。在N1和N2条件下, 接种根瘤菌分别提高大豆地上部及根干重64.20%和39.33%以及60.88%和42.46% (图3 )。而在高氮下接种根瘤菌, 具有抑制大豆生长的趋势。上述结果表明, 低氮下接种根瘤菌可显著促进大豆生长; 而高氮下接种根瘤菌对大豆生长有抑制作用。表1 Table 1 表1 表1 供氮水平及接种根瘤菌对大豆生长及产量影响的方差分析 Table 1 Effect of nitrogen supply levels and inoculation of rhizobium on soybean growth and yieldF value Shoot dry weight Root dry weight Grain weight Hundred grain weight N 67.15*** 134.57*** 50.75*** 36.33*** R 0.89* 2.11* 49.53*** 0.398 N×R 4.31* 14.80*** 8.31*** 4.45**
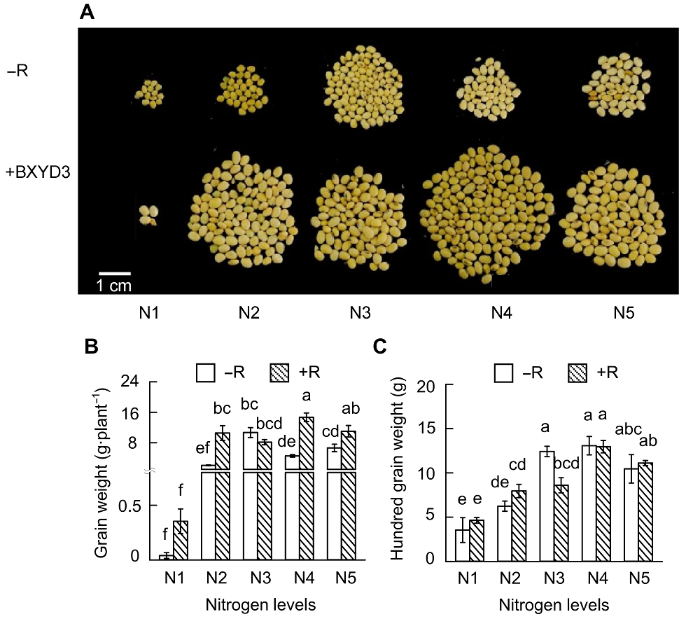
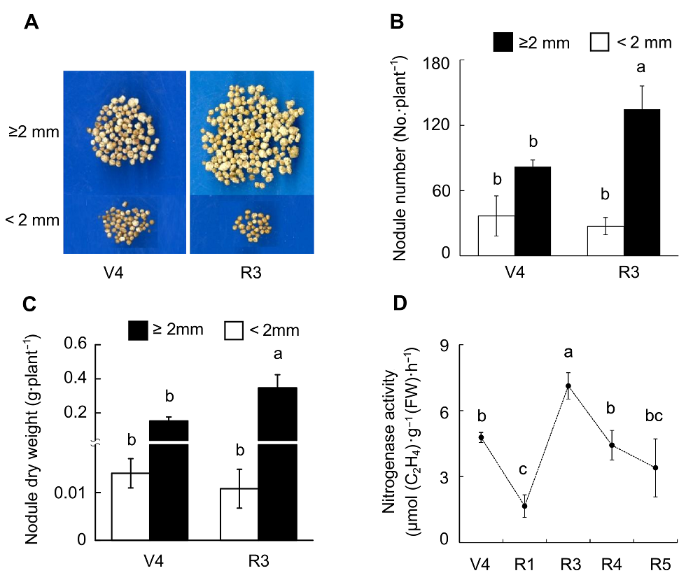
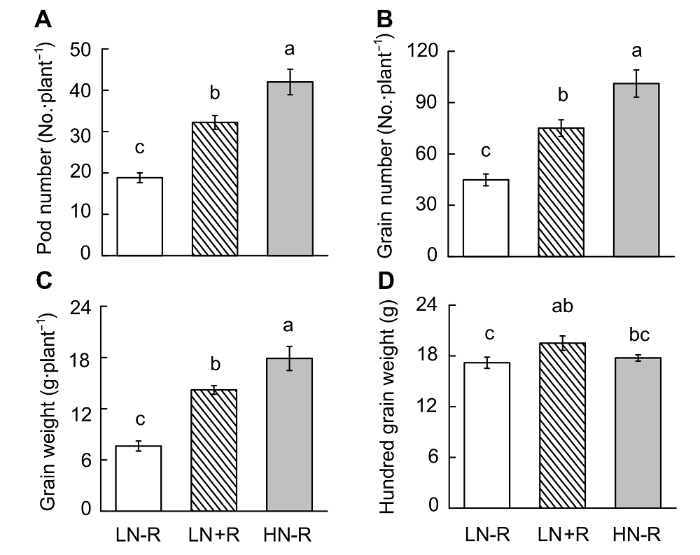
N: 供氮水平; R: 接种根瘤菌; N×R: 氮水平与接种根瘤菌的交互作用。* 0.01<P< 0.05; ** 0.001<P< 0.01; *** P< 0.001 N: Level of nitrogen supply; R: Rhizobium inoculation; N×R: Nitrogen level interactions with rhizobium inoculation. * 0.01<P <0.05; ** 0.001<P <0.01; *** P <0.001 图3 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_3.png <b>图3</b> 供氮水平对大豆生长的影响<br/>(A) 地上部干重; (B) 根干重。N1-N5同<xref ref-type="fig" rid="F1-1674-3466-53-4-519">图1</xref>。不同小写字母代表不同氮供应水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 3</b> Effects of nitrogen supply on soybean growth<br/>(A) Up-ground dry weight; (B) Root dry weight. N1-N5 see <xref ref-type="fig" rid="F1-1674-3466-53-4-519">Figure 1</xref>. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). Figure 3 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_3.png <b>图3</b> 供氮水平对大豆生长的影响<br/>(A) 地上部干重; (B) 根干重。N1-N5同<xref ref-type="fig" rid="F1-1674-3466-53-4-519">图1</xref>。不同小写字母代表不同氮供应水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 3</b> Effects of nitrogen supply on soybean growth<br/>(A) Up-ground dry weight; (B) Root dry weight. N1-N5 see <xref ref-type="fig" rid="F1-1674-3466-53-4-519">Figure 1</xref>. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). 在新窗口打开 下载 下载原图ZIP 生成PPT 图1。不同小写字母代表不同氮供应水平间差异显著(P <0.05)。Figure 1. Different lowercase letters indicate significant differences among different N supply levels (P <0.05).表1 )。在不接种根瘤菌的条件下, 大豆单株粒重和百粒重均表现出随供氮水平升高先增后降的趋势(图4 )。对单株粒重而言, 在N3处理下最高(为10.69 g), 分别是N1和N2的267.13倍和5.20倍; 比N4和N5分别高出135.00%和60.80%。而百粒重在N4到达最高之后, 随供氮水平升高变化不明显。图4 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_4.png <b>图4</b> 供氮水平对大豆产量的影响<br/>(A) 单株籽粒照片; (B) 粒重; (C) 百粒重。N1-N5同<xref ref-type="fig" rid="F1-1674-3466-53-4-519">图1</xref>。不同小写字母代表不同氮供应水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 4</b> Effects of nitrogen supply levels on soybean yield<br/>(A) Pictures of soybean seeds; (B) Grain weight; (C) Hundred grain weight. N1-N5 see <xref ref-type="fig" rid="F1-1674-3466-53-4-519">Figure 1</xref>. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). Figure 4 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_4.png <b>图4</b> 供氮水平对大豆产量的影响<br/>(A) 单株籽粒照片; (B) 粒重; (C) 百粒重。N1-N5同<xref ref-type="fig" rid="F1-1674-3466-53-4-519">图1</xref>。不同小写字母代表不同氮供应水平间差异显著(<i>P</i><0.05)。<br/><b>Figure 4</b> Effects of nitrogen supply levels on soybean yield<br/>(A) Pictures of soybean seeds; (B) Grain weight; (C) Hundred grain weight. N1-N5 see <xref ref-type="fig" rid="F1-1674-3466-53-4-519">Figure 1</xref>. Different lowercase letters indicate significant differences among different N supply levels (<i>P</i><0.05). 在新窗口打开 下载 下载原图ZIP 生成PPT 图1。不同小写字母代表不同氮供应水平间差异显著(P <0.05)。Figure 1. Different lowercase letters indicate significant differences among different N supply levels (P <0.05).图4 )。除N3处理差异不显著外, 接种根瘤菌在N1、N2、N4和N5分别提高单株粒重88.68%、80.53%、69.10%和39.69%。接种根瘤菌对大豆百粒重的影响不显著。-1 低氮处理; R1期开始转入2 500 μmol·L-1 中氮进行适量供氮处理, 以期获得较多的根瘤及较高的产量。通过优化氮处理, 发现随着大豆生长天数的增加, 根瘤数量明显增多。利用2 mm筛子对大豆根瘤进行分级, 发现R3期, 根瘤多以直径≥2 mm的大根瘤为主(图5A , B), 且总根瘤数量和根瘤干重分别是V4期的1.36和2.14倍(图5B , C)。固氮酶活性分析(图5D )表明, R1期较V4期根瘤固氮酶活性显著下降, 仅有V4期固氮酶活性的34.77%。主要原因是R1期外源供氮增加, 从而抑制其固氮酶活性, 但对固氮酶活性的抑制只是短暂的, 到R3期固氮酶活性达到最大值, 之后随着植株的生长, 根瘤的固氮酶活性出现下降趋势, 但仍旧保持较高的活性; 然而, 直径<2 mm的根瘤数目及干重在V4和R3期差异不明显, 且与大根瘤相比, <2 mm的根瘤在V4和R3期所占比例均很低。以上结果表明, 大根瘤是发挥生物固氮作用的主要根瘤群体。可见, 优化氮处理条件及接种根瘤菌的效果非常显著, 所形成的根瘤较大且固氮酶活性较高。图5 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_5.png <b>图5</b> 低氮条件下接种根瘤菌对大豆根瘤生长及固氮酶活性的影响<br/>(A) 根瘤照片; (B) 根瘤数目; (C) 根瘤干重; (D) 固氮酶活性。不同小写字母代表大豆不同生长期之间差异显著(<i>P</i><0.05)。<br/><b>Figure 5</b> Effects of rhizobium inoculation on soybean nodule growth and nitrogenase activity<br/>(A) Pictures of nodules; (B) Nodule number; (C) Nodule dry weight; (D) Nitrogenase activity. Different lowercase letters indicate significant differences among different growth stages of soybean (<i>P</i><0.05). Figure 5 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_5.png <b>图5</b> 低氮条件下接种根瘤菌对大豆根瘤生长及固氮酶活性的影响<br/>(A) 根瘤照片; (B) 根瘤数目; (C) 根瘤干重; (D) 固氮酶活性。不同小写字母代表大豆不同生长期之间差异显著(<i>P</i><0.05)。<br/><b>Figure 5</b> Effects of rhizobium inoculation on soybean nodule growth and nitrogenase activity<br/>(A) Pictures of nodules; (B) Nodule number; (C) Nodule dry weight; (D) Nitrogenase activity. Different lowercase letters indicate significant differences among different growth stages of soybean (<i>P</i><0.05). 在新窗口打开 下载 下载原图ZIP 生成PPT P <0.05)。P <0.05).图6 所示, 供氮水平显著影响大豆产量性状。在不接种根瘤菌的条件下, 高氮条件下大豆有效荚数(图6 A)、粒数(图6 B)、粒重(图6 C)和百粒重(图6 D)分别为低氮处理的122.86%、125.56%、134.35%和3.31%。优化氮供应结合接种根瘤菌, 大豆有效荚数、粒数和粒重比低氮处理分别增加了71.02%、67.41%和86.05%; 仅比高氮处理低23.26%、25.78%和20.61%。值得一提的是, 优化氮供应结合接种根瘤菌处理显著促进大豆籽粒发育, 其百粒重比非接种的高氮处理增加了9.85%, 而比低氮处理增加了13.49%。图6 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_6.png <b>图6</b> 不同氮或接种根瘤菌处理对大豆产量的影响<br/>(A) 有效荚数; (B) 粒数; (C) 粒重; (D) 百粒重。LN-R: 低氮未接种处理; LN+R: 低氮接种处理; HN-R: 高氮未接种处理。不同小写字母代表不同处理间差异显著(<i>P</i><0.05)。<br/><b>Figure 6</b> Soybean yield as affected by different nitrogen or rhizobia inoculation treatments<br/>(A) Pod number; (B) Grain number; (C) Grain weight; (D) Hundred grain weight. LN-R: Low N without inoculation treatment; LN+R: Low N with inoculation treatment; HN-R: High N without inoculation treatment. Different lowercase letters indicate significant differences among different treatments (<i>P</i><0.05). Figure 6 https://www.chinbullbotany.com/article/2018/1674-3466/1674-3466-53-4-519/img_6.png <b>图6</b> 不同氮或接种根瘤菌处理对大豆产量的影响<br/>(A) 有效荚数; (B) 粒数; (C) 粒重; (D) 百粒重。LN-R: 低氮未接种处理; LN+R: 低氮接种处理; HN-R: 高氮未接种处理。不同小写字母代表不同处理间差异显著(<i>P</i><0.05)。<br/><b>Figure 6</b> Soybean yield as affected by different nitrogen or rhizobia inoculation treatments<br/>(A) Pod number; (B) Grain number; (C) Grain weight; (D) Hundred grain weight. LN-R: Low N without inoculation treatment; LN+R: Low N with inoculation treatment; HN-R: High N without inoculation treatment. Different lowercase letters indicate significant differences among different treatments (<i>P</i><0.05). 在新窗口打开 下载 下载原图ZIP 生成PPT P <0.05)。P <0.05).图1 , 图2 , 图4 )。Fujikake等(2003) 报道, 在高氮条件下, 大量的光合产物向根系分配; 而在低氮条件下, 光合产物优先向根瘤分配, 从而促进结瘤。在本研究中, HN66在不同氮水平条件下接种BXYD3, 其根瘤数先随着氮浓度的增加递增, N2处理下最多; 当氮浓度大于900 μmol·L-1 (N2)时, 根瘤数则随着氮浓度的增加而下降。可见营养液栽培条件下, 900 μmol·L-1 左右的低氮水平最有利于根瘤的形成(图1 A)。供氮水平对根瘤发育也有极显著影响, 在V4期, N3处理下根瘤鲜重最大; R1期, N1和N5处理的根瘤鲜重显著低于其余3个氮处理, 表明适量供氮更有利于根瘤的发育。这与李宗盛等(1986) 所推广的技术, 即利用前期减氮促进根瘤生长和发育的结果相吻合。此外, 供氮水平也显著影响大豆根瘤固氮能力。本研究中, V4期供氮水平在4 800 μmol·L-1 时固氮酶活性最高, R1期供氮水平在900-4 800 μmol·L-1 时固氮酶活性均较高(图2 ), 表明相对于根瘤形成及根瘤发育, 维持较高固氮酶活性需要较高的氮供应。表1 )。在低氮(N1和N2)条件下, 接种根瘤菌显著促进大豆地上部及根系的生长(图3 )。在高氮下接种根瘤菌具有抑制大豆生长的趋势, 但在本试验中差异不显著, 表明低氮下接种根瘤菌, 显著促进大豆生长。高氮下接种根瘤菌, 对大豆生长作用不明显。王庆胜(2010) 在水解氮为129.05 mg·kg-1 土壤中利用2种根瘤菌剂分别接种合丰55号, 与对照相比分别增产20.55%和22.45%。本试验结果表明, 供氮水平低于4 800 μmol·L-1 时(图4 ), 接种根瘤菌显著提高大豆籽粒产量, 并且大豆产量随供氮水平的提高而增加; 在高氮(7 200 μmol·L-1 )下, 接种根瘤菌大豆产量有所降低, 说明高氮下接种根瘤菌会抑制大豆生长及产量的形成。图5 )。当植株生长至R1期, 优化供氮水平, 进行适量供氮。结果表明, 供氮后根瘤的固氮酶活性显著下降, 进一步表明外界氮的增加会抑制根瘤的固氮酶活性。Fujikake等(2003) 的结果表明, 低氮处理的根瘤, 侵染细胞发育良好; 当外界供应5 mmol·L-1 硝酸盐时, 侵染细胞明显变小甚至退化, 这可能是外界供氮抑制根瘤固氮能力的原因之一。然而, 本研究表明, 这种抑制作用是短暂的, 植株生长至R3期时根瘤的固氮酶活性达到最大值, 之后随着植株的生长出现下降趋势, 但仍保持较高活性。这说明前期低氮确实有利于结瘤, 后期氮增加至中氮水平, 既能保持根瘤数量又能增加固氮酶活性。Williams 82在V4期的固氮酶活性明显高于HN66品种(图2 , 图5 )。一方面, 豆科植物与根瘤菌之间存在匹配性问题, 即宿主专一性(Wang et al., 2012 ; Tang et al., 2016 ); 另一方面, 后期供氮增加有利于根瘤活性保持在较高水平。接种根瘤菌后, 生物固氮成为大豆植株的额外氮源。因此, 对植株最直接的作用即是改善氮营养情况。然而, 530 μmol·L-1 与5 300 μmol·L-1 的差距过大, 前期减氮接瘤的优化设计未能实现在产量上超越或追平全生长期高氮处理。但可以看出, 这种前期低氮后期中、高氮处理的做法具有一定的应用潜力, 即保持大豆80%左右的产量及较高的百粒重(图6 ), 暗示了优化供氮条件, 即前期低氮促进结瘤, 后期中氮既能保持根瘤较高的活性, 又能提供更多额外的氮源, 进而更有利于籽粒的形成。本研究结果可为高效研究大豆根瘤共生固氮提供营养液配方及获得足量的根瘤进行共生固氮研究, 同时也为大豆高产高效栽培提供了试验依据。The authors have declared that no competing interests exist. 参考文献 文献选项 原文顺序 文献年度倒序 文中引用次数倒序 被引期刊影响因子 [1] 陈文新 , 陈文峰 (2004 ). 发挥生物固氮作用减少化学氮肥用量. 中国农业科技导报 6(6 ), 3 -6 .[2] 程凤娴 , 曹桂芹 , 王秀荣 , 赵静 , 严小龙 , 廖红 (2008 ). 华南酸性低磷土壤中大豆根瘤菌高效株系的发现及应用. 科学通报 53, 2903 -2910 .[3] 邸伟 , 金喜军 , 马春梅 , 龚振平 , 董守坤 , 张磊 (2010 ). 施氮水平对大豆氮素积累与产量影响的研究. 核农学报 24, 612 -617 .[4] 胡浩南 , 敖俊华 , 黄晓财 , 李欣欣 , 廖红 (2017 ). 甘蔗不同组织联合固氮能力评价. 植物生理学报 53, 437 -444 .[5] 李欣欣 , 许锐能 , 廖红 (2016 ). 大豆共生固氮在农业减肥增效中的贡献及应用潜力. 大豆科学 35, 531 -535 .[6] 李艳 , 盖钧镒 (2017 ). 大豆向热带地区发展的遗传基础. 植物学报 52, 389 -393 .[7] 李宗盛 , 李展辉 , 邓建军 (1986 ). 不同时期施氮对大豆产量影响的研究. 土壤肥料 (6 ), 46 -47 .[8] 罗进 , 曹智 (2017 ). 2016年国内外大豆市场回顾及2017年展望. 中国畜牧杂志 53(4 ), 160 -165, 178 .[9] 彭玉新 (2009 ). 施肥对大豆产量及品质的影响研究. 现代农业科技 (18 ), 19, 21 .[10] 王庆胜 (2010 ). 根瘤菌对大豆产量及品质的影响. 黑龙江农业科学 (9 ), 138, 147 .[11] Alam F Bhuiyan MAH Alam SS Waghmode TR Kim PJ Lee YB 2015 ). Effect of Rhizobium sp. BARIRGm901 ino- culation on nodulation, nitrogen fixation and yield of soybean(Glycine max ) genotypes in gray terrace soil. Biosci Biotechnol Biochem 1660 -1668 .[12] Alves BJR Boddey RM Urquiaga S 2003 ). The success of BNF in soybean in Brazil.Plant Soil 252, 1 -9 .[13] Brewin NJ 1991 ). Development of the legume root nodule.Annu Rev Cell Biol 7, 191 -226 .[14] Daimon H Hori K Shimizu A Nakagawa M 1999 ). Nitrate-induced inhibition of root nodule formation and nitrogenase activity in the peanut (Arachis hypogaea L.). Plant Prod Sci 81 -86 .[15] Fujikake H Yamazaki A Ohtake N Sueyoshi K Matsuhashi S Ito T Mizuniwa C Kume T Hashimoto S Ishioka NS Watanabe S Osa A Sekine T Uchida H Tsuji A Ohyama T 2003 ). Quick and reversible inhibition of soybean root nodule growth by nitrate involves a decrease in sucrose supply to nodules.J Exp Bot 54, 1379 -1388 .[16] Gan YB Stulen I van Keulen H Kuiper PJC 2004 ). Low concentrations of nitrate and ammonium stimulate nodulation and N2 fixation while inhibiting specific nodulation (nodule DW·g-1 root dry weight) and specific N2 fixation (N2 fixed·g-1 root dry weight) in soybean.Plant Soil 258, 281 -292 .[17] Hungria M Campo RJ Mendes IC 2005 ). Reinoculation increasing soybean grain yield in Brazil. In: Proceedings of the 14th International Nitrogen Fixation Congress . Dordrecht: Springer. pp. 315 -315 .[18] Hungria M Franchini JC Campo RJ Crispino CC Mor- aes JZ Sibaldelli RNR Mendes IC Arihara J 2006 ). Nitrogen nutrition of soybean in Brazil: contributions of biological N2 fixation and N fertilizer to grain yield.Can J Plant Sci 86, 927 -939 .[19] Li XX Zhao J Tan ZY Zeng RS Liao H 2015 ). GmEXPB2, a cell wall β-expansin, affects soybean nodulation through modifying root architecture and promoting nodule formation and development.Plant Physiol 169, 2640 -2653 .[20] Qin L Jiang H Tian J Zhao J Liao H 2011 ). Rhizobia enhance acquisition of phosphorus from different sources by soybean plants.Plant Soil 349, 25 -36 .[21] Qin L Zhao J Tian J Chen LY Sun ZA Guo YX Lu X Gu M Xu GH Liao H 2012 ). The high-affinity phosphate transporter GmPT5 regulates phosphate transport to nodu- les and nodulation in soybean.Plant Physiol 159, 1634 -1643 .[22] Saito A Tanabata S Tanabata T Tajima S Ueno M Ishikawa S Ohtake N Sueyoshi K Ohyama T 2014 ). Effect of nitrate on nodule and root growth of soybean (Glycine max (L.) Merr.). Int J Mol Sci 4464 -4480 .[23] Tang F Yang SM Liu JG Zhu HY 2016 ). Rj4 , a gene controlling nodulation specificity in soybeans, encodes a thau- matin-like protein but not the one previously reported. Plant Physiol 26 -32 .[24] Wang D Yang SM Tang F Zhu HY 2012 ). Symbiosis specificity in the legume-rhizobial mutualism.Cell Microbiol 14, 334 -342 .
陈文新和陈文峰, 2004 ; 彭玉新, 2009 ; 邸伟等, 2010 ).Gan等(2004) 研究不同供氮浓度对大豆结瘤性状的影响, 发现氮浓度高于10 mmol·L-1 时, 无论供氮形式是硝态氮、铵态氮还是硝酸铵, 均显著降低大豆根瘤数、根瘤重以及总固氮量.Daimon等(1999) 利用15 N标记硝酸盐, 发现氮浓度高于14 mmol·L-1 时, 花生(Arachis hypogaea )的根瘤数、根瘤重量及固氮酶活性最低, 并且花生产量不随供氮浓度的增加而增加.而Saito等(2014) 的研究结果表明, 在低氮(5 mmol·L-1 )条件下, 大豆根生长及结瘤受到抑制.因此, 需要针对不同豆科作物及不同的土壤环境, 确定适量的施氮水平, 确保豆科作物既能高效固氮, 又能高产.由于田间试验影响因素太多, 不仅耗费大量的人力物力, 而且研究结果还可能存在重复性不好等问题.因此, 有必要建立一套高效且能够模拟田间供氮及接种条件的研究体系. ...程凤娴等, 2008 ).目前, BXYD3作为侵染大豆根系的高效固氮菌株, 已被应用于根瘤固氮生理与分子机制等方面的研究(Qin et al., 2011 , 2012 ; Li et al., 2015 ).本研究以磷高效大豆基因型HN66及测序品种Williams 82为材料, 通过在不同氮浓度下接种高效根瘤菌株系BXYD3, 研究不同施氮水平对大豆结瘤及产量的影响, 以期建立一套既能高效固氮、又能获得较高籽粒产量的营养液栽培体系. ...陈文新和陈文峰, 2004 ; 彭玉新, 2009 ; 邸伟等, 2010 ).Gan等(2004) 研究不同供氮浓度对大豆结瘤性状的影响, 发现氮浓度高于10 mmol·L-1 时, 无论供氮形式是硝态氮、铵态氮还是硝酸铵, 均显著降低大豆根瘤数、根瘤重以及总固氮量.Daimon等(1999) 利用15 N标记硝酸盐, 发现氮浓度高于14 mmol·L-1 时, 花生(Arachis hypogaea )的根瘤数、根瘤重量及固氮酶活性最低, 并且花生产量不随供氮浓度的增加而增加.而Saito等(2014) 的研究结果表明, 在低氮(5 mmol·L-1 )条件下, 大豆根生长及结瘤受到抑制.因此, 需要针对不同豆科作物及不同的土壤环境, 确定适量的施氮水平, 确保豆科作物既能高效固氮, 又能高产.由于田间试验影响因素太多, 不仅耗费大量的人力物力, 而且研究结果还可能存在重复性不好等问题.因此, 有必要建立一套高效且能够模拟田间供氮及接种条件的研究体系. ...胡浩南等(2017) 的方法, 取适量根瘤于10 mL青霉素瓶中, 并用封口膜封紧瓶盖, 再用1 mL针筒抽出1 mL气体并同时注入等体积的乙炔气体, 室温下反应2小时后, 加入0.5 mol·L-1 NaOH终止反应.用1 mL针筒吸取0.3 mL反应气体注入GC-2014气相色谱分析仪测定生成乙烯的量.利用1%乙烯稀释成1.78×10-3 mol·L-1 、3.56×10-3 mol·L-1 、7.12×10-3 mol·L-1 、1.424×10-2 mol·L-1 、2.136×10-2 mol·L-1 、2.848×10-2 mol·L-1 和3.56×10-2 mol·L-1 浓度梯度, 用于制作乙烯标准曲线.以μmol (C2 H4 )·g-1 (FW)·h-1 表示固氮酶活性大小, 计算公式如下: ...2 )转化为NH3 (Brewin, 1991 ).根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(李欣欣等, 2016 ).接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术.据报道, 巴西大豆增产主要依靠生物固氮(Alves et al., 2003 ; Hungria et al., 2005 ).不施化学氮肥, 接种根瘤菌平均增产127 kg·hm-2 (Hungria et al., 2006 ).在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(Alam et al., 2015 ).在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(Qin et al., 2012 ).可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一. ...Glycine max )富含蛋白质、脂肪、维生素及微量元素等, 营养价值高, 享有“豆中之王”、“绿色乳牛”等美誉, 是我国重要的粮油经济作物.中国栽培大豆已有五千多年的历史, 是世界上最早种植和驯化大豆的国家.我国大豆生产量曾长期居于世界首位.然而近年来, 虽然大豆的种植范围已由温带扩展到热带地区(李艳和盖钧镒, 2017 ), 但我国大豆生产依旧停滞不前, 供不应求, 需要大量进口才能满足市场对大豆日益增长的需求.仅在2016年, 我国进口大豆就超过8×107 t万吨, 占当年大豆总消费量的80%以上(罗进和曹智, 2017 ).因此, 加强大豆基础研究, 提高大豆产量, 对保障我国食品安全具有重要意义. ...图1 , 图2 , 图4 ).Fujikake等(2003) 报道, 在高氮条件下, 大量的光合产物向根系分配; 而在低氮条件下, 光合产物优先向根瘤分配, 从而促进结瘤.在本研究中, HN66在不同氮水平条件下接种BXYD3, 其根瘤数先随着氮浓度的增加递增, N2处理下最多; 当氮浓度大于900 μmol·L-1 (N2)时, 根瘤数则随着氮浓度的增加而下降.可见营养液栽培条件下, 900 μmol·L-1 左右的低氮水平最有利于根瘤的形成(图1 A).供氮水平对根瘤发育也有极显著影响, 在V4期, N3处理下根瘤鲜重最大; R1期, N1和N5处理的根瘤鲜重显著低于其余3个氮处理, 表明适量供氮更有利于根瘤的发育.这与李宗盛等(1986) 所推广的技术, 即利用前期减氮促进根瘤生长和发育的结果相吻合.此外, 供氮水平也显著影响大豆根瘤固氮能力.本研究中, V4期供氮水平在4 800 μmol·L-1 时固氮酶活性最高, R1期供氮水平在900-4 800 μmol·L-1 时固氮酶活性均较高(图2 ), 表明相对于根瘤形成及根瘤发育, 维持较高固氮酶活性需要较高的氮供应. ...Glycine max )富含蛋白质、脂肪、维生素及微量元素等, 营养价值高, 享有“豆中之王”、“绿色乳牛”等美誉, 是我国重要的粮油经济作物.中国栽培大豆已有五千多年的历史, 是世界上最早种植和驯化大豆的国家.我国大豆生产量曾长期居于世界首位.然而近年来, 虽然大豆的种植范围已由温带扩展到热带地区(李艳和盖钧镒, 2017 ), 但我国大豆生产依旧停滞不前, 供不应求, 需要大量进口才能满足市场对大豆日益增长的需求.仅在2016年, 我国进口大豆就超过8×107 t万吨, 占当年大豆总消费量的80%以上(罗进和曹智, 2017 ).因此, 加强大豆基础研究, 提高大豆产量, 对保障我国食品安全具有重要意义. ...陈文新和陈文峰, 2004 ; 彭玉新, 2009 ; 邸伟等, 2010 ).Gan等(2004) 研究不同供氮浓度对大豆结瘤性状的影响, 发现氮浓度高于10 mmol·L-1 时, 无论供氮形式是硝态氮、铵态氮还是硝酸铵, 均显著降低大豆根瘤数、根瘤重以及总固氮量.Daimon等(1999) 利用15 N标记硝酸盐, 发现氮浓度高于14 mmol·L-1 时, 花生(Arachis hypogaea )的根瘤数、根瘤重量及固氮酶活性最低, 并且花生产量不随供氮浓度的增加而增加.而Saito等(2014) 的研究结果表明, 在低氮(5 mmol·L-1 )条件下, 大豆根生长及结瘤受到抑制.因此, 需要针对不同豆科作物及不同的土壤环境, 确定适量的施氮水平, 确保豆科作物既能高效固氮, 又能高产.由于田间试验影响因素太多, 不仅耗费大量的人力物力, 而且研究结果还可能存在重复性不好等问题.因此, 有必要建立一套高效且能够模拟田间供氮及接种条件的研究体系. ...表1 ).在低氮(N1和N2)条件下, 接种根瘤菌显著促进大豆地上部及根系的生长(图3 ).在高氮下接种根瘤菌具有抑制大豆生长的趋势, 但在本试验中差异不显著, 表明低氮下接种根瘤菌, 显著促进大豆生长.高氮下接种根瘤菌, 对大豆生长作用不明显.王庆胜(2010) 在水解氮为129.05 mg·kg-1 土壤中利用2种根瘤菌剂分别接种合丰55号, 与对照相比分别增产20.55%和22.45%.本试验结果表明, 供氮水平低于4 800 μmol·L-1 时(图4 ), 接种根瘤菌显著提高大豆籽粒产量, 并且大豆产量随供氮水平的提高而增加; 在高氮(7 200 μmol·L-1 )下, 接种根瘤菌大豆产量有所降低, 说明高氮下接种根瘤菌会抑制大豆生长及产量的形成. ...2 )转化为NH3 (Brewin, 1991 ).根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(李欣欣等, 2016 ).接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术.据报道, 巴西大豆增产主要依靠生物固氮(Alves et al., 2003 ; Hungria et al., 2005 ).不施化学氮肥, 接种根瘤菌平均增产127 kg·hm-2 (Hungria et al., 2006 ).在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(Alam et al., 2015 ).在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(Qin et al., 2012 ).可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一. ...2 )转化为NH3 (Brewin, 1991 ).根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(李欣欣等, 2016 ).接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术.据报道, 巴西大豆增产主要依靠生物固氮(Alves et al., 2003 ; Hungria et al., 2005 ).不施化学氮肥, 接种根瘤菌平均增产127 kg·hm-2 (Hungria et al., 2006 ).在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(Alam et al., 2015 ).在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(Qin et al., 2012 ).可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一. ...2 )转化为NH3 (Brewin, 1991 ).根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(李欣欣等, 2016 ).接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术.据报道, 巴西大豆增产主要依靠生物固氮(Alves et al., 2003 ; Hungria et al., 2005 ).不施化学氮肥, 接种根瘤菌平均增产127 kg·hm-2 (Hungria et al., 2006 ).在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(Alam et al., 2015 ).在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(Qin et al., 2012 ).可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一. ...陈文新和陈文峰, 2004 ; 彭玉新, 2009 ; 邸伟等, 2010 ).Gan等(2004) 研究不同供氮浓度对大豆结瘤性状的影响, 发现氮浓度高于10 mmol·L-1 时, 无论供氮形式是硝态氮、铵态氮还是硝酸铵, 均显著降低大豆根瘤数、根瘤重以及总固氮量.Daimon等(1999) 利用15 N标记硝酸盐, 发现氮浓度高于14 mmol·L-1 时, 花生(Arachis hypogaea )的根瘤数、根瘤重量及固氮酶活性最低, 并且花生产量不随供氮浓度的增加而增加.而Saito等(2014) 的研究结果表明, 在低氮(5 mmol·L-1 )条件下, 大豆根生长及结瘤受到抑制.因此, 需要针对不同豆科作物及不同的土壤环境, 确定适量的施氮水平, 确保豆科作物既能高效固氮, 又能高产.由于田间试验影响因素太多, 不仅耗费大量的人力物力, 而且研究结果还可能存在重复性不好等问题.因此, 有必要建立一套高效且能够模拟田间供氮及接种条件的研究体系. ...图1 , 图2 , 图4 ).Fujikake等(2003) 报道, 在高氮条件下, 大量的光合产物向根系分配; 而在低氮条件下, 光合产物优先向根瘤分配, 从而促进结瘤.在本研究中, HN66在不同氮水平条件下接种BXYD3, 其根瘤数先随着氮浓度的增加递增, N2处理下最多; 当氮浓度大于900 μmol·L-1 (N2)时, 根瘤数则随着氮浓度的增加而下降.可见营养液栽培条件下, 900 μmol·L-1 左右的低氮水平最有利于根瘤的形成(图1 A).供氮水平对根瘤发育也有极显著影响, 在V4期, N3处理下根瘤鲜重最大; R1期, N1和N5处理的根瘤鲜重显著低于其余3个氮处理, 表明适量供氮更有利于根瘤的发育.这与李宗盛等(1986) 所推广的技术, 即利用前期减氮促进根瘤生长和发育的结果相吻合.此外, 供氮水平也显著影响大豆根瘤固氮能力.本研究中, V4期供氮水平在4 800 μmol·L-1 时固氮酶活性最高, R1期供氮水平在900-4 800 μmol·L-1 时固氮酶活性均较高(图2 ), 表明相对于根瘤形成及根瘤发育, 维持较高固氮酶活性需要较高的氮供应. ...图5 ).当植株生长至R1期, 优化供氮水平, 进行适量供氮.结果表明, 供氮后根瘤的固氮酶活性显著下降, 进一步表明外界氮的增加会抑制根瘤的固氮酶活性.Fujikake等(2003) 的结果表明, 低氮处理的根瘤, 侵染细胞发育良好; 当外界供应5 mmol·L-1 硝酸盐时, 侵染细胞明显变小甚至退化, 这可能是外界供氮抑制根瘤固氮能力的原因之一.然而, 本研究表明, 这种抑制作用是短暂的, 植株生长至R3期时根瘤的固氮酶活性达到最大值, 之后随着植株的生长出现下降趋势, 但仍保持较高活性.这说明前期低氮确实有利于结瘤, 后期氮增加至中氮水平, 既能保持根瘤数量又能增加固氮酶活性.Williams 82在V4期的固氮酶活性明显高于HN66品种(图2 , 图5 ).一方面, 豆科植物与根瘤菌之间存在匹配性问题, 即宿主专一性(Wang et al., 2012 ; Tang et al., 2016 ); 另一方面, 后期供氮增加有利于根瘤活性保持在较高水平.接种根瘤菌后, 生物固氮成为大豆植株的额外氮源.因此, 对植株最直接的作用即是改善氮营养情况.然而, 530 μmol·L-1 与5 300 μmol·L-1 的差距过大, 前期减氮接瘤的优化设计未能实现在产量上超越或追平全生长期高氮处理.但可以看出, 这种前期低氮后期中、高氮处理的做法具有一定的应用潜力, 即保持大豆80%左右的产量及较高的百粒重(图6 ), 暗示了优化供氮条件, 即前期低氮促进结瘤, 后期中氮既能保持根瘤较高的活性, 又能提供更多额外的氮源, 进而更有利于籽粒的形成.本研究结果可为高效研究大豆根瘤共生固氮提供营养液配方及获得足量的根瘤进行共生固氮研究, 同时也为大豆高产高效栽培提供了试验依据. ...陈文新和陈文峰, 2004 ; 彭玉新, 2009 ; 邸伟等, 2010 ).Gan等(2004) 研究不同供氮浓度对大豆结瘤性状的影响, 发现氮浓度高于10 mmol·L-1 时, 无论供氮形式是硝态氮、铵态氮还是硝酸铵, 均显著降低大豆根瘤数、根瘤重以及总固氮量.Daimon等(1999) 利用15 N标记硝酸盐, 发现氮浓度高于14 mmol·L-1 时, 花生(Arachis hypogaea )的根瘤数、根瘤重量及固氮酶活性最低, 并且花生产量不随供氮浓度的增加而增加.而Saito等(2014) 的研究结果表明, 在低氮(5 mmol·L-1 )条件下, 大豆根生长及结瘤受到抑制.因此, 需要针对不同豆科作物及不同的土壤环境, 确定适量的施氮水平, 确保豆科作物既能高效固氮, 又能高产.由于田间试验影响因素太多, 不仅耗费大量的人力物力, 而且研究结果还可能存在重复性不好等问题.因此, 有必要建立一套高效且能够模拟田间供氮及接种条件的研究体系. ...2 )转化为NH3 (Brewin, 1991 ).根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(李欣欣等, 2016 ).接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术.据报道, 巴西大豆增产主要依靠生物固氮(Alves et al., 2003 ; Hungria et al., 2005 ).不施化学氮肥, 接种根瘤菌平均增产127 kg·hm-2 (Hungria et al., 2006 ).在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(Alam et al., 2015 ).在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(Qin et al., 2012 ).可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一. ...2 )转化为NH3 (Brewin, 1991 ).根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(李欣欣等, 2016 ).接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术.据报道, 巴西大豆增产主要依靠生物固氮(Alves et al., 2003 ; Hungria et al., 2005 ).不施化学氮肥, 接种根瘤菌平均增产127 kg·hm-2 (Hungria et al., 2006 ).在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(Alam et al., 2015 ).在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(Qin et al., 2012 ).可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一. ...程凤娴等, 2008 ).目前, BXYD3作为侵染大豆根系的高效固氮菌株, 已被应用于根瘤固氮生理与分子机制等方面的研究(Qin et al., 2011 , 2012 ; Li et al., 2015 ).本研究以磷高效大豆基因型HN66及测序品种Williams 82为材料, 通过在不同氮浓度下接种高效根瘤菌株系BXYD3, 研究不同施氮水平对大豆结瘤及产量的影响, 以期建立一套既能高效固氮、又能获得较高籽粒产量的营养液栽培体系. ...程凤娴等, 2008 ).目前, BXYD3作为侵染大豆根系的高效固氮菌株, 已被应用于根瘤固氮生理与分子机制等方面的研究(Qin et al., 2011 , 2012 ; Li et al., 2015 ).本研究以磷高效大豆基因型HN66及测序品种Williams 82为材料, 通过在不同氮浓度下接种高效根瘤菌株系BXYD3, 研究不同施氮水平对大豆结瘤及产量的影响, 以期建立一套既能高效固氮、又能获得较高籽粒产量的营养液栽培体系. ...2 )转化为NH3 (Brewin, 1991 ).根瘤所固定的氮不仅可为宿主植物提供氮素营养, 还能改良土壤, 减少化肥投入(李欣欣等, 2016 ).接种高效根瘤菌剂是目前国际上大豆生产的常规栽培技术.据报道, 巴西大豆增产主要依靠生物固氮(Alves et al., 2003 ; Hungria et al., 2005 ).不施化学氮肥, 接种根瘤菌平均增产127 kg·hm-2 (Hungria et al., 2006 ).在孟加拉国, 接种高效根瘤菌可显著增加根瘤数、大豆荚数及籽粒产量(Alam et al., 2015 ).在我国东北, 减施50%氮肥的同时接种高效根瘤菌, 比常规施肥增产大豆20%以上(Qin et al., 2012 ).可见, 将根瘤菌接种技术应用于农业生产, 充分发挥生物固氮作用, 是大豆减肥增产的重要策略之一. ...程凤娴等, 2008 ).目前, BXYD3作为侵染大豆根系的高效固氮菌株, 已被应用于根瘤固氮生理与分子机制等方面的研究(Qin et al., 2011 , 2012 ; Li et al., 2015 ).本研究以磷高效大豆基因型HN66及测序品种Williams 82为材料, 通过在不同氮浓度下接种高效根瘤菌株系BXYD3, 研究不同施氮水平对大豆结瘤及产量的影响, 以期建立一套既能高效固氮、又能获得较高籽粒产量的营养液栽培体系. ...陈文新和陈文峰, 2004 ; 彭玉新, 2009 ; 邸伟等, 2010 ).Gan等(2004) 研究不同供氮浓度对大豆结瘤性状的影响, 发现氮浓度高于10 mmol·L-1 时, 无论供氮形式是硝态氮、铵态氮还是硝酸铵, 均显著降低大豆根瘤数、根瘤重以及总固氮量.Daimon等(1999) 利用15 N标记硝酸盐, 发现氮浓度高于14 mmol·L-1 时, 花生(Arachis hypogaea )的根瘤数、根瘤重量及固氮酶活性最低, 并且花生产量不随供氮浓度的增加而增加.而Saito等(2014) 的研究结果表明, 在低氮(5 mmol·L-1 )条件下, 大豆根生长及结瘤受到抑制.因此, 需要针对不同豆科作物及不同的土壤环境, 确定适量的施氮水平, 确保豆科作物既能高效固氮, 又能高产.由于田间试验影响因素太多, 不仅耗费大量的人力物力, 而且研究结果还可能存在重复性不好等问题.因此, 有必要建立一套高效且能够模拟田间供氮及接种条件的研究体系. ...图5 ).当植株生长至R1期, 优化供氮水平, 进行适量供氮.结果表明, 供氮后根瘤的固氮酶活性显著下降, 进一步表明外界氮的增加会抑制根瘤的固氮酶活性.Fujikake等(2003) 的结果表明, 低氮处理的根瘤, 侵染细胞发育良好; 当外界供应5 mmol·L-1 硝酸盐时, 侵染细胞明显变小甚至退化, 这可能是外界供氮抑制根瘤固氮能力的原因之一.然而, 本研究表明, 这种抑制作用是短暂的, 植株生长至R3期时根瘤的固氮酶活性达到最大值, 之后随着植株的生长出现下降趋势, 但仍保持较高活性.这说明前期低氮确实有利于结瘤, 后期氮增加至中氮水平, 既能保持根瘤数量又能增加固氮酶活性.Williams 82在V4期的固氮酶活性明显高于HN66品种(图2 , 图5 ).一方面, 豆科植物与根瘤菌之间存在匹配性问题, 即宿主专一性(Wang et al., 2012 ; Tang et al., 2016 ); 另一方面, 后期供氮增加有利于根瘤活性保持在较高水平.接种根瘤菌后, 生物固氮成为大豆植株的额外氮源.因此, 对植株最直接的作用即是改善氮营养情况.然而, 530 μmol·L-1 与5 300 μmol·L-1 的差距过大, 前期减氮接瘤的优化设计未能实现在产量上超越或追平全生长期高氮处理.但可以看出, 这种前期低氮后期中、高氮处理的做法具有一定的应用潜力, 即保持大豆80%左右的产量及较高的百粒重(图6 ), 暗示了优化供氮条件, 即前期低氮促进结瘤, 后期中氮既能保持根瘤较高的活性, 又能提供更多额外的氮源, 进而更有利于籽粒的形成.本研究结果可为高效研究大豆根瘤共生固氮提供营养液配方及获得足量的根瘤进行共生固氮研究, 同时也为大豆高产高效栽培提供了试验依据. ...图5 ).当植株生长至R1期, 优化供氮水平, 进行适量供氮.结果表明, 供氮后根瘤的固氮酶活性显著下降, 进一步表明外界氮的增加会抑制根瘤的固氮酶活性.Fujikake等(2003) 的结果表明, 低氮处理的根瘤, 侵染细胞发育良好; 当外界供应5 mmol·L-1 硝酸盐时, 侵染细胞明显变小甚至退化, 这可能是外界供氮抑制根瘤固氮能力的原因之一.然而, 本研究表明, 这种抑制作用是短暂的, 植株生长至R3期时根瘤的固氮酶活性达到最大值, 之后随着植株的生长出现下降趋势, 但仍保持较高活性.这说明前期低氮确实有利于结瘤, 后期氮增加至中氮水平, 既能保持根瘤数量又能增加固氮酶活性.Williams 82在V4期的固氮酶活性明显高于HN66品种(图2 , 图5 ).一方面, 豆科植物与根瘤菌之间存在匹配性问题, 即宿主专一性(Wang et al., 2012 ; Tang et al., 2016 ); 另一方面, 后期供氮增加有利于根瘤活性保持在较高水平.接种根瘤菌后, 生物固氮成为大豆植株的额外氮源.因此, 对植株最直接的作用即是改善氮营养情况.然而, 530 μmol·L-1 与5 300 μmol·L-1 的差距过大, 前期减氮接瘤的优化设计未能实现在产量上超越或追平全生长期高氮处理.但可以看出, 这种前期低氮后期中、高氮处理的做法具有一定的应用潜力, 即保持大豆80%左右的产量及较高的百粒重(图6 ), 暗示了优化供氮条件, 即前期低氮促进结瘤, 后期中氮既能保持根瘤较高的活性, 又能提供更多额外的氮源, 进而更有利于籽粒的形成.本研究结果可为高效研究大豆根瘤共生固氮提供营养液配方及获得足量的根瘤进行共生固氮研究, 同时也为大豆高产高效栽培提供了试验依据. ...