
首都师范大学生命科学学院, 北京 100048

引用本文
贡献者
接受日期:2017-09-20接受日期:2017-11-2网络出版日期:2017-11-1
-->Copyright
2017《植物学报》编辑部
Contributors
History
Received:Accepted:Online:
摘要:
Abstract:
Key words:
中科院遗传与发育所左建儒研究员与合作者, 于2017年8月17日在Molecular Cell杂志发表题为“Nitric Oxide Regulates Protein Methylation During Stress Responses in Plants”的论文, 被选为当期Featured Article。该刊同时发表题为“Modulating the Modulator: Regulation of Protein Methylation by Nitric Oxide”的专文评述(Frungillo and Spoel, 2017)。
左建儒研究团队长期致力于探究一氧化氮(nitric oxide, NO)信号通路调控植物生长发育与胁迫反应的分子机理。
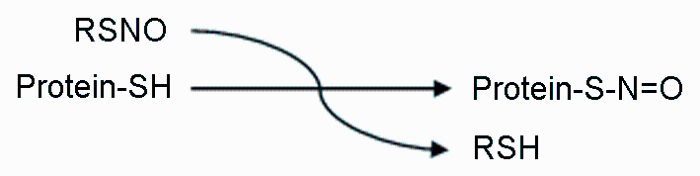
NO是自然界中已知存在的10种最小分子之一, 可以自由地穿过细胞膜(其半衰期只有数秒), 是有机体中广泛存在的一类信号分子并调控众多生物学过程。NO主要通过取代蛋白质中特异半胱氨酸残基中巯基基团的氢离子, 形成共价键相连的亚硝基硫醇(S-NO), 从而发挥其生物学功能(Hess et al., 2005; Astier et al., 2011)。这一过程被称为S-亚硝基化(S-nitrosylation) (图1), 是一种基于氧化还原、可逆的蛋白质翻译后修饰机制, 参与调控几乎所有信号通路。
图1
Figure 1
下载原图ZIP
生成PPT
图1
S-亚硝基化反应
Figure 1
The reactions of S-nitrosylation
已有研究表明, S-亚硝基化参与植物多种生理活动。NO可以通过S-亚硝基化修饰涉及水杨酸途径的关键蛋白NPR1, 从而调控拟南芥(Arabidopsis thalia- na)对病原侵染的应答反应(Tada et al., 2008)。AtMYB30蛋白在由超敏反应引起的细胞死亡过程中发挥关键作用, 该蛋白Cys-49和Cys-53两个位点的S-亚硝基化会降低其结合DNA的能力(Tavares et al., 2014)。植物进化系统中的保守蛋白S-亚硝基谷胱甘肽还原酶(S-nitrosolutathione reductase, GSNOR)催化S-亚硝基谷胱甘肽(S-nitrosoglutathione, GS- NO)的降解。拟南芥gsnor1-3及等位突变体par2内GSNO含量和大量蛋白S-亚硝基化水平升高, 同时伴有严重的生长发育障碍(Feechan et al., 2005; Chen et al., 2009)。据报道, 拟南芥APX1的Cys32受到S-亚硝基化修饰会增强其清除H2O2的活性(Yang et al., 2015)。ABA信号途径中的蛋白激酶OST1/SnRK2.6活性中心附近的半胱氨酸存在S-亚硝基化修饰, 导致活性中心被封闭, 从而在ABA影响下的气孔调节方面发挥作用(Wang et al., 2015)。
蛋白质甲基化也是一种非常重要的蛋白转录后修饰。甲基化位点多为赖氨酸和精氨酸, 不同的氨基酸受到不同类别的甲基化酶催化。其中精氨酸甲基转移酶家族(PRMTs)以精氨酸为底物。拟南芥PRMTs分为I类和II类, 而PRMT5属于II类精氨酸甲基转移酶, 参与调控各种生理活动。拟南芥PRMT5缺陷型突变体对盐处理表现为超敏感并伴有严重的发育障碍(Bedford and Clarke, 2009)。
左建儒研究组较早使用质谱技术, 通过高通量鉴定和深入系统研究植物体NO对蛋白质S-亚硝基化, 发现PRMT5蛋白碱基存在S-亚硝基化现象。随后的生物素-置换分析表明, PRMT5重组蛋白可以被GS- NO进行S-亚硝基化修饰; 同时, 体内实验证明, 拟南芥PRMT5在正常生理状态下也会被S-亚硝基化。生物信息学预测分析表明, PRMT5蛋白第125位半胱氨酸(Cys-125)存在S-亚硝基化修饰。为了进一步探明Cys-125 S-亚硝基化对PRMT5功能的影响, 他们构建了以缺陷型突变体prmt5-1为背景的PRMT5:: PRMT5-FLAG和PRMT5::PRMT5C125S-FLAG点突变转基因植株, 发现被S-亚硝基化的PRMT5C125S- FLAG蛋白量较对照下降25%, 这与体外生化实验(DAN-NAT assay)结果一致, 证明PRMT5蛋白第125位半胱氨酸在体外和体内都可以被S-亚硝基化修饰。
随后, 他们发现PRMT5蛋白第125位半胱氨酸S-亚硝基化现象对其在甲基转移酶活性调节方面具有重要作用。首先, 实验证明PRMT5C125S并未影响到GSNO和NaCl处理下PRMT5在量上的积累, 也未影响到其亚细胞定位。在生化实验中, 他们发现GSNO 显著增加PRMT5重组蛋白甲基转移酶活性, 而在PRMT5C125S-FLAG中并未发现这一现象。实验证明, PRMT5蛋白第125位半胱氨酸的S-亚硝基化修饰对于NO调节PRMT5蛋白甲基转移酶活性具有重要作用。
研究结果表明, 基因缺陷型突变体prmt5-1存在严重的发育障碍, 同时在非生物胁迫下表现为超敏感表型。PRMT5和PRMT5C125S转基因植株可以完全恢复缺陷型突变体prmt5-1在正常状态下的发育障碍。此外, PRMT5基因可以恢复缺陷型突变体prmt5-1对于NaCl和ABA处理下子叶失绿的表型。但是PRMT5 C125S转基因植株无法恢复上述表型, 表现出对NaCl和ABA超敏感, 与突变体prmt5-1表型相似。同样, PRMT5C125S转基因植株也只能部分恢复在NaCl处理下根长的表型。研究结果显示, PRMT5蛋白第125位半胱氨酸的S-亚硝基化修饰对于非生物胁迫调节有重要作用。前期实验表明, GSNO和NaCl处理并不影响PRMT5蛋白的积累。
SYM11抗体杂交结果表明, NaCl导致野生型拟南芥中14 kDa左右的蛋白质条带信号增强, 而该位置条带在prmt5-1突变体中几乎检测不到。PRMT5C125S转基因植株可以部分恢复该蛋白条带的信号, 但这些条带的信号却不受NaCl诱导, 证明PRMT5蛋白第125位半胱氨酸的S-亚硝基化修饰在NaCl诱导的精氨酸对称二甲基化方面具有调节作用。Pre-mRNA At1G18- 160的检测结果也表明, PRMT5C125S与prmt5-1基因缺陷型突变体具有相同的表型, 即在NaCl处理下会产生不规则pre-mRNA, 说明S-亚硝基化对于PRM- T5蛋白第125位半胱氨酸的修饰在PremRNA At1- G18160响应盐胁迫方面具有重要作用。
目前普遍的观点认为, NO在拟南芥响应盐胁迫方面发挥重要作用。高含量的外源GSNO可以提高拟南芥对盐胁迫的抗性。内源GSNO高含量突变体gsnor1-3也表现出对NaCl的抗性。同时NaCl处理可以使拟南芥NO水平升高。左建儒研究组用NaCl处理野生型拟南芥, 发现PRMT5的S-亚硝基化水平提高, 而在gsnor1-3突变体中PRMT5的S-亚硝基化水平也升高。同时他们观测到突变体gsnor1-3具有更高的anti-SYM11信号。以上结果说明, NO与精氨酸对称二甲基化修饰与拟南芥响应盐胁迫有关。进一步实验表明, GSNO处理无法使PRMT5C125S转基因植株获得更高的NaCl和ABA抗性, 其表现型与prmt5-1基因缺陷型突变体一致。而在野生型以及PRMT5转基因植株中, GSNO处理可以增强植株对NaCl和ABA的抗性。研究表明PRMT5蛋白第125位半胱氨酸的亚硝基化修饰对于PRMT5发挥功能具有非常重要的作用。
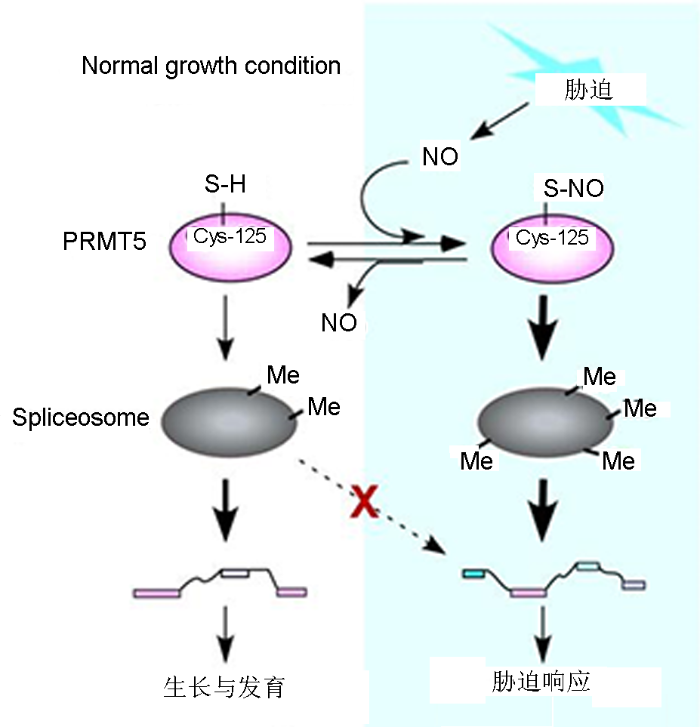
综上所述, 左建儒研究组通过生化和分子遗传学数据揭示, 在响应非生物胁迫时, NO通过对PRMT5第125位半胱氨酸残基(Cys-125)特异的亚硝基化修饰来调控其甲基转移酶活性, 即Cys-125为PRMT5感受NO信号所必需; PRMT5甲基转移酶中Cys-125的亚硝基化修饰增强了植物体内精氨酸双对称性甲基化修饰水平, 介导胁迫相关基因pre-mRNA的正常剪切, 从而增强植物对胁迫的耐受性。左建儒研究团队的开创性工作, 首次揭示了NO介导的蛋白质亚硝基化修饰与蛋白质甲基化通路互作、协调植物拮抗非生物胁迫的分子机制(图2)。
图2
Figure 2
下载原图ZIP
生成PPT
图2
蛋白质亚硝基化与甲基化通路互作调控植物胁迫反应的工作模型(Hu et al., 2017)
Figure 2
The working model of protein S-nitrosylation coordinating with protein methylation during stress in plants (Hu et al., 2017)
值得注意的是, 细胞内的蛋白质活性和相关调控功能与其分布的亚细胞区域及其精确定位密切相关。随着单分子标记活体观察和高分辨率显微技术的不断提高, 我们将可以更清晰准确地解析NO介导的蛋白质修饰后生理生化效应。
上述研究成果由中科院遗传与发育所左建儒研究组、曹晓风研究组、鲍时来研究组与中科院微生物所孔照胜研究组合作完成。左建儒研究组博士后胡济梁、左建儒研究组与孔照胜研究组联合培养博士后杨焕杰为该论文共同第一作者。该研究还获得国家自然科学基金、中科院战略性先导科技专项、植物基因组国家重点实验室、中国博士后科学基金会与中科院联合资助博士后基金等项目资助。
参考文献
文献选项
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | DOI:10.1016/j.plantsci.2011.02.011PMID:21893248URLIncreasing evidences support the assumption that nitric oxide (NO) acts as a physiological mediator in plants. Understanding its pleiotropic effects requires a deep analysis of the molecular mechanisms underlying its mode of action. In the recent years, efforts have been made in the identification of plant proteins modified by NO at the post-translational level, notably by S-nitrosylation. This reversible process involves the formation of a covalent bond between NO and reactive cysteine residues. This research has now born fruits and numerous proteins regulated by S-nitrosylation have been identified and characterized. This review describes the basic principle of S-nitrosylation as well as the Biotin Switch Technique and its recent adaptations allowing the identification of S-nitrosylated proteins in physiological contexts. The impact of S-nitrosylation on the structure/function of selected proteins is further discussed. [本文引用: 1] |
| [2] | DOI:10.1016/j.molcel.2008.12.013PMID:19150423URLThe covalent marking of proteins by methyl group addition to arginine residues can promote their recognition by binding partners or can modulate their biological activity. A small family of gene products that catalyze such methylation reactions in eukaryotes (PRMTs) works in conjunction with a changing cast of associated subunits to recognize distinct cellular substrates. These reactions display many of the attributes of reversible covalent modifications such as protein phosphorylation or protein lysine methylation; however, it is unclear to what extent protein arginine demethylation occurs. Physiological roles for protein arginine methylation have been established in signal transduction, mRNA splicing, transcriptional control, DNA repair, and protein translocation. [本文引用: 1] |
| [3] | [本文引用: 1] |
| [4] | [本文引用: 1] |
| [5] | DOI:10.1016/j.molcel.2017.08.001PMID:28820964URLAbstract Protein methylation is an important modulator of signal transduction pathways, but methyltransferases themselves may also be modulated. Hu et0002al. (2017) demonstrate in this issue of Molecular Cell that S-nitrosylation selectively modulates enzymatic activity of a protein arginine methyltransferase vital to abiotic stress tolerance. Copyright 0008 2017 Elsevier Inc. All rights reserved. [本文引用: 1] |
| [6] | [本文引用: 1] |
| [7] | DOI:10.1016/j.molcel.2017.06.031PMID:28757206URLMethylation and nitric oxide (NO)-based S -nitrosylation are highly conserved protein posttranslational modifications that regulate diverse biological processes. In higher eukaryotes, PRMT5 catalyzes Arg symmetric dimethylation, including key components of the spliceosome. The Arabidopsis prmt5 mutant shows severe developmental defects and impaired stress responses. However, little is known about the mechanisms regulating the PRMT5 activity. Here, we report that NO positively regulates the PRMT5 activity through S -nitrosylation at Cys-125 during stress responses. In prmt5-1 plants, a PRMT5 C125S transgene, carrying a non-nitrosylatable mutation at Cys-125, fully rescues the developmental defects, but not the stress hypersensitive phenotype and the responsiveness to NO during stress responses. Moreover, the salt-induced Arg symmetric dimethylation is abolished in PRMT5 C125S / prmt5-1 plants, correlated to aberrant splicing of pre-mRNA derived from a stress-related gene. These findings define a mechanism by which plants transduce stress-triggered NO signal to protein methylation machinery through S -nitrosylation of PRMT5 in response to environmental alterations. [本文引用: 2] |
| [8] | [本文引用: 1] |
| [9] | DOI:10.1016/j.bbapap.2014.02.015PMID:24583075URL61AtMYB30 S-nitrosylation interferes with its DNA binding activity.61AtMYB30 S-nitrosylation occurs in its two Cys residues, C49 and C53.61The S-nitrosylation of AtMYB30 influences thermal stability and overall structure. [本文引用: 1] |
| [10] | [本文引用: 1] |
| [11] | [本文引用: 1] |
1
2011
... NO是自然界中已知存在的10种最小分子之一, 可以自由地穿过细胞膜(其半衰期只有数秒), 是有机体中广泛存在的一类信号分子并调控众多生物学过程.NO主要通过取代蛋白质中特异半胱氨酸残基中巯基基团的氢离子, 形成共价键相连的亚硝基硫醇(S-NO), 从而发挥其生物学功能(
1
2009
... 蛋白质甲基化也是一种非常重要的蛋白转录后修饰.甲基化位点多为赖氨酸和精氨酸, 不同的氨基酸受到不同类别的甲基化酶催化.其中精氨酸甲基转移酶家族(PRMTs)以精氨酸为底物.拟南芥PRMTs分为I类和II类, 而PRMT5属于II类精氨酸甲基转移酶, 参与调控各种生理活动.拟南芥PRMT5缺陷型突变体对盐处理表现为超敏感并伴有严重的发育障碍(
1
2009
... 已有研究表明, S-亚硝基化参与植物多种生理活动.NO可以通过S-亚硝基化修饰涉及水杨酸途径的关键蛋白NPR1, 从而调控拟南芥(Arabidopsis thalia- na)对病原侵染的应答反应(
1
2005
... 已有研究表明, S-亚硝基化参与植物多种生理活动.NO可以通过S-亚硝基化修饰涉及水杨酸途径的关键蛋白NPR1, 从而调控拟南芥(Arabidopsis thalia- na)对病原侵染的应答反应(
1
2017
... 中科院遗传与发育所左建儒研究员与合作者, 于2017年8月17日在Molecular Cell杂志发表题为“Nitric Oxide Regulates Protein Methylation During Stress Responses in Plants”的论文, 被选为当期Featured Article.该刊同时发表题为“Modulating the Modulator: Regulation of Protein Methylation by Nitric Oxide”的专文评述(
1
2005
... NO是自然界中已知存在的10种最小分子之一, 可以自由地穿过细胞膜(其半衰期只有数秒), 是有机体中广泛存在的一类信号分子并调控众多生物学过程.NO主要通过取代蛋白质中特异半胱氨酸残基中巯基基团的氢离子, 形成共价键相连的亚硝基硫醇(S-NO), 从而发挥其生物学功能(
2
2017
... 蛋白质亚硝基化与甲基化通路互作调控植物胁迫反应的工作模型(
... The working model of protein S-nitrosylation coordinating with protein methylation during stress in plants (
1
2008
... 已有研究表明, S-亚硝基化参与植物多种生理活动.NO可以通过S-亚硝基化修饰涉及水杨酸途径的关键蛋白NPR1, 从而调控拟南芥(Arabidopsis thalia- na)对病原侵染的应答反应(
1
2014
... 已有研究表明, S-亚硝基化参与植物多种生理活动.NO可以通过S-亚硝基化修饰涉及水杨酸途径的关键蛋白NPR1, 从而调控拟南芥(Arabidopsis thalia- na)对病原侵染的应答反应(
1
2015
... 已有研究表明, S-亚硝基化参与植物多种生理活动.NO可以通过S-亚硝基化修饰涉及水杨酸途径的关键蛋白NPR1, 从而调控拟南芥(Arabidopsis thalia- na)对病原侵染的应答反应(
1
2015
... 已有研究表明, S-亚硝基化参与植物多种生理活动.NO可以通过S-亚硝基化修饰涉及水杨酸途径的关键蛋白NPR1, 从而调控拟南芥(Arabidopsis thalia- na)对病原侵染的应答反应(
