 ,1,2, 王冬
,1,2, 王冬 ,1,2,*, 周国英3, 熊丰3, 杜岩功3
,1,2,*, 周国英3, 熊丰3, 杜岩功3Soil microbial biomass carbon, nitrogen, phosphorus and their stoichiometric characteristics in alpine wetlands in the Three Rivers Sources Region
Xiu-Qing NIE ,1,2, Dong WANG
,1,2, Dong WANG ,1,2,*, Guo-Ying ZHOU3, Feng XIONG3, Yan-Gong DU3
,1,2,*, Guo-Ying ZHOU3, Feng XIONG3, Yan-Gong DU3通讯作者: *(dwang@caf.ac.cn)
编委: 韩文轩
责任编辑: 赵航
收稿日期:2021-03-26接受日期:2021-07-3
| 基金资助: |
Corresponding authors: *(dwang@caf.ac.cn)
Received:2021-03-26Accepted:2021-07-3
| Fund supported: |

摘要
微生物生物量及其化学计量特征是土壤养分循环的重要参数, 对预测气候变化和提高模型准确性及理解陆地生态系统养分循环都起到重要作用。为了明晰高寒生态系统土壤微生物生物量碳(MBC)、微生物生物量氮(MBN)、微生物生物量磷(MBP)浓度及其化学计量特征, 该研究通过在三江源区高寒湿地连续两年的野外调查和室内培养, 分析了50个样点的数据, 探究三江源高寒湿地MBC、MBN、MBP浓度及其化学计量特征, 明确了土壤理化特性和微生物群落特征对其影响。结果表明: (1)三江源高寒湿地MBC、MBN和MBP浓度分别为105.11、3.79和0.78 mmol·kg-1, MBC:MBN、MBC:MBP、MBN:MBP和MBC:MBN:MBP分别为50.56、184.89、5.42和275:5:1。高寒湿地土壤的MBC浓度显著高于高寒草甸土壤, 而MBN和MBP浓度在高寒湿地和高寒草甸土壤之间没有显著差异; 高寒湿地土壤的MBC:MBN和MBC:MBP显著高于高寒草甸土壤, 而MBN:MBP在高寒湿地和高寒草甸土壤之间差异不显著。(2)土壤理化特性与MBC、MBN和MBP浓度具有显著相关性。土壤含水率与MBC:MBN和MBC:MBP存在显著负相关关系, 而土壤密度与MBC:MBN和MBC:MBP浓度存在显著正相关关系, 土壤全氮含量和MBC:MBP存在显著负相关关系, 而与MBC:MBN的相关关系不显著。土壤理化特性对MBN:MBP的影响不显著。(3)整体而言, 微生物群落结构与MBC、MBN和MBP浓度之间存在显著的相关性。微生物群落结构和MBC:MBN、MBC:MBP的关系是相似的, 总磷脂脂肪酸(PLFA)含量、革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP存在显著负相关关系, 而真菌:细菌与MBC:MBN和MBC:MBP之间存在显著正相关关系, 真菌浓度与MBC:MBN和MBC:MBP之间的相关关系不显著。除丛枝菌根真菌外, MBN:MBP与微生物群落结构均无显著相关关系。
关键词:
Abstract
Aims Microbial biomass and their stoichiometric characteristics not only are important parameters of soil nutrient cycling, but also can contribute to prediction of climate changes, improvement of model accuracy, and understanding of terrestrial nutrient cycling. Our objective was to investigate microbial biomass carbon (MBC), microbial biomass nitrogen (MBN), and microbial biomass phosphorus (MBP) concentrations and their stoichiometric characteristics in alpine wetlands in the Three Rivers Sources Region. Methods Using data from 50 sites, we explored MBC, MBN, MBP, their stoichiometry and their relationships with the controlling factors of alpine wetlands in the Three Rivers Source Region. Important findings Our results showed that 1) MBC, MBN, MBP concentrations were 105.11, 3.79, 0.78 mmol·kg-1, respectively, and MBC:MBN, MBC:MBP, MBN:MBP, MBC:MBN:MBP were 50.56, 184.89, 5.42, 275:5:1, respectively. 2) Soil physical and chemical properties could significantly affect MBC, MBN and MBP concentration. Soil moisture had significantly negative effects on both MBC:MBN and MBC:MBP, while soil density had positive effects on both MBC:MBN and MBC:MBP. Soil total nitrogen content had negative relationship with MBC:MBP, while having weak effects on MBC:MBN. Soil physical and chemical properties also had weak effects on MBN:MBP. 3) Generally, soil microbial community composition had significant effects on MBC, MBN and MBP concentration. Soil microbial community composition had similar effects on MBC:MBN and MBC:MBP. Total phospholipid fatty acid (PLFA) content, gram-positive bacteria, gram-negative bacteria, bacteria, actinomycete, arbuscular mycorrhizal fungi concentration, and other PLFA content had negative effects on MBC:MBN and MBC:MBP, while fungi:bacteria had positive effects on both MBC:MBN and MBC:MBP, but fungi had weak relationships with both MBC:MBN and MBC:MBP. Except for arbuscular mycorrhizal fungi, MBN:MBP had weak relationships with soil microbial community composition. Soil physical and chemical properties, and soil microbial community composition had significant effects on soil microbial biomass and their stoichiometric characteristics in Three Rivers Sources Regions in the alpine wetlands, which are greatly helpful for deeply understanding of terrestrial high altitude nutrient cycling.
Keywords:
PDF (1769KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
引用本文
聂秀青, 王冬, 周国英, 熊丰, 杜岩功. 三江源地区高寒湿地土壤微生物生物量碳氮磷及其化学计量特征. 植物生态学报, 2021, 45(9): 996-1005. DOI: 10.17521/cjpe.2021.0113
NIE Xiu-Qing, WANG Dong, ZHOU Guo-Ying, XIONG Feng, DU Yan-Gong.

土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al., 1987; Li et al., 2014)。尽管微生物生物量碳(MBC)占土壤有机碳的比例不足2% (Zhou & Wang, 2015), 但是微生物生物量不仅可反映土壤养分及土壤碳的转化和循环, 也是碳循环模型的重要参数, 对预测气候变化对陆地生态系统的影响和提高模型的准确性都起到至关重要的作用(Medlyn et al., 2015)。微生物通过对N、P的固定可以显著影响土壤N、P含量, 甚至会影响植被生长(Attiwill & Adams, 1993; Frossard et al., 2000; Heuck et al., 2015)。MBC、微生物生物量氮(MBN)和微生物生物量磷(MBP)浓度的比值可作为判断土壤养分限制的重要指标(Cleveland & Liptzin, 2007), 对化学计量特征的研究有助于更深入地理解陆地生态系统养分循环和养分限制(Chen et al., 2013)。
已有研究表明, 在全球尺度, 森林生态系统和草地生态系统的MBC:MBP、MBN:MBP和MBC: MBN分别为74.0、47.3、8.9和4.9、8.2、8.3 (Cleveland & Liptzin, 2007)。生态系统类型的不同会形成不同的微生物生物量化学计量比。在区域尺度上, 已探明青藏高原的高寒草原和高寒草甸的MBC:MBN: MBP分别为81:6:1和48:5:1, 其化学计量特征受到土壤理化特性和微生物群落结构的影响(Chen et al., 2016), 而高寒湿地生态系统作为青藏高原重要的植被类型(白军红等, 2004), 其相关研究尚未见报道, 与高寒草地是否具有相似的化学计量特征和调控因素亦不清楚。
由于微生物由特定的元素比例组成, 所以其群落结构的变化会影响微生物生物量化学计量特征(Fanin et al., 2013; Mouginot et al., 2014)。青藏高原高寒草地MBC:MBP主要受到微生物群落结构的影响, 而微生物群落结构对MBC:MBN的影响相对较弱(Chen et al., 2016)。同时, 在不同的生态系统类型中, 微生物群落结构对土壤微生物化学计量特征的影响也是不同的, 如在高寒草甸生态系统中, 革兰氏阳性菌、革兰氏阴性菌、真菌、丛枝菌根真菌、放线菌浓度和其他磷脂脂肪酸(PLFA)含量均可以显著影响MBN:MBP, 而在高寒草原生态系统, 微生物群落结构与MBN:MBP的相关关系不显著(Chen et al., 2016)。类似地, 对黄土高原弃耕地的研究表明, 细菌和真菌浓度对MBC:MBN、MBC:MBP和MBN: MBP均未有显著的影响(Li et al., 2019)。高寒湿地是高寒生态系统水陆相互作用而形成的特殊生态系统, 其土壤特征有别于高寒草地, 高寒草地微生物群落结构对微生物生物量及其化学计量特征的影响是否也适用于高寒湿地尚未可知。
Xu等(2013)研究表明, 在全球尺度上, MBN:MBP随着纬度的增加而增加, 而Cleveland和Liptzin (2007)的研究表明, MBN:MBP随着纬度的变化未发生明显变化, 二者研究结果的不同表明了区域研究的重要性。相较于植被, 土壤微生物对土壤养分变化更加敏感(Cleveland & Liptzin, 2007)。土壤有机碳是MBC的重要来源(Mooshammer et al., 2014), 且土壤有机碳具有很高的异质性(Jobbágy & Jackson, 2000), 因此不同区域MBC可能也具有很高的异质性。此外, 青藏高原高寒生态系统土壤有机碳的地球化学循环具有一定的特殊性, 如高寒草地和高寒灌丛土壤有机碳含量随着温度的增加而增加, 有别于全球尺度的负相关关系(Yang et al., 2008; Nie et al., 2021)。因此, 探究高寒湿地生态系统土壤微生物生物量及其化学计量特征的影响因素有助于更好地掌握高海拔区域的生物地球化学循环特征, 也可为区域政策的制定提供科学的数据支撑。
青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等, 2017), 是我国重要的生态安全屏障(孙鸿烈等, 2012)。受全球气候变暖的影响, 该区域的气候发生了剧烈的变化, 年平均气温和年降水量分别以0.05 ℃·a-1和10.2 mm·10 a-1的速率增加(杨元合, 2018)。受全球氮沉降的影响, 青藏高原地区的总氮沉降速率为7.55 kg·hm-2·a-1 (Lü & Tian, 2007), 且大气氮沉降速率在持续增加(Liu et al., 2013)。地处青藏高原腹地的三江源地 区, 近40年来, 气温增加了1.5 ℃, 比全国平均增温要高0.3 ℃。降水量也呈增加趋势, 平均升高 1.35 mm·a-1, 且2003年以后降水量增加的速度开始加速(秦大河, 2014)。在三江源环境发生变化的背景下, 更有必要探究土壤微生物生物量及其土壤化学计量特征的影响因素。本研究通过在三江源高寒湿地和高寒草甸生态系统土壤MBC、MBN和MBP的调查研究, 旨在明确三江源地区高寒湿地MBC、MBN和MBP浓度及其化学计量特征, 探究微生物群落结构等生物因子和土壤养分含量、密度、含水率等非生物因子对高寒湿地MBC、MBN和MBP浓度及其化学计量特征的影响。
1 材料和方法
1.1 研究区概况及样地设置
三江源区地处青藏高原腹地, 是长江、黄河和澜沧江的发源地, 被誉为“中华水塔”。三江源区河流密布, 湖泊、沼泽众多, 雪山冰川分布广泛, 是世界上分布面积最大、海拔最高的区域, 湿地总面积达7.33 × 104 km2, 也是我国海拔最高、面积最大的天然湿地, 平均海拔4 000 m左右。其中沼泽分布面积大于2.5%, 是全国分布率最高的地区(秦大河, 2014)。三江源地域广阔, 景观类型多样, 分布有独特的高原生物群落, 动植物种类丰富, 植被类型齐全, 在生物多样性保护方面具有重要意义(秦大河, 2014)。由于三江源地区具有重大价值, 我国于2000年成立三江源自然保护区, 并于2019年成立三江源国家公园。高寒草甸和湿地为该区域的重要植被类型, 多以线叶嵩草(Kobresia capillifolia)、高山嵩草(K. pygmaea)和矮生嵩草(K. humilis)为优势物种。三江源源区海拔范围为3 335-6 564 m, 大部分地区海拔在4 000 m以上, 年平均气温为-5.6-3.8 ℃, 年降水量为262.2-772.8 mm, 主要土壤类型为高山寒漠土、高山草甸土、高山草原土等。近40年来, 三江源区气温显著升高。黄河源区每10年增温幅度最大, 为0.33 ℃; 长江源区增温幅度较黄河源略小, 为0.30 ℃; 澜沧江源区增温幅度最小, 为0.27 ℃ (秦大河, 2014)。2019-2020年7-8月, 对三江源的高寒草甸和湿地进行野外调查, 样地分布如图1所示, 在三江源区的曲麻莱、治多、杂多、囊谦、玉树、称多、玛多、甘德、达日、班玛、久治、玛沁、兴海、同德、贵南、泽库、河南等17个县市, 共计样地50处, 其中高寒草甸样地18个, 高寒湿地32个。
图1
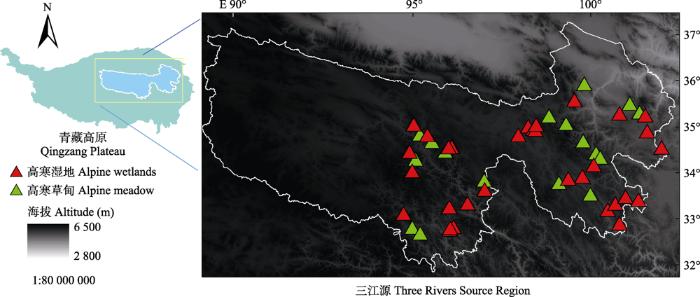 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1三江源地区高寒湿地样点分布图。
Fig. 1Distribution of sampling sites across the alpine wetlands in the Three Rivers Sources Region.
1.2 MBC、MBN、MBP浓度、微生物群落结构及相关指标的测定
每个样地收集3份0-10 cm土壤样品, 混匀作为1个样品。土壤样品分成两份。其中一份为土壤鲜样, 将其保存在4 ℃冰盒中, 带回实验室后, 除去可见的动植物残体, 过孔径2 mm筛, 混匀并在室温下风干至土壤含水量大约相当于40%的土壤饱和含水量, 室内培养10天, 培育温度为25 ℃ (Chen et al., 2016)。MBC和MBN浓度的测定采用氯仿熏蒸的方法。每份样本分为两份, 其中一份用0.5 mol·L-1 K2SO4提取, 另一份用氯仿熏蒸24 h后加0.5 mol·L-1 K2SO4提取, C、N含量用元素分析仪(PE-2400 II, Perkin-Elmer, Boston, USA)测定。以熏蒸土壤和未熏蒸土样提取的C与N含量的差值, 其中MBC和MBN分别统一用转化系数0.45和0.54计算, 测定总MBC和MBN浓度。MBP浓度测定过程中, 熏蒸过程与MBC和MBN的过程相同。对于熏蒸与未熏蒸的土壤样品, 均用0.5 mol·L-1 NaHCO3 (土壤:溶液(体积比) = 1:20)提取, 土壤全P含量用比色法测定。应用0.40的转化系数测定全部的MBP浓度(Chen et al., 2016)。微生物群落结构用PLFA法测定, 称取适量鲜土于土壤离心管中, 提取液为甲醇:氯仿:磷酸缓冲液(体积比2:1:0.8)振荡提取, 取氯仿相, N2吹干, 氯仿溶解后过硅胶柱, 以甲醇洗提, N2吹干洗提液, 用甲醇甲苯溶液(体积比1:1)溶解后甲酯化, 最后采用气相色谱——质谱联用技术(GC-MS)测定和鉴定磷脂脂肪酸甲酯, 得到土壤微生物的磷脂脂肪酸组成图谱, 进而得到一个群落中不同脂肪酸的含量和种类。其中18:2w6c表示真菌(Frostegård et al., 1993), 革兰氏阳性菌主要包括i14:0、i15:0、a15:0、i16:0、a17:0和i17:0; 革兰氏阴性菌主要为16:1w7c、cy17:0、18:1w7、18:1w5、cy18:0和cy19:0; 16:1w5c用于表示丛枝菌根真菌; 10-methyl16:0、10-methyl17:0和10-methyl18:0代表放线菌类, 其他PLFA主要包括14:0, 16:0, 16:1 2OH, 16:1w9c, 17:1w8c, 18:1w9c和18:3w6c等(Frostegård & Bååth, 1996)。
将另外一份土壤样品风干, 挑出粗根和砾石, 经研磨过2 mm筛; 为了减少毛细根对土壤元素含量测定的影响, 过筛后的土壤样品采用静电吸附的方法, 尽量将样品中的细根去除, 对挑根后的样品研磨过60目筛, 然后使用冷冻混合球磨仪研磨, 过100目筛。土壤全N含量用C/N元素分析仪测定。土壤密度和土壤含水量分别用环刀法测定和烘干法测定。
1.3 数据分析
为了实现数据的正态性, 分别将MBC、MBN和MBP浓度进行lg转化, 为了避免lg转化后MBN和MBP浓度<0, 转化前将其扩大10倍; 同样地, 也将MBC:MBN, MBC:MBP和MBN:MBP进行lg转化。采用独立样本t检验对转化后高寒湿地(样本量为32)和高寒草甸(样本量为18)的MBC、MBN和MBP浓度及其化学计量比进行比较, 判断是否存在显著性差异(p < 0.05)。土壤理化特征和微生物群落结构与MBC、MBN和MBP浓度及其化学计量的关系采用最小二乘法或幂函数进行拟合(p < 0.05)。2 结果
2.1 高寒湿地MBC、MBN和MBP浓度及其化学计量关系
三江源高寒湿地土壤MBC、MBN和MBP浓度分别为105.11、3.79和0.78 mmol·kg-1; MBC:MBN, MBC:MBP和MBN:MBP分别为50.56、184.89和5.42, MBC:MBN:MBP为275:5:1。三江源地区高寒湿地土壤MBC浓度显著高于高寒草甸(p = 0.000 4), MBN (p = 0.60)和MBP (p = 0.14)浓度在高寒草甸和高寒湿地之间无显著差异; 高寒湿地土壤MBC:MBN (p = 0.000 02)和MBC:MBP (p = 0.03)显著高于高寒草甸, 而MBN:MBP (p = 0.15)在高寒湿地和高寒草甸之间的差异不显著。Table 1
表1
表1高寒生态系统和全球陆地生态系统的土壤微生物生物量化学计量特征(平均值和95%的置信区间)
Table 1
| 植被类型 Vegetation type | MBC | MBN | MBP | MBC:MBN | MBC:MBP | MBN:MBP | MBC:MBN: MBP | 参考文献 Reference |
|---|---|---|---|---|---|---|---|---|
| 高寒草甸 Alpine meadow | 49.25a [38.92-61.58] | 3.40a [2.83-4.12] | 0.55a [0.42-0.69] | 14.53a [12.76-16.17] | 117.02a [79.22-168.91] | 8.13a [5.64-11.79] | 118:8:1 | 本研究 This study |
| 高寒湿地 Alpine wetland | 105.11b [81.33-133.33] | 3.79b [2.58-5.16] | 0.78a [0.55-1.06] | 50.56b [37.33-65.33] | 184.89b [156.25-213.18] | 5.42a [4.22-6.89] | 275:5:1 | 本研究 This study |
| 高寒草甸 Alpine meadow | 33.5 [30.1-37.2] | 3.24 [2.69-3.89] | 0.70 [0.61-0.80] | 10.23 [9.77-10.96] | 48.0 [43.8-52.6] | 4.68 [3.98-5.50] | 47.9:4.68:1 | Chen et al., 2016 |
| 高寒草原 Alpine steppe | 13.5 [11.9-15.4] | 1.00 [0.79-1.29] | 0.17 [0.14-0.20] | 13.49 [12.02-15.14] | 80.0 [71.4-89.5] | 6.03 [4.79-7.41] | 81.3:6.03:1 | Chen et al., 2016 |
| 全球湿地平均值 Global wetland average | 111.4 [84.4-147.0] | 19.3 [14.5-25.9] | 2.4 [1.1-5.4] | 9.5 [7.7-11.8] | 130.7 [62.1-275.0] | 35.7 [14.0-91.2] | 131:14:1 | Xu et al., 2013 |
| 全球平均值 Global average | 56.7 | 7.5 | 1.3 | 7.6 | 42.4 | 5.6 | 42:6:1 | Xu et al., 2013 |
| 82.3 [69.2-97.7] | 10.9 [9.1-12.9] | 1.4 [1.1-1.6] | 8.6 [8.3-8.9] | 59.5 [55.9-63.1] | 6.9 [6.5-7.3] | 60:7:1 | Cleveland & Liptzin, 2007 |
新窗口打开|下载CSV
2.2 高寒湿地土壤理化特性对MBC、MBN和MBP浓度及其化学计量关系的影响
高寒湿地土壤含水率、土壤全N含量和土壤密度的范围分别为23%-73%、0.73-12.17 g·kg-1和0.23-1.26 kg·m-2, 平均值分别为48%、4.24 g·kg-1和0.72 kg·m-2。土壤理化特性可以显著改变MBC、MBN和MBP浓度(图2)。土壤含水量和土壤全N含量与MBC、MBN和MBP浓度之间存在显著正相关关系(p < 0.05), 而土壤密度与MBC、MBN和MBP浓度之间存在显著负相关关系(p < 0.05)。土壤含水量与MBC:MBN和MBC:MBP之间存在显著负相关关系, 而土壤密度与MBC:MBN和MBC:MBP之间存在显著正相关关系(p < 0.05), 土壤全N含量和MBC:MBP之间存在显著负相关关系(p < 0.05), 而与MBC:MBN之间的相关关系不显著(p > 0.05)。土壤理化特性对MBN:MBP的影响不显著(p > 0.05)(图3)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2三江源地区高寒湿地土壤理化特性对土壤微生物生物量碳(MBC)、微生物生物量氮(MBN)和微生物生物量磷(MBP)浓度的影响。
Fig. 2Effects of soil physical and chemical properties on microbial biomass carbon (MBC), microbial biomass nitrogen (MBN) and microbial biomass phosphorus (MBP) concentration in alpine wetlands in the Three Rivers Sources Region.
图3
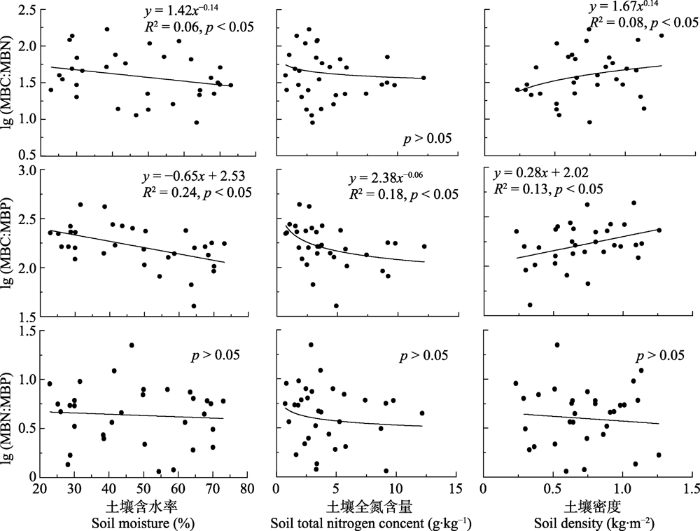 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3三江源地区高寒湿地土壤理化特性对微生物生物量化学计量比的影响。MBC, 微生物生物量碳; MBN, 微生物生物量氮; MBP, 微生物生物量磷。
Fig. 3Effects of soil physical and chemical properties on microbial biomass stoichiometry in alpine wetlands in the Three Rivers Sources Region. MBC, microbial biomass carbon; MBN, microbial biomass nitrogen; MBP, microbial biomass phosphorus.
2.3 高寒湿地微生物群落结构对MBC、MBN和MBP浓度及其化学计量关系的影响
高寒湿地的总PLFA含量、革兰氏阳性菌、革兰氏阴性菌、真菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量以及真菌细菌比的范围分别为34.70- 183.67、5.70-29.90、6.51-37.09、0.65-7.29、1.06- 11.88、0.59-5.95、17.45-99.52 nmol·g-1和0.04-0.23, 平均值分别为84.76、14.98、17.77、2.60、4.22、1.84、43.41 nmol·g-1和0.08。整体而言, 微生物群落结构与MBC、MBN和MBP浓度之间存在显著相关性(图4)。总PLFA含量、革兰氏阳性菌、革兰氏阴性菌、细菌、真菌、放线菌、丛枝菌根真菌浓度和其他PLFA的含量与MBC、MBN和MBP浓度之间存在正相关的关系, 其中真菌浓度对MBN浓度的作用相对较弱(p < 0.05); 而真菌:细菌和MBC、MBN和MBP浓度之间存在显著负相关关系, 其中对MBC浓度的作用相对较弱(p < 0.05)(图4)。微生物群落结构和MBC:MBN及MBC:MBP的关系是相似的, 总PLFA含量、革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著负相关关系(p < 0.05), 而真菌:细菌与MBC:MBN和MBC:MBP之间存在显著的正相关关系(p < 0.05), 真菌浓度与MBC:MBN和MBC:MBP之间的关系不显著(p > 0.05)。除丛枝菌根真菌外, MBN:MBP和微生物群落结构之间无显著相关性(p > 0.05)(图5)。
图4
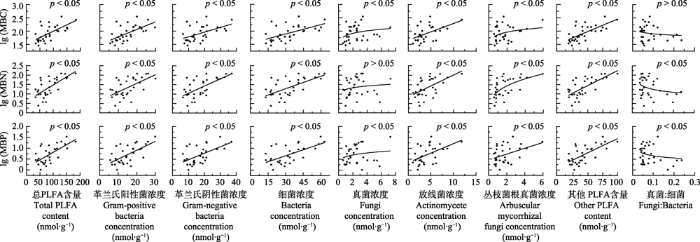 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4三江源地区高寒湿地微生物群落结构对微生物生物量碳(MBC)、微生物生物量氮(MBN)、微生物生物量磷(MBP)浓度的影响。PLFA, 总磷脂脂肪酸。
Fig. 4Effects of soil microbial community structure on microbial biomass carbon (MBC), microbial biomass nitrogen (MBN) and microbial biomass phosphorus (MBP) in alpine wetlands in the Three Rivers Sources Region. PLFA, total phospholipid fatty acid.
图5
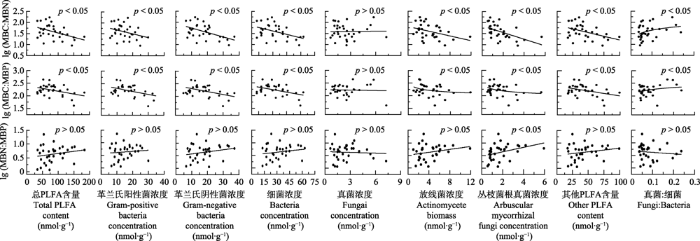 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5三江源地区高寒湿地微生物群落结构对微生物化学计量比的影响。MBC, 微生物生物量碳; MBN, 微生物生物量氮; MBP, 微生物生物量磷。PLFA, 总磷脂脂肪酸。
Fig. 5Effects of soil microbial community structure on microbial biomass stoichiometry in alpine wetlands in the Three Rivers Sources Region. MBC, microbial biomass carbon; MBN, microbial biomass nitrogen; MBP, microbial biomass phosphorus. PLFA, total phospholipid fatty acid.
3 讨论
3.1 MBC、MBN和MBP浓度及其化学计量特征
三江源高寒湿地MBC浓度为105.11 mmol·kg-1, 与全球湿地的111.4 mmol·kg-1无显著差异, 且高 于全球陆地生态系统平均值的56.7 mmol·kg-1 (Xu et al., 2013)和82.3 mmol·kg-1 (Cleveland & Liptzin, 2007)。同时, 该值也大于青藏高原高寒草甸的 33.5 mmol·kg-1和高寒草原的13.5 mmol·kg-1 (Chen et al., 2016)。植物残体是微生物的重要营养源, 植被的不同必然会导致土壤MBC浓度的差异性。发达的根系必将产生大量的根系分泌物, 进而为微生物提供了充足的能源物质, 有利于其生长繁殖(彭晓茜和王娓, 2016)。由于野外采集过程中很难将死根和活根区分, 因此并未作区分(Mu et al., 2018), 测得三江源区高寒湿地0-10 cm地下生物量为8.16 kg·m-2, 高寒草甸0-10 cm地下生物量为5.13 kg·m-2。相较于高寒草地生态系统, 高寒湿地生态系统具有更大的地下生物量, 这意味着更多的植物残体和根系分泌物的输入, 可能使得湿地土壤具有更高的MBC浓度。三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al., 2013)和全球陆地生态系统的平均值(7.5和1.3 mmol·kg-1 (Xu et al., 2013); 10.9和1.4 mmol·kg-1 (Cleveland & Liptzin, 2007)), 但与青藏高原高寒草甸(3.24和0.70 mmol·kg-1)差异不显著(Chen et al., 2016)。随着生态系统的演替, 不同组分的营养元素储量呈现不同的动态变化过程, 土壤磷的消耗是影响其储量的根本原因(Vitousek et al., 2010)。三江源地处青藏高原腹地, 在全球气候变暖的背景下, 青藏高原在过去几十年经历着显著的多年冻土退化, 导致土壤养分如N和P的大量损失(Yang et al., 2010; 杨文静等, 2019)。研究区土壤全N和全P含量分别为402.1和20.1 mmol·kg-1, 均低于全球湿地平均水平的1 231.5和26.5 mmol·kg-1 (Xu et al., 2013)。而营养元素如有效磷的缺失, 可以限制微生物生物量积累和微生物活动(Cleveland et al., 2002), 这可能是导致MBN和MBP浓度较低的原因(Li et al., 2014)。
由于MBC浓度相对较高, 而MBN和MBP浓度相对较低, 使得三江源地区高寒湿地MBC:MBN (50.56)高于全球湿地(9.5)和全球陆地生态系统平均值(7.6 (Xu et al., 2013)和10.23 (Cleveland & Liptzin, 2007)); 类似地, 高寒湿地MBC:MBP (184.89)高于全球湿地(130.7)和全球平均值(42.4 (Xu et al., 2013)和48.0 (Cleveland & Liptzin, 2007))。
3.2 MBC、MBN、MBP浓度及其化学计量比与土壤理化性质的关系
土壤含水量和土壤全N含量与MBC、MBN和MBP浓度之间存在显著正相关关系, 而土壤密度和MBC、MBN和MBP浓度之间存在显著负相关关系(图2)。类似地, 在全球森林生态系统, 土壤全N含量与MBC和MBP浓度存在显著正相关关系(Li et al., 2014), 青藏高原高寒草地MBC、MBN和MBP与土壤含水率也存在显著正相关关系(Chen et al., 2016)。土壤的理化特性可以显著地改变微生物生物量。土壤养分含量越高, 微生物数量越多(王长庭等, 2010), 土壤密度越大意味着土壤颗粒组成越紧实, 这将导致土壤通气性降低, 微生物的生长环境变差, 使得微生物数量降低。随着土壤含水量的增加, MBN和MBP浓度的变化量(斜率)相近, 分别为2.09和2.22, 高于MBC的变化量(1.57, 图2)。因此, 土壤含水量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 而MBN:MBP随着含水量的增加并未发生显著变化(p > 0.05)。类似地, 随着土壤全N含量的增加, MBC、MBN和MBP浓度的变化量为0.06、0.07和0.09, 其中MBC和MBP浓度变化量的差别较大, 这使得MBC:MBP与土壤全N含量之间存在显著的负相关的关系(p < 0.05), 而MBC:MBN和MBN:MBP随着土壤全N含量的增加, 其降低趋势不显著(p > 0.05)。然而, 土壤密度与土壤含水量和土壤养分含量和MBC、MBN和MBP浓度的作用趋势相反, 随着土壤密度的增加, MBN和MBP浓度的变化量相近, 分别为-0.89和-0.85, 因此, MBN:MBP随着土壤密度的增加并未发生显著的变化, 而MBC浓度的变化量为-0.56, 低于MBN和MBP浓度的变化量, 因此, MBC:MBN和MBC:MBP随着土壤密度的增加而显著增加。随着土壤条件的改善, 微生物倾向于降低C利用效率, 而提高N利用效率(Zechmeister-Boltenstern et al., 2015), 进而使得MBC:MBN和MBC:MBP有降低的趋势。此外, 三江源地区大部分海拔在4 000 m以上, 气候寒冷, 此时微生物可能会增加N和P的吸收以弥补较低的微生物活动造成的影响(Reich & Oleksyn, 2004; Li et al., 2014)。
3.3 MBC、MBN、MBP浓度及其化学计量比与微生物群落结构的关系
整体而言, 总PLFA含量、革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC、MBN和MBP浓度之间存在正相关关系, 且真菌的作用相对较弱。对植被类型为欧洲山毛榉(Fagus sylvatica)落叶阔叶林的样地开展的相关控制实验也表明, 微生物的群落结构可以显著地改变MBC、MBN和MBP浓度(Heuck et al., 2015), 不仅细菌可以显著地改变MBC、MBN和MBP浓度, 而且真菌也能够显著地影响MBN浓度(r = 0.699, p < 0.001)(Heuck et al., 2015)。然而, 本研究中真菌浓度与MBN浓度之间的相关关系较弱(p > 0.05), 两者结果差异表明, 微生物群落结构对微生物生物量的调控可能与植被类型及其特定的生境条件有关。微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05)。可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al., 2007; Chen et al., 2016)。当养分较为贫瘠时, 相较于r策略, 微生物倾向于采取K策略, 分解更多的高碳底物, 使得微生物具有更高的MBC: MBN和MBC:MBP (Strickland & Rousk, 2010; Chen et al., 2016); 然而, 周转和生长迅速的r策略则相反, 常具较低的MBC:MBN和MBC:MBP (Kaiser et al., 2014; 周正虎和王传宽, 2016), 且高生长速率需要对富含P的核糖体RNA进行投资(Elser et al., 2003), 进而形成负相关的关系。而真菌:细菌与MBC:MBN和MBC:MBP之间存在显著正相关关系。相较于细菌, 真菌的代谢活动更低且对P的需求更少, 使得真菌的MBC:MBN和MBC:MBP更高(Strickland & Rousk, 2010; Mouginot et al., 2014), 因此真菌:细菌增大, 使得MBC:MBN和MBC:MBP显著地增加(p > 0.05)。
4 结论
(1) 三江源高寒湿地土壤的MBC浓度显著高于高寒草甸, 而MBN和MBP浓度在高寒草甸和高寒湿地之间没有显著差异; 高寒湿地的土壤MBC:MBN和MBC:MBP显著高于高寒草甸, 而MBN:MBP在高寒草甸和高寒湿地之间的差异不显著。(2) 土壤理化特性可以显著改变MBC、MBN和MBP浓度。类似地, 土壤理化特性与MBC:MBN和MBC:MBP之间存在显著的相关性, 而土壤含水率、土壤全N含量和密度与MBN:MBP的关系不显著。
(3) 整体而言, 微生物群落结构与MBC、MBN和MBP浓度之间存在显著的相关性。相较于MBN:MBP, MBC:MBN和MBC:MBP更容易受到微生物群落结构的影响。
致谢
林木培育重点实验室专项资金项目(ZDRIF201905)对本研究有资助, 在此表示感谢。感谢青海师范大学李晶晶和中国科学院西北高原生物研究所王玲玲在野外采样和室内样品处理过程中给予的帮助。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
DOI:10.1111/j.1469-8137.1993.tb03847.xPMID:33874438 [本文引用: 1]

Studies of nutrient cycling in forests span more than 100 yr. In earlier years, most attention was given to the measurement of the pools of nutrients in plants and soil and of the return of nutrients from plant to soil in litterfall. The past 20 yr or so have seen a major concentration on the processes of nutrient cycling, with particular emphasis on those processes by which the supply of nutrients to the growing forest is sustained. In the more highly productive forests, up to 10 tonnes of litter of low nutritional quality is deposited annually on the forest floor. The decomposition of this litter, the mineralization of the nutrients it holds, and the uptake of nutrients by tree roots in the carbon-rich environment which results are the themes of this review. Studies of decomposition of litter in forests have been dominated by the role of nitrogen as a limiting factor, a domination which reflects the preponderance of studies of temperate forests in the Northern Hemisphere. For many forests of the world growing on soils of considerable age, it seems more probable that growth and nutrient cycling are limited by phosphorus (or some other element). There is increasing evidence for a number of forests that phosphorus is immobilized in the first stages of decomposition to a significantly greater extent than is nitrogen. Advances in research will depend, as with studies of soil organic matter, in denning and developing analytical techniques for studying biologically active forms of potentially limiting nutrients, rather than total elemental concentrations. The availability of phosphorus in forests is sustained by phosphorus cycling. More than 50% of the total phosphorus in the surface soils is in organic forms and much of the more labile phosphorus is in the form of diesters. Phosphorus availability is determined by competition between biological and geochemical sinks, and it is clear that the sinks in the rhizosphere (plant roots, microorganisms, soil mineral and organic components) are extensively modified by active processes (e.g. production of exudates, nutrient storage in a variety of organic or polymeric forms and nutrient transport away from sites of uptake). There is abundant evidence that roots of many species exude compounds which have the ability to solubilize sources of phosphorus of otherwise low availability. The significance of root exudates (for example, phosphatases, organic acids) in the functioning of perennial ecosystems has yet to be quantified and there are conflicting reports as to the effects of simple organic acids on phosphorus availability. The distribution of phosphorus sinks and their relative competitiveness and their modification are topics of fundamental importance for future research. In contrast to the mineralization of phosphorus, our knowledge of transformations and availability of nitrogen in forest soils is well-developed. Net nitrogen mineralization rates approximate rates of nitrogen return in litterfall but the contribution of nitrification is variable. Nitrification is not inhibited by the low pH of many forest soils and there is increasing evidence of nitrate immobilization by microorganisms and of increased diversity and better competitiveness for NH of nitrifying microorganisms than has previously been accepted. Variability in rates of nitrification is often interpreted as being due to allelopathy. Hypotheses invoking allelopathy are more or less untestable, and it seems likely that new techniques using N in situ will lead to a more fundamental understanding of nitrogen transformations in forest soils. Recent studies in coniferous forest soils have highlighted the short (< 1 d) turnover time of NH. Finally, it seems that forest soils are resistant to major changes in patterns of nitrogen mineralization (and certainly, because of the large number of sinks, in patterns of phosphorus mineralization) following disturbance by natural events such as wind-throw and fire, and by man-made events such as logging and fertilizing. The long-term disturbance by acid rain is a more complex matter since forest ecosystems are not adequate buffers for nitrate. Contents Summary 561 I. Introduction 562 II. Linking nutrient cycling to nutrient availability - Setting the themes 563 III. The nature of soil organic matter 566 IV. Tree roots and the availability of nutrients 566 V. The decomposition of forest litter 569 VI. Mineralization of organically-bound nutrients 571 Acknowledgements 576 References 576.
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/more.2013.36.issue-2URL [本文引用: 1]
[本文引用: 12]
DOI:10.1007/s10533-007-9132-0URL [本文引用: 9]
DOI:10.1007/s10021-002-0202-9URL [本文引用: 1]
DOI:10.1046/j.1461-0248.2003.00518.xURL [本文引用: 1]
DOI:10.1111/ele.12108URL [本文引用: 1]
PMID:17601128 [本文引用: 1]

Although researchers have begun cataloging the incredible diversity of bacteria found in soil, we are largely unable to interpret this information in an ecological context, including which groups of bacteria are most abundant in different soils and why. With this study, we examined how the abundances of major soil bacterial phyla correspond to the biotic and abiotic characteristics of the soil environment to determine if they can be divided into ecologically meaningful categories. To do this, we collected 71 unique soil samples from a wide range of ecosystems across North America and looked for relationships between soil properties and the relative abundances of six dominant bacterial phyla (Acidobacteria, Bacteroidetes, Firmicutes, Actinobacteria, alpha-Proteobacteria, and the beta-Proteobacteria). Of the soil properties measured, net carbon (C) mineralization rate (an index of C availability) was the best predictor of phylum-level abundances. There was a negative correlation between Acidobacteria abundance and C mineralization rates (r2 = 0.26, P < 0.001), while the abundances of beta-Proteobacteria and Bacteroidetes were positively correlated with C mineralization rates (r2 = 0.35, P < 0.001 and r2 = 0.34, P < 0.001, respectively). These patterns were explored further using both experimental and meta-analytical approaches. We amended soil cores from a specific site with varying levels of sucrose over a 12-month period to maintain a gradient of elevated C availabilities. This experiment confirmed our survey results: there was a negative relationship between C amendment level and the abundance of Acidobacteria (r2 = 0.42, P < 0.01) and a positive relationship for both Bacteroidetes and beta-Proteobacteria (r2 = 0.38 and 0.70, respectively; P < 0.01 for each). Further support for a relationship between the relative abundances of these bacterial phyla and C availability was garnered from an analysis of published bacterial clone libraries from bulk and rhizosphere soils. Together our survey, experimental, and meta-analytical results suggest that certain bacterial phyla can be differentiated into copiotrophic and oligotrophic categories that correspond to the r- and K-selected categories used to describe the ecological attributes of plants and animals. By applying the copiotroph-oligotroph concept to soil microorganisms we can make specific predictions about the ecological attributes of various bacterial taxa and better understand the structure and function of soil bacterial communities.
[本文引用: 1]
DOI:10.1007/BF00384433URL [本文引用: 1]
DOI:10.1016/0038-0717(93)90113-PURL [本文引用: 1]
DOI:10.1016/j.soilbio.2015.02.029URL [本文引用: 3]
DOI:10.1890/1051-0761(2000)010[0423:TVDOSO]2.0.CO;2URL [本文引用: 1]
DOI:10.1111/ele.2014.17.issue-6URL [本文引用: 1]
URL [本文引用: 1]
DOI:10.1111/geb.2014.23.issue-9URL [本文引用: 4]
DOI:10.1038/nature11917URL [本文引用: 1]
[本文引用: 1]
DOI:10.1038/nclimate2621URL [本文引用: 1]
PMID:24550895 [本文引用: 1]

Terrestrial microbial decomposer communities thrive on a wide range of organic matter types that rarely ever meet their elemental demands. In this review we synthesize the current state-of-the-art of microbial adaptations to resource stoichiometry, in order to gain a deeper understanding of the interactions between heterotrophic microbial communities and their chemical environment. The stoichiometric imbalance between microbial communities and their organic substrates generally decreases from wood to leaf litter and further to topsoil and subsoil organic matter. Microbial communities can respond to these imbalances in four ways: first, they adapt their biomass composition toward their resource in a non-homeostatic behavior. Such changes are, however, only moderate, and occur mainly because of changes in microbial community structure and less so due to cellular storage of elements in excess. Second, microbial communities can mobilize resources that meet their elemental demand by producing specific extracellular enzymes, which, in turn, is restricted by the C and N requirement for enzyme production itself. Third, microbes can regulate their element use efficiencies (ratio of element invested in growth over total element uptake), such that they release elements in excess depending on their demand (e.g., respiration and N mineralization). Fourth, diazotrophic bacteria and saprotrophic fungi may trigger the input of external N and P to decomposer communities. Theoretical considerations show that adjustments in element use efficiencies may be the most important mechanism by which microbes regulate their biomass stoichiometry. This review summarizes different views on how microbes cope with imbalanced supply of C, N and P thereby providing a framework for integrating and linking microbial adaptation to resource imbalances to ecosystem scale fluxes across scales and ecosystems.
DOI:10.1016/j.soilbio.2014.05.011URL [本文引用: 2]
URL [本文引用: 1]
DOI:10.1111/ejss.v72.4URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1016/0038-0717(87)90076-9URL [本文引用: 1]
[本文引用: 4]
[本文引用: 4]
[本文引用: 1]
DOI:10.1016/j.soilbio.2010.05.007URL [本文引用: 2]
[本文引用: 1]
DOI:10.11821/xb201201001 [本文引用: 1]

青藏高原对我国乃至亚洲生态安全具有重要的屏障作用。在全球变化和人类活动的综合影响下,青藏高原呈现出生态系统稳定性降低、资源环境压力增大等问题,突出表现为:冰川退缩显著、土地退化形势严峻、水土流失加剧、生物多样性威胁加大与珍稀生物资源减少、自然灾害增多等。这些问题严重影响了青藏高原区域生态安全屏障功能的发挥。针对当前高原生态安全状况,在总结相关研究成果和生态建设实践经验的基础上,提出了加强青藏高原国家生态安全屏障保护与建设的对策建议:加强气候变化对青藏高原生态屏障作用影响及区域生态安全调控作用的基础研究;系统开展高原生态安全屏障保护和建设关键技术研究与示范推广;部署建设生态屏障功能动态监测体系,加强生态安全屏障保护与建设成效评估,构建评估体系和标准,并凝练经验,以系统提升国家生态安全屏障的总体功能,在应对全球变化中占据主动地位。
DOI:10.1890/08-0127.1URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1111/geb.12029URL [本文引用: 9]
DOI:10.1016/j.earscirev.2010.07.002URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.17521/cjpe.2018.0048URL [本文引用: 1]
DOI:10.17521/cjpe.2018.0048 [本文引用: 1]
DOI:10.1111/gcb.2008.14.issue-7URL [本文引用: 1]
[本文引用: 1]
[本文引用: 1]
DOI:10.1890/14-0777.1URL [本文引用: 1]
DOI:10.5194/bg-12-6751-2015URL [本文引用: 1]
DOI:10.17521/cjpe.2015.0449URL [本文引用: 1]
DOI:10.17521/cjpe.2015.0449 [本文引用: 1]

微生物分解者的生存和生长策略、群落结构和功能会随着底物化学计量特征而改变, 从而强烈地影响底物的分解速度和元素的周转速率, 进而影响生态系统的功能过程。深入理解微生物生理代谢活动和群落结构与陆地生态系统过程之间的联系及其对全球变化的响应和反馈机理是生态学和全球变化生物学领域值得关注的重大科学命题。该文基于生态化学计量学理论和代谢理论, 首先介绍微生物在陆地生态系统碳氮磷循环中的作用; 然后综述微生物对分解底物化学计量变异性的响应和调节的4种主要机制: (1)调整微生物自身化学计量特征; (2)调整微生物群落结构; (3)产生特定的胞外酶以获取受限制的资源; (4)改变碳氮磷元素利用效率。最后, 通过分析当前研究不足, 提出该领域亟需关注的科学问题有: (1)综合阐明微生物对底物化学计量变化响应的各种机制及其相对重要性; (2)探索全球变化对微生物驱动的碳氮磷循环的影响; (3)探索微生物对底物化学计量变化适应对策的时空变化。
Nutrient cycling in forests
1
1993
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
青藏高原湿地研究进展
1
2004
... 已有研究表明, 在全球尺度, 森林生态系统和草地生态系统的MBC:MBP、MBN:MBP和MBC: MBN分别为74.0、47.3、8.9和4.9、8.2、8.3 (Cleveland & Liptzin,
青藏高原湿地研究进展
1
2004
... 已有研究表明, 在全球尺度, 森林生态系统和草地生态系统的MBC:MBP、MBN:MBP和MBC: MBN分别为74.0、47.3、8.9和4.9、8.2、8.3 (Cleveland & Liptzin,
Leaf nitrogen and phosphorus concentrations of woody plants differ in responses to climate, soil and plant growth form
1
2013
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
12
2016
... 已有研究表明, 在全球尺度, 森林生态系统和草地生态系统的MBC:MBP、MBN:MBP和MBC: MBN分别为74.0、47.3、8.9和4.9、8.2、8.3 (Cleveland & Liptzin,
... 由于微生物由特定的元素比例组成, 所以其群落结构的变化会影响微生物生物量化学计量特征(Fanin et al.,
... .,
... 每个样地收集3份0-10 cm土壤样品, 混匀作为1个样品.土壤样品分成两份.其中一份为土壤鲜样, 将其保存在4 ℃冰盒中, 带回实验室后, 除去可见的动植物残体, 过孔径2 mm筛, 混匀并在室温下风干至土壤含水量大约相当于40%的土壤饱和含水量, 室内培养10天, 培育温度为25 ℃ (Chen et al.,
... .,
... Stoichiometric characteristics of soil microbial biomass (results are shown as means and 95% confidence intervals) in alpine ecosystems and global biomes
| 植被类型 Vegetation type | MBC | MBN | MBP | MBC:MBN | MBC:MBP | MBN:MBP | MBC:MBN: MBP | 参考文献 Reference |
|---|---|---|---|---|---|---|---|---|
| 高寒草甸 Alpine meadow | 49.25a [38.92-61.58] | 3.40a [2.83-4.12] | 0.55a [0.42-0.69] | 14.53a [12.76-16.17] | 117.02a [79.22-168.91] | 8.13a [5.64-11.79] | 118:8:1 | 本研究 This study |
| 高寒湿地 Alpine wetland | 105.11b [81.33-133.33] | 3.79b [2.58-5.16] | 0.78a [0.55-1.06] | 50.56b [37.33-65.33] | 184.89b [156.25-213.18] | 5.42a [4.22-6.89] | 275:5:1 | 本研究 This study |
| 高寒草甸 Alpine meadow | 33.5 [30.1-37.2] | 3.24 [2.69-3.89] | 0.70 [0.61-0.80] | 10.23 [9.77-10.96] | 48.0 [43.8-52.6] | 4.68 [3.98-5.50] | 47.9:4.68:1 | Chen et al., |
| 高寒草原 Alpine steppe | 13.5 [11.9-15.4] | 1.00 [0.79-1.29] | 0.17 [0.14-0.20] | 13.49 [12.02-15.14] | 80.0 [71.4-89.5] | 6.03 [4.79-7.41] | 81.3:6.03:1 | Chen et al., |
| 全球湿地平均值 Global wetland average | 111.4 [84.4-147.0] | 19.3 [14.5-25.9] | 2.4 [1.1-5.4] | 9.5 [7.7-11.8] | 130.7 [62.1-275.0] | 35.7 [14.0-91.2] | 131:14:1 | Xu et al., |
| 全球平均值 Global average | 56.7 | 7.5 | 1.3 | 7.6 | 42.4 | 5.6 | 42:6:1 | Xu et al., |
| 82.3 [69.2-97.7] | 10.9 [9.1-12.9] | 1.4 [1.1-1.6] | 8.6 [8.3-8.9] | 59.5 [55.9-63.1] | 6.9 [6.5-7.3] | 60:7:1 | Cleveland & Liptzin, |
... .,
Global wetland average
[84.4-147.0]
[14.5-25.9]
[1.1-5.4]
[7.7-11.8]
[62.1-275.0]
[14.0-91.2]
Global average
[69.2-97.7]
[9.1-12.9]
[1.1-1.6]
[8.3-8.9]
[55.9-63.1]
[6.5-7.3]
... 三江源高寒湿地MBC浓度为105.11 mmol·kg-1, 与全球湿地的111.4 mmol·kg-1无显著差异, 且高 于全球陆地生态系统平均值的56.7 mmol·kg-1 (Xu et al.,
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
... 土壤含水量和土壤全N含量与MBC、MBN和MBP浓度之间存在显著正相关关系, 而土壤密度和MBC、MBN和MBP浓度之间存在显著负相关关系(
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
... .,
C:N:P stoichiometry in soil: Is there a “Redfield ratio” for the microbial biomass
9
2007
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
... 已有研究表明, 在全球尺度, 森林生态系统和草地生态系统的MBC:MBP、MBN:MBP和MBC: MBN分别为74.0、47.3、8.9和4.9、8.2、8.3 (Cleveland & Liptzin,
... Xu等(
... )的研究表明, MBN:MBP随着纬度的变化未发生明显变化, 二者研究结果的不同表明了区域研究的重要性.相较于植被, 土壤微生物对土壤养分变化更加敏感(Cleveland & Liptzin,
... Stoichiometric characteristics of soil microbial biomass (results are shown as means and 95% confidence intervals) in alpine ecosystems and global biomes
| 植被类型 Vegetation type | MBC | MBN | MBP | MBC:MBN | MBC:MBP | MBN:MBP | MBC:MBN: MBP | 参考文献 Reference |
|---|---|---|---|---|---|---|---|---|
| 高寒草甸 Alpine meadow | 49.25a [38.92-61.58] | 3.40a [2.83-4.12] | 0.55a [0.42-0.69] | 14.53a [12.76-16.17] | 117.02a [79.22-168.91] | 8.13a [5.64-11.79] | 118:8:1 | 本研究 This study |
| 高寒湿地 Alpine wetland | 105.11b [81.33-133.33] | 3.79b [2.58-5.16] | 0.78a [0.55-1.06] | 50.56b [37.33-65.33] | 184.89b [156.25-213.18] | 5.42a [4.22-6.89] | 275:5:1 | 本研究 This study |
| 高寒草甸 Alpine meadow | 33.5 [30.1-37.2] | 3.24 [2.69-3.89] | 0.70 [0.61-0.80] | 10.23 [9.77-10.96] | 48.0 [43.8-52.6] | 4.68 [3.98-5.50] | 47.9:4.68:1 | Chen et al., |
| 高寒草原 Alpine steppe | 13.5 [11.9-15.4] | 1.00 [0.79-1.29] | 0.17 [0.14-0.20] | 13.49 [12.02-15.14] | 80.0 [71.4-89.5] | 6.03 [4.79-7.41] | 81.3:6.03:1 | Chen et al., |
| 全球湿地平均值 Global wetland average | 111.4 [84.4-147.0] | 19.3 [14.5-25.9] | 2.4 [1.1-5.4] | 9.5 [7.7-11.8] | 130.7 [62.1-275.0] | 35.7 [14.0-91.2] | 131:14:1 | Xu et al., |
| 全球平均值 Global average | 56.7 | 7.5 | 1.3 | 7.6 | 42.4 | 5.6 | 42:6:1 | Xu et al., |
| 82.3 [69.2-97.7] | 10.9 [9.1-12.9] | 1.4 [1.1-1.6] | 8.6 [8.3-8.9] | 59.5 [55.9-63.1] | 6.9 [6.5-7.3] | 60:7:1 | Cleveland & Liptzin, |
... 三江源高寒湿地MBC浓度为105.11 mmol·kg-1, 与全球湿地的111.4 mmol·kg-1无显著差异, 且高 于全球陆地生态系统平均值的56.7 mmol·kg-1 (Xu et al.,
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
... 由于MBC浓度相对较高, 而MBN和MBP浓度相对较低, 使得三江源地区高寒湿地MBC:MBN (50.56)高于全球湿地(9.5)和全球陆地生态系统平均值(7.6 (Xu et al.,
... )和48.0 (Cleveland & Liptzin,
Phosphorus limitation of microbial processes in moist tropical forests: evidence from short-term laboratory incubations and field studies
1
2002
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
Growth rate-stoichiometry couplings in diverse biota
1
2003
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
An experimental test of the hypothesis of non-homeostatic consumer stoichiometry in a plant litter-microbe system
1
2013
... 由于微生物由特定的元素比例组成, 所以其群落结构的变化会影响微生物生物量化学计量特征(Fanin et al.,
Toward an ecological classification of soil bacteria
1
2007
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
Processes governing phosphorus availability in temperate soils
1
2000
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil
1
1996
... 微生物群落结构用PLFA法测定, 称取适量鲜土于土壤离心管中, 提取液为甲醇:氯仿:磷酸缓冲液(体积比2:1:0.8)振荡提取, 取氯仿相, N2吹干, 氯仿溶解后过硅胶柱, 以甲醇洗提, N2吹干洗提液, 用甲醇甲苯溶液(体积比1:1)溶解后甲酯化, 最后采用气相色谱——质谱联用技术(GC-MS)测定和鉴定磷脂脂肪酸甲酯, 得到土壤微生物的磷脂脂肪酸组成图谱, 进而得到一个群落中不同脂肪酸的含量和种类.其中18:2w6c表示真菌(Frostegård et al.,
Shifts in the structure of soil microbial communities in limed forests as revealed by phospholipid fatty acid analysis
1
1993
... 微生物群落结构用PLFA法测定, 称取适量鲜土于土壤离心管中, 提取液为甲醇:氯仿:磷酸缓冲液(体积比2:1:0.8)振荡提取, 取氯仿相, N2吹干, 氯仿溶解后过硅胶柱, 以甲醇洗提, N2吹干洗提液, 用甲醇甲苯溶液(体积比1:1)溶解后甲酯化, 最后采用气相色谱——质谱联用技术(GC-MS)测定和鉴定磷脂脂肪酸甲酯, 得到土壤微生物的磷脂脂肪酸组成图谱, 进而得到一个群落中不同脂肪酸的含量和种类.其中18:2w6c表示真菌(Frostegård et al.,
Soil microbial biomass C:N:P stoichiometry and microbial use of organic phosphorus
3
2015
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
... 整体而言, 总PLFA含量、革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC、MBN和MBP浓度之间存在正相关关系, 且真菌的作用相对较弱.对植被类型为欧洲山毛榉(Fagus sylvatica)落叶阔叶林的样地开展的相关控制实验也表明, 微生物的群落结构可以显著地改变MBC、MBN和MBP浓度(Heuck et al.,
... .,
The vertical distribution of soil organic carbon and its relation to climate and vegetation
1
2000
... Xu等(
Microbial community dynamics alleviate stoichiometric constraints during litter decay
1
2014
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
Dynamics of soil microbial C:N:P stoichiometry and its driving mechanisms following natural vegetation restoration after farmland abandonment
1
2019
... 由于微生物由特定的元素比例组成, 所以其群落结构的变化会影响微生物生物量化学计量特征(Fanin et al.,
Global patterns of soil microbial nitrogen and phosphorus stoichiometry in forest ecosystems
4
2014
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
... 土壤含水量和土壤全N含量与MBC、MBN和MBP浓度之间存在显著正相关关系, 而土壤密度和MBC、MBN和MBP浓度之间存在显著负相关关系(
... 随着土壤含水量的增加, MBN和MBP浓度的变化量(斜率)相近, 分别为2.09和2.22, 高于MBC的变化量(1.57,
Enhanced nitrogen deposition over China
1
2013
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
Spatial and temporal patterns of nitrogen deposition in China: synthesis of observational data
1
2007
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
Using ecosystem experiments to improve vegetation models
1
2015
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
Stoichiometric imbalances between terrestrial decomposer communities and their resources: mechanisms and implications of microbial adaptations to their resources
1
2014
... Xu等(
Elemental stoichiometry of Fungi and Bacteria strains from grassland leaf litter
2
2014
... 由于微生物由特定的元素比例组成, 所以其群落结构的变化会影响微生物生物量化学计量特征(Fanin et al.,
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
Impacts of permafrost on above- and belowground biomass on the northern Qinghai-Tibetan Plateau
1
2018
... 三江源高寒湿地MBC浓度为105.11 mmol·kg-1, 与全球湿地的111.4 mmol·kg-1无显著差异, 且高 于全球陆地生态系统平均值的56.7 mmol·kg-1 (Xu et al.,
Controls on variation of soil organic carbon concentration in the shrublands of the north-eastern Tibetan Plateau
1
2021
... Xu等(
内蒙古温带草原土壤微生物生物量碳的空间分布及驱动因素
1
2016
... 三江源高寒湿地MBC浓度为105.11 mmol·kg-1, 与全球湿地的111.4 mmol·kg-1无显著差异, 且高 于全球陆地生态系统平均值的56.7 mmol·kg-1 (Xu et al.,
内蒙古温带草原土壤微生物生物量碳的空间分布及驱动因素
1
2016
... 三江源高寒湿地MBC浓度为105.11 mmol·kg-1, 与全球湿地的111.4 mmol·kg-1无显著差异, 且高 于全球陆地生态系统平均值的56.7 mmol·kg-1 (Xu et al.,
Measurement of soil microbial biomass provides an early indication of changes in total soil organic matter due to straw incorporation
1
1987
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
三江源区生态保护与可持续发展
4
2014
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
... 三江源区地处青藏高原腹地, 是长江、黄河和澜沧江的发源地, 被誉为“中华水塔”.三江源区河流密布, 湖泊、沼泽众多, 雪山冰川分布广泛, 是世界上分布面积最大、海拔最高的区域, 湿地总面积达7.33 × 104 km2, 也是我国海拔最高、面积最大的天然湿地, 平均海拔4 000 m左右.其中沼泽分布面积大于2.5%, 是全国分布率最高的地区(秦大河,
... ).三江源地域广阔, 景观类型多样, 分布有独特的高原生物群落, 动植物种类丰富, 植被类型齐全, 在生物多样性保护方面具有重要意义(秦大河,
... )为优势物种.三江源源区海拔范围为3 335-6 564 m, 大部分地区海拔在4 000 m以上, 年平均气温为-5.6-3.8 ℃, 年降水量为262.2-772.8 mm, 主要土壤类型为高山寒漠土、高山草甸土、高山草原土等.近40年来, 三江源区气温显著升高.黄河源区每10年增温幅度最大, 为0.33 ℃; 长江源区增温幅度较黄河源略小, 为0.30 ℃; 澜沧江源区增温幅度最小, 为0.27 ℃ (秦大河,
三江源区生态保护与可持续发展
4
2014
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
... 三江源区地处青藏高原腹地, 是长江、黄河和澜沧江的发源地, 被誉为“中华水塔”.三江源区河流密布, 湖泊、沼泽众多, 雪山冰川分布广泛, 是世界上分布面积最大、海拔最高的区域, 湿地总面积达7.33 × 104 km2, 也是我国海拔最高、面积最大的天然湿地, 平均海拔4 000 m左右.其中沼泽分布面积大于2.5%, 是全国分布率最高的地区(秦大河,
... ).三江源地域广阔, 景观类型多样, 分布有独特的高原生物群落, 动植物种类丰富, 植被类型齐全, 在生物多样性保护方面具有重要意义(秦大河,
... )为优势物种.三江源源区海拔范围为3 335-6 564 m, 大部分地区海拔在4 000 m以上, 年平均气温为-5.6-3.8 ℃, 年降水量为262.2-772.8 mm, 主要土壤类型为高山寒漠土、高山草甸土、高山草原土等.近40年来, 三江源区气温显著升高.黄河源区每10年增温幅度最大, 为0.33 ℃; 长江源区增温幅度较黄河源略小, 为0.30 ℃; 澜沧江源区增温幅度最小, 为0.27 ℃ (秦大河,
Global patterns of plant leaf N and P in relation to temperature and latitude
1
2004
... 随着土壤含水量的增加, MBN和MBP浓度的变化量(斜率)相近, 分别为2.09和2.22, 高于MBC的变化量(1.57,
Considering fungal: bacterial dominance in soils-Methods, controls, and ecosystem implications
2
2010
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
... ), 进而形成负相关的关系.而真菌:细菌与MBC:MBN和MBC:MBP之间存在显著正相关关系.相较于细菌, 真菌的代谢活动更低且对P的需求更少, 使得真菌的MBC:MBN和MBC:MBP更高(Strickland & Rousk,
青藏高原国家生态安全屏障保护与建设
1
2012
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
青藏高原国家生态安全屏障保护与建设
1
2012
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
Terrestrial phosphorus limation: mechanisms, implication, and nitrogen-phosphorus interaction
1
2010
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
高寒草甸群落地表植被特征与土壤理化性状、土壤微生物之间的相关性研究
1
2010
... 土壤含水量和土壤全N含量与MBC、MBN和MBP浓度之间存在显著正相关关系, 而土壤密度和MBC、MBN和MBP浓度之间存在显著负相关关系(
高寒草甸群落地表植被特征与土壤理化性状、土壤微生物之间的相关性研究
1
2010
... 土壤含水量和土壤全N含量与MBC、MBN和MBP浓度之间存在显著正相关关系, 而土壤密度和MBC、MBN和MBP浓度之间存在显著负相关关系(
A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems
9
2013
... Xu等(
... Stoichiometric characteristics of soil microbial biomass (results are shown as means and 95% confidence intervals) in alpine ecosystems and global biomes
| 植被类型 Vegetation type | MBC | MBN | MBP | MBC:MBN | MBC:MBP | MBN:MBP | MBC:MBN: MBP | 参考文献 Reference |
|---|---|---|---|---|---|---|---|---|
| 高寒草甸 Alpine meadow | 49.25a [38.92-61.58] | 3.40a [2.83-4.12] | 0.55a [0.42-0.69] | 14.53a [12.76-16.17] | 117.02a [79.22-168.91] | 8.13a [5.64-11.79] | 118:8:1 | 本研究 This study |
| 高寒湿地 Alpine wetland | 105.11b [81.33-133.33] | 3.79b [2.58-5.16] | 0.78a [0.55-1.06] | 50.56b [37.33-65.33] | 184.89b [156.25-213.18] | 5.42a [4.22-6.89] | 275:5:1 | 本研究 This study |
| 高寒草甸 Alpine meadow | 33.5 [30.1-37.2] | 3.24 [2.69-3.89] | 0.70 [0.61-0.80] | 10.23 [9.77-10.96] | 48.0 [43.8-52.6] | 4.68 [3.98-5.50] | 47.9:4.68:1 | Chen et al., |
| 高寒草原 Alpine steppe | 13.5 [11.9-15.4] | 1.00 [0.79-1.29] | 0.17 [0.14-0.20] | 13.49 [12.02-15.14] | 80.0 [71.4-89.5] | 6.03 [4.79-7.41] | 81.3:6.03:1 | Chen et al., |
| 全球湿地平均值 Global wetland average | 111.4 [84.4-147.0] | 19.3 [14.5-25.9] | 2.4 [1.1-5.4] | 9.5 [7.7-11.8] | 130.7 [62.1-275.0] | 35.7 [14.0-91.2] | 131:14:1 | Xu et al., |
| 全球平均值 Global average | 56.7 | 7.5 | 1.3 | 7.6 | 42.4 | 5.6 | 42:6:1 | Xu et al., |
| 82.3 [69.2-97.7] | 10.9 [9.1-12.9] | 1.4 [1.1-1.6] | 8.6 [8.3-8.9] | 59.5 [55.9-63.1] | 6.9 [6.5-7.3] | 60:7:1 | Cleveland & Liptzin, |
...
[69.2-97.7]
[9.1-12.9]
[1.1-1.6]
[8.3-8.9]
[55.9-63.1]
[6.5-7.3]
... 三江源高寒湿地MBC浓度为105.11 mmol·kg-1, 与全球湿地的111.4 mmol·kg-1无显著差异, 且高 于全球陆地生态系统平均值的56.7 mmol·kg-1 (Xu et al.,
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
... .,
... .,
... 由于MBC浓度相对较高, 而MBN和MBP浓度相对较低, 使得三江源地区高寒湿地MBC:MBN (50.56)高于全球湿地(9.5)和全球陆地生态系统平均值(7.6 (Xu et al.,
... .,
Permafrost degradation and its environmental effects on the Tibetan Plateau: a review of recent research
1
2010
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
基于BP神经网络的青藏高原土壤养分评价
1
2019
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
基于BP神经网络的青藏高原土壤养分评价
1
2019
... 三江源高寒湿地MBN和MBP浓度分别为3.79和0.78 mmol·kg-1, 低于全球湿地(19.3和2.4 mmol·kg-1 (Xu et al.,
全球变化背景下的高寒生态过程
1
2018
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
全球变化背景下的高寒生态过程
1
2018
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
Storage, patterns and controls of soil organic carbon in the Tibetan grasslands
1
2008
... Xu等(
从青藏高原到第三极和泛第三极
1
2017
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
从青藏高原到第三极和泛第三极
1
2017
... 青藏高原是地球上海拔最高和面积最大的高原, 被誉为“世界第三极” (姚檀栋等,
The application of ecological stoichiometry to plant-microbial- soil organic matter transformations
1
2015
... 随着土壤含水量的增加, MBN和MBP浓度的变化量(斜率)相近, 分别为2.09和2.22, 高于MBC的变化量(1.57,
Reviews and syntheses: soil resources and climate jointly drive variations in microbial biomass carbon and nitrogen in China's forest ecosystems
1
2015
... 土壤微生物生物量是土壤活性养分库评估的重要参数, 其转化迅速且敏感易变, 在土壤碳(C)、氮(N)、磷(P)等元素的生物地球化学循环过程中发挥着重要的驱动作用(Powlson et al.,
微生物对分解底物碳氮磷化学计量的响应和调节机制
1
2016
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
微生物对分解底物碳氮磷化学计量的响应和调节机制
1
2016
... 微生物PLFA含量, 革兰氏阳性菌、革兰氏阴性菌、细菌、放线菌、丛枝菌根真菌浓度和其他PLFA含量与MBC:MBN和MBC:MBP之间存在显著的负相关关系(p < 0.05), 但是细菌:真菌与MBC:MBN和MBC:MBP存在显著的正相关关系(p < 0.05).可能的原因是随着土壤中可利用碳的增多, 微生物生物量增加, 且由缓慢生长的K策略转变为快速生长的r策略(Fierer et al.,
