高雨秋
1 , 2 , 戴晓琴
, 1 , 2 , 3 , * , 王建雷
1 , 付晓莉
1 , 2 , 3 , 寇亮
1 , 2 , 3 , 王辉民
1 , 2 , 3 , 4 1
中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室千烟洲试验站, 北京 100101 2
中国科学院大学资源与环境学院, 北京 100190 3
中科吉安生态环境研究院, 江西吉安 343000 4
江西省区域生态过程与信息重点实验室, 江西泰和 343725 Characteristics of soil enzymes stoichiometry in rhizosphere of understory vegetation in subtropical forest plantations Yu-Qiu GAO
1 , 2 , Xiao-Qin DAI
, 1 , 2 , 3 , * , Jian-Lei WANG
1 , Xiao-Li FU
1 , 2 , 3 , Liang KOU
1 , 2 , 3 , Hui-Min WANG
1 , 2 , 3 , 4 1
Qianyanzhou Ecological Research Station, Key Laboratory of Ecosystem Network Observation and Modeling, Institute of Geographic Science and Natural Resources Research, Chinese Academy of Sciences, Beijing 100101, China 2
College of Resource and Environment, University of Chinese Academy of Sciences, Beijing 100190, China 3
Zhongke-Ji’an Institute of Eco-Environmental Sciences, Ji’an, Jiangxi 343000, China; 4
Jiangxi Province Key Laboratory of Regional Ecological Processes and Information, Taihe, Jiangxi 343725, China 通讯作者: *
daixq@igsnrr.ac.cn 编委: 程磊
责任编辑: 李敏
收稿日期: 2018-11-30
修回日期: 2019-03-7
网络出版日期: 2019-03-20
基金资助: 国家自然科学基金 (31730014 )国家重点研发计划 (2016YFD0600202 )
Received: 2018-11-30
Revised: 2019-03-7
Online: 2019-03-20
Fund supported: Supported by the National Natural Science Foundation of China (31730014 )The National Key R&D Program of China (2016YFD0600202 )
摘要 为探讨林下植被根际土壤酶化学计量特征及其对林分类型和季节的响应, 该研究以江西省泰和县千烟洲试验站典型人工杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )林林下优势灌草檵木(
Loropetalum chinense )、杨桐(
Adinandra millettii )、格药柃(
Eurya muricata )、狗脊蕨(
Woodwardia japonica )和暗鳞鳞毛蕨(
Dryopteris atrata )为对象, 在植被生长初期(4月)和旺盛期(7月)测定优势灌草根际土壤与碳(C)循环相关的β-1,4-葡萄糖苷酶(BG)、与氮(N)循环相关的β-1,4-N-乙酰葡糖氨糖苷酶(NAG)和亮氨酸氨基肽酶(LAP)、与磷(P)循环相关的酸性磷酸酶(AP)活性、酶化学计量比及土壤理化性质。结果发现: (1)根际土壤与C和N循环相关的酶活性以及BG:AP (酶C:P)在不同林下植被之间存在显著差异, 而与P循环相关的酶活性差异不显著。林分类型和取样季节显著影响BG:(NAG+LAP)(酶C:N), 且林下植被类型、林分类型和取样季节交互影响酶C:P。主成分分析表明, 根际土壤酶的活性及计量比在不同林下植被(檵木不同于格药柃, 且二者显著区别于其他物种)、林分类型(杉木林区别于马尾松、湿地松林)和取样季节之间均存在显著差异。土壤硝态氮(NO
3 - -N)、铵态氮(NH
4 + -N)、可溶性有机碳(DOC)含量和碳氮比(C:N)是影响林下植被根际土壤酶的活性及化学计量比的主要因素。(2)标准主轴回归分析表明, 林下植被根际土壤lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系, lgBG:lg(NAG+LAP):lgAP (酶C:N:P)约为1:1:1.3, 酶C:P及(NAG+LAP):AP (酶N:P)分别为0.14和0.15。AP远大于BG和NAG+LAP的活性, 导致lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1。说明林下植被根际土壤酶的活性及计量比受植被种类、林分类型及取样季节影响, 且基质有效性在其中发挥重要作用。相较于C循环和N循环, 微生物会分配更多资源用于P循环相关酶的生产, 暗示亚热带人工林林下植被根际土壤微生物生长和活性更易受P限制。
关键词: 人工林 ;
胞外酶 ;
生态化学计量比 ;
红壤丘陵区 Abstract Aims The objective was to explore the stoichiometry of rhizosphere soil enzymes under major understory vegetation and their responses to plantation types and seasons.
Methods Rhizosphere soils of understory shrubs (
Loropetalum chinense, Adinandra millettii and
Eurya muricata ) and herbs (
Woodwardia japonica and
Dryopteris atrata ) were sampled in the early growth stage (April) and the vigorous growth stage (July) in
Cunninghamia lanceolata ,
Pinus massoniana and
Pinus elliottii plantations at Qianyanzhou Ecological Research Station, Taihe, Jiangxi. Potential activities of β-1,4-glucosidase (BG, carbon (C) acquiring enzyme), β-1,4-N-acetylglucosaminidase (NAG, nitrogen (N) acquiring enzyme) and leucine aminopeptidase (LAP, N-acquiring enzyme), acid phosphatase (AP, phosphorus (P) acquiring enzyme) and their stoichiometric ratios were measured. Soil physical and chemical properties were also analyzed.
Important findings The results found that (1) rhizosphere soil extracellular enzyme activities associated with C and N acquisition and BG:AP (enzyme C:P) were significantly different among understory species, but P acquisition were not. Both forest stand types and sampling seasons influenced BG:(NAG+LAP) (enzyme C:N). Interactions of understory species, forest stand types and seasons observably affected enzyme C:P. Principal component analysis showed that rhizosphere soil enzyme activities and ecoenzymatic stoichiometry differed significantly among different understory species (
Loropetalum chinense was obviously different from
Eurya muricata , and both of them were evidently different from other understory species), forest stand types (
Cunninghamia lanceolata was different from
Pinus massoniana and
Pinus elliottii plantations) and sampling seasons. Soil NO
3 - -N, NH
4 + -N, DOC content and C:N were the main edaphic abiotic factors influencing the rhizosphere soil enzyme activities and ecoenzymatic stoichiometry. (2) Standardized major axis analysis showed that there were significantly linear relationship among lg(BG), lg(NAG+LAP) and lg(AP) of rhizosphere soils of understory species. lgBG:lg(NAG+LAP):lgAP(enzyme C:N:P) was approximately 1:1:1.3. Rhizosphere soil enzyme C:P and (NAG+LAP):AP (enzyme N:P) of understory species were 0.14 and 0.15, respectively. The regression slopes of lg(BG), lg(NAG+LAP) and lg(AP) deviated significantly from 1 because AP activities were much higher than BG activities and NAG+LAP activities. This study found that rhizosphere soil enzyme activities and ecoenzymatic stoichiometry were affected by understory species, forest stand types and sampling seasons in which substrate availability played an important role. Compared with C- and N-acquiring enzymes, microorganisms allocated more resources to the production of P-acquiring enzymes, which implied that the growth and activity of soil microorganisms were much more limited by P in rhizosphere soil of understory vegetation in subtropical plantations.
Keywords: plantation ;
soil extracellular enzyme ;
ecological stoichiometry ;
red soils PDF (1658KB) 元数据 多维度评价 相关文章 导出 EndNote |
Ris |
Bibtex 收藏本文 引用本文 高雨秋, 戴晓琴, 王建雷, 付晓莉, 寇亮, 王辉民. 亚热带人工林下植被根际土壤酶化学计量特征. 植物生态学报, 2019, 43(3): 258-272. DOI:
10.17521/cjpe.2018.0299 GAO Yu-Qiu, DAI Xiao-Qin, WANG Jian-Lei, FU Xiao-Li, KOU Liang, WANG Hui-Min.
Characteristics of soil enzymes stoichiometry in rhizosphere of understory vegetation in subtropical forest plantations .
Chinese Journal of Plant Ecology , 2019, 43(3): 258-272. DOI:
10.17521/cjpe.2018.0299 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 )。水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视。近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 )。
近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 )。酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 )。目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 )。研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 )。然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 )。
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异。
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低。
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征。因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要。
根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 )。研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 )。不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著。如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 )。作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义。然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估。
亚热带人工林是我国森林的重要组成部分。截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种。林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 )。研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 )。关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道。我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 )。因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定。
本文以我国中亚热带常见人工杉木、马尾松和湿地松林林下优势植被为研究对象, 以期通过对不同人工林林下植被根际土壤酶活性及理化性质的测定, 探讨亚热带人工林内主要林下植被根际土壤酶化学计量特征, 明确不同林下植被根际土壤酶的活性及化学计量特征对人工林类型的响应, 揭示影响林下植被根际土壤酶化学计量特征的主要土壤理化性质因素, 为人工林生态系统物质循环和能量流动的精准估计提供重要理论依据。
1 材料和方法 1.1 研究区概况 研究地设在中国科学院-江西省千烟洲红壤丘陵综合开发试验站(千烟洲试验站), 位于江西省泰和县灌溪镇(115.07° E, 26.75° N), 平均海拔为110.8 m, 相对高差20-50 m。站区属亚热带季风气候, 年平均气温为17.9 ℃, 1月平均气温为6.4 ℃, 7月平均气温为28.8 ℃; 年降水量1 489 mm, 主要集中在3-6月。土壤类型主要为红壤, 成土母质多为红色砂岩和砂砾岩(
中国科学院南方山区综合科学考察队, 1989 )。站区属于中亚热带常绿阔叶林区, 但原生植被在20世纪80年代初被破坏, 现有森林主要为林龄约30年的人工纯林, 主要树种为杉木、马尾松和湿地松, 密度分别为每公顷(1 443 ± 241)、(1 473 ± 159)和(961 ± 87)株, 平均胸径分别为(18.1 ± 1.63)、(16.6 ± 0.53)和(21.8 ± 0.51) cm。林下优势植被主要为檵木(
Loropetalum chinense )、杨桐(
Adinandra millettii )和格药柃(
Eurya muricata )等灌木及狗脊蕨(
Woodwardia japonica )、暗鳞鳞毛蕨(
Dryopteris atrata )和芒萁(
Dicranopteris dichotoma )等草本。人工林生态系统林下植被基本信息见
表1 。
Table 1 表1 表1 亚热带人工林生态系统林下植被基本信息
Table 1
Characteristics of understory shrub and herb species in three subtropical plantations 林分类型 林下植被类型 基径 高度 冠幅 盖度 重要值 杉木林Cunninghamia forest 檵木 Loropetalum chinense 11.9 ± 2.7 126 ± 31 81 ± 15 - 19.72 杨桐 Adinandra millettii 13.1 ± 1.0 152 ± 13 94 ± 7 - 30.44 格药柃 Eurya muricata 13.2 ± 1.5 142 ± 16 86 ± 9 - 32.71 狗脊蕨 Woodwardia japonica - 94 ± 12 - 71 ± 7 3.09 暗鳞鳞毛蕨 Dryopteris atrata - 60 ± 5 - 43 ± 8 1.89 马尾松林Pinus massoniana forest 檵木 Loropetalum chinense 18.9 ± 2.0 413 ± 41 144 ± 16 - 33.68 杨桐 Adinandra millettii 26.7 ± 2.3 376 ± 64 160 ± 12 - 39.88 格药柃 Eurya muricata 13.2 ± 1.1 302 ± 50 81 ± 6 - 31.43 狗脊蕨 Woodwardia japonica - 99 ± 6 - 60 ± 7 3.85 暗鳞鳞毛蕨 Dryopteris atrata - 64 ± 6 - 53 ± 7 3.41 湿地松林Pinus elliottii forest 檵木 Loropetalum chinense 25.7 ± 1.7 244 ± 34 180 ± 11 - 36.39 杨桐 Adinandra millettii 20.3 ± 3.1 206 ± 21 118 ± 16 - 33.11 格药柃 Eurya muricata 19.6 ± 3.8 112 ± 25 106 ± 18 - 19.22 狗脊蕨 Woodwardia japonica - 86 ± 10 - 73 ± 8 4.15 暗鳞鳞毛蕨 Dryopteris atrata - 70 ± 4 - 38 ± 5 2.07
-, no corresponding data. -, 无对应的数据。 新窗口打开 |
下载CSV 1.2 土壤样品采集 在千烟洲试验站选择5个独立山头作为5个区组, 每个区组内随机选择杉木、马尾松和湿地松3种人工林地, 每种人工林样地内分别设置1个20 m × 20 m的样方, 共15个样方。在每个样方内分别选取5种优势林下灌草, 采集其根际土。其中, 灌木包括檵木、杨桐和格药柃, 草本包括狗脊蕨和暗鳞鳞毛蕨。虽然芒萁在研究区内分布广泛, 但在杉木林内存在较少, 为保证试验的平衡, 没有选择芒萁作为研究对象。不同人工林造林前土壤特性差异不显著(
Fu et al ., 2015 )。另外, 所选5个区组土壤特性差异也不显著(
Dai et al ., 2018 ), 证明本研究样地本底环境一致。
取样时间为2017年4月和7月。在每个样方内, 每种植被类型分别随机选择3-5株, 在已确认物种的植株周围按照自树干追踪根系的方法多方位挖取0-20 cm土层根系, 具体方法参考
Guo等(2008) 、
Liu等(2015) 及
Wang等(2017) , 取直径小于5 mm的根系, 轻轻抖落其上容易掉落的大块土壤, 只取剩余仍附着于根系表面4 mm以内的土壤, 即根际土(
Riley & Barber, 1970 )。若灌草根系生物量较小, 则按照
Dai等(2018) 详细描述的方法将整株植物根系挖出, 收集根际土壤。同一样方内相同物种根际土壤样品混合均匀。采集到的鲜土立即带回实验室, 过2 mm筛后, 一部分立即保存在-4 ℃冰箱, 另一部分土壤风干, 以便后续操作。
1.3 土壤样品分析 1.3.1 土壤酶活性测定
土壤酶活性采用微孔板荧光法(
Saiya-Cork et al ., 2002 )测定, 其中BG酶底物为4-甲基伞形酮酰- β-D-吡喃葡萄糖苷(4-MUB-β-D-glucopyranoside), NAG酶底物为4-甲基伞形酮酰-β-D-吡喃葡糖酸苷(4-MUB-N-acetyl-β-D-glucosaminide), LAP酶底物为L-亮氨酸-7-氨基-4-甲基香豆素盐酸盐(L-leucine-7-?amino-4-methylcoumarin), AP酶底物为4-甲基伞形酮磷酸酯(4-MUB-phosphate)。具体方法为: 称取-4 ℃保存的鲜土1 g于烧杯中, 加入125 mL醋酸缓冲液(50 mmol·L
-1 , pH值5.0), 用旋涡振荡器混匀, 制成土壤悬浮液。在96孔微孔板每个孔内各加入200 μL土壤悬浮液, 再在每个孔内分别加入50 μL底物(200 μmol·L
-1 , 超纯水配制), 所有微孔板在20 ℃的黑暗条件下培养4 h, 之后分别在每个孔内加10 μL NaOH溶液(1 mol·L
-1 )终止培养。1 min后, 用多功能酶标仪(Synergy H4, BioTek, Winooski, USA)在365 nm波长激发, 450 nm波长进行荧光测定。酶底物均为Sigma公司生产, 其他试剂为国产分析纯。
1.3.2 土壤理化性质测定
-4 ℃保存的鲜土用于土壤铵态氮(NH
4 + -N)、硝态氮(NO
3 - -N)、可溶性有机碳(DOC)、有效磷(aP)含量及土壤含水率(
SWC )的测定; 风干土用于土壤pH值、土壤总C (TC)、总N (TN)和总P (TP)含量的测定。土壤pH值(土:水=1:2.5)用pH计(Mettler Toledo GmbH, Schwerzenbach, Switzerland)测定;
SWC 用质量差异法测量; DOC采用超纯水浸提(土:水=1:5), 总有机碳分析仪(Elementar Liquid II, Frankfurt, Germany)测定含量; NO
3 - -N和NH
4 + -N用1 mol·L
-1 的KCl溶液浸提, aP用0.01 mol·L
-1 的NH
4 F-HCl浸提, TP用H
2 SO
4 -HClO
4 消煮, 之后分别用流动分析仪(Bran Luebbe AA3, Hamburg, Germany)测定含量; TC和TN含量用元素分析仪(vario MAX CN, Elementar, Hamburg, Germany)测定。
1.4 数据分析 酶C:N通过BG:(NAG+LAP)计算, 酶C:P通过BG:AP计算, 酶N:P通过(NAG+LAP):AP计算。
文中酶活性及其比值的平均值及标准误差为原数据。为使数据符合正态分布和方差齐性, 统计分析部分所用数据经过以10为底的log转化。林分类型、林下植被类型和取样季节对酶活性、酶化学计量比和土壤理化性质的影响采用重复测量的多因素方差分析。不同取样季节同一林分类型下, 不同林下植被根际土壤酶的活性及计量比之间的差异采用线性混合效应模型分析。BG、NAG+LAP和AP之间的关系用标准主轴回归(SMA)法分析, 以lg(BG): lg(NAG+LAP)、lg(BG):lg(AP)及lg(NAG+LAP):lg(AP)形式直接表示, 回归斜率代表受C、N或者P相对限制, 斜率偏离1的程度越大, 表示限制的相对程度越大(
Hill et al ., 2014 )。另外, 对酶的活性及计量比进行主成分分析(PCA)。土壤理化性质与酶的活性及计量比之间的关系采用冗余分析(RDA)。首先通过方差膨胀因子(
VIF )判断解释变量间的线性关系(即共线性程度), 若
VIF 超过20证明共线性严重, 超过10证明存在共线性问题, 需要剔除存在共线性关系的变量, 剔除共线性变量后剩余NO
3 - -N、NH
4 + -N、DOC含量及C:N 4个解释变量。之后再通过RDA分析NO
3 - -N、NH
4 + -N、DOC含量及C:N和酶活性及计量比的关系。SMA、PCA、RDA及
VIF 计算分别基于R语言中的smatr (
Warton et al ., 2012 )、vegan和packfor程序包(
Borcard et al ., 2011 )完成。其余统计分析在SPSS 18.0中完成。
2 结果和分析 2.1 根际土壤酶活性 根际土壤BG活性平均为(908.9 ± 49.6) nmol·g
-1 ·h
-1 ; NAG+LAP活性平均为(966.9 ± 47.6) nmol·g
-1 ·h
-1 ; AP活性平均为(6 521.5 ± 143.0) nmol·g
-1 ·h
-1 。林下植被类型显著影响了BG和NAG+LAP活性(BG,
p = 0.009; NAG+LAP,
p = 0.010;
表2 ), 如7月在杉木和马尾松林中格药柃根际BG活性显著低于檵木, 3种林分类型下格药柃根际N元素获得相关的酶活性显著低于檵木(
图1 )。林分类型和取样季节均没有显著影响土壤BG、NAG+LAP和AP活性(
p > 0.05;
表2 )。
Table 2 Table 2 Results (
p-value ) of multi-way repeated measures ANOVAs on the effects of forest stand types, understory species, sampling seasons and their interactions on soil enzyme activities and ecoenzymatic stoichiometry in rhizosphere of subtropical forest plantations
变异来源 Source of variation 酶相关参数 Parameter of soil enzyme BG NAG+LAP AP BG:(NAG+LAP) BG:AP (NAG+LAP):AP 林分类型 Forest stand types (F) 0.061 0.881 0.156 0.013* 0.092 0.938 林下植被类型 Understory species (U) 0.009** 0.010* 0.173 0.165 0.027* 0.286 取样季节 Sampling seasons (S) 0.066 0.575 0.148 0.032* 0.082 0.113 F × U 0.556 0.920 0.423 0.845 0.580 0.821 F × S 0.070 0.054 0.089 0.294 0.057 0.122 U × S 0.112 0.792 0.957 0.331 0.167 0.573 F × U × S 0.260 0.396 0.823 0.495 0.036* 0.221
BG, β-1,4-葡萄糖苷酶; NAG+LAP, β-1,4-N-乙酰葡糖氨糖苷酶和亮氨酸氨基肽酶之和; AP, 酸性磷酸酶。*, p < 0.05; **, p < 0.01。p < 0.05; **, p < 0.01. 新窗口打开 |
下载CSV 图1 新窗口打开 |
下载原图ZIP |
生成PPT 图1不同林分类型亚热带人工林林下植被根际土壤酶活性(平均值+标准误差, n = 5)。CL, 杉木林; PM, 马尾松林; PE, 湿地松林。LC, 檵木; AM, 杨桐; EM, 格药柃; WJ, 狗脊蕨; DA, 暗鳞鳞毛蕨。不同小写字母代表根际土壤C、N或P循环相关的酶活性在同一取样季节相同林分类型下不同林下植被之间差异显著(p < 0.05), 不同大写字母代表根际土壤C、N或P循环相关的酶活性在同一取样季节不同林分类型下差异显著(p < 0.05)。BG, β-1,4-葡萄糖苷酶; NAG+LAP, β-1,4-N-乙酰葡糖氨糖苷酶和亮氨酸氨基肽酶之和; AP, 酸性磷酸酶。 Fig. 1Rhizosphere soil enzyme activities of understory vegetation under different forest stand types in subtropical plantations (mean + SE, n = 5). CL, Cunninghamia lanceolata forest; PM, Pinus massoniana forest; PE, Pinus elliottii forest. LC, Loropetalum chinense; AM, Adinandra millettii; EM, Eurya muricata; WJ, Woodwardia japonica; DA, Dryopteris atrata . Different lowercase letters were significantly different among different understory vegetation species of the same forest stand types at the same sampling season (p < 0.05), Different uppercase letters were significantly different among different stand types at the same sampling season (p < 0.05). BG, β-1,4-glucosidase; NAG+LAP, the sum of β-1,4-N-acetylglucosaminidase and leucine aminopeptidase; AP, acid phosphatase. 2.2 根际土壤酶的生态化学计量比 根际土壤BG:(NAG+LAP)(酶C:N)平均为1.05 ± 0.05, BG:AP(酶C:P)平均为0.14 ± 0.01, (NAG+LAP):AP(酶N:P)平均为0.15 ± 0.01。林分类型和取样季节显著影响了酶C:N (
p < 0.05;
表2 )。除4月份马尾松林外, 湿地松和马尾松林林下植被根际土壤酶C:N显著高于杉木林(
p < 0.05;
图2 )。4月酶C:N显著高于7月(
p < 0.05;
表2 ;
图2 )。林下植被类型及其与林分类型和季节的交互作用显著影响了酶C:P (
p < 0.05;
表2 ), 如7月份在杉木和马尾松林格药柃根际酶C:P显著低于檵木(
p < 0.05;
图2 )。林分类型、林下植被类型和取样季节以及三者的交互作用均没有显著影响酶N:P (
p > 0.05;
表2 )。
图2 新窗口打开 |
下载原图ZIP |
生成PPT 图2不同林分类型亚热带人工林林下植被根际土壤酶的生态化学计量比(平均值+标准误差, n = 5)。CL, 杉木林; PM, 马尾松林; PE, 湿地松林。 LC, 檵木; AM, 杨桐; EM, 格药柃; WJ, 狗脊蕨; DA, 暗鳞鳞毛蕨。不同小写字母代表根际土壤C、N或P循环相关的酶活性在同一取样季节相同林分类型下不同林下植被之间差异显著(p < 0.05), 不同大写字母代表根际土壤C、N或P循环相关的酶活性计量比在同一取样季节不同林分类型下差异显著(p < 0.05)。BG, β-1,4-葡萄糖苷酶; NAG+LAP, β-1,4-N-乙酰葡糖氨糖苷酶和亮氨酸氨基肽酶之和; AP, 酸性磷酸酶。 Fig. 2Rhizosphere soil ecoenzymatic stoichiometry of understory vegetation under different forest stand types in subtropical plantations (mean + SE, n = 5). CL, Cunninghamia lanceolata forest; PM, Pinus massoniana forest; PE, Pinus elliottii forest. LC, Loropetalum chinense; AM, Adinandra millettii; EM, Eurya muricata; WJ, Woodwardia japonica; DA, Dryopteris atrata . Different lowercase letters were significantly different among different understory vegetation species of the same forest stand types at the same sampling season (p < 0.05), Different uppercase letters were significantly different among different stand types at the same sampling season (p < 0.05). BG, β-1,4-glucosidase; NAG+LAP, the sum of β-1,4-N-acetylglucosaminidase and leucine aminopeptidase; AP, acid phosphatase. 综合所有根际土壤酶活性数据显示, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 )。lg(BG)和lg(NAG+LAP)回归关系的斜率为1.28 (
R 2 = 0.185), 显著大于1 (
p < 0.05), 截距为-0.86; lg(BG)和lg(AP)、lg(NAG+LAP)和lg(AP)的回归斜率分别为2.59 (
R 2 = 0.273)和2.03 (
R 2 = 0.133), 均极显著大于1 (
p < 0.001), 截距分别为-6.99和-4.80 (
图3 )。
图3 新窗口打开 |
下载原图ZIP |
生成PPT 图3亚热带人工林土壤C、N、P获得酶活性关系的标准主轴回归分析(n = 150)。颜色代表林分: 红色, 杉木林; 绿色, 马尾松林; 蓝色, 湿地松林。空心和实心符号分别表示取样时间为4月或7月。CL, 杉木林; PM, 马尾松林; PE, 湿地松林。 LC, 檵木; AM, 杨桐; EM, 格药柃; WJ, 狗脊蕨; DA, 暗鳞鳞毛蕨。BG, β-1,4-葡萄糖苷酶; NAG+LAP, β-1,4-N-乙酰葡糖氨糖苷酶和亮氨酸氨基肽酶之和; AP, 酸性磷酸酶。 Fig. 3Standardized major axis regressions of the log-transformed soil C-, N-, and P-acquiring enzyme activities in subtropical plantations (n = 150). The colors represent the forest stand types: red symbols, Cunninghamia lanceolata forest; green symbols, Pinus massoniana forest; blue symbols, Pinus elliottii forest. Filled symbols and open symbols respectively represent the sampling seasons at April and July.CL, Cunninghamia lanceolata forest; PM, Pinus massoniana forest; PE, Pinus elliottii forest. LC, Loropetalum chinense; AM, Adinandra millettii; EM, Eurya muricata; WJ, Woodwardia japonica; DA, Dryopteris atrata . BG, β-1,4-glucosidase; NAG+LAP, the sum of β-1,4-N-acetylglucosaminidase and leucine aminopeptidase; AP, acid phosphatase. 2.3 土壤酶的活性及计量比变异的主成分分析和冗余分析 PCA结果表明, 沿着PC1杉木林内林下植被根际土壤酶的活性及计量比不同于马尾松林和湿地松林(
图4 )。沿着PC1和PC2的45°角方向, 不同林下植被根际土壤酶的活性及计量比明显不同, 具体表现为檵木明显不同于格药柃, 且二者明显区别于其他植被。另外, 沿着PC1和PC2直角三角形斜边方向, 不同取样季节也存在明显不同。PC1和PC2共解释了土壤酶活性及计量比变异的93.6%, 其中PC1解释了57.7%的变异, PC2解释了35.9%的变异。RDA结果表明9个土壤理化性质共解释了土壤酶活性及计量比变异的30.9%。剔除存在共线性关系的变量后剩余NO
3 - -N、NH
4 + -N、DOC含量及C:N 4个因素, 结果表明这4个因素显著影响了林下植被根际土壤酶的活性及计量比, 共解释了变异的25.9% (
图5 )。
图4 新窗口打开 |
下载原图ZIP |
生成PPT 图4亚热带人工林土壤酶活性及计量比的主成分分析(PCA)。相同取样季节, 林下植被土壤的酶活性及计量比PCA坐标平均值表征取样季节效应。同一林分类型下, 林下植被土壤酶的活性及计量比PCA坐标平均值表征林分类型的效应。同一林下植被类型土壤酶活性及计量比PCA坐标平均值为林下植被类型的效应。颜色代表林分: 红色, 杉木林; 绿色, 马尾松林; 蓝色, 湿地松林。CL, 杉木林; PM, 马尾松林; PE, 湿地松林; LC, 檵木; AM, 杨桐; EM, 格药柃; WJ, 狗脊蕨; DA, 暗鳞鳞毛蕨。 Fig. 4Principal component analysis (PCA) of soil enzyme activities and ecoenzymatic stoichiometry in subtropical plantations. The effect of sampling seasons is from the average of PCA scores of soil enzyme activities and ecoenzymatic stoichiometry of understory vegetation within the same season. The effect of forest stand types is from the average of PCA scores of soil enzyme activities and ecoenzymatic stoichiometry of understory vegetation within the same forest stand type. The effect of understory species is from the average of PCA site scores of soil enzyme activities and ecoenzymatic stoichiometry of the same understory species. The colors represent the forest stand types: red symbols, Cunninghamia lanceolata forest; green symbols, Pinus massoniana forest; blue symbols, Pinus elliottii forest. CL, Cunninghamia lanceolata forest; PM, Pinus massoniana forest; PE, Pinus elliottii forest; LC, Loropetalum chinense; AM, Adinandra millettii; EM, Eurya muricata; WJ, Woodwardia japonica; DA, Dryopteris atrata . 图5 新窗口打开 |
下载原图ZIP |
生成PPT 图5亚热带人工林土壤酶活性及计量比与土壤理化性质关系的冗余分析(RDA)。NO3 - -N, 硝态氮; NH4 + -N, 铵态氮; DOC, 可溶性有机碳; C:N, 全碳和全氮的比值。BG, β-1,4-葡萄糖苷酶; NAG+LAP, β-1,4-N-乙酰葡糖氨糖苷酶和亮氨酸氨基肽酶之和; AP, 酸性磷酸酶。 Fig. 5Redundancy analysis (RDA) of soil enzyme activities, ecoenzymatic stoichiometry and physical and chemical properties in subtropical plantations. NO3 - -N, nitrate nitrogen; NH4 + -N, ammonium nitrogen; DOC, dissolved organic carbon; C:N, the ratio of total carbon to total nitrogen. BG, β-1,4-glucosidase; NAG+LAP, the sum of β-1,4-N-acetylglucosaminidase and leucine aminopeptidase; AP, acid phosphatase. 3 讨论 3.1 亚热带人工林林下植被根际土壤酶生态化学计量特征 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 )。本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 )。这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 )。本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平。lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产。这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致。
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13。因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 )。另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 )。该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 )。
然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果。因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重。由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异。本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土。
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土。
Gianfreda (2015) 也证明AP活性在根际土壤中更大。大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 )。由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 )。
3.2 人工林下植被类型对根际土壤酶生态化学计量比的影响 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大。一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 )。研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比。本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 )。一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 )。因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 )。如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 )。土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 )。另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 )。林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 )。
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同。同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 )。如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N。
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响。
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致。本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 )。
鲁顺保等(2011) 也发现C:N对酶活性有重要影响。再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 )。本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b )。此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究。
Table 3 表3 表3 林分类型、林下植被类型和取样季节对亚热带人工林4种主要土壤养分影响的重复测量多因素方差分析结果(
p 值)
Table 3
Results (p -value) of multi-way repeated measures ANOVAs on the effects of forest stand types, understory species, sampling seasons and their interactions on four major soil nutrient factors in subtropical plantations 变异来源 Source of variation DOC NH4 + -N NO3 - -N C:N 林分类型 Forest stand types (F) 0.200 0.021* 0.221 0.112 林下植被类型 Understory species (U) 0.000** 0.002** 0.002** 0.000** 取样季节 Sampling seasons (S) 0.226 0.003** 0.178 0.296 F × U 0.735 0.658 0.506 0.058 F × S 0.407 0.384 0.009** 0.623 U × S 0.311 0.095 0.084 0.267 F × U × S 0.129 0.511 0.270 0.800
DOC, 可溶性有机碳。*, p < 0.05; **, p < 0.01。 DOC, dissolved organic carbon. *, p < 0.05; **, p < 0.01. 新窗口打开 |
下载CSV 3.3 林分类型对根际土壤酶生态化学计量比的影响 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 )。
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征。本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 )。一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 )。另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 )。再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差。
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少。
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林。
3.4 取样季节对根际土壤酶生态化学计量比的影响 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足。从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 )。一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 )。大部分酶为蛋白质, 其活性受温度直接影响。此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 )。
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降。土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 )。本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同。另一方面, 可能与不同季节植被生长环境状况有关。本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 )。7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 )。研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 )。此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果。虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应。在后续的研究中会考虑多次采样, 使季节变化更具有说服力。
此外, 本研究发现, 酶N:P对林分类型、林下植被类型及季节的响应均不显著(
表2 ), 这可能反映了微生物对N、P养分需求比例的相对稳定。
Cleveland和Liptzin (2007) 发现随纬度变化土壤微生物生物量N:P没有变化, 他们认为这与土壤N:P供应无关, 而是微生物自身保持的一种相对稳定性。
3.5 土壤理化性质对根际土壤酶的活性及计量比的影响 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响。大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 )。研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 )。DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 )。Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因。但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 )。非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 )。土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 )。
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%。
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%。考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证。此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系。研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 )。如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大。因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑。
4 结论 研究区林下植被根际土壤酶活性对数转化后酶C:N:P约为1:1:1.3, 酶C:P及酶N:P分别为0.14和0.15, 远低于多数陆地生态系统平均水平(0.62和0.44), 表明亚热带地区人工林林下植被根际土壤微生物受P限制较为严重。林下植被根际土壤酶活性及计量比存在明显差异, 且与林分类型和取样季节有关。酶C:N显著受林分类型和取样季节影响。酶C:P在不同林下植被类型之间差异显著, 且在林分类型和取样季节间表现不同。酶N:P对林分类型、林下植被类型及季节的响应均不显著, 这可能反映了微生物对N、P养分需求比例的相对稳定。总体来看, 土壤酶活性及计量比在檵木、格药柃及其他植被之间明显不同; 植被生长初期明显不同于植被生长旺盛期。不同林下植被酶活性不同可能是由于其根际环境差异造成, 根系分泌物差异、养分吸收策略差异及菌根类型差异等造成了根际土壤NO
3 - -N、NH
4 + -N、DOC含量和C:N的差异, 进而解释了25.9%的根际土壤酶活性及计量比变异。
综上, 考虑不同林分林下植被类型及其取样季节是准确评估人工林生态系统养分循环状况的重要前提。此外, 根际微生物及植物根系对根际土壤酶活性及计量比的影响值得进一步深入研究。
[1] Allison SD Weintraub MN Gartner TB Waldrop MP 2011 ). Evolutionary-economic principles as regulators of soil enzyme production and ecosystem functionSoil Enzymology 229 -243 . [本文引用: 2] [2] Bell C Carrillo Y Boot CM Rocca JD Pendall E Wallenstein MD 2014 ). Rhizosphere stoichiometry: Are C:N:P ratios of plants, soils, and enzymes conserved at the plant species-level?New Phytologist 505 -517 . [本文引用: 2] [3] Bengtson P Barker J Grayston SJ 2012 ). Evidence of a strong coupling between root exudation, C and N availability, and stimulated SOM decomposition caused by rhizosphere priming effectsEcology and Evolution 1843 -1852 . [4] Bird JA Herman DJ Firestone MK 2011 ). Rhizosphere priming of soil organic matter by bacterial groups in a grassland soilSoil Biology & Biochemistry 718 -725 . [本文引用: 1] [5] Borcard D Gillet F Legendre P 2011 ). Numerical Ecology with R. SpringerNew York [本文引用: 1] [6] Burns RG 1978 ). Soil Enzymes [本文引用: 3] [7] Chapin III FS Matson PA Mooney HA 2002 ). Principles of Terrestrial Ecosystem Ecology. SpringerNew York [本文引用: 1] [8] Chen X Ding ZJ Tang M Zhu B 2018 ). Greater variations of rhizosphere effects within mycorrhizal group than between mycorrhizal group in a temperate forestSoil Biology & Biochemistry 237 -246 . [本文引用: 4] [9] Cheng W Johnson DW Fu S 2003 ). Rhizosphere effects on decomposition: Controls of plant species, phenology, and fertilizationSoil Science Society of America Journal 1418 -1427 . [本文引用: 1] [10] Cleveland CC Liptzin D 2007 ). C:N:P stoichiometry in soil: Is there a “Redfield ratio” for the microbial biomass?Biogeochemistry 235 -252 . [本文引用: 3] [11] Cui YX Fang LC Guo XB Wang X Zhang YJ Li PF Zhang XC 2018 ). Ecoenzymatic stoichiometry and microbial nutrient limitation in rhizosphere soil in the arid area of the northern Loess Plateau, ChinaSoil Biology & Biochemistry 11 -21 . [本文引用: 5] [12] Dai XQ Fu XL Kou L Wang HM Shock CC 2018 ). C:N:P stoichiometry of rhizosphere soils differed significantly among overstory trees and understory shrubs in plantations in subtropical ChinaCanadian Journal of Forest Research 1398 -1405 . [本文引用: 5] [13] DeForest JL Zak DR Pregitzer KS Burton AJ 2004 ). Atmospheric nitrate deposition, microbial community composition, and enzyme activity in northern hardwood forestsSoil Science Society of America Journal 132 -138 . [本文引用: 2] [14] Du Z Cai XH Bao WK Chen H Pan HL 2016 ). Understory effects on overstory trees: A reviewChinese Journal of Applied Ecology 963 -972 . [本文引用: 1] [ 杜忠 , 蔡小虎 , 包维楷 , 陈槐 , 潘红丽 ( 2016 ). 林下层植被对上层乔木的影响研究综述应用生态学报 , 27, 963 -972 .] [本文引用: 1] [15] Duan L Huang YM Hao JM Zhou ZP 2002 ). Vegetation uptake of nitrogen and base cation in China and its role in soil acidificationEnvironmental Science 3 ), 69 -74 . [本文引用: 1] [ 段雷 , 黄永梅 , 郝吉明 , 周中平 ( 2002 ). 中国植被对氮和盐基阳离子吸收速率及其在土壤酸化中的作用环境科学 , 23(3 ), 69 -74 .] [本文引用: 1] [16] Fu XL Yang FT Wang JL Di YB Dai XQ Zhang XY Wang HM 2015 ). Understory vegetation leads to changes in soil acidity and in microbial communities 27 years after reforestationScience of the Total Environment 280 -286 . [本文引用: 4] [17] Gianfreda L 2015 ). Enzymes of importance to rhizosphere processesJournal of Soil Science and Plant Nutrition 283 -306 . [本文引用: 3] [18] Guo DL Xia MX Wei X Chang WJ Liu Y Wang ZQ 2008 ). Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree speciesNew Phytologist 673 -683 . [本文引用: 1] [19] Guo ZM Zhang XY Li DD Dong WT Li ML 2017 ). Characteristics of soil organic carbon and related exo-enzyme activities at different altitudes in temperate forestsChinese Journal of Applied Ecology 2888 -2896 . [本文引用: 1] [ 郭志明 , 张心昱 , 李丹丹 , 董文亭 , 李美玲 ( 2017 ). 温带森林不同海拔土壤有机碳及相关胞外酶活性特征应用生态学报 , 28, 2888 -2896 .] [本文引用: 1] [20] He TX Li YP Zhang FY Wang QK 2015 ). Effects of understory removal on soil respiration and microbial community composition structure in a Chinese fir plantationChinese Journal of Plant Ecology 797 -806 . [本文引用: 1] [ 贺同鑫 , 李艳鹏 , 张方月 , 王清奎 ( 2015 ). 林下植被剔除对杉木林土壤呼吸和微生物群落结构的影响植物生态学报 , 39, 797 -806 .] [本文引用: 1] [21] Hill BH Elonen CM Jicha TM Bolgrien DW Moffett MF 2010 ). Sediment microbial enzyme activity as an indicator of nutrient limitation in great lakes coastal wetlandsFreshwater Biology 1670 -1683 . [本文引用: 1] [22] Hill BH Elonen CM Jicha TM Kolka RK Lehto LLP Sebestyen SD Seifert-Monson LR 2014 ). Ecoenzymatic stoichiometry and microbial processing of organic matter in northern bogs and fens reveals a common P-limitation between peatland typesBiogeochemistry 203 -224 . [本文引用: 1] [23] Hu YL Wang SL Huang Y Yu XJ 2005 ). Effects of litter chemistry on soil biological property and enzymatic activityActa Ecoligica Sinica 2662 -2668 . [本文引用: 1] [ 胡亚林 , 汪思龙 , 黄宇 , 于小军 ( 2005 ). 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响生态学报 , 25, 2662 -2668 .] [本文引用: 1] [24] Huang YM Yang WQ Zhang J Lu CT Liu X Wang W Guo W Zhang DJ 2014 ). Response of soil microorganism and soil enzyme activity to understory plant removal in the subalpine coniferous plantation of western SichuanActa Ecologica Sinica 4183 -4192 . [本文引用: 1] [ 黄玉梅 , 杨万勤 , 张健 , 卢昌泰 , 刘旭 , 王伟 , 郭伟 , 张丹桔 ( 2014 ). 川西亚高山针叶林土壤微生物及酶对林下植物去除的响应生态学报 , 34, 4183 -4192 .] [本文引用: 1] [25] Kivlin SN Treseder KK 2014 ). Soil extracellular enzyme activities correspond with abiotic factors more than fungal community compositionBiogeochemistry 23 -37 . [本文引用: 3] [26] Kuzyakov Y 2002 ). Review: Factors affecting rhizosphere priming effectsJournal of Plant Nutrition and Soil Science 66 -70 . [本文引用: 3] [27] Kuzyakov Y Xu XL 2013 ). Competition between roots and microorganisms for nitrogen: Mechanisms and ecological relevanceNew Phytologist 656 -669 . [本文引用: 1] [28] Li B 2000 ). Ecology [本文引用: 1] [ 李博 ( 2000 ). 生态学 . 高等教育出版社, 北京.] [本文引用: 1] [29] Li CC Li QR Xu XL Ouyang H 2016 ). Nitrogen acquisition strategies of Cunninghamia lanceolata at different agesActa Ecologica Sinica 2620 -2625 . [本文引用: 1] [ 李常诚 , 李倩茹 , 徐兴良 , 欧阳华 ( 2016 ). 不同林龄杉木氮素的获取策略生态学报 , 36, 2620 -2625 .] [本文引用: 1] [30] Lin GG McCormack ML Ma CE Guo DL 2017 ). Similar belowground carbon cycling dynamics but contrasting modes of nitrogen cycling between arbuscular mycorrhizal and ectomycorrhizal forestsNew Phytologist 1440 -1451 . [本文引用: 1] [31] Lin GG Zhao Q Zhao L Li HC Zeng DH 2012 ). Effects of understory removal and nitrogen addition on the soil chemical and biological properties of Pinus sylvestris var. mongolica plantation in Keerqin Sandy LandChinese Journal of Applied Ecology 1188 -1194 . [本文引用: 1] [ 林贵刚 , 赵琼 , 赵蕾 , 李慧超 , 曾德慧 ( 2012 ). 林下植被去除与氮添加对樟子松人工林土壤化学和生物学性质的影响应用生态学报 , 23, 1188 -1194 .] [本文引用: 1] [32] Lin N Liu Y Li GL Yu HQ 2010 ). Research progress on forest soil enzymeWorld Forestry Research 4 ), 21 -25 . [本文引用: 1] [ 林娜 , 刘勇 , 李国雷 , 于海群 ( 2010 ). 森林土壤酶研究进展世界林业研究 , 23(4 ), 21 -25 .] [本文引用: 1] [33] Liu BT Li HB Zhu B Koide RT Eissenstat DM Guo DL 2015 ). Complementarity in nutrient foraging strategies of absorptive fine roots and arbuscular mycorrhizal fungi across 14 coexisting subtropical tree speciesNew Phytologist 125 -136 . [本文引用: 1] [34] Liu JB Chen GS Guo JF Yang ZJ Li YQ Lin CF Yang YS 2017 ). Advances in research on the responses of forest soil enzymes to environmental changeActa Ecologica Sinica 110 -117 . [本文引用: 3] [ 刘捷豹 , 陈光水 , 郭剑芬 , 杨智杰 , 李一清 , 林成芳 , 杨玉盛 ( 2017 ). 森林土壤酶对环境变化的响应研究进展生态学报 , 37, 110 -117 .] [本文引用: 3] [35] Liu SJ Xia X Chen GM Mao D Che SG Li YX 2011 ). Study progress on functions and affecting factors of soil enzymesChinese Agricultural Science Bulletin 21 ), 1 -7 . [本文引用: 1] [ 刘善江 , 夏雪 , 陈桂梅 , 卯丹 , 车升国 , 李亚星 ( 2011 ). 土壤酶的研究进展中国农学通报 , 27(21 ), 1 -7 .] [本文引用: 1] [36] Lu SB Zhou XQ Rui YC Chen CR Xu ZH Guo XM 2011 ). Effects of forest type on soil organic matter, microbial biomass, and enzyme activitiesChinese Journal of Applied Ecology 2567 -2573 . [本文引用: 2] [ 鲁顺保 , 周小奇 , 芮亦超 , 陈成榕 , 徐志红 , 郭晓敏 ( 2011 ). 森林类型对土壤有机质、微生物生物量及酶活性的影响应用生态学报 , 22, 2567 -2573 .] [本文引用: 2] [37] Mccormack ML Guo DL Iversen CM Chen WL Eissenstat DM Fernandez CW Li L Ma CE Ma ZQ Poorter H Reich PB Zadworny M Zanne A 2017 ). Building a better foundation: Improving root-trait measurements to understand and model plant and ecosystem processesNew Phytologist 27 -37 . [本文引用: 1] [38] McDaniel MD Kaye JP Kaye MW 2013 ). Increased temperature and precipitation had limited effects on soil extracellular enzyme activities in a post-harvest forestSoil Biology & Biochemistry 90 -98 . [本文引用: 1] [39] McKane RB Johnson LC Shaver GR Nadelhoffer KJ Rastetter EB Fry B Giblin AE Kielland K Kwiatkowski BL Laundre JA Murray G 2002 ). Resource-based niches provide a basis for plant species diversity and dominance in arctic tundraNature 68 -71 . [本文引用: 1] [40] Mo XL Dai XQ Wang HM Kou L Fu XL 2018 ). Rhizosphere effect of overstory tree and understory shrub species in central subtropical plantations—A case study at Qianyanzhou, Taihe, JiangxiChinese Journal of Plant Ecology 723 -733 . [本文引用: 5] [ 莫雪丽 , 戴晓琴 , 王辉民 , 寇亮 , 付晓莉 ( 2018 ). 中亚热带常见乔木灌木根际效应研究——以江西泰和千烟洲为例植物生态学报 , 42, 723 -733 .] [本文引用: 5] [41] Nannipieri P Trasar-Cepeda C Dick RP 2018 ). Soil enzyme activity: A brief history and biochemistry as a basis for appropriate interpretations and meta-analysisBiology and Fertility of Soils 11 -19 . [本文引用: 1] [42] National Forestry Administration of China ( 2014 ). National Forest Resources Statistics:The Eighth National Inventory of Forest Resources [本文引用: 1] [ 国家林业局 ( 2014 ). 全国森林资源统计:第八次全国森林资源清查 [本文引用: 1] [43] Peng X Wang W 2016 ). Stoichiometry of soil extracellular enzyme activity along a climatic transect in temperate grasslands of northern chinaSoil Biology & Biochemistry 74 -84 . [本文引用: 6] [44] Phillips RP Erlitz Y Bier R Bernhardt ES 2008 ). New approach for capturing soluble root exudates in forest soilsFunctional Ecology 990 -999 . [本文引用: 1] [45] Phillips RP Fahey TJ 2006 ). Tree species and mycorrhizal associations influence the magnitude of rhizosphere effectsEcology 1302 -1313 . [本文引用: 2] [46] Phillips RP Fahey TJ 2008 ). The influence of soil fertility on rhizosphere effects in northern hardwood forest soilsSoil Science Society of America Journal 453 -461 . [本文引用: 3] [47] Riley D Barber SA 1970 ). Salt accumulation at the soybean (Glycine max (L.) Merr.) root-soil interfaceSoil Science Society of America Journal 154 -155 . [本文引用: 1] [48] Saiya-Cork KR Sinsabaugh RL Zak DR 2002 ). The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soilSoil Biology & Biochemistry 1309 -1315 . [本文引用: 1] [49] Santiago L Wright S 2007 ). Leaf functional traits of tropical forest plants in relation to growth formFunctional Ecology 19 -27 . [本文引用: 1] [50] Scientific Investigation Team of Chinese Academy of Sciences for Southern Mountainous Areas ( 1989 ). Management and Development of Red Hilly Area-Experimental Study in Qianyanzhou [本文引用: 1] [ 中国科学院南方山区综合科学考察队 ( 1989 ). 红壤丘陵综合开发治理——千烟洲综合开发治理试验研究 [本文引用: 1] [51] Shukla G Varma A 2011 ). Soil EnzymologySpringer, Berlin [本文引用: 1] [52] Sinsabaugh RL Follstad Shah JJ 2012 ). Ecoenzymatic stoichiometry and ecological theoryAnnual Review of Ecology Evolution and Systematics 313 -343 . [本文引用: 5] [53] Sinsabaugh RL Hill BH Shah JJF 2009 ). Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sedimentNature 795 -798 . [本文引用: 5] [54] Sinsabaugh RL Lauber CL Weintraub MN Ahmed B Allison SD Crenshaw C Contosta AR Cusack D Frey S Gallo ME Gartner TB Hobbie SE Holland K Keeler BL Powers JS Stursova M Takacs-Vesbach C Waldrop MP Wallenstein MD Zak DR Zeglin LH 2008 ). Stoichiometry of soil enzyme activity at global scaleEcology Letters 1252 -1264 . [本文引用: 3] [55] Sinsabaugh RL Moorhead DL 1994 ). Resource allocation to extracellular enzyme production: A model for nitrogen and phosphorus control of litter decompositionSoil Biology & Biochemistry 1305 -1311 . [本文引用: 1] [56] Smalla K Sessitsch A Hartmann A 2006 ). The rhizosphere: “Soil compartment influenced by the root”FEMS Microbiology Ecology 165 -165 . [本文引用: 1] [57] Steinaker DF Wilson SD Peltzer DA 2010 ). Asynchronicity in root and shoot phenology in grasses and woody plantsGlobal Change Biology 2241 -2251 . [本文引用: 1] [58] Sterner RW Elser JJ 2002 ). Ecological Stoichiometry:The Biology of Elements from Molecules to the Biosphere [本文引用: 1] [59] Su LY Cheng AX Yu AL Fu WQ Zhen PY 1992 ). Investigation on mycorrhizae of forest trees in natural reserve of Mount TianmuJournal of Zhejiang Forestry College 263 -276 . [本文引用: 2] [ 苏琍英 , 程爱兴 , 喻爱林 , 傅卫庆 , 郑平谣 ( 1992 ). 天目山自然保护区林木菌根调查浙江林学院学报 , 3, 263 -276 .] [本文引用: 2] [60] Sun LJ Kominami Y Yoshimura K Kitayama K 2017 ). Root-exudate flux variations among four co-existing canopy species in a temperate forest, JapanEcological Research 331 -339 . [本文引用: 1] [61] Sun Y Xu XL Kuzyakov Y 2014 ). Mechanisms of rhizosphere priming effects and their ecological significanceChinese Journal of Plant Ecology 62 -75 . [本文引用: 2] [ 孙悦 , 徐兴良 , Kuzyakov Y 2014 ). 根际激发效应的发生机制及其生态重要性植物生态学报 , 38, 62 -75 .] [本文引用: 2] [62] Tao BX Zhang JC Yu YC Cong RL 2010 ). Season variations of forest soil enzyme activities in the hilly region of southern Jiangsu ProvinceEcology and Environmental Sciences 2349 -2354 . [本文引用: 1] [ 陶宝先 , 张金池 , 愈元春 , 丛日亮 ( 2010 ). 苏南丘陵地区森林土壤酶活性季节变化生态环境学报 , 19, 2349 -2354 .] [本文引用: 1] [63] Tapia-Torres Y Elser JJ Souza V García-Oliva F 2015 ). Ecoenzymatic stoichiometry at the extremes: How microbes cope in an ultra-oligotrophic desert soilSoil Biology & Biochemistry 34 -42 . [本文引用: 2] [64] Toberman H Evans CD Freeman C Fenner N White M Emmett BA Artz RRE 2008 ). Summer drought effects upon soil and litter extracellular phenol oxidase activity and soluble carbon release in an upland Calluna heathlandSoil Biology & Biochemistry 1519 -1532 . [本文引用: 1] [65] Wang RL Wang QF Zhao N Yu GR He NP 2017 ). Complex trait relationships between leaves and absorptive roots: Coordination in tissue N concentration but divergence in morphologyEcology and Evolution 2697 -2705 . [本文引用: 1] [66] Wang T Yang YH Ma WH 2008 ). Storage, patterns and environmental controls of soil phosphorus in ChinaActa Scientiarum Naturalium Universitatis Pekinensis 945 -951 . [本文引用: 1] [ 汪涛 , 杨元合 , 马文红 ( 2008 ). 中国土壤磷库的大小、分布及其影响因素北京大学学报(自然科学版) , 44, 945 -951 .] [本文引用: 1] [67] Waring BG Weintraub SR Sinsabaugh RL 2014 ). Ecoenzymatic stoichiometry of microbial nutrient acquisition in tropical soilsBiogeochemistry 101 -113 . [本文引用: 3] [68] Warton DI Duursma RA Falster DS Taskinen S 2012 ). Smatr 3—An R package for estimation and inference about allometric linesMethods in Ecology and Evolution 257 -259 . [本文引用: 1] [69] Wei Y Wang ZQ Zhang XY Yang H Liu XY Liu WJ 2017 ). Enzyme activities and microbial communities in subtropical forest soil aggregates to ammonium and nitrate-?nitrogen additionsJournal of Resources and Ecology 258 -267 . [本文引用: 3] [70] Wu WD Liao CH Liu KS Wang JM 1994 ). A study on the soil deterioration of the first generation of artificial fir plantation in Jiangxi ProvinceResearch of Soil and Water Conservation Suppl.1 ), 64 -74 . [本文引用: 2] [ 吴蔚东 , 廖彩恢 , 刘开树 , 王景明 ( 1994 ). 江西省第一代人工杉木林土壤退化的研究水土保持研究 , 1(Suppl.1 ), 64 -74 .] [本文引用: 2] [71] Wu XQ Sun MQ 2006 ). Mycorrhizal formation between seven ectomycorrhizal fungi and seedlings of three pines speciesActa Ecologica Sinica 4186 -4191 . [本文引用: 1] [ 吴小芹 , 孙民琴 ( 2006 ). 七株外生菌根真菌与三种松苗菌根的形成能力生态学报 , 26, 4186 -4191 .] [本文引用: 1] [72] Yang WQ Wang KY 2004 ). Advances in forest soil enzymologyScientia Silvae Sinicae 2 ), 152 -159 . DOI:
10.11707/j.1001-7488.20040227 Magsci [本文引用: 1] <p>土壤酶在土壤生态系统的物质循环和能量流动方面扮演重要的角色。目前,在几乎所有的森林生态系统研究中,土壤酶活性的监测似乎成为必不可少的研究内容。森林凋落物分解过程中的酶活性动态,植被特征与土壤酶活性的关系,土壤微生物与土壤酶的关系,植物-土壤界面的土壤酶,森林土壤质量评价指标的土壤酶及人类活动干扰对森林土壤酶活性的影响等是当前森林土壤酶学的研究重点。由于土壤酶的功能和生态重要性,森林土壤酶研究可能包括:(1 )土壤酶系统分异;(2 )作为森林土壤质量综合评价指标的土壤酶活性;(3)植被动态与土壤酶的关系;(4 )退化森林生态系统的土壤酶活性特征;(5 )人工林土壤酶活性特征;(6 )人类活动对森林土壤酶系统的影响。本文从土壤酶系统分异和生态系统的角度对土壤酶在森林生态系统中的作用和地位进行了综述,这对于加深理解森林生态系统中的物质循环、土壤酶的生态重要性以及森林生态系统退化机理有重要作用</p>
[ 杨万勤 , 王开运 ( 2004 ). 森林土壤酶的研究进展林业科学 , 40(2 ), 152 -159 .] DOI:
10.11707/j.1001-7488.20040227 Magsci [本文引用: 1] <p>土壤酶在土壤生态系统的物质循环和能量流动方面扮演重要的角色。目前,在几乎所有的森林生态系统研究中,土壤酶活性的监测似乎成为必不可少的研究内容。森林凋落物分解过程中的酶活性动态,植被特征与土壤酶活性的关系,土壤微生物与土壤酶的关系,植物-土壤界面的土壤酶,森林土壤质量评价指标的土壤酶及人类活动干扰对森林土壤酶活性的影响等是当前森林土壤酶学的研究重点。由于土壤酶的功能和生态重要性,森林土壤酶研究可能包括:(1 )土壤酶系统分异;(2 )作为森林土壤质量综合评价指标的土壤酶活性;(3)植被动态与土壤酶的关系;(4 )退化森林生态系统的土壤酶活性特征;(5 )人工林土壤酶活性特征;(6 )人类活动对森林土壤酶系统的影响。本文从土壤酶系统分异和生态系统的角度对土壤酶在森林生态系统中的作用和地位进行了综述,这对于加深理解森林生态系统中的物质循环、土壤酶的生态重要性以及森林生态系统退化机理有重要作用</p>
[73] Yang Y Wang JF Zhang XY Li DD Wang HM Chen FS Sun XM Wen XF 2016 ). Mechanism of litter and understory vegetation effects on soil carbon and nitrogen hydrolase activities in Chinese fir forestsActa Ecologica Sinica 8102 -8110 . [本文引用: 3] [ 杨洋 , 王继富 , 张心昱 , 李丹丹 , 王辉民 , 陈伏生 , 孙晓敏 , 温学发 ( 2016 ). 凋落物和林下植被对杉木林土壤碳氮水解酶活性的影响机制生态学报 , 36, 8102 -8110 .] [本文引用: 3] [74] Yang Y Zhang XY Zhang C Wang HM Fu XL Chen FS Wan SZ Sun XM Wen XF Wang JF 2018 ). Understory vegetation plays the key role in sustaining soil microbial biomass and extracellular enzyme activitiesBiogeosciences 4481 -4494 . [本文引用: 2] [75] Yin HJ Wheeler E Phillips RP 2014 ). Root-induced changes in nutrient cycling in forests depend on exudation ratesSoil Biology & Biochemistry 213 -221 . [本文引用: 1] [76] Zhang XX Yang LM Chen Z Li YQ Lin YY Zheng XZ Chu HY Yang YS 2018 ). Patterns of ecoenzymatic stoichiometry on types of forest soils form different parent materials in subtropical areasActa Ecoligica Sinica 5828 -5836 . [本文引用: 4] [ 张星星 , 杨柳明 , 陈忠 , 李一清 , 林燕语 , 郑宪志 , 楚海燕 , 杨玉盛 ( 2018 ). 中亚热带不同母质和森林类型土壤生态酶化学计量特征生态学报 , 38, 5828 -5836 .] [本文引用: 4] [77] Zhang YL Chen LJ Liu GF Wu ZJ 2003 ). Research advance in catalytic kinetics of soil hydrolasChinese Journal of Applied Ecology 2326 -2332 . [本文引用: 1] [ 张玉兰 , 陈利军 , 刘桂芬 , 武志杰 ( 2003 ). 土壤水解酶类催化动力学研究进展应用生态学报 , 14, 2326 -2332 .] [本文引用: 1] [78] Zhao J Wan SZ Fu SL Wang XL Wang M Liang CF Chen YQ Zhu XL 2013 ). Effects of understory removal and nitrogen fertilization on soil microbial communities in Eucalyptus plantationsForest Ecology and Management 80 -86 . [本文引用: 1] [79] Zhao ZW 1998 a). VA mycorrhizal fungi in the rhizosphere soil of tropical and subtropical pteridophytes in YunnanActa Botanica Yunnanica 183 -192 . [本文引用: 1] [ 赵之伟 ( 1998 a). 云南热带、亚热带蕨类植物根际土壤中的VA菌根真菌云南植物研究 , 20, 183 -192 .] [本文引用: 1] [80] Zhao ZW 1998 b). Vesicular Arbuscular mycorrhizae of PteridophytesJournal of Yunnan University 2 ), 97 -100 . [本文引用: 1] [ 赵之伟 ( 1998 b). 蕨类植物的VA菌根云南大学学报(自然科学版) , 20(2 ), 97 -100 .] [本文引用: 1] Evolutionary-economic principles as regulators of soil enzyme production and ecosystem function
2
2011
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
Rhizosphere stoichiometry: Are C:N:P ratios of plants, soils, and enzymes conserved at the plant species-level?
2
2014
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
... ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
Evidence of a strong coupling between root exudation, C and N availability, and stimulated SOM decomposition caused by rhizosphere priming effects
2012
Rhizosphere priming of soil organic matter by bacterial groups in a grassland soil
1
2011
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
Numerical Ecology with R. Springer
1
2011
... 文中酶活性及其比值的平均值及标准误差为原数据.为使数据符合正态分布和方差齐性, 统计分析部分所用数据经过以10为底的log转化.林分类型、林下植被类型和取样季节对酶活性、酶化学计量比和土壤理化性质的影响采用重复测量的多因素方差分析.不同取样季节同一林分类型下, 不同林下植被根际土壤酶的活性及计量比之间的差异采用线性混合效应模型分析.BG、NAG+LAP和AP之间的关系用标准主轴回归(SMA)法分析, 以lg(BG): lg(NAG+LAP)、lg(BG):lg(AP)及lg(NAG+LAP):lg(AP)形式直接表示, 回归斜率代表受C、N或者P相对限制, 斜率偏离1的程度越大, 表示限制的相对程度越大(
Hill et al ., 2014 ).另外, 对酶的活性及计量比进行主成分分析(PCA).土壤理化性质与酶的活性及计量比之间的关系采用冗余分析(RDA).首先通过方差膨胀因子(
VIF )判断解释变量间的线性关系(即共线性程度), 若
VIF 超过20证明共线性严重, 超过10证明存在共线性问题, 需要剔除存在共线性关系的变量, 剔除共线性变量后剩余NO
3 - -N、NH
4 + -N、DOC含量及C:N 4个解释变量.之后再通过RDA分析NO
3 - -N、NH
4 + -N、DOC含量及C:N和酶活性及计量比的关系.SMA、PCA、RDA及
VIF 计算分别基于R语言中的smatr (
Warton et al ., 2012 )、vegan和packfor程序包(
Borcard et al ., 2011 )完成.其余统计分析在SPSS 18.0中完成. ...
3
1978
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
... ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
Principles of Terrestrial Ecosystem Ecology. Springer
1
2002
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
Greater variations of rhizosphere effects within mycorrhizal group than between mycorrhizal group in a temperate forest
4
2018
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
Rhizosphere effects on decomposition: Controls of plant species, phenology, and fertilization
1
2003
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
C:N:P stoichiometry in soil: Is there a “Redfield ratio” for the microbial biomass?
3
2007
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
... , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
... 此外, 本研究发现, 酶N:P对林分类型、林下植被类型及季节的响应均不显著(
表2 ), 这可能反映了微生物对N、P养分需求比例的相对稳定.
Cleveland和Liptzin (2007) 发现随纬度变化土壤微生物生物量N:P没有变化, 他们认为这与土壤N:P供应无关, 而是微生物自身保持的一种相对稳定性. ...
Ecoenzymatic stoichiometry and microbial nutrient limitation in rhizosphere soil in the arid area of the northern Loess Plateau, China
5
2018
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
... ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
C:N:P stoichiometry of rhizosphere soils differed significantly among overstory trees and understory shrubs in plantations in subtropical China
5
2018
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... 在千烟洲试验站选择5个独立山头作为5个区组, 每个区组内随机选择杉木、马尾松和湿地松3种人工林地, 每种人工林样地内分别设置1个20 m × 20 m的样方, 共15个样方.在每个样方内分别选取5种优势林下灌草, 采集其根际土.其中, 灌木包括檵木、杨桐和格药柃, 草本包括狗脊蕨和暗鳞鳞毛蕨.虽然芒萁在研究区内分布广泛, 但在杉木林内存在较少, 为保证试验的平衡, 没有选择芒萁作为研究对象.不同人工林造林前土壤特性差异不显著(
Fu et al ., 2015 ).另外, 所选5个区组土壤特性差异也不显著(
Dai et al ., 2018 ), 证明本研究样地本底环境一致. ...
... 取样时间为2017年4月和7月.在每个样方内, 每种植被类型分别随机选择3-5株, 在已确认物种的植株周围按照自树干追踪根系的方法多方位挖取0-20 cm土层根系, 具体方法参考
Guo等(2008) 、
Liu等(2015) 及
Wang等(2017) , 取直径小于5 mm的根系, 轻轻抖落其上容易掉落的大块土壤, 只取剩余仍附着于根系表面4 mm以内的土壤, 即根际土(
Riley & Barber, 1970 ).若灌草根系生物量较小, 则按照
Dai等(2018) 详细描述的方法将整株植物根系挖出, 收集根际土壤.同一样方内相同物种根际土壤样品混合均匀.采集到的鲜土立即带回实验室, 过2 mm筛后, 一部分立即保存在-4 ℃冰箱, 另一部分土壤风干, 以便后续操作. ...
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
Atmospheric nitrate deposition, microbial community composition, and enzyme activity in northern hardwood forests
2
2004
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
林下层植被对上层乔木的影响研究综述
1
2016
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
林下层植被对上层乔木的影响研究综述
1
2016
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
中国植被对氮和盐基阳离子吸收速率及其在土壤酸化中的作用
1
2002
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
中国植被对氮和盐基阳离子吸收速率及其在土壤酸化中的作用
1
2002
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
Understory vegetation leads to changes in soil acidity and in microbial communities 27 years after reforestation
4
2015
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... 在千烟洲试验站选择5个独立山头作为5个区组, 每个区组内随机选择杉木、马尾松和湿地松3种人工林地, 每种人工林样地内分别设置1个20 m × 20 m的样方, 共15个样方.在每个样方内分别选取5种优势林下灌草, 采集其根际土.其中, 灌木包括檵木、杨桐和格药柃, 草本包括狗脊蕨和暗鳞鳞毛蕨.虽然芒萁在研究区内分布广泛, 但在杉木林内存在较少, 为保证试验的平衡, 没有选择芒萁作为研究对象.不同人工林造林前土壤特性差异不显著(
Fu et al ., 2015 ).另外, 所选5个区组土壤特性差异也不显著(
Dai et al ., 2018 ), 证明本研究样地本底环境一致. ...
Enzymes of importance to rhizosphere processes
3
2015
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species
1
2008
... 取样时间为2017年4月和7月.在每个样方内, 每种植被类型分别随机选择3-5株, 在已确认物种的植株周围按照自树干追踪根系的方法多方位挖取0-20 cm土层根系, 具体方法参考
Guo等(2008) 、
Liu等(2015) 及
Wang等(2017) , 取直径小于5 mm的根系, 轻轻抖落其上容易掉落的大块土壤, 只取剩余仍附着于根系表面4 mm以内的土壤, 即根际土(
Riley & Barber, 1970 ).若灌草根系生物量较小, 则按照
Dai等(2018) 详细描述的方法将整株植物根系挖出, 收集根际土壤.同一样方内相同物种根际土壤样品混合均匀.采集到的鲜土立即带回实验室, 过2 mm筛后, 一部分立即保存在-4 ℃冰箱, 另一部分土壤风干, 以便后续操作. ...
温带森林不同海拔土壤有机碳及相关胞外酶活性特征
1
2017
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
温带森林不同海拔土壤有机碳及相关胞外酶活性特征
1
2017
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
林下植被剔除对杉木林土壤呼吸和微生物群落结构的影响
1
2015
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
林下植被剔除对杉木林土壤呼吸和微生物群落结构的影响
1
2015
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
Sediment microbial enzyme activity as an indicator of nutrient limitation in great lakes coastal wetlands
1
2010
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
Ecoenzymatic stoichiometry and microbial processing of organic matter in northern bogs and fens reveals a common P-limitation between peatland types
1
2014
... 文中酶活性及其比值的平均值及标准误差为原数据.为使数据符合正态分布和方差齐性, 统计分析部分所用数据经过以10为底的log转化.林分类型、林下植被类型和取样季节对酶活性、酶化学计量比和土壤理化性质的影响采用重复测量的多因素方差分析.不同取样季节同一林分类型下, 不同林下植被根际土壤酶的活性及计量比之间的差异采用线性混合效应模型分析.BG、NAG+LAP和AP之间的关系用标准主轴回归(SMA)法分析, 以lg(BG): lg(NAG+LAP)、lg(BG):lg(AP)及lg(NAG+LAP):lg(AP)形式直接表示, 回归斜率代表受C、N或者P相对限制, 斜率偏离1的程度越大, 表示限制的相对程度越大(
Hill et al ., 2014 ).另外, 对酶的活性及计量比进行主成分分析(PCA).土壤理化性质与酶的活性及计量比之间的关系采用冗余分析(RDA).首先通过方差膨胀因子(
VIF )判断解释变量间的线性关系(即共线性程度), 若
VIF 超过20证明共线性严重, 超过10证明存在共线性问题, 需要剔除存在共线性关系的变量, 剔除共线性变量后剩余NO
3 - -N、NH
4 + -N、DOC含量及C:N 4个解释变量.之后再通过RDA分析NO
3 - -N、NH
4 + -N、DOC含量及C:N和酶活性及计量比的关系.SMA、PCA、RDA及
VIF 计算分别基于R语言中的smatr (
Warton et al ., 2012 )、vegan和packfor程序包(
Borcard et al ., 2011 )完成.其余统计分析在SPSS 18.0中完成. ...
凋落物化学组成对土壤微生物学性状及土壤酶活性的影响
1
2005
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
凋落物化学组成对土壤微生物学性状及土壤酶活性的影响
1
2005
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
川西亚高山针叶林土壤微生物及酶对林下植物去除的响应
1
2014
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
川西亚高山针叶林土壤微生物及酶对林下植物去除的响应
1
2014
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
Soil extracellular enzyme activities correspond with abiotic factors more than fungal community composition
3
2014
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
... ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
... ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
Review: Factors affecting rhizosphere priming effects
3
2002
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
Competition between roots and microorganisms for nitrogen: Mechanisms and ecological relevance
1
2013
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
1
2000
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
1
2000
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
不同林龄杉木氮素的获取策略
1
2016
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
不同林龄杉木氮素的获取策略
1
2016
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
Similar belowground carbon cycling dynamics but contrasting modes of nitrogen cycling between arbuscular mycorrhizal and ectomycorrhizal forests
1
2017
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
林下植被去除与氮添加对樟子松人工林土壤化学和生物学性质的影响
1
2012
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
林下植被去除与氮添加对樟子松人工林土壤化学和生物学性质的影响
1
2012
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
森林土壤酶研究进展
1
2010
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
森林土壤酶研究进展
1
2010
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
Complementarity in nutrient foraging strategies of absorptive fine roots and arbuscular mycorrhizal fungi across 14 coexisting subtropical tree species
1
2015
... 取样时间为2017年4月和7月.在每个样方内, 每种植被类型分别随机选择3-5株, 在已确认物种的植株周围按照自树干追踪根系的方法多方位挖取0-20 cm土层根系, 具体方法参考
Guo等(2008) 、
Liu等(2015) 及
Wang等(2017) , 取直径小于5 mm的根系, 轻轻抖落其上容易掉落的大块土壤, 只取剩余仍附着于根系表面4 mm以内的土壤, 即根际土(
Riley & Barber, 1970 ).若灌草根系生物量较小, 则按照
Dai等(2018) 详细描述的方法将整株植物根系挖出, 收集根际土壤.同一样方内相同物种根际土壤样品混合均匀.采集到的鲜土立即带回实验室, 过2 mm筛后, 一部分立即保存在-4 ℃冰箱, 另一部分土壤风干, 以便后续操作. ...
森林土壤酶对环境变化的响应研究进展
3
2017
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
森林土壤酶对环境变化的响应研究进展
3
2017
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
土壤酶的研究进展
1
2011
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
土壤酶的研究进展
1
2011
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
森林类型对土壤有机质、微生物生物量及酶活性的影响
2
2011
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
森林类型对土壤有机质、微生物生物量及酶活性的影响
2
2011
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
Building a better foundation: Improving root-trait measurements to understand and model plant and ecosystem processes
1
2017
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
Increased temperature and precipitation had limited effects on soil extracellular enzyme activities in a post-harvest forest
1
2013
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
Resource-based niches provide a basis for plant species diversity and dominance in arctic tundra
1
2002
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
中亚热带常见乔木灌木根际效应研究——以江西泰和千烟洲为例
5
2018
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
中亚热带常见乔木灌木根际效应研究——以江西泰和千烟洲为例
5
2018
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
Soil enzyme activity: A brief history and biochemistry as a basis for appropriate interpretations and meta-analysis
1
2018
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
1
2014
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
1
2014
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
Stoichiometry of soil extracellular enzyme activity along a climatic transect in temperate grasslands of northern china
6
2016
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
... 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
... 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
New approach for capturing soluble root exudates in forest soils
1
2008
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
Tree species and mycorrhizal associations influence the magnitude of rhizosphere effects
2
2006
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
The influence of soil fertility on rhizosphere effects in northern hardwood forest soils
3
2008
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
Salt accumulation at the soybean (Glycine max (L.) Merr.) root-soil interface
1
1970
... 取样时间为2017年4月和7月.在每个样方内, 每种植被类型分别随机选择3-5株, 在已确认物种的植株周围按照自树干追踪根系的方法多方位挖取0-20 cm土层根系, 具体方法参考
Guo等(2008) 、
Liu等(2015) 及
Wang等(2017) , 取直径小于5 mm的根系, 轻轻抖落其上容易掉落的大块土壤, 只取剩余仍附着于根系表面4 mm以内的土壤, 即根际土(
Riley & Barber, 1970 ).若灌草根系生物量较小, 则按照
Dai等(2018) 详细描述的方法将整株植物根系挖出, 收集根际土壤.同一样方内相同物种根际土壤样品混合均匀.采集到的鲜土立即带回实验室, 过2 mm筛后, 一部分立即保存在-4 ℃冰箱, 另一部分土壤风干, 以便后续操作. ...
The effects of long term nitrogen deposition on extracellular enzyme activity in an Acer saccharum forest soil
1
2002
... 土壤酶活性采用微孔板荧光法(
Saiya-Cork et al ., 2002 )测定, 其中BG酶底物为4-甲基伞形酮酰- β-D-吡喃葡萄糖苷(4-MUB-β-D-glucopyranoside), NAG酶底物为4-甲基伞形酮酰-β-D-吡喃葡糖酸苷(4-MUB-N-acetyl-β-D-glucosaminide), LAP酶底物为L-亮氨酸-7-氨基-4-甲基香豆素盐酸盐(L-leucine-7-?amino-4-methylcoumarin), AP酶底物为4-甲基伞形酮磷酸酯(4-MUB-phosphate).具体方法为: 称取-4 ℃保存的鲜土1 g于烧杯中, 加入125 mL醋酸缓冲液(50 mmol·L
-1 , pH值5.0), 用旋涡振荡器混匀, 制成土壤悬浮液.在96孔微孔板每个孔内各加入200 μL土壤悬浮液, 再在每个孔内分别加入50 μL底物(200 μmol·L
-1 , 超纯水配制), 所有微孔板在20 ℃的黑暗条件下培养4 h, 之后分别在每个孔内加10 μL NaOH溶液(1 mol·L
-1 )终止培养.1 min后, 用多功能酶标仪(Synergy H4, BioTek, Winooski, USA)在365 nm波长激发, 450 nm波长进行荧光测定.酶底物均为Sigma公司生产, 其他试剂为国产分析纯. ...
Leaf functional traits of tropical forest plants in relation to growth form
1
2007
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
1
1989
... 研究地设在中国科学院-江西省千烟洲红壤丘陵综合开发试验站(千烟洲试验站), 位于江西省泰和县灌溪镇(115.07° E, 26.75° N), 平均海拔为110.8 m, 相对高差20-50 m.站区属亚热带季风气候, 年平均气温为17.9 ℃, 1月平均气温为6.4 ℃, 7月平均气温为28.8 ℃; 年降水量1 489 mm, 主要集中在3-6月.土壤类型主要为红壤, 成土母质多为红色砂岩和砂砾岩(
中国科学院南方山区综合科学考察队, 1989 ).站区属于中亚热带常绿阔叶林区, 但原生植被在20世纪80年代初被破坏, 现有森林主要为林龄约30年的人工纯林, 主要树种为杉木、马尾松和湿地松, 密度分别为每公顷(1 443 ± 241)、(1 473 ± 159)和(961 ± 87)株, 平均胸径分别为(18.1 ± 1.63)、(16.6 ± 0.53)和(21.8 ± 0.51) cm.林下优势植被主要为檵木(
Loropetalum chinense )、杨桐(
Adinandra millettii )和格药柃(
Eurya muricata )等灌木及狗脊蕨(
Woodwardia japonica )、暗鳞鳞毛蕨(
Dryopteris atrata )和芒萁(
Dicranopteris dichotoma )等草本.人工林生态系统林下植被基本信息见
表1 . ...
1
1989
... 研究地设在中国科学院-江西省千烟洲红壤丘陵综合开发试验站(千烟洲试验站), 位于江西省泰和县灌溪镇(115.07° E, 26.75° N), 平均海拔为110.8 m, 相对高差20-50 m.站区属亚热带季风气候, 年平均气温为17.9 ℃, 1月平均气温为6.4 ℃, 7月平均气温为28.8 ℃; 年降水量1 489 mm, 主要集中在3-6月.土壤类型主要为红壤, 成土母质多为红色砂岩和砂砾岩(
中国科学院南方山区综合科学考察队, 1989 ).站区属于中亚热带常绿阔叶林区, 但原生植被在20世纪80年代初被破坏, 现有森林主要为林龄约30年的人工纯林, 主要树种为杉木、马尾松和湿地松, 密度分别为每公顷(1 443 ± 241)、(1 473 ± 159)和(961 ± 87)株, 平均胸径分别为(18.1 ± 1.63)、(16.6 ± 0.53)和(21.8 ± 0.51) cm.林下优势植被主要为檵木(
Loropetalum chinense )、杨桐(
Adinandra millettii )和格药柃(
Eurya muricata )等灌木及狗脊蕨(
Woodwardia japonica )、暗鳞鳞毛蕨(
Dryopteris atrata )和芒萁(
Dicranopteris dichotoma )等草本.人工林生态系统林下植被基本信息见
表1 . ...
Soil Enzymology
1
2011
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
Ecoenzymatic stoichiometry and ecological theory
5
2012
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment
5
2009
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
Stoichiometry of soil enzyme activity at global scale
3
2008
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
... ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
Resource allocation to extracellular enzyme production: A model for nitrogen and phosphorus control of litter decomposition
1
1994
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
The rhizosphere: “Soil compartment influenced by the root”
1
2006
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
Asynchronicity in root and shoot phenology in grasses and woody plants
1
2010
... 根际是植物、微生物和土壤互作的界面, 是生物地球化学循环的热点区域(
Smalla et al ., 2006 ).研究根际土壤酶化学计量特征对于理解根际土壤微生物的代谢, 揭示根-土界面养分循环过程具有重要的作用(
Bell et al ., 2014 ;
Gianfreda, 2015 ;
Cui et al ., 2018 ).不同植物根系的形态、生理特性(如根系生物量、周转、根系分泌物数量和质量等)、物候和对养分的需求存在较大的差异(
Steinaker et al ., 2010 ;
Fu et al ., 2015 ;
Mccormack et al ., 2017 ), 导致其根际环境显著不同(
Dai et al ., 2018 ), 必然使得不同植物根际土壤酶计量关系差异显著.如半干旱草原不同物种根际土壤酶N:P差异显著(
Bell et al ., 2014 ), 黄土高原灌丛和草地生态系统中植物和土壤特性共同调控着根际土壤酶化学计量特征(
Cui et al ., 2018 ).作为陆地生态系统的主体, 森林生态系统不同植被根际土壤酶化学计量特征的研究对于充分理解森林生态系统养分循环, 维持陆地生态系统养分平衡具有重要意义.然而, 目前关于森林生态系统不同植被根际土壤酶化学计量特征的研究明显不足, 限制了对森林生态系统养分循环的准确评估. ...
1
2002
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
天目山自然保护区林木菌根调查
2
1992
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
天目山自然保护区林木菌根调查
2
1992
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
Root-exudate flux variations among four co-existing canopy species in a temperate forest, Japan
1
2017
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
根际激发效应的发生机制及其生态重要性
2
2014
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
... ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
根际激发效应的发生机制及其生态重要性
2
2014
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
... ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
苏南丘陵地区森林土壤酶活性季节变化
1
2010
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
苏南丘陵地区森林土壤酶活性季节变化
1
2010
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
Ecoenzymatic stoichiometry at the extremes: How microbes cope in an ultra-oligotrophic desert soil
2
2015
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
Summer drought effects upon soil and litter extracellular phenol oxidase activity and soluble carbon release in an upland Calluna heathland
1
2008
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
Complex trait relationships between leaves and absorptive roots: Coordination in tissue N concentration but divergence in morphology
1
2017
... 取样时间为2017年4月和7月.在每个样方内, 每种植被类型分别随机选择3-5株, 在已确认物种的植株周围按照自树干追踪根系的方法多方位挖取0-20 cm土层根系, 具体方法参考
Guo等(2008) 、
Liu等(2015) 及
Wang等(2017) , 取直径小于5 mm的根系, 轻轻抖落其上容易掉落的大块土壤, 只取剩余仍附着于根系表面4 mm以内的土壤, 即根际土(
Riley & Barber, 1970 ).若灌草根系生物量较小, 则按照
Dai等(2018) 详细描述的方法将整株植物根系挖出, 收集根际土壤.同一样方内相同物种根际土壤样品混合均匀.采集到的鲜土立即带回实验室, 过2 mm筛后, 一部分立即保存在-4 ℃冰箱, 另一部分土壤风干, 以便后续操作. ...
中国土壤磷库的大小、分布及其影响因素
1
2008
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
中国土壤磷库的大小、分布及其影响因素
1
2008
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
Ecoenzymatic stoichiometry of microbial nutrient acquisition in tropical soils
3
2014
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 全球尺度土壤C、N和P循环相关的酶活性比约为1:1:1 (
Sinsabaugh et al ., 2008 ).本研究SMA分析也表明, lg(BG)、lg(NAG+LAP)和lg(AP)之间存在显著线性关系(
p < 0.001;
图3 ).这主要是由于微生物生物量C:N:P具有一定的保守性(
Cleveland & Liptzin, 2007 ), 因此酶活性计量比也相对保守(
Sinsabaugh et al ., 2008) , 即使受环境影响, 也在一个相对稳定的范围内波动(
Cleveland & Liptzin, 2007 ).本研究发现亚热带地区人工林内林下植被根际土壤对数转化后酶C:N:P约1:1:1.3, 酶C:N、C:P及N:P分别平均为1.05、0.14和0.15, 远远低于40个主要陆地生态系统的平均值, 即酶C:N为1.41, C:P为0.62, N:P为0.44 (
Sinsabaugh et al ., 2009 ), 说明本研究中AP酶活性高于大部分陆地生态系统的平均水平.lg(BG)和lg(NAG+LAP)与lg(AP)的回归斜率极显著偏离1 (
p < 0.001), 且AP活性远大于BG和NAG+LAP活性, 进一步证明相较于C与N循环相关的酶, 微生物会分配更多资源用于P循环相关的酶的生产.这意味着亚热带地区人工林林下植被根际土壤微生物受P限制较为严重, 这与在热带老土或酸土及P缺乏地区的研究结论(
Waring et al ., 2014 )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
... )一致.
Waring等(2014) 研究发现热带土壤酶C:N、C:P和N:P分别为1.83、0.21和0.13.因为本研究区属亚热带红壤丘陵地区, 土壤为酸性, 铁铝离子含量高, 磷元素易络合成不易被植物、微生物利用的形态, 导致土壤P限制较为严重(
Chapin et al ., 2002 ;
汪涛等, 2008 ).另外, 在湿润的森林中, 丰富的降雨及其所引起的淋溶会进一步降低P的有效性(
Santiago & Wright, 2007 ), 这种条件致使微生物投入更多的资源用于P循环相关的酶的生产以提高P的生物有效性(
Sinsabaugh & Follstad Shah, 2012 ).该结果符合资源分配理论, 即某元素可利用性越低, 植物及微生物越会增加对该元素酶资源的投入, 提高该元素利用性(
Sinsabaugh & Moorhead, 1994 ). ...
Smatr 3—An R package for estimation and inference about allometric lines
1
2012
... 文中酶活性及其比值的平均值及标准误差为原数据.为使数据符合正态分布和方差齐性, 统计分析部分所用数据经过以10为底的log转化.林分类型、林下植被类型和取样季节对酶活性、酶化学计量比和土壤理化性质的影响采用重复测量的多因素方差分析.不同取样季节同一林分类型下, 不同林下植被根际土壤酶的活性及计量比之间的差异采用线性混合效应模型分析.BG、NAG+LAP和AP之间的关系用标准主轴回归(SMA)法分析, 以lg(BG): lg(NAG+LAP)、lg(BG):lg(AP)及lg(NAG+LAP):lg(AP)形式直接表示, 回归斜率代表受C、N或者P相对限制, 斜率偏离1的程度越大, 表示限制的相对程度越大(
Hill et al ., 2014 ).另外, 对酶的活性及计量比进行主成分分析(PCA).土壤理化性质与酶的活性及计量比之间的关系采用冗余分析(RDA).首先通过方差膨胀因子(
VIF )判断解释变量间的线性关系(即共线性程度), 若
VIF 超过20证明共线性严重, 超过10证明存在共线性问题, 需要剔除存在共线性关系的变量, 剔除共线性变量后剩余NO
3 - -N、NH
4 + -N、DOC含量及C:N 4个解释变量.之后再通过RDA分析NO
3 - -N、NH
4 + -N、DOC含量及C:N和酶活性及计量比的关系.SMA、PCA、RDA及
VIF 计算分别基于R语言中的smatr (
Warton et al ., 2012 )、vegan和packfor程序包(
Borcard et al ., 2011 )完成.其余统计分析在SPSS 18.0中完成. ...
Enzyme activities and microbial communities in subtropical forest soil aggregates to ammonium and nitrate-?nitrogen additions
3
2017
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
... 取样季节也显著影响了酶C:N (
表2 ), 这主要是因为季节显著影响了BG酶活性, 其中4月份显著大于7月份(
p < 0.05)(
图1 ,
图3 ), 说明相对于7月份, 4月份根际土壤活性C相对不足.从lg(BG)与lg(NAG+LAP)的SMA分析中也可以看出, 与7月份比较, 4月份C酶活性相对更高, 说明相对于N酶, 4月份微生物倾向于分配更多资源合成C酶(
Allison et al ., 2011 ).一方面, 与酶本身的性质、土壤温度和含水量等有关(
Shukla & Varma, 2011 ).大部分酶为蛋白质, 其活性受温度直接影响.此外, 温度会通过影响土壤水热条件, 影响土壤微生物, 间接影响酶的活性(
刘捷豹等, 2017 ).
McDaniel等(2013) 通过模拟增温实验发现, 增温后BG酶活性显著下降.土壤水分则通过改变底物和抑制物的扩散速率影响酶的活性(
Toberman et al ., 2008 ).本研究区4月份平均气温为13.7 ℃, 降水量为86.0 mm; 7月份平均气温23.7 ℃, 降水量为219.4 mm, 取样季节的气温、湿度明显不同.另一方面, 可能与不同季节植被生长环境状况有关.本研究发现根际土壤NH
4 + -N受取样季节影响显著(
表3 ).7月份根际土NH
4 + -N平均含量为9.28 mg·kg
-1 , 显著低于4月(平均30.80 mg·kg
-1 ).研究发现土壤NH
4 + -N含量增加可以提高BG酶活性(
Wei et al ., 2017 ).此外, 7月是植物生长的旺盛时期, 根系分泌物分泌速率较高(
Kuzyakov, 2002 ), 虽然多因素方差分析显示DOC含量的季节差异未达到显著水平(
表3 ), 但是我们的结果中根际土壤DOC含量在7月份平均含量为103.7 mg·kg
-1 , 高于4月份的平均含量84.4 mg·kg
-1 , 进一步验证了该结果.虽然本研究仅在植被生长初期的4月份和植被生长旺盛期的7月份进行了两次取样, 但本研究严格控制样品的采集、保存和处理过程, 获得的数据具有一定的代表性, 因此4月份和7月份酶的活性及计量比的差异在一定程度上反映了取样季节的效应.在后续的研究中会考虑多次采样, 使季节变化更具有说服力. ...
江西省第一代人工杉木林土壤退化的研究
2
1994
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
... ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
江西省第一代人工杉木林土壤退化的研究
2
1994
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
... ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
七株外生菌根真菌与三种松苗菌根的形成能力
1
2006
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
七株外生菌根真菌与三种松苗菌根的形成能力
1
2006
... 已有研究证明乔木可以通过根系分泌物、凋落物等方式影响样地土壤性质(
吴蔚东等, 1994 ), 进而影响土壤微生物及酶活性(
胡亚林等, 2005 ;
鲁顺保等, 2011 ).
Chen等(2018) 研究发现, 森林类型显著影响了土壤酶化学计量特征.本研究中, 杉木林林下植被酶活性及计量比与马尾松林及湿地松林差异较为显著(
图4 ), 具体表现为林分类型边缘显著(
p = 0.061)影响了林下植被根际土壤BG活性, 进而显著影响了根际土壤酶C:N (
表2 ).一方面, 人工林内乔木庞大的根系系统影响了林下植被根际土壤NH
4 + -N养分状况(
表3 ), 影响了根际土壤BG活性(
Wei et al ., 2017 ).另一方面, 杉木为丛枝菌根植物(
苏琍英等, 1992 ), 而湿地松和马尾松属于外生菌根植物(
吴小芹和孙民琴, 2006 ), 这导致其土壤养分循环存在显著差异(
Phillips & Fahey, 2006 ;
Lin et al ., 2017 ).再者可能是因为杉木养分归还相比其他两种人工林差, 导致土壤养分条件更差.
吴蔚东等(1994) 发现杉木林枯枝落叶较少, 对土壤归还少.
莫雪丽等(2018) 也发现杉木林下凋落物的量显著低于湿地松林. ...
森林土壤酶的研究进展
1
2004
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
森林土壤酶的研究进展
1
2004
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
凋落物和林下植被对杉木林土壤碳氮水解酶活性的影响机制
3
2016
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
凋落物和林下植被对杉木林土壤碳氮水解酶活性的影响机制
3
2016
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
... 本研究9个土壤理化性质贡献率共30.9%, 去除共线性后筛选出的NO
3 - -N、NH
4 + -N、DOC含量和C:N 4个土壤理化因素解释率仍达到了25.9% (
图5 ), 说明了这4个因素对土壤酶活性及计量比的重要作用, 证明了基质有效性对林下植被根际土壤酶活性化学计量特征的重要影响.大量研究发现非生物因素对土壤酶活性的影响显著, 贡献率大于生物因素, 达到35%左右(
Kivlin & Treseder, 2014 ;
Peng & Wang, 2016 ).研究表明, 土壤碳和养分可能是通过土壤中可利用基质的浓度和C、N、P的化学计量来影响胞外酶活性(
Kivlin & Treseder, 2014 ).DOC作为微生物的重要碳源, 可以增加微生物数量及活性(
孙悦等, 2014 ), 从而提高胞外酶活性(
杨洋等, 2016 ).Bengtson等(2012)研究发现, 低浓度可利用性N可以促进微生物分泌胞外酶, 而酶活性的提高可以分解有机质释放更多无机N (
孙悦等, 2014 ), 这可能是NH
4 + -N与酶活性呈正相关关系的原因.但是NO
3 - -N的增加可能抑制了某些种类的微生物数量从而导致BG等酶活性降低(
DeForest et al ., 2004 ).非生物因素可以直接影响酶活性, 也可以通过影响土壤微生物, 间接影响土壤酶活性(
刘捷豹等, 2017 ).土壤微生物是胞外酶的生产者之一(
Burns, 1978 ), 对养分的需求与酶生态化学计量比密切相关(
Allison et al ., 2011 ).
Kivlin和Treseder (2014) 研究发现真菌群落组成对土壤酶活性贡献率达到27.4%.
Peng和Wang (2016) 发现0-20 cm土层微生物因素贡献率为5.9%-14.1%.考虑微生物群落等相关指标可能会更准确地解释酶的活性及计量比变异特征, 有关微生物群落与酶的活性及计量比的关系有待于进一步试验验证.此外, 还有很多未知因素影响酶活性(
Peng & Wang, 2016 ), 而未知影响因素很可能来自植物根系.研究发现植物根系可以直接分泌土壤胞外酶(
Burns, 1978 ), 改变养分循环(
Cheng et al ., 2003 ), 且根系及其分泌物是造成不同植物根际土壤理化性质差异的主要原因(
Phillips & Fahey, 2008 ), 可以间接影响微生物群落和土壤酶活性(
Bird et al ., 2011 ).如
Cui等(2018) 研究发现根际土壤的酶活性受地上植被的影响较大.因此, 对植物的根系形态结构、根系分泌物数量及成分的研究, 可以从机理上揭示植物对根际土壤酶活性的直接影响, 进一步阐明不同植物根际土壤酶活性差异的原因, 在今后的试验中需要重点考虑. ...
Understory vegetation plays the key role in sustaining soil microbial biomass and extracellular enzyme activities
2
2018
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
... ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
Root-induced changes in nutrient cycling in forests depend on exudation rates
1
2014
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
中亚热带不同母质和森林类型土壤生态酶化学计量特征
4
2018
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
... ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
中亚热带不同母质和森林类型土壤生态酶化学计量特征
4
2018
... 近年来, 随着生态化学计量研究的深入, 酶的生态化学计量, 即与元素循环相关的酶活性之间的比值日益受到科学家们的重视(
Sinsabaugh et al ., 2009 ;
Hill et al ., 2010 ;
Sinsabaugh & Follstad Shah, 2012 ;
Waring et al ., 2014 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ;
Cui et al ., 2018 ).酶的生态化学计量比可以更好地反映微生物的代谢和营养需求之间的生化平衡(
Sterner & Elser, 2002 ;
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ), 是衡量土壤微生物能量和养分资源限制状况, 揭示土壤养分循环的重要指标(
张星星等, 2018 ).目前, 关于酶化学计量比的研究多以参与碳(C)循环的β-1,4-葡萄糖苷酶(β-1,4-glucosidase, BG), 参与氮(N)循环的β-1,4-N-乙酰葡糖氨糖苷酶(β-1,4-N-acetylglucosaminidase, NAG)和亮氨酸氨基肽酶(leucine aminopeptidase, LAP)以及参与磷(P)循环的酸性磷酸酶(acid phosphatase, AP)为对象, 以BG活性表示C元素获得相关的酶活性, NAG与LAP活性之和代表N元素获得相关的酶活性, AP活性代表P元素获得相关的酶活性(
Sinsabaugh et al ., 2009 ;
Sinsabaugh & Follstad Shah, 2012 ;
Tapia-Torres et al ., 2015 ;
Peng & Wang, 2016 ;
Chen et al ., 2018 ).研究发现, 在全球尺度上, 参与C、N、P循环的相关的土壤酶的化学计量比, 即lnBG:ln(NAG+LAP):lnAP (酶C:N:P)近似为1:1:1, 意味着在全球尺度上土壤酶C:N:P相对稳定(
Sinsabaugh et al ., 2008 ).然而, 在局域尺度上, 受基质有效性、环境和生物等因素影响, 酶化学计量比存在显著差异(
Sinsabaugh et al ., 2009 ).
Chen等(2018) .在我国亚热带喀斯特地区的研究发现, 喀斯特森林与非喀斯特森林土壤酶的计量比存在显著差异.
Peng和Wang (2016) 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 对中国北方草地土壤C、N和P元素获得酶活性研究发现, 受土壤养分计量比的影响, 酶C:N和酶C:P随着土壤深度增加而降低.
张星星等(2018) 在中亚热带地区的研究也发现, 土壤母质和森林类型均显著影响了土壤酶的化学计量特征.因此, 对不同环境条件下土壤酶计量特征的研究对于准确评估生态系统养分周转状况至关重要. ...
... 然而,
张星星等(2018) 对中亚热带红壤人工林土壤酶活性的研究发现, 砂岩为母质的杉木林和米槠林土壤酶C:P和N:P分别为0.3-0.8和0.4-1.2, 明显高于本研究结果.因为他们的研究中砂岩母质的两林分土壤AP活性为50-150 nmol·g
-1 ·h
-1 , 远低于本研究(2 786-12 545 nmol·g
-1 ·h
-1 ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
... ), 说明本研究中土壤P限制更为严重.由于
张星星等(2018) 的研究区域与本研究区气候、土壤母质和植被类型相近, 所以酶活性计量比之间的差异可能主要来源于土壤差异.本研究中所取土壤为林下植被的根际土壤, 而他们的研究对象为全土.
Cui等(2018) 也发现根际土壤酶活性化学计量比明显不同于全土.
Gianfreda (2015) 也证明AP活性在根际土壤中更大.大量研究发现根际土壤与全土土壤理化性质存在显著差异, 一般表现为根际土壤养分、微生物量、微生物活性及酶活性等大于全土土壤(
Phillips & Fahey, 2008 ;
Dai et al ., 2018 ).由于根际根系分泌物主要为葡萄糖等碳水化合物(
Kuzyakov, 2002 ), 同时根际土壤中大量植物根系和土壤微生物对营养元素的吸收利用, 往往导致根际土壤C相对过剩, 其他元素相对受限(
李博, 2000 ). ...
土壤水解酶类催化动力学研究进展
1
2003
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
土壤水解酶类催化动力学研究进展
1
2003
... 土壤胞外酶主要来自土壤中动植物、微生物活动及其残体的分解物(
Burns, 1978 ), 在生态系统的物质循环和能量流动中起着重要作用(
杨万勤和王开运, 2004 ;
林娜等, 2010 ;
刘善江等, 2011 ).水解酶是一类极为重要的胞外酶, 它可以催化土壤中的高分子和其他难利用的物质水解为植物、微生物可利用的营养物质(
张玉兰等, 2003 ;
郭志明等, 2017 ), 在物质循环和能量流动中的作用不容忽视.近百年来, 国内外土壤学家、生态学家、农学家等针对不同生态系统的土壤水解酶活性开展了大量的研究(
Nannipieri et al ., 2018 ), 发现研究区域、生态系统类型、植被类型及取样季节等均显著影响了土壤酶活性, 究其原因主要是土壤可利用养分等环境因素的差异(
陶宝先等, 2010 ;
Gianfreda, 2015 ;
刘捷豹等, 2017 ), 一方面因为酶的表达受环境信号的制约; 另一方面因为酶从细胞分泌出来后其活性也受环境因素影响(
Sinsabaugh & Follstad Shah, 2012 ). ...
Effects of understory removal and nitrogen fertilization on soil microbial communities in Eucalyptus plantations
1
2013
... 亚热带人工林是我国森林的重要组成部分.截至2013年, 南方地区人工林面积已占全国森林总面积的22.4%, 占全国人工林总面积的67.2% (
国家林业局, 2014 ), 其中杉木(
Cunninghamia lanceolata )、马尾松(
Pinus massoniana )和湿地松(
Pinus elliottii )是亚热带地区主要造林树种.林下植被是人工林生态系统的重要组成部分, 在稳定森林生产力、维持生态系统稳定性方面的作用不容忽视(
林贵刚等, 2012 ;
Zhao et al ., 2013 ;
Fu et al ., 2015 ;
贺同鑫等, 2015 ;
Yang et al ., 2018 ).研究发现, 林下植被养分及生物量周转速度快, 其地上部分生物量周转率是乔木层的6-17倍(
杜忠等, 2016 ).关于林下植被对土壤的理化性质、微生物群落等的影响已开展了大量研究(
Fu et al ., 2015 ;
莫雪丽等, 2018 ), 也有研究者就林下植被对土壤酶活性的影响开展了相关研究(
黄玉梅等, 2014 ;
杨洋等, 2016 ;
Yang et al ., 2018) , 但关于林下植被根际土壤酶的化学计量特征的研究仍未见报道.我们前期研究发现不同林下植被根际土壤养分及其计量比存在显著差异(
Dai et al ., 2018 ;
莫雪丽等, 2018 ).因此, 我们假设: (1)不同林下植被根际土壤酶的化学计量比存在差异; (2)林下植被根际土壤酶化学计量特征主要由基质有效性决定. ...
云南热带、亚热带蕨类植物根际土壤中的VA菌根真菌
1
1998
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
云南热带、亚热带蕨类植物根际土壤中的VA菌根真菌
1
1998
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
蕨类植物的VA菌根
1
1998
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
蕨类植物的VA菌根
1
1998
... 根际是土壤中根系周边狭小的区域(
Kuzyakov & Xu, 2013 ), 因此受根系生理活动的影响更大.一般根系通过主动或被动释放可溶性、低分子量的有机化合物(即根系分泌物), 如糖、氨基酸和有机酸到根际, 影响根际环境(
Phillips et al ., 2008 ).研究发现, 不同植被根际根系分泌物速率(
Sun et al ., 2017 )、土壤养分状况等有所不同(
莫雪丽等, 2018 ), 必然影响根际土壤酶的活性及计量比.本研究发现林下植被类型显著影响了BG和NAG+LAP活性, 对AP没有显著影响, 进而显著影响了酶C:P (
表2 ).一方面, 根际土壤DOC状况显著影响土壤酶活性及计量比(
图5 ).因为根系分泌物主要为含碳化合物(
Kuzyakov, 2002 ), 不同植物的根系分泌物速率和成分不同, 导致其根际DOC状况存在明显差异(
表3 ).如外生菌根树种以根系渗出物或其他沉积物的形式输入到根际的碳是丛枝菌根树种的2-3倍(
Yin et al ., 2014 ).土壤DOC含量的提高为微生物提供了更多底物, 增加了土壤酶活性(
杨洋等, 2016 ).另一方面, 不同植被养分吸收速率不同, 导致根际土壤NH
4 + -N及NO
3 - -N含量差异显著(
表3 ), 显著影响了酶的活性及计量比(
图5 ).林下植被可以通过根际活动, 影响根际土壤NH
4 + -N、NO
3 - -N含量(
Phillips & Fahey, 2008 ;
莫雪丽等, 2018 ).
段雷等(2002) 发现不同生态系统及不同类型植被对N及阳离子吸收速率不同.同一群落中不同物种为减少竞争实现共存, 对不同形态的同种养分的吸收速率往往也存在差异(
McKane et al ., 2002 ).如
李常诚等(2016) 发现相对于NO
3 - -N和甘氨酸, 杉木林更偏好吸收NH
4 + -N.
Wei等(2017) 对中亚热带森林土壤添加NH
4 + -N, 发现全土中BG及NAG活性提高, 也证明了NH
4 + -N在中亚热带森林中对酶活性有重要影响.
DeForest等(2004) 发现添加NO
3 - -N降低了土壤表层微生物生物量并抑制了BG等酶的活性, 与本研究结果一致.本研究还发现根际土壤C:N也受林下植被的显著影响(
表3 ), 进而影响了酶活性及计量比(
图5 ).
鲁顺保等(2011) 也发现C:N对酶活性有重要影响.再者, 外生菌根及菌丝也有合成胞外酶的能力(
Phillips & Fahey, 2006 ).本研究中, 檵木根际土壤酶活性及计量比显著高于其他植被(
图1 ,
图2 ,
图4 ), 可能因为檵木是外生菌根植物, 而杨桐、格药柃、狗脊蕨和暗鳞鳞毛蕨均为丛枝菌根或无丛枝菌根植物(
苏琍英等, 1992 ;
赵之伟, 1998a ,
1998b ).此外, 同为内生菌根树种, 格药柃根际土壤酶活性及计量比明显不同于杨桐、狗脊蕨和暗鳞鳞毛蕨, 可能是由于格药柃根系本身特性导致其根际土壤理化性质较其他物种差, 进而影响了微生物活性及酶活性, 具体机制有待进一步研究. ...
 ,1,2,3,*, 王建雷1, 付晓莉1,2,3, 寇亮1,2,3, 王辉民1,2,3,41
,1,2,3,*, 王建雷1, 付晓莉1,2,3, 寇亮1,2,3, 王辉民1,2,3,41  ,1,2,3,*, Jian-Lei WANG1, Xiao-Li FU1,2,3, Liang KOU1,2,3, Hui-Min WANG1,2,3,41
,1,2,3,*, Jian-Lei WANG1, Xiao-Li FU1,2,3, Liang KOU1,2,3, Hui-Min WANG1,2,3,41 
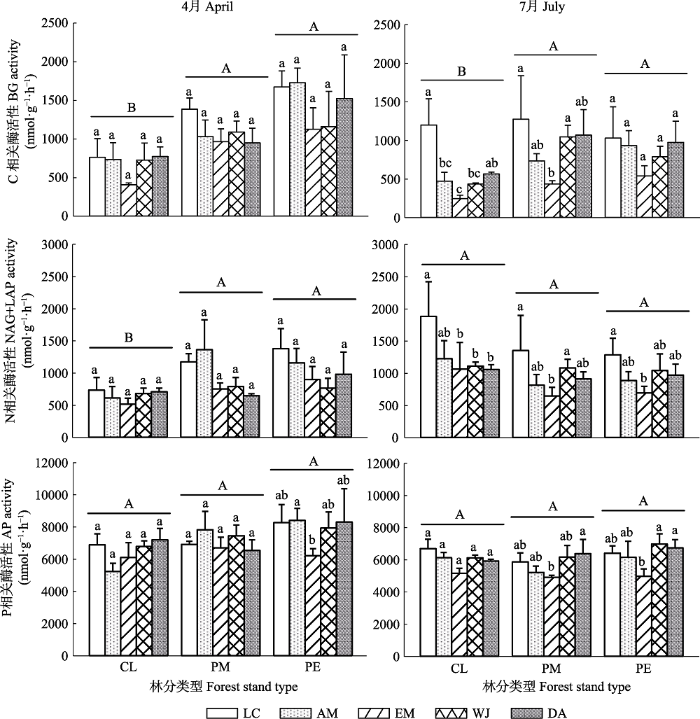 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT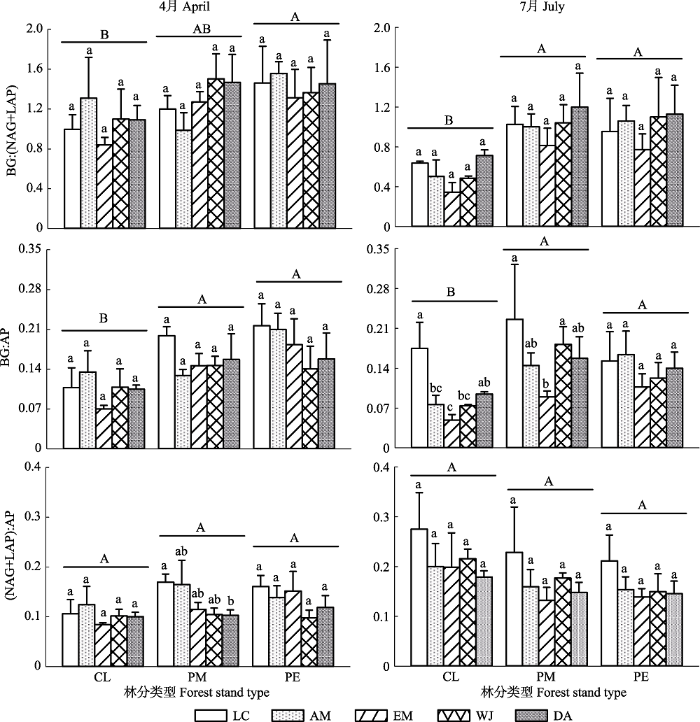 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT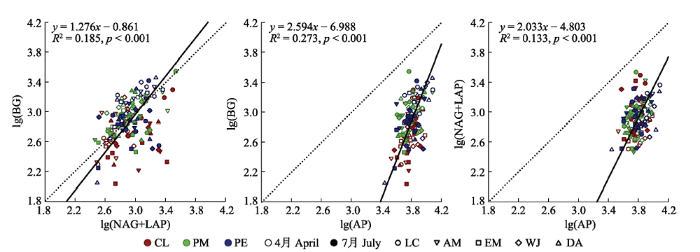 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT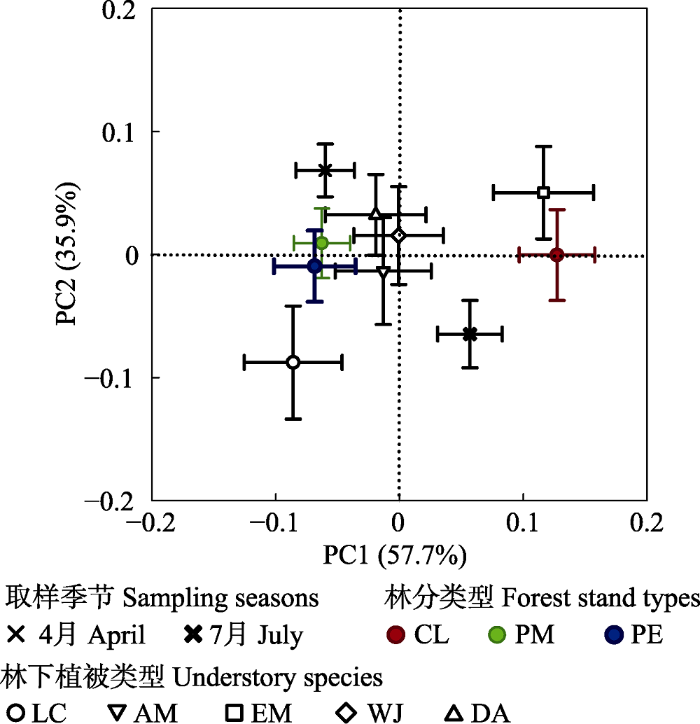 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT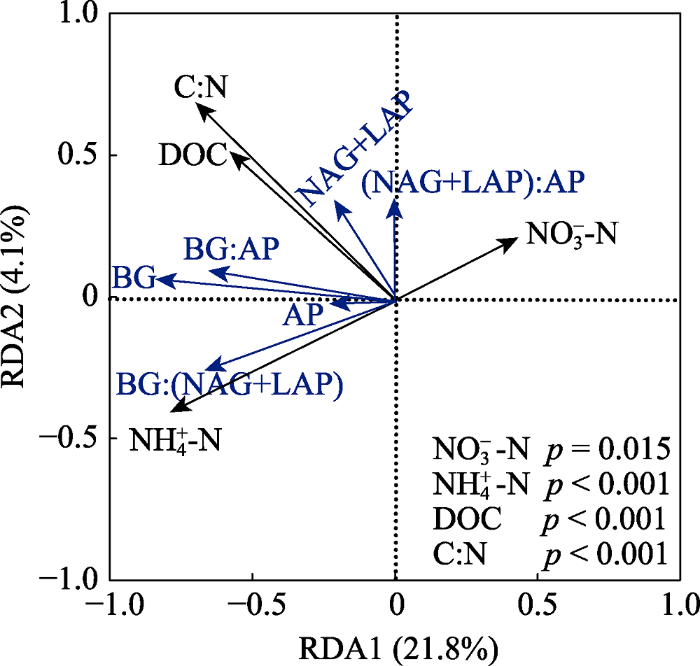 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT


