0 引言
【研究意义】核盘菌(Sclerotinia sclerotiorum)是一种世界范围内分布的病原真菌,能侵染400多种植物[1,2,3],给农业生产造成巨大的经济损失。一般认为核盘菌是典型的死体营养型病原菌,其通过产生细胞壁降解酶和草酸杀死寄主植物从而获取营养[4,5,6,7]。但最近的研究表明,核盘菌在侵染寄主早期阶段存在短暂的活体营养阶段,其与寄主之间的相互作用比之前认为的更为复杂[7,8,9],对其致病机理有待于进一步深入解析。脯氨酸具有高度水溶性和两亲性,在细胞代谢、生物抗逆等过程中发挥至关重要的作用[10]。解析脯氨酸合成相关基因在核盘菌生长发育及致病过程中的作用,对揭示其抵御逆境和致病的分子机理并进一步探索菌核病的绿色高效防控技术具有重要意义。【前人研究进展】当生物遭受干旱、低温和高盐等逆境时,细胞会发生渗透胁迫,为适应逆境,生物通常会在短时间内积累一些小分子渗透调节物质,如脯氨酸、甜菜碱等,以此增强对渗透胁迫的抵抗能力,维持膜完整性[11,12]。在哺乳动物中,脯氨酸被发现广泛参与蛋白质的合成、结构和代谢,在伤口愈合、抗氧化反应及免疫反应中发挥作用[13]。在植物中,脯氨酸除了作为渗透调节物质外,还是一种抗氧化剂、生长发育信号和分子伴侣[14]。NANJO等[15]研究发现,抑制拟南芥中脯氨酸脱氢酶的表达,转基因植株中脯氨酸水平升高,对寒冷、高盐的耐受性增强;SZÉKELY等[16]敲除了拟南芥脯氨酸合成的Δ-1-吡咯啉-5-羧酸合成酶(P5CS)的两个编码基因P5CS1和P5CS2,发现P5CS1的敲除突变导致胁迫诱导的脯氨酸合成减少、对盐胁迫具超敏感性和活性氧积累,P5CS2的缺失则导致种子发育后期的胚胎败育。在真菌中,TAKAGI[17]通过破坏酿酒酵母(Saccharomyces cerevisiae)中参与脯氨酸降解的PUT1和过量表达编码γ-谷氨酸激酶的PRO1来增强脯氨酸的合成,发现酵母菌株表现出对冷冻、干旱、氧化等耐受性的提高;CHEN等[18]发现刺盘孢菌(Colletotrichum trifolii)显性激活的Ras(dominant activated Ras,DARas)突变体菌株表现出菌丝形态和发育异常以及凋亡样细胞死亡,而添加脯氨酸的突变体则恢复了野生型表型,细胞内ROS被清除且细胞凋亡受到抑制。此外,脯氨酸还与真菌的生长发育密切相关,杨佳文等[19]研究发现在培养基中添加脯氨酸可以显著促进大豆炭疽菌(Colletotrichum truncatum)产生分生孢子。脯氨酸合成是生物体内脯氨酸大量累积的重要前提,真菌中脯氨酸的合成与细菌中脯氨酸的合成途径大致相同[17]。在细菌和酵母中,谷氨酸在谷氨酰激酶的作用下,生成谷氨酰磷酸,谷氨酰磷酸很不稳定,在γ-谷氨酰磷酸还原酶(或谷氨酸-5-半醛脱氢酶)的催化下,很快生成谷氨酸半醛,谷氨酸半醛自发环化成吡咯琳-5-羧酸,后者最终被吡咯琳-5-羧酸还原酶还原成脯氨酸[20,21,22,23]。【本研究切入点】核盘菌在侵染寄主早期存在短暂的活体阶段,在该阶段病原菌会面临着因寄主植物防御反应而造成的逆境,如活性氧爆发等[24,25]。已有研究表明脯氨酸能影响真菌的形态建成和发育,增强其对氧化等胁迫的耐受性。目前为止,脯氨酸合成相关基因是否参与核盘菌的致病过程还不清楚。本研究前期利用RNA-seq技术构建了核盘菌侵染时期的表达谱,发现基因SS1G_08171在侵染寄主初期表达量显著升高,保守结构域分析发现其含有γ-谷氨酰磷酸还原酶(gamma-glutamyl phosphate reductase,GPR)结构域,同源性比对发现其编码的蛋白与多种真菌中的γ-谷氨酰磷酸还原酶高度同源,故将其命名为SsGPR1,到目前为止关于SsGPR1的特性和功能还不清楚。【拟解决的关键问题】通过基因沉默的方式对SsGPR1进行研究,为深入揭示核盘菌的生长发育和致病机理打下基础,并为菌核病的绿色防控提供理论依据。1 材料与方法
试验于2014—2017年在西南大学真菌病害研究实验室完成。1.1 试验材料
供试菌株为核盘菌野生型菌株1980,置于PDA培养基斜面中4℃条件下保存,20℃培养箱中培养。RNA提取采用天根生化科技(北京)有限公司TRNzol总RNA提取试剂。反转录采用Thermo Scientific公司ReventAidTM First Strand cDNA Synthesis Kit,荧光定量PCR采用TOYOBO公司THUNDERBIRD SYBR qPCR Mix。DNA纯化采用天根(同上)通用型DNA纯化回收试剂盒。质粒提取采用天根(同上)质粒小提试剂盒。PCR引物(表1)由生工生物工程(上海)股份有限公司合成。
Table 1
表1
表1本研究所用引物
Table 1Primers used in this study
| 引物Primer | 序列Sequence (5′→3′) |
|---|---|
| RT-Tubfp | GTGAGGCTGAGGGCTGTGA |
| RT-Tubrp | CCTTTGGCGATGGGACG |
| RT-Gpr1fp | TGCGTCTCACATTCTGGCTAC |
| RT-Gpr1rp | AAGCTCAAACGACCACCCTC |
| SiGPR1fp | CGCGGATCCATCGATACACGACTTGACGATGGTCT |
| SiGPR1rp | CGCCTGCAGAAGCTTTGTTGCATGCTGCTGGATA |
新窗口打开
1.2 SsGPR1生物信息学分析
通过NCBI网站检索获得核盘菌SsGPR1基因序列(SS1G_08171,登录号:EDN92308.1)及编码蛋白序列(登录号:XP_001590431.1),蛋白同源性比对采用BLASTp在线软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi),氨基酸结构域分析采用NCBI Conserved Domain Database在线软件(https://www.ncbi.nlm.nih.gov),采用MEGA 5.0软件按照邻近相似法构建蛋白系统发育树。1.3 SsGPR1表达分析
将活化好的核盘菌野生型菌株接种到铺有灭菌玻璃纸的PDA平板上,倒置于20℃培养箱培养,分别收集菌丝生长时期、菌核形成初期、菌核发育时期和菌核成熟时期的样品;将经过一段时间低温处理的菌核埋入高温灭菌的河沙中,16℃诱导萌发并收集菌核萌发时期样品。同时将野生型菌株置于铺有玻璃纸的PDA培养基中培养2 d,研钵磨碎收集的新鲜菌丝,利用喷壶喷施拟南芥叶片,分别收集0、3、6、9和12 h的叶片。利用TRIzol总RNA提取试剂提取样品总RNA,ReventAidTM First Strand cDNA Synthesis Kit反转录试剂盒合成cDNA第一链。根据核盘菌SsGPR1的mRNA序列,设计实时荧光PCR引物RT-Gpr1fp和RT-Gpr1rp(表1),以合成的cDNA为模板,核盘菌β-tubulin(SS1G_04652)为内参[26],进行实时荧光RT-PCR扩增,试验重复3次。扩增反应体系:2×SYBR Green real-time PCR Master Mix 10 μL,正/反向引物各0.2 μmol·L-1,cDNA模板50 ng,总体积20 μL。反应程序:95℃ 2 min(1个循环);95℃ 20 s,56℃ 15 s,72℃ 20 s(40个循环)。
1.4 SsGPR1基因沉默载体的构建
为构建基因沉默载体,以核盘菌cDNA为模板,根据SsGPR1基因序列设计引物SiGPR1fp和SiGPR1rp(表1)进行扩增。PCR反应体系:10×Taq Buffer 5 μL,SiGPR1fp、SiGPR1rp引物各1 μL,Taq酶0.5 μL,cDNA模板1 μL,无菌水37.5 μL,总体积50 μL。PCR反应程序:预变性 95℃ 3 min;变性95℃ 30 s;退火55℃ 40 s;延伸72℃ 30 s;32个循环;终延伸72℃ 10 min。将上述PCR产物用ClaⅠ、Hind Ⅲ双酶切,回收后连接到相同酶切的pCIT载体[27]上,双酶切检测连接成功的质粒命名为pCIT1;采用同样方法用PstⅠ、Bam HⅠ双酶切上述PCR产物,将所得片段连接至相同酶切的pCIT1载体上,将连接成功后的质粒命名为pCIT2;将潮霉素磷酸转移酶基因片段连接到pCIT2的XbaⅠ酶切位点上,最终的载体命名为pSIGPR1。
1.5 SsGPR1基因沉默转化子的获取
按照文献[24]的方法制备原生质体,将pSIGPR1质粒通过PEG介导转化核盘菌野生型菌株原生质体。将挑出的转化子连续培养3代后,提取各转化子总RNA,用ReventAidTM First Strand cDNA Synthesis Kit合成cDNA第一链。以合成的cDNA为模板,以β-tubulin为内参基因进行实时荧光RT-PCR扩增,试验重复3次,扩增反应体系同前。1.6 SsGPR1基因沉默转化子形态特征观察
将菌株于PDA培养基上活化后打取直径为6 mm的菌丝块接种至PDA平板中央,20℃培养24 h后于光学显微镜下观察菌丝尖端,每个转化子3次重复,每隔12 h以十字交叉法测定菌落直径并计算菌丝生长速度。同样打取直径为6 mm的菌丝块接种至PDA平板中央,每个转化子重复3次,将平板倒置于20℃培养箱中培养30 d后,收集菌核于室温下晾干,称取菌核质量并记录菌核数量。将收集的菌核消毒后半埋于湿润的河沙中,置于16℃条件下诱导萌发,观察并记录菌核的子囊盘萌发表型。
1.7 SsGPR1基因沉默转化子在氧化胁迫下的生长抑制率测定
以野生型菌株为对照,在沉默转化子菌落边缘打取直径6 mm的菌丝块,分别接种至MM培养基和含有5 mmol·L-1 H2O2的MM培养基平板中央,根据十字交叉法每12 h测定菌落直径,计算72 h时菌丝的生长抑制率。1.8 SsGPR1基因沉默转化子的致病力测定
在活化好的野生型及沉默转化子菌落边缘打取直径为6 mm的菌丝块,菌丝面朝下接种到幼嫩的油菜(中油821)叶片靠近主脉的部位,每个叶片接种1个菌丝块,每个菌株3个重复,将接种后的植株在20℃培养箱中保湿培养,24 h后观察并拍照记录叶片发病情况。同时将菌丝块接种于拟南芥(Col-0)叶片上,每株挑取3片不相邻叶片接种,每个转化子接种3株,48 h后观察并拍照记录叶片发病情况。1.9 SsGPR1基因沉默转化子游离脯氨酸含量的测定
参照朱广廉等[28]对植物体内游离脯氨酸测定的方法进行脯氨酸标准曲线的制作,并对核盘菌中的游离脯氨酸进行提取,具体步骤:分别称取野生型及沉默转化子菌丝各0.5 g(每个菌株重复3次以上),置于试管中,向试管中加入5 mL的磺基水杨酸溶液(3%),沸水浴(10 min)后冷却并过滤,得到游离脯氨酸的提取液。分别取2 mL的提取液,加入2 mL冰醋酸和2 mL酸性茚三酮溶液(2.5%),沸水浴30 min,冷却后加入4 mL甲苯,摇荡30 s,吸取上层溶液于离心管中,离心机离心5 min(3 000 r/min)。将离心后的溶液置于比色杯中,以甲苯溶液为空白对照,在520 mm波长处测定吸光度(A)值并计算每克菌丝中相应游离脯氨酸含量。2 结果
2.1 SsGPR1生物信息学分析
SsGPR1开放阅读框全长1 350 bp,编码449个氨基酸。保守结构域分析发现SsGPR1在氨基酸H10-N426(E=0)处含有γ-谷氨酰磷酸还原酶(GPR)结构域。在NCBI数据库上进行蛋白同源比对,发现SsGPR1的同源蛋白存在于许多真菌中,如灰葡萄孢(Botrytis cinerea)、白霉病菌(Sclerotinia borealis)、白色绿僵菌(Metarhizium album)、稻曲病菌(Ustilaginoidea virens)、禾谷镰孢(Fusarium graminearum)等(图1),其中相似性最高的为灰葡萄孢BC1G_13183蛋白(XP001548140.1)和白霉病菌SBOR_2215蛋白(ESZ97387.1),氨基酸序列一致性分别为95%和94%。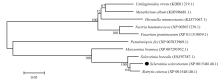 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1SsGPR1蛋白系统发育树黑点表示核盘菌SsGPR1蛋白位置
-->Fig. 1Phylogenetic tree of SsGPR1 protein The black spot indicates the position of S. sclerotiorum SsGPR1 protein
-->
2.2 SsGPR1在核盘菌生长发育和致病时期的表达模式
利用实时荧光RT-PCR检测SsGPR1在核盘菌野生型菌株不同发育阶段的表达,结果如图2所示,SsGPR1在菌丝生长时期的表达量较高,在菌核不同发育阶段表达量相近,但与菌丝生长时期相比,表达量均显著性降低。将野生型菌株接种至拟南芥植株上,并对接种后0、3、6、9 和12 h 的表达量进行分析,如图3所示,该基因在致病过程表达水平不断提高,且在接种9 h后表达量最高。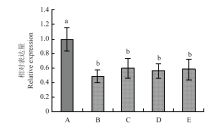 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2SsGPR1在核盘菌生长发育阶段的表达柱上不同小写字母表示差异显著(P<0.05)。下同 A:菌丝时期 Hyphae;B:菌核形成初期Initial sclerotia;C:菌核发育时期 Development sclerotia;D:菌核成熟时期Mature sclerotia;E:菌核萌发时期Germinate sclerotia
-->Fig. 2The expression of SsGPR1 at different development stages of S. sclerotiorum Different lowercases on column mean significantly different (P<0.05). The same as below
-->
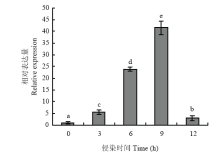 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3SsGPR1在核盘菌致病过程中的表达
-->Fig. 3The expression of SsGPR1 during the infection process of S. sclerotiorum
-->
2.3 SsGPR1基因沉默转化子鉴定
利用PEG介导的原生质体转化方法将pSIGPR1转入到核盘菌野生型菌株中,并利用实时荧光RT-PCR检测不同转化子中SsGPR1的表达水平,结果表明,菌株SiGPR1-104和SiGPR1-149中的表达水平与野生型相比显著下降(图4),故将这两个菌株作为研究对象。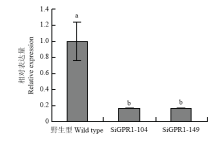 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4SsGPR1基因沉默转化子中SsGPR1的表达
-->Fig. 4The expression of SsGPR1 in different SsGPR1 gene-silenced strains
-->
2.4 SsGPR1基因沉默转化子形态特征
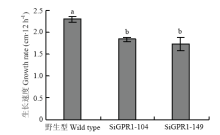
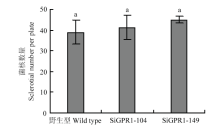
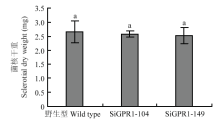
在光学显微镜下分别观察核盘菌野生型菌株、SiGPR1-104和SiGPR1-149的菌丝形态,与野生型菌株相比,SsGPR1基因沉默转化子菌落边缘菌丝较稠密(图5)。对沉默转化子生长速度进行测定,结果表明沉默转化子生长速度显著降低(图6)。在PDA培养基上培养30 d后,SsGPR1基因沉默转化子菌核形成数量(图7)及干重(图8)与野生型菌株无显著性差异。通过在室内诱导菌核萌发表明沉默转化子形成的菌核均能萌发形成子囊盘,表明SsGPR1与菌核形成及萌发无关。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5SsGPR1基因沉默转化子菌丝形态
-->Fig. 5Hyphal morphology of SsGPR1 gene-silenced strains
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6SsGPR1基因沉默转化子生长速度
-->Fig. 6Growth rate of SsGPR1 gene-silenced strains
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7SsGPR1基因沉默转化子菌核数量
-->Fig. 7Sclerotial number of SsGPR1 gene-silenced strains
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图8SsGPR1基因沉默转化子菌核干重
-->Fig. 8Sclerotial dry weight of SsGPR1 gene-silenced strains
-->
2.5 SsGPR1基因沉默转化子在氧化胁迫下的生长
将野生型菌株和SiGPR1-104、SiGPR1-149分别接种于添加了5 mmol·L-1 H2O2的MM培养基中培养,测定其菌落直径并计算菌丝生长抑制率。如图9所示,与野生型菌株相比,沉默转化子在含有H2O2的培养基中菌丝生长受到更强的抑制(图9),表明SsGPR1基因沉默转化子对氧化胁迫更加敏感。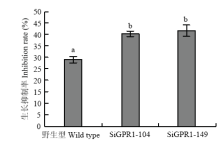 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图9SsGPR1基因沉默转化子在氧化胁迫下的生长抑制率
-->Fig. 9Growth inhibition rate of SsGPR1 gene-silenced strains under oxidative stress
-->
2.6 SsGPR1基因沉默转化子致病力分析
将野生型菌株、SiGPR1-104和SiGPR1-149分别接种到活体拟南芥植株和活体油菜叶片上,结果表明与野生型菌株相比,SiGPR1-104和SiGPR1-149在油菜和拟南芥叶片上致病力减弱(图10),病斑直径显著下降(图11),表明SsGPR1与核盘菌致病力密切相关。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图10SsGPR1基因沉默转化子致病力测定
-->Fig. 10Pathogenicity analysis of SsGPR1 gene-silenced strains
-->
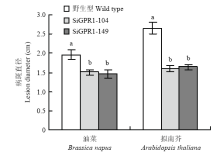 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图11SsGPR1基因沉默转化子病斑直径
-->Fig. 11Lesion diameter of SsGPR1 gene-silenced strains
-->
2.7 SsGPR1基因沉默转化子的游离脯氨酸含量
利用茚三酮法对野生型菌株、SiGPR1-104和SiGPR1-149菌丝中游离脯氨酸含量进行了测定,结果显示SsGPR1基因沉默转化子与野生型菌株菌丝中的游离脯氨酸含量无显著差异(图12),均在0.175—0.178 μg·g-1,表明SsGPR1与核盘菌游离脯氨酸的含量无关。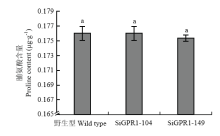 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图12SsGPR1基因沉默转化子游离脯氨酸含量
-->Fig. 12Content of proline produced by SsGPR1 gene-silenced strains
-->
3 讨论
本研究发现核盘菌基因SsGPR1编码一个γ-谷氨酰磷酸还原酶同源蛋白,该基因在核盘菌菌丝生长时期及致病初期表达显著上调,SsGPR1基因沉默转化子生长速度降低,菌丝稠密,致病力下降以及对氧化胁迫更加敏感,但菌核形成及萌发表现正常。由于γ-谷氨酰磷酸还原酶催化脯氨酸生物合成的第二步[12,13,14,15],为明确SsGPR1在核盘菌脯氨酸合成中的作用,本研究比较了野生型菌株和SsGPR1基因沉默菌株之间的脯氨酸积累量,结果却表明在SsGPR1基因沉默菌株的脯氨酸含量与野生型菌株并无显著差异。唐亮[29]研究酿酒酵母谷胱甘肽(GSH)合成途径时发现,除γ-谷氨酰半胱氨酸合成酶(Gsh1)和谷胱甘肽合成酶(Gsh2)两个合成途径外,还存在一条谷胱甘肽合成的替代途径,即通过参与脯氨酸生物合成的第一个功能蛋白酶γ-谷氨酰激酶(GK)的功能来实现对Gsh1的替代作用,是谷胱甘肽合成的第3条途径。笔者推测,当SsGPR1基因沉默导致脯氨酸合成受到抑制时,该替代途径可能向脯氨酸合成偏移,从而弥补脯氨酸的合成,使脯氨酸的合成相对稳定,而谷胱甘肽的合成是否会产生影响有待于进一步研究。
SsGPR1在致病初期表达量逐步升高,且基因沉默菌株在油菜和拟南芥上的致病力显著下降,表明SsGPR1参与调控了核盘菌的致病性,但对于其作用机理仍不清楚。核盘菌在侵染初期会激发寄主植物的活性氧爆发,而活性氧能帮助寄主抵御病原菌的侵入[25,30],XU等[24]通过T-DNA插入突变发现核盘菌超氧化物歧化酶基因SsSOD1与病原菌抵抗氧化压力和致病力密切相关;YU等[31]将核盘菌Bax抑制子基因Ss-Bi1沉默后发现,基因沉默转化子对活性氧更加敏感,且致病力显著下降。这些研究均表明,核盘菌抵御氧化胁迫的能力与其致病性有着密切联系,本研究发现SsGPR1基因沉默菌株对于氧化胁迫更加敏感,推测SsGPR1基因沉默菌株致病力减弱与其抵御活性氧能力下降有关,而后者可能受到谷胱甘肽含量变化的影响,谷胱甘肽具备抗氧化的特点,作为重要的抗氧化剂和自由基清除剂[32,33],在核盘菌侵染过程中,谷胱甘肽可以帮助抵御植物活性氧迸发,从而有利于其侵染[34]。
4 结论
核盘菌基因SsGPR1编码一个γ-谷氨酰磷酸还原酶同源蛋白,该基因与核盘菌菌丝形态和生长密切相关,且参与病原菌氧化胁迫和致病过程。(责任编辑 岳梅)
The authors have declared that no competing interests exist.
