0 引言
【研究意义】近年来,伴随着集约化畜牧业以及配合饲料工业的发展,抗生素作为疾病防治药物和饲料添加剂被广泛地应用[1],目前我国已成为世界上生产和使用抗生素最多的国家[2,3],也是抗生素滥用问题较多的国家之一[4]。由于约有40%—90%抗生素进入动物体内不能被完全消化吸收,导致大量抗生素随畜禽粪便进入土壤或水体环境[5]。不断被引入农业环境中的兽用抗生素已成为一种“假”持久性化合物,随之不可估量的环境负效应引起了社会广泛关注[6,7]。因而,研究土壤中抗生素残留状况以及添加外源降解微生物对土壤微生物的影响,对土壤抗生素污染原位修复有重要意义。【前人研究进展】综合国内外报道,畜禽粪便中抗生素残留浓度为23—1 420 mg·kg-1[8],土壤中的抗生素残留浓度为0.28—10.51 mg·kg-1[9],植物组织中兽用抗生素检出量最高可达为14 mg·kg-1[10,11]。由于我国畜禽有机粪肥改良耕地推广政策,土壤环境中兽用抗生素残留量已超国外其他国家平均水平[8-9, 12-13],其中大环内酯类和氨基糖苷类作为典型的兽用抗生素存在于土壤环境中,其残留量最高可以达到2.07 mg·kg-1[14]。土壤环境中的残留抗生素除了具有生物可富集性[15,16],还可诱导产生抗生素耐药菌和抗性基因(ARGs)[17,18]。抗性基因可以通过遗传基因原件在各类微生物及环境中传播,存在通过食物链向人体转移的潜在风险[19],抗生素及其抗性基因污染问题亟待解决。土壤细菌是土壤微生物主要组成之一,参与土壤养分循环并维持整个土壤生态系统稳定。土壤细菌数量、分布范围及其群落结构特征和变化规律等是反应土壤细菌群落多样性及其生态功能的重要指标[20]。现有研究表明,外源抗生素会对土壤细菌产生极大的影响。孙英健等[21]发现阿维菌素能够导致土壤中微生物种群数量的降低;姚建华等[7]发现土霉素能够显著降低土壤以及小麦根际的土壤酶活性;而张奇春等[22]发现土壤原有耐药菌能以抗生素为碳源促进生长繁殖。抗生素在抑制其靶标微生物的同时,土壤中其他微生物还可以利用这些抗生素及死亡微生物来获得碳源等进行生长[23]。兽用抗生素在土壤中残留特征及其对微生物多样性影响等的研究已成为环境科学领域的研究热点。【本研究切入点】本研究所选用的庆大霉素(氨基糖苷类)和泰乐菌素(大环内酯类)是我国土壤环境中残留量较大且相对难降解的两种抗生素[24,25,26,27],现有研究仅考察了抗生素对土壤环境细菌多样性的影响,而关于外源抗生素降解菌对土壤细菌多样性影响鲜有报道。【拟解决的关键问题】本研究采用盆栽试验法,借助固相萃取-液质联用检测抗生素技术及Illumina MiSeq高通量测序技术,以庆大霉素和泰乐菌素为研究对象,揭示了外源添加抗生素及相关功能性降解菌(庆大霉素降解菌FZC3和泰乐菌素降解菌无色杆菌)在土壤中残留规律及对细菌多样性影响,以期为今后土壤中抗生素类污染物的高效绿色解决和抗生素污染物土壤修复提供依据。1 材料与方法
1.1 试剂
甲醇、乙腈、正己烷、甲酸(色谱纯,美国Fisher公司);丙酮、柠檬酸、乙酸、磷酸、硫酸、盐酸、氢氧化钠均为分析纯试剂,购于广州试剂公司;氯化钠、磷酸氢二钠、乙二胺二乙酸二钠(EDTA)(国药集团试剂有限公司);葡萄糖、蛋白胨、牛肉膏、琼脂(西陇化工股份有限公司);实验用水为经Milli-Q净化系统(Millipore,Billerica,MA,USA)过滤的超纯水。试验用庆大霉素(Gentamycin,GM,99.99%)由山东只楚药业提供,泰乐菌素来源于北京海格里斯公司(Tylosin,TYL,97.00%)。试验接种的菌剂为本实验室(中国农业科学院资源所中国-新西兰土壤分子生态学联合实验室)筛选的优势降解菌,庆大霉素优势降解真菌土曲霉FZC3和泰乐菌素优势降解细菌无色杆菌。真菌培养基为液体土豆培养基(LPD),细菌培养基为液体牛肉膏蛋白胨培养基(蛋白胨5 g,牛肉膏3 g,氯化钠5 g,蒸馏水1 000 mL,用1 mol·L-1 NaOH调节pH为7.0—7.2后灭菌)。
1.2 材料及仪器
1.2.1 盆栽土壤采集 试验所用土壤为华北地区典型潮土,采自河北省廊坊市中国农业科学院廊坊基地休耕一年表层土,所有供试土壤均采自0—20 cm表层,经自然风干后研磨过5 mm筛备用。土壤理化性质如表1所示,其中pH、电导率、总有机碳和总氮测定方法参考土壤农化分析[28]。Table 1
表1
表1试验用土壤基本理化性质
Table 1Selected properties of soil samples
| 土壤类型Soil type | 酸碱度pH | 电导率EC (μs·cm-1) | 总有机碳TOC (g·kg-1) | 全氮TN (g·kg-1) |
|---|---|---|---|---|
| 潮土 Fluvo-aquic soil | 8.57 | 178.15 | 3.23 | 0.23 |
新窗口打开
1.2.2 仪器及耗材 庆大霉素检测采用Agilent 1260高效液相色谱仪(HPLC, 美国)配置Alltech蒸发光检测器2000(美国),色谱柱采用Waters Atlantis C18色谱柱(250 mm×4.6 mm, 5 μm);泰勒菌素检测采用Agilent 1200型高效液相色谱串联Agilent 6410三重四级杆质谱仪(美国Agilent公司),色谱柱采用Waters Atlantis Sunfire C18色谱柱(150 mm×4.6 mm, 3.5 μm)。LGJ-10D冷冻干燥机(北京四环公司),TL2020球磨仪(北京鼎昊源公司),涡旋仪(德国Wiggens公司),超声波清洗仪(宁波新芝公司),Sigma 3K15高速冷冻离心机(德国Sigma公司),Heidolph 2旋转蒸发仪(德国海道尔夫),十二孔固相萃取装置(美国Supelco公司),PCR扩增仪(Bio rad ALS1296型),Oasis HLB固相萃取柱(6 mL·500mg-1,美国Waters公司)和0.45 μm、0.22 μm针筒式微孔滤膜(天津津腾公司)。盆土采样器型号为TC-601-A2,钻头直径为38 mm。
1.3 试验设计
1.3.1 盆栽试验 本试验于2016年11月中国农业科学院玻璃智能温室中进行。由于培养室气温较低(15—22℃),因此选用北方耐冷蔬菜菠菜—菠菜一号为供试植物。两种外源抗生素添加量为50 mg·kg-1;FZC3每千克土壤中接种量为1×108个孢子数;无色杆菌每千克土壤中接种量为1×109 CFU。共设计7个处理,3次重复,详细见表2。Table 2
表2
表2不同处理名称及其对应添加内容
Table 2The names and the detail supplements of different treatments
| 处理Treatment | 添加的抗生素Spiked antibiotics | 添加的降解菌Spiked degrading-microbe |
|---|---|---|
| CGF | 庆大霉素Gentamycin | 真菌降解菌FZC3 Aspergillus Terreus FZC3 |
| CG | 庆大霉素Gentamycin | 无None |
| CTW | 泰乐菌素Tylosin | 无色杆菌Achromobacter |
| CT | 泰乐菌素TYL | 无None |
| CMM | 庆大霉素+泰乐菌素Gentamycin + Tylosin | FZC3+无色杆菌FZC3+ Achromobacter |
| CM | 庆大霉素+泰乐菌素Gentamycin +Tylosin | 无None |
| CC | 无None | 无None |
新窗口打开
1.3.2 具体实施与样品采集 外源抗生素及外源菌剂添加:培养盆采用长宽高分别为30 cm×15 cm×20 cm黑色亚克力板粘合的箱体,将同处理的风干土平铺于塑料布上,用喷雾器喷洒抗生素标液、液体微生物菌剂,同时不断翻搅,使土壤与抗生素、菌剂充分混匀(为避免其他因素干扰,本次试验未施肥),加水调节土壤湿度为田间持水量的65%,随后分装于3个培养盆中,每盆装土量为8 kg。
菠菜栽种:挑选完整饱满的菠菜种子,放置于70%的酒精中表面消毒30 min,接着用大量超纯水冲洗10 min后置于培养皿中润湿滤纸上,在人工培养箱中避光培养3 d(日温20℃,夜温18℃,湿度为60%),挑选生长均一的菠菜苗移栽于盆土中,每盆中平行定植12株菠菜苗,之后正常浇水,维持土壤湿度为田间持水量的65%。11月的玻璃智能温室中自然日照时长为6.4 h,温室内人工补光12 h(8:00—20:00),日温20—22℃,夜温15—17℃,空气相对湿度为47%—55%,盆土温度一般维持在(15±0.73)℃。冬季菠菜生长周期大约是45—55 d,因而将培养周期按周定为处理后第8周(56 d)。
菠菜样品采收:56 d后将菠菜整株从土壤中分离进行表面清洗,并分为地上和地下部分,避光充分冷冻干燥后研磨过2 mm筛并避光密封保存于-20℃冰箱中,待提取。
土壤样品采集:分别在第0、7、14、28、42和56天进行采样,即在同一盆中随机选取3点利用盆土采样器纵向采集土壤样品(避开菠菜根系范围)并混合均匀,每份样品采样量为(4.5±0.3)g,采集后通过松土及浇水使土壤土层恢复平整。然后将采集的样品放于-80℃超低温冰箱中保存待测。其中第7天和14天取土样1 g进行细菌多样性和群落结构分析。
1.4 抗生素测定方法
土壤中庆大霉素的提取方法为732树脂-氨水法,用液相色谱-蒸发光检测器检测[26],庆大霉素液相方法流动相:0.2 mol·L-1的三氟乙酸/甲醇=92/8(V/V);土壤中泰勒菌素的提取方法为固相萃取EDTA- McIlvaine法,通过液质联用方法进行测定[29],泰乐菌素初始流动相:0.1%甲酸水/乙腈=80:20(V/V)。庆大霉素标准溶液配制:准确称取0.010 g药品,用超纯水定容于100 mL容量瓶中,配置成100 mg·L-1的庆大霉素标准储备溶液。
泰乐菌素标准溶液配制:准确称取0.010 g,加入少量甲醇溶解并定容于100 mL容量瓶中,配制成100 mg·L-1的泰乐菌素标准储备液。标准液(0.1、0.5、1、5、10 mg·L-1)均由储存标样加甲醇稀释配制而成。以上标准储备液均保存于4℃冰箱中。
提取庆大霉素试剂配制。(1)4.5%氨水:量取氨水197.8 mL,用超纯水稀释至1 000 mL,混匀;(2)0.2 mol·L-1的三氟乙酸:量取14.85 mL的三氟乙酸定容于1 L超纯水中。
提取泰乐菌素试剂配制。(1)EDTA-McIlvaine缓冲溶液:准确称取21.0 g柠檬酸和28.4 g无水磷酸氢二钠,分别用超纯水溶解并定容至1 L,制成0.1 mol·L-1柠檬酸溶液以及0.2 mol·L-1磷酸氢二钠溶液,两种溶液按8:5(V/V)比例混合,配制成McIlvaine缓冲液。称取37.2 g EDTA-二钠溶解于1 L McIlvaine溶液中,配得0.1 mol·L-1 EDTA-McIlvaine缓冲液,用HCl或者NaOH调节pH为4.0[30,31,32]。(2)有机混合提取剂:量取一定量的甲醇、乙腈、丙酮按照2:2:1(V/V/V)比例混合配制而成,用H3PO4调节pH为4.0。
1.5 土壤样品总DNA的提取及高通量测序
采用强力土壤DNA提取试剂盒(Omega Bio-tek, Norcross, GA, U.S.),按其操作手册提取土壤样品微生物基因组DNA。本试验扩增PCR反应所采用的引物由北京奥维森基因科技有限公司合成。细菌的引物对为336F(5’-GTACTCCTACGGGAGGCAGCA-3’)和806R(5’-GTGGACTACHVGGGTWTCTAAT-3’),此引物用来扩增细菌16S rDNA的V3-V4区。PCR反应体系总体积均为50 μL。30 ng 所提取样品DNA,10×Pyrobest buffer 5 μL,Pyrobest DNA聚合酶(2.5 U·μL-1)0.3 μL,正反向引物(10 μmol·L-1)各2 μL,dNTP Mix 4 μL,ddH2O 36.7 μL。扩增程序为:95℃预变性5 min;25个普通PCR循环,具体为95℃变性30 s,56℃退火30 s,72℃延伸40 s;循环结束后72℃充分延伸10 min。每组PCR扩增过程中设立一个阴性对照,除不加DNA样品外,其余反应组成相同。
PCR扩增产物用2%琼脂糖凝胶EB染色,在150 V下电泳30 min,用BIO-RAD紫外凝胶成像系统检测,拍照。参照电泳初步定量结果,用Qubit荧光定量系统对PCR产物进行定量检测之后,根据每个样本的测序量要求以及定量结果进行相应比例的混合。样品纯化后送至北京奥维森通过Illumina平台的MiSeq进行测序(CA, USA)。
1.6 数据处理及分析
1.6.1 常规数据分析 土壤中庆大霉素和泰乐菌素的残留率计算公式:R(%)=Ct/C0×100 (1)
式中,R为抗生素的残留率;C0为抗生素起始浓度(mg·kg-1),Ct为时间t时间残留的抗生素浓度(mg·kg-1)。
数据分析采用Excel 2016及SPSS 20软件,图表绘制采用Origin 8.5软件。
1.6.2 高通量测序数据分析 本试验采用Illumina MiSeq平台的双端(Paired-end)测序。首先对测得的下机数据进行基本降噪处理,首先过滤read尾部质量值20以下的碱基和长度50 bp以下的reads,最终获得高质量的reads[33];然后通过FLASH软件将成对的序列拼接成一条序列。要了解一个样品测序结果中的菌种、菌属等数目信息,就需要对序列进行归类操作(cluster)。通过归类操作,将序列按照彼此的相似性分归为许多小组,一个小组就是一个OTU。通过UPARSE 7.1按照97%相似性对序列进行OTU聚类,得到OUT表及去除嵌合体的有效代表序列[34]。最后采用RDP Classifier算法对代表序列进行比对分析,并在各水平(kingdom, phylum, class, order, family, genus, species)注释其群落的物种信息。并利用mothur软件计算细菌群落的丰富度指数Chao1以及多样性指数Shannon,采用SPSS 20.0对数据进行显著性分析[35]。
Chao1指数计算公式:
Schao1=Sobs+ n1(n1-1)/2(n2+1) (2)
式中,Schao1指估计的OTU数,Sobs指实际观测到的OTU数,n1指只含有一条序列的OTU数目,n2指只含有两条序列的OTU数目。
Shannon指数计算公式:
$H_{shannon}=-\sum^{S_{obs}}_{i=1}\frac{n_{i}}{N}ln\frac{n_{i}}{N}$ (3)
式中,Hshannon代表Shannon多样性指数,Sobs指实际观测到的OTU数,ni指每个OUT包含的序列数,N指所有序列之和。
2 结果
2.1 不同处理土壤中抗生素的残留
土壤中庆大霉素浓度随时间的变化情况如表3所示,空白对照组(CC)中始终无庆大霉素检出。由表中可知,第0天(掺药并定植菠菜当天定义为处理第0天)时,各处理组中所检测到的抗生素含量为40.087—40.796 mg·kg-1,加药浓度为50 mg·kg-1,因而掺药及降解菌后潮土中庆大霉素的回收率为80.17%—81.59%,且处理组间无显著差异性。第7—14天时,各处理组中庆大霉素含量之间有显著性差异;第28—56天时,各处理组中庆大霉素含量之间渐无差异。Table 3
表3
表3不同时期不同处理土壤中的庆大霉素的残留浓度(mg·kg-1)
Table 3Residual concentrations of GM (mg·kg-1) in soils with different treatments at different stages
| 处理 Treatment | 第0 天 Day 0 | 第7天 The 7th day | 第14天 The 14th day | 第28天 The 28th day | 第42天 The 42th day | 第56天 The 56th day |
|---|---|---|---|---|---|---|
| CGF | 40.087±0.462a | 22.488±0.064c | 7.873±0.260c | 2.568±0.009c | 1.527±0.027b | 0.580±0.013b |
| CG | 40.796±0.447a | 24.204±0.136a | 8.958±0.043b | 3.708±0.079b | 1.684±0.019b | 0.762±0.015b |
| CMM | 40.143±0.510a | 21.647±0.437d | 8.223±0.040bc | 3.122±0.064b | 1.853±0.047b | 0.597±0.014b |
| CM | 40.521±1.000a | 23.130±0.165b | 11.342±0.249a | 4.068±0.0464a | 2.671±0.015a | 1.736±0.012a |
| CC | 0 | 0 | 0 | 0 | 0 | 0 |
新窗口打开
不同时期各处理土壤中庆大霉素的残留情况如图1所示。以0 d各处理残留浓度为初始浓度,按照公式1计算得到不同时期不同处理中庆大霉素的残留率。随着菠菜的生长,各处理庆大霉素平均残留率从第7天的56.62%下降到第56天的1.66%,表明菠菜种植过程中庆大霉素可以被有效得去除掉。对比第7、14和28天加菌处理和不加菌处理发现,加菌后土壤庆大霉素的残留率显著低于未加菌处理;比较不同时期处理CGF和CG处理中庆大霉素残留率发现,除第56天外,CGF处理中庆大霉素残留率显著低于CG处理中的残留率,表明添加FZC3可以提高庆大霉素的去除效率。比较不同时期处理CG和CM发现,两个处理中庆大霉素残留率差异不明显(P>0.05),表明土壤中同时添加两种抗生素并没有对庆大霉素的去除造成影响。比较不同时期CMM和CM处理发现,CMM处理中庆大霉素残留率均比CM处理中显著降低(P<0.05),表明庆大霉素和泰乐菌素同时存在时,添加两种外源降解菌可以促进土壤中庆大霉素的去除。
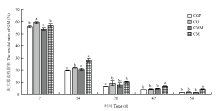 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1不同处理中庆大霉素的残留率数据为平均残留率±标准差(n=3);不同小写字母表示同一时期不同处理中抗生素残留率之间存在显著差异(P<0.05)
-->Fig. 1The residual rates of GM under different treatments Data are means ± standard deviation (n=3); Different small letters mean significant differences (P<0.05)
-->
土壤中泰乐菌素浓度随时间的变化情况如表4所示,CC处理中始终无泰乐菌素检出。第0天各处理组中所检测到的抗生素含量为42.810—44.087 mg·kg-1,加药浓度为50 mg·kg-1,因而掺药及降解菌后潮土中泰乐菌素的回收率为85.62%—88.17%,处理组间无显著差异性。7 d各处理组中泰乐菌素含量之间有显著性差异,而第14—56天时,各处理泰乐菌素含量之间显著性差异逐渐变小。
Table 4
表4
表4不同时期不同处理土壤中的泰乐菌素的残留浓度(mg·kg-1)
Table 4Residual concentrations of TYL (mg·kg-1) in soils with different treatments at different stages
| 处理 Treatment | 第0天 Day 0 | 第7天 The 7th day | 第14天 The 14th day | 第28天 The 28th day | 第42天 The 42th day | 第56天 The 56th day |
|---|---|---|---|---|---|---|
| CTW | 44.087±0.396a | 1.729±0.089c | 1.030±0.054b | 0.613±0.031b | 0.068±0.001a | 0.034±0.001a |
| CT | 43.796±0.44ab | 3.502±0.288b | 2.027±0.584a | 0.912±0.061a | 0.351±0.002a | 0.044±0.002a |
| CMM | 42.810±0.464b | 3.801±0.671b | 2.071±0.112a | 0.702±0.050b | 0.191±0.007a | 0.053±0.003a |
| CM | 43.187±0.547ab | 5.260±0.497a | 2.470±0.117a | 0.720±0.047b | 0.194±0.004a | 0.044±0.002a |
| CC | 0 | 0 | 0 | 0 | 0 | 0 |
新窗口打开
图2为不同时期各处理土壤中泰乐菌素的残留情况。以第0 天各处理残留浓度为初始浓度,按照公式1计算得到不同时期不同处理中泰乐菌素残留率。随着菠菜的生长,各处理泰乐菌素平均残留率从第7天8.25%下降到第56天0.1%,表明菠菜种植过程中泰乐菌素可被有效去除。对比第7天和第14天加菌和不加菌处理发现,加菌后土壤泰乐菌素残留率显著低于未加菌处理:其中第7天各处理间(CTW、CT、CMM和CM)泰乐菌素残留率差异最为显著(P<0.05),分别为3.92%、8.00%、8.89%、12.19%;比较不同时期CTW和CT处理泰乐菌素残留率发现,除了第56天外,CTW处理泰乐菌素残留率比CT处理显著降低,表明添加外源降解菌可以显著提高土壤中泰乐菌素去除效果。比较第7天CT和CM处理发现,前者泰乐菌素残留率明显比后者低,表明当土壤中存在庆大霉素时泰乐菌素的去除效果受到影响。比较不同时期CMM和CM处理发现,第7天前者泰乐菌素残留率明显比后者低,而之后两者差异逐渐减小,表明庆大霉素和泰乐菌素同时存在时,添加两种外源降解菌在盆栽种植初期可以促进土壤中泰乐菌素的去除,但随着种植时间的推移,该作用逐渐减小。
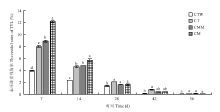 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2不同处理中泰乐菌素的残留率数据为平均残留率±标准差(n=3);不同小写字母表示同一时期不同处理中抗生素残留率之间存在显著差异(P<0.05)
-->Fig. 2The residual rates of TYL in different treatments Data are means ± standard deviation (n=3); Different small letters means significant differences (P<0.05)
-->
2.2 不同处理土壤微生物群落丰富度和多样性
研究发现,外源菌剂在土壤[36]或堆体中[26]活跃期为1—2周,因而本研究选取前两周(0—14 d)土壤样品进行细菌多样性检测,以探究外源抗生素降解菌在去除抗生素的同时对土壤中细菌的影响。表5所示为各处理第1周(第7天)和第2周(第14天)的细菌群落丰富度(Chao1)和多样性指数(Shannon)。各处理第2周和第1周细菌丰富度和多样性指数变化不一。其中CC和CT处理第2周细菌丰富度和多样性与第1周相比均未有显著变化;CGF处理第2周较第1周细菌丰富度和多样性均显著下降;CG和CTW处理第2周较第1周细菌的丰富度和多样性均显著增加;CMM和CM处理中第2周较第1周细菌的丰富度变化不显著,而细菌多样性有显著增长。Table 5
表5
表5不同处理土壤中的细菌丰富度及多样性指数
Table 5Richness and diversity indexes of bacteria in the soils of different treatments
| 处理 Treatment | 第1周The first week | 第2周The second week | |||
|---|---|---|---|---|---|
| Chao1指数 Chao index | Shannon指数 Shannon index | Chao1指数 Chao index | Shannon指数 Shannon index | ||
| CGF | 1898±5a | 8.95±0.03a | 1744±30b | 8.68±0.02ab | |
| CG | 1775±103ab | 7.75±1.15cd | 1836±35a | 8.79±0.05a | |
| CTW | 1686±71b | 7.04±0.54de | 1770±44b | 7.94±0.28c | |
| CT | 1898±19a | 8.69±0.04ab | 1886±26a | 8.72±0.05ab | |
| CMM | 1781±44ab | 7.77±0.05c | 1772±76ab | 8.30±0.11bc | |
| CM | 1849±17ab | 8.73±0.05a | 1816±29ab | 8.54±0.07b | |
| CC | 1870±33a | 8.70±0.07ab | 1900±16a | 8.66±0.05ab | |
新窗口打开
对比CGF、CG和CC处理,第1周CG与CC处理细菌丰富度和多样性均较低,第2周两个处理的细菌丰富度和多样性基本一致,表明初期庆大霉素对土壤中细菌的生长有明显影响,而可能由于庆大霉素的降解以及耐药菌的形成,第2周时两个处理间差异减小;第1周时CGF组土壤中细菌丰富度及多样性均高于CG组,而第2周时CGF组细菌丰富度及多样性指数均低于CG组。
对比CTW、CT和CC处理,第1周和第2周CT与CC处理细菌丰富度与多样性指数均差异较小,表明土壤中添加泰乐菌素后对其中的细菌丰富度和多样性影响较小。与CT处理相比,CTW处理细菌丰富度与多样性指数均显著降低,表明泰乐菌素外源降解菌会导致土壤中细菌丰富度和多样性的降低。
对比CMM、CM和CC处理,第1周和第2周CM与CC处理细菌丰富度与多样性均相差较小,可能是因为两种抗生素产生了拮抗效应,减小了对细菌的抑制作用;CMM处理的细菌丰富度与多样性指数均少于CM处理,表明两种降解菌的添加会使土壤中细菌的丰富度和多样性的降低。
2.3 不同处理土壤细菌群落结构
2.3.1 门分类水平 图3是不同处理在门分类水平上细菌群落组成和结构变化,图3-A为第1周,图3-B为第2周。各处理组主要有4个优势细菌类群,分别是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi),这4个优势细菌门在所有处理中平均相对丰度值分别为38.93%、26.32%、10.72%和6.14%。对比CC处理两周变化发现,第2周较第1周厚壁菌门相对丰度增加8.4%,而绿弯菌门相对丰度下降7.0%。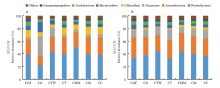 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3不同处理门分类水平上的细菌群落分布比较(A:第1周;B:第2周)
-->Fig. 3Comparison of bacteria groups at phylum level in the different treatments (A: First week; B: Second week)
-->
对比CGF、CG和CC处理,第1周CG与CC处理变形菌门、放线菌门和绿弯菌门相对丰度分别下降15.9%、13.1%和4.2%,厚壁菌门和拟杆菌门相对丰度分别上升25.3%和9.8%,说明庆大霉素对变形菌门和放线菌门有较大的抑制作用;而第2周CG与CC处理群落结构相近,可能是因为庆大霉素的降解降低了其对细菌群落的抑制效应。相较于CG处理,第1周CGF处理中变形菌门和放线菌门相对丰度分别增加16.1%和9.7%,厚壁菌门和拟杆菌门相对丰度分别下降26.7%和8.8%;但CGF与CC处理相差较小,说明庆大霉素降解菌FZC3可缓解庆大霉素对细菌群落结构的影响。第2周时CGF和CG处理均与CC处理群落结构相近,说明土壤中添加庆大霉素及其降解菌后一段时间不会对土壤细菌菌群结构造成显著影响。
对比CTW、CT和CC处理,第1周和第2周CT与CC处理细菌菌群组成结构及变化均相似,说明土壤中添加泰乐菌素对细菌群落结构影响较小。第1周CTW组与CT组相比变形菌门和厚壁菌门相对丰度分别增加4.0%和10.2%,绿弯菌门和酸杆菌门(Acidobacteria)相对丰度分别下降6.3%和2.8%,说明泰乐菌素降解菌无色杆菌加入使得变形菌门相对丰度显著上升并对细菌群落结构造成影响;相较于CT处理,第2周CTW处理变形菌门相对丰度增高11.2%,厚壁菌门相对丰度下降4.5%,说明土壤中添加泰乐菌素及其降解菌后一段时间内会对土壤细菌菌群结构造成持续影响。
对比CMM、CM和CC处理,第1周和第2周CM处理中细菌群落结构均与CC处理相近,说明同时添加庆大霉素和泰乐菌素药效间产生拮抗作用;相较于CT处理,第1周CMM处理变形菌门相对丰度增加11.0%,绿弯菌门下降约3.9%。相较于CT处理,第2周CMM处理变形菌门提高3.9%,厚壁菌门降低3.3%,说明两种抗生素及其降解菌加入对土壤细菌菌群结构影响显著。
2.3.2 属分类水平 图4是不同处理属分类水平上的细菌群落组成和结构,图4-A为第1周,图4-B为第2周。除了没有被分类的菌属(undentified)和其他(others)之外,土壤中相对丰度较大的细菌菌属分别为芽胞杆菌属(Bacillus)、鞘氨醇单胞菌属(Sphingomonas)、节细菌属(Arthrobacter)、无色杆菌属(Achromobacter)、微小杆菌属(Microvirga)、乳酸杆菌属(Lactobacillus)和马赛菌属(Massilia),这7个优势细菌属在所有处理中平均相对丰度值分别为3.19%、5.53%、2.69%、3.32%、2.64%、2.47%和1.79%。对比CC处理两周变化发现,第2周比第1周芽胞杆菌属、鞘氨醇单胞菌属和乳酸杆菌属相对丰度分别增长2.4%、1.6%和2.3%,而马赛菌属、节细菌属的相对丰度分别减少1.8%和4.5%。
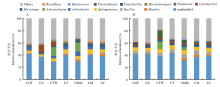 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同处理属分类水平上的细菌群落分布比较(A:第1周;B:第2周)
-->Fig. 4Comparison of bacteria groups at genus level in the different treatments (A: First week; B: Second week)
-->
对比CGF、CG和CC处理,第1周CG较CC处理马赛菌属、芽胞杆菌属、节细菌属和鞘氨醇单胞菌属相对丰度会分别下降3.2%、1.2%、2.5%和1.9%,乳酸杆菌属相对丰度增加11.2%,说明乳酸杆菌属是耐庆大霉素菌属,而马赛菌属、芽胞杆菌属、节细菌属和鞘氨醇单胞菌属对庆大霉素较为敏感;第2周CG处理马赛菌属、芽胞杆菌属和鞘氨醇单胞菌属相对丰度比第1周分别增加0.6%、3.2%和2.5%,乳酸杆菌和节细菌属相对丰度分别减少9.5%和2.4%(节细菌属变化趋势与空白对照相似),且CG与CC处理群落结构逐渐趋于相似,说明庆大霉素残留率的下降降低了其对属分类水平细菌群落的干扰;相较于CG处理,第1周CGF芽孢杆菌属、鞘氨醇单胞菌属和节细菌属的相对丰度分别增加0.3%、1.2%和2.4%,乳酸杆菌属相对丰度下降11.3%,且CGF与CC处理群落结构相近,表明庆大霉素降解菌FZC3可缓解庆大霉素对细菌群落结构的影响;第2周CGF和CG处理均与CC处理群落结构相近,说明土壤中添加庆大霉素及其降解菌后一段时间不会对土壤细菌菌群结构造成显著影响。
对比CTW、CT和CC处理发现,第1周CT较CC处理马赛菌属相对丰度下降2.0%,鞘氨醇单胞菌属相对丰度增加1.8%,说明鞘氨醇单胞菌属是耐泰乐菌素菌属,而马赛菌属对泰乐菌素较为敏感;CT处理第2周与第1周相比细菌群落结构变化与CC处理变化相似,而CT与CC处理马赛菌属相对丰度由第1周2.0%降为1.1%,说明泰乐菌素残留率的下降降低了其对属分类水平细菌群落的干扰。第1周CTW较CT处理无色杆菌属和乳酸杆菌属相对丰度分别增加13.7%和6.4%,马赛菌属、鞘氨醇单胞菌属和节细菌属相对丰度分别下降1.1%、2.2%和1.5%,说明泰乐菌素降解菌无色杆菌对属分类水平细菌群落结构影响较大;第2周CTW处理无色杆菌属和Flavisolibacter相对丰度分别比CT提高11.9%和11.8%,而乳酸杆菌属相对丰度差值由第1周6.4%降为-0.7%,说明第2周CTW处理群落结构与CT处理差异显著,而CT与CC处理第2周群落结构相近,表明泰乐菌素降解菌无色杆菌比泰乐菌素对属分类水平细菌群落结构影响更为显著。
对比CMM、CM和CC处理发现,第1周和第2周CM处理中细菌群落结构与CC处理差异较小,说明同时添加庆大霉素和泰乐菌素药效间产生了拮抗作用;第1周CMM较CM处理无色杆菌属相对丰度增加14.7%,而下降的菌属分布在未被分类的菌属中,第2周CMM处理无色杆菌和Flavisolibacter相对丰度比CM处理分别提高3.5%和3.4%,说明泰乐菌素降解菌无色杆菌的加入显著提高Flavisolibacter的竞争力。
3 讨论
3.1 抗生素在土壤中的残留
李孟阳[27]通过培养试验发现,当土壤中泰乐菌素初始浓度分别为2 000、1 000和500 mg·kg-1时,7 d后其残留率分别为10%、17%和20%左右。本研究中当菠菜土壤中泰乐菌素初始浓度为50 mg·kg-1时,7 d后的残留率为8%,而添加泰乐菌素降解菌处理中其残留率能降为3%左右。这表明土壤中泰乐菌素初始浓度会影响其在土壤中的去除效果,而植物和泰乐菌素降解菌无色杆菌可以有效促进土壤中泰乐菌素的降解[37]。章明奎等[38]通过培养实验发现,不同浓度(1、5和20 mg·kg-1)的泰乐菌素在试验初期(20 d内)降解速率明显高于后期(50—100 d),与本试验得出泰乐菌素前期(前7 d)残留率下降速度显著高于后期(14—56 d)的结果相似。当种植菠菜土壤中庆大霉素初始浓度为50 mg·kg-1时,14 d后残留率已降为21.96%,而添加庆大霉素降解菌FZC3后其残留率可显著降为19.64%,说明土壤中添加庆大霉素降解菌FZC3可以显著提高庆大霉素的去除效果,与堆肥中FZC3对庆大霉素显著去除效果一致[26]。
比较两种抗生素在盆栽试验中的去除效果发现,庆大霉素去除效率较泰乐菌素低,尤其7 d后各处理庆大霉素的残留率为56.62%,而泰乐菌素的残留率为8.25%,这可能与泰乐菌素较易光解的性质有关[39]。同时添加两种抗生素,泰乐菌素去除效果受到较大影响而庆大霉素影响不大,这可能是因为庆大霉素对土壤中泰乐菌素降解菌产生了抑制作用,而7 d后CM和CT处理间泰乐菌素残留率差异不明显,可能是因为随着庆大霉素的去除,其对泰乐菌素降解菌的影响逐渐减小所致。土壤中添加两种抗生素及其降解菌后,前期(前7 d)均促进两种抗生素的去除,但随着菠菜的生长,该作用逐渐减小,这与堆肥中添加外源降解菌后抗生素降解特点一致[26, 29]。
3.2 土壤细菌的多样性
多样性指数是评价细菌群落多样性的重要指标,多样性指数越高表明细菌群落的丰富度和多样性越高。Chao1指数和Shannon指数分别表示细菌群落的丰富度和多样性。本试验中CC处理Chao1和Shannon指数分别为1870±33和8.70±0.07,与汪峰[40]研究中潮土的Chao1和Shannon指数相近。比较不同处理第2周和第1周细菌Chao1指数和Shannon指数变化特点发现,只有CGF处理细菌丰富度和多样性显著下降(Chao1和Shannon指数分别下降153和0.3),这表明该时期内庆大霉素降解真菌FZC3对土壤中细菌群落丰富度和多样性有显著的抑制作用。第1周CGF处理细菌群落丰富度和多样性指数与CG处理相比分别高123和1.2,第2周CGF处理与CG处理相比分别降低92和0.1,这可能是因为初期添加庆大霉素降解真菌FZC3而减少庆大霉素对细菌的抑制作用,因此CGF处理细菌丰富度和多样性指数较高;而随着后期两个处理庆大霉素残留差异减小,庆大霉素降解真菌与土壤中细菌的资源竞争逐渐激烈,导致CGF处理细菌丰富度和多样性比CG处理要低。第1周CTW处理比CT处理细菌群落丰富度和多样性指数分别低212和1.6,第2周分别低116和0.8,而CT组与CC组细菌群落丰富度和多样性指数无显著差异,说明泰乐菌素降解细菌会显著干扰土壤细菌群落原有的动态平衡。而第1周和第2周CM处理土壤中细菌丰富度和多样性与CC处理相比均无显著变化,可能是土壤中同时添加两种抗生素对土壤细菌菌群存在有互相干扰(拮抗作用),而毛书帅[41]的研究也有类似结果。
3.3 土壤细菌群落结构
细菌是土壤微生物的主要组成之一,参与土壤养分循环并维持整个土壤生态系统的稳定[33]。本试验采用16S rDNA高通量测序技术对土壤样品进行检测,在97%相似度条件下,所得OTUs涵盖了土壤中90%以上的细菌,其中包括52个门分类水平和484个属分类水平上的细菌类群。其中优势门类分别是变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi)。优势属类群分别是芽胞杆菌属(Bacillus)、鞘氨醇单胞菌属(Sphingomonas)、节细菌属(Arthrobacter)、无色杆菌属(Achromobacter)、微小杆菌属(Microvirga)和乳酸杆菌属(Lactobacillus)。试验结果与杨亚东等[42]对不同类型农田土壤中细菌优势类群的调查结果相似,但不同土壤类型、不同试验环境及不同作物会导致细菌各类群的相对丰度值有一定偏差。比较添加两种抗生素对土壤细菌菌群的影响发现,在细菌门分类水平下,第1周CG处理比CC处理中变形菌门和放线菌门的相对丰度均显著降低,而CT与CC处理无显著差异,这是由于本试验条件下庆大霉素对细菌门分类水平细菌菌群结构的影响较泰乐菌素较强的缘故;第2周后CG和CT处理均与CC处理细菌群落结构相似,这可能是由于抗生素对土壤中细菌菌群的影响作用随菠菜的生长逐渐减小所致。在细菌属分类水平下,第1周CG较CC处理马赛菌属、芽胞杆菌属、节细菌属和鞘氨醇单胞菌属的相对丰度均显著降低,而CT与CC处理相比只有马赛菌属相对丰度显著降低,这也表明属分类水平下土壤细菌群落受庆大霉素的影响比泰乐菌素的更大。第2周后CG和CT处理细菌群落结构均趋于相似,随着菠菜的生长,抗生素对土壤中细菌菌群的影响均随抗生素在土壤中残留率的降低而减小。
通过分析CGF、CG和CC处理门和属分类水平下细菌群落结构和庆大霉素残留特点发现,相较于CG处理,第1周CGF与CC处理细菌群落结构更为相似,且CGF处理庆大霉素残留明显比CG处理明显降低,这表明庆大霉素降解真菌FZC3可以通过提高土壤中庆大霉素的去除效率来缓解庆大霉素对细菌群落结构的影响。第2周CGF与CC处理门分类水平细菌群落结构极为相近,而细菌群落的丰富度和多样性显著下降,这表明庆大霉素降解真菌对各门细菌的抑制作用较为一致。比较第1周CTW、CT和CC处理门和属分类水平下细菌群落结构和泰乐菌素残留特点发现,CT与CC处理细菌群落结构更为相似,而CTW处理泰乐菌素残留率明显比CT处理要低,且第2周CTW处理无色杆菌属和Flavisolibacter的相对丰度显著高于CT和CC处理,这表明泰乐菌素降解菌虽能显著提高泰乐菌素的去除效率,但相较于泰乐菌素的残留其对细菌菌群影响更大。
通过对比分析CM和CC处理门和属分类水平下的细菌菌群和抗生素残留特点发现,第1周和第2周CM与CC处理细菌群落结构和细菌丰富度与多样性指数均无显著差异,这表明同时添加两种抗生素对细菌菌群无显著影响,可能是由于庆大霉素和泰乐菌素两种抗生素药效之间有拮抗效应,这与毛书帅等[41]的研究结果类似。
4 结论
4.1
种植菠菜过程中土壤庆大霉素和泰乐菌素可以得到有效去除。其中泰乐菌素的去除效率显著高于庆大霉素,且添加抗生素降解菌可显著提高抗生素的去除效果。4.2
庆大霉素和泰乐菌素均影响土壤细菌群落,其中庆大霉素的影响作用强于泰乐菌素;两种抗生素同时添加时呈现拮抗作用,对土壤细菌群落的影响低于单一添加抗生素处理;随着菠菜的生长,抗生素对土壤中细菌菌群的影响逐渐减小。4.3
庆大霉素降解真菌FZC3可以缓解庆大霉素对细菌菌群的抑制作用,但对细菌丰富度和多样性等有一定的抑制作用;泰乐菌素降解菌无色杆菌的添加对土壤细菌群落有较大影响。(责任编辑 李云霞)
The authors have declared that no competing interests exist.
