0 引言
【研究意义】山荆子(Malus baccata ( L.) Borkh.)属蔷薇科(Rosaceae)苹果属(Malus Mill.)[1],是苹果属植物中分布最广,变异更为多样的类群[2]。山荆子花果美丽、树形优雅,常被用作砧木和园林绿化树种,果实、种子、幼叶及木材均有很高的经济利用价值,是苹果属植物中较为珍贵的野生资源。具有丰富变异的苹果属野生种是苹果砧木选育和产业可持续发展的重要基础和必要前提。通过苹果属植物的考察和收集,增加苹果属优异种的特异类型,并开展新收集苹果属植物种质资源的遗传多样性和群体遗传结构的评价,对明确收集保存苹果属植物的遗传多样性水平,指导其保护和有效利用具有重要意义,为研究种的遗传进化提供依据。【前人研究进展】山荆子主要分布于中国的东北、华北及西南,包括辽宁、吉林、黑龙江、内蒙古、河北、山西、山东、陕西、甘肃、四川、云南、贵州及西藏;朝鲜及西伯利亚亦有分布[3,4,5,6]。山荆子原产于亚洲东北部,在长期演变和进化过程中形成了丰富的变异类型[2]。通过其表型和不同居群遗传多样性研究表明,其居群间的遗传分化和亲缘关系较为复杂[7,8,9,10]。探明不同来源区域山荆子种质资源的遗传多样性和群体遗传结构是阐明其种群亲缘关系和系统进化的重要途径。山荆子的形态变异式样已经得到了充分的研究[11,12],利用RAPD[9]、ISSR[13]和SSR[14]分子标记仅对少数居群的遗传多样性进行研究。其中,王雷宏等[14]仅利用10对SSR引物对河北塞罕坝、山西灵空山、山西管涔山、山西中条山、山西五台山、黑龙江小兴安岭以及北京东灵山8个山荆子居群140个单株的遗传多样性和遗传关系进行分析,推测山荆子起源于中国华北和东北地区,山西灵空山、黑龙江小兴安岭、吉林长白山以及山西中条山居群可能为遗传多样性的核心居群。平均每个居群不到20个个体,且有4个居群来自于山西,因此,有必要通过利用多态性更高、数量更多的SSR引物以及更先进的检测和数据方法对更广泛来源的山荆子群体进行遗传多样性和群体结构分析。【本研究切入点】以往对于山荆子的遗传多样性研究主要注重于其表型,利用分子标记的方法仅对少数居群进行过研究,扩增产物的检测均采用的凝胶电泳。荧光SSR分子标记是将SSR分子标记和荧光标记技术相结合,利用测序仪进行产物检测,具有效率高、准确度和灵敏度好、避免人工判读条带的误差等优点。中国农业科学院果树研究所国家果树种质兴城梨、苹果圃自2008年至2015年分别对黑龙江、吉林、内蒙古、山西、甘肃和河北等中国野生苹果资源的主要分布区以及俄罗斯的西伯利亚地区进行苹果种质资源的考察和收集,并实现入圃安全保存。基于已经广泛收集的山荆子种质资源,利用荧光SSR分子标记的方法,以研究苹果属山荆子种质资源的遗传多样性和群体遗传结构。【拟解决的关键问题】本研究筛选19对高效的SSR引物,对新收集的7个来源地区的269份山荆子种质资源的遗传多样性和群体遗传结构进行分析,明确已收集区域该种的遗传多样性水平和遗传变异,以期为该种的进一步有效收集和保护、起源和地理演化规律研究提供依据。1 材料与方法
1.1 材料
供试每份种质均为2008年至2015年苹果资源的原生境考察过程中,在野外通过表型鉴定为山荆子本种之后,采集其野生群落的特异类型种质接穗,引入国家果树种质兴城梨、苹果圃内无性繁殖,待鉴定评价后给予国圃号。于2016年春季采集嫩叶并进行试验,2017年完成所有材料的SSR分子标记鉴定,所有供试山荆子材料信息见电子附表1。其中MB26—MB37和MB130—MB148保存于国家果树种质公主岭寒地果树圃(吉林省公主岭),其余供试山荆子材料保存于国家果树种质兴城梨、苹果圃(辽宁省兴城)。269份山荆子材料包括来源于俄罗斯37份、黑龙江92份、吉林19份、内蒙古44份、河北58份、山西15份和甘肃4份。Table 1
表1
表1不同SSR位点的遗传多样性特征
Table 1The characteristics of genetic diversity of different SSR loci
| 位点 Locus | 等位基因数 Na | 有效等位基因数 Ne | 香农指数 I | 观察杂合度 Ho | 期望杂合度 He | 固定指数 F |
|---|---|---|---|---|---|---|
| GD12 | 24.000 | 6.929 | 2.378 | 0.554 | 0.856 | 0.353 |
| GD15 | 14.000 | 3.538 | 1.618 | 0.480 | 0.717 | 0.331 |
| GD96 | 25.000 | 12.207 | 2.705 | 0.688 | 0.918 | 0.251 |
| GD100 | 18.000 | 12.586 | 2.650 | 0.669 | 0.921 | 0.273 |
| GD142 | 22.000 | 8.218 | 2.453 | 0.480 | 0.878 | 0.454 |
| GD162 | 23.000 | 11.539 | 2.699 | 0.755 | 0.913 | 0.174 |
| CH01h01 | 19.000 | 11.316 | 2.633 | 0.621 | 0.912 | 0.319 |
| CH01f02 | 21.000 | 9.260 | 2.514 | 0.543 | 0.892 | 0.392 |
| CH02d08 | 18.000 | 5.905 | 2.152 | 0.796 | 0.831 | 0.042 |
| CH01d08 | 32.000 | 16.334 | 3.044 | 0.695 | 0.939 | 0.259 |
| CH01f07a | 21.000 | 15.401 | 2.862 | 0.859 | 0.935 | 0.082 |
| COLa | 22.000 | 12.620 | 2.727 | 0.725 | 0.921 | 0.213 |
| CH05e03 | 23.000 | 8.324 | 2.451 | 0.476 | 0.880 | 0.459 |
| CH02d12 | 21.000 | 10.252 | 2.590 | 0.710 | 0.902 | 0.213 |
| CH02b10 | 17.000 | 3.494 | 1.705 | 0.509 | 0.714 | 0.287 |
| CH01d09 | 21.000 | 4.779 | 2.174 | 0.461 | 0.791 | 0.417 |
| NH009b | 19.000 | 10.802 | 2.596 | 0.621 | 0.907 | 0.316 |
| NH015a | 19.000 | 6.490 | 2.190 | 0.703 | 0.846 | 0.169 |
| NZ28f4 | 13.000 | 2.343 | 1.307 | 0.584 | 0.573 | -0.018 |
| 平均值 Mean | 20.632 | 9.070 | 2.392 | 0.628 | 0.855 | 0.262 |
新窗口打开
1.2 试验方法
采用德国QIAGEN的DNeasy Plant Mini Kit提取供试材料春季嫩叶的基因组DNA。从HOKANSON等[15]、LIEBHARD等[16]、YAMAMOTO等[17]和GUILFORD等[18]报道的序列中选取扩增产物片段长度在100—300 bp并经检测具有高度多态性的SSR引物19对,除GD15和NH015a在苹果染色体上的位置未知外,其余17对SSR引物均来源于编码区并分别定位于10条染色体上[17,19-20],19对引物所属染色体连锁群、引物名称编号和序列见电子附表2。其中,NH009b、NH015a和NZ28f4SSR为梨SSR引物,NH015a定位于梨的第17染色体上。SSR反向引物和5’端带有6FAMTM荧光标记SSR正向引物由上海生工有限公司合成。Table 2
表2
表27个来源地区山荆子群体的遗传多样性
Table 2The genetic diversity among the seven groups of Malus baccata from seven sources
| 山荆子群体 Population of Malus Baccata | 等位基因数 Na | 有效等位基因数 Ne | 香农指数 I | 观察杂合度 Ho | 期望杂合度 He | 固定指数 F |
|---|---|---|---|---|---|---|
| 俄罗斯 Russia | 14.421 | 7.816 | 2.207 | 0.725 | 0.835 | 0.126 |
| 中国黑龙江 Heilongjiang, China | 15.684 | 7.198 | 2.153 | 0.624 | 0.823 | 0.241 |
| 中国吉林 Jilin, China | 9.579 | 5.985 | 1.869 | 0.626 | 0.779 | 0.174 |
| 中国内蒙古 Inner Mongolia, China | 11.737 | 6.495 | 1.918 | 0.602 | 0.760 | 0.187 |
| 中国河北 Hebei, China | 15.474 | 8.218 | 2.278 | 0.601 | 0.852 | 0.286 |
| 中国山西 Shanxi, China | 10.053 | 6.877 | 2.007 | 0.625 | 0.820 | 0.230 |
| 中国甘肃 Gansu, China | 4.684 | 4.054 | 1.406 | 0.513 | 0.714 | 0.289 |
新窗口打开
PCR体系参照CAO等[21],扩增产物的纯化体系参照高源等[22]方法。PCR反应在Bio-Rad PTC-200上进行。PCR扩增并经过纯化后的SSR荧光标记产物在美国ABI 3730基因测序仪上进行荧光检测,收集原始数据。
1.3 数据统计与分析
利用GeneMapper3.0软件对ABI3730收集数据进行分析,获得不同样品在每个SSR位点的扩增片段长度。利用遗传数据分析软件GenAlEx 6.501[23,24]计算多态性等位基因数(Na)、SSR 位点的有效等位基因数(Ne)、观察杂合度(Ho)、期望杂合度(He)、固定指数(F)及香农多样性指数(I)等遗传多样性指标,并分析群体间的分子变异(AMOVA)。利用GenepopV4和Fstat293[25,26]计算群体间的遗传分化系数Fst和群体遗传多样性Ht、群体内遗传多样性Hs、群体间的遗传多样性Dst、遗传分化系数Gst和基因流Nm。基于Nei遗传距离DA[27],利用POPULATION 1.2构建269份山荆子材料的Neighbour-Joining(NJ)进化树,并用在线绘图软件iTOL(Interactive tree of life)[28]绘制。使用STRUCTURE 2.3.4进行贝叶斯聚类[29],分析群体的遗传结构并确定最佳的群体分组。首先设定等位变异频率特征数(遗传群体数)K=1—5,设定Burn-in周期为100 000,MCMC的重复次数为100 000次,采用混合模型和相关等位基因频率,对不同的K值进行10次重复运行,然后将后缀为“_f”的结果文件压缩,上传到“STRUCTURE HARVESTER”网站(http://taylor0.biology.ucla.edu/ struct_harvest/),据EVANNO等[30]的方法计算得到Delta K和似然值的对数函数Lnp(D),分别针对基因库数目(K)建模,确定最佳K值。利用CLUMPP 1.1.2软件[31]处理10次独立运行得到的分配系数Q值(即每一个类群内每个个体之间的估测系数),然后使用DISTRUCT 1.1软件[32]将计算结果进行图形化输出。2 结果
2.1 SSR扩增产物的多态性
19对具有明显多态性的SSR引物对269份山荆子材料的基因组DNA进行扩增,共扩增出392个多态性等位基因(Na),多态性等位基因数为13(NZ28f4)—32(CH01d08),平均等位基因数为20.6(表1)。每份样品在每个位点产生2个相同(单峰)或不同(双峰)的等位基因。有效等位基因数(Ne)为2.343(NZ28f4)—16.334(CH01d08),平均值为9.070。观察杂合度(Ho)为0.476—0.859,平均值为0.628。期望杂合度(He)为0.573—0.939,平均期望杂合度为0.855。香农多样性指数(I)为1.307—3.044,平均值为2.392。而固定指数(F)只有在NZ28f4中为负值,其余均为正值,说明供试山荆子群体内含有的杂合子较少。2.2 7个山荆子群体的遗传多样性
将所有山荆子材料按照来源地区划分为7个群体(表2),黑龙江群体的观测等位基因数最多为15.684;河北群体的有效等位基因数和香农指数最高,分别为8.218和2.278;全部群体的杂合度均高于0.5,俄罗斯群体的观察杂合度最高为0.725;河北群体的期望杂合度最高为0.852;期望杂合度与观察杂合度差值最小的为俄罗斯群体,差值最大的为河北群体;固定指数在各个群体均为正值,其中在俄罗斯群体中最小为0.126,相比于其他群体其杂合子较多。2.3 群体间的遗传分化和分子变异
为了揭示各个收集区域山荆子群体的遗传差异,按照来源地划分群体后计算Nei遗传距离(表3)。可以看出,甘肃与吉林群体间遗传距离最大为1.061,除山西群体外,甘肃与俄罗斯、黑龙江、内蒙古和河北群体的遗传距离均较大;吉林与内蒙古群体间的遗传距离最小为0.193,除甘肃外,吉林与其他5个来源地山荆子的遗传距离均相对较小。甘肃与其他来源地群体的遗传距离总和最大,其次是俄罗斯群体,最小的为河北群体。从一定程度上体现了群体间地理距离与遗传距离的相关性。Table 3
表3
表37个来源地区山荆子群体间遗传距离和遗传分化系数
Table 3The genetic distance and genetic differentiation coefficient among the seven groups of Malus baccata from seven sources
| 7个山荆子群体 7 populations of Malus baccata | 俄罗斯 Russia | 中国黑龙江 Heilongjiang, China | 中国吉林 Jilin, China | 中国内蒙古 Inner Mongolia, China | 中国河北 Hebei, China | 中国山西 Shanxi, China | 中国甘肃 Gansu, China |
|---|---|---|---|---|---|---|---|
| 俄罗斯 Russia | 0.000 | 0.393 | 0.268 | 0.394 | 0.268 | 0.455 | 0.881 |
| 中国黑龙江 Heilongjiang, China | 0.052 | 0.000 | 0.299 | 0.253 | 0.251 | 0.387 | 0.984 |
| 中国吉林 Jilin, China | 0.032 | 0.042 | 0.000 | 0.193 | 0.195 | 0.387 | 1.061 |
| 中国内蒙古 Inner Mongolia,China | 0.065 | 0.047 | 0.028 | 0.000 | 0.205 | 0.275 | 0.958 |
| 中国河北 Hebei, China | 0.029 | 0.034 | 0.019 | 0.035 | 0.000 | 0.288 | 0.906 |
| 中国山西 Shanxi, China | 0.044 | 0.043 | 0.040 | 0.037 | 0.021 | 0.000 | 0.696 |
| 中国甘肃 Gansu, China | 0.073 | 0.088 | 0.099 | 0.111 | 0.064 | 0.036 | 0.000 |
新窗口打开
群体发生分化主要是基因型或基因型频率不同,因此,基于SSR基因型鉴定,推测山荆子的基因分化。如表4所示,所有供试山荆子在种水平的基因多样性Ht为0.868,群体内遗传多样性Hs为0.831,群体间遗传多样性Dst 为0.037,居群间基因分化系数Gst为0.049,基因流Nm为5.785。对7个群体进行群体分子遗传变异方差分析,遗传结构分类群的遗传变异极显著(P<0.001),群体内方差分量的贡献率占23%,而群体间方差分量的贡献率仅占4%,个体内方差分量的贡献率占73%。山荆子基因分化和分子遗传变异2个系数指标分析结果一致,说明山荆子整体遗传多样性较高,但其主要分布在群体内部和由个体差异产生的遗传变异,群体间分布较低的遗传多样性。
Table 4
表4
表4基于SSR标记的7个来源地区山荆子群体的分子方差分析(AMOVA)和基因分化
Table 4Analysis of molecular variance (AMOVA)and coefficients of gene differentiation of 7 populations based on SSR in Malus baccata
| 变异来源 Source of variance | 自由度 df | 平方和 SS | 均方差 MSE | 方差分量 Variance component | 方差分量百分率 Total variance (%) | 遗传 多样性 Ht | 居群内遗传 多样性 Hs | 居群间的 遗传多样性 Dst | 遗传分化 系数 Gst | 基因流 Nm |
|---|---|---|---|---|---|---|---|---|---|---|
| 群体间 Among population | 6 | 202.000 | 33.667 | 0.340 | 4 | — | — | — | — | — |
| 群体内 In population | 262 | 2564.076 | 9.787 | 1.912 | 23 | — | — | — | — | — |
| 个体内 In individual | 269 | 1604.000 | 5.963 | 5.963 | 73 | — | — | — | — | — |
| 总体Total | 537 | 4370.076 | 8.215 | 100 | — | — | — | — | — | |
| 7个群体平均 Mean | — | — | — | — | — | 0.868 | 0.831 | 0.037 | 0.049 | 5.785 |
新窗口打开
7个山荆子群体基因流Nm平均值为5.785,根据公式Nm=0.25(1-Fst)/Fst,计算群体间遗传分化系数Fst为0.0414,即7个群体间的遗传变异为4.14%,与群体分子遗传变异方差分析(AMOVA)中群体间方差分量的贡献率相一致;而群体内的遗传变异为95.84%,表明各个群体在过去的某个时间相互都可能曾发生过基因交流,但同时这又抵制了由于基因漂变而导致的群体遗传分化。7个群体两两间遗传分化系数为0.019—0.111,河北与吉林群体间的遗传分化系数最低为0.019,而甘肃与内蒙古群体间的遗传分化系数最高为0.111。俄罗斯群体作为国外的群体,也是供试地理位置最北端的群体,其与甘肃群体的遗传分化系数最高为0.073,其次是与内蒙古群体,而与河北群体的遗传分化系数最低。群体间遗传分化系数与其地理位置远近不完全相关。
2.4 基于Nei遗传距离的聚类分析
基于所有山荆子材料的SSR数据的Nei遗传距离进行NJ聚类。在遗传距离0.7444处,269份材料可以分成7个类群(图1)。其中类群Ⅰ和Ⅱ与其他类群遗传距离较远,类群Ⅰ遗传多样性丰富,包含来自黑龙江、吉林、内蒙古和河北的19份材料;类群Ⅱ主要为内蒙古的12份和河北的19份材料,以及9份吉林和3份黑龙江材料。类群Ⅲ包含4份俄罗斯、10份内蒙古、6份山西、1份吉林和1份河北材料;类群Ⅳ主要为河北的22份和俄罗斯的27份材料,以及1份黑龙江、2份山西和4份吉林材料;类群Ⅴ主要包含内蒙古的14份、黑龙江的2份和河北的2份材料;类群Ⅵ的40份材料来自供试的全部7个来源地,材料来源最为复杂,相互交错在一起;类群Ⅶ中除1份河北材料,其余全部为来自于黑龙江。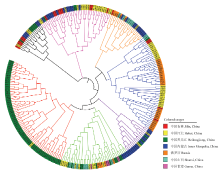 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1269份材料基于Nei遗传距离的NJ聚类图黑色分支线为类群Ⅰ,紫红色分支线为类群Ⅱ,橘色分支线为类群体Ⅲ,蓝色分支线为类群Ⅳ,紫色分支线为类群Ⅴ,绿色分支线为类群Ⅵ,红色分支线为类群Ⅶ
-->Fig. 1The Neighbor-Joining Cluster of 269 accessions of Malus baccata based on Nei of SSR data The first part with black branches is groupⅠ, the second part with burgundy branches is groupⅡ, the third part with orange branches is groupⅢ, the fourth part with blue branches is groupⅣ,the fifth part with purple branches is groupⅤ, the sixth part with green braches is groupⅥ, the seventh part with red braches is groupⅦ
-->
2.5 群体遗传结构分析
基于SSR分子标记数据对269份山荆子材料进行群体结构分析,设置分析群体数K为1—10,重复10次。根据得到的结果(图2-A),随着K值的增加,Lnp(D)一直上升,无明显的拐点。因此,根据EVANNO等[30]的方法,用△K来确定K值,当K=3时,△K取得最大值(图2-B)。所以,可以将269份材料划分为3个群体,具有3个可能的基因来源,不同来源地的材料在群体中均有分布(图3)。黑龙江、甘肃和山西的材料与其他区域分化明显,内蒙古材料在区域内部有明显分化;河北和俄罗斯的材料群体区域内分化亦明显,基因来源相似。群体结构分析结果与SSR聚类结果一致。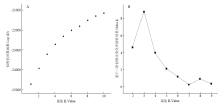 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2K值与LnP(D)、△K值折线图 Delta K 和似然值的对数函数LnP(D)根据EVANNO等[
-->Fig. 2Line chart of K with LnP(D) and △K Delta K and LnP(D) were calculated by the method of EVANNO et al. [
-->
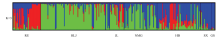 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图37个来源地区的269份山荆子种质遗传结构分析图 RU:俄罗斯;HLJ:中国黑龙江;JL:中国吉林;NMG:中国内蒙古;HB:中国河北;SX:中国山西;GS:中国甘肃。纵坐标为Q值(每一个类群内每个个体之间的估测系数)0.00—1.00,横坐标为7个来源地区群体代码,7个群体间用黑线分隔
-->Fig. 3Analysis on genetic structure of 269 germplasm of Malus baccata RU: Russia; HLJ: Heilongjiang, China; JL: Jilin, China; NMG: Inner Mongolia, China; HB: Hebei, China; SX: Shanxi, China; GS: Gansu, China. The ordinate is Q value 0.00~1.00, abscissa is the code of 7 groups, and 7 groups are separated by black line
-->
根据计算出来的各个群体中的Q值分布,当某一材料在某群体中的Q≥0.6时,认为该材料血缘比较单一,Q<0.6则认为该材料拥有混合来源[33]。本研究有232份材料Q≥0.6,说明大部分山荆子的血缘相对单一;拥有混合来源的材料仅占13.75%。在Q≥0.6的232份材料中,包含的俄罗斯材料属于类群2(红色)和类群3(蓝色)的数量分别为25份和6份,黑龙江材料属于类群1(绿色)和类群3的数量分别为73份和6份,吉林材料分属于3个类群的数量分别为9份、5份和3份,内蒙古材料属于类群1和类群3的数量分别为25份和15份,河北材料分属于3个类群的数量分别为6份、10份和30份,山西材料除1份属于类群1外,其余12份属于类群3,甘肃材料全部属于类群3。
3 讨论
3.1 山荆子的遗传多样性
本研究利用19对SSR引物,对7个来源地区的269份野生山荆子种质资源进行遗传多样性分析,19个SSR位点除2个位点在染色体上的位置未知外,其余17对SSR引物定位于10条染色体上,全部为多态位点,在群体中多态位点的百分率为100%。表明这19个微卫星位点均具有高度的多态性,虽未全部覆盖所有的染色体,但在种群间可转移性高,可作为有效的遗传标记用于山荆子遗传多样性和遗传结构分析。观测等位基因数(Na)是衡量SSR位点多态性和群体变异程度高低的重要指标。19对SSR引物在7个群体269份材料中共扩增出392个等位基因,平均每个位点扩增20.6个(Na=20.6),远高于前人利用SSR标记对三叶海棠[34]、刺梨[35]、豆梨[36]和樱桃[37]等野生果树种质资源进行研究的结果。
平均有效等位基因数(Ne)、平均Shannon 信息指数(I)、平均期望杂合度(He)等是评价遗传多样性的重要指标。本研究表明7个来源地的269份山荆子的遗传多样性(He=0.855,I=2.392,Ne=9.070)高于以往研究的三叶海棠[34](Malus sieboldii)(He=0.699,I=1.458,Ne=3.954)、湖北海棠[38](Malus hupehensis)(He=0.2628,I=0.4015,Ne=1.4375)、变叶海棠[39](Malus toringoides)(He=0.4389,I=0.6282,Ne=1.81)和新疆野苹果[40](Malus sieversii)(He= 0.2619,I= 0.4082,Ne=1.4252),也高于前人研究山荆子遗传多样性(Malus baccata)(He=0.3386,I=0.4961,Ne=1.6021)[9]、(I=0.5285,Ne=1.6169)[14],与苹果属野生种[41](He=0.86,I=2.07)的遗传多样性相接近。相较于苹果属其他植物而言,供试7个山荆子群体的遗传多样性处于较高水平,充分证明了其是苹果属变异更为多样的类群[2]。推测原因,其一是本研究中的山荆子材料来源广泛,地域跨度大,从华北、西北到东北,而且包含了国外种质资源考察收集的种质;其二是收集材料中大多来自于山荆子原生境野生分布群落,有的成片分布、有的零散分布,未经过较多的人为干预;其三可能是由于苹果属植物种间几乎不存在生殖隔离,极易发生属内种间自然杂交,导致种间基因互渗。但究其遗传多样性高的深入原因,是否真的与种间基因互渗有关,还需要通过根据山荆子来源区域探究与其地理位置相近的苹果属各种间的亲缘关系和遗传结构进一步证明。
在以往的对野生苹果种质资源的考察收集过程中,在几乎所有的考察区域均可收集山荆子本种的不同类型,这也充分证明了其是苹果属中分布最广的种[2]。对苹果属植物种质资源的考察和收集要尽可能多的涉及到其原生境分布区域,在生产和人为干预之前抢救性收集苹果野生资源并实现其安全保存,仍然是较快提高国家苹果种质资源圃苹果属植物种质资源的遗传多样性水平的重要方式。
3.2 7个群体的遗传多样性
对按照来源地划分的7个群体进行比较分析,发现7个山荆子群体的遗传多样性水平均处于较高的水平。一般认为杂合度高于0.5的种群没有经过高强度的人工选择,具有较高的遗传多样性[42],本研究中7个群体杂合度均高于0.5,均未经过高强度的人工选择,遗传多样性相对较高。相比而言,黑龙江群体的观测等位基因数最多,而河北群体的有效等位基因数和香农指数最高,这表明河北群体可能比黑龙江群体存在更丰富的稀有基因,遗传多样性也比黑龙江群体更高。根据杂合度的意义,杂合度观测值和杂合度期望值的相近程度也可以衡量群体的遗传多样性,它们的值越接近,群体遗传多样性越高[42]。期望杂合度与观察杂合度差值最小的为俄罗斯群体,差值最大的为河北群体,因此,根据固定系数虽然俄罗斯群体中比其他群体含有较多的杂合子,但河北群体的遗传多样性最高。群体间的遗传多样性比较可以指导苹果属植物种质资源的收集,本研究中7个区域遗传多样性水平均较高,但黑龙江和河北地区可以作为山荆子的优先收集区域考虑。3.3 群体间的遗传分化
估算群体间的遗传分化系数可区分群体间和群体内相对遗传变异大小,是解释群体遗传变异程度的主要依据[43,44]。WRIGHT [45]认为,若群体Fst值为0—0.05,则表明其各亚群间不存在分化;若Fst值为0.05—0.15,为中度分化;若Fst值在0.15—0.25,则为高度分化。本研究两两群体间遗传分化系数为0.019—0.111,其中黑龙江与俄罗斯群体、内蒙古与俄罗斯群体、甘肃与俄罗斯群体、甘肃与黑龙江群体、甘肃与吉林群体、甘肃与内蒙古群体、甘肃与河北群体发生中度分化,其余两两群体间均未发生分化,群体间的遗传分化与地理位置远近不完全相关。根据基因流Nm与遗传分化系数Fst的计算公式可知,每代迁入的有效个体数与群体间遗传差异水平成反比,群体越稳定,度量群体间遗传差异程度的Fst值越大,反之当Fst值比较低时,则对应的群体基因稳定性越差,基因交流越频繁[40]。本试验中河北与吉林群体的Fst值最低,河北与山西群体的Fst值次之,河北与俄罗斯群体的Fst值再次之。充分说明了河北群体与多个地域的群体基因交流频繁,甘肃群体是7个群体中最为稳定的,群体间的基因交流与地理位置远近不完全相关,但基因交流的同时又抵制了由于基因漂变而导致的群体间的遗传分化。山荆子常被用作实生砧木,随苗木调运长距离运输,由此造成种质交流频繁。本次供试山荆子材料虽均来自于野生群落,但有的群落为成片分布,有的为零星分散分布,尤其是河北地区收集到的山荆子材料,其中有少部分材料来源于生产园周边的半山坡上,河北地区苹果栽培历史悠久,是苹果主要产区之一,因此,究其历史不排除收集的野生山荆子基因来源于其他地区的可能。而黑龙江、吉林、内蒙古、甘肃和山西材料均完全来自于山区、林区或自然保护区等纯野生环境。这也许可以解释为何河北群体与多个地域的群体基因交流频繁。3.4 群体遗传结构
群体遗传结构是群体内各个亚群的分布情况,同时也反映了亚群的结构特征。利用STRUCTURE软件分析群体结构是基于不同个体中等位基因出现的频率,通过计算Q值(第i份材料SSR位点变异源于第K群体的概率)而归类。所有供试山荆子材料可以分为3个类群,有3个可能的基因来源,与地理位置没有十分明确的相关性,只有黑龙江、山西和甘肃群体以及部分的俄罗斯和河北材料类群归属相对单一,这与Nei遗传距离的NJ聚类结果相一致;诸多地理位置相近的种质也未聚到一起,这与王雷宏等[14]的研究结果相一致。按照WRIGHT[45]的理论和王雷宏等[14]对山荆子的研究,山荆子群体相对稳定,不存在遗传漂变,但分化程度较高。通过本试验研究,山荆子群体的遗传变异和分化主要存在于群体内部和个体内部,抵制基因漂变产生群体间遗传分化。本研究群体遗传结构分析对指导苹果属植物种质资源的进一步考察和收集具有重要的意义,并为后续研究苹果属植物的进化提供了依据。4 结论
19对SSR引物具有高度的多态性,可以作为有效的标记用于山荆子群体遗传多样性和遗传结构评价。7个来源地区山荆子遗传多样性均较高,以河北地区的遗传多样性最高,遗传变异和分化主要发生在群体内和个体内部;群体间有基因交流,以河北与其他地区的交流最频繁;抵制基因漂变而导致的群体间的遗传分化,群体间的遗传分化程度和基因交流水平与地理位置远近不完全相关。(责任编辑 李莉)
The authors have declared that no competing interests exist.
