0 引言
【研究意义】黄瓜(Cucumis sativus L.)是主要的蔬菜之一,在世界各地广泛栽培。而白粉病是危害黄瓜生产的主要病害之一,对白粉病抗性基因的精细定位是克隆抗性基因并建立白粉病分子标记辅助选择育种体系的基础。【前人研究进展】由于白粉病病原菌种类或生理小种不明确、实验材料各异、鉴定方法和病情分级标准不同等因素,造成黄瓜白粉病抗性遗传规律研究结论存在较大差异,主要有以下4种观点。第一种观点认为黄瓜白粉病抗性是由隐性多基因控制,且为数量性状[1,2]。第二种观点认为黄瓜白粉病抗性是由隐性单基因控制[3,4]。第三种观点认为黄瓜白粉病抗性是由1对不完全隐性基因和2对上位修饰基因控制[5,6,7,8]。第四种观点认为黄瓜白粉病抗性是由显性基因控制[9]。目前,对于黄瓜白粉病基因的定位研究已有较多的报道[10,11,12,13]。例如,沈丽平[10]采用复合区间作图法检测到2个白粉病抗性QTL位点,位于第3连锁群上,贡献率分别为7.6%和13.5%。刘龙洲等[12]在两种环境里共检测到4个分布于连锁群1、2、4和6上的黄瓜白粉病抗性QTL,单个QTL解释贡献率介于5.2%—21.0%。张圣平等[13]检测到一个位于5号染色体上的QTL(Pm5.2),并认为其为主效QTL位点,此位点与SSR00772紧密连锁。【本研究切入点】近年来,新一代测序技术的发展,SNP标记的应用越来越广泛,也随之产生了基于全基因组测序的BSA-seq技术。该技术极大程度的提高了基因定位的准确性和效率,并且已经广泛应运于藜麦、水稻、鹰嘴豆等作物中[14,15,16],而在黄瓜中鲜有报道。2009年黄瓜基因组全测序的完成,为在黄瓜中利用BSA-seq技术定位基因提供了序列基础[17]。【拟解决的关键问题】以高抗白粉病自交系‘74’和高感白粉病自交系‘80’为亲本配置组合,构建F2分离群体;并利用BSA分池法结合二代测技术进行白粉病基因的初步定位;在此基础上在进一步在候选区段内开发分子标记,对白粉病抗性基因进行精细定位。1 材料与方法
试验于2013年—2016年在青岛市农业科学研究院进行。1.1 试验材料
试验材料由青岛市农业科学研究院蔬菜研究所黄瓜课题组提供。母本自交系‘74’(简称74)为2003年从青岛国际种苗有限公司引进的华北型黄瓜种质,为高抗白粉病的自交系;父本自交系‘80’(简称80)为2001年从日本引进的华南型黄瓜种质,是高感白粉病的自交系。74×80杂交获得F1种子,F1自交获得233个F2单株。用于接种鉴定的病菌是单囊壳白粉菌Sphaerotheca fuliginea(Schlecht.exFr.)Poll.),由青岛市农业科学院蔬菜研究所黄瓜课题组提供,2015年3—5月在青岛市农科院李沧试验基地进行接菌鉴定。1.2 黄瓜白粉病成株抗性鉴定
将黄瓜自交系‘74’、自交系‘80’以及杂交F1和F2代种子浸泡催芽后播种于经高温灭菌的营养土中。黄瓜幼苗植株长至5—6叶期,将其移栽至黄瓜塑料大棚内。待黄瓜植株长至14—15叶期时,用小型手持喷雾器将接种液均匀地、充分地喷在黄瓜整个植株叶片的正、反两面,直至叶片透湿。接种后,大棚内湿度控制在70%—80%,温度控制在25—28℃,持续黑暗12—16 h后恢复正常光照,15 d后进行病情调查。植株病情鉴定方法和分级标准参考2010年国家农业行业标准-黄瓜抗白粉病鉴定技术规程(NY/ T1857.2—2010)[18]。病情分级标准根据病斑面积和感病程度分为6个级别:0级:无任何病症;1级:病斑面积占叶面积的1/3以下,白粉状病斑模糊不清;3级:病斑面积占叶面积的1/3—2/3,白粉状病斑较为明显,但分散不连片;5级:病斑面积占叶面积的2/3以上,白粉状病斑连片,叶片开始变黄;7级:白粉层浓厚,由叶缘向里变褐;9级:叶片变褐坏死斑面积占叶面积的2/3以上,叶缘上卷[18]。
1.3 黄瓜DNA的提取和PCR扩增
采用改良的CTAB法[19]提取亲本、F2单株基因组DNA。用1%琼脂糖凝胶电泳检测DNA纯度,用紫外分光光度计检测其浓度,根据测定结果将样品稀释到50 ng·µL-1备用。PCR反应体系20 µL,含100 ng基因组DNA 2 µL、10×PCR缓冲液2 µL、25 mmol·L-1 MgCl2 2 µL、20 mmol·L-1dNTPs 0.4 µL、2 µmol·L-1上下游引物各0.75 µL、1 U TaqDNA聚合酶0.05 µL,ddH2O补至20 µL。反应程序为94℃预变性4 min;94℃变性30 s,51—54℃退火30 s,72℃延伸45 s,循环35次;72℃延伸5 min,4℃冰箱保存。扩增产物用5%的变性聚丙烯酰胺凝胶50 W恒功率电泳分离,银染显色后进行数据分析。1.4 抗感池的建立和及重测序
根据田间接种调查得到的黄瓜单株病情指数结果,从F2群体中选择抗病性最好及感病最严重的极端材料构建抗感池。抗感池包含20个单株,单株取其幼嫩叶片并提取DNA后,单株取等量DNA混合构建抗感池。将20 µg抗感池基因组DNA进行建库测序,采用Illumina Hiseq 2000测序仪进行双末端(pair-ended)测序,得到的读长为2×100 bp,要求获得5 GB数据量(深圳华大基因)。
对质量控制后的序列数据比对黄瓜参考基因组,获得抗感池的SNP位点信息,计算SNP-index值[20]。
1.5 定位所用的分子标记
本研究所用标记包括两部分。290对SSR标记来源于高密度黄瓜SSR遗传图谱[21]。针对候选区段的序列在两个亲本间的差异,利用Primer Premier 5软件设计38对In/Del标记[22]。1.6 遗传作图
将候选染色体的分子标记对F2群体进行多态性检测,统计各单株带型,与自交系‘74’带型一致的记为“A”,与自交系‘80’带型一致的记为“B”,杂合记为“H”,缺少或不正常条带均记为“-”。最后利用QTL IciMaping软件计算分子标记与目的基因之间的遗传距离,并绘制连锁图谱[23]。2 结果
2.1 表型鉴定与遗传分析
本研究论文中选用的亲本自交系‘74’对白粉病菌表现免疫(0级),而自交系‘80’对白粉病菌表现为感病(7级)(图1)。为了分析自交系‘74’对白粉病成株抗性的遗传,对F1植株接种白粉病菌,所有F1植株均感白粉病,且具有与其感病亲本自交系‘80’相似的侵染型(5级),介于双亲之间,说明自交系‘74’对白粉病的抗性是不完全隐性的。F2群体单株的发病级别为1—9,平均值为4.55;其中1级发病植株占32.4%,3级发病植株占13.2%,5级发病植株占20.5%,7级发病植株占11.9%,9级发病植株占21.9%,F2群体中发病级别呈现连续分布。表明抗病亲本中含有的抗病性状可能是由数量性状控制。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1供试黄瓜抗感亲本体接菌后表型(A:74;B:80)
-->Fig. 1Parents phenotypes after inoculation (A:74; B: 80)
-->
2.2 抗性基因的初步定位
本研究中选择F2群体中抗感极端材料各20株构建白粉病抗感池。如图2所示,在抗性池中,在第5染色体22—25 Mb区间SNP-index接近0,说明该位点与参考基因组序列基本一致;而在感病池中在同一区间SNP-index接近1,说明该位点与参考基因组序列存在序列差异。观察两个池在同一区间的SNP-index值相减后得到Δ(SNP-index)数值,可以看出,22—25 Mb的Δ(SNP-index)值大于0.5,并显著大于0(P<0.05);15—20 Mb的Δ(SNP-index)值在0.25—0.35。由此,确认第五号染色体15—25 Mb区段为白粉病抗性基因的候选区域,将该基因暂命名为PM74。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2抗感池SNP检测结果
图中箭头指示处为目标区段
-->Fig. 2Detection results with SNP markers in the resistant (Br) and susceptible (Bs) bulks
The arrow indicate the target region
-->
2.3 抗性基因的精细定位
为了进一步定位PM74在5号染色体的位置,利用位于5号染色体的290个SSR标记、38个In/Del标记和12对PCR标记,共筛选获得在抗感亲本间存在多态性的23对SSR标记、10对In/Del标记和2对PCR标记,利用上述多态性标记对F2单株进行连锁分析。结合F2单株抗病性表型分析,共预测到1个白粉病抗性相关QTL(PM74),位于标记SSR15321和SSR07531之间,遗传距离为3.06 cM,LOD值21.99,可解释41.95%的表型变异(图3)。利用GUGI提供基因组数据,标记SSR15321位于5号染色体17 443 753—17 443 896位置;SSR07531位于5号染色体17 208 433—17 205 452位置,这与利用BSA混池测序鉴定的结果一致。最终将黄瓜抗白粉病基因PM74锁定在5号染色体第17 443 896—17 205 452碱基之间,物理距离为238 444 bp。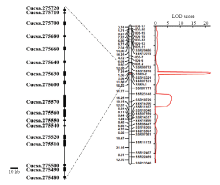 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3黄瓜白粉病抗性基因精细定位
-->Fig. 3Fine mapping of powdery mildew resistance gene in cucumber
-->
2.4 候选基因的预测分析
结合Phytozome数据库中的注释数据及NCBI比对,在候选区段内预测到17个有功能注释的基因(图3和表1)。这些基因编码的蛋白类型包括MYB转录因子(Cucsa.275510)、植物自交不亲和蛋白(Cucsa. 275540和Cucsa. 275550)、PPR蛋白(Cucsa.275720)等。其中,还包含有一个TIR-NBS-LRR蛋白(Cucsa. 275630)。Table 1
表1
表1候选区段基因信息
Table 1Gene information in the candidate regions
| 基因名称 Gene name | 基因注释 Gene annotation |
|---|---|
| Cucsa.275480 | 捕光叶绿素A/B结合蛋白 Chlorophyll A-B binding protein |
| Cucsa.275490 | 真核细胞内膜蛋白(DUF1751) Eukaryotic integral membrane protein (DUF1751) |
| Cucsa.275500 | 跨膜蛋白家族 Tetraspanin family |
| Cucsa.275510 | Myb相似蛋白 Myb-like DNA-binding domain |
| Cucsa.275520 | 假尿苷酸RNA合成酶 RNA pseudouridylate synthase |
| Cucsa.275540 | 自交不亲和蛋白S1 Plant self-incompatibility protein S1 |
| Cucsa.275550 | 自交不亲和蛋白S1 Plant self-incompatibility protein S1 |
| Cucsa.275560 | 转录起始因子IIF, beta亚基 Transcription initiation factor IIF, beta subunit |
| Cucsa.275570 | 类阻凝蛋白 Myosin-like coiled-coil protein |
| Cucsa.275600 | 溴蛋白 Bromodomain |
| Cucsa.275630 | TIR-NBS-LRR相似蛋白 TIR-NBS-LRR like protein |
| Cucsa.275640 | 机动蛋白 Plant mobile domain |
| Cucsa.275660 | 线粒体质子转运ATP合成器复合体 Assembly, mitochondrial proton-transport ATP synth complex |
| Cucsa.275680 | 伸长因子Tu GTP Elongation factor Tu GTP binding domain |
| Cucsa.275700 | IQ钙调素结合蛋白 IQ calmodulin-binding motif |
| Cucsa.275710 | 未知功能蛋白(DUF260) Unknown Protein (DUF260) |
| Cucsa.275720 | PPR家族PPR Protein family |
新窗口打开
3 讨论
MICHELNORE等[24]最早利用群体分离分析法(bulked segregant analysis)在莴苣中筛选到与抗病基因紧密连锁的分子标记,简称BSA法。此后,BSA 法与不同类型的分子标记(RFLP、RAPD、SSR标记等)相结合,广泛地应用于作物重要农艺性状的关键基因定位研究中,显示出巨大的应用潜力和发展前景[25]。近年来,测序技术的快速发展,也随之产生了基于全基因组重测序的BSA-seq技术。BSA-seq技术将基因组测序技术与极端性状个体DNA混池有机结合,使基因定位克隆又迎来了一个新的阶段[26]。本研究构建了各包含20个单株的抗、感池,通过基因组重测序获得5 Gb的序列,将候选基因初步定位于黄瓜5号染色体的15—25 Mb处。目前,在黄瓜白粉病抗性基因QTL的定位研究上已经有大量的报道,张桂花等[3]利用F2分离群体,通过构建抗感池,获得一个AFLP标记,与黄瓜的白粉病抗性基因连锁,遗传距离为5.56 cM。简德明[7]获得与黄瓜白粉病感病基因连锁的AFLP标记(P63M51- 384)和SCAR标记(PMSCAR-300),连锁距离均为7 cM。此外,还有利用SSR标记开展抗性基因定位的研究,张海英等[27]获得2 个与黄瓜白粉病主效抗病基因连锁的SSR分子标记SSR97-200和SSR273-300,连锁遗传距离分别为5和13 cM。此外,聂京涛等[28]研究认为SSR标记SSR15592与黄瓜白粉病基因紧密连锁,且与抗性基因的遗传距离为7.62 cM。SSR连锁标记的获得也使得开展黄瓜白粉病分子育种成为可能。同样,在黄瓜白粉病研究中也有大量关于QTL定位的研究报道,例如张圣平等[13]检测到1个白粉病的抗性基因的QTL位点,其中位于5号染色体的pm5.2位点的效应最强。XU等[29]在1号染色体上检测到1个白粉病抗性基因QTL位点Pm1.1,位于S6472和SSR16881之间,物理距离为41.1 kb,在该区段预测到8个候选基因。XU等[30]在5号染色体上发现了与Pm5.1抗性有关的8个候选基因,包括编码受体蛋白激酶基因、转录因子和热激蛋白基因等。值得注意的是,多数白粉病抗性基因定位在5号染色体。本研究中,PM74基因定位于5号染色体SSR07531和SSR15321标记之间,物理距离为238 444 bp,包含一个TIR-NBS-LRR Like基因。
NBS是一类非常重要的抗病基因,在其他作物中有大量报道的抗性基因属于NBS类基因,例如小麦抗条锈病基因Yr10(CC-NBS-LRR),小麦抗秆锈病基因Sr33(CC-NBS-LRR),大麦中白粉病基因Mla1(CC-NBS-LRR),亚麻中的锈病基因L6(TIR-NBS-LRR)和M(TIR-NBSLRR)[31,32,33,34,35]。而黄瓜中也有关于NBS类基因的报道,张圣平在5号染色体上定位到的白粉病抗性基因候选区段包含4个NBS类抗病基因[13],依据标记信息比对基因组数据库发现,PM74所在区段与张圣平等[13]所定位的基因并不在同一个scaffold,初步认定PM74是不同于其所定位的基因。同样,NIE等[36]定位的基因是位于scaffold000038,与PM74也不在同一个scaffold。初步认为PM74是位于5号染色体的一个新的抗性基因,还需要进一步的试验验证。
4 结论
在黄瓜‘74’自交系的5号染色体15—25 Mb处检测到一个贡献率为41.95%的白粉病抗性基因,初步命名为PM74。该抗性基因位于SSR15321和SSR07531之间,遗传距离为3.06 cM,物理距离为238 444 bp。该预测候选区段内包含有17个基因,其中Cucsa. 275630为TIR-NBS-LRR类基因。The authors have declared that no competing interests exist.
