0 引言
【研究意义】卵泡发育是一个复杂的生理过程,受动物遗传、体况、内分泌激素和卵泡内生长因子等多方面因素的综合调控。目前,对卵泡发育影响的研究多集中在单胎动物上,基因组测序技术的发展,为其生物学研究提供了更全面、便利的平台。本研究通过对不同生理状态牛卵泡的高通量测序来筛选与卵泡发育相关的基因,对全面分析牛卵泡发育的关键调控因子具有重要意义,同时为阐明牛卵泡发育的调控机理奠定基础。【前人研究进展】在卵泡发育过程中,基因转录和蛋白表达等一系列关键事件是通过特定基因顺序表达基础上完成的,是调控卵泡募集、选择及卵泡细胞凋亡的内在因素[1]。因此,研究者通过基因芯片和新一代高通量测序技术对影响动物卵泡发育的相关调控基因展开了研究,TERENINA等[2]通过基因芯片技术对猪闭锁卵泡和健康卵泡颗粒细胞(granulesa cells, GCs)全基因表达谱进行分析,共发现1 684个差异表达的调控基因,其中两个转录组共有287个高表达基因,有11个差异表达基因(DKK3, GADD45A, CAMTA2, CCDC80, DAPK2, ECSIT, MSMB, NUPR1, RUNX2, SAMD4A和ZNF628)可能是卵泡闭锁的标记基因。TICIANELLI等[3]对不同品种牛和不同应激温度处理组卵泡的卵母细胞、卵丘细胞进行转录组分析,共获得127个卵泡发育相关基因,qRT-PCR检测发现KIF3A在荷斯坦奶牛卵泡细胞中表达显著上调,促凋亡基因DAP和膜转运基因DENND3则显著下调。课题组前期也通过Illumina测序平台对牛第一卵泡波的最大卵泡(PDF1)和出现优势化的最大卵泡ODF1进行转录组测序,获得的83个差异表达基因中,有42个属于上调基因,41个属于下调基因,其中PPM1K, BEX2, CYP19A1, PRSS23 GREB1, SERPINE2, INHBA, CYP11A1, INHA, TNFAIP6和OPTN被认为是与牛卵泡发育密切相关,如CYP19A1和CYP11A1直接参与类固醇激素的生物合成[4]。【本研究切入点】PDF1和第一卵泡波的第二大卵泡(PDF2)是牛卵泡发育波中具有显著生理特征的两个发育阶段,随着卵泡的进一步发育,PDF1最终可能出现优势化进而成为优势卵泡(dominant follicles, DF),而PDF2卵泡必将成为从属卵泡(subordinate follicles, SF),本研究以牛第一卵泡波PDF1和PDF2作为研究对象筛选卵泡发育相关基因,并通过qRT-PCR交叉检测DF和SF中这些基因的表达谱,具有可靠的理论依据。【拟解决的关键问题】试验中运用转录组测序技术、qRT-PCR技术研究影响牛卵泡发育的调控基因,并从功能上进行验证分析,提高了卵泡发育基因筛选的准确性。1 材料与方法
1.1 试验动物及样品采集
选取8头10月龄海福特青年母牛(2013年9月),同期发情(前列腺素F2α)处理后,B超声波监测并记录卵泡的生长状况,山西省文水县胡兰镇肉牛屠宰厂屠宰并采集第一卵泡波优势化前的PDF1(直径6—8 mm)和PDF2(直径5—6 mm),该阶段的卵泡处于发情开始5 d内[5,6]。qRT-PCR试验中DF和SF的采集通过卵泡黄体形态观察和雌激素/孕酮比值进行确定,具体方法参照课题组前期研究[7]。采集后的双侧卵巢放入灭菌的DPBS中,实验室分离GCs。1.2 试验方法
1.2.1 Illumina平台测序 分离PDF1和PDF2卵泡GCs,提取总RNA后Illumina平台对PDF1和PDF2转录组测序,具体方法参照课题组前期研究[4, 8]。1.2.2 差异表达基因的筛选及GO分析 参照AUDIC等[9]的算法,将Illumina平台对PDF1和PDF2测序得到的结果进行数据库比对,设定RPKM≥0.5,获得有意义的表达基因;设定参数:PDF1 RPKM /PDF2 RPKM>2及PDF2 RPKM /PDF1 RPKM>2,FDR校正的P-value<0.05,获得差异表达基因;应用DAVID v6.8对获得的差异表达基因进行GO(Gene ontology)功能显著性富集分析(P-value<0.05),Excel作图。
1.2.3 反转录及引物设计 提取DF和SF颗粒细胞总RNA,反转录反应条件为:7℃ 15 min,85℃ 5 s,-20℃保存;参考NCBI上提交的Bos taurus(Calve)各基因的序列,Primer 3.0设计引物(表1),将RPLP0作为内参基因,引物合成由北京六合华大完成。
Table 1
表1
表1荧光定量引物
Table 1Primers of quantitative PCR
| 基因类型 Genotype | 基因名称 Gene symbol | 引物序列(5′-3′) Primer sequence |
|---|---|---|
| 目的基因 Target gene | PRSS35 | F: GTGGTGACCGCCTTAGGAATA R: AAAGCATCAACCCGAAGAACA |
| PTGFR | F: CTGAAGCGTGTATTTGGTCTA R: CTGAGGCTATGTAACGAGGAG | |
| ARID4B | F: AGTCTTCTTCATCCTCCAGTG R: CAGTCAGGACATACCACCAAT | |
| GPR116 | F: TCGAGGTGTCAACAGTCTGC R: TAAGGCAACTGCAGTGATGC | |
| APOA1 | F: CTCCTGGACAACTGGGACAC R: CCAGGTTGTCCCAGAACTCC | |
| CPXM1 | F: CCAGGAGTGGGAGAACAACAAA R: CAGAAATGACGGCATCAGCAA | |
| 内参基因 Reference gene | RPLP0 | F:CAACCCTGAAGTGCTTGACAT R:AGGCAGATGGATCAGCCA |
新窗口打开
1.2.4 qRT-PCR检测 依据qRT-PCR检测技术要求,数据需经内参基因校正、物理校正和重复校正,扩增前先制作标准曲线。根据标准曲线和不同基因的扩增条件进行qRT-PCR反应,构建20 μL反应体系,试验流程参照qRT-PCR说明书进行;反应条件:95℃变性10 s,95℃ 5 s,60℃ 25 s,40个循环。
1.3 统计分析
采用△△CT法计算各目的基因的相对表达量,各基因的相对表达水平=2-△△CT。结果采用均值±标准差表示,各基因的表达量经内参基因RPLP0表达量校正,设定TEDDM1在DF的表达量作为对照组[10],实验数据运用SPSS(V 18.0)统计软件进行t检验分析。2 结果
2.1 高表达基因筛选
将Illumina平台对PDF1和PDF2测序得到的结果进行数据库比对,设定RPKM≥0.5,共获得15 760个基因,表2中列出了表达量最高的10个基因,从中可以发现一些基因是已经明确了与卵泡发育直接相关,如卵泡抑素(follistatin, FST)和抑制素β(inhibin, beta A,INHBA)都属于负调控卵泡发育的因子。Table 2
表2
表2转录组PDF1和PDF2中表达量最高的10个基因
Table 2Top 10 highly expressed genes in PDF1 and PDF2 follicles
| 基因名称 Gene symbol | PDF1-RPKM | PDF2-RPKM |
|---|---|---|
| Glutathione S-transferase alpha3 (GSTA3) | 12445.32 | 12815.54 |
| 5.8S ribosomal RNA (RN5-8S1) | 9330.16 | 12506.60 |
| Serglycin (SRGN) | 8808.27 | 9501.33 |
| Hypothetical LOC100337434 | 7026.76 | 7955.30 |
| Serpin peptidase inhibitor, clade E, member 2 (SERPINE2) | 6816.85 | 7124.70 |
| Inhibin, beta A (INHBA) | 5824.46 | 6115.10 |
| 18S ribosomal RNA (RN18S1) | 4431.16 | 5947.28 |
| Cytochrome C oxidase subunit I-like (LOC100299681) | 5017.21 | 4322.93 |
| Follistatin (FST) | 3435.17 | 3968.98 |
| Cytochrome c oxidase subunit I-like (LOC100301020) | 3252.12 | 2830.21 |
新窗口打开
2.2 差异表达基因筛选及GO分析
数据库比对结果设定参数:RPKM≥0.5,PDF1-RPKM /PDF2-RPKM>2,FDR校正P<0.05,共获得196差异表达基因,表3列出了前10个高差异上调基因及其功能;设定参数PDF2-RPKM /PDF1-RPKM>2,FDR校正P<0.05,共获得67差异表达基因,表4列出了前10个高差异下调基因及其功能。应用DAVID v6.8对263个筛选出的差异表达基因进行GO功能聚类分析,共分为三大类90组:其中生物学过程占64.4%,细胞组分占17.8%,分子功能占17.8%(图1)。Table 3
表3
表3转录组PDF1和PDF2中的上调基因及其功能
Table 3List of up-regulated genes in PDF1 vs. PDF2 and their functions
| 基因名称 Gene symbol | PDF1- RPKM | PDF2- RPKM | PDF1/PDF2 | P-value | 基因功能 Gene function |
|---|---|---|---|---|---|
| SERINC5 | 6.44 | 0.54 | 11.93 | 1.94×10-2 | 与L丝氨酸的跨膜活性相关 Transmembrane activity of L-serine |
| ALDH1A1 | 10.34 | 1.22 | 8.48 | 6.20×10-3 | 调节脂肪代谢 Regulate fat metabolism |
| CXCL14 | 5.39 | 0.64 | 8.42 | 3.93×10-3 | 维持巨噬细胞稳定 Maintain macrophage stability |
| CYP17A1 | 5.10 | 0.62 | 8.23 | 参与雌激素合成和胎儿性别发育 Estrogen synthesis and fetal gender development | |
| LOC785462 | 6.14 | 0.77 | 7.97 | 6.16×10-8 | 参与类固醇合成 Anabolic steroids |
| GJA5 | 4.46 | 0.62 | 7.19 | 参与细胞缝隙连接 Cell gap junction | |
| HGSNAT | 11.23 | 1.60 | 7.02 | 3.63×10-2 | 调节细胞新陈代谢 Cell metabolism |
| MGP | 19.80 | 2.93 | 6.76 | 抑制骨和软骨形成 Inhibit bone and cartilage formation | |
| LOC100295148 | 5.29 | 0.83 | 6.37 | 9.40×10-4 | — Unknown |
| OGN | 5.06 | 0.84 | 6.02 | 9.78×10-3 | 参与骨形成 Bone formation |
新窗口打开
Table 4
表4
表4转录组PDF1和PDF2中的下调基因及其功能
Table 4List of down-regulated genes in PDF1 vs. PDF2 and their functions
| 基因名称 Gene symbol | PDF2- RPKM | PDF1- RPKM | PDF2/PDF1 | P-value | 基因功能 Gene function |
|---|---|---|---|---|---|
| LOC100335298 | 4.29 | 0.71 | 6.04 | 1.06×10-3 | 羧肽酶活性 Carboxypeptidase activity |
| ETNK2 | 132.52 | 22.35 | 5.93 | 参与磷脂酰乙醇胺生物合成 Phosphatidyl ethanolamine biosynthesis | |
| DACH1 | 5.88 | 1.26 | 4.67 | 4.05×10-2 | 细胞发育过程中调节细胞凋亡 Regulate cell apoptosis |
| LOC100295214 | 2.12 | 0.53 | 4.00 | 2.52×10-7 | 参与胚胎形态发生 Embryogenesis |
| ZBTB7B | 2.74 | 0.69 | 3.97 | 纤连蛋白和细胞外基质基因的阻遏物 The repressors of fibronectin and extracellular matrix genes | |
| LOC100297097 | 2.24 | 0.58 | 3.86 | 2.61×10-9 | — Unknown |
| USP25 | 5.01 | 1.35 | 3.71 | 4.65×10-3 | 调节细胞内蛋白降解、细胞周期及应激反应 Regulate protein degradation, cell cycle and stress response in cells |
| LOC100140123 | 2.48 | 0.69 | 3.59 | 6.77×10-9 | — Unknown |
| C28H10orf10 | 2.45 | 0.69 | 3.55 | 4.16×10-7 | 参与自体吞噬 Autophagy |
| MAP3K3 | 5.49 | 1.63 | 3.37 | 2.74×10-8 | 调节ERK和MEK1/2信号通路 Regulate ERK and MEK1/2 signaling pathways |
新窗口打开
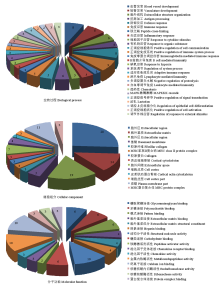 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1差异表达基因GO分析饼状图数字表示基因富集数
-->Fig. 1GO analysis of differentially expressed genes between PDF1 vs. PDF2 The numbers in pie chart represent the numbers of gene enrichment
-->
2.3 牛卵泡发育相关基因的筛选及qRT-PCR验证分析
筛选出的263个差异表达基因,经Genecards功能查询分析,共获得6个基因与卵泡发育关系较为密切。其中上调基因分别为PRSS35, PTGRF, ARID4B, GPR116;下调基因为APOA1和CPXM1(表5)。qRT-PCR分析结果显示(图2),6个基因在DF和SF的表达变化趋势与高通量测序结果相一致,其中PRSS35和ARID4B在DF中的表达量显著高于SF(P<0.05);CPXM1在SF中的表达量极显著高于DF(P<0.01);PTGRF, GPR116和APOA1在DF和SF中的表达量不存在显著差异(P>0.05)。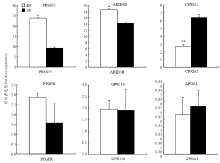 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2各基因在牛DF与SF的表达差异分析**和*分别表示在显著水平0.01和0.05的结果 Superscript
-->Fig. 2qRT-PCR analysis of candidate genes mRNA in DF vs. SF** and * indicate significantly different at the level of 0.05 and 0.01
-->
Table 5
表5
表5PDF1/PDF2和PDF2/PDF1转录本中筛选卵泡发育相关基因
Table 5Candidate genes associated with follicular development selected by PDF1/PDF2 and PDF2/PDF1 transcript analysis
| 基因名称 Gene symbol | PDF1-RPKM | PDF2-RPKM | PDF1/PDF2 | PDF2/PDF1 | 基因功能 Gene function |
|---|---|---|---|---|---|
| PRSS35 | 134.05 | 23.36 | 5.74 | — | 参与排卵及黄体的形成和退化 Ovulation and corpus luteum formation and degeneration |
| PTGFR | 3.80 | 1.23 | 3.09 | — | 促黄体溶解,调节子宫平滑肌收缩 Promote dissolution of corpus luteum, regulate uterine smooth muscle contraction |
| ARID4B | 6.88 | 2.88 | 2.39 | — | 参与细胞生长及周期调控 Cell growth and cycle regulation |
| GPR116 | 4.19 | 1.85 | 2.27 | — | 调节细胞增殖和细胞周期 Cell proliferation and cell cycle |
| APOA1 | 126.56 | 297.92 | — | 2.35 | 参与胰岛素抵抗及激活精子运动 Insulin resistance and activation of sperm motility |
| CPXM1 | 27.28 | 62.09 | — | 2.28 | 对细胞生长发育具有调节作用 Cell growth and development |
新窗口打开
3 讨论
动物卵泡发育是一个复杂的生理过程,受到基因、蛋白水平以及内分泌激素等多方面调控,因此,动物卵泡发育的关键调控因子及作用机理仍不明确。转录组水平的研究是对特定组织或细胞在不同生理状态下所有RNA转录集合的全方位分析,其显著特点是测序通量高,可深度挖掘研究对象中各基因表达的细微变化[11,12]。与基因芯片技术相比较,新一代测序技术在基因挖掘、表达灵敏度方面优势明显;MARIONI等[13]对动物组织采用基因芯片和新一代测序技术进行了对比研究,发现在相同的FDR校正下,Illumina技术获得的差异表达基因比基因芯片多检测出30%;同时,Illumina测序结果重复性好,技术误差也较小[14]。因此,本试验通过Illumina技术对牛卵泡转录组PDF1和PDF2进行深度测序,结合Genecards功能查询共筛选出6个差异表达基因与卵泡发育相关;经qRT-PCR检测确定了各基因差异表达趋势与转录组测序结果相一致,其中PRSS35和ARID4B在DF中的表达量显著高于SF(P<0.05),CPXM1在SF中的表达量极显著高于DF(P<0.01)。
PRSS35(Serine protease 35)是以丝氨酸为活性中心的蛋白水解酶,在动物体内主要通过抑制或激活蛋白酶原,参与蛋白质的合成与降解[15]。其生理功能的执行主要通过丝氨酸蛋白酶抑制剂(serine protease inhibitor,SPI)的调节,在病原入侵、细胞分化、组织重建、血管形成和胚胎发育等过程中都发挥着重要作用[16]。WAHLBERG等通过基因芯片技术对参与小鼠排卵期的蛋白酶进行了鉴定,其中,PRSS35在促性腺激素诱导下表达上调;深入研究促性腺激素诱导的未性成熟的小鼠和假孕小鼠黄体期PRSS35的表达谱发现,PRSS35在发育卵泡的膜细胞层表达,并强烈诱导排卵期前的卵泡GCs表达该基因;同时,在黄体的形成和退化过程中PRSS35也有表达;这些结果表明PRSS35可能参与了动物排卵以及黄体的形成和退化[17]。LI等研究也表明PRSS35在排卵期和黄体期存在较高水平的表达,类固醇替代实验研究表明卵泡破裂之前的PRSS35 mRNA的表达依赖于黄体酮的调节[18]。
ARID(AT rich interactive domain)即核苷酸AT富集区域,主要存在于DNA双螺旋大沟中,该区域呈螺旋-转角-螺旋结构,在生物进化过程中高度保守。该特殊区域最先在果蝇Dri基因[19]以及鼠Bright特异性转录因子[20]上发现。目前,在人和动物中共发现15个ARID家族基因,7个亚家族之间ARID结构域的核苷酸和氨基酸序列相似性均较低[21]。ARID蛋白家族在动物体内执行广泛的生理功能,如在基因表达调控、细胞分化、增殖和分裂以及染色体重塑过程中发挥重要作用[22]。ARID4有ARID4A和ARID4B两个异构体,二者氨基酸序列相似性为74%,其显著特点是二者均包含一个TD(Tudor domain)和CD(Chrome domain)结构域。CAO等研究表明在细胞生长间期,ARID4过表达会引起转录因子E2F依赖性基因转录沉默,抑制细胞进入DNA合成期,从而阻碍细胞正常生长,这表明ARID4具有转录抑制活性[23]。动物正常组织中,ARID4B的表达具有规律性并受到严格限制,由于其在人癌组织表达丰富,ARID4B通常作为标记物用于早期肿瘤检测[24]。本研究发现,ARID4B在牛第一卵泡波DF颗粒细胞中表达量显著高于SF(P<0.05),而第一卵泡波中的DF最终不排卵,因此,ARID4B可能在DF的生长发育过程中阻碍颗粒细胞的增殖和雌激素的分泌,从而抑制了排卵。
羧肽酶(carboxypeptidases)是专一性从多肽链C-末端逐个降解并释放游离氨基酸的肽链外切酶,在生物体各组织器官中广泛分布,发挥重要生理功能[25]。羧肽酶依据活性中心金属离子和氨基酸残基的不同,可分为半胱氨酸羧肽酶、金属羧肽酶、丝氨酸羧肽酶[26]。编码金属羧肽酶蛋白(carboxypeptidase X, Member 1,CPXM1)也称为CPX1,其氨基酸序列中包含有一个由160个氨基酸构成的DSD蛋白结合后区域[27]。GO功能聚类分析显示,CPXM1具有金属羧肽酶活性并与锌离子连接有关,其功能是将肽链C-末端降解为精氨酸和赖氨酸短肽,选择性地对肽类激素进行加工和修饰[28]。有研究表明,小鼠通过基因点突变造成机体羧肽酶E缺乏,但小鼠仍具有完整的神经内分泌调节能力,这表明各类羧肽酶之间肽类激素加工及其调节存在相互替代的现象;进一步通过原位杂交对小鼠胚胎和胎儿组织研究发现,从头到胸部CPXM1均有表达,提示神经内分泌肽可能通过CPXM1的加工,实现对细胞间相互作用的调节,从而对细胞生长和发育产生调控作用[29]。目前对CPXM1功能研究的相关报道较少,UEHIRO等[30]研究表明,CPXM1的表达受表观遗传调控,在乳腺癌发展过程中作为肿瘤抑制基因存在。
综上所述,通过转录组数据分析并结合Genecards功能查询筛选调控卵泡发育相关基因,为进一步对影响卵泡发育各信号通路关键蛋白的功能研究及调控网络基因扰动研究提供了依据,也为深入探讨卵泡发育调控机理奠定了基础。
4 结论
牛第一卵泡波的最大卵泡和第二大卵泡转录组测序共获得15 760个转录本,其中筛选出263个差异表达基因;经Genecards基因功能注释分析,4个上调基因PRSS35, PTGRF, ARID4B, GPR116和2个下调基因APOA1, CPXM1与卵泡发育相关;qRT-PCR分析表明,PRSS35、ARID4B和CPXM1在优势卵泡和从属卵泡表达量存在显著差异,推测在牛卵泡发育过程中可能参与了卵泡的优势化或闭锁。(责任编辑 林鉴非)
The authors have declared that no competing interests exist.
