0 引言
【研究意义】灰葡萄孢(Botrytis cinerea)是一种重要的植物病原真菌,在全球230多种植物上造成灰霉病[1,2]。由于灰葡萄孢的寄主范围广泛,遗传变异速度快,产生的菌核抵抗逆境能力强,使得灰霉病很难防控[3,4,5,6]。随着灰葡萄孢菌株B05.10和T4基因组序列的发布,灰葡萄孢已经成为研究病原物与植物互作的模式真菌[7]。探究灰葡萄孢生长、发育与致病的分子机制,不仅可为制定持久控制灰霉病的策略提供理论依据和实践基础,同时对研究其他真菌的遗传、发育和致病性具有重要参考价值。【前人研究进展】灰葡萄孢的cAMP信号途径在病菌生长、发育和致病过程中发挥着重要的调控作用[8],该途径中包括3个编码异源三聚体G-蛋白Gα亚基(B. cinerea Gα subunits)的基因bcg1[9,10]、bcg2[11]和bcg3[12],腺苷酸环化酶编码基因bac(B. cinerea adenylate cyclase)[13],cAMP依赖的蛋白激酶(the cAMP-dependent protein kinase,PKA)催化亚基基因pka1(PKA catalytic subunit)、pka2(PKA catalytic subunit)和调节亚基基因pkaR(PKA regulatory subunit)[14],这些基因突变均会影响病菌的生长、发育和致病力。bcg1的缺失突变体∆bcg1能够产生分生孢子,穿透植物组织,但不能产生软腐症状[9,10]。bcg2和bcg3的缺失突变体Δbcg2和Δbcg3虽可以侵染寄主,但是侵染速度较野生型缓慢[11,12]。bac的缺失突变体Δbac在寄主体内不能产生分生孢子,但在培养基上的产孢能力不受影响,侵染速度较野生型慢[13]。pka1的缺失突变体Δpka1生长缓慢,不能在寄主叶片上产生病斑,但在寄主叶片上的产孢能力不受影响[14]。pka2的缺失突变体Δpka2在生长速度、分生孢子萌发、侵染寄主等方面与野生型没有明显差别[14]。pkaR缺失会导致突变体组成型激活PKA,使突变体∆pkaR的表型与突变体∆pka1基本一致[14]。【本研究切入点】实验室前期获得了灰葡萄孢致病相关基因BcKMO(B. cinerea kynurenine 3-monooxygenase),明确了BcKMO正调控病菌的生长、发育,负调控病菌的致病力,确定了BcKMO通过调控病菌的胞壁降解酶活性、毒素活性、产酸能力、致病相关基因及信号途径基因的表达而影响病菌的致病力[15,16,17]。但是该基因与病菌cAMP信号途径之间的关系尚未明确。【拟解决的关键问题】通过检测灰葡萄孢BcKMO突变体对cAMP信号途径抑制剂的敏感性、突变体中cAMP含量以及BcKMO与cAMP信号途径关键基因的表达规律、BcKMO突变对cAMP信号途径关键基因表达的影响,以及cAMP信号途径关键基因突变对BcKMO表达的影响,确定BcKMO与cAMP信号途径关键基因之间的关系,为阐明BcKMO调控病菌生长、发育和致病力的分子机制打下基础。1 材料与方法
试验于2017年在河北省植物生理与分子病理学重点实验室/河北农业大学真菌毒素与植物分子病理学实验室完成。1.1 试验材料
灰葡萄孢野生型菌株BC22、BcKMO的T-DNA插入突变体BCG183、回复菌株BCG183/BcKMO、cAMP信号途径关键基因pka1、pka2、pkaR、bcg2、bcg3的RNAi突变体菌株,均由河北农业大学真菌毒素与植物分子病理学实验室保存并提供。1.2 突变体对cAMP信号途径抑制剂的敏感性检测
在灭菌后的PDA培养基中加入cAMP信号途径特异性的抑制剂SQ22536母液,使SQ22536终浓度为10 μmol·L-1,然后接种培养7 d的灰葡萄孢野生型菌株BC22、BcKMO的T-DNA插入突变体BCG183和BcKMO的回复菌株BCG183/BcKMO的菌盘(直径为5 mm),20℃条件下培养,观测病菌菌落的生长速率。同时,以在PDA培养基中加入与SQ22536母液等量的DMSO为空白对照。1.3 突变体中cAMP的含量检测
分别提取灰葡萄孢野生型BC22、突变体BCG183和回复菌株BCG183/BcKMO中的cAMP,利用HPLC检测各菌株中cAMP的含量。cAMP的提取方法:称取约0.1 g样本,加入液氮研磨后,加入1 mL水,并将其转移至1.5 mL离心管中,50℃水浴1 h并且振荡3—4次,8 000×g离心10 min,取上清液,氮气吹干后定容至0.5 mL,涡旋振荡溶解,过滤后待测。HPLC液相条件:Agilent 1100高效液相色谱仪,Kromasil C18反相色谱柱(250 mm×4.6 mm,5 μm),流动相A:一定浓度的KH2PO4水溶液。流动相B:色谱级甲醇1 L,A﹕B=80﹕20。样品进样量10 μL,流速0.8 mL·min-1,柱温30℃,走样时间为20 min,紫外波长254 nm。1.4 BcKMO与cAMP信号途径关键基因的表达规律分析
1.4.1 病菌不同发育阶段、不同部位的基因表达规律分析 分别收集野生型菌株BC22的菌丝生长时期、附着胞发育时期、分生孢子时期和菌核发育时期的菌丝、分生孢子和菌核,提取其RNA,反转录成cDNA。利用real-time PCR技术,以Tubulin作为内参,分析BcKMO和cAMP途径关键基因pka1、pka2、pkaR、bcg2、bcg3的表达规律。反应体系(10 μL):模板cDNA 1.0 μL、Mix(5 U·μL-1) 5 μL、引物(10 μmol·L-1)0.2 μL。反应程序:95℃ 10 min;94℃ 30 s、58℃ 30 s、72℃ 30 s,循环数为35次,每个样品重复3次。1.4.2 不同培养条件对BcKMO和cAMP信号途径关键基因表达的影响 将灰葡萄孢野生型菌株BC22分别接种在含蔗糖、葡萄糖、果糖、甘油的YEB培养基中,在20℃黑暗条件下培养7 d,提取其RNA,反转录成cDNA。以Tubulin作为内参,利用real-time PCR技术,分析pka1、pka2、pkaR、bcg2、bcg3的表达情况。具体反应体系同上。
1.5 BcKMO基因突变对cAMP信号途径关键基因表达的影响
利用real-time PCR技术,检测野生型菌株BC22、突变体BCG183、回复菌株BCG183/BcKMO中cAMP信号途径关键基因的表达水平。以BC22、BCG183、BCG183/BcKMO的cDNA为模板,以Tubulin为内参,用cAMP信号途径关键基因的特异性引物(表1)进行荧光定量PCR检测。Table 1
表1
表1Real-time PCR引物设计
Table 1Real-time PCR primer design
| 基因 Gene | 引物名称 Primer name | 引物序列 Primer sequence (5′-3′) |
|---|---|---|
| Tubulin | Tubulin-F | TCTCCGTCAAGAGTGGGTTG |
| Tubulin-R | ACTGTGGCTACAGGGTACATT | |
| pka1 | pka1-F | CGTCAACCTCTCGCACAACG |
| pka1-R | GACGGTGCTGCTGTTGATCG | |
| pka2 | pka2-F | GGGTTGGGAGCAAGTTCGAG |
| pka2-R | AGCAGGATTCGCAAGGCGTA | |
| pkaR | pkaR -F | ACAGCAAATCGGCCGAGGAT |
| pkaR -R | TCCGGGAACCGCTTGTTCAT | |
| bmp1 | bmp1-F | ATCTCTTTCAATGTCAGCGAGCAAT |
| bmp1-R | ATGGAGTAATCTTCTTGATAGCGAC | |
| bmp3 | bmp3-F | ACAACATGTCCGTGTTCAACCTG |
| bmp3-R | CACGCCAGCTTGCTTGTTCT | |
| bcg2 | bcg2-F | AGCTGGCAACAAACCTCGAA |
| bcg2-R | TCGGTATCGGTGGCGTTTGT | |
| bcg3 | bcg3-F | CGAGCCAGAGAATCCAGCGA |
| bcg3-R | TGTGCCCATCCTTCCAGAAC | |
| BcKMO | BcKMO-F | TTGGAGACCAAGTTCACGGG |
| BcKMO-R | CACAAATGCACCCTTTGGGG |
新窗口打开
1.6 cAMP信号途径关键基因突变对BcKMO表达的影响
利用real-time PCR技术,检测cAMP信号途径关键基因RNAi突变体中BcKMO的表达水平。以cAMP信号途径关键基因RNAi突变体的cDNA为模板,Tubulin为内参,用BcKMO特异性引物(表1)进行荧光定量PCR检测。2 结果
2.1 突变体对cAMP信号途径抑制剂的敏感性
检测灰葡萄孢野生型菌株BC22、BcKMO的T-DNA插入突变体BCG183和回复菌株BCG183/ BcKMO对cAMP信号途径特异性抑制剂SQ22536的敏感性,发现突变体BCG183对抑制剂SQ22536的敏感性明显低于野生型和回复菌株,抑制率测定结果也表现出突变体BCG183受抑制的程度明显降低(图1)。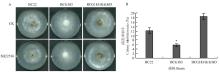 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1突变体对cAMP信号途径抑制剂的敏感性检测
A:敏感性测定; B:抑制率检测. *表示在P<0.05水平上差异显著。下同
-->Fig. 1Sensitivity detection of mutants to cAMP signaling pathway inhibitor
A:Sensitivity detection; B:Detection of inhibition rate. * indicates significantly different at P<0.05 level. The same as below
-->
2.2 突变体中cAMP含量检测
利用HPLC方法,检测灰葡萄孢野生型BC22、突变体BCG183和回复菌株BCG183/BcKMO中的cAMP含量。结果发现,突变体BCG183中cAMP含量明显低于野生型和回复菌株BCG183/BcKMO(图2)。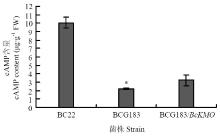 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2突变体中cAMP含量的测定
-->Fig. 2Detection of cAMP content in mutant
-->
2.3 BcKMO与cAMP信号途径关键基因的表达规律分析
2.3.1 病菌不同发育阶段、不同组织部位的基因表达分析 利用real-time PCR技术,以Tubulin作为内参基因,检测在病菌不同发育阶段、不同部位BcKMO和cAMP信号途径关键基因的表达情况。结果发现,BcKMO和cAMP信号途径关键基因在菌丝、分生孢子和菌核中均有所表达,BcKMO在6—8 d的菌丝和菌核中表达水平高;cAMP途径关键基因pka1、bcg2、bcg3的表达规律与BcKMO基本一致,均是在6、7 d的菌丝和菌核中表达水平高;cAMP途径关键基因pka2、pkaR在6、7 d的菌丝中表达水平较高,但在菌核和分生孢子中的表达水平相对较低(图3)。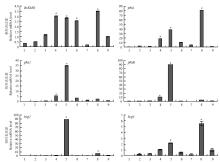 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3BcKMO和cAMP信号途径关键基因的表达规律
1—6:菌丝生长第3—8天; 7:菌丝生长第15天; 8:菌核; 9:分生孢子
-->Fig. 3Expression pattern of the BcKMO and cAMP signaling pathway key genes
The 3rd to 8th day of mycelia growth; The 15th day of mycelia growth; Scleroia; Conidiab
-->
2.3.2 不同培养条件对BcKMO和cAMP信号途径关键基因表达的影响 提取不同培养条件下生长的野生型菌株BC22的总RNA,反转录成cDNA,利用real-time PCR技术,以Tubulin作为内参基因,检测BcKMO和cAMP信号途径关键基因的表达水平。结果发现,BcKMO和cAMP信号途径关键基因均在含果糖的培养基培养的病菌中表达水平最高(图4)。
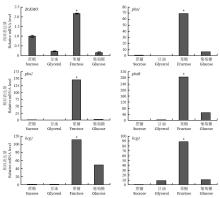 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4不同培养条件对BcKMO和cAMP信号途径关键基因表达的影响
-->Fig. 4Effect of different cultural conditions on expression level of the BcKMO and cAMP signaling pathway key genes
-->
2.4 BcKMO基因突变对cAMP信号途径关键基因表达的影响
利用real-time PCR技术,检测野生型菌株BC22、突变体BCG183和回复菌株BCG183/BcKMO中cAMP信号途径关键基因的表达情况。结果发现,野生型和回复菌株中cAMP信号途径关键基因表达水平基本一致,而在突变体BCG183中cAMP途径关键基因pka1、pka2、pkaR、bcg2、bcg3的表达水平均明显高于野生型和回复菌株(图5)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5突变体BCG183和BCG183/BcKMO中cAMP信号途径关键基因的表达分析
-->Fig. 5Expression level of cAMP signaling pathway key genes in mutants BCG183 and BCG183/BcKMO
-->
2.5 cAMP信号途径关键基因突变对BcKMO表达的影响
利用real-time PCR技术,检测cAMP信号途径关键基因RNAi突变体中BcKMO的表达水平。结果发现,pka1、bcg2的RNAi突变体中BcKMO表达水平明显高于野生型,而pka2、pkaR、bcg3的RNAi突变体中BcKMO表达水平明显低于野生型(图6)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6cAMP途径关键基因的RNAi突变体中BcKMO表达分析
-->Fig. 6Expression level of the BcKMO in RNAi mutants of cAMP signaling pathway key genes
-->
3 讨论
真菌的cAMP信号途径可以参与不同的生物进程,包括病菌的生长[18]、分生孢子形成[19]、分生孢子萌发[20,21,22,23]、次生代谢[24,25]、营养感知[26,27]、应激反应[18,23]、菌核发育[28]、致病性或毒力[29]。灰葡萄孢cAMP信号途径相关基因突变影响病菌的生长、发育和致病力,如bcg1[9,10]、bcg2[11]、bcg3[12]、bac[13]、pka1、pka2和pkaR[14]等基因突变均会影响病菌的生长、发育和致病力。笔者实验室前期明确了BcKMO正调控病菌的生长、发育,负调控病菌的致病力[15,16],但是该基因是否通过病菌的cAMP信号途径起作用,以及该基因与病菌cAMP信号途径关键基因之间的关系尚未明确。本研究发现BcKMO的T-DNA插入突变体BCG183对cAMP信号途径特异性抑制剂SQ22536不敏感,其抑制率明显低于野生型和回复菌株;而回复菌株的抑制率明显高于野生型,这与回复菌株中BcKMO的高水平表达相一致[16],表明BcKMO的表达水平与菌株对抑制剂的敏感性呈正相关。突变体BCG183和回复菌株中的cAMP含量明显低于野生型,且突变体BCG183中的cAMP含量最低,表明菌株中BcKMO的高水平表达和低水平表达均对体内cAMP含量造成影响。进一步研究发现,BcKMO与cAMP信号途径关键基因在表达规律上存在一定的相关性,由此确定BcKMO与病菌的cAMP信号途径密切相关,该基因通过病菌cAMP信号途径对病菌生长、发育和致病力的起调控作用。
利用real-time PCR技术,检测突变体BCG183中cAMP信号途径关键基因的表达水平,发现突变体BCG183中cAMP途径关键基因pka1、pka2、pkaR、bcg2、bcg3的表达水平均明显高于野生型和回复菌株,这说明BcKMO基因突变上调pka1、pka2、pkaR、bcg2、bcg3的表达,表明BcKMO负调控病菌cAMP信号途径关键基因的表达。利用real-time PCR技术,检测cAMP信号途径关键基因pka1、pka2、pkaR、bcg2、bcg3的RNAi突变体中BcKMO的表达水平,发现BcKMO在pka1、bcg2的RNAi突变体中上调表达,在pka2、pkaR、bcg3的RNAi突变体中均下调表达,表明pka1、bcg2负调控BcKMO的表达,pka2、pkaR、bcg3正调控BcKMO的表达。
研究结果确定了BcKMO与病菌cAMP信号途径密切相关,明确了BcKMO与cAMP信号途径关键基因pka1、pka2、pkaR、bcg2、bcg3之间的调控关系,但是BcKMO通过cAMP信号途径调控病菌生长、发育和致病力的分子机制尚未明确,需要进一步的深入研究。
4 结论
灰葡萄孢BcKMO负调控cAMP途径关键基因pka1、pka2、pkaR、bcg2、bcg3的表达。cAMP途径关键基因pka1、bcg2负调控BcKMO的表达,而cAMP途径关键基因pka2、pkaR、bcg3正调控BcKMO的表达。The authors have declared that no competing interests exist.
