0 引言
【研究意义】玉米(Zea mays L.)是世界重要的粮食作物之一,在世界粮食总产量中处于第一位,同时也是重要的饲料和工业原料[1]。但实际生产中玉米常常会因受到诸多不利环境因素的影响而大面积减产,比如干旱、盐胁迫和低温等。SRO(similar to rcd one)是植物所特有的一类小蛋白家族,其在植物的生长发育及应对盐、干旱、重金属等非生物胁迫中发挥着重要作用。对玉米SRO家族基因进行全面的生物信息学、组织特异性表达及盐、干旱胁迫条件下表达进行分析,有利于更深入了解SRO家族基因的功能,并对玉米抗逆基因挖掘和抗逆育种具有重要意义。【前人研究进展】SRO是植物所特有的类RCD-ONE蛋白家族,它们通常包含高度保守的PARP(poly (ADP ribose) polymerase catalytic;PS51059)催化中心和C末端的RST(RCD1-SRO-TAF4;PF12174)保守结构域[2]。目前对SRO蛋白家族的研究主要集中在拟南芥中。据报道,在拟南芥中共鉴定出6个SRO同源基因,分别为AtRCD1、AtSRO1—AtSRO 5[2,3]。AtSRO1与AtRCD1(radical-induced cell death 1)同源性最高,除具有PARR和RST保守结构域外,还具有N端的WWE(PS50918)结构域,属于亚家族A[4],AtSRO2-5仅包含PARP和RST结构域,缺少WWE结构域,属于亚家族B[5]。以往研究表明,PARP-RST结构域是植物所特有的,而WWE-PARP结构域广泛存在于生物体中,且高度保守[6,7]。AtRCD1是植物中首个被鉴定的SRO家族基因,拟南芥中rcd1突变体表现出对盐、寒害、紫外线、MV、以及CO毒害和激素(ABA/JA/ETH)的耐受性的增加,同时影响拟南芥的生长,表现为株高减少、早花、连坐叶片、限制根系生长和生殖发育等[1,5,8-14]。AtSRO1同样参与到非生物胁迫的应激反应,但是与AtRCD1之间有些不同,sro1-1突变体增强盐胁迫下的拟南芥的渗透调节能力,而rcd1—rcd3突变体则表现出对盐胁迫敏感表型[13]。此外,有研究表明AtSRO5可以响应盐胁迫[15],AtSRO2和AtSRO3的转录子也受到O3引起的氧化胁迫诱导[5]。目前SRO家族基因在水稻、小麦、番茄、苹果、陆地棉等作物中有部分研究,其作用和功能也已日益清楚。水稻OsSRO1c蛋白可以与水稻干旱转录因子SNAC1和DST直接作用,通过调节气孔关闭和过氧化氢累积来响应干旱和氧化胁迫[16,17]。小麦Ta-sro1在干旱、高盐和H2O2胁迫条件下均上调表达,可以通过调节植物体内的氧化还原平衡来提高植物生长和抵抗逆境胁迫的能力[18]。番茄SlSRO1与AtSRO5序列相似,且在盐胁迫条件下上调表达,特别是在根系中[19]。苹果中鉴定出6个SRO家族基因,其中MdRCD1被认为是重要的非生物胁迫调节因子,可以增强其耐受盐、干旱、及氧化胁迫的能力[20]。吕有军等[21]在陆地棉中鉴定出12个SRO基因,它们的表达存在组织特异性,且Gh_A08G1390明显受冷处理和盐处理的诱导,Gh_D12G2054、Gh_D08G1685、Gh_A12G2663也受到不同程度胁迫处理的诱导。【本研究切入点】随着研究的深入,植物SRO家族基因功能被越来越多的人所认识,其在植物生长,特别是应答各种非生物胁迫中的作用被日益重视,但是该家族基因在玉米中鲜见报道。【拟解决的关键问题】本研究以玉米全基因组数据为基础,鉴定SRO家族成员,分析基因结构、亚细胞定位、蛋白保守结构域及系统进化关系等信息,明确玉米SRO家族基因在各个组织中的表达特异性和胁迫条件下的表达模式,为解析SRO蛋白功能和抗逆调控作用奠定基础,同时也为玉米抗逆基因挖掘和抗逆育种提供理论参考。1 材料与方法
1.1 试验材料及处理方法
供试玉米材料为B73,玉米不同组织器官(根、茎、叶、雄穗和雌穗)取自B73自交系,采样时期为玉米抽穗期,采样时间为2017年5月23日。取样完成后,液氮速冻,-80℃保存,备用。非生物胁迫于2017年6月8日开始,具体试验如下:选取B73生长饱满的种子,表面消毒杀菌后,28℃催芽2 d,转入1/2 Hoagland培养液中培养7 d后,正常营养液培养至玉米3叶1心,选取生长一致玉米幼苗各12株进行干旱和高盐胁迫处理,每个处理4株,3次重复。干旱胁迫:幼苗置于20% PEG-6000溶液中培养;高盐胁迫:幼苗置于200 mmol·L-1 NaCl溶液中培养,并于处理后0、1、6和24 h采集玉米幼苗和根系样品,液氮速冻,-80℃冰箱保存备用。1.2 玉米SRO基因家族的鉴定及序列分析
以拟南芥全基因组数据库(TAIP)中6个拟南芥SRO蛋白序列为探针,在玉米基因组数据库MaizeGDB(https://www.maizegdb.org/)和Phytozome12.0(https://phytozome.jgi.doe.gov/pz/portal.html)搜索玉米SRO家族候选成员,并利用Pfam和SMART对候选基因进行进一步确认玉米SRO家族基因,同时获得其CDS、氨基酸序列及染色体位置信息。1.3 玉米SRO基因的生物信息学分析
运用Expasy protparam tool(http://web.expasy.org/protparam/)在线工具分析玉米SRO基因家族成员的分子量和等电点;分别运用在线工具Plant-mPloc(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)和SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对SRO进行亚细胞定位和蛋白的二级结构预测。利用GSDS2.0(http://gsds.cbi.pku.edu.cn/)在线工具绘制玉米SRO基因结构图,分析其外显子和内含子结构。利用EMBL-EBI(http://www.ebi.ac.uk/interpro/)分析氨基酸序列的蛋白质保守区,并用IBS1.0软件绘制蛋白保守结构域图。利用MEME(http://meme-suite.org/tools/meme)在线工具对玉米SRO蛋白的保守基序进行预测,参数中预测数目设置为5,长度设置为6—50,其他参数均为默认设置。从水稻基因组获取已知的水稻SRO家族蛋白序列,利用Clustalx(1.83)进行同源序列比对,并利用MEGA6.0软件,采用相邻连接法(Neighbor-Joining,NJ)构建拟南芥、水稻、玉米SRO蛋白家族的系统进化树,校验参数BootStrap重复为1 000次,其他参数均为默认值。1.4 玉米SRO基因家族表达
采用华越洋植物RNA快速提取试剂盒提取玉米样品总RNA,使用Roche第一链cDNA合成试剂盒将提取的总RNA反转录cDNA。根据玉米SRO基因序列,采用Oligo 7软件设计定量引物,上海生工生物工程有限公司合成,引物序列详见表1。实时荧光定量PCR反应在Roche lightCycler480中进行,试剂盒为Thermo Fisher scientific,反应体系10 μL包括SYBR Green Master MIX(2×),5 μL、上下游引物(10 μmol·L-1)各1 μL、cDNA 1 μL和ddH2O 2 μL。反应条件为50℃ 2 min,95℃ 3 min;95℃ 15 s,58℃ 15 s,72 ℃ 30 s,45个循环,3次重复。采用2-ΔΔCt方法进行数据计算,基因的相对表达量使用(平均值±标准差)表示。Table 1
表1
表1ZmSROs实时荧光定量PCR分析所用引物
Table 1Primer sequences used in quantitative real-time PCR analysis of ZmSROs
| 基因名称 Gene name | 上游引物序列 Forward primer sequence (5′-3′) | 下游引物序列 Revers primer sequence (5′-3′) |
|---|---|---|
| ZmSRO1a | CTTACACCAGCAAATCGTTC | TTTAAGGTCGTCTACTCCAC |
| ZmSRO1b | GCAAAGGCTCCAAGCTCA | CCTTTATTAGTTCGCATCGG |
| ZmSRO1c | ATGATAATGGCAAACGCTTC | ACTTCACCAACAGATACCGAA |
| ZmSRO1d | ACGCTTCTTGCAGAGATCCAG | CCACGGTTTTCAGCACTTCGTC |
| ZmSRO1e | ATACGTGGTCAGCTTCAAGTGCTC | ATCCGACCCATCTTGAATCTGCT |
| ZmSRO1f | ATACTTCATGTCCACCGCTA | GCCAGCCATACTTAACATTTGCAT |
| Actin | ACCTTACCAGCCCTTGACATATG | GACTTGACCAAACATCTCACGAC |
新窗口打开
2 结果
2.1 玉米SRO基因的鉴定及序列分析
从玉米基因组数据库中共鉴定到6个SRO家族基因,并按照YOU等[17]方法进行命名,其基因序列信息见表2。6个ZmSROs分别分布于第1、4、5和9染色体,其中ZmSRO1a和ZmSRO1e位于第1染色体,ZmSRO1f位于第4染色体,ZmSRO1b和ZmSRO1c位于第5染色体,ZmSRO1d位于第9染色体。玉米SRO家族基因编码区长度为1 215—1 791 bp;编码氨基酸数目为404—596 aa;分子量为45.23—66.78 kD;等电点为7.01—9.17,均大于7,均为碱性蛋白。亚细胞预测定位4个ZmSROs定位于叶绿体,ZmSRO1f定位于细胞核,ZmSRO1e则定位于过氧化氢酶体中(表2)。Table 2
表2
表2玉米SRO基因家族的序列信息
Table 2Sequence information of SRO family genes in maize
| 基因 Gene | 基因组名称 Genomic name | 染色体位置 Chromosomal location (bp) | CDS (bp) | 氨基酸数目 Number of amino acids (aa) | 分子量 Molecular weight (kD) | 等电点 Isoelectric point | 亚细胞定位 Subcellular localization |
|---|---|---|---|---|---|---|---|
| ZmSRO1a | GRMZM5G866843 | Chr.1:103834719-103838119 | 1791 | 596 | 66.78 | 8.23 | 叶绿体Chloroplast |
| ZmSRO1b | GRMZM2G145236 | Chr.5:44743981-44748577 | 1791 | 596 | 66.65 | 8.02 | 叶绿体Chloroplast |
| ZmSRO1c | GRMZM2G072894 | Chr.5:859812-865046 | 1743 | 580 | 64.79 | 7.01 | 叶绿体Chloroplast |
| ZmSRO1d | GRMZM2G177878 | Chr.9:144869094-144872515 | 1347 | 448 | 48.04 | 9.17 | 叶绿体Chloroplast |
| ZmSRO1e | GRMZM2G122543 | Chr.1:29683943-29687582 | 1296 | 431 | 48.09 | 8.41 | 过氧化物酶体Peroxisome |
| ZmSRO1f | GRMZM2G011469 | Chr.4:183120639-183125222 | 1215 | 404 | 45.23 | 8.14 | 细胞核Nucleus |
新窗口打开
通过对6个ZmSROs蛋白的二级结构预测(表3),结果表明,ZmSROs蛋白的二级结构以α-螺旋和无规则卷曲结构为主,扩展链结构和β-转角结构所占比例较小。其中ZmSRO1a、ZmSRO1b、ZmSRO1c和ZmSRO1f的无规则卷曲结构所占比例最大,为38.76%—46.55%,其次为α-螺旋结构,为28.22%—30.54%;ZmSRO1d和ZmSRO1e的α-螺旋结构所占比例最大,分别为47.10%和43.62%,其次为无规则卷曲结构分别为30.36%和32.25%。
Table 3
表3
表3玉米SRO蛋白的二级结构
Table 3The secondary structure of SRO proteins in maize
| 蛋白质名称 Protein name | α-螺旋 Alpha helix (%) | 扩展链结构 Extend strand (%) | β-转角 Beta turn (%) | 无规则卷曲 Random coil (%) |
|---|---|---|---|---|
| ZmSRO1a | 30.54 | 20.81 | 9.90 | 38.76 |
| ZmSRO1b | 29.03 | 21.98 | 9.23 | 39.77 |
| ZmSRO1c | 30.00 | 17.93 | 5.52 | 46.55 |
| ZmSRO1d | 47.10 | 10.94 | 11.61 | 30.36 |
| ZmSRO1e | 43.62 | 15.08 | 9.05 | 32.25 |
| ZmSRO1f | 28.22 | 19.80 | 8.66 | 43.32 |
新窗口打开
2.2 玉米SRO基因结构、蛋白保守结构域及进化树分析
6个ZmSROs的基因结构图见图1。ZmSRO1a/ ZmSRO1b/ZmSRO1c均含有5个内含子和6个外显子,ZmSRO1d和ZmSRO1e均包含3个内含子和4个外显子,而ZmSRO1f仅包含2个内含子和3个外显子。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1 ZmSROs基因结构图
-->Fig. 1Structure of ZmSROs gene
-->
利用EBL-EBI在线分析发现,根据SRO蛋白序列中所包含的保守功能区域,可以将ZmSROs蛋白分为2类,A类为ZmSRO1a/ZmSRO1b/ZmSRO1c/ZmSRO1d/ZmSRO1e共5个蛋白,均包含PARP催化中心和C-末端的RST结构域,缺少WWE结构域,但是由于蛋白质氨基酸序列长度不同,其保守结构域出现的位置也不相同。ZmSRO1a/ZmSRO1b/ZmSRO1c的PARP和RST结构域分别位于第235—466 aa和第486—572 aa,而ZmSRO1d和ZmSRO1e蛋白的PARP和RST结构域分别位于第147—384 aa和第373—448 aa;B类为ZmSRO1f包含WWE和PARP催化中心,C-末端的RST结构域缺失,其中WWE位于第75—129 aa,PARP催化中心位于第189—404 aa(图2)。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2ZmSROs蛋白结构域灰色区域、黑色斜纹网格区域和黑色竖纹区域分别表示ZmSROs蛋白的WWE、PARP和RST结构域
-->Fig. 2Structure of ZmSROs proteins gray areas, Black twill areas, and Black vertical area represent WWE, PARP, and RST domains of ZmSRO proteins, respectively
-->
利用MEME在线工具预测ZmSROs蛋白的保守基序,由图3可知,ZmSROs蛋白共找到5个保守基序,ZmSRO1a/ZmSRO1b/ZmSRO1c包含保守基序1—5,ZmSRO1d/ ZmSRO1e缺少保守基序3,ZmSRO1f缺少保守基序5。结合ZmSROs蛋白结构域分析可以看出,保守基序1位于PARP催化中心,保守基序5位于RST保守结构域中。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3ZmSROs蛋白保守基序分布
-->Fig. 3Distribution of conserved motifs in ZmSROs proteins
-->
利用MAGA6.0构建玉米、拟南芥、水稻SRO蛋白家族的系统进化树(图4),SRO家族蛋白可以被分为Ⅰ和Ⅱ两类,其中Ⅰ类由可以被分为Ⅰa、Ⅰb、Ⅰc 3个亚类,Ⅱ类可以被分为Ⅱa和Ⅱb 2个亚类。在玉米和水稻中仅存在第Ⅰ亚类,缺少第Ⅱ亚类。按照水稻的亚家族分类,可以将ZmSROs分为3个亚类,ZmSRO1a/ZmSRO1b/ZmSRO1c同源性最高,均属于Ⅰa亚类,ZmSRO1d/e属于Ⅰc亚类,ZmSRO1f属于Ⅰb亚类,玉米和水稻均为禾本科植物亲源关系较近,其SRO蛋白序列同源性非常高,进化关系非常接近。
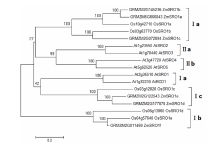 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4玉米、拟南芥、水稻的SRO蛋白家族的系统进化树
-->Fig. 4Phylogenetic tree of SRO Proteins in maize, Arabidopsis thaliana and rice
-->
2.3 玉米SRO基因在不同组织的表达分析
利用qRT-PCR技术分析了6个ZmSROs在玉米根、茎、叶、雄穗和雌穗中的表达(图5),6个ZmSROs在玉米根系相对表达量显著高于其他组织部位,说明6个ZmSROs均在根系中有特异性表达,而在雌穗和雄穗中的表达量较低,几乎不表达。结果表明,ZmSROs可能在玉米根系发育过程中起重要作用。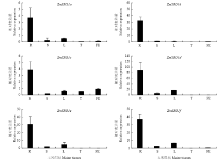 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5玉米组织中ZmSROs的相对表达量 R:玉米根;S:茎;L:叶片;T:雄穗;FE:雌穗
-->Fig. 5The relative expression levels of ZmSROs in different apple organs R: Root; S: Stem; L: Leaf; T: Tassel; FE: Female ear
-->
2.4 玉米SRO基因在逆境胁迫的表达分析
为了明确玉米SRO基因对逆境胁迫下的应答机制,分析了SRO基因在盐胁迫和干旱胁迫下根系和地上部的表达模式(图6和图7)。在根系中,200 mmol·L-1NaCl处理下,除ZmSRO1f外,其余5个ZmSROs处理1 h时显著上调表达,1 h相对表达量分别为0 h的13.5、17.1、5.4、31.1和27.9倍,随后6和24 h后表达量下降,表明玉米根系中的ZmSRO1a/ZmSRO1b/ ZmSRO1c/ZmSRO1d/ZmSRO1e 5个基因均可以迅速响应盐胁迫信号,而ZmSRO1f对盐胁迫信号没有响应。20%PEG处理下,ZmSRO1e在1 h表达量为0 h处理的3.6倍,显著上调表达;ZmSRO1f在24 h的表达量为0 h的2.7倍,显著上调表达,表明玉米根系中ZmSRO1e和ZmSRO1f可能响应干旱胁迫。盐胁迫条件下玉米地上部ZmSRO1a/ZmSRO1b/ZmSRO1d/ZmSRO1e的表达均下调,ZmSRO1c表达差异不大,而ZmSRO1f在处理6 h显著上调表达,为0 h的3.06倍,说明玉米地上部ZmSRO1f可能对盐胁迫有响应。干旱胁迫处理下,ZmSRO1a/ZmSRO1b/ZmSRO1d/ ZmSRO1e均下调表达,而ZmSRO1c和ZmSRO1f表达差异不显著,变化趋势与盐胁迫处理类似。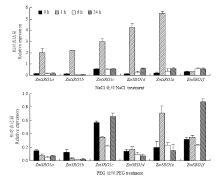 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6胁迫条件下ZmSROs在玉米根系的表达
-->Fig. 6The relative expression levels of ZmSROs in root treated with different stresses
-->
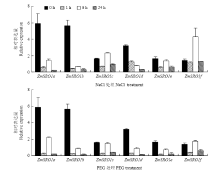 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图7胁迫条件下ZmSROs在玉米地上部的表达
-->Fig. 7The relative expression levels of ZmSROs in seedling treated with different stresses
-->
3 讨论
由于全球气候变化,极端气候条件频发,以及土壤质量下降和盐渍化的加剧,使得干旱和盐害等非生物胁迫成为影响植物生长和产量的主要限制因子。玉米作为世界重要粮食作物,玉米产业发展也时刻面临着非生物胁迫等逆境环境的危害,因而挖掘重要的抗逆基因,选育抗逆玉米新品种,以提高玉米自身的抗逆能力显得尤为重要。研究发现许多植物特有的转录因子可以影响植物生长发育,并响应外界环境变化[22],如NAC、AP2/ERF、WRKY、Dof和ARF等[23,24,25,26,27]。SRO是最近被发现的陆生植物特有蛋白家族,其在植物生长发育以及响应非生物胁迫方面具有重要作用。目前,拟南芥[2,3]、水稻[16,17]、小麦[18]、番茄[19]、苹果[20]等植物中的SRO家族已被分离鉴定,并对其功能进行了初步研究,但SRO基因家族在玉米中的研究仍鲜见报道。本研究从玉米全基因组中共鉴定出6个ZmSROs,依次命名为ZmSRO1a—ZmSRO1f,系统进化树分析发现,玉米和水稻SRO蛋白相似性非常高,亲缘关系相近。根据植物SRO蛋白可以被分为2类(Ⅰ和Ⅱ),Ⅰ类被进一步分为Ⅰa、Ⅰb、Ⅰc 3个亚类,系统进化树分析表明AtSRO1、AtRCD1、OsSRO1a/ OsSRO1b和ZmSRO1a/ZmSRO1b/ZmSRO1c属于Ⅰa亚类,OsSRO1d/OsSRO1e和ZmSRO1f属于Ⅰb亚类,OsSRO1c和ZmSRO1d/ZmSRO1e属于Ⅰc亚类,Ⅱ类蛋白也可以被分为Ⅱa和Ⅱb 2个亚类,其中AtSRO2/AtSRO3属于Ⅱa,AtSRO4/AtSRO5属于Ⅱb亚类(图4)。Ⅱ类蛋白是双子叶植物所特有的[17],玉米和水稻中均不存在Ⅱ类的SRO蛋白。根据其包含蛋白家族结构域可将ZmSROs分为2类,A类包括ZmSRO1a/ZmSRO1b/ZmSRO1c/ZmSRO1d/ZmSRO1e,均包含PARP催化中心和C-末端的RST结构域,缺少WWE结构域,而B类仅包括ZmSRO1f,包含PARP催化中心和WWE结构域,缺少C-末端的RST结构域(图2),以往研究表明水稻OsSRO1d中也缺少RST结构域,其原因可能是OsSRO1d的RST结构域中被额外插入18个氨基酸序列,使得在结构域分析时RST结构域未被分析出来[17]。蛋白保守基序预测显示ZmSRO1f缺少保守基序5,结合蛋白保守结构域分析保守基序5恰好位于RST保守结构域内(图4和图5),而ZmSRO1f仅含404个氨基酸,其氨基酸数目较少可能是RST保守结构域缺失的原因。SRO基因可以调控植物生长发育,因此其在植物不同组织部位的表达情况也备受关注。有研究表明苹果中SRO家族基因存在组织特异性表达,MdRCD1在果实中的表达显著高于其他组织,而其余MdSROs在根、茎和花中的表达量较高,而在叶片和果实中的表达量低,同时MdSRO5在花中表达量最高,说明MdSRO5可能在苹果花发育过程中发挥重要作用[20]。水稻中OsSRO1d和OsSRO1e呈现组成性表达,OsSRO1a和OsSRO1c呈现组织特异性表达,OsSRO1a在水稻三叶苗期和分蘖期表达量高,在叶片、鞘和4—5 cm幼穗中表达量低,OsSRO1c在子房发育和胚乳成熟阶段表达量高,而在胚胎发育早期的表达量较低[17]。本研究结果显示ZmSROs在根系中表达量显著高于其他组织,暗示ZmSROs在玉米根系发育中发挥作用。另外ZmSROs在雄穗和雌穗中的表达量均较低,几乎不表达,表明其对玉米的生殖生长阶段作用较小(图6)。
SRO家族不仅影响植物的生长进程,而且在许多植物中均证实SRO家族可以响应植物的非生物胁迫。如OsSRO1c在ABA和JA处理下显著上调表达[17],小麦中Ta-sro1可以通过调节植物体内的氧化还原平衡来提高其耐干旱、高盐和H2O2胁迫的能力[18]。番茄SlSRO1在番茄根系中,盐胁迫条件下显著上调表达[19]。苹果MdSRO4表达量在100 μmol·L-1 ABA和4℃处理下分别上调14和37倍,而在20%PEG处理下,MdRCD1、MdSRO2和MdSRO3分别上调18、17和14倍,说明MdSRO4可以响应ABA和寒害胁迫,MdRCD1、MdSRO2和MdSRO3响应干旱胁迫[20]。本研究中,玉米根系中ZmSRO1a/ ZmSRO1b/ZmSRO1c/ ZmSRO1d/ZmSRO1e 5个基因均在200 mmol·L-1 NaCl处理1 h显著上调表达,表明根系中这些基因可以迅速响应盐胁迫信号,另外ZmSRO1e和ZmSRO1f在干旱条件下显著上调表达,说明ZmSRO1d和ZmSRO1f响应干旱胁迫(图6)。相较根系SRO基因的表达量变化,地上部SRO基因表达量普遍呈现下调现象(图7),综上所述,ZmSROs可能在玉米根系响应干旱和高盐胁迫中发挥作用。
4 结论
从玉米全基因组中鉴定到6个SRO家族基因,均含有SRO蛋白特有的PARR催化中心结构域。系统进化树分析ZmSROs被分为3个亚类,其中ZmSRO1a/b/c属于Ⅰa亚类,ZmSRO1f属于Ⅰb亚类,ZmSRO1d/e属于Ⅰc亚类。ZmSROs在玉米根系特异性表达。玉米根系中的ZmSRO1a/ZmSRO1b/ZmSRO1c/ ZmSRO1d/ZmSRO1e受盐胁迫诱导上调表达,ZmSRO1d和ZmSRO1f受干旱胁迫诱导上调表达,同时地上部ZmSRO1f受盐胁迫诱导上调表达,其余基因在干旱和盐胁迫均下调表达。(责任编辑 李莉)
The authors have declared that no competing interests exist.
