0 引言
【研究意义】流感病毒(influenza virus)是引起流行性感冒的重要病原体,在人群中传播可造成季节性流感以及流感大流行,严重危害人类的健康[1,2,3]。目前对于流感病毒的防控措施主要有疫苗免疫和抗流感药物。由于流感病毒基因组包含8条单股负链RNA片段,极易发生重组和突变[4,5,6],使得疫苗和抗流感药物失去保护作用。因此,研究流感病毒在宿主体内的复制及调控机制可以为防控流感病毒提供新思路。在病毒入侵宿主过程中,病毒组分与宿主蛋白发生广泛且复杂的相互作用。PA蛋白是流感病毒RNA聚合酶复合体的重要组成部分,在流感病毒RNA的转录复制过程中发挥重要作用[7]。因此研究PA蛋白与宿主蛋白的相互作用对于揭示流感病毒在宿主体内的复制及调控机制具有重要意义。【前人研究进展】PA蛋白由流感病毒基因组第3节段编码,全长为716个氨基酸,具有核定位信号[8]。在流感病毒粒子中,PA与PB2和PB1组成RNA聚合酶复合体,负责病毒基因组的转录和复制[9,10]。PA蛋白经胰酶切割后可分为两个结构域,即氨基端结构域和羧基端结构域[11],氨基端结构域具有切割宿主mRNA前体分子5′帽子结构的内切核酸酶活性[12],羧基端的突变可使RNA聚合酶复合体失去转录活性[13]。此外,PA蛋白具有蛋白水解活性[14],还是酪氨酸激酶II的底物,可以发生丝氨酸和苏氨酸的磷酸化[15]。已发现与PA蛋白相互作用的蛋白有:IRF3[16]、MCM[17]、COPI[17]、HAX1[18]、CLE[19,20]、FACT[19]等。【本研究切入点】鉴于PA蛋白在流感病毒RNA转录复制过程中的重要功能,中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室前期利用酵母双杂交技术从cDNA文库中筛选与PA蛋白相互作用的宿主蛋白,获得多聚胞嘧啶结合蛋白1(poly(rC)-binding protein 1,PCBP1)。已有研究表明,PCBP1蛋白与猪繁殖障碍呼吸综合征病毒(PRRSV)[21]、猪瘟病毒(CSFV)[22]以及人类免疫缺陷性病毒(HIV)[23]的复制有关,且PCBP1蛋白对不同病毒复制的调控作用具有多样性,目前尚未有关于PCBP1蛋白对流感病毒复制影响的研究。【拟解决的关键问题】探索PA蛋白与PCBP1蛋白的相互作用关系以及PCBP1蛋白对流感病毒复制的影响,为深入理解流感病毒在宿主体内的复制及调控机制提供数据。1 材料与方法
试验于2017年在中国农业科学院哈尔滨兽医研究所完成。1.1 主要试验材料
真核表达载体pCAGGS由美国威斯康星大学Yoshihiro Kawaoka教授惠赠; pGADT7-DEST酵母双杂交文库由Invitrogen构建;siRNA由苏州吉玛基因公司合成;Flag、Myc等标签抗体均购自Sigma-Aldrich;兔抗PA多抗为中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室制备;小鼠抗PCBP1单抗购自Abcam;IRDye800CW山羊抗小鼠和山羊抗兔IgG购自LI-COR Bioscience;流感病毒A/Anhui/2/2005(H5N1)、A/WSN/1933(H1N1)均由中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室保存。1.2 酵母回交验证
采用LiAc方法[24]将阴性对照组pGBKT7-Lamin+ pGADT7-T、阳性对照组pGBKT7-p53+pGADT7-T和诱饵质粒pGBKT7-PA+重组阳性质粒pGADT7- PCBP1三组质粒分别共转化Y2H Gold酵母感受态细胞,把转化后的菌液分别涂布在SD/-2、SD/-4和SD/-4/X/A三种营养缺陷平板上,30℃培养箱倒置培养5—7 d,观察菌落生长情况及颜色。1.3 真核表达质粒的构建及鉴定
参照GenBank中登录的A/Anhui/2/2005(H5N1)病毒PA基因序列(GenBank: HM172310.1)及人源PCBP1序列(poly(rC)binding protein 1 [Homo sapiens(human)] Gene ID: 5093),设计相关克隆引物(表1)。Trizol法[25,26]提取流感病毒RNA,经12 bp通用引物反转录得到cDNA,利用PA特异性扩增引物,从流感病毒cDNA中扩增出PA片段,与NdeI/SmaI双酶切处理的pCAGGS载体连接,构建重组表达质粒pCAGGS-Flag-PA;根据QIAGEN的RNA提取试剂盒说明书提取A549细胞总RNA,以oligo(d)T为引物反转录制备cDNA,利用PCBP1特异性扩增引物扩增PCBP1目的基因,将载体pCAGGS进行EcoRI/SmaI双酶切处理,构建表达质粒pCAGGS- Myc-PCBP1。Table 1
表1
表1本研究所使用的引物
Table 1Primers used in this study
| 引物Primers | 序列 Sequences(5′-3′) |
|---|---|
| AH/2/05 PA-NdeI F | GGTCCCGCCATATGATGGAAGACTTTGTGCGACA AT |
| AH/2/05 PA-SmaI R | ACAGATCCCGGGCTATTTCAGTGCATGTGTGAG |
| PCBP1-N- Myc EcoRI F | GGCTGAATTCGCCACCATGGAGCAGAAACTCAT CTCT GAAGAGGATCTGATGGATGCCGGTGTGACTGA |
| PCBP1-N- Myc SmaI R | ATGACCCGGGCTAGCTGCACCCCATGCCCTTCTC |
新窗口打开
1.4 免疫共沉淀试验
将HEK293T细胞按1﹕4传代于赖氨酸包被的6孔板中,当细胞密度达到约80%时,参照转染试剂Lipofectamine LTX with Plus Reagent(Invitrogen)说明书,将真核表达质粒pCAGGS-Flag-PA和pCAGGS- Myc-PCBP1各1 μg配制单转和共转混合液,室温静置25 min,然后将HEK293T细胞用PBS洗一遍后每孔加入500 μL opti-MEM培养基,然后加入相应的转染混合液,8—12 h后更换正常生长培养基。转染48 h后,每孔加入200 μL含Protease Inhibitor Cocktail(Roche)的NP40裂解液,在冰上裂解细胞30 min,4℃ 12 000 r/min离心15 min并收集上清,取1/10样品留作裂解液对照Input,剩余样品经加入1μL小鼠抗FLAG 单抗 4℃结合4—6 h、加入30 μL Protein G琼脂糖珠(Roche)4℃结合4—6 h、预冷裂解液(含PMSF)洗4—6次、加入30 μL 2×蛋白上样缓冲液后95℃煮5 min等一系列过程制备IP样品。将得到的Input和IP样品进行SDS-PAGE电泳、300 mA恒流转膜2 h、5%脱脂乳室温封闭1 h、兔抗Myc多抗和兔抗FLAG多抗(1﹕1 000稀释)室温孵育1 h、0.05%PBST洗3遍、IRDye800CW山羊抗兔IgG 二抗(1﹕10 000稀释)室温孵育1 h、0.05%PBST洗3遍,然后利用Odyssey双色红外荧光成像系统(LI-COR公司)扫膜。1.5 流感病毒蚀斑滴定
将MDCK细胞接种于12孔板,当细胞密度达到95%时进行蚀斑滴定。配制2×MEM培养基(含0.6% BSA,1 μg·mL-1 TPCK胰酶),用等体积ddH2O将2×MEM培养基稀释为1×MEM培养基,并分装于1.5 mL离心管,每管900 μL,取100 μL病毒液进行倍比稀释。将12孔板中的MDCK细胞用PBS洗两遍,然后每孔加入100 μL倍比稀释后的病毒液,感染1 h。然后弃病毒液,每孔加入1 mL固态培养基(2×MEM培养基、等体积的2%低熔点琼脂糖凝胶),待培养基凝固后,倒置于CO2培养箱继续培养,48 h后用福尔马林固定液固定。固定后,弃孔中固态培养基,以0.1%结晶紫溶液染色,空斑计数。应用GraphPad Prism 6.0进行Multiple t tests分析。1.6 PCBP1蛋白过表达对病毒复制的影响
参照慢病毒包装系统pLVX-IRES-ZsGreen1(Clontech)说明书,将pLVX-IRES-ZsGreen1空载体或pLVX-IRES-ZsGreen1-PCBP1、pSPAX2和pMDG按4﹕3﹕1共同转染HEK293T细胞包装假病毒,48 h后收获上清,将包装的病毒侵染A549细胞,被假病毒侵染的A549细胞将表达绿色荧光蛋白ZsGreen1,48 h后将A549细胞消化成单细胞根据荧光标记进行超速流式细胞分选,留下阳性细胞继续培养,建立PCBP1蛋白过表达A549的细胞系,并通过Western blot验证PCBP1蛋白的过表达情况。将A/WSN/1933(H1N1)毒株以MOI=0.01感染对照组及PCBP1蛋白过表达A549细胞系,并分别于感染后24、48 h收获上清,进行蚀斑滴定计数。1.7 PCBP1基因表达下调对病毒复制的影响
参照Lipofectamine RNAiMAX(Invitrogen)说明书,将Scramble siRNA和PCBP1 siRNA分别转染A549细胞,转染后48 h以MOI=0.01感染A/WSN/1933(H1N1),并于感染后24、48 h收上清进行蚀斑滴定计数,同时收获细胞样品进行Western blot检测干扰效果。2 结果
2.1 酵母回交验证
将阴性对照组、阳性对照组和pGADT7-PCBP1+ pGBKT7-PA 3组酵母质粒分别共转化Y2H感受态细胞后涂在SD/-2、SD/-4和SD/-4/X/A 3种营养缺陷平板上。结果显示,阴性对照组pGBKT7-Lamin+ pGADT7-T可以在SD/-2平板上生长,但不能在SD/-4、SD/-4/X/A平板上生长,阳性对照组pGBKT7-p53+ pGADT7-T在3种缺陷型平板上均能正常生长,而且阳性对照组可以分解SD/-4/X/A平板的X-α-Gal,使菌落变蓝,表明阴性对照和阳性对照均正常。重组阳性质粒pGADT7-PCBP1+pGBKT7-PA也可以在SD/-2、SD/-4、SD/-4/X/A 3种营养缺陷型培养基上正常生长,并且也能分解底物X-α-Gal,使菌落呈现蓝色(图1),与阳性对照组一致,表明PA蛋白与PCBP1蛋白在酵母系统中存在相互作用。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1酵母回交验证PA蛋白与PCBP1蛋白的相互作用
-->Fig. 1Interaction between PA protein and PCBP1 protein in yeast
-->
2.2 PA蛋白与PCBP1蛋白互作的Co-IP验证
将pCAGGS-Flag-PA和pCAGGS-Myc-PCBP1共转染HEK293T细胞。细胞裂解液样品(Input)结果显示, PA蛋白和PCBP1蛋白均正常表达,Co-IP结果显示PA蛋白与PCBP1蛋白之间存在相互作用,而PA蛋白与pCAGGS空载体不存在相互作用(图2)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2Co-IP 验证PA蛋白与PCBP1蛋白相互作用
-->Fig. 2Verification of interaction between PA protein and PCBP1 protein by Co-IP assay
-->
2.3 过表达PCBP1蛋白抑制流感病毒复制
利用慢病毒载体pLVX-IRES-ZsGreen1包装假病毒,侵染A549细胞后经流式分选构建PCBP1蛋白过表达细胞系。取部分细胞样品进行Western blot检测,证实PCBP1蛋白在A549过表达细胞系中表达量显著上调(图3-A)。同时,将A/WSN/1933(H1N1)毒株以MOI=0.01感染A549过表达细胞系和对照细胞系,收上清后进行蚀斑滴定检测病毒复制情况。结果显示,感染后48 h病毒滴度下降,P<0.01,差异极显著,说明PCBP1蛋白过表达后可以抑制流感病毒的复制(图3-B)。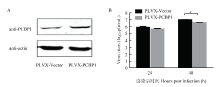 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3过表达PCBP1 抑制流感病毒复制
A:Western blot 检测PCBP1蛋白过表达;B: 蚀斑测定病毒滴度
-->Fig. 3Inhibition of influenza virus replication in PCBP1-overexpressing A549 cells
A: PCBP1 overexpression detected by Western blot; B: Virus titers determined by plaque assay
-->
2.4 PCBP1蛋白表达下调后促进流感病毒的复制
将Scramble siRNA和PCBP1 siRNA分别转染A549细胞后,进行Western blot检测,确证PCBP1蛋白表达水平下降(图4-A)。同时,以MOI=0.01 A/WSN/1933(H1N1)病毒感染后,利用蚀斑试验检测病毒复制情况。结果显示,感染后48 h病毒滴度升高,P<0.01,差异极显著(图4-B),表明PCBP1蛋白表达下调后促进病毒复制。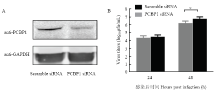 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4敲低PCBP1促进流感病毒复制
A:A549细胞中PCBP1蛋白siRNA干扰后western 检测;B:蚀斑测定病毒滴度
-->Fig. 4Knockdown of PCBP1 in A549 cells promotes influenza virus replication
A: PCBP1 knockdown by siRNA in A549 cells; B: Virus titers determined by plaque assay
-->
3 讨论
酵母双杂交技术是高通量筛选和鉴定蛋白互作的有效方法[27],广泛应用于筛选与病毒蛋白相互作用的宿主蛋白。由于流感病毒基因组较小,蛋白编码能力有限,因此在病毒感染宿主的过程中会与大量的宿主蛋白发生相互作用。笔者前期利用酵母双杂交技术从人源细胞cDNA文库中筛选到与流感病毒PA蛋白相互作用的宿主蛋白PCBP1。PCBP1是一种RNA结合蛋白,因其可以与RNA多聚胞嘧啶区域特异性结合而得名。PCBP1基因在1994年由AASHEIM等从人淋巴细胞cDNA文库中克隆出来[28],属于多聚胞嘧啶结合蛋白PCBPs家族成员之一,因其含有3个与该家族最先被发现的成员hnRNP K(heterogenous nuclear ribonucleoprotein K)相似的KH结构域(hnRNP K homology, KH domain),因此又被命名为hnRNP E1[29]。PCBP1蛋白广泛表达于人体各组织器官,在多水平参与基因的表达调控,如转录、前体mRNA剪切、mRNA稳定性、翻译沉默或翻译增强及蛋白质之间相互作用等 [29,30]。PCBP1含有核定位信号[31],具有核-质穿梭特性[32]。有研究表明,PCBP1及PCBP2可与猪繁殖障碍呼吸综合征病毒(PRRSV)的NS 1β蛋白互作,促进PRRSV的复制[21];PCBP1与猪瘟病毒(CSFV)的Npro蛋白互作,PCBP1对猪瘟病毒具有正调控作用[22]。在人类免疫缺陷性病毒HIV的研究中发现,PCBP1可以同HIV的外显子剪接抑制子3(exon splicing silencer 3,ESS3)区域相互作用,且对病毒复制起负调控作用[23]。可见,PCBP1蛋白对不同病毒复制的调控作用具有多样性。目前也有许多研究报道PCBP1与人类多种肿瘤发生如结肠癌、乳腺癌及宫颈癌等具有相关性[33,34,35]。PCBP1功能的多样性可能是由于其参与不同的通路或形成不同的复合体,从而对mRNA稳定性及蛋白翻译过程影响不同。本研究通过酵母回交验证试验证实了PCBP1蛋白与流感病毒PA蛋白在酵母系统中存在相互作用。由于酵母双杂交系统假阳性率较高,且蛋白质在酵母与哺乳动物细胞中的加工修饰不完全相同,因而蛋白质在酵母中的相互作用并不一定反应真实情况。本研究采用免疫共沉淀检测流感病毒PA蛋白与PCBP1蛋白在HEK293T细胞中相互作用,发现PA蛋白可以与PCBP1蛋白发生免疫共沉淀,说明PA蛋白与PCBP1蛋白在哺乳动物细胞中存在相互作用。本研究发现利用慢病毒过表达系统pLVX-IRES-ZsGreen1将A549细胞中PCBP1蛋白过表达,可以抑制流感病毒复制,而通过 siRNA干扰下调A549细胞中PCBP1蛋白表达后,可以促进流感病毒复制,即PCBP1蛋白对流感病毒复制具有负调控作用,但其调控流感病毒复制的具体机制仍有待进一步研究。
4 结论
本研究发现流感病毒PA蛋白与宿主蛋白PCBP1在酵母和哺乳动物细胞中存在相互作用,且宿主蛋白PCBP1对流感病毒复制具有负调控作用。The authors have declared that no competing interests exist.
